基于Fe3O4@SiO2@TiO2纳米粒子富集和PSMA传感器检测前列腺癌外泌体的方法与流程
本发明应用于外泌体标记物检测分析技术领域,涉及一种基于tio2和psma适配体对前列腺癌外泌体的快速准确分析测定。
背景技术:
前列腺癌(pca)是全球男性最常见的实体恶性肿瘤。在早期,它有很高的治愈率,因此,前列腺癌的治疗依赖于早期诊断。前列腺特异抗原(psa)是前列腺癌诊断的一种血清生物标志物。然而,虽然psa具有很高的敏感性,但它的特异性很差,尤其是在血清psa水平为2-10ng/ml的男性中,因此,泌尿外科需要其他特异的pca生物标志物。外泌体是由正常细胞和肿瘤细胞分泌的包裹在脂质双层膜内的生物小泡,其大小从30到200纳米不等。外泌体在细胞间通讯中发挥着不同的作用,在体液中广泛存在,包括血液、尿液、唾液等。肿瘤外泌体包含肿瘤特异性蛋白、rnas,并参与肿瘤的发生和病原体的扩散等。许多研究表明肿瘤外泌体是诊断癌症的一种理想的标记物,但是目前其分离和检测方法仍存在挑战。超速离心是最常用的外泌体分离方法,但是步骤复杂,分离效率低。商用elisa试剂盒基于免疫亲和方法以cd-63,cd-9(外泌体表面抗体)等作为靶标分离和检测外泌体,灵敏度高,但是过程复杂并且成本高昂。
tio2由于其与磷酸集团的可逆性结合作用,广泛应用于磷酸肽段和蛋白的分离富集,而外泌体表面富含磷酸基团,因此可以采用tio2分离富集外泌体。有文献报道tio2可以成功实现外泌体的富集,但是后续采用离心方法进行固液分离可能会损失大量外泌。
技术实现要素:
为了克服现有技术的不足,本发明的目的在于提供一种快速、高灵敏、高特异性的检测前列腺癌外泌体的方法。
本发明的技术方案具体介绍如下。
本发明提供一种基于fe3o4@sio2@tio2纳米粒子富集和psma传感器检测前列腺癌外泌体的方法,包括如下步骤:
1)合成fe3o4@sio2@tio2纳米粒子,与含前列腺细胞外泌体的样本共孵育并磁性分离,实现外泌体的分离;
2)将分离得到的外泌体与前列腺特异性膜抗原(psma)传感器共孵育,并获得荧光强度信号,通过测得荧光强度的改变对外泌体进行定量。
进一步,步骤1)中,fe3o4@sio2@tio2纳米粒子制备方法如下:
将fe3o4溶于乙醇、去离子水和氨水的混合物中,超声,接着加入teos,室温下连续搅拌反应,得到fe3o4@sio2;
将fe3o4@sio2溶于乙醇和氨水的混合物中,超声后,用连续搅拌逐滴加入溶于乙醇的钛酸四丁酯。连续搅拌反应,制备好的产品用超纯水和乙醇洗涤,烘干后得到fe3o4@sio2@tio2纳米粒子。
进一步,本发明中进行外泌体分离的较优条件为:1.2mgfe3o4@sio2@tio2,常温孵育8分钟。
进一步,步骤1)中,磁性分离后,碱液洗脱。
进一步,洗脱步骤使用10%氨水与磁性分离得到的fe3o4@sio2@tio2/外泌体复合物震摇共孵育。
优选的,洗脱步骤使用10%氨水与磁性分离得到的fe3o4@sio2@tio2/外泌体复合物在4摄氏度条件下震摇共孵育10分钟达到充分洗脱。
进一步,步骤2)中,构建发卡状psma传感器如下:通过对psma抗体序列进行设计,使其形成发卡状结构,并在相应3’端和5’修饰上羧基四甲基罗丹明荧光基团(tamra)和偶氮苯甲酸(dabcyl)猝灭基团。
进一步,步骤2)中,psma抗体核苷酸序列如seqno.3所示。
进一步,psma传感器浓度400nm,25度共孵育30分钟。
进一步,步骤2)中,获得荧光强度的条件:激发光557纳米,发射光580纳米。
本发明还提供一种fe3o4@sio2@tio2纳米粒子,所述纳米粒子制备方法如下:
将fe3o4溶于乙醇、去离子水和氨水的混合物中,超声,接着加入teos,室温下连续搅拌反应,得到fe3o4@sio2;
将fe3o4@sio2溶于乙醇和氨水的混合物中,超声后,用连续搅拌逐滴加入溶于乙醇的钛酸四丁酯。连续搅拌反应,制备好的产品用超纯水和乙醇洗涤,烘干后得到fe3o4@sio2@tio2纳米粒子。
本发明还提供一种fe3o4@sio2@tio2纳米粒子在前列腺癌外泌体检测中的用途,利用fe3o4@sio2@tio2纳米粒子,与外泌体共孵育并磁性分离,实现外泌体的分离和富集。
本发明提供一种前列腺癌外泌体检测装置,所述检测装置中采用fe3o4@sio2@tio2纳米粒子对外泌体进行分离富集,并与psma传感器共孵育。
具体的,本发明一个实施例中,
本发明合成fe3o4@sio2@tio2纳米粒子用于外泌体的富集,主要是基于tio2与磷酸基团的可逆性结合。然后设计了前列腺特异性膜抗原(psma)传感器。
psma是前列腺癌外泌体表面一种特异的蛋白,在前列腺病外泌体表面高表达,在正常外泌体上低表达,通过检测psma实现对前列腺外泌体的特异性检测。psma传感器由psma蛋白适配体,tamra荧光基团和dabcyl猝灭基团组成的发卡状结构,构建完成后,psma传感器由于荧光共振能量转移效应tamra的荧光被猝灭,当遇到外泌体时,psma适配体与外泌体表面psma蛋白特异结合,使荧光共振能量转移效应消失,tamra重新发射荧光,通过这种荧光的改变实现对外泌体的检测。
与现有技术相比,本发明具有如下有益效果:
本发明合成fe3o4@sio2@tio2,以fe3o4作为内核,sio2有利于两种材料的连接,在富集完成后,可以快速磁性分离,减少外泌体损失。本发明结合fe3o4快速磁性分离的优势和sio2广泛相容性,合成了fe3o4@sio2@tio2纳米粒子以快速高效分离外泌体。同时设计了前列腺癌特异蛋白psma传感器,特异性识别前列腺癌外泌体。本发明集富集与检测为一体,对前列腺癌外泌体实现快速准确分析鉴定
具体的,本发明富集外泌体方法基于fe3o4@sio2@tio2纳米粒子。富集外泌体是基于tio2与磷酸基团的特异性结合,tio2尺寸大概为600纳米,相比于外泌体尺寸,比表面积大,可以结合较多外泌体。因此富集效率高,富集效率为91.5%,本发明合成的fe3o4@sio2@tio2纳米粒子也可以富集其他含磷酸基团的多肽,蛋白等。以fe3o4作为内核,富集后可以快速磁性分离,在8分钟内完成富集,简单快速。本发明检测外泌体的方法灵敏度高,特异性强,检出限为9×103个/μl,可以显著性区分临床前列腺癌病人与健康人(p<0.01),并得到传统elisa方法验证。本发明包括富集与检测外泌体两部分,分离方法简单快速,效率高,检测方法灵敏度高特异性好,适用于临床前列腺癌早期诊断。
附图说明
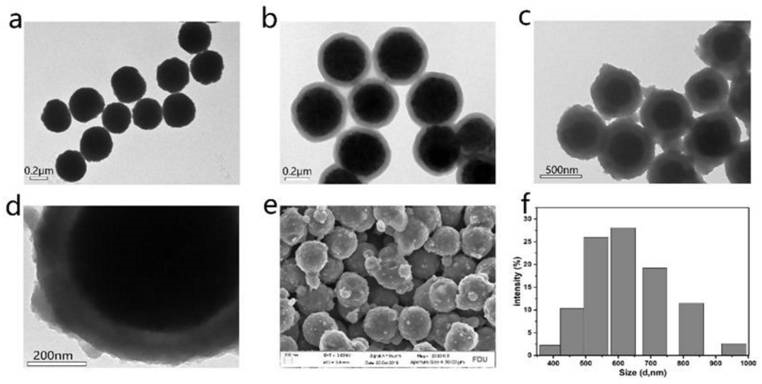
图1为fe3o4@sio2@tio2的表征。(a)fe3o4的透射电镜(tem)图像。标尺,100纳米。(b)fe3o4@sio2的tem。标尺0.2μm。(c)fe3o4@sio2@tio2的tem。标尺500纳米。(d)fe3o4@sio2@tio2透射电镜放大图像。标尺200纳米。(e)fe3o4@sio2@tio2的扫描电镜(sem)图像。标尺200纳米。(f)fe3o4@sio2@tio2的粒径大小分布。
图2为荧光图像和外泌体分离的最佳条件。(a-c)外泌体的亮场和荧光图像,fe3o4@sio2@tio2/外泌体,磁分离反复洗涤后的洗涤物。标尺50μm。(d)优化fe3o4@sio2@tio2用于外泌体分离的数量。(e)优化外泌体分离的孵育时间。(f)血清和pbs中fe3o4@sio2@tio2纳米颗粒和超离心分离外泌体的效率比较。所有实验至少独立进行三次。误差条表示每个样本三次重复测量的标准差。
图3为外泌体最佳检测条件。(a)单检测传感器1、传感器2和传感器3的荧光光谱。(b)相同外泌体含量在不同浓度传感器存在下的散点图。(c)荧光强度时间和温度图。(d)荧光光谱图。在不同浓度外泌体(a-h:分别为0.09,0.69,6.93,2.08,3.12,6.25,8.3,10,12.5×105个/μl)。(e)不同浓度外泌体与传感器的线性关系。(f)特异性直方图。误差条表示基于三个重复实验的标准误差。
图4临床血清样品的外泌体定量检测。(a)psma传感器的检测结果。(b)用于psma传感器临床样本分析的点图。(c)elisa检测结果。(d)elisa法临床样品分析的点图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细描述,但本发明法的实施方式不限于此。
实施例中所采用的试剂及仪器如下:
1.试剂
fe3o4购于苏州海狸公司
四乙氧基硅烷(teos)和钛酸四丁酯(tbot)均产自上海沪试股份有限公司
pbs缓冲液(ph7.4),氨水,0.22μm超滤膜,pkh26均购于美国sigma公司
elisa购于美国sbi公司
psma适配体购于上海生工公司
2、仪器
透射电镜200kv(型号:jem2011,厂商:日本jeol公司),f7000f荧光光谱仪(立
日本),日力s-4800场发射扫描电镜,zs90纳米电势仪(莫尔文,英国).
实施例1
合成fe3o4@sio2@tio2纳米粒子
1.将0.15gfe3o4溶于乙醇(280ml)、去离子水(70ml)和氨水(5ml,28wt%)的混合物中,超声15min。接着加入4mlteos,室温下连续搅拌反应10h,得到fe3o4@sio2。图1a是fe3o4的tem图,图1b是fe3o4@sio2的tem图。这两张图说明sio2成功包裹在fe3o4外面。
2.将0.05gfe3o4@sio2溶于乙醇(100ml)和氨水(0.3ml,28wt%)的混合物中,超声15min后,用连续搅拌逐滴加入0.75ml溶于乙醇的tbot。在45℃下连续搅拌反应24h,制备好的产品用超纯水和乙醇洗涤三次,在60℃的温度下烘干过夜。图1c是fe3o4@sio2@tio2的tem图,图1d是fe3o4@sio2@tio2的局部放大图,这两张图说明fe3o4@sio2@tio2的成功合成,且粒径大小均一。图1e是fe3o4@sio2@tio2的sem图,说明成功合成且粒径大小均匀。图1f是fe3o4@sio2@tio2的粒径分布图,表明粒径大小大约600nm。
实施例2
外泌体分离。
1.准备两个平行样本:lncap外泌体溶液(107个/μl)。一个样本的外泌体用pkh26染料染色。另外一个样本的外泌体染色后与1.2mgfe3o4@sio2@tio2在常温下孵育8分钟后,用磁力架快速磁性分离,用pbs反复洗涤3次。图2a是外泌体染色后的亮场和荧光图,图2b是fe3o4@sio2@tio2/外泌体的亮场和荧光图,图2c是反复洗涤后的洗涤物亮场和荧光图。这三张图说明fe3o4@sio2@tio2可以成功分离外泌体,且富集的外泌体数量很多。
2.准备外泌体浓度为107个/μl,用pkh26染色,荧光强度记为f0。准备相同浓度外泌体分别与0.2,0.4,0.6,0.8,1.2,1.4,1.6mgfe3o4@sio2@tio2纳米粒子共孵育8分钟,磁性分离后,用150μlpbs反复洗涤3次,测得上清液荧光强度为f1,每组实验平行三次,通过计算f0-f1/f0得到分离效率。图2d是不同质量fe3o4@sio2@tio2对外泌体分离效率的影响。随着fe3o4@sio2@tio2量的增大(0.2-1.2mg),外泌体分离效率逐步增大,后面随着fe3o4@sio2@tio2量的增大(1.2-1.6mg),外泌体分离效率缓慢降低,因此选择1.2mgfe3o4@sio2@tio2作为最优条件。
3.外泌体染色荧光强度记为f0(107个/μl),相同浓度外泌体与在步骤2得到的最优fe3o4@sio2@tio2质量下分别共孵育1-10分钟,快速磁性分离,并用pbs反复洗涤3次,荧光强度记为f1,每组实验平行三次,通过计算f0-f1/f0得到分离效率。图2e是不同孵育时间对外泌体分离效率的影响。随着孵育时间的增加(1-10分钟),分离效率逐渐增大,然后几乎不变,因此选择孵育时间为8分钟。
4.准备模型外泌体(标准细胞分泌的外泌体)溶于pbs(107个/μl),染色并且记录荧光强度为f0,相同浓度的外泌体染色后用传统超速离心方法得到的上清荧光强度记为f1,相同浓度的外泌体染色后与1.2mgfe3o4@sio2@tio2共孵育8分钟,快速磁性分离,用pbs反复洗涤三次,上清荧光强度记为f1,每组实验平行三次。通过计算f0-f1/f0得到分离效率。准备血清外泌体(107个/μl),染色并且记录荧光强度为f0,相同浓度的外泌体染色后用传统超速离心方法得到的上清荧光强度记为f1,相同浓度的外泌体染色后与1.2mgfe3o4@sio2@tio2共孵育8分钟,快速磁性分离,用pbs反复洗涤三次,上清荧光强度记为f1,每组实验平行三次。通过计算f0-f1/f0得到分离效率。图2f是传统超速离心方法和fe3o4@sio2@tio2分离外泌体方法分离模型外泌体和血清外泌体的对比图,fe3o4@sio2@tio2分离外泌体无论是分离模型外泌体还是血清外泌体分离效率均远远大于传统超速离心方法。
实施例3外泌体检测的最佳条件探索,包括以下步骤:
1.psma传感器的优化。首先设计构建三个psma传感器,psma1序列见下面表格:
合成后经过高温100度链解开,然后退火实验,然后三个传感器均稀释浓度至200nm并测量其荧光强度(激发:557nm,发射580nm)。图3a是三个相同浓度传感器的荧光强度图,其中传感器3荧光强度最小,背景最小,因此实验选择传感器3进行外泌体检测。
2.准备外泌体浓度为106/μl,与不同浓度(0,20,50,100,200,300,400,500,600nm)的传感器3在常温下进行孵育30分钟,并测得荧光强度(激发:557nm,发射580nm),每组实验平行三次。图3b是不同浓度传感器3与相同浓度外泌体孵育所得的荧光强度,随着传感器3浓度的增大,荧光强度不断增大后至几乎不变,因此选择400nm作为检测浓度。
3.准备外泌体浓度为106个/μl,与200nm传感器3在不同温度下(4度,25度,37度)孵育不同时间并测得荧光强度(激发:557nm,发射580nm),每组实验平行三次。图3c是不同温度下荧光强度随时间的变化图。随着时间增加,荧光强度均增大,温度为25度时荧光增加更快,且荧光更强,因此选择25度,30分钟作为检测温度与时间。
4.psma传感器浓度为400nm,分别与不同浓度(0.09,0.69,0.93,2.08,3.12,6.25,8.3,10,12.5×105个/μllncap外泌体在25度下共孵育30分钟,并测得荧光强度(激发:557nm,发射580nm)。图3d是psma传感器对不同浓度外泌体的荧光响应信号图。随着外泌体浓度增加,荧光强度逐渐增大。
5.步骤4每组实验平行三次,将所得的平均荧光强度与外泌体浓度做曲线拟合,如图3e所示,荧光强度与外泌体浓度呈良好线性关系y=39.62x+131.14,r2=0.9942,表明psma传感器检测外泌体的可行性,且实际检测限为9×103个/μl。
6.psma传感器的特异性。准备lncap外泌体浓度为106个/μl和相同浓度的prec外泌体、乳腺癌mb-231外泌体,分别与400nm的psma传感器在25度下共孵育30分钟,并测得荧光强度(激发:557nm,发射580nm),每组实验平行三次。图3f是相同浓度不同类型的外泌体对psma传感器的荧光响应信号。lncap外泌体荧光响应信号最大,mb-231外泌体次之,prec外泌体响应最小,表明psma传感器对lncap外泌体具有特异性,可以成功区分前列腺癌与正常人。
实施例4
血清外泌体的检测
1.临床前列腺癌病人和正常人血清样本,过0.22μm滤膜,去除大分子后留待备用。血清经过上述fe3o4@sio2@tio2分离和psma传感器检测后,得到荧光响应信号(激发:557nm,发射580nm),并根据线性关系换算成外泌体浓度。相同样本通过elisa进行实验验证,得到相应的外泌体浓度。每组实验平行三次。图4a是psma传感器对前列腺癌病人血清和正常人血清的检测结果。前列腺癌病人血清相比于正常人含有较多数量的外泌体。图4b是图4a数据的点图表示,前列腺癌血清和正常人存在显著性差异,p<0.01。图4c是商用elisa对相同样本的检测结果。我们的方法与之相对比,均是前列腺癌血清外泌体远远大于正常人血清外泌体,表明我们检测外泌体方法的可行性。图4d是elisa4c数据的点图,前列腺癌血清与正常人存在显著性差异,p<0.01。elisa是针对所有的外泌体的检测方法,包括正常外泌体。我们的方法基于psma的特异性,对检测前列腺癌外泌体特异性高。同时相比较于传统方法,我们的检测方法操作简单方便,可以在30分钟内完成加检测。
sequencelisting
<110>宁波大学
<120>基于fe3o4@sio2@tio2纳米粒子富集和psma传感器检测前列腺癌外泌体的方
法
<130>2020
<160>3
<170>patentinversion3.5
<210>1
<211>60
<212>dna
<213>人工序列
<400>1
accccagcgttttcgcttttgcgttttgggtcatctgcttacgatagcaatgcttggggt60
<210>2
<211>60
<212>dna
<213>人工序列
<400>2
accccagcgttttcgcttttgcgttttgggtcatctgcttacgatagcaatgcttggggt60
<210>3
<211>40
<212>dna
<213>人工序列
<400>3
cggacgcttttcgcttttgcgttttgggtcatctgctccg40
- 还没有人留言评论。精彩留言会获得点赞!