一种基于液晶的检测探针及其制备方法和应用与流程
本发明涉及生化传感器领域,尤其涉及一种基于液晶的检测探针及其制备方法和应用。
背景技术:
随着时代和社会的进步,人们越来越关注个人身体健康和环境污染的问题,而重金属离子对人体和环境的具有巨大危害,引起人们的关注和研究。例如铅离子,在人体内达到一定含量会导致大脑记忆力减退,情绪不稳定,心血管疾病,以及幼儿的肌肉瘫痪。铅离子是一种不可降解的物质,存在于我们生活的环境中,一般人类饮用水中最大铅离子含量为15μg/l或72nm。
传统的铅离子检测方法主要包括电化学方法、比色法、阳极溶出伏安法等。虽然这些方法的灵敏度可以达到要求,但是往往需要昂贵的仪器设备、复杂的操作过程,导致了应用通常局限在检测所和医院,无法广泛运用于日常生活中。因此,为了更方便的检测铅离子浓度,研究人员还构建了一些较为新颖的离子浓度检测方法,其中就包括基于脱氧核酶(dnazyme)检测铅离子的方法。
脱氧核酶是通过指数富集配体系统进化体外筛选技术合成的单链dna(ssdna),具有很强的催化活性和生物识别能力,脱氧核酶的发展为铅离子的检测提供了新的思路。研究发现“8-17”dnazyme活性依赖于铅离子,在铅离子存在条件下能催化底物在特定位置发生水解。“8-17”dnazyme是一种rna切割型dnazyme,在铅离子存在条件下能够切割rna使其发生裂解。目前,研究人员已经构建了基于17e荧光法检测铅离子的方法,该法在酶链及底物链上分别标记荧光和淬灭基团,加入铅离子后,底物链断裂引起荧光与淬灭基团分离,致使荧光增强。该法灵敏,检测限为10nm,但是该方法需要荧光标记,并且操作温度必须控制在4℃以下。
与此同时,液晶材料也被应用于离子检测。液晶是一种性质介于液体和晶体之间的物质,在十九世纪被发现并赋予定义,广泛应用于工作生活的各个领域。液晶具有光学各向异性和双折射特性,光线入射后会分解成两个振动方向相互垂直的折射光,不同的偏振光入射后折射率存在差异。液晶容易收到外界环境的诱导而转变形态,例如机械取向、表面活性剂、手性剂、电场、磁场等,可以通过施加或者改变这些外界条件来实现液晶在不同状态间的切换,呈现出不同的光学现象,进而将我们需要的不宜观察的微观形态变化转变为易于观察对比的光学变化。将液晶材料应用于离子检测的研究已经存在,但是其实现离子检测时往往需要配套使用较为专业的仪器设备,检测较为繁琐。
因此,研发一种简单、快捷、灵敏、能够广泛应用于生活中的铅离子检测产品及方法具有广阔的应用前景和市场价值。
技术实现要素:
鉴于现有技术中存在的问题,本发明提供一种基于液晶的检测探针及其制备方法和应用。通过多种分子之间的相互作用帮助液晶分子垂直排列于基底层上,并结合脱氧核酶的特性实现对铅离子的检测。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种基于液晶的检测探针,所述检测探针包含基底层、连接在基底层上的核苷酸链a、通过碱基互补配对作用与所述核苷酸链a连接的核苷酸链b以及垂直排列在基底层上的向列相液晶。
本发明结合铅离子的性质特点和向列相液晶的光学效应,先将核苷酸链a、核苷酸链b固定于基底层表面,辅助液晶分子在玻璃基板上做垂直排列,得到检测探针。其中,所述核苷酸链a和核苷酸链b形成8-17脱氧核酶体系,即“8-17”dnazyme体系,其部分片段互补配对,未配对的部分形成u型环,溶液中的pb2+会嵌入u型环中并对另一条链的位点进行剪切,剪切后核苷酸链发生断裂,导致液晶分子无法继续规律的垂直与基底层排列,再检测光源信号,得到溶液中pb2+浓度。所述基于液晶的检测探针能够方便快速的检测pb2+浓度,检测方法简便,且特异性较好。
同时,需要说明的是,此处核苷酸链a与核苷酸链b通过碱基互补配对作用相连,两者是部分互补;考虑到实际的结合情况,所述垂直排列指的是向列相液晶与基底层的夹角为90°±10°。
作为本发明优选的技术方案,所述核苷酸链a修饰氨基,与3-氨丙基三乙氧基硅烷(aptes)通过戊二醛(ga)的胶联作用相连。
优选地,所述核苷酸链b通过静电作用与十二烷基三甲基溴化铵(dtab)结合。
优选地,所述核苷酸链a包含如seqidno.1所示的核苷酸序列。其中,seqidno.1为5′-cgataactcactat/ra/ggaagagatg-3′,ra表示腺嘌呤核糖核苷酸,相应的,a表示腺嘌呤脱氧核糖核苷酸。同时,所述核苷酸链a的5′端连接氨基;所述核苷酸链b包含如seqidno.2所示的核苷酸序列,其中,seqidno.2为5′-catctcttctccgagccggtcgaaatagtgagt-3′。
本发明中,核苷酸链a是一条具有单个rna(ra)的rna/dna嵌合体,通过碱基互补配对与核苷酸链b的结合部位结合,在没有pb2+存在的适当介质中,核苷酸链a和b互补配对形成带有u型环的双链dna(dsdna)。其中,核苷酸链b中形成u型环的核苷酸为“tccgagccggtcgaa”;核苷酸a中剪切的位点为未与b链配对的ra。
优选地,所述核苷酸链a包含如seqidno.3所示的核苷酸序列,所述核苷酸链b包含如seqidno.4。
其中,seqidno.3为:5'-actcactat/ra/ggaagagatg-3',同样的,其5′端连接氨基;相应的,seqidno.4为:
5'-catctcttctccgagccggtcgaaatagtgagt-3';
优选地,所述核苷酸链a包含如seqidno.5所示的核苷酸序列,所述核苷酸链b包含如seqidno.6。
其中,seqidno.5为:5'-cact/ra/ggaagagatgatt-3',同样的,其5′端连接氨基;相应的,seqidno.6为:
5'-aatcatctctgaagtagcgccgccgtagtg-3'。
优选地,所述基底层包括玻璃基底。
优选地,所述向列相液晶通过二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵(dmoap)的锚定作用固定于所述玻璃基底表面。
换言之,本发明所述的检测探针可以分为如下几个部分:基底层,在基底层上连接的aptes和dmoap,通过ga的胶粘作用与aptes相连的核苷酸链a,与核苷酸链a部分互补配对的核苷酸链b,通过dmoap的锚定作用与基底层相连的向列相液晶以及远离基底层通过静电作用与核苷酸链b相连的dtab。
第二方面,本发明提供一种如第一方面所述的检测探针的制备方法,其特征在于,所述制备方法包括如下步骤:
(1)使用预处理液处理基底层,再用胶粘剂处理所述基底层;
(2)将步骤(1)中得到的基底层置于含有核苷酸链a和核苷酸链b的混合液中,反应;
(3)再将间隔网置于所述基底层上,注入向列相液晶后,再加入封端剂,得到所述检测探针。
作为本发明优选的技术方案,步骤(1)所述预处理液为3-氨丙基三乙氧基硅烷和二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵的乙醇溶液;
优选地,所述aptes与乙醇的体积比为(0.5~1.5):1000,例如可以是0.5:1000、0.6:1000、0.8:1000、1:1000、1.2:1000、1.4:1000或1.5:1000等。
优选地,所述dmoap与乙醇的体积比为(0.5~1.5):1000,例如可以是0.5:1000、0.6:1000、0.8:1000、1:1000、1.2:1000、1.4:1000或1.5:1000等。
优选地,步骤(1)所述预处理液处理基底层的时间为20~40min,例如可以是20min、22min、25min、30min、32min、35min或40min等,优选为30min。
优选地,步骤(1)所述胶粘剂为质量浓度为0.3~0.6%(例如可以是0.3%、0.35%、0.4%、0.45%、0.5%、0.55%或0.6%等)的戊二醛。
优选地,步骤(1)所述胶粘剂处理后还包括使用氮气风干的操作。
作为本发明优选的技术方案,所述预处理液处理基底层前,还包括清洗基底层的操作。
优选地,所述清洗基底层时使用的溶液为食人鱼溶液。所述食人鱼溶液由30%h2o2和h2so4混合而成,混合浓度比例为1:1。
优选地,所述清洗基底层的时间为20~40min,例如可以是20min、22min、25min、30min、32min、35min或40min等,优选为30min。
优选地,所述清洗基底层的温度为105~120℃,例如可以是105℃、108℃、110℃、112℃、115℃、118℃或120℃等,优选为110℃。
作为本发明优选的技术方案,步骤(2)所述混合液中核苷酸链a的浓度为100~500μm,例如可以是100μm、120μm、150μm、180μm、200μm、220μm、250μm、300μm、350μm、400μm、450μm或500μm等,优选为200μm。
优选地,步骤(2)所述混合液中核苷酸链b的浓度为100~500μm,例如可以是100μm、120μm、150μm、180μm、200μm、220μm、250μm、300μm、350μm、400μm、450μm或500μm等,优选为200μm。
优选地,步骤(2)所述反应的时间为0.5~2h,例如可以是0.5h、0.8h、1h、1.2h、1.5h、1.8h或2h等;优选为1h。
优选地,步骤(2)所述温度的时间为30~40℃,例如可以是30℃、32℃、34℃、35℃、36℃、38℃或40℃等,优选为37℃。
优选地,步骤(2)所述反应结束后还包括使用去离子水清洗基底层的操作。
作为本发明优选的技术方案,步骤(3)所述向列相液晶的使用量没有固定的数值,添加的液晶体积可以覆盖整个反应区域即可,最终判别的监测结果是计算平面上灰度值变化而来,与具体的液晶用量无关。
优选地,步骤(3)所述间隔网包括铜网。
本发明中,在玻璃基底表明设置铜网的目的在于,一方面可以限制液晶的流动,另一方面可以将检测探针分隔成较小的区域,方便使用和结果统计分析。
优选地,步骤(3)中所述封端剂包括十二烷基三甲基溴化铵(dtab)。因为步骤(1)中添加的aptes、ga和dmoap可以帮助与玻璃基底相连部分的液晶的锚定,dtab可以辅助远离玻璃基底部分的液晶的排列。
优选地,所述于十二烷基三甲基溴化铵溶液的摩尔浓度为5~20mm,例如可以是5mm、6mm、8mm、10mm、12mm、15mm、18mm或20mm等,优选为10mm。
作为本发明优选的技术方案,所述制备方法包括如下步骤:
(1)用食人鱼溶液在105~120℃下清洗玻璃基板20~40min,再使用去离子水清洗后风干;
(2)用aptes、dmoap和乙醇的混合溶液浸泡步骤(1)得到的玻璃基板,再用质量浓度为0.3~0.6%的戊二醛溶液涂覆玻璃基板表面,并用氮气风干;
(3)将所述玻璃基板上表面浸泡在含有核苷酸链a和核苷酸链b的混合液中,30~40℃反应0.5~2h,之后用去离子水清洗所述玻璃基板表面;
(4)在玻璃基板表面放上铜网,注入向列相液晶后,在表面滴加在摩尔浓度为5~20mm的dtab溶液,得到所述检测探针。
第三方面,本发明提供一种如第一方面所述的检测探针在检测铅离子浓度中的应用。
第四方面,本发明还提供一种利用如第一方面所述的检测探针检测铅离子浓度的方法,包括如下步骤:将所述检测探针置于光学显微镜下,加入含有铅离子的溶液,检测明暗度,得到所述溶液中铅离子的浓度。
本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
与现有技术相比,本发明至少具有以下有益效果:
本发明中利用铅离子的性质以及向列相液晶的光学效应,将dtab和aptes-ga结合,并使用核苷酸链,使液晶分子5cb在玻璃基板上做垂直排列;同时,由于铅离子会嵌入探针b的u型环中,同时对探针a的“ra”位置进行剪切,导致探针a发生断裂,发挥铅离子剪切特定核苷酸的功能,导致dtab分离逃脱aptes-ga链,致使液晶乱序排列,光线入入射后发生不同程度的各个方向上的散射,正交偏光显微镜下的明暗亮度发生改变,进而通过明暗灰度值强度检测铅离子的浓度,高效简洁地检测铅离子浓度,易于操作,反应灵敏,便于推广应用,具有广阔的应用前景。
附图说明
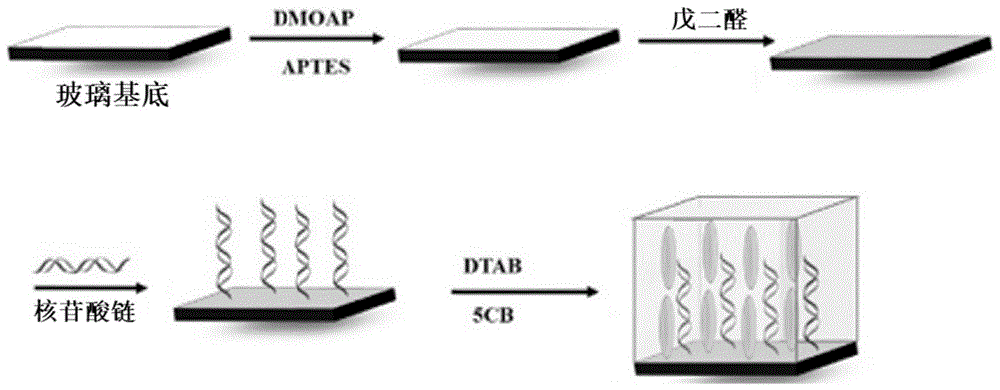
图1为实施例1中制备所述检测探针的操作流程示意图。
图2为实施例1中核苷酸链a和核苷酸链b的结合配对示意图。
图3为实施例1中核苷酸链在铅离子存在的条件下发生的变化示意图。
图4为实施例1中检测铅离子浓度时检测探针的变化示意图。
图5(a)为实施例2中不同浓度铅离子检测过程的明暗亮度图;其中,a图~h图分别为铅离子浓度为0nm、50nm、150nm、500nm、1μm、50μm、250μm和500μm下的明暗亮度图。
图5(b)为实施例2中不同浓度铅离子检测过程的明暗灰度值强度变化图。
图6为实施例3中对不同重金属离子检测过程中的明暗信号强度对比图。
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
实施例1
本实施例提供一种基于液晶的检测探针,其制备方法如图1所示,具体包括如下步骤:
(1)将30%h2o2和h2so4按1:1混合得到食人鱼溶液,在110℃下清洗玻璃基板30分钟,去离子水清洗后风干;
(2)用含质量浓度为0.1%的aptes和dmoap的乙醇溶液浸泡玻璃基板30min,用质量浓度为0.5%的ga溶液涂覆玻璃基板表面,并用氮气风干;
(3)在37℃环境下将玻璃基板上表面浸泡在含有核苷酸链a和核苷酸链b的缓冲液中,核苷酸链a浓度为200μm,核苷酸链b浓度为200μm;
浸泡1h之后用去离子水清洗表面;
其中,核苷酸链a的序列(seqidno.1)为:
5′-nh2-cgataactcactat/ra/ggaagagatg-3′;
核苷酸链b的序列(seqidno.2)为:
5′-catctcttctccgagccggtcgaaatagtgagt-3′;
其中,核苷酸结合配对示意图如图2所示,a和b中未配对的部分形成了一个u型环,若溶液中含有铅离子,在铅离子会嵌入该u型环中;同时对探针a的“ra”位置进行剪切,从而导致探针a发生断裂,核苷酸链在铅离子存在的条件下变化示意图如图3所示,
(4)在玻璃基板表面放上铜网,注入1μl的5cb液晶,之后暴露在浓度为10mm的dtab环境中,得到基于液晶的检测探针。
实施例2
本实施例提供一种基于液晶的检测探针,其制备方法与实施例1的区别在于,核苷酸链a和核苷酸链b的缓冲液中,核苷酸链a浓度为100μm,核苷酸链b浓度为100μm;其余步骤与实施例1相同。
实施例3
本实施例提供一种基于液晶的检测探针,其制备方法与实施例1的区别在于,核苷酸链a和核苷酸链b的缓冲液中,核苷酸链a浓度为500μm,核苷酸链b浓度为500μm;其余步骤与实施例1相同。
实施例4
本实施例提供一种基于液晶的检测探针,与实施例1的区别在于,其中核苷酸链a的序列(seqidno.3)为:
5'-nh2-actcactat/ra/ggaagagatg-3';
核苷酸链b的序列(seqidno.4)为:
5'-catctcttctccgagccggtcgaaatagtgagt-3'。
实施例5
本实施例提供一种基于液晶的检测探针,与实施例1的区别在于,其中核苷酸链a的序列(seqidno.5)为:
5'-nh2-cact/ra/ggaagagatgatt-3';
核苷酸链b的序列(seqidno.6)为:
5'-aatcatctctgaagtagcgccgccgtagtg-3'。
应用例1
本应用例利用实施例1提供的检测探针研究铅离子浓度与明暗度之间的关系。
将实施例1中制备得到的检测探针置于光学显微镜下,在正交偏光下进行明暗度信号检测结合后的核苷酸;然后加入不同浓度的铅离子(硝酸铅),检测信号强度,检测体系示意图如图4所示;
对不同浓度的铅离子检测过程的明暗度图如图5(a)所示,其中a图~h图分别表示0nm、50nm、150nm、500nm、1μm、50μm、250μm和500μm下的明暗亮度图,由图可知随着铅离子浓度的升高,显微视野的明亮度逐渐增加,即透光率逐渐增高;
所述明暗度对应的明暗灰度值变化如图5(b)所示,以lgc(c表示铅离子浓度,单位为nm)为横坐标,以(g0-g)/g0为纵坐标,其中,g0代表原始灰度值,g代表加入铅离子后的灰度值,拟合的浓度与明暗灰度值变化曲线为y=0.1893x-0.2998;
由图5(a)和图5(b)可知,本发明提供的检测探针能够有效检测铅离子浓度,呈现出线性相关的结果。
同样的,使用实施例2~5提供的检测探针,也能够实现铅离子浓度的检测。
其中,由实施例1~3比较可知,核酸的浓度大小会影响检测结果的亮度,核酸浓度较小时可能导致某些区域无法正常反应,进而导致滴入硝酸铅后,某些小区域不会产生明暗变化。故而实验中使用的核酸分子的数量是远高于玻璃基底所能结合的核酸数量的,在制备过程中,玻璃基底表面锚定的核酸数量达到饱和,再用去离子水冲洗,洗去了过量未锚定核酸。
实施例1和实施例4~5比较可知,所用的核苷酸链的具体核苷酸序列并不会对本发明的检测结果产生影响,只要核苷酸链a和核苷酸链b之间部分互补,能够形成u型环,且核苷酸链a能够被铅离子剪切即可。
应用例2
本应用例用于验证实施例1提供的检测探针的特异性。
配制含有不同金属离子的溶液,包括ca2+、mg2+、al3+、cd2+、k+、mn2+、cu2+、zn2+、fe3+、hg2+、ag+,其离子浓度与pb2+相同;
而后使用实施例1中制备的检测探针检测各溶液中明暗信号强度,计算其金属离子的浓度,其中明暗灰度值强度对比图如图6所示;由图6可知,本发明提供的探针能特异性检测铅离子浓度,对其他金属离子不敏感,无检测功能。
综上所述,本发明将核苷酸链的碱基互补配对原理与液晶的光学特性相结合,制备得到的探针能够敏感检测铅离子浓度,易于操作,反应灵敏,便于推广应用,具有广阔的应用前景。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
sequencelisting
<110>南方科技大学
<120>一种基于液晶的检测探针及其制备方法和应用
<130>20200729
<160>6
<170>patentinversion3.3
<210>1
<211>25
<212>dna
<213>人工合成
<400>1
cgataactcactataggaagagatg25
<210>2
<211>33
<212>dna
<213>人工合成
<400>2
catctcttctccgagccggtcgaaatagtgagt33
<210>3
<211>20
<212>dna
<213>人工合成
<400>3
actcactataggaagagatg20
<210>4
<211>33
<212>dna
<213>人工合成
<400>4
catctcttctccgagccggtcgaaatagtgagt33
<210>5
<211>18
<212>dna
<213>人工合成
<400>5
cactaggaagagatgatt18
<210>6
<211>30
<212>dna
<213>人工合成
<400>6
aatcatctctgaagtagcgccgccgtagtg30
- 还没有人留言评论。精彩留言会获得点赞!