一种无酶循环放大核酸适配体传感器及其制备方法和应用
1.本发明属于传感器领域,涉及氨苄西林的检测,特别是指一种无酶循环放大核酸适配体传感器及其制备方法和应用。
背景技术:
2.抗生素已被广泛用于预防和治疗世界各地人类和家禽疾病,是一种抗细菌感染药物
1.。氨苄西林又名氨苄青霉素(ampicilin,amp)是氨基苄西林的一种半合成衍生物,其可以通过抑制肽聚糖的合成来抑制细菌细胞壁的形成,从而导致细胞裂解,自1961年以来被广泛用于治疗细菌感染。当前amp是畜牧养殖过程中常用β-内酰胺类抗生素药物之一,属于广谱抗生素,可被作为饲料添加剂使用,其广谱并廉价因此被大量地使用,且被频繁地以超剂量使用,抗生素滥用会导致动物源性食品中抗生素残留超过最大残留允许量,还会导致人类和家禽排泄粪便、尿液等对环境造成严重污染,并产生细菌耐药性。目前已有报道在鸡、猪、牛奶等动物体内检测到了amp残留,食物中过高浓度的amp会杀灭人体内的正常细菌,使人体产生耐药性,破坏微生物群落,严重的甚至可以引发强烈的过敏反应、导致心血管衰竭,会引起了严重的环境和健康问题。因此,迫切需要开发有效的方法来监测抗生素水平。各国家对畜禽产品中的氨苄西林残留都非常重视。为满足人民健康饮食需求,对各种食品的氨苄西林残留检测必不可少。
3.早期有学者利用色谱技术,根据样品中各组分的差异将目标待测物分离出来,该类方法可对各种基质中的氨苄西林进行精确测量。barot等采用高效液相色谱法实现了药物制剂中氨苄西林的检测。该方法目前已经完成对水,尿液,牛奶,动物血浆,饲料,肌肉组织,药物等样品中氨苄西林的检测。parker等利用液相色谱
‑
质谱联用法成功测得尿液和血浆中amp残留。ibrahim等采用紫外检测的胶束液相色谱法成功测定了鸡肌肉、鸡肝、牛肉、肝、肾和鸡蛋中amp残留量。液相色谱法检测的灵敏度和检测范围符合氨苄西林残留检测标准,且检测的基质多种多样,应用领域广泛,但该方法所需设备较为贵重,测试过程较为复杂,需要熟练的技术人员参与,难以满足现场快速检测和大批量检测的需求。
4.当前免疫吸附测定法是目前青霉素残留检测中常用传感器设计方法,主要利用抗原抗体特异性结合进行定性和定量检测,其最大特点是具有高灵敏度和强特异性,及抗原抗体复合物的高亲和力。pallavi等开发了一种基于光纤表面纳米金粒子等离子体共振的新型光学免疫传感器,采用光纤表面纳米金作基底,通过抗体特异性吸附氨苄西林实现检测。通过免疫吸附测定抗生素残留的传感器具有检出限低、特异性强、检测种类多等优点,所需仪器设备相对简单,便于实际应用,但其抗体制备成本较高,限制了该类传感器的广泛推广与应用。
5.电化学适体传感器是将核酸适体作为敏感元件,电极作为转换元件,以电势或电流为特征检测信号的传感器。yu等taghdisi等wang等yang等以电极作为转换元件,以电流为特征检测信号,制成的电化学传感器实现了amp残留的检测。上述这些方法大多存在设备昂贵、操作熟练、试剂使用量大、分析时间长、样品制备费时费力、现场分析受限、成本高等
缺点。因此,需要一种简单、经济、快速的amp残留检测方法。
6.近年来,适体传感器作为一种灵敏、高效的技术受到越来越多的关注。适体传感器是一种以适配体为识别元件的新型生物传感器。与抗体和其他识别元件相比,核酸适体具有许多独特的特性,包括合成亲和力高、特异性强、方便、成本低、结构稳定灵活、易于生产和修饰。专利cn 202010947091.5公开了一种一种双酶介导级联信号放大的氨苄西林检测适体传感器,该传感器在在t4 dna连接酶及核酸外切酶iii的辅助下,实现了信号的放大;现有的荧光信号放大传感器,也多是要借助至少一种酶。
7.分子信标技术(mb)是一种基于荧光共振能量转移现象(fret)和碱基互补配对原则建立起来的一种分析技术。分子信标作为一种荧光标记的分子探针,可根据设计者的需求对其结构进行灵活的设计,将适配体融入分子信标的设计中,由此开发出的传感器具有极强的特异性和较高的灵敏度。1996 年 tyagi 和 kramer 首先建立了分子信标技术,很快这种技术就广泛的应用于医学、生物学、分子生物学、临床医学和化学等诸多领域。在临床诊断、基因检测等领域,分子信标也越来越显示出它的优势。近年来,人们对分子信标的结构作了诸多改进,发展出很多具有更多特性的新型分子信标。mb用于许多应用领域。在生物传感器的设计中用于dna和rna、抗生素、重金属、atp、胰岛素检测和生物芯片的制备等。本课题组对分子信标技术进行深入研究以期寻找到一种不需要酶作用就能实现荧光信号的循环放大的核酸适配体传感器。
技术实现要素:
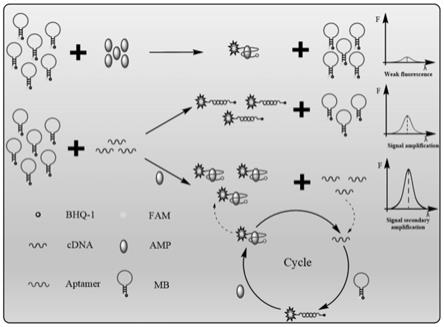
8.为解决上述技术问题,本发明提出一种无酶循环放大核酸适配体传感器及其制备方法和应用。
9.本发明的技术方案是这样实现的:一种无酶循环放大核酸适配体传感器的制备方法,步骤如下:将分子信标mb和cdna分别溶于超纯水中进行激活,静置1h后,按比例混合置于恒温摇床孵育8h,即得无酶循环放大核酸适配体传感器的工作溶液。
10.所述分子信标mb的序列为5
’‑
fam
‑
(ch2)6‑
cccgggttagttggggttcagttggcccggg
‑
bhq
‑1‑3’
;cdna的序列为5
’‑
ccaactgaaccccaactaa
‑3’
。
11.所述分子信标mb和cdna的混合比例为1:0.5,分子信标mb的浓度为166nm,cdna的浓度为83nm。
12.所述恒温摇床孵育的温度为37℃、ph为9。
13.上述方法所制备的无酶循环放大核酸适配体传感器,所述适配体传感器主要由分子信标mb和cdna制备而成,其中分子信标mb为茎
−
环结构,分子信标mb与cdna杂交后会形成mb
‑
cdna复合结构。
14.上述的无酶循环放大核酸适配体传感器的工作原理如图1所示,所述分子信标mb为茎
−
环结构,在没有cdna时荧光团和淬灭剂非常接近,当加入cdna后杂交形成mb
‑
cdna复合结构,此时分子信标mb被打开,并将荧光基团从猝灭剂中分离出来,恢复荧光,当加入靶目标amp时,靶目标amp与分子信标mb特异性结合,并释放cdna;被释放的cdna会触发一个新的循环,与游离的分子信标mb杂交重新形成mb
‑
cdna复合结构;在动态组装下,cdna被循环释放,实现无酶扩增,使荧光信号得到循环放大,荧光信号增强的程度与amp的浓度有关。
15.上述的无酶循环放大核酸适配体传感器在高灵敏检测氨苄西林(amp)中的应用。
16.上述的应用,步骤为:将待测溶液加入到无酶循环放大核酸适配体传感器的工作溶液中,所需缓冲液用20mm tris
‑
hcl (ph=9.0)、50 mm nacl、5 mm kcl、5 mm mgcl2、工作溶液体积为600μl,利用荧光分光光度计对工作溶液进行荧光检测,记录该待测溶液的荧光强度值,代入线性方程,即可计算待测物溶液中amp的浓度。
17.所述线性方程为分段式线性方程,当amp浓度在0.1
‑
10nmol/l范围对数坐标化求出lgc与y的线性回归方程,线性拟合曲线l1为y=138.9616+14.30674
·
lgc,r2=0.99227;当amp浓度在10
‑
150nmol/l线性拟合曲线l2为y=93.42218+58.50019
·
lgc,r2=0.99991,其中y为荧光强度,c为amp浓度。
18.所述无酶循环放大核酸适配体传感器的检测范围为0.05
‑
200nmol/l,检出限为50pmol/l。
19.本发明具有以下有益效果:1、本申请利用分子信标技术通过增加茎区域或增加g,c含量改善mb的选择性,然而在实验阶段发现增加了稳定性发夹构象,但同时会降低杂交速度;在茎序列较短的情况下,可获得较高的荧光背景,但是这降低了检测的灵敏度;茎序列在选择上要同时兼顾特异性和灵敏度。最终本申请筛选的茎长为6个碱基对长度,本申请的分子信标mb的荧光信号由于fam和bhq
‑
1非常接近,所以很微弱,由于荧光共振能量转移效应fam的荧光被猝灭。当引入互补链时,互补链可以破坏mb的结构,使发夹打开并形成mb
‑
cdna复合结构,此时fam的荧光得到恢复。当amp存在时,cdna会被释放出来与游离的mb进行杂交,再一次与靶目标作用,释放出的cdna参与至下一循环,使荧光靶目标信号得到循环放大,随着氨苄西林浓度的增加,荧光强度增加。该传感系统显示出低背景荧光,对amp的检测显示出较高的灵敏度。
20.2、本申请制备的传感器在检测amp时,amp浓度在0.05
‑
150nmol/l范围内,随着amp的浓度增加,荧光强度值呈现出增长的趋势。amp浓度在0.1
‑
10nmol/l范围对数坐标化求出lgc与y的线性回归方程,线性拟合曲线l1为y=138.9616+14.30674
·
lgc,r2=0.99227,amp浓度在10
‑
150nmol/l线性拟合曲线l2为y=93.42218+58.50019
·
lgc,r2=0.99991(y为荧光强度,c为amp浓度),检测范围为0.05~200nmol/l,检出限为50pmol/l。
21.3、本申请的传感器在分别检测了浓度为100nmol/l的氯霉素、羟氨苄青霉素、磺胺、红霉素、头孢氨苄、青霉素g、青霉素v、苯唑西林、氨苄西林的荧光强度变化,用来检测传感器的特异性,如图14所示,该传感器在有干扰目标存在的情况下,能够高选择性地识别amp目标,验证了该传感器对amp具有良好的特异性。
22.4、本发明构建了一种用于检测水环境中氨苄西林浓度的荧光适体传感器,通过适配体实现对氨苄西林的特异性捕获,利用猝灭基团和荧光基团间的距离变化实现荧光信号检测,并凭借互补链作为媒介参与反应循环,最终实现荧光信号的放大。其中,为了提高传感器的灵敏性和稳定性,实验优化了传感器的各项制备参数,并对氨苄西林的浓度进行了检测,检出限为0.05nmol/l,具有一定的抗干扰能力。该方法为水环境中氨苄西林的浓度检测提供研究基础。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现
有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
24.图1为基于mb
‑
cdna的amp检测原理。
25.图2为mb加不同浓度amp的荧光光谱图和荧光强度图。
26.图3为a
‑
d在相同温度下的荧光光谱图。
27.图4为a、b、c分别为amp4、amp17、amp18在温度为37℃条件下的结构,d、e、f分别为amp4、amp17、amp18在37℃与对应适配体互补链结合的结构图。
28.图5为amp4、amp17、amp18的自由能随温度的变化曲线图。
29.图6为mb
‑
cdna在不同温度下的结构图。
30.图7为不同浓度比下加amp工作溶液的荧光强度图。
31.图8为300nm适体加不同浓度amp的荧光光谱图。
32.图9为100nm适体加不同浓度amp的荧光光谱图。
33.图10为mb@cdna不同浓度比下加染料工作溶液的荧光光谱图。
34.图11为mb@cdna凝胶电泳图。
35.图12 为mb@cdna加不同浓度amp凝胶电泳图,其中a:dna maker、 b:mb
‑
cdna@50nm amp、c: mb
‑
cdna@100nm amp、 d: mb
‑
cdna@200nm amp、 e: mb
‑
cdna、f:mb。
36.图13为 mb与cdna浓度比为1:0.5加不同浓度amp的荧光光谱图。
37.图14为加入100nm不同待测物后荧光强度的变化图。
38.图15为不同ph下fam的荧光光谱图。
39.图16为不同温度下fam的荧光光谱图。
40.图17为饮用纯净水中和工作溶液中amp检测对比图。
41.图18为自来水中和工作溶液中amp检测对比图。
具体实施方式
42.一、材料与方法1、材料:本发明中使用的所有化学品均从商业来源获得,无需进一步提纯即可直接使用。实验中所用到的药品有ampicilin、tris
‑
hcl、nacl、naoh、hcl、kcl、 mgcl2、tris
‑
(2
‑
carboxyethyl) phosphine hydrochloride (tcep)、hoechst 33258、4s green plus 、edta、glycerol、bromophenol blue、dna marker a (25~500 bp)。
43.本研究中使用的缓冲液20mm tris
‑
hcl (ph=9.0)、50 mm nacl、5 mm kcl、5 mmmgcl2。所有的溶液均用去离子水配置,纯水通过purelab option
‑
r (elga lab water, uk)净化,采用日本日立f
‑
7000荧光分光光度计进行荧光测量。
44.所有ph值均采用fe
‑
20k酸度计(瑞士梅特勒
‑
托莱多)测定。孵育培养用hzq
‑
f200恒温摇床(北京东联哈尔仪器有限公司)促进杂交,凝胶成像用培清js
‑
680b全自动凝胶成像分析仪(上海培清科技有限公司),所有物质的称重用梅特勒
‑
托利多mettler toledo me204(北京宏达恒业科技有限公司)完成。
45.2、方法:传感器的制备:实验之前首先对样品进行预处理,完成样品的激活并在室温条件
下静止1小时,随后将mb和cdna按所需比例混合在37℃恒温摇床下孵育8个小时,然后向工作溶液中滴加不同浓度的amp并在37℃的水浴锅中孵育2个小时,检测时设置荧光分光光度计的槽内温度为恒定值,设置合适的入射和反射狭缝,在495nm的激发波和508nm发射波下监控样品的荧光强度值。
46.实际样品的检测:在实验中为了测试复杂的测试环境对传感器检测性能的影响,我们测试了实际样品中氨苄西林,并通过回收率测定进行评价。在实际样品中加入三种浓度的氨苄西林溶液。提取分析后,计算氨苄西林的回收率和相对标准偏差。
47.3、传感器的检测原理如图1所示,信标分子mb采用茎
−
环结构,在没有cdna时荧光团和淬灭剂非常接近。当cdna与mb杂交后形成mb
‑
cdna复合结构,打开mb并将荧光基团从猝灭剂中分离出来,从而恢复荧光。在amp存在的情况下。靶目标首先与mb特异性结合,并释放cdna。被释放的cdna和游离的mb杂交重新形成mb
‑
cdna结构。该结构会与靶目标作用,并再一次释放cdna,从而触发另一个反应循环。在该动态组装下,cdna被循环释放,实现无酶扩增,使荧光信号得到循环放大,荧光信号增强的程度与amp的浓度有关。我们也做了只有mb与amp条件下的检测,实验结果显示加入amp后工作溶液的荧光强度有微小的变化,并随着待测物浓度的升高呈现上升的趋势。
48.双标记dna适体探针中分子信标mb的核酸序列5
‘
fam
‑
(ch2)6
‑
cccgggttagttggggttcagttggcccggg
‑
bhq
‑
13’和互补链cdna的核酸序列为:5
‘
ccaactgaaccccaactaa3’由生工生物工程(上海)股份有限公司合成。利用核酸折叠和杂交预测的网络服务器nupack获得了适体的二级结构(http://www.nupack.org/partition/new)。
49.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
50.实施例1:传感器检测的可行性本发明对mb能否与amp直接反应的问题,做了不添加互补链直接引入amp的实验。通过实验可以看出加入amp后工作溶液的荧光强度有微小的变化,并随着待测物浓度的升高呈现上升的趋势,这表明有极少量的mb与amp作用,产生了一个非常微弱的荧光信号(如图2所示)。在这项工作中为了验证该传感器的可行性,分别检测加入amp前后荧光适体传感器的荧光强度如图3所示。最初mb的荧光信号非常微弱,具体地说,fam和bhq
‑
1非常接近,由于荧光共振能量转移效应fam的荧光被猝灭(曲线a所示)。当引入互补链时,互补链可以破坏mb的结构,使发夹打开并形成mb
‑
cdna复合结构,此时fam的荧光得到恢复(曲线b所示)。当amp存在时,cdna会被释放出来与游离的mb进行杂交,再一次与靶目标作用,释放出的cdna参与至下一循环,使荧光靶目标信号得到循环放大(曲线c和d所示)。通过利用该设计策略,可以通过检测荧光信号变化来确定amp的浓度。
51.实施例2:分子信标茎长和适配体的选择本课题组分析了茎长的不同可能会带来的一些不利因素,碱基对数太短结构不稳定,碱基对数太长导致互补链与发夹的结合变得困难。氨苄西林对应的三个序列分别为:
amp4: cacggcatggtgggcgtcgtg(21碱基、gc含量:71.43%);amp17: gcgggcggttgtatagcgg(19碱基、gc含量: 68.42%);amp18: tttagttggggttcagttg(19碱基、gc含量:42.11%)。解离常数(kd)分别为9.4、13.4和9.8nm,下面图4中a
‑
c分别展示了三个序列两端各增加六个碱基(cccggg
‑
amp
‑
cccggg)在nupack软件中的模拟情况,图d
‑
f为在a
‑
c基础上添加每个序列对应适配体互补链的模拟数据。
52.通过模拟我们最终选择了茎部的碱基对数目为6,并且在靠近猝灭基团的那一侧链选择了较多的的碱基g,(碱基g目的可以增强猝灭效果)。通过软件模拟可以看出amp4发夹结构的茎部较长,适配体并没有完全在mb的环部展现,茎部增长尽管可使发夹结构的稳定性得到提升,在107℃左右发夹展开为一条直链结构,但该结构与其适配体对应的互补链结合的自由能较大、使靶目标将互补链竞争下来变得困难,amp17同样也存在着类似的问题。通过结构图可看出amp18序列完整的在mb的环部展现出来,amp18相对于amp4和amp17稳定性较差一些,在87℃左右发夹展开为一条直链结构,该结构与其适配体对应的互补链结合的自由能较小,且茎部较短,这使得本身与适配体对应的互补链和靶分子结合变得容易(见图5)。
53.图4中的d、e、f分别显示出为三种适配体在37℃与对应适配体的互补链结合情况,可以看出f图中二者结合后的自由能偏小,这表明在靶目标的存在下该结构更不稳定,换句话讲靶目标更容易将互补链竞争下来。与其综合三种适配体的解离常数、成环状况、以及与互补链和靶目标结合的难易程度考虑,将amp18筛选为合适的对象。
54.实施例3:各反应条件对mb
‑
cdna结合率的影响mb是一种特殊的dna探针,由一个用于靶标识别的环区域以及在各个末端带有荧光供体和受体的茎区域组成,其作为一种荧光标记的分子探针,具有极强的特异性和较高的灵敏度。分子信标对温度异常敏感,其选择性、与靶标的杂交率会受到温度的显著影响,较高的温度会破坏发夹球,使发夹结构开始熔化形成随机发夹,并造成高的背景信号导致mb不可用,因此需要对温度进行优化选择一个合适的温度。通常环境的温度和ph会影响fam的发光效率,互补链作为mb和amp反应的媒介,在整个反应循环过程中扮演着重要角色;因此对溶液环境的温度、ph、mb和cdna的比例及适体浓度进行了优化。
55.首先我们对工作溶液孵育温度的进行优化,用nupack模拟了mb随温度的变化,实验结果显示随着温度的升高mb的自由能在下降(见图6),也就表明茎部碱基对之间的作用力在变弱,为发夹的打开提供了可能。图6用实验的方法测得mb在不同温度下的荧光强度,可以看出随着温度的升高mb的荧光强度在增强。尽管mb会随温度的升高荧光强度呈现上升的趋势,但无法判定温度使mb的结构发生了变化,不排除温度对荧光基团(fam)自身的影响。为了探究温度对fam的影响,我们做了fam在不同温度下的实验,通过实验数据可以看出在40℃附近荧光强度达到了最大,之后随着温度的升高荧光强度呈现出衰减的趋势。这初步表明温度使得mb的结构发生了变化,使得fam和bhq
‑
1远离发生了荧光共振能量转移。
56.本实施例用nupack软件完成了mb和cdna在不同温度条件下的模拟,通过模拟可以看出温度在0℃
‑
95℃范围(图5),自由能随着温度的升高在减小,当温度超过95℃时,自由能略有上升。图6为二者在25℃、65℃、105℃、125℃条件下的结合情况,随着温度的升高,两者结合的碱基对数在减少,彼此间的结合力在下降。而且随着温度的升高,二者的结合率在下降。由此温度的变化会影响传感器的检测性能,实验中需保持温度的一致性,图16可以看
出在25℃
‑
50℃范围mb的荧光强度变化幅度较小,换句话说mb在此范围受温度的影响较小,在40℃附近fam的发光效率较高,综合这些因素最终选定了接近人体的温度37℃为实验温度。
57.然后对ph进行优化:fam对ph非常敏感,为了优化工作溶液的ph,实验在ph为1~12范围内考察了ph对fam的影响。由图15所示,ph值在1~9范围内,随着ph值的增大荧光强度逐渐增强。当ph值在9~12范围时,随着ph的升高荧光强度逐渐降低。在ph值为9时fam的发光效率达到最大,而过酸或过碱的环境可使dna发生裂解,这不利于此传感器对amp的检测,因此选择了ph值为9的缓冲液进行后续实验。
58.再对互补链比例进行了优化,实验为了选择一个合适的比例,做了不同比例下加amp的优化实验(a
‑
f比例分别为1:0、1:0.3、1:0.4、1:0.5、1:0.8、1:1)。结果如图7 通过对比发现当浓度比为1:0.5时其检测范围和灵敏度与其他比例相比有突出的优势,因此选定mb与cdna浓度比为1:0.5进行后续实验。
59.最后,对适体浓度进行优化,在前面的实验基础上我们分别做了增加和减少适体浓度的实验,其中mb与cdna的浓度比为1:0.5固定不变。目的是探究适体浓度的不同对传感器检测的灵敏度和检测范围有何影响。实验发现适体浓度为300nm(图8) ,amp浓度在1nm
‑
200nm范围,该传感器会随着待测物浓度的升高荧光信号增强,而在200nm以后荧光信号有下降趋势。适体浓度为100nm(图9),amp浓度在0.5
‑
100nm范围变化较为规律,随amp浓度的增加有上升的趋势。由此适体浓度的不同,传感器在检出范围和检出限方面也存在着差异,经过对比分析不难发现适体浓度为166nm左右较为合适。
60.实施例4:mb
‑
cdna复合结构的表征实验发明人为了进一步验证加入互补链后形成了mb
‑
cdna复合结构,引入了一种核酸染料hoechst 33258,该染料可嵌入双链结构的dna碱基槽中,在波长为350nm的紫外光下被激发,可使原始的荧光信号得到增强。通过图10可以看出波长在459nm时对应的荧光强度最大,随着互补链数目的增多,荧光信号也在增强,表明cdna 迫使发夹结构打开,形成的mb
‑
cdna复合结构也在增多。实验还利用凝胶电泳的方法对该结构进行表征,可以看出mb
‑
cdna复合结构能够明显的区别于mb和cdna,而且在引入amp后,电泳后跑出的条带mb
‑
cdna@amp和mb
‑
cdna也存在着差异mb
‑
cdna团聚现象强于前者,且mb
‑
cdna@amp条带稍滞后于mb
‑
cdna条带(图11)。紧接着我们做了50nm、100nm 、200nm的amp( 图12),可以看出三者有细微的差异,浓度为200nm的amp较滞后于前面两者。
61.实施例5:灵敏度和特异性在优化的实验条件下,分别对0.05、0.1、0.5、1、5、10、50、100、150、200nmol/l的amp进行检测,得到不同浓度amp的荧光强度值。如图13所示,amp浓度在0.05
‑
150nmol/l范围内,随着amp的浓度增加,荧光强度值呈现出增长的趋势。amp浓度在0.1
‑
10nmol/l范围对数坐标化求出lgc与y的线性回归方程,线性拟合曲线l1为y=138.9616+14.30674
·
lgc,r2=0.99227,amp浓度在10
‑
150nmol/l线性拟合曲线l2为y=93.42218+58.50019
·
lgc,r2=0.99991(y为荧光强度,c为amp浓度),检测总范围为0.05~200nmol/l,检出限为0.05nmol/l。
62.特异性是评价传感器性能的重要参数之一,为了评价该传感器的特异性,我们对某些amp的类似物进行了检测。在最优的实验条件下分别检测了浓度为100nmol/l的氯霉
素、羟氨苄青霉素、磺胺、红霉素、头孢氨苄、青霉素g、青霉素v、苯唑西林、氨苄西林的荧光强度变化,用来检测传感器的特异性。如图14所示,该传感器在有干扰目标存在的情况下,能够高选择性地识别amp目标。验证了该传感器对amp具有良好的特异性。
63.实施例6:实际样品中的检测分析在实验中为了测试复杂的测试环境对传感器检测性能的影响,我们测试了实际样品中氨苄西林,并通过回收率测定进行评价。
64.表17
‑
1饮用纯净水中和工作溶液中amp检测数据表17
‑
2饮用纯净水中amp的回收率和相对标准偏差表18
‑
1自来水中和工作溶液中amp检测数据表18
‑
2自来水中amp的回收率和相对标准偏差
在饮用纯净水中(图17)和自来水(图18)中加入了不同浓度的amp,根据表17
‑
1、17
‑
2、17
‑
3、17
‑
4计算了实际样品中氨苄西林的回收率和相对标准偏差,对比分析了实际样品中amp的检测和同等条件下工作溶液中amp检测之间差异。
65.实施效果例分析综上所述,本申请构建了一种用于检测水环境中氨苄西林浓度的荧光适体传感器,通过适配体实现对氨苄西林的特异性捕获,利用猝灭基团和荧光基团间的距离变化实现荧光信号检测,并凭借互补链作为媒介参与反应循环,最终实现荧光信号的放大。其中,为了提高传感器的灵敏性和稳定性,实验优化了传感器的各项制备参数,并对银离子的浓度进行了检测,检出限为0.05nmol/l,具有一定的抗干扰能力。该方法为水环境中氨苄西林的浓度检测提供研究基础。
66.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1