细胞的状态的评价方法和评价试剂盒与流程
1.本发明涉及细胞的状态的评价方法和评价试剂盒。
2.本技术要求于2020年9月24日提交的日本技术特愿2020-159896号的优先权,其全部内容以引用的方式并入本文中。
背景技术:
3.目前,在再生医疗领域和疾病研究领域等各种领域中,正在处理各种细胞。例如,在再生医疗领域中,培养干细胞,使其增殖至一定量,然后使其分化为期望的细胞,用于向人的移植。另外,在疾病研究领域中的细胞的利用中,进行疾病细胞或治疗用细胞的培养,评价该细胞的性质和特性。
4.在任一领域中,为了利用细胞,都需要评价培养的细胞的状态。在现状下,细胞的状态的评价根据基于显微镜观察的形状评价和培养工艺本身是否没有异常来进行,但不能说能够充分地评价细胞的状态。另外,为了显微镜观察而采集的细胞不能用于之后的工艺。进而,由于细胞大多与培养皿等托底材料粘接,因此采集操作有可能对其它培养细胞造成影响。
5.近年来,提出了通过分析细胞释放到细胞外的mirna(microrna,微小核糖核酸)来评价细胞的分化状态的方法(专利文献1)。然而,mirna容易受到酶分解,测定操作繁杂,测定耗费时间。另外,mirna的检测需要利用pcr(polymerase chain reaction,聚合酶链式反应)等进行扩增,因此即使是微小误差也大多形成大问题。
6.在先技术文献
7.专利文献
8.专利文献1:日本特开2018-113924号公报。
技术实现要素:
9.发明要解决的问题
10.为了在再生医疗领域或疾病研究领域中利用细胞,通常需要准备相同状态的细胞。为了避免细胞的采集操作对培养细胞的影响,要求不直接采集细胞而能够简单且准确地评价细胞的状态的技术。
11.因此,本发明的目的在于提供一种能够使用细胞的培养上清液来简易地评价细胞的状态的细胞的状态的评价方法及评价试剂盒。
12.解决问题的手段
13.本发明包括以下的方式。
14.[1]一种细胞的状态的评价方法,包括:
[0015]
工序(a),在所述细胞的培养上清液中,测定具有第一外泌体膜蛋白质的第一外泌体(exosome)和具有第二外泌体膜蛋白质的第二外泌体;
[0016]
工序(b),计算所述第二外泌体相对于所述第一外泌体的比例;以及
[0017]
工序(c),以所述比例为指标,判定所述细胞的状态。
[0018]
[2]根据[1]所述的细胞的状态的评价方法,其中,
[0019]
所述工序(a)是使用第一抗体、第二抗体和第三抗体的工序,
[0020]
所述第一抗体对所述第一外泌体膜蛋白质具有特异性结合活性,且结合有第一标记物质,
[0021]
所述第二抗体对所述第二外泌体膜蛋白质具有特异性结合活性,且结合有第二标记物质,
[0022]
所述第三抗体对所述第一外泌体的至少一部分和所述第二外泌体的至少一部分所具有的第三外泌体膜蛋白质具有特异性结合活性,且固定于固相载体,
[0023]
所述工序(a)包括:
[0024]
工序(i),使所述培养上清液与固定于所述固相载体的所述第三抗体接触;
[0025]
工序(ii),在所述工序(i)后,使所述第一抗体和所述第二抗体与所述固相载体接触;以及
[0026]
工序(iii),在所述工序(ii)后,测定被捕获于所述固相载体上的所述第一标记物质和所述第二标记物质。
[0027]
[3]一种细胞的状态的评价方法,包括:
[0028]
工序(a),在所述细胞的时刻(t1)的培养上清液中,测定具有第一外泌体膜蛋白质的第一外泌体和具有第二外泌体膜蛋白质的第二外泌体;
[0029]
工序(b),计算所述时刻(t1)的所述第二外泌体相对于所述第一外泌体的比例(t1);
[0030]
工序(c),在所述细胞的时刻(t2)的培养上清液中,测定所述第一外泌体和所述第二外泌体;
[0031]
工序(d),计算所述时刻(t2)的所述第二外泌体相对于所述第一外泌体的比例(t2);以及
[0032]
工序(e),基于所述比例(t1)和所述比例(t2)的比较结果,判定所述细胞的状态。
[0033]
[4]根据[3]所述的细胞的状态的评价方法,所述工序(a)和(c)是使用第一抗体、第二抗体和第三抗体的工序,
[0034]
所述第一抗体对所述第一外泌体膜蛋白质具有特异性结合活性,且结合有第一标记物质,
[0035]
所述第二抗体对所述第二外泌体膜蛋白质具有特异性结合活性,且结合有第二标记物质,
[0036]
所述第三抗体对所述第一外泌体的至少一部分和所述第二外泌体的至少一部分所具有的第三外泌体膜蛋白质具有特异性结合活性,且固定于固相载体,
[0037]
所述工序(a)和(c)包括:
[0038]
工序(i),使所述培养上清液与固定于所述固相载体的所述第三抗体接触;
[0039]
工序(ii),在所述工序(i)后,使所述第一抗体和所述第二抗体与所述固相载体接触;以及
[0040]
工序(iii),在所述工序(ii)后,测定被捕获于所述固相载体上的所述第一标记物质和所述第二标记物质。
[0041]
[5]一种细胞的状态的评价试剂盒,包括:
[0042]
第一抗体,对第一外泌体膜蛋白质具有特异性结合活性,且结合有第一标记物质;
[0043]
第二抗体,对第二外泌体膜蛋白质具有特异性结合活性,且结合有第二标记物质;以及
[0044]
第三抗体,对第三外泌体膜蛋白质具有特异性结合活性,且固定于固相载体,
[0045]
其中,具有所述第一外泌体膜蛋白质的第一外泌体的至少一部分和具有所述第二外泌体膜蛋白质的第二外泌体的至少一部分具有所述第三外泌体膜蛋白质。
[0046]
发明效果
[0047]
根据本发明,提供一种能够使用细胞的培养上清液来简易地评价细胞的状态的细胞的状态的评价方法及评价试剂盒。
附图说明
[0048]
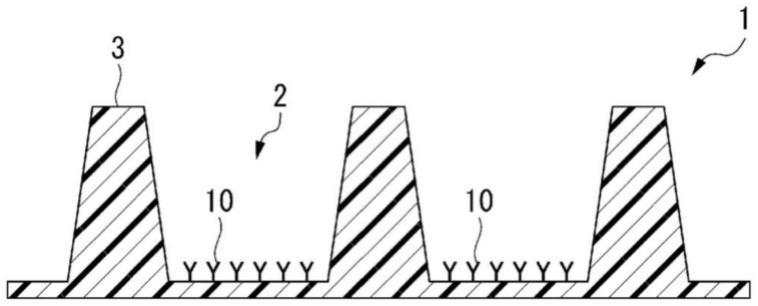
图1a示出本发明的一个实施方式涉及的细胞的状态的评价方法中使用的固相载体的一个例子。
[0049]
图1b是说明本发明的一个实施方式涉及的细胞的状态的评价方法的工序(a)中工序(i)的一个例子的图。
[0050]
图1c是说明本发明的一个实施方式涉及的细胞的状态的评价方法的工序(a)中工序(ii)的一个例子的图。
[0051]
图2a是示出具备了外泌体计数器中使用的固相载体的外泌体捕获单元的一个例子的示意图。
[0052]
图2b是图2a的外泌体捕获单元a-a切线的示意性剖视图。
[0053]
图2c是用于说明图2a的外泌体捕获单元的盒52为可拆装的示意性剖视图。
[0054]
图3a是图2a的外泌体单元的b-b切线处的示意性剖视图。
[0055]
图3b是用于说明图2a的外泌体单元的凹部和凸部的尺寸形状的放大剖视图。
[0056]
图4示出cd63阳性外泌体相对于cd9阳性外泌体的比例与细胞的状态关系的调查结果。
具体实施方式
[0057]
以下,根据情况,参照附图,并对本发明的实施方式进行详细说明。在附图中,对相同或相当的部分标注相同或对应的附图标记,并省略重复说明。各图中的尺寸比存在为了说明而夸张的部分,未必与实际的尺寸比一致。
[0058]“抗体”是指具有抗原结合活性的免疫球蛋白。抗体只要具有抗原结合活性即可,不需要是完整的抗体,也可以是抗原结合片段。在本说明书中,“抗体”这一术语包含抗原结合片段。“抗原结合片段”是指包含抗体一部分的多肽,是维持原抗体的抗原结合性的多肽。抗原结合片段优选包含原抗体的6个互补性决定区(complementarity determining region,cdr)的全部。即,优选包含重链可变区的cdr1、cdr2、cdr3以及轻链可变区的cdr1、cdr2、cdr3的全部。作为抗原结合片段例如包括fab、fab’、f(ab’)2、可变区片段(fv)、二硫键fv、单链fv(scfv)和sc(fv)2等。
[0059]
抗体可以来自任何生物。作为抗体来源的生物,例如举出哺乳类(人、小鼠、大鼠、
兔、马、牛、猪、猴子、狗等)、鸟类(鸡、鸵鸟)等,但不限于这些。
[0060]
抗体可以是免疫球蛋白的任一类和亚类。另外,抗体可以是单克隆抗体,也可以是多克隆抗体,但优选单克隆抗体。
[0061]
抗体可以通过免疫法、杂交瘤法、噬菌体展示法等公知的方法来制作。
[0062]“具有特异性结合活性”是指对对象物质具有高结合活性,对其它物质几乎不具有结合活性。例如,对第一外泌体膜蛋白质具有特异性结合活性的抗体对第一外泌体膜蛋白质具有高结合活性,对其它物质几乎不具有结合活性。因此,该抗体仅与第一外泌体结合,几乎不与其它物质结合。对于第二外泌体膜蛋白质具有特异性结合活性的抗体以及对于第三外泌体膜蛋白质具有特异性结合活性的抗体也相同。
[0063]“包含(包括)”(comprise)这一术语意味着也可以包含成为对象的构成要素以外的构成要素。“由
…
构成”(consist of)这一术语意味着不包含成为对象的构成要素以外的构成要素。“基本上由
…
构成”(consist essentially of)这样的术语意味着不会以发挥特别功能的方式(使发明的效果完全丧失的方式等)包含成为对象的构成要素以外的构成要素。在本说明书中,在记载为“包含(包括)”(comprise)的情况下,包含“由
…
构成”(consist of)方式以及“基本上由
…
构成”(consist essentially of)方式。
[0064]
蛋白质(包括抗体)和细胞可以是分离的。“分离”是指从天然状态分离的状态。本说明书中记载的蛋白质和细胞可以是分离的蛋白质和分离的细胞。
[0065]
《细胞的状态的评价方法》
[0066]
[第一实施方式]
[0067]
在一个实施方式中,本发明提供细胞的状态的评价方法。本实施方式的细胞的状态的评价方法包括:工序(a),在所述细胞的培养上清液中,测定具有第一外泌体膜蛋白质的第一外泌体和具有第二外泌体膜蛋白质的第二外泌体;工序(b),计算所述第二外泌体相对于所述第一外泌体的比例;以及工序(c),以所述比例为指标,判定细胞的状态。
[0068]
本实施方式的评价方法中,在细胞的培养上清液中,获取第二外泌体相对于第一外泌体的比例,所述第一外泌体具有第一外泌体膜蛋白质,所述第二外泌体具有第二外泌体膜蛋白质,将所述比例作为指标,评价细胞的状态。外泌体是由直径50~150nm左右的脂双层膜包围的膜囊泡,是对内泌体(endosome)内腔向内出芽的腔内膜囊泡被释放到细胞外的物质。外泌体反映来源细胞的性质,在外泌体膜上具有各种蛋白质。细胞并非总是释放一定性质的外泌体,外泌体中反映释放时的细胞的状态。本实施方式的评价方法基于如下见解:培养上清液中具有特定种类的膜蛋白质的2种外泌体的比例反映了培养细胞的状态。
[0069]
通过本实施方式的评价方法评价的“细胞的状态”是使用标准地用于对象细胞培养的培养基,在标准的培养条件下进行培养时,以该细胞的大部分所显示的性状为基准的状态。即,“细胞的状态异常”是指培养细胞的性状脱离所述标准性状。另外,“细胞的状态正常”是指培养细胞的性状不脱离所述标准性状。作为细胞的性状,例如举出细胞的形态、大小、粘附状态、浮游状态、凝集状态、代谢活性、基因表达谱以及蛋白质谱等,但不限定于这些。根据本实施方式的评价方法,能够在没有直接观察或分析细胞的情况下判定细胞的状态。
[0070]
(细胞)
[0071]
本实施方式的评价方法是评价培养细胞的状态的方法。评价对象的细胞只要是能
够在体外(in vitro)培养的细胞就不受到特别限定,可以使用任意的细胞。细胞优选为真核细胞。细胞来源的生物不受到特别限定,可以是动物细胞,也可以是植物细胞,但优选动物细胞。作为动物细胞,例如举出哺乳动物、鸟类、爬虫类、两栖类、鱼类、节肢动物等细胞,但并不限定于这些。细胞优选哺乳动物的细胞,作为哺乳动物,可举出人、人以外的灵长类(猴子、黑猩猩、大猩猩等)、啮齿类(小鼠、仓鼠、大鼠等)、兔、狗、猫、牛、山羊、羊、马等,但不限定于这些。
[0072]
细胞的种类不受到特别限定,可以使用任意种类的细胞。细胞可以是体细胞,也可以是生殖细胞。作为细胞,例如举出胚胎干细胞(embryonic stem cell,es细胞)、人工多能干细胞(induced pluripotent stem cell,ips细胞)等多能干细胞;造血干细胞、脂肪干细胞、间充质干细胞、神经干细胞、肠道上皮干细胞、表皮干细胞等躯体干细胞;树突状细胞、巨噬细胞、淋巴细胞(t细胞、b细胞、自然杀伤细胞等)等免疫系统细胞;骨细胞、成骨细胞、脂肪细胞、软骨细胞、皮肤细胞、神经细胞、肌肉细胞、成纤维细胞、肝脏细胞等各种组织细胞、以及它们的前体细胞;癌细胞、癌干细胞等,但并不限定于这些。另外,细胞可以是从多能干细胞或体干细胞分化诱导的细胞,也可以是通过基因重组技术等进行了改变的改变细胞,还可以是株化细胞。
[0073]
(细胞的培养)
[0074]
细胞的培养方法不受到特别限定,可以根据细胞种类使用公知的方法。培养中使用的培养基为液体培养基,可以根据细胞种类选择公知的培养基。培养基可以根据细胞的种类适当选择细胞的增殖/维持所需的成分来使用。作为培养基成分,例如举出糖类、有机酸、氨基酸、蛋白质、多糖、脂肪酸、无机盐类、维生素类、微量元素、增殖因子、细胞因子、抗生素、抗氧化剂、缓冲剂等,但并不限定于这些。
[0075]
培养基也可以在公知的基础培养基中添加血清、血清替代物等成分来制作。“基础培养基”是指包含培养对象的细胞生长所需的最小限度成分的培养基,已知有各种培养基。作为动物细胞的基础培养基,例如举出imdm培养基、medium 199(培养基199)培养基、鹰的最小必需培养基(eagle's minimum essential medium,emem)培养基、αmem培养基、杜尔贝科改良伊格尔培养基(dulbecco's modified eagle's medium,dmem)培养基、ham's f12培养基、rpmi1640培养基、fischer's培养基、mcdb201培养基、mc'coy5a培养基、公知的干细胞用培养基以及它们的混合培养基等。
[0076]
作为添加到基础培养基中的血清,例如可以使用人血清、胎牛血清(fbs)、牛血清、小牛血清、山羊血清、马血清、猪血清、羊血清、兔血清、大鼠血清等,但并不限定于这些。另外,也可以使用选自白蛋白质、转铁蛋白质、脂肪酸、胰岛素、亚硒酸钠、胆固醇、胶原蛋白前体、微量元素、2-巯基乙醇、3
’‑
硫醇甘油等中的1种以上的血清替代物。
[0077]
细胞的培养条件可以根据细胞种类适当选择。例如,作为动物细胞的培养条件,举出温度30℃~37℃、co2浓度2%~7%以及o2浓度0.1%~21%等。也可以根据细胞的生长状况,适当地进行传代。
[0078]
(工序(a))
[0079]
工序(a)是在细胞的培养上清液中测定具有第一外泌体膜蛋白质的第一外泌体和具有第二外泌体膜蛋白质的第二外泌体的工序。
[0080]“外泌体膜蛋白质”是存在于外泌体膜的蛋白质。外泌体膜蛋白质可以是泛外泌体
膜蛋白质,也可以是仅一部分种类外泌体特异性地具有的外泌体膜蛋白质。“泛外泌体膜蛋白质”是指外泌体普遍具有的膜蛋白质。“外泌体普遍具有”是指广义种类的外泌体具有。作为泛外泌体膜蛋白质,例如举出cd9、cd63和cd81等。
[0081]
第一外泌体是具有第一外泌体膜蛋白质的外泌体,第二外泌体是具有第二外泌体膜蛋白质的外泌体。第一外泌体膜蛋白质和第二外泌体膜蛋白质是彼此不同的外泌体膜蛋白质。然而,第一外泌体和第二外泌体也可以一部分重复。即,除了第一外泌体膜蛋白质以外,第一外泌体的一部分还可以具有第二外泌体膜蛋白质。除了第二外泌体膜蛋白质以外,第二外泌体的一部分还可以具有第一外泌体膜蛋白质。
[0082]
作为第一外泌体膜蛋白质和第二外泌体膜蛋白质的组合,例如举出泛外泌体膜蛋白质彼此的组合(例如cd9和cd63、cd9和cd81、cd63和cd81等)、泛外泌体膜蛋白质和特异性外泌体膜蛋白质的组合、以及特异性外泌体膜蛋白质彼此的组合等。“特异性外泌体膜蛋白质”是指泛外泌体膜蛋白质以外的外泌体膜蛋白质,是仅在一部分外泌体中表达的膜蛋白质。作为一个例子,第一外泌体膜蛋白质为cd9,第二外泌体膜蛋白质为cd63。
[0083]“培养上清液”是指培养细胞的培养液的液相组分。培养上清液也可以说是从细胞的培养液中除去细胞后的部分。细胞粘附或沉降于培养容器的底面时,培养上清液可以通过采集培养液的上清部分而得到。在细胞悬浮于培养液中的情况下,可以从培养液上部采集试样,通过离心分离或过滤等除去固体成分。
[0084]
培养上清液可以直接使用从培养液采集的物质,也可以使用通过超离心分离等分离了外泌体组分的物质。
[0085]
培养上清液中的第二外泌体相对于第一外泌体的比例反映在采集培养上清液的时刻的培养细胞的状态。因此,可以在想要评价培养细胞的状态的时期适当采集培养上清液,供于第一外泌体和第二外泌体的测定。
[0086]
在培养上清液中,测定第一外泌体和第二外泌体的方法不受到特别限定,可以使用公知的方法。作为测定第一外泌体的方法,例如举出使用对第一外泌体膜蛋白质具有特异性结合活性的抗体(第一抗体)的免疫化学测定方法。作为测定第二外泌体的方法,例如举出使用对第二外泌体膜蛋白质具有特异性结合活性的抗体(第二抗体)的免疫化学测定方法。
[0087]
优选在所述第一抗体上结合有第一标记物质。优选在所述第二抗体上结合有第二标记物质。标记物质不受到特别限定,可以没有特别限制地使用在免疫化学测定法中通常使用的标记物质。作为标记物质,例如举出固相载体颗粒(聚苯乙烯、甲基丙烯酸缩水甘油酯等树脂珠;磁珠;金属纳米颗粒等)、过氧化物酶(例如辣根过氧化物酶)、碱性磷酸酶等酶标记;羧基荧光素(fam)、6-羧基-4’,5
’‑
二氯-2’,7
’‑
二甲氧基荧光素(joe)、异硫氰酸荧光素(fitc)、四氯荧光素(tet)、5
’‑
六氯-荧光素-ce亚磷酰胺(hex)、cy3、cy5、alexa568、alexa647等荧光标记;碘125等放射性同位素标记;钌络合物等电化学发光标记;生物素等。标记物质相对于第一抗体和第二抗体的结合可以通过公知的方法进行。优选第一标记物质与第二标记物质彼此不同。
[0088]
除了上述第一抗体和第二抗体以外,工序(a)还可以使用对第三外泌体膜蛋白质具有特异性结合活性的第三抗体进行。第三外泌体膜蛋白质优选与第一外泌体膜蛋白质和第二外泌体膜蛋白质不同。作为第三外泌体膜蛋白质,可以使用第一外泌体的至少一部分
和第二外泌体的至少一部分所具有的外泌体膜蛋白质。作为第三外泌体膜蛋白质,例如举出泛外泌体膜蛋白质(cd9、cd63、cd81)。在使用cd9作为第一外泌体膜蛋白质、使用cd63作为第二外泌体膜蛋白质的情况下,可以使用cd81作为第三外泌体膜蛋白质。
[0089]
工序(a)可以包括:工序(i),使所述培养上清液与固定于固相载体的所述第三抗体接触;工序(ii),在所述工序(i)后,使所述第一抗体和所述第二抗体与所述固相载体接触;以及工序(iii),在所述工序(ii)后,测定被捕获于所述固相载体上的所述第一标记物质和所述第二标记物质。以下,参照图1,对工序(a)包含所述工序(i)~(iii)的情况进行说明。
[0090]
《工序(i)》
[0091]
工序(i)中,使培养上清液与固定于固相载体的所述第三抗体接触。
[0092]
图1a示出固定有第三抗体10的固相载体1。固相载体1具备凹部2和凸部3,在凹部2固定有第三抗体10。
[0093]
固相载体1的材质不受到特别限定,可举出聚苯乙烯、聚烯烃(聚乙烯、聚丙烯等)、环烯烃聚合物和聚碳酸酯等树脂;以及玻璃等。固相载体1可以是以能够结合第三抗体10的方式进行了表面加工的孔板,凹部2可以是孔板的孔。或者,固相载体1也可以在经表面加工的基板上设置凹部2和凸部3。
[0094]
第三抗体10向固相载体1的固定方法可以使用公知的方法进行。例如,可以对固定第三抗体10的面进行表面加工以使得通过表面疏水相互作用而蛋白质被物理吸附,也可以进行表面加工以使得具有氨基或羧基等。或者,也可以利用抗生物素蛋白-生物素结合来将第三抗体10固定于凹部2。
[0095]
为了使培养上清液与第三抗体10接触,将培养上清液提供到固定有第三抗体10的固相载体1的表面上即可。
[0096]
在培养上清液中含有具有第三外泌体膜蛋白质31的外泌体的情况下,通过第三外泌体膜蛋白质31与第三抗体10的结合,外泌体被捕获于凹部2。在图1b中,具有第三外泌体膜蛋白质31且具有第一外泌体膜蛋白质21的第一外泌体e1、以及具有第三外泌体膜蛋白质31且具有第二外泌体膜蛋白质22的第二外泌体e2被捕获于凹部2。
[0097]
使培养上清液与第三抗体10接触后,可以适当地使用清洗液进行固相载体1的清洗。通过清洗固相载体1,能够除去未与第三抗体10结合的外泌体。清洗液不受到特别限定,可以没有特别限制地使用免疫化学测定法中通常使用的清洗液。作为清洗液,例如举出pbs(磷酸盐缓冲液)、tris(三羟甲基氨基甲烷)缓冲液、hepes(4-羟乙基哌嗪乙磺酸)缓冲液等缓冲液;在所述缓冲液中添加了tween20(吐温20)等表面活性剂的清洗液;以及纯水等,但并不限定于这些。
[0098]
可以在使培养上清液与固相载体1接触之前,进行固相载体1的封闭处理。通过进行封闭处理,能够抑制对固相载体的非特异性结合。
[0099]
封闭处理可以通过使封闭液与固定有捕获用抗体的固相载体接触来进行。封闭液不受到特别限定,可以没有特别限制地使用在免疫化学测定法中通常使用的封闭液。作为封闭液,例如举出含有1~5%左右的脱脂奶或牛血清白蛋白(bsa)的缓冲液等。所述封闭液用的缓冲液不受到特别限定,例如可举出pbs、pbs-t(磷酸盐缓冲液含吐温20)、tris缓冲液、hepes缓冲液等。
[0100]
《工序(ii)》
[0101]
工序(ii)中,使第一抗体和第二抗体与固相载体接触。
[0102]
在工序(ii)中使用的第一抗体和第二抗体上分别结合有第一标记物质和第二标记物质。
[0103]
在工序(i)后的固相载体1中,具有第三外泌体膜蛋白质31的外泌体(e1、e2)经由第三抗体10被捕获。如图1c所示,在此,使结合有第一标记物质41的第一抗体46接触时,第一抗体46与外泌体e1的第一外泌体膜蛋白质21结合。另外,当使结合有第二标记物质42的第二抗体47接触时,第二抗体47与外泌体e2的第二外泌体膜蛋白质22结合。
[0104]
在使第一抗体46和第二抗体47与固相载体1接触后,可以适当地使用清洗液进行固相载体1的清洗。通过清洗固相载体1,能够除去未与外泌体结合的第一抗体46和第二抗体47。清洗液不受到特别限定,可以没有特别限制地使用在免疫化学测定法中通常使用的清洗液。作为清洗液,例如举出pbs、tris缓冲液、hepes缓冲液等缓冲液;在上述缓冲液中添加了tween20等表面活性剂的清洗液;以及纯水等,但并不限定于这些。
[0105]
《工序(iii)》
[0106]
在工序(iii)中,测定被捕获在固相载体上的第一标记物质和第二标记物质。
[0107]
如图1c所示,在工序(ii)后的固相载体1中,第一标记物质41经由第一抗体46和第一外泌体e1被捕获。另外,第二标记物质42经由第二抗体47和第二外泌体e2被捕获。因此,通过测定被固相载体1捕获的第一标记物质41,能够间接地测定第一外泌体e1。另外,因此,通过测定被固相载体1捕获的第二标记物质42,能够间接地测定第二外泌体e2。
[0108]
第一标记物质41和第二标记物质42的测定方法不受到特别限定,可以根据标记物质的种类使用公知的方法。
[0109]
例如,标记物质为酶标记时,添加上述酶标记的显色底物进行显色反应。接着,在显色反应后,可以通过测定反应液的吸光度等来测定检测对象物质。例如,标记物质为荧光标记时,可以通过测定荧光强度来测定标记物质。标记物质为固相载体颗粒时,使用颗粒计数器或显微镜观察等而对捕获于固相载体上的固相载体颗粒的数量进行计数,由此可以测定标记物质。
[0110]
第一标记物质41和第二标记物质42优选为能够通过同种测定方法检测信号的物质。
[0111]
例如,第一标记物质41和第二标记物质42可以分别使用荧光波长不同的荧光标记。此时,根据荧光波长的不同,能够识别第一标记物质41的信号和第二标记物质42的信号。
[0112]
例如,第一标记物质41和第二标记物质42可以分别使用显色底物不同的酶标记。在该情况下,根据显色色调的不同,能够识别第一标记物质41的信号和第二标记物质42的信号。
[0113]
例如,第一标记物质41和第二标记物质42可以分别使用材质不同的固相载体颗粒。在该情况下,根据激光照射的反射光波长的不同,能够识别第一标记物质41的信号和第二标记物质42的信号。
[0114]
在第一标记物质41和第二标记物质42使用相同的标记物质的情况下,也可以准备两个固相载体1,进行上述工序(i)和工序(ii),使第一抗体46与一个固相载体1接触,使第
二抗体47与另一个固相载体1接触。在该情况下,1个固相载体1中仅存在第一标记物质41和第二标记物质42中的任一方,因此能够分别进行测定。
[0115]
工序(a)中的第一外泌体和第二外泌体的测定方法不限于上述方法,可以使用其它公知的免疫化学测定法。例如,在使用荧光标记作为第一标记物质和第二标记物质的情况下,从培养上清液中分离外泌体组分,使第一抗体和第二抗体与所述外泌体组分反应后,使用流式细胞术等来检测第一标记物质和第二标记物质,由此能够测定第一外泌体和第二外泌体。
[0116]
(工序(b))
[0117]
工序(b)是计算第二外泌体相对于第一外泌体的比例的工序。
[0118]
在工序(b)中,根据在工序(a)中得到的第一外泌体的测定值和第二外泌体的测定值,计算第二外泌体相对于第一外泌体的比例(第二外泌体/第一外泌体)即可。
[0119]
(工序(c))
[0120]
工序(c)是将工序(b)中计算出的比例作为指标来判定细胞的状态的工序。
[0121]
第二外泌体相对于第一外泌体的比例反映在培养上清液采集时的细胞的状态。因此,可以将上述比例作为指标,判定在培养上清液采集时的细胞的状态。例如,预先决定与细胞的状态相应的基准范围,将在工序(b)中计算出的比例与所述基准范围进行比较,由此能够判定细胞的状态。更具体而言,关于第二外泌体相对于第一外泌体的比例,也可以分别决定正常状态、稍微异常的状态以及异常状态的基准范围,根据工序(b)中计算出的比例处于哪个状态的基准范围内来判定细胞的状态。
[0122]
表示所述细胞的状态的基准值可以根据细胞的种类、以及第一外泌体膜蛋白质和第二外泌体膜蛋白质的种类来设定。例如,对于与评价对象相同种类的细胞,事先进行多次培养,观察细胞的状态,并且算出第二外泌体相对于第一外泌体的比例。此时的细胞的状态例如可以通过显微镜观察来确认。而且,也可以对每个细胞的状态设定基准范围。
[0123]
另外,也可以以培养开始时为基准,在从培养开始时的比例降低或增加了规定以上的情况下,判定为细胞成为异常状态。例如,可以在将培养开始时的(第二外泌体/第一外泌体)的值设为1时的相对值成为0.9以下、0.8以下、0.7以下、或0.6以下的情况下,判定为细胞为异常状态。或者,可以在将培养开始时的(第二外泌体/第一外泌体)的值设为1时的相对值成为1.1以上、1.2以上、1.3以下、1.4以上、或1.5以上的情况下,判定为细胞为异常状态。
[0124]
在第一外泌体膜蛋白质为cd9、第二外泌体膜蛋白质为cd63的情况下,若成为异常状态,则存在(cd63/cd9)的比例降低的倾向。因此,在(cd63/cd9)的比例为预先决定的正常状态阈值以下的情况下,能够判定为细胞是异常状态。或者,可以在将培养开始时的(cd63/cd9)的值设为1时的相对值成为0.9以下、0.8以下、0.7以下、或0.6以下的情况下,判定为细胞为异常状态。
[0125]
在本实施方式的评价方法中,能够基于培养上清液中的外泌体的组成来评价培养细胞的状态,因此不需要采集培养细胞。因此,不会浪费培养细胞,且不会因采集操作而对培养细胞造成影响。另外,由于能够使用简易的免疫化学测定法来实施,因此能够简易地评价培养细胞的状态。
[0126]
[第二实施方式]
[0127]
在一个实施方式中,本发明提供细胞的状态的评价方法。本实施方式的细胞的状态的评价方法是用于评价细胞的状态的方法,包括:工序(a),在所述细胞的时刻(t1)的培养上清液中,测定具有第一外泌体膜蛋白质的第一外泌体和具有第二外泌体膜蛋白质的第二外泌体;工序(b),计算所述时刻(t1)的所述第二外泌体相对于所述第一外泌体的比例(t1);工序(c),在所述细胞的时刻(t2)的培养上清液中,测定所述第一外泌体和所述第二外泌体;工序(d),计算所述时刻(t2)的所述第二外泌体相对于所述第一外泌体的比例(t2);以及工序(e),基于所述比例(t1)和所述比例(t2)的比较结果,判定细胞的状态。
[0128]
在本实施方式的评价方法中,比较时刻(t1)的培养上清液中的第二外泌体相对于第一外泌体的比例和时刻(t2)的培养上清液中的第二外泌体相对于第一外泌体的比例,并判定细胞的状态。由此,能够经时地评价相同培养体系中的培养细胞的变化。
[0129]
本实施方式的评价方法中使用的细胞、培养基、培养条件等可以使用与上述第一实施方式相同的细胞、培养基、培养条件等。
[0130]
(工序(a)、工序(b))
[0131]
在工序(a)中,在时刻(t1),从细胞的培养液中采集培养上清液,与上述第一实施方式的工序(a)同样地测定第一外泌体和第二外泌体即可。
[0132]
在工序(b)中,根据在工序(a)中得到的第一外泌体的测定值和第二外泌体的测定值,计算出时刻(t1)的所述第二外泌体相对于第一外泌体的比例(t1)即可。
[0133]
(工序(c)、工序(d))
[0134]
在工序(c)中,在时刻(t2),从细胞的培养液中采集培养上清液,与上述第一实施方式的工序(a)同样地测定第一外泌体和第二外泌体即可。
[0135]
在工序(d)中,根据在工序(c)中得到的第一外泌体的测定值和第二外泌体的测定值,计算出时刻(t2)的所述第二外泌体相对于第一外泌体的比例(t2)即可。
[0136]
时刻(t2)是从时刻(t1)经过了任意时间的时刻。
[0137]
(工序(e))
[0138]
在工序(e)中,将在工序(b)中计算出的比例(t1)与在工序(d)中计算出的比例(t2)进行比较,基于该比较结果来判定细胞的状态。更具体而言,能够判定时刻(t2)的细胞的状态与时刻(t1)的培养细胞相比是否变化。
[0139]
例如,在比例(t2)与比例(t1)相比变化了规定范围以上的情况下,能够判定为时刻(t2)的细胞的状态是从时刻(t1)的细胞的状态变化。
[0140]
例如,在比例(t2)的变化与比例(t1)相比在规定范围内的情况下,能够判定为时刻(t2)的细胞的状态未从时刻(t1)的细胞的状态变化。
[0141]
用于判定细胞的状态的变化的、比例(t2)相对于比例(t1)的变化率的基准值可以根据细胞种类、以及第一外泌体膜蛋白质和第二外泌体膜蛋白质的种类来设定。例如,也可以对与评价对象相同种类的细胞事先进行多次培养,在细胞的状态成为异常状态时,确认第二外泌体相对于第一外泌体的比例是处于增加倾向还是处于降低倾向,设定细胞从正常状态成为异常状态时的阈值。
[0142]
例如,当细胞成为异常状态时,在第二外泌体相对于第一外泌体的比例存在增加的倾向的情况下,如果比例(t2)与比例(t1)相比增加,则能够判定为时刻(t2)的细胞的状态与时刻(t1)的细胞相比恶化。相反,如果比例(t2)与比例(t1)相比降低,则能够判定为时
刻(t2)的细胞的状态与时刻(t1)的细胞相比改善。
[0143]
例如,当细胞成为异常状态时,在第二外泌体相对于第一外泌体的比例存在降低的倾向的情况下,如果比例(t2)与比例(t1)相比降低,则能够判定为时刻(t2)的细胞的状态与时刻(t1)的细胞相比恶化。相反,如果比例(t2)与比例(t1)相比增加,则能够判定为时刻(t2)的细胞的状态与时刻(t1)的细胞相比改善。
[0144]
例如,在第一外泌体膜蛋白质为cd9、第二外泌体膜蛋白质为cd63的情况下,若成为异常状态,则比例(cd63/cd9)存在降低的倾向。因此,在时刻(t2)的比例(cd63/cd9)与时刻(t1)的比例(cd63/cd9)相比降低的情况下,能够判定为时刻(t2)的细胞的状态与时刻(t1)的细胞相比恶化。相反,在时刻(t2)的比例(cd63/cd9)与时刻(t1)的比例(cd63/cd9)相比增加的情况下,能够判定为时刻(t2)的细胞的状态与时刻(t1)的细胞相比改善。“比例(cd63/cd9)”表示具有cd63的第二外泌体相对于具有cd9的第一外泌体的比例。
[0145]
根据本实施方式的评价方法,利用免疫化学方法来测定培养上清液中的外泌体组成,由此能够经时地确认培养细胞的状态。在本实施方式的评价方法中,使用培养上清液,不需要采集细胞,因此能够避免细胞采集对培养细胞的影响。
[0146]
《细胞状态的评价试剂盒》
[0147]
在一个实施方式中,本发明提供细胞状态的评价试剂盒。本实施方式的评价试剂盒包括:第一抗体,对第一外泌体膜蛋白质具有特异性结合活性,且结合有第一标记物质;第二抗体,对第二外泌体膜蛋白质具有特异性结合活性,且结合有第二标记物质;以及第三抗体,对第三外泌体膜蛋白质具有特异性结合活性,且固定于固相载体。具有所述第一外泌体膜蛋白质的第一外泌体的至少一部分和具有所述第二外泌体膜蛋白质的第二外泌体的至少一部分具有所述第三外泌体膜蛋白质。
[0148]
本实施方式的细胞状态的评价试剂盒可以用于实施上述实施方式的细胞的状态的评价方法。
[0149]
(第一抗体)
[0150]
第一抗体是对第一外泌体膜蛋白质具有特异性结合活性,且结合有第一标记物质的抗体。第一抗体可以使用与所述实施方式的细胞的评价方法中记载的相同抗体。第一抗体优选为对cd9具有特异性结合活性的抗体。作为第一标记物质,优选固相载体颗粒。
[0151]
(第二抗体)
[0152]
第二抗体是对第二外泌体膜蛋白质具有特异性结合活性,且结合有第二标记物质的抗体。第二抗体可以使用与所述实施方式的细胞的评价方法中记载的相同抗体。第二抗体优选为对cd63具有特异性结合活性的抗体。作为第二标记物质,优选固相载体颗粒。第二标记物质优选与第一标记物质不同。
[0153]
(第三抗体)
[0154]
第三抗体是对第三外泌体膜蛋白质具有特异性结合活性,且固定于固相载体的抗体。第三抗体可以使用与所述实施方式的细胞的评价方法中记载的相同抗体。第三抗体优选为对cd81具有特异性结合活性的抗体。作为固相载体,可以使用与所述实施方式的细胞的评价方法中记载的固相载体同样的固相载体。固相载体优选为能够在具备光拾取器的外泌体计数器中使用的固相载体。
[0155]
(任意构成)
[0156]
除了上述构成以外,本实施方式的测定试剂盒还可以包含任意的构成。作为任意的结构,例如举出用于处理试样的试剂(例如稀释液等)、清洗液、封闭液、缓冲液等各种试剂类、以及使用说明书等。
[0157]
本实施方式的细胞的状态的评价试剂盒优选使用能够在具备光拾取器的外泌体计数器中使用的试剂盒。“外泌体计数器”是指通过检测与外泌体直接或间接结合的标记物质的信号,能够对外泌体进行计数的装置。作为市售的外泌体计数器,例如可以使用exocounter(注册商标)(jvc建伍)等。以下,示出能够在外泌体计数器中使用的固相载体和标记物质的具体例,但并不限定于这些。
[0158]
《固相载体的具体例》
[0159]
图2a是包含固相载体的外泌体捕获单元50的示意性俯视图。图2b是图2a的a-a切线处的示意性剖视图。图2c是用于说明盒52相对于基板51为可拆装的示意性剖视图。图3a是图2a的b-b切线处的局部放大立体图。
[0160]
如图2a所示,外泌体捕获单元50构成为具有基板51和盒52。
[0161]
基板51例如具有与蓝光光盘(bd)、dvd(digital video disc,数字影碟光盘)、光盘(cd)等光盘同等的圆板形状。基板51例如由通常用于光盘的聚碳酸酯树脂、环烯烃聚合物等树脂材料形成。
[0162]
如图3a所示,在基板51的表面上形成有凸部3和凹部2在半径方向上交替配置的轨道区域55。凸部3和凹部2从内周部朝向外周部形成为螺旋状。凸部3相当于光盘的平台。凹部2相当于光盘的凹槽。
[0163]
基板51相当于图1a的固相载体1,形成于基板51上的凸部3和凹部2分别相当于图1a的凸部3和凹部2。对于在基板51中形成有凹部2和凸部3的轨道区域55,至少在凹部2固定有第三抗体10。
[0164]
如图2a所示,盒52具有环形状。在盒52上沿周向形成有多个圆筒状的贯通孔56。
[0165]
如图2b和图3a所示,外泌体捕获单元50具有由盒52的贯通孔56和基板51的轨道区域55形成的多个孔57。即,贯通孔56的内周面构成孔57的内周面,基板51的轨道区域55构成孔57的底面。孔57是用于储存试样液等的容器。另外,若在贯通孔56与基板51之间放入由硅橡胶等弹性变形的材料制作的衬垫,则能够降低溶液泄漏的可能性,是非常有益的。
[0166]
如图2c所示,盒52相对于基板51可拆装。关于外泌体捕获后的外泌体的检测,从基板51拆卸盒52,以基板51单独进行。
[0167]
在外泌体捕获单元50中,所述工序(i)中的培养上清液与固定于轨道区域55的第三抗体10的接触可以通过将培养上清液投入孔57来进行。另外,在所述工序(ii)中,第一抗体46和第二抗体47与结合于第三抗体10的外泌体(e1、e2)的反应可以通过将包含第一抗体46和第二抗体47的溶液投入孔57来进行。另外,在进行清洗处理、封闭处理等的情况下,也能够通过向孔57投入清洗液、封闭液等来进行。优选的是,在将各处理用的溶液投入孔57之前,从孔57中除去之前的处理中使用的溶液。
[0168]
《固相载体颗粒的具体例》
[0169]
作为固相载体颗粒,例如举出聚苯乙烯、甲基丙烯酸缩水甘油酯等树脂颗粒;以及磁珠等。如图1c所示,在相同的反应体系中使用与第一抗体46结合的第一标记物质41和与第二抗体47结合的第二标记物质42的情况下,优选的是,作为第一标记物质41的固相载体
颗粒和作为第二标记物质42的固相载体颗粒由彼此不同的材质构成。作为这样的固相载体颗粒的材质的组合,例如可举出树脂珠与金属珠的组合。金属珠的材质最优选为金或银,但不限于此。固相载体颗粒的粒径例如优选为1000nm以下,更优选为1~500nm,进一步优选为10~300nm,特别优选为10~200nm。磁性颗粒优选为具有纳米尺寸(1~1000nm)粒径的纳米颗粒。
[0170]
接着,对形成于外泌体捕获单元50的基板51上的凹部2和凸部3的尺寸、固相载体颗粒的尺寸以及外泌体的平均粒径间的关系进行说明。
[0171]
图3b是用于说明形成于基板51的轨道区域55的凹部2和凸部3的尺寸形状的放大剖视图。将凹部2的深度(凸部3的高度)设为h,将凹部2的宽度设为wa,将凸部3的宽度设为wb。宽度wa、宽度wb是虚线所示的h/2位置处的宽度。
[0172]
关于凸部3的宽度wb,优选的是,如下述式(1)所示,小于外泌体的平均粒径ra。通过满足下述式(1),外泌体难以位于凸部3上。
[0173]
wb《ra
ꢀꢀ…
(1)
[0174]
关于凹部2的宽度wa,优选的是,如下述式(2)所示,大于外泌体的平均粒径ra且小于平均粒径ra的4倍值。通过满足下述式(2),容易将外泌体捕获于凹部2。
[0175]
ra《wa《4
×
ra
ꢀꢀ…
(2)
[0176]
捕获于凹部2的外泌体一般是球形因此向扩大接触面积的方向变形。若假设球形的外泌体保持体积而变形为椭圆体,则在球的直径变化50%的情况下,作为旋转椭圆体的长轴的与凹部2的接触部位的直径增大约40%。进而,实际上,由于向接触部位的面积与旋转椭圆体形状相比变大的方向变形,因此接触部位的直径有时增大原来球形时的直径的50%以上,根据情况也存在增大100%以上的情况。因此,优选满足上述式(2)的wa<4
×
ra。
[0177]
凹部2的宽度wa、凸部3的宽度wb和固相载体颗粒的粒径rc优选满足下述式(3)。
[0178]
wb《rc《wa《2
×
rc
ꢀꢀ…
(3)
[0179]
通过满足上述式(3)的wb<rc,固相载体颗粒难以位于凸部3上。通过满足上述式(3)的rc<wa,固相载体颗粒变得容易进入凹部2。通过满足式(3)的wa<2
×
rc,固相载体颗粒难以在凹部2的宽度方向上同时进入2个以上,能够使外泌体与固相载体颗粒的数量关系接近1比1。
[0180]
如下述式(4)所示,固相载体颗粒的粒径rc优选大于外泌体的平均粒径ra。
[0181]
ra《rc
ꢀꢀ…
(4)
[0182]
通过满足上述式(4),多个固相载体颗粒难以与固定于凹部2的外泌体结合,能够使外泌体与固相载体颗粒的数量关系接近1比1。通过满足式(4),外泌体与固相载体颗粒反应性相遇的概率变高,结果能够提高反应的收率。
[0183]
如下述式(5)所示,凹部2的深度h优选大于外泌体的平均粒径ra与固相载体颗粒的粒径rc的相加值的1/8倍值。
[0184]
(ra+rc)/8《h
ꢀꢀ…
(5)
[0185]
通过满足上述式(5),外泌体容易捕获于凹部2。另外,难以引起固相载体颗粒向凸部3的非特异性吸附,固相载体颗粒容易与捕获于凹部2的外泌体结合。
[0186]
凹部2的深度h进一步优选满足式(6)。
[0187]
(ra+rc)/6《h
ꢀꢀ…
(6)
[0188]
凹部2、凸部3和固相载体颗粒优选满足上述式(1)~(5)(或式(6))的全部,但也可以仅部分地满足。
[0189]
具备光拾取器的外泌体计数器对捕获于基板51的固相载体颗粒照射激光,并对其反射光进行分析,由此能够对捕获于基板51的固相载体颗粒的数量进行计数。更具体而言,光拾取器对基板51照射激光,接收来自基板51的反射光。光拾取器检测反射光的受光电平而生成受光电平信号js,并向具备cpu(central processing unit,中央处理器)等的控制部输出。在控制部中,从由光拾取器输出的受光电平信号js中提取固相载体颗粒检测信号ks并进行计数,由此检测捕获于基板51的固相载体颗粒并进行计数。作为具备这样的机构的外泌体计数器,例如举出日本特开2017-207289号公报中记载的分析装置。
[0190]
实施例
[0191]
以下,通过实施例对本发明进行说明,但本发明并不限定于以下的实施例。
[0192]
《细胞株》
[0193]
使用以下的细胞株。
[0194]
结肠癌细胞株:hct116
[0195]
乳腺癌细胞株:skbr3
[0196]
间充质干细胞:hadsc脂肪来源干细胞
[0197]
《培养基》
[0198]
细胞的培养使用以下培养基。
[0199]
结肠癌细胞株:mc’coy5a培养基+10%胎牛血清
[0200]
乳腺癌细胞株:mc’coy5a培养基+10%胎牛血清
[0201]
间充质干细胞:干细胞用无血清培养基
[0202]
《培养》
[0203]
在10ml的培养基中接种约1
×
106个细胞,在37℃、5%co2存在下培养至达到汇合状态。从汇合状态起24小时后、48小时后和72小时后,分别采集50μl的培养上清液,计数cd63阳性外泌体和cd9阳性外泌体。另外,进行细胞的显微镜观察,以培养开始时的细胞形态为基准,基于以下判定基准判定细胞的状态。
[0204]
《细胞状态的判定基准》
[0205]
正常:从培养开始时起细胞形态没有变化。
[0206]
稍微异常:存在从培养开始时起细胞形态发生变化的细胞。
[0207]
异常:从培养开始时起细胞形态发生变化的细胞大量存在。
[0208]
《外泌体的计数方法》
[0209]
(cd81抗体的向固相载体的固定)
[0210]
cd81抗体使用的是外泌体单克隆抗体anti cd81(科斯莫生物(cosmo bio)公司制造)。作为固相载体,使用了设置在附属于exocounter(jvc建伍株式会社)的盒中的孔。
[0211]
将cd81抗体以成为5μg/ml的方式溶解于磷酸缓冲食盐水,将70μl注入至盘的孔中。在37℃下孵育30分钟,通过疏水吸附将cd81抗体固定于孔中。孵育后,用缓冲液清洗孔。
[0212]
(抗体结合纳米颗粒的制备)
[0213]
在cd63阳性外泌体的检测中,作为cd63抗体而使用外泌体单克隆抗体anti cd63(科斯莫生物公司制造)。在cd9阳性外泌体的检测中,作为cd9抗体而使用外泌体单克隆抗
体anti cd9(科斯莫生物公司制造)。
[0214]
在fg珠(cooh珠;多摩川精机)中添加含有400mm的1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc
·
hcl)和n-羟基琥珀酰亚胺的pbs(ph7.4),在室温下反应4小时。反应后,使用50mm的乙酸缓冲液(ph5.2)来清洗珠。接着,在珠中添加1.0g/l的含有cd9抗体或cd63抗体的乙酸缓冲液(ph5.2),在4℃下反应一晚,将cd9抗体或cd63抗体固定于珠上。接着,在珠中添加0.1m的含有乙醇胺的pbs(ph7.4),在4℃下反应5小时,掩蔽未反应的羧基。使用含有150mm的kcl、5mm的edta和0.1%的tween20的hepes缓冲液(10mm的hepes,ph7.9)来清洗珠,在4℃下保存至使用。使用这些珠作为cd63抗体结合纳米颗粒和cd9抗体结合纳米颗粒。
[0215]
(外泌体的计数)
[0216]
在固定有cd81抗体的孔中注入50μl培养上清液,在37℃下孵育2小时。孵育后,用缓冲液清洗孔。通过该操作,培养上清液中的cd81阳性外泌体被捕获到孔上。
[0217]
接着,在孔中注入cd63抗体结合纳米颗粒或cd9抗体结合纳米颗粒,在37℃下孵育1.5小时。孵育后,清洗孔,使孔内干燥。接着,从盒中分离孔,使用exocounter来测定试样分析用盘,计数与盘表面结合的纳米颗粒的个数。
[0218]
《结果》
[0219]
根据用各培养时间时的培养上清液计数的cd9阳性外泌体数和cd63阳性外泌体数,计算cd63阳性外泌体数相对于cd9阳性外泌体数的比例(cd63阳性外泌体数/cd9阳性外泌体数)。将其结果示于图4。
[0220]
如图4所示,在结肠癌细胞、乳腺癌细胞和间充质干细胞的任一个中,若细胞的状态为异常,则(cd63阳性外泌体数/cd9阳性外泌体数)的比例减少。根据该结果,确认了(cd63阳性外泌体数/cd9阳性外泌体数)的比例成为细胞的状态的指标。
[0221]
工业应用性
[0222]
根据本发明,提供一种能够使用细胞的培养上清液来简易地评价细胞的状态的细胞的状态的评价方法及评价试剂盒。
[0223]
以上,对本发明优选的实施方式进行了说明以及图示,但应该理解为这些是例示本发明的实施方式,不应视为限定性的实施方式。在不脱离本发明的精神或范围的情况下,能够进行追加、省略、替换以及其它变更。因此,本发明不被视为由上述说明所限定,而仅由所附的权利要求书所限定。
[0224]
符号说明
[0225]
1:固相载体;
[0226]
2:凹部;
[0227]
3:凸部;
[0228]
10:第三抗体;
[0229]
21:第一外泌体膜蛋白质;
[0230]
22:第二外泌体膜蛋白质;
[0231]
31:第三外泌体膜蛋白质;
[0232]
41:第一标记物质;
[0233]
42:第二标记物质;
[0234]
46:第一抗体;
[0235]
47:第二抗体;
[0236]
50:外泌体捕获单元;
[0237]
51:基板;
[0238]
52:盒;
[0239]
55:轨道区域;
[0240]
56:贯通孔;
[0241]
57:孔。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1