检测加入样本量是否异常的试剂及方法与流程
1.本发明涉及血液检测技术领域,尤其涉及检测加入样本量是否异常的试剂及方法。
背景技术:
2.在体外诊断涉及血液或尿液检测的生化检测、免疫测定及其他领域,全自动、半自动及手动测试过程中由于自动化仪器的加样模块偶发故障或人为操作失误会出现加入样本量异常(低于或高于目标样本量),会导致报告错误的测试结果,造成临床上的误诊,最终对病患可能造成严重的后果。
3.对于生化检测及免疫测定领域,加入样本量异常目前尚未见系统性解决方案,多依赖于检验医生或临床医生的经验做判断。
4.人体血液样本中均含有人血白蛋白成分,且其含量波动范围较小(比如正常人血清/血浆中含量通常在35g/l~55g/l,更可能的含量范围为40g/l-50g/l,如超出此范围即会表现出极明显的临床指征,但目前未见以白蛋白作为检测标志物,判断样品加样量是否异常的方法。
技术实现要素:
5.有鉴于此,本发明要解决的技术问题在于提供检测加入样本量是否异常的试剂及方法,通过荧光信号判断检测过程中加样量是否异常。
6.以白蛋白为标志物,在制备检测加入样本量是否异常的试剂中的应用。
7.本发明所述样本为进行生化检测或免疫检测的样本。具体为荧光分析法或紫外-可见分光光度法检测的样本。本发明中,所述样本为全血、血浆、血清或尿液,所述加入样本是否异常是指在生化检测或免疫检测中样本的加入量是否高于或低于目标样本量。
8.人体血液样本或者尿液样本中均含有人血白蛋白成分,且其含量波动范围较小。例如,正常人血清/血浆中含量通常在35g/l~55g/l,更可能的含量范围为40g/l~50g/l。超出该范围时,患者往往具有较明显的症状且可能处于高风险状态,因此,对于检测后发现白蛋白含量极端异常的情况,应提醒检测者对该样本的白蛋白含量进行复核以排除风险。
9.本发明中,所述以白蛋白为标志物是指以样本中存在的人血白蛋白为标志物进行检测。在检测中,在反应试剂中加入能够与白蛋白发生反应并产生荧光或发生颜色反应的物质,就能够根据白蛋白的量判断样本的加入量与目标样本量之间是否存在差异。
10.本发明中,所述能够与白蛋白发生反应并产生荧光或发生颜色反应的物质包括白蛋白蓝。具体包括:白蛋白蓝580、白蛋白蓝670或白蛋白蓝633。在一些具体实施例中,使用的白蛋白蓝为白蛋白蓝580,其cas no.为192140-46-8。
11.在本发明实施例中,本发明依据人血白蛋白原料与白蛋白蓝反应,在580nm波长光激发下,发出波长为616nm的光,根据检测到的616nm光强度不同可实现血液中人血白蛋白的定量,从而达到其内参照的目的。因此,在检测试剂中加入白蛋白蓝,如果定量结果超出
正常血液中白蛋白可能的含量,则说明样品加入量异常。
12.本发明中,所述含白蛋白样品为全血、血浆、血清或尿液;所述检测试剂为生化检测试剂或免疫检测试剂。
13.本发明中,基于白蛋白与白蛋白蓝的荧光反应对待测样品中的人血白蛋白进行检测。因此,本发明所述的检测试剂可应用于除检测波长为616nm的荧光波长外的其他任何方法的检测试剂。本发明的一些实施例中,所述检测试剂为紫外-可见分光光度法法的检测试剂。所述检测的靶标为适用于紫外-可见分光光度法法检测的任意靶标。
14.本发明提供了一种检测加入样本量是否异常的方法,其包括:
15.将含有染料的检测试剂混合后,检测荧光强度f0;
16.加入含白蛋白的样品,孵育后,检测荧光强度f2;
17.所述染料为能够与白蛋白发生染色反应的物质;
18.f2/f0比值在预设值范围内则判断为加入样本量正常,f2/f0比值不在预设值范围内则判断为加入样本量异常。
19.本发明还提供了一种含白蛋白样品的检测方法,其包括:
20.将含有染料的检测试剂混合后,检测荧光强度f0和吸光度a0;
21.加入含白蛋白的样品,孵育后,检测吸光度a1,继续孵育后,检测荧光强度f2和吸光度a2;
22.所述染料为能够与白蛋白发生染色反应的物质;
23.f2/f0比值在预设值范围内则判断为加入样本量正常,根据吸光度变化计算待测靶标的浓度;
24.f2/f0比值不在预设值范围内则判断为加入样本量异常,需重新检测。
25.本发明中,所述预设值范围为(x
×
下浮指数)~(x
×
上浮指数)。
26.本发明中,所述x为标准加样条件下测得的f2/f0比值。所述标准加样条件是指确定加样量无误的条件。x为多次标准加样后测得的平均值。
27.本发明中,所述下浮指数为80%~99%,所述上浮指数为101%~120%。实施例中,所述下浮指数为85%~97%,所述上浮指数为103%~115%。一些实施例中,所述下浮指数为90%~95%,所述上浮指数为105%~110%。一些具体实施例中,所述下浮指数为90%、91%、92%、93%、94%或95%。一些具体实施例中,所述上浮指数为105%、106%、107%、108%、109%、110%。,本发明中,所述上浮指数和下浮指数可以根据不同检测的需要进行调整。本发明对此不做限定,在本发明实施例中,以x值
±
5%为可接受误差范围进行方法学验证,即上浮指数为105%,下浮指数为95%。
28.本发明中,所述染料为能够与白蛋白发生反应并产生荧光或发生颜色反应的物质,一些实施例中,所述染料包括白蛋白蓝。具体的所述染料包括:白蛋白蓝580、白蛋白蓝670或白蛋白蓝633。在一些具体实施例中,使用的白蛋白蓝为白蛋白蓝580,其cas no.为192140-46-8。
29.本发明所述方法中所述的检测试剂为包括生化比色检测法的检测试剂或免疫比浊法检测的试剂,其试剂数量多为2个,也可根据实际需要包括多种其他试剂。例如,除r1、r2试剂外,还包括1种、2种、3种、4种、5种、6种、7种、8种、9种或10种试剂。所述试剂为反应所需的缓冲液、金属离子溶液、盐离子溶液、包被抗原或抗体微球的悬液、保护剂溶液、酶溶
液、表面活性剂溶液等。
30.以两个试剂为例,所述的检测试剂中,包括r1试剂和r2试剂;
31.所述r1试剂包括缓冲液a;
32.所述r2试剂中包括待测靶标检测试剂、缓冲液b和白蛋白蓝。
33.本发明所述r1试剂(实施例中记做reagent 1)中含有实现人血白蛋白浓度判定试剂反应所需以及待测靶标检测试剂反应所需的缓冲液。
34.本发明所述r2试剂(实施例中记做reagent 2)中含有染料以及待测靶标检测试剂的必需反应组分。
35.一些具体实施例中,在所述r2试剂中,所述白蛋白蓝的质量分数为0.05%~4%。
36.本发明中,所述缓冲液a和缓冲液b独立的选自4-羟乙基哌嗪乙磺酸缓冲液、吗啉乙磺酸缓冲液、磷酸盐缓冲液、焦磷酸缓冲液、3-(n-吗啉代)丙磺酸缓冲液、1,4-哌嗪二乙磺酸缓冲液。
37.本发明中,所述r1试剂中还包括钾盐、钠盐、氰基化合物或表面活性剂中至少一种或两者以上的组合。
38.本发明所述待测靶标检测试剂为包被有待测靶标抗体的颗粒或者为与待测靶标反应后吸光度发生变化的物质。
39.在试剂数量为2时,本发明所述的方法在将r1和r2混合后,检测荧光强度f0和吸光度a0;加入含白蛋白的样品,孵育后,检测吸光度a1,继续孵育后,检测荧光强度f2和吸光度a2。
40.在试剂数量为3时,本发明所述的方法在将r1~3混合后,检测荧光强度f0和吸光度a0;加入含白蛋白的样品,孵育后,检测吸光度a1,继续孵育后,检测荧光强度f2和吸光度a2。
41.在试剂数量为4时,本发明所述的方法在将r1~4混合后,检测荧光强度f0和吸光度a0;加入含白蛋白的样品,孵育后,检测吸光度a1,继续孵育后,检测荧光强度f2和吸光度a2。
42.依次类推,在添加多个试剂的情况下,每次添加完所有试剂都对吸光度和荧光强度进行检测,再加入样品,孵育后检测a1,继续孵育后检测f2和a2,并与预设值范围进行比较,判断加样量是否异常。
43.在本发明实施例中,以c反应蛋白、总胆红素或胆碱酯酶为待测靶标作为案例,对本发明的方案做进一步阐述。
44.通过本发明实施例可以确定本发明所述的试剂可以为胶乳免疫比浊检测法的检测试剂,除c反应蛋白外的检测外,该试剂可应用于其他任何能够通过胶乳免疫比浊法检测的待测物。在对c反应蛋白检测的方案中,实验表明,缓冲液的种类、盐离子的选择和浓度都会对结果产生一定影响,但以该实施例中记载的参数能够实现对目标物的更准确的检测。
45.所述c反应蛋白的检测中:
46.r1试剂为含有nacl的4-羟乙基哌嗪乙磺酸缓冲液。其中4-羟乙基哌嗪乙磺酸缓冲液的浓度为50mm~500mm,nacl的浓度为150mm~500mm。
47.r2试剂为含有白蛋白蓝、c反应蛋白抗体包被胶乳的4-羟乙基哌嗪乙磺酸缓冲液。其中,4-羟乙基哌嗪乙磺酸缓冲液的浓度为50mm~500mm,白蛋白蓝的质量分数为0.05%~
2%,c反应蛋白抗体包被胶乳的质量分数为0.1%~0.5%。
48.通过本发明实施例可以确定本发明所述的试剂可以为生化比色检测法的检测试剂,除总胆红素或胆碱酯酶的检测外,该试剂可应用于其他任何能够通过生化比色法检测的待测物。在对总胆红素或胆碱酯酶检测的方案中,实验表明,缓冲液的种类、盐离子的选择和浓度都会对结果产生一定影响,但以该实施例中记载的参数能够实现对目标物的更准确的检测。
49.所述总胆红素的检测中:
50.r1试剂为含有kcl和吐温的吗啉乙磺酸缓冲液。其中,吗啉乙磺酸缓冲液的浓度为50mm~250mm,kcl的浓度为150mm~500mm,吐温为吐温20,其浓度为0.05%~0.2%(w/v)。
51.r2试剂为含有白蛋白蓝和偏钒酸钠的磷酸盐缓冲液。其中,磷酸盐缓冲液的浓度为50mm~500mm,白蛋白蓝的质量分数为0.1%~4%,偏钒酸钠的浓度为1mm~10mm。
52.所述胆碱酯酶的检测中:
53.r1试剂为含有6-氰基高铁酸盐的焦磷酸缓冲液。其中,焦磷酸缓冲液的浓度为50mm~250mm,6-氰基高铁酸盐的浓度为150mm~500mm。
54.r2试剂为含有白蛋白蓝和丁酰硫代胆碱的焦磷酸缓冲液。其中,焦磷酸缓冲液的浓度为50mm~500mm,白蛋白蓝的质量分数为0.1%~4%,偏钒酸钠的浓度为5mm~25mm。
55.本发明还提供了一种含白蛋白样品的加样异常的检测方法,其包括:
56.将本发明所述的检测试剂中r1试剂与r2试剂混合,检测荧光强度f0;
57.加入含白蛋白的样品,孵育3min~5.5min后,检测荧光强度f2;
58.以标准加样条件下测得的f2/f0比值为x,检测条件下测得f2/f0比值为x
×
(80%~120%)判断为正常,检测条件下测得f2/f0比值<80%x或>120%x判断为异常。
59.本发明中,所述标准加样条件是指确定加样量无误的条件。x值为多次标准加样后测得的平均值。
60.本发明还提供了一种含白蛋白样品的检测方法,其包括:
61.将本发明所述的检测试剂中r1试剂与r2试剂混合,检测荧光强度f0和吸光度a0;
62.加入含白蛋白的样品,孵育5s~30s后检测吸光度a1;
63.继续孵育3min~5min,检测荧光强度f2和吸光度a2;
64.以标准加样条件下测得的f2/f0比值为x:
65.检测条件下测得f2/f0比值为x
×
(80%~120%)判断为正常,根据吸光度变化计算待测靶标的浓度;
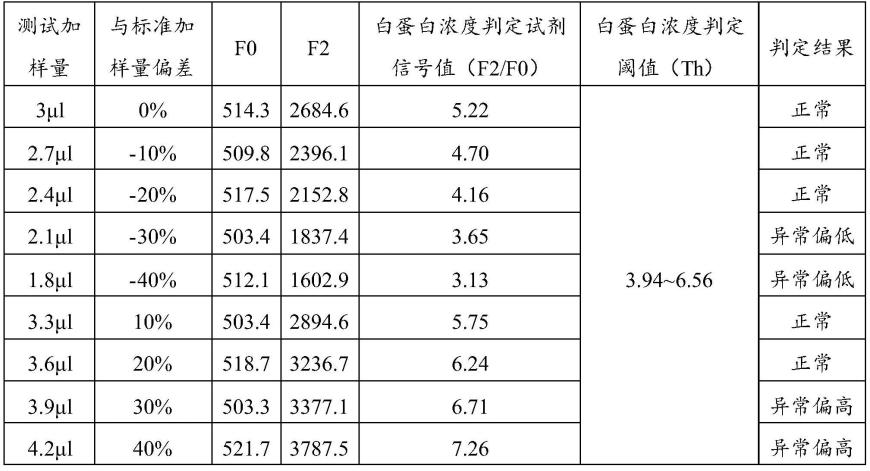
66.检测条件下测得f2/f0比值<80%x或>120%x判断为异常,需重新检测。
67.在本发明中,所述含白蛋白样品为全血、血浆、血清或尿液;所述待测靶标为总胆红素、c反应蛋白、胆碱酯酶、β2-微球蛋白、胱抑素c、血清淀粉样蛋白a。
68.本发明中以人血清样本为例,其在检测中的加样量为3~20μl。
69.标准加样量为3μl,测得f2/f0比值为4.16~6.24判断为样本加样正常,测得f2/f0比值<4.16或测得f2/f0比值>6.24判断为样本加样异常。
70.标准加样量为10μl,测得f2/f0比值为14.11~21.05判断为样本加样正常,测得f2/f0比值<14.11或测得f2/f0比值>21.05判断为样本加样异常。
71.标准加样量为5μl,测得f2/f0比值为7.08~10.55判断为样本加样正常,测得f2/
f0比值<7.08或测得f2/f0比值>10.55判断为样本加样异常。
72.以白蛋白为标志物,在制备检测加入样本量是否异常的试剂中的应用,基于白蛋白与白蛋白蓝的荧光反应对待测样品中的人血白蛋白进行检测,针对不同项目加样量设定合理的发射荧光接受范围,超过该接受范围则判定测试过程中加样量异常,提示该次测试结果无效需进行复测或提示需要复核白蛋白浓度。实验表明,本发明提供的方法准确可靠,能够有效降低检测时误报结果的风险。
具体实施方式
73.本发明提供了检测加入样本量是否异常的试剂及方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
74.本发明采用的试材皆为普通市售品,皆可于市场购得。
75.下面结合实施例,进一步阐述本发明:
76.实施例1
77.①
待测靶标项目:c反应蛋白;
78.②
实验材料:待测样本为新鲜人血清样本;
79.③
reagent1:4-羟乙基哌嗪乙磺酸缓冲液50mm~500mm;nacl150mm~500mm;
80.④
reagent2:4-羟乙基哌嗪乙磺酸缓冲液50mm~500mm;白蛋白蓝0.05%~2%;c反应蛋白抗体包被胶乳0.1%~0.5%;
81.⑤
白蛋白浓度判定试剂阈值:3.94~6.56;
82.⑥
检测过程:试剂/样本针将150μl reagent 1转移至反应腔中,然后试剂/样本针将150μl reagent 2转移至前述反应腔中并混合均匀,启动荧光光源照射读取荧光强度f0,同时启动紫外光源读取a0。试剂/样本针将3μl待测血清样本转移至前述反应杯/腔中并混合均匀,孵育5~30秒,启动紫外光源读取a1。继续孵育3~5分钟,启动荧光光源读取荧光强度f2,同时启动紫外光源读取a2。根据公式f2/f0计算待测样本荧光强度,将测试得到的荧光强度与白蛋白浓度判定试剂阈值比较,高于4.55提示样本量异常偏高,低于2.45提示样本量异常偏低。按公式δab=a2-a1计算c反应蛋白检测信号,代入内置校准曲线,获得该样本c反应蛋白浓度。
83.实施例1测量结果:
[0084][0085]
另对检测的准确性进行验证:
[0086][0087]
注:参考品参考值为标准方法(未引入本方案中白蛋白蓝的方法)所赋值。
[0088]
结果表明,该方法能够准确判断c反应蛋白检测过程中样品加入量是否过高或过低,且同时,对检测结果的准确性不产生干扰。
[0089]
实施例2
[0090]
①
待测靶标项目:总胆红素;
[0091]
②
实验材料:待测样本为新鲜人血清样本;
[0092]
③
reagent1:吗啉乙磺酸缓冲液50mm~250mm;kcl 150mm~500mm;吐温20 0.05%~0.2%(w/v);
[0093]
④
reagent2:磷酸盐缓冲液50mm~500mm;白蛋白蓝0.1%~4%;偏钒酸钠1mm~10mm;
[0094]
⑤
白蛋白浓度判定试剂阈值:13.22~21.93
[0095]
⑥
检测过程:试剂/样本针将240μl reagent 1转移至反应腔中,然后试剂/样本针将60μl reagent 2转移至前述反应腔中并混合均匀,启动荧光光源照射读取荧光强度fo,同时启动紫外光源读取a0。试剂/样本针将10μl待测血清样本转移至前述反应杯/腔中并混合均匀,孵育5~30秒,启动紫外光源读取a1。继续孵育3~5分钟,启动荧光光源读取荧光强度f2,同时启动紫外光源读取a2。根据公式f2/f0计算待测样本荧光强度,将测试得到的荧光强度与白蛋白浓度判定试剂阈值比较,高于4.55提示样本量异常偏高,低于2.45提示样本量异常偏低。按公式δac=a2-a0计算总胆红素检测信号,代入内置校准曲线,获得该样本总胆红素浓度。
[0096]
实施例2测量结果:
[0097][0098]
另对检测的准确性进行验证:
[0099][0100]
注:参考品参考值为标准方法(未引入本方案中白蛋白蓝的方法)所赋值。
[0101]
结果表明,该方法能够准确判断总胆红素检测过程中样品加入量是否过高或过低,且同时,对检测结果的准确性不产生干扰。
[0102]
实施例3
[0103]
①
待测靶标项目:胆碱酯酶;
[0104]
②
实验材料:待测样本为新鲜人血清样本;
[0105]
③
reagent1:焦磷酸缓冲液50mm~250mm;6-氰基高铁酸盐0.5mm~5mm;
[0106]
④
reagent2:焦磷酸缓冲液50mm~500mm;白蛋白蓝0.1%~4%;丁酰硫代胆碱5mm~25mm;
[0107]
⑤
白蛋白浓度判定试剂阈值:6.21~11.40;
[0108]
⑥
检测过程:试剂/样本针将240μl reagent 1转移至反应腔中,然后试剂/样本针将60μl reagent 2转移至前述反应腔中并混合均匀,启动荧光光源照射读取荧光强度fo,同时启动紫外光源读取a0。试剂/样本针将5μl待测血清样本转移至前述反应杯/腔中并混合均匀,孵育5~30秒,启动紫外光源读取a1。继续孵育3~5分钟,启动荧光光源读取荧光强度f2,同时启动紫外光源读取a2。根据公式f2/f0计算待测样本荧光强度,将测试得到的荧光强度与白蛋白浓度判定试剂阈值比较,高于11.4提示样本量异常偏高,低于6.2提示样本量异常偏低。按公式δa/min=(a2-a1)/t计算胆碱酯酶检测信号,代入内置校准曲线,获得该样本胆碱酯酶含量。
[0109]
实施例3测量结果:
[0110][0111]
另对检测的准确性进行验证:
[0112][0113]
注:参考品参考值为标准方法(未引入本方案中白蛋白蓝的方法)所赋值。
[0114]
结果表明,该方法能够准确判断胆碱酯酶检测过程中样品加入量是否过高或过低,且同时,对检测结果的准确性不产生干扰。
[0115]
由上述结果可见,本发明所述方法在多种不同类型项目中均表现出预期效果,在加样量明显异常偏高或偏低时能准确识别,有效降低检测时误报结果的风险。
[0116]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1