一种水果中氯氟氰虫酰胺的超高效液相色谱串联质谱分析方法
1.本发明属于农药检测领域,具体涉及一种水果中氯氟氰虫酰胺的超高效液相色谱串联质谱分析方法。
背景技术:
2.氯氟氰虫酰胺属于邻苯二甲酰胺类杀虫剂,是由浙江化工研究院有限公司自主研发的新型杀虫剂,作用机理是通过激活昆虫肌肉细胞中的鱼尼丁受体,引起细胞内钙库中的钙离子无限制地释放,致使昆虫肌肉产生松弛性麻痹、瘫痪,从而停止取食,最终导致死亡。氯氟氰虫酰胺主要应用于作物上的二化螟、棉铃虫、小菜蛾、稻纵卷叶蛾等鳞翅目害虫的防治,具有高效、杀虫谱广等特点。氯氟氰虫酰胺对大鼠的急性经口ld
50
值>5000mg/kg,急性经皮ld
50
值>2000mg/kg;对家兔皮肤、眼睛无刺激性;由此表明表明氯氟氰虫酰胺对动物属低毒,但有关其对鱼、蜜蜂、家蚕等的毒性数据暂无。近年来,人们越来越关注由于杀虫剂的过度使用所引起的食品安全问题与生态环境风险,农药残留和食品安全问题在国际社会也受到广泛关注,尤其是水果等以鲜食为主的食品中化学农药的检测浓度越来越低,因此需要更高效和灵敏的分析方法快速测定其中化学农药的含量,为准确评价农药在水果中的残留水平提供方法支撑。目前有关氯氟氰虫酰胺的分析方法报道较少,主要涉及水稻、环境水、土壤等基质中的含量分析,暂未见水果中的报道;净化方式采用传统层析柱和简单的psa分散吸附剂净化,缺乏氯氟氰虫酰胺在不同基质中的提取、净化参数的系统性对比评价。
技术实现要素:
3.本发明所要解决的技术问题是提供一种水果中氯氟氰虫酰胺的超高效液相色谱串联质谱分析方法,该方法能够对水果中氯氟氰虫酰胺进行检测,满足农药残留分析中对准确度、精密度和灵敏度的要求。
4.本发明的水果中氯氟氰虫酰胺的超高效液相色谱串联质谱分析方法,包括以下步骤:
5.a、样品前处理
6.(1)提取
7.每水果样品5.0g加入10ml乙腈,涡旋混匀,加入4g无水硫酸镁、1g氯化钠,涡旋后离心,收取提取液;
8.(2)净化
9.每提取液2ml,加入5ml正己烷,摇动后静置,弃去上层净化液,下层乙腈相加入装有100mg psa、100mg c
18
、10mg多壁碳纳米管、10mg gcb混合分散吸附剂的离心管中净化,振荡后涡旋,再离心,取上清液,过有机针式滤器,待进行超高效液相色谱串联质谱测定;
10.b、超高效液相色谱串联质谱的条件是:
11.液相色谱法的色谱条件如下:流动相为a:含0.1%甲酸的2mmol/l乙酸铵水溶液,流动相b:乙腈;采用的梯度洗脱程序为80%a(0.5min),0.5~2.0min 40%a,40%a(1min),3.0~4.0min 15%a,15%a(0.5min),4.5~6.5min 80%a,80%a(1min);流速设为0.3ml/min;柱温:35℃,进样量2μl;
12.质谱条件:电喷雾负离子模式(esi-);毛细管电压:4kv;雾化气流量3.0ml/min,干燥气和加热气流量均为10.0ml/min,接口温度300℃,脱溶剂温度526℃,加热块温度400℃;检测方式:多反应离子监测模式(mrm),氯氟氰虫酰胺定量离子对:522.05>254.15,定性离子对522.05>214.1。
13.优选,所述的液相色谱法的柱子是:poroshell 120sb-c18 column(75mm
×
2.1mm,2.7-μm)色谱柱。
14.进一步优选:
15.a、样品前处理
16.(1)提取
17.称取水果样品5.0g,置于50ml离心管中,加入10ml乙腈,涡旋混匀5min,加入4g无水硫酸镁、1g氯化钠,涡旋后在5000rpm下离心5min,收取提取液;
18.(2)净化
19.移取离心管中提取液2ml,加入5ml正己烷,剧烈摇动1min,静置5min,弃去上层净化液,下层乙腈相加入装有100mg psa、100mg c
18
、10mg多壁碳纳米管、10mg gcb混合分散吸附剂的离心管中净化,剧烈振荡后,涡旋10s,再以10000r/min离心2min,取上清液,过0.22μm有机针式滤器,待进行超高效液相色谱串联质谱测定;
20.b、超高效液相色谱串联质谱的条件是:
21.液相色谱法的色谱条件如下:流动相为a:含0.1%甲酸的2mmol/l乙酸铵水溶液,流动相b:乙腈。采用的梯度洗脱程序为80%a(0.5min),0.5~2.0min 40%a,40%a(1min),3.0~4.0min 15%a,15%a(0.5min),4.5~6.5min 80%a,80%a(1min);流速设为0.3ml/min;柱温:35℃,进样量2μl;
22.质谱条件:电喷雾负离子模式(esi-);毛细管电压:4kv;雾化气流量3.0ml/min,干燥气和加热气流量均为10.0ml/min,接口温度300℃,脱溶剂温度526℃,加热块温度400℃;检测方式:多反应离子监测模式(mrm),氯氟氰虫酰胺定量离子对:522.05>254.15,定性离子对522.05>214.1。
23.本发明相对于现有技术具有如下的优点及效果
24.本发明建立了水果中氯氟氰虫酰胺的分析检测方法,采用乙腈作为提取剂,无水硫酸镁和氯化钠的混合物作为提取盐,正己烷去除部分色素,psa、c18、多壁碳纳米管和gcb等4种分散吸附剂联合净化进一步去除水果中色素、糖、多酚等杂质,使用外标法定量。本方法的前处理操作简单方便,净化效果好,具有回收率高、重现性好、有机溶剂用量少等优点,氯氟氰虫酰胺的最低检测浓度较低,适合于氯氟氰虫酰胺在水果中的分析检测。
附图说明
25.图1是9种不同净化组合对氯氟氰虫酰胺的净化效果;
26.图2是质谱正负离子模式对氯氟氰虫酰胺的响应影响;
27.图3是不同规格色谱柱对氯氟氰虫酰胺的分离效果影响;
28.图4是流动相等度洗脱和梯度洗脱对氯氟氰虫酰胺的响应影响;
29.图5是氯氟氰虫酰胺的标准曲线图;
30.图6是氯氟氰虫酰胺的标准溶液色谱图(10μg/l);
31.图7是氯氟氰虫酰胺的水果样品添加色谱图(10μg/kg)。
具体实施方式
32.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
33.实施例1:
34.本发明的水果中氯氟氰虫酰胺的超高效液相色谱串联质谱分析方法,该方法所采用的主要仪器和试剂信息如下:
35.1、仪器:
36.超高效液相色谱串联质谱仪(岛津8045)、多管旋涡混合仪(lichen vorter-2500mt)、离心机(gtr22-1)。
37.2、试剂:乙腈(色谱纯,美国fisher公司)、无水硫酸镁(分析纯,国药集团)、氯化钠(分析纯,国药集团)、乙二胺-n-丙基硅烷吸附剂(psa,上海安谱公司)、石墨化碳黑吸附剂(gcb,上海安谱公司)、十八烷基键合硅胶吸附剂(c
18
,上海安谱公司)、多壁碳纳米管(南京先丰纳米材料科技有限公司)、纳米氧化锆(上海阿拉丁生物科技有限公司)、弗罗里硅土固相萃取小柱(安捷伦有限公司)、氨基固相萃取小柱(安捷伦有限公司)、氯氟氰虫酰胺(99.5%)(chem service公司)。
38.3、标准工作溶液配制:分别准确称取10mg氯氟氰虫酰胺标准品,用10ml色谱纯的乙腈溶解,配制成1000mg/l的储备液,0~4℃冰箱密封保存,保存期为6个月。
39.配制工作溶液:准确移取适量储备液,用色谱纯乙腈逐级稀释成1、5、10、20、100、500μg/l不同浓度工作液,现用现配。
40.4、仪器工作条件:
41.色谱条件:使用poroshell 120sb-c18 column(75mm
×
2.1mm,2.7-μm)色谱柱。
42.所述液相色谱法的色谱条件如下:流动相为a:含质量分数0.1%甲酸的2mmol/l乙酸铵水溶液,流动相b:乙腈。采用的梯度洗脱程序为体积分数80%a(0.5min),0.5~2.0min体积分数40%a,体积分数40%a(1min),3.0~4.0min体积分数15%a,体积分数15%a(0.5min),4.5~6.5min体积分数80%a,80%a(1min);流速设为0.3ml/min;柱温:35℃,进样量2μl。
43.质谱条件:
44.电喷雾负离子模式(esi-);毛细管电压:4kv;雾化气流量3.0ml/min,干燥气和加热气流量均为10.0ml/min,接口温度300℃,脱溶剂温度526℃,加热块温度400℃;检测方式:多反应离子监测模式(mrm),氯氟氰虫酰胺定量离子对:522.05>254.15,定性离子对522.05>214.1。
45.5、样品前处理
46.(1)提取
47.称取水果样品5.0g(精确至0.01g,本实施例中所用的水果样品都是荔枝的全果),
置于50ml离心管中,加入10ml乙腈,涡旋(lichen vorter-2500mt)混匀5min,加入4g无水硫酸镁、1g氯化钠,涡旋(lichen vorter-2500mt)后在5000rpm下离心(gtr22-1型台式离心机)5min,收取上层的提取液。
48.(2)净化
49.移取离心管中提取液2ml,加入5ml正己烷,剧烈摇动1min,静置5min,弃去上层净化液,下层乙腈相加入装有100mg psa、100mg c
18
、10mg多壁碳纳米管、10mg gcb混合分散吸附剂的离心管中净化,剧烈振荡后,涡旋10s,再以10000r/min离心2min,取上清液,过0.22μm有机针式滤器,待进行超高效液相色谱串联质谱测定,测定方法见步骤4。
50.6、实验结果
51.(1)提取步骤的优化
52.1)提取溶剂的优化
53.在选择提取溶剂时,乙腈、含0.1%甲酸的乙腈、含0.1%甲酸的2mmol/l乙酸铵乙腈溶液均可作为本发明的提取液,用步骤5中的(1)提取方法提取,3种提取液的提取效率略有差异,但提取率均在90%以上,综合考虑节约成本、省时省力等因素,选择乙腈匀浆提取作为氯氟氰虫酰胺在水果中的提取方法。
54.2)提取盐的选择
55.无水硫酸镁常被用于去除基质当中的水分,加入氯化钠的目的是为了让有机相和水相分层。本发明选择无水硫酸镁和氯化钠的质量比为4:1,可获得较好的提取效率。
56.(2)净化条件的优化
57.在选择净化材料时,对比了c
18
、psa、gcb、多壁碳纳米管、纳米氧化锆、氨基和弗罗里硅土固相萃取柱、正己烷液液分配等8种净化条件对水果中氯氟氰虫酰胺净化效果的影响。采用100μg/kg氯氟氰虫酰胺作为添加浓度,具体为从10000μg/l氯氟氰虫酰胺标准溶液中吸取50μl加入已称量好的空白水果样品(5g荔枝),添加后充分混合,放置2h后,加入10ml乙腈,涡旋混匀5min,加入4g无水硫酸镁、1g氯化钠,涡旋后在5000rpm下离心5min,移取离心管中提取液2ml,待净化。
58.c
18
吸附剂具有去除基质中的脂肪、脂类等非极性干扰物的作用;psa可去除基质中脂肪酸、色素、糖类等物质;gcb可去除色素等杂质;多壁碳纳米管具有较大的比表面积,可有效去除色素等干扰杂质;纳米氧化锆具有比表面积大、吸附容量大等性能。根据上述吸附剂吸附能力和特性,分别选择50mg c
18
、50mg psa、50mg gcb、5mg多壁碳纳米管、5mg纳米氧化锆进行净化。将2ml提取液加入分别装有上述5种分散吸附剂的离心管中净化,剧烈振荡后,涡旋10s,再以10000r/min离心2min,取上清液,过0.22μm有机针式滤器,待进行超高效液相色谱串联质谱测定。
59.氨基和弗罗里硅土固相萃取柱预先分别用5ml乙腈/乙酸乙酯(v/v=3/1)、丙酮/正己烷(v/v=1/9)预淋洗,再分别用5ml乙酸乙酯和正己烷平衡固相萃取小柱,当溶剂液面达到小柱吸附层表面时,马上加入2ml提取液,接收洗脱液,分别用10ml乙腈/乙酸乙酯(v/v=3/1)、丙酮/正己烷(v/v=1/9)洗脱,在氮吹仪上50℃吹干,用2ml甲醇溶解,过0.22μm有机针式滤器,待进行超高效液相色谱串联质谱测定。
60.将2ml提取液置于分液漏斗中,加入5ml正己烷进行萃取,剧烈混匀后,静置,待分层完全后,将下层乙腈相过0.22μm有机针式滤器,待进行超高效液相色谱串联质谱测定(色
谱和质谱条件同4中的仪器工作条件)。
61.结果显示,经上述8种净化条件单独净化,氯氟氰虫酰胺的回收率均在90%以上,回收率均能满足要求。
62.表1不同净化条件对回收率的影响
[0063][0064]
但由于不同水果,其中所含的色素、糖、多酚等杂质种类和含量不同,单一净化材料净化,净化效果不佳,还会产生较大的基质效应,影响定量结果的准确性,同时也容易对质谱构成污染,因此,本发明又对不同净化材料进行组合,探究其对基质净化效果和回收率的影响。
[0065]
1.50mg psa、50mg c18、5mg纳米氧化锆;
[0066]
2.100mg psa、100mg c18、5mg纳米氧化锆;
[0067]
3.50mg psa、50mg c18、5mg多壁碳纳米管、5mg纳米氧化锆;
[0068]
4.100mg psa、100mg c18、5mg多壁碳纳米管、5mg纳米氧化锆;
[0069]
5.100mg psa、100mg c18、5mg多壁碳纳米管、5mggcb;
[0070]
6.100mg psa、100mg c18、5mg多壁碳纳米管、10mggcb;
[0071]
7.100mg psa、100mg c18、10mg多壁碳纳米管、5mggcb;
[0072]
8.100mg psa、100mg c18、10mg多壁碳纳米管、10mggcb;
[0073]
9.5ml正己烷液液分配,100mg psa、100mg c18、10mg多壁碳纳米管、10mggcb;
[0074]
净化效果显示(图1),先采用正己烷进行液液分配,去除部分色素,再用100mg psa、100mg c
18
、10mg多壁碳纳米管、10mg gcb分散吸附剂联合净化,可显著去除大部分色素、糖类、多酚等杂质,不仅达到良好的净化效果,回收率也满足分析要求(见表2)。综合考虑回收率、杂质去除效果等因素,选择正己烷进行液液分配后,再用100mg psa、100mg c
18
、10mg多壁碳纳米管、10mg gcb分散吸附剂联合净化为最优净化条件。
[0075]
表2不同组合净化方式对回收率的影响
[0076][0077]
(3)基质效应
[0078]
基质效应(me)是指样品中分析物以外的组分对分析物响应值的影响。采用下式计算基质效应:me(%)=[(基质匹配标准曲线的斜率/纯溶剂标准曲线的斜率)
–
1)]
×
100%,
将100mg/l的氯氟氰虫酰胺标准工作溶液用上述步骤5样品前处理后的空白水果的基质净化溶液(不含氯氟氰虫酰胺)进行逐级稀释,配制成基质标准曲线(经过步骤4的色谱和质谱测定)。基质效应按me绝对值分为3个等级,当me绝对值在0~20%范围时,是弱基质效应,在20%~50%范围时,是中等强度基质效应,当在50%以上时,是强基质效应。氯氟氰虫酰胺的溶剂曲线为:y=8.01087e+007x+127881,r=0.9988,选择基质较为复杂的荔枝样品作基质标准曲线,y=7.63487e+007x+426383,r=0.9991。按上述公式计算,基质效应为-4.7%,存在弱基质效应。因此,本实验可采用溶剂标准曲线进行定量。
[0079]
(4)检测条件的优化
[0080]
本发明考察了正负离子扫描模式对氯氟氰虫酰胺的响应影响。设置仪器的扫描模式分别为正离子扫描和负离子扫描模式,对100μg/l氯氟氰虫酰胺的标准溶液采用自动进样器进样分析,观察氯氟氰虫酰胺特征性离子的形成和响应情况。结果显示(图2),在负离子模式下,氯氟氰虫酰胺的响应较高,因此,本实验选择负离子扫描模式。
[0081]
本发明考察了50mm、75mm、100mm等三种常用的液相色谱柱对于氯氟氰虫酰胺的分离、响应和保留效果。以100μg/l氯氟氰虫酰胺的标准溶液作为分离对象,仪器工作条件同步骤4,只是色谱柱不同,具体为:选择岛津shim-pack gist-hp c18(50mm
×
2.1mm,3.0-μm)、poroshell 120sb-c18 column(75mm
×
2.1mm,2.7-μm)和岛津shim-pack velox sp-c18(100mm
×
2.7mm,3.0-μm)3种型号色谱柱对100μg/kg的添加样品进行分析。结果显示(图3),当使用poroshell 120sb-c18 column(75mm
×
2.1mm,2.7-μm)色谱柱时,氯氟氰虫酰胺的分离效果较好,可较好的实现基线分离,获得良好的对称峰型,保证定量结果的准确性。
[0082]
在确定了色谱柱后,本发明考察了等度洗脱和梯度洗脱对100μg/kg的添加样品中氯氟氰虫酰胺分离效果,仪器工作条件参见步骤4,只是洗脱条件发生变化。其中,采用的等度洗脱采用流动相a(含0.1%甲酸的2mmol/l乙酸铵水溶液)和流动相b(乙腈)的体积比为65/35;梯度洗脱程序为80%a(0.5min),0.5~2.0min 40%a,40%a(1min),3.0~4.0min 15%a,15%a(0.5min),4.5~6.5min 80%a,80%a(1min)。对比发现(图4),梯度洗脱可显著提高氯氟氰虫酰胺的响应,最终本发明确定采用梯度洗脱程序。
[0083]
(5)方法学考察
[0084]
采用外标法定量,以氯氟氰虫酰胺浓度为横坐标,以定量离子峰面积为纵坐标,绘出准溶液曲线(仪器工作条件参照步骤4),见图5,回归方程为y=8.01087e+007x+127881(r2=0.9989)。超高效液相色谱串联质谱仪对氯氟氰虫酰胺检出限为0.1μg/kg,定量限为1μg/kg。
[0085]
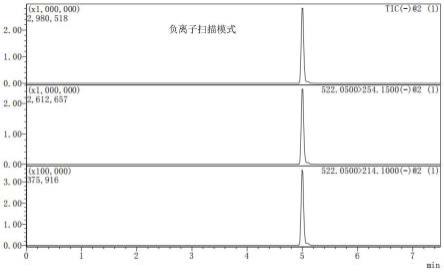
取空白水果样品(步骤5样品前处理后的荔枝的基质净化溶液,不含氯氟氰虫酰胺),分别设置10μg/kg、100μg/kg和500μg/kg等3档添加氯氟氰虫酰胺浓度,进行添加回收率试验,其中10μg/kg添加浓度具体为从1000μg/l标准溶液中吸取50μl加入已称量好的空白水果样品、100μg/kg添加浓度具体为从10000μg/l标准溶液中吸取50μl加入已称量好的空白水果样品、500μg/kg添加浓度具体为从10000μg/l标准溶液中吸取25μl加入已称量好的空白水果样品,添加后充分混合,放置2h后进行提取、净化步骤(参见步骤5),每档添加浓度设置5个重复,再进行色谱和质谱(参见步骤4)。由表3可知,氯氟氰虫酰胺在水果中添加浓度为10μg/kg、100μg/kg和500μg/kg时,平均回收率为89.3%~101.3%,相对标准偏差为3.01%~8.50%(图6、图7)。
[0086]
表3不同添加浓度对应的回收率及标准偏差
[0087][0088][0089]
本发明建立了水果中氯氟氰虫酰胺的分析检测方法。本发明的氯氟氰虫酰胺在1~500μg/l浓度范围内呈现良好的线性关系,水果中添加氯氟氰虫酰胺的平均回收率为89.3~101.3%,相对标准偏差(rsd)为3.01~8.50%,方法定量限为1μg/kg。本发明方法具有操作简便快速、样品重现性好、适用性强的特点,各项技术指标均可满足农药残留检测分析要求。
[0090]
上述为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1