蛋白偶联试剂、蛋白偶联微球、微孔板及其应用的制作方法
1.本发明涉及生物检测领域,尤其涉及蛋白偶联试剂、蛋白偶联微球、微孔板及其应用。
背景技术:
2.化学发光酶免疫分析(chemiluminescent enzymeimmunoassay,cleia)属酶免疫分析,只是酶反应的底物是发光剂,操作步骤与酶免分析完全相同:通过包被于聚苯乙烯板的抗原或抗体捕获样本中特异性物质,并与酶标记生物活性物质组合成免疫复合物。检测时,利用该免疫复合物上的酶催化底物发光,化学发光分析等设备对催化所发出的光量子进行测定得到最终的检测结果。
3.酶标板在参与免疫学反应的抗原、抗体、标记抗体或抗原的纯度、浓度和比例;缓冲液种类、浓度和离子强度、ph值和反应温度、时间等条件起着关键作用。此外,作为载体的固相聚苯乙烯(polystyrene)表面对抗原、抗体或抗原抗体复合物的吸附也起着重要作用。
4.乳胶微球是免疫学和磁性微球结合而发展的一类新型材料,由于其高效、低毒等特性,目前在生物化学领域、医药领域、食品检测领域应用广泛。
5.抗体与乳胶微球的偶联是将单克隆抗体与带有功能基团的微球偶联,抗体与微球连接的方式有两种:共价偶联(covalent coupling)和物理吸附(physical absorption)。物理吸附非常不稳定,在一定的条件下很容易脱落,而共价偶联是抗体与微球表面的基团共价结合,使抗体稳固地结合在微球上。微球上的醛基、环氧基等基团可以直接和目标分子上的氮基结合,而含其他基团的微球则需要进行活化才能与目标分子连接。常用的活化方法有:碳二亚胺法、重氮法、烃化法、溴化氰法、戊二醛法、伍德沃德试剂k法等。
6.固相载体在酶免分析测定过程作为吸附剂和容器,不参与化学反应,最常用的是聚苯乙烯。包被是将蛋白结合到固相载体表面的过程。蛋白质与聚苯乙烯固相载体是通过物理吸附结合的,靠的是蛋白质分子结构上疏水基团与固相载体表面的疏水基团间的作用,这种物理吸附是非特异性的,受蛋白质的分子量、等电点、浓度等的影响。
7.在现有技术中,通常在包被的时候,将包被液加入到酶标板中,包被液中的蛋白会吸附到聚苯乙烯上,在固定的面积内,聚苯乙烯板的位置是有限的,因此所吸附的蛋白有限。在上述包被的微孔板中检测,检测试验的灵敏度较低。
技术实现要素:
8.有鉴于此,本发明提供了蛋白偶联试剂、蛋白偶联微球、微孔板及其应用。本发明通过在微球偶联蛋白后包被微孔板,扩大了载体上蛋白面积,提高酶标板灵敏度。
9.为了实现上述发明目的,本发明提供以下技术方案:
10.本发明提供了蛋白偶联试剂,包括试剂i和试剂ii;所述试剂i包括:mes、edc和nhs;所述试剂ii包括:抗磷脂酶a2重组蛋白。
11.在本发明的一些实施方案中,上述蛋白偶联试剂中所述mes采用mes溶液的形式添
加;所述mes溶液的浓度为0.05mol/l,ph值为6.0;上述蛋白偶联试剂中所述edc与所述nhs的质量比为1:15。
12.本发明还提供了上述蛋白偶联试剂在制备蛋白偶联微球中的应用。
13.本发明还提供了蛋白偶联微球的制备方法,包括以下步骤:
14.s1:取生物磁珠活化后,获得活化后的微球;
15.s2:取所述活化后的微球,偶联后,获得所述蛋白偶联微球;
16.s1中所述活化和s2中所述偶联采用上述蛋白偶联试剂。
17.在本发明的一些实施方案中,上述制备方法中所述生物磁珠包括羧基微球。
18.在本发明的一些实施方案中,上述制备方法s1中所述活化采用所述试剂i;所述生物磁珠与所述mes的体积比为1:2500。
19.在本发明的一些实施方案中,上述制备方法s2中所述偶联采用试剂ii;所述活化后的微球体积与所述抗磷脂酶a2重组蛋白的质量比为1:1~5。
20.在本发明的一些实施方案中,上述制备方法中所述mes溶液的浓度为0.05mol/l,ph值为6.0。
21.在本发明的一些实施方案中,上述制备方法中所述mes溶液的体积为500μl。
22.在本发明的一些实施方案中,上述制备方法中所述生物磁珠的体积为0.2μl。
23.在本发明的一些实施方案中,上述制备方法中所述edc与所述nhs的质量比为1:15。
24.在本发明的一些实施方案中,上述制备方法中所述edc的质量为0.03mg。
25.在本发明的一些实施方案中,上述制备方法中所述nhs的质量为0.045mg。
26.在本发明的一些实施方案中,上述制备方法中所述抗磷脂酶a2重组蛋白的质量为20~100μg。
27.在本发明的一些实施方案中,上述制备方法中所述抗磷脂酶a2重组蛋白的质量为20μg、50μg或100μg。
28.在本发明的一些实施方案中,上述制备方法s1中所述活化的时间为30min,温度为20~25℃。
29.在本发明的一些实施方案中,上述制备方法s2中所述偶联的时间为20min,温度为20~25℃。
30.本发明还提供了上述蛋白偶联试剂或上述制备方法获得的蛋白偶联微球在制备微孔板中的应用。
31.本发明还提供了微孔板的制备方法,取上述蛋白偶联微球封闭、离心、去上清、超声、稀释后铺板,获得所述微孔板。
32.在本发明的一些实施方案中,上述制备方法中所述封闭的时间为30min,温度为20~25℃。
33.在本发明的一些实施方案中,上述制备方法中所述离心的转速为16000rpm,时间为30~60min。
34.在本发明的一些实施方案中,上述制备方法中所述离心包括第一离心和第二离心;所述第一离心的转速为16000rpm,时间为30min;所述第二离心的转速为16000rpm,时间为30min。
35.在本发明的一些实施方案中,上述制备方法中所述第二离心包括与50mm tb缓冲液混合的步骤。
36.在本发明的一些实施方案中,上述制备方法中所述超声的参数为10%,3/3,时间为2min。
37.在本发明的一些实施方案中,上述制备方法中所述铺板后还包括包被、封闭和干燥的步骤。
38.在本发明的一些实施方案中,上述制备方法中所述包被的时间为18h,温度为2~8℃。
39.在本发明的一些实施方案中,上述制备方法中所述封闭的时间为1h,温度为20~25℃。
40.在本发明的一些实施方案中,上述制备方法中所述干燥的时间为2h,温度为37℃。
41.在本发明的一些实施方案中,上述制备方法中所述稀释采用cb缓冲液;所述稀释后的浓度为0.1~0.2μg/ml。
42.在本发明的一些实施方案中,上述制备方法中所述稀释后的浓度为0.1μg/ml、0.15μg/ml或0.2μg/ml。
43.本发明还提供了上述制备方法获得的微孔板。
44.本发明还提供了上述蛋白偶联试剂、上述制备方法获得的蛋白偶联微球、上述微孔板在蛋白或核酸检测中的应用。
45.本发明提供了蛋白偶联试剂,包括试剂i和试剂ii;所述试剂i包括:mes、edc和nhs;所述试剂ii包括:抗磷脂酶a2重组蛋白。
46.本发明通过在微球偶联蛋白后包被微孔板,扩大了载体上蛋白面积,提高酶标板灵敏度。
附图说明
47.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
48.图1示活化微球对蛋白偶联质量筛选结果图;
49.图2示蛋白包被浓度筛选结果图;
50.图3示验证例中实施例与对照组实验结果图。
具体实施方式
51.本发明公开了蛋白偶联试剂、蛋白偶联微球、微孔板及其应用。
52.应该理解,表述
“……
中的一种或多种”单独地包括每个在所述表述后叙述的物体以及所述叙述的物体中的两者或更多者的各种不同组合,除非从上下文和用法中另有理解。与三个或更多个叙述的物体相结合的表述“和/或”应该被理解为具有相同的含义,除非从上下文另有理解。
53.术语“包括”、“具有”或“含有”,包括其语法同义语的使用,通常应该被理解为开放性和非限制性的,例如不排除其他未叙述的要素或步骤,除非另有具体陈述或从上下文另有理解。
54.应该理解,只要本发明仍可操作,步骤的顺序或执行某些行动的顺序并不重要。此外,两个或更多个步骤或行动可以同时进行。
55.本文中的任何和所有实例或示例性语言如“例如”或“包括”的使用,仅仅打算更好地说明本发明,并且除非提出权利要求,否则不对本发明的范围构成限制。本说明书中的任何语言都不应解释为指示任何未要求保护的要素对于本发明的实践是必不可少的。
56.此外,用以界定本发明的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。因此,除非另有明确的说明,应当理解本公开所用的所有范围、数量、数值与百分比均经过“约”的修饰。在此处,“约”通常是指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。
57.本发明提供了一种提高聚苯乙烯微孔板灵敏度的微孔板的制备方法,包括:蛋白偶联,酶标板的包被,封闭,标本孵育,酶结合物孵育,底物显色,终止。
58.本发明实施例1~实施例9和效果例1~效果例3中,抗磷脂酶a2重组蛋白(来源于:origene,批号:wx03364f),ce210溶液(来源:北京博尔迈,2502lb-02),兔抗pla2r抗体(来源:abcam,批号:gr3266954-4),
59.本发明实施例1~实施例9和效果例1~效果例3中,所用原料及试剂均可由市场购得。
60.下面结合实施例,进一步阐述本发明:
61.实施例1配制包被缓冲液
62.(1)配制100ml cb缓冲液:称取na2co30.159g,nahco30.293g,用量筒量取55ml纯化水倒入烧杯中,放入搅拌转子,并放到磁力搅拌器上搅拌至完全溶解。用校准后的ph计测量上述溶液的ph,用2m的hcl或2m的naoh调整ph至9.60
±
0.20,定容至100ml。
63.(2)配制100ml mes溶液:称取mes,用量筒量取90ml纯化水倒入烧杯中,放入搅拌转子,并放到磁力搅拌器上搅拌至完全溶解。用校准后的ph计测量上述溶液的ph,用2m的hcl或2m的naoh调整ph至6.00
±
0.20,定容至100ml。
64.(3)10
×
浓缩洗涤液100ml:称取nacl 2.422g、tris 8.766g并用纯化水溶解,加入110μl,proclin300,50μl吐温20混匀后,调节ph至7.2
±
0.2,并用纯化水定容到100ml。
65.(4)1
×
洗涤液:将步骤(3)获得的10
×
浓缩洗涤液稀释10倍。
66.(5)样本稀释液:称取nacl 8.766g、tris 2.422g,并用纯化水溶解,加入100μl proclin 300,加入1g bsa,50μl吐温20混匀后,调节ph至7.2
±
0.2,并用纯化水定容到100ml。
67.(6)基础封闭液:称取海藻糖25g,并用纯化水溶解,加入500μl proclin300,加入10g bsa混匀后,调节ph至7.2
±
0.2,并用纯化水定容到500ml。
68.(7)偶联储存液:称取bsa 1.5g,pg200000.03g,加0.3ml 0.2m硼酸,加入纯化水29.7ml充分溶解混匀。
69.实施例2偶联
70.(1)活化微球
71.以实施例1获得的mes溶液作为活化缓冲溶液,取0.2μl羧基微球于2ml离心管中,加入500μl活化缓冲溶液,在漩涡振荡器上混合均匀,再分别加入0.03mg碳二亚胺(edc)与
0.045mgn-羟基琥珀酰亚胺(nhs),在漩涡振荡器上混合均匀,20~25℃活化磁珠表面的羧基30min。
72.(2)微球偶联蛋白
73.在步骤(1)获得的活化的微球中加入20μg抗磷脂酶a2重组蛋白,漩涡振荡器上混合均匀,期间缓慢旋转振荡,避免微球沉淀,20~25℃偶联20min。
74.(3)微球封闭
75.步骤(2)偶联结束后加入50μl ce210溶液,20~25℃封闭30min。封闭完成后,以转速为16000rpm离心30min,移除上清液。
76.(4)离心洗涤
77.在步骤(3)的离心管中加入500μl 50mmtb,以转速为16000rpm离心30min,移除上清液。
78.(5)储存
79.在步骤(4)的离心管中加入偶联储存液500μl,以超声参数10%,3/3,超声2min,获得蛋白偶联微球。
80.实施例3偶联
81.(1)活化微球
82.以实施例1获得的mes溶液作为活化缓冲溶液,取0.2μl羧基微球于2ml离心管中,加入500μl活化缓冲溶液,在漩涡振荡器上混合均匀,再分别加入0.03mg碳二亚胺(edc)与0.045mgn-羟基琥珀酰亚胺(nhs),在漩涡振荡器上混合均匀,20~25℃活化磁珠表面的羧基30min。
83.(2)微球偶联蛋白
84.在步骤(1)获得的活化的微球中加入50μg抗磷脂酶a2重组蛋白,漩涡振荡器上混合均匀,期间缓慢旋转振荡,避免微球沉淀,20~25℃偶联20min。
85.(3)微球封闭
86.步骤(2)偶联结束后加入50μl ce210溶液,20~25℃封闭30min。封闭完成后,以转速为16000rpm离心30min,移除上清液。
87.(4)离心洗涤
88.在步骤(3)的离心管中加入500μl 50mmtb,以转速为16000rpm离心30min,移除上清液。
89.(5)储存
90.在步骤(4)的离心管中加入偶联储存液500μl,以超声参数10%,3/3,超声2min,获得蛋白偶联微球。
91.实施例4偶联
92.(1)活化微球
93.以实施例1获得的mes溶液作为活化缓冲溶液,取0.2μl羧基微球于2ml离心管中,加入500μl活化缓冲溶液,在漩涡振荡器上混合均匀,再分别加入0.03mg碳二亚胺(edc)与0.045mgn-羟基琥珀酰亚胺(nhs),在漩涡振荡器上混合均匀,20~25℃活化磁珠表面的羧基30min。
94.(2)微球偶联蛋白
95.在步骤(1)获得的活化的微球中加入100μg抗磷脂酶a2重组蛋白,漩涡振荡器上混合均匀,期间缓慢旋转振荡,避免微球沉淀,20~25℃偶联20min。
96.(3)微球封闭
97.步骤(2)偶联结束后加入50μl ce210溶液,20~25℃封闭30min。封闭完成后,以转速为16000rpm离心30min,移除上清液。
98.(4)离心洗涤
99.在步骤(3)的离心管中加入500μl 50mmtb,以转速为16000rpm离心30min,移除上清液。
100.(5)储存
101.在步骤(4)的离心管中加入偶联储存液500μl,以超声参数10%,3/3,超声2min,获得蛋白偶联微球。
102.实施例5酶标板的制备
103.(1)预包被
104.将兔抗pla2r抗体用实施例1获得的cb缓冲液稀释为0.15μg/ml,将稀释好的包被液加入到白色微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
105.(2)包被
106.将抗磷脂酶a2重组蛋白用实施例1获得的cb缓冲液稀释为0.15μg/ml,将稀释好的包被液加入到预包被微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
107.(2)封闭
108.用基础封闭液封闭,每孔加入180μl实施例1获得的基础封闭液,在20~25℃下封闭1h,甩出液体。
109.(3)干燥、装袋
110.取步骤(2)稳定好的板放入烘箱,37℃干燥2h。取出板后在装入铝箔袋,并放入干燥剂,封袋待用。
111.实施例6酶标板的制备
112.(1)预包被
113.将兔抗pla2r抗体用实施例1获得的cb缓冲液稀释为0.15μg/ml,将稀释好的包被液加入到白色微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
114.(2)包被
115.将实施例4获得的蛋白偶联微球,用实施例1获得的cb缓冲液稀释为0.1μg/ml,将稀释好的包被液加入到预包被微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
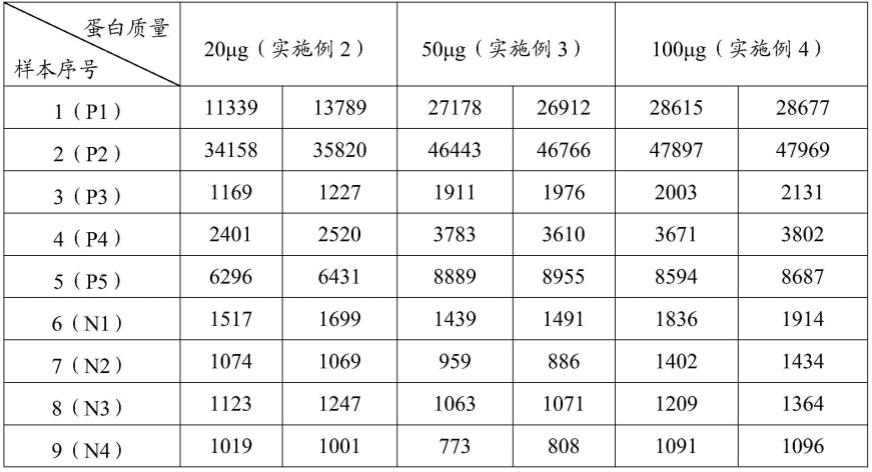
116.(3)封闭
117.用基础封闭液封闭,每孔加入180μl实施例1获得的基础封闭液,在20~25℃下封闭1h,甩出液体。
118.(4)干燥、装袋
119.取步骤(2)稳定好的板放入烘箱,37℃干燥2h。取出板后在装入铝箔袋,并放入干燥剂,封袋待用。
120.实施例7酶标板的制备
121.(1)预包被
122.将兔抗pla2r抗体用实施例1获得的cb缓冲液稀释为0.15μg/ml,将稀释好的包被液加入到白色微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
123.(2)包被
124.将实施例4获得的蛋白偶联微球,用实施例1获得的cb缓冲液稀释为0.15μg/ml,将稀释好的包被液加入到预包被微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
125.(3)封闭
126.用基础封闭液封闭,每孔加入180μl实施例1获得的基础封闭液,在20~25℃下封闭1h,甩出液体。
127.(4)干燥、装袋
128.取步骤(2)稳定好的板放入烘箱,37℃干燥2h。取出板后在装入铝箔袋,并放入干燥剂,封袋待用。
129.实施例8酶标板的制备
130.(1)预包被
131.将兔抗pla2r抗体用实施例1获得的cb缓冲液稀释为0.15μg/ml,将稀释好的包被液加入到白色微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
132.(2)包被
133.将实施例4获得的蛋白偶联微球,用实施例1获得的cb缓冲液稀释为0.2μg/ml,将稀释好的包被液加入到预包被微孔板中,100μl/孔,将包被板放入冰箱(2~8℃环境下),包被18h,用实施例1获得的1
×
洗涤液洗板2次,洗好后拍干。
134.(2)封闭
135.用基础封闭液封闭,每孔加入180μl基础封闭液,在20~25℃下封闭1h,甩出液体。
136.(3)干燥、装袋
137.取步骤(2)稳定好的板放入烘箱,37℃干燥2h。取出板后在装入铝箔袋,并放入干燥剂,封袋待用。
138.实施例9检测方法
139.(1)酶结合物配制
140.将羊抗人igg-hrp稀释6000倍,混匀。
141.(2)样本孵育
142.取不同浓度的pla2r阳性样本及阴性样本用样本稀释液稀释100倍或使用高浓度样本倍比稀释至1024倍,分别加入已平衡到20~25℃的实施例5~实施例8获得的酶标板中,100μl/孔复孔检测;另设一空白对照,直接加样本稀释液100μl/孔。20~25℃反应30min;用实施例1获得的1
×
洗涤液洗涤3次,每次300μl,拍干残余液体。
143.(3)酶结合物孵育
144.每孔加入酶结合物100μl,20~25℃反应30min,用实施例获得的1
×
洗涤液3次,每次300μl,拍干残余液体。
145.(4)显色读值
146.每孔加入化学发光底物,a、b液等比例混合,100μl/孔,用酶标仪读取发光值。
147.效果例1
148.按实施例5的包被步骤、实施例9的检测方法将实施例2~实施例4活化微球对蛋白的偶联质量进行筛选,检测结果如表1和图1所示;
149.表1
[0150][0151][0152]
实验结果如图1和表1所示,活化微球通过偶联不同质量的蛋白,得到的结果表明,不同蛋白质量对偶联效果有的影响,实施例3中在活化的微球中加入50μg抗磷脂酶a2重组蛋白为最优选择。
[0153]
效果例2
[0154]
按实施例9的检测方法检测实施例6~实施例8包被不同浓度的蛋白进行筛选,检测结果如表2和图2所示;
[0155]
表2
[0156][0157]
实验结果如图2和表2所示,通过包被不同浓度的偶联微球蛋白,根据结果可得出实施例6包被0.15μg/ml为最佳浓度。
[0158]
效果例3本发明所述微孔板灵敏度检测
[0159]
对照微孔板:实施例5获得的微孔板,区别在于磷脂酶a2重组蛋白不需要偶联,直接使用cb缓冲液对蛋白稀释后进行包被。
[0160]
实验微孔板:实施例7获得的微孔板。
[0161]
(1)检测发光值结果如表3所示;
[0162]
表3
[0163][0164]
(2)对照组及实验组检测结果平均值数据进行单因素方差分析,结果如表4和表5所示;
[0165]
表4方差分析:单因素方差分析
[0166][0167][0168]
表5方差分析
[0169]
差异源ssdfmsfp-valuefcrit组间279329309410279329309.413.004824850.000100642.853624858组内236267880.51121478898.23
ꢀꢀꢀ
总计302956097421
ꢀꢀꢀꢀ
[0170]
由表5所示,p值小于0.05,则实验组及对照组数据具有显著差异。
[0171]
(3)对照组及实验组平均值数据进行折线图分析,如图3所示,从图中可看出实验组的检测吸光值大于对照组发光值,两组数据变化趋势大体相同;对照组检测结果发光值趋近与0时,实验组还能检测出更低浓度。
[0172]
(4)结论
[0173]
1)使用活化后的羧基微球与磷脂酶重组蛋白偶联后检测吸光度值变大。
[0174]
2)使用活化后的羧基微球与磷脂酶重组蛋白偶联后能够检测更低浓度的抗体,灵敏度提高。
[0175]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1