一种G蛋白偶联受体药物靶点口袋结构预测方法与流程
本发明涉及一种g蛋白偶联受体药物靶点口袋结构预测方法。
背景技术:
药物靶点的发现和定位是新药研究成功的关键,在药物靶点的研究中,虽然人们已经做出了巨大努力,但到目前为止,被临床验证的药物靶点的数量还很少。迄今已发现的治疗药物靶点约500个,其中受体,尤其是g蛋白偶联受体(gprotein-coupledreceptors,gpcrs)靶点占绝大多数,另外还有酶、抗病毒、抗菌的作用靶点。世界药物市场上有三分之一的小分子药物是gpcr的激活剂或拮抗剂,大约40%的现代药物都以gpcr作为药物靶点。此外,与gpcr相关的疾病为数众多。因此,更深入地研究gpcr,挖掘其中潜在的药物靶点,对于新药的开发有着重要的意义。
g蛋白偶联受体是一肽类膜蛋白受体的统称。这类受体的共同点是其立体结构中都有七个跨膜α螺旋,且其肽链的c端和连接第5和第6个跨膜螺旋的胞内环上都有g蛋白(鸟苷酸结合蛋白)的结合位点。目前为止,研究显示g蛋白偶联受体只见于真核生物之中,而且参与了很多细胞信号转导过程。在这些过程中,g蛋白偶联受体能结合细胞周围环境中的化学物质并激活细胞内的一系列信号通路,最终引起细胞状态的改变。已知的与g蛋白偶联受体结合的配体包括气味,费洛蒙,激素,神经递质,趋化因子等等。这些配体可以是小分子的糖类,脂质,多肽,也可以是蛋白质等生物大分子。一些特殊的g蛋白偶联受体也可以被非化学性的刺激源激活,例如在感光细胞中的视紫红质可以被光所激活。
许多算法和程序模拟受体的灵活性已经得到发展。glide和gold具有蛋白质的灵活性通过减少配体原子和受体之间的紧密接触(空间冲突)的能量损失来考虑。autodock4.2和slide显示全侧链柔性可以通过优化侧链扭转角度和使用旋转异构体库来确定。此外,rosettaligand对接程序考虑到全面的侧链灵活性。
早期的方法检查的灵活性侧链,同时较少关注骨干的灵活性。后期版本rosettaligand在对接过程中增加了完整的骨架和配体灵活性。
然而,界面骨架的柔韧性不仅是由配体引发,而且还受到口袋附近的残留物的影响。相比之下,骨架上的受体结合位点柔性的直接建模仍然是困难的,因为初始受体的单个固定构象缩小了不同的构象空间。
因此,gpcr-配体对接灵活性的面对的两个挑战是:(1)如何准确地模拟主体在将配体插入受体时的扰动,和(2)如何在装订口袋附近采样骨干。
技术实现要素:
本发明的目的在于克服现有技术存在的以上问题,提供一种g蛋白偶联受体药物靶点口袋结构预测方法,本发明通过集成基于rosettaligand平台的两种不同的细化协议,提出了通过对接界面的灵活性组合细化(coref)方法。
为实现上述技术目的,达到上述技术效果,本发明通过以下技术方案实现:
一种g蛋白偶联受体药物靶点口袋结构预测方法,预测方法基于rosetttaligand平台,包括以下步骤:
s10没有配体构象的并行受体细化方法:通过平行不同的运动产生多个初始受体,通过多个初始受体来模拟绑定位点附近骨架的同时波动;
s20具有配体构象的并行受体细化方法:利用rlex配体对接受体的配体期间模拟界面柔性,通过插入主干扰动阶段来改善界面附近的原子,重组rosetta标准运动,为界面残基添加配体构象的骨架细化步骤,扩展了rosetttaligand对接算法。
优选地,
s10中包括以下步骤:
s101将rosetta能量函数被用于改善受体主链,并且引入并行算法来预测蛋白质主链结构;
s102与不同的rosetta标准运动并行,以模拟绑定位点附近的骨架的同时波动;
s103结合位点附近的残基,根据受体和配体的界面,pbk并行主干算法使用三个线程进行后排运动、小骨架运动、剪切运动;
s104加入并行结构进行并行化,获得多种交叉构象;
s105输出若多低能量构象。
优选地,
s20中包括以下步骤:
s201在gpcg蛋白偶联受体和配体构象异构体进行取样;
s202在配体取样过程中,配体取样位置变化时界面残留发生变化,进行受体界面结构精炼;
s203插入精炼阶段遵循mcm对接阶段之前的粗粒度采样阶段,提高受体界面结构的分辨率;
s204识别界面残基后,rlex使用运动闭合协议在ramachandran空间中实施骨架扭转采样,用于模拟配体诱导拟合的结构变化。
优选地,s20步骤的算法包括:
算法1:rlex对接(m,n,l,b,e,c)
1:输入:受体m的起始模型,受体序列长度n,构象的集合配体l,起始结合位点b,能量函数e,
输出:gpcr-配体配合物的候选构象集合c;
2:rinterface=φ;
3:c’=coarsegrainedsampling(m,l,b,e);
4:foreachc′inc’do
5:fori=1tondo
6:ifdi<=7
7:rinterface=rinterface∪resi;
8:endif
9:endfor
10:foreachlinrinterfacedo
11:c’=kicrefining(c’,l);
12:endfor
13:endfor
14:c’=dockmcm(c’);
15:c’=energyminimization(c’,e);
16:c=c’;
17:output:c。
优选地,以没有配体构象的平行受体细化方法和具有配体构象的平行受体细化方法进行综合细化,coref的工作流程包括:
s301下载十个cxc4和十个d3模型,作为coref的起始模型;
s302每个起始模型都使用pbk进行了改进,并且生成了一个包含500个模型的集合体;
s303使用rlex对接算法将集合中最大的五个集群的中心选为与配体对接的精英构象,其再次产生500个复合体。
本发明的有益效果是:
(1)本发明由于集成了两种具有和不具有配体结构的骨架柔性建模协议,所以coref拓宽了具有或不具有配体结构的单一协议无法获得的构象采样空间。
(2)本发明涉及的方法中,coref以并行方式结合了rosetta骨干运动,而不是在不同预测阶段顺序交替不同运动的传统方式,这使得从不同移动导出的构象搜索智能能够同时协作。
(3)本发明涉及的方法中,rlex在rosetta的对接协议中增加了界面细化步骤,以模拟配体诱导拟合的结构变化,所有这些功能帮助coref实现更好的预测精度。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。本发明的具体实施方式由以下实施例及其附图详细给出。
附图说明
为了更清楚地说明本发明实施例技术中的技术方案,下面将对实施例技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1pbk算法流程图;
图2是本发明s20的方法流程图;
图3coref工作流程图;
图4使用pymol创建的本机模型和叠加r1-r5的结构比较。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例中涉及的材料:
目前,领域中已经确定了大约十个gpcr三级结构。为了合理评估,三种已知的结构gpcr,cxc趋化因子受体4(cxcr4,pdbid:30e0,3oe6,3oe8,3oe9和3odu),人a2a腺苷受体(a2a,pdbid:3eml)和多巴胺d3受体(3pbl)用于检查pbk、rlex和coref细化的优势和弱点。
本实施例仅选择3个目标进行评估,因为这些目标是gpcrdocking2008/2010社区范围的目标。本实施例使用coref确定的结果不仅可以用于评估自然结构与结果之间的差距,还可以了解其他研究组获得的差异。
1.1趋化因子受体cxcr4
趋化因子受体cxcr4是趋化因子基质细胞衍生因子-1(cxcl12)的特异受体。cxcl12对淋巴细胞有强烈的趋化作用。该受体是用来提取纯化艾滋病毒的几个趋化因子受体之一。
已经公开五个独立的晶体结构cxcr4以
1.2腺苷受体a2a
实施对接a2a至zm241325的实验,以评估rlex(具有配体构象的细化方案)的性能。使用由baker组提交的在gpcrdock2008上发布的配体zm241325的前五名a2a型号作为rlex的起始模型。
模型的ca_rmsd范围为3.5至
表1.五个起始模型的cα_rmsd和lrmsd
1.3多巴胺受体d3
多巴胺d3受体在药物依赖中的作用越来越受到关注,药理学实验证明多巴胺d3受体参与成瘾药物的强化作用,影响啮齿类动物的运动和行为。
配体结合口袋相对于结合的配体的空间定位和在配体结合口袋中呈现侧链的βar中非常相似。通常,口袋区域的特征在于gpcr系列之间的高序列多样性。实施了将d3对依替必利(eticlopride)的实验,以评估coref的表现。
本实施例中公开了一种g蛋白偶联受体药物靶点口袋结构预测方法,预测方法基于于rosetttaligand平台,包括以下步骤:
s10没有配体构象的并行受体细化方法:通过并行不同的运动产生多个初始受体,通过多个初始受体来模拟绑定位点附近骨架的同时波动;
s20具有配体构象的并行受体细化方法:利用rlex配体对接受体的配体期间模拟界面柔性,通过插入主链扰动阶段来改善界面附近的原子,重组rosetta标准运动,为界面残基添加配体构象的骨架细化步骤,扩展了rosetttaligand对接算法。
基于上述方法,本申请涉及的gpcrdock2010模型
为了评估coref的可靠性,本实施例下载gpcrdock2010参与者所有提交的模型。本实施例根据lrmsd阈值将这些cxcr4和d3模型分为更好和更差的组;对于cxcr4,阈值为10,d3为5。在每组中,随机选取5个模型作为起始模型。因此,测试数据集由包括不同程度的分辨率的二十个模型组成。
十个cxcr4起始模型的lrmsd范围为
2.1没有配体构象的平行受体细化方案如下:
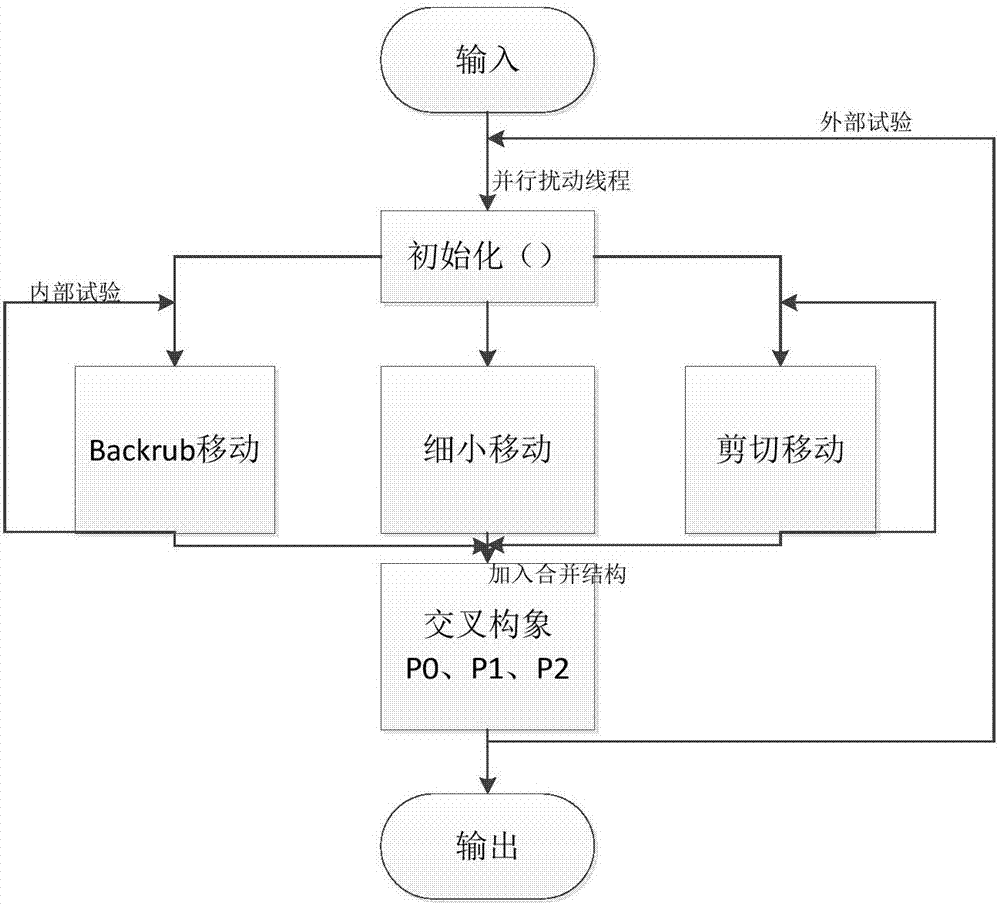
如图1所示,s10中包括以下步骤:
s101将rosetta能量函数被用于改善受体主链,并且引入并行算法来预测蛋白质主链结构;
s102与不同的rosetta标准运动并行,以模拟绑定位点附近的骨架的同时波动;
s103结合位点附近的残基,根据受体和配体的界面,pbk并行主干算法使用三个线程进行backrub运动、小骨架运动、剪切运动;
s104加入并行结构进行并行化,获得多种交叉构象;
s105输出若多低能量构象。
受体骨架的采样空间可以来自小开发与已知蛋白质结构的片段相似性或能量的最小化。在本方法中,rosetta能量函数被用于改善受体主链。另一方面,引入并行算法来预测蛋白质主链结构。在我们以前的并行方法中,我们结合了各种能源功能,而对于对接问题,我们结合了不同的示例策略。
对于psp(蛋白质结构预测)问题,不同的样本策略通过蛋白质中所有或部分原子的不同结构运动来实现,例如rosetta中的背衬运动,小骨架移动和剪切运动。
如图1所示,在没有配体构象的平行细化方案中,为了制备具有优化的配体对接初始构象的多个界面,本实施例中与不同的rosetta标准运动并行,以模拟绑定位点附近的骨架的同时波动。在平行混合各种运动之后,采样空间比单次运动更宽。结合位点附近的残基根据受体和配体的界面,称为pbk的并行主干算法使用三个线程进行后座运动,小骨架运动和剪切运动。backrub是一种简单的运动模式,灵感来源于观察到的高分辨率晶体结构模型的波动,并用于描述蛋白质的灵活性。小移动通过随机小角度扰乱随机残差的phi或psi,剪切运动改变残留物i-1的残基i和psi的phi。通过并行化,引入pbk的骨架运动越多,pbk获得的低能量构象数越多。
其中,在图1中,在pbk中采用了rosetta全原子“标准”评分功能,补丁“score12”。pbk的dof(自由度)只能使界面残基骨架可移动,侧链和其他残留物固定。使用的移动图文件和标志文件在s1中有描述。
2.2具有配体构象的受体细化方案
其中,如图2中所示,s20中包括以下步骤:
s201在g蛋白偶联受体和配体构象异构体进行取样;
s202在配体取样过程中,配体取样位置变化时界面残留发生变化,进行受体界面结构精炼;
s203插入精炼阶段遵循mcm对接阶段之前的粗粒度采样阶段,提高受体界面结构的分辨率;
s204识别界面残基后,rlex使用运动闭合协议在ramachandran空间中实施骨架扭转采样,用于模拟配体诱导拟合的结构变化。
具有配体构象的受体细化方案在使用rlex(参见算法1)配体对接受体的配体期间模拟界面柔性,其通过插入主干扰动阶段来改善界面附近的原子,从而重组rosetta标准运动。随着配体取样位置的变化,界面残留会发生变化。插入的精炼阶段(算法1中的行4-13)遵循mcm对接阶段之前的粗粒度采样阶段。在识别界面残基后,rlex使用运动闭合(kic)协议在ramachandran空间中实施骨架扭转采样,用于模拟配体诱导拟合的结构变化。
算法1:rlex对接(m,n,l,b,e,c)
1:输入:受体m的起始模型,受体序列长度n,构象的集合配体l,起始结合位点b,能量函数e,
输出:gpcr-配体配合物的候选构象集合c;
2:rinterface=φ;
3:c’=coarsegrainedsampling(m,l,b,e);
4:foreachc′inc’do
5:fori=1tondo
6:ifdi<=7
7:rinterface=rinterface∪resi;
8:endif
9:endfor
10:foreachlinrinterfacedo
11:c’=kicrefining(c’,l);
12:endfor
13:endfor
14:c’=dockmcm(c’);
15:c’=energyminimization(c’,e);
16:c=c’;
17:output:c。
在rlex中使用rosetta配体对接受体灵活性评分功能(ligand_soft_rep.wts)。在rlex中定义的移动图可以将固定距离内的残留物(rosetta中的默认值为7埃)配置为可移动的。在这种情况下,界面的可移动原子根据配体与受体的不同位置来确定。
2.3综合细化
以没有配体构象的平行受体细化方法和具有配体构象的平行受体细化方法进行综合细化,coref的工作流程如图3所示,包括:
s301从gpcrdocking2010网站下载十个cxc4和十个d3模型,作为coref的起始模型;
s302每个起始模型都使用pbk进行了改进,并且生成了一个包含500个模型的集合体;
s303使用rlex对接算法将集合中最大的五个集群的中心选为与配体对接的精英构象,其再次产生500个复合体。
coref为每个起始模型细化花费大约150cpu小时。
3结果
3.1通过将cxcr4对接到cvx15来评估pbk的个体性能
为了评估rlex,我们比较了由本机和模型生成的构造集合的精度与界面灵活的细化。在实验中,我们制作了五个具有界面灵活细化pbk的模型(r1-r5)。使用pymol产生的本机模型和叠加r1-r5的结构比较如图4所示。由pbk产生的灵活性由循环突出显示。然后使用相同的对接算法(rosettaligand对接)生成每个受体模型(天然模型和r1-r5)的gpcr-配体(cvx15)复合物的一千个构象。
从原始模型预测的lrmsd分布和由pbk精炼的界面灵活模型如图4所示。结果表明,从接口精制模型(r1-r5)开始,对接算法产生比使用未精制受体模型产生的lrmsd复合物更低的lrmsd复合物。
3.2coref与rl的性能比较
本实施例中使用相同的起始受体结构,相同的配体结构,相同的起始配体位置,并产生相同数量的decoys来比较coref和rl的性能。
表2中列出的十二种起始受体结构以星形开始,六个cxcr4目标中的四个和六个d3目标中的五个显示出比使用rl获得的lrmsd更低的lrmsd。然而,lrmsd的改进非常有限(少于
表2.测试数据集中模型的名称和lrmsd
(标有*号的模型用于比较core和rl的性能)
在本实施例中,通过基于rosetttaligand平台的两个细化方案提出对接界面的灵活性的组合细化(coref)方法,第一个细化方法通过平行不同的运动产生多个初始受体,来模拟观察到的在配体构象附近的结合位点附近的骨架的同时波动;第二个细化方案为界面残基添加配体构象的骨架细化步骤,扩展了rosetttaligand对接算法。
由于集成了两种具有和不具有配体结构的骨架柔性建模协议,所以coref拓宽了具有或不具有配体结构的单一协议无法获得的构象采样空间。
coref以并行方式结合了rosetta骨干运动,而不是在不同预测阶段顺序交替不同运动的传统方式,这使得从不同移动导出的构象搜索智能能够同时协作。
rlex在rosetta的对接协议中增加了界面细化步骤,以模拟配体诱导拟合的结构变化,所有这些功能帮助coref实现更好的预测精度。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 5‑HT2B拮抗剂的制造方法与工艺
- 1‑(噻唑‑2‑基)哌啶‑4‑醇的合成方法与制造工艺
- 一种大麻酚类化合物的合成方法与制造工艺
- 一类对GPR84具有激动作用的化合物及其制备方法和用途与制造工艺
- eGFP标记GPR120阳性细胞的小鼠模型构建方法
- 靶向生长抑素受体的Al<sup>18</sup>F?NOTA?PEG<sub>6</sub>?TATE及其制备方法和应用
- 吡咯烷衍生物的口服制剂的制作方法
- 胰高血糖素样肽-1受体激动剂制备治疗肺动脉高压药物的应用
- 一种armc5基因检测试剂盒及突变位点的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法