通过质谱法定量胰岛素的制作方法与工艺
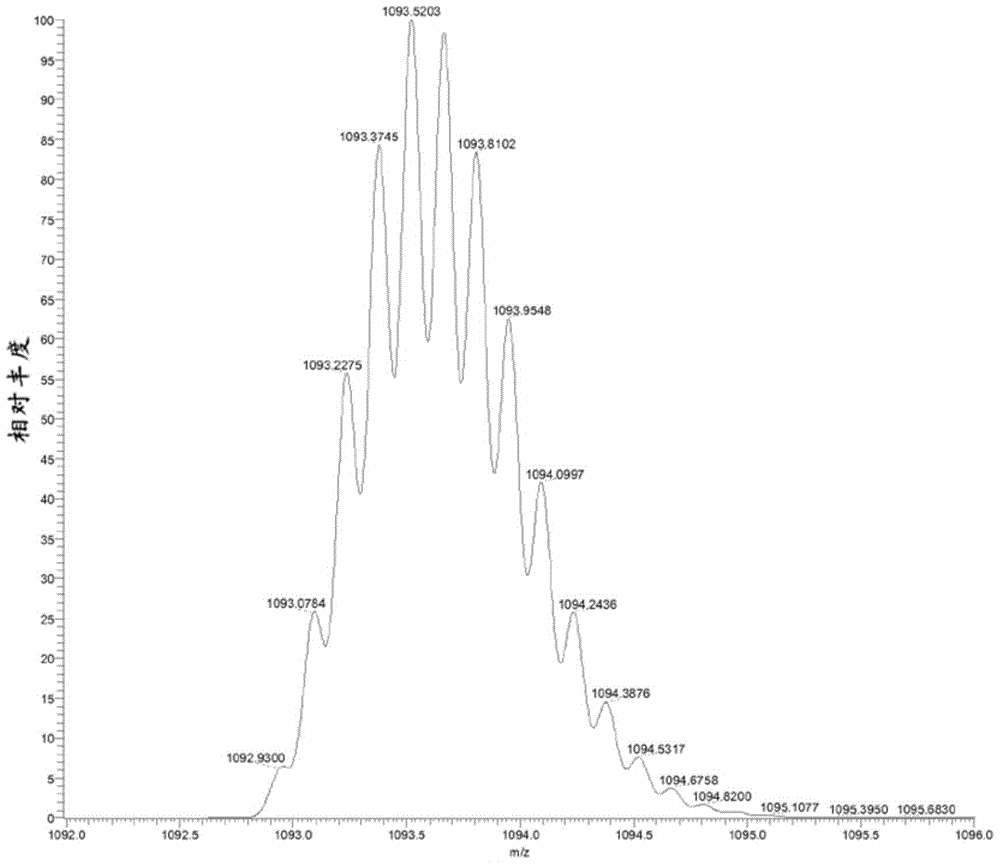
通过质谱法定量胰岛素相关专利申请案本申请要求2010年12月28日提交的美国临时申请No.61/427,749的权益,该临时申请以引用的方式整体并入本文以用于所有用途。发明领域本发明涉及胰岛素的定量测量。在具体方面,本发明涉及通过质谱法定量测量胰岛素的方法。发明背景以下对发明背景的描述仅仅作为理解本发明的帮助而提供并不承认是描述或组成本发明的现有技术。胰岛素是由表示为A链和B链,通过半胱氨酸残基之间的二硫桥键连接的两条链中的51个氨基酸组成的小肽。人胰岛素的摩尔质量为约5607.4amu。A链具有21个氨基酸而B具链有30个氨基酸。胰岛素是对于调节体内脂肪和类固醇代谢至关重要的激素。当餐后血糖水平升高时,胰岛素释放至血流中并允许葡萄糖从循环转运至细胞中。胰岛素生成或利用的缺陷导致糖尿病。常常施用胰岛素治疗糖尿病。糖尿病及其并发症代表主要公共健康问题。因此,糖尿病和糖尿病前期患者样品中胰岛素的定量作为诊断工具和检测患者治疗均很重要。已将免疫学技术广泛用于胰岛素定量(参见例如,Manley等,ClinChem.,2007,53:922-32),并且已经报道了若干种检测和/或定量胰岛素的质谱方法。参见例如,R.等,Diabetes1997,46:44-50(报道了通过免疫亲和色谱法-固相萃取-HPLC-单一质谱法定量血清样品中的胰岛素);Darby,S.M.等,J.AnalToxicol2001,25:8-14(报道了高生理水平下对血浆中胰岛素的SPE-HPLC-MS定量);Fierens,C.等,RapidCommun.MassSpectrom.2001,15:1433-41(报道了通过HPLC-(ESI)MS/MS检测水溶液中的胰岛素);Magnes,C.等,2004年5月第52次ASMS会议(报道了通过高分辨率/高精度质谱法定量血清中的胰岛素);Thevis,M.等,Anal.Chem.,2005,77:3579-85(报道了用于定量来自血浆的胰岛素并检测胰岛素B链的免疫亲和色谱法-固相萃取-HPLC-串联质谱法);Thevis,M.等,Anal.Chem.,2006,77:3579-85和Thomas,A.等,Anal.Chem.,2007,79:2518-24(报道了用于定量来自血浆的胰岛素并检测胰岛素B链的固相萃取-免疫亲和色谱法-固相萃取-HPLC-串联质谱法);Uytfanghe,K.等,RapidCommMassSpectrom.,2007,21:819-821(报道了用于定量来自血清的胰岛素的免疫亲和色谱法-固相萃取-HPLC-串联质谱法);Rodríguez-Cabaleiro,D.等,ClinChem.,2007,53:1462-69(报道了用于定量来自血浆的胰岛素并检测胰岛素B链的免疫亲和色谱法-固相萃取-HPLC-串联质谱法);Thevis,M.等,MassSpectrom.Reviews,2008,27:35-50(报道了用于定量来自血浆的胰岛素并检测胰岛素B链的免疫亲和色谱法-固相萃取-HPLC-串联质谱法);和Guedes,S.,J.AmSocMassSpectrom,2009,20:1319-26。发明概述本发明提供了一种通过质谱法测定样品中胰岛素的量的方法。在一个方面,所述方法利用串联质谱法。在一些串联质谱法实施方案中,所述方法用于测定取自人类时的生物样品中胰岛素的量。在一些实施方案中,所述方法包括:(a)使样品经受固相萃取(SPE)和高效液相色谱法(HPLC)以由样品获得富含胰岛素的成分;(b)在适合生成可通过质谱法检测的一种或多种胰岛素离子的条件下使富集的胰岛素经受电离源;(c)通过串联质谱法测定一种或多种胰岛素离子的量,其中所述样品在电离之前未经受免疫纯化。在这些实施方案中,使用步骤(c)中测定的所述一种或多种离子的量测定样品中胰岛素的量。在一些实施方案中,在正离子模式下电离之前使所述样品经受酸性条件。在一些相关实施方案中,使所述样品经受酸性条件包括使富集的胰岛素经受甲酸。在一些相关实施方案中,步骤(c)中测定的一种或多种离子包括选自质荷比(m/z)为1162.5±0.5和968.9±0.5的离子的胰岛素前体离子。在另外的相关实施方案中,步骤(c)中测定的一种或多种离子包括选自m/z为226.2±0.5和135.9±0.5的离子的一种或多种碎片离子。在其它相关实施方案中,一种或多种碎片离子包括来自m/z为1162.5±0.5的胰岛素前体离子的一种或多种碎片离子和来自m/z为968.9±0.5的胰岛素前体离子的一种或多种碎片离子。在相关实施方案中,来自每种前体离子的一种或多种碎片离子包括选自m/z为226.2±0.5和135.9±0.5的离子的一种或多种碎片离子。在一些实施方案中,在正离子模式下电离之前使所述样品经受碱性条件。在一些相关实施方案中,使所述样品经受碱性条件包括使样品经受氨。在一些相关实施方案中,步骤(c)中测定的一种或多种离子包括选自m/z为1453.8±0.5和1163.0±0.5的离子的胰岛素前体离子。在另外的相关实施方案中,步骤(c)中测定的一种或多种离子包括选自m/z为226.2±0.5和135.9±0.5的离子的一种或多种碎片离子。在其它相关实施方案中,一种或多种碎片离子包括来自m/z为1453.8的胰岛素前体离子的一种或多种碎片离子和来自质荷比为1163.0±0.5的胰岛素前体离子的一种或多种碎片离子。在利用串联质谱法测定样品中胰岛素的量的一些实施方案中,所述方法包括:(a)通过萃取技术使样品中的胰岛素富集;(b)使来自步骤(a)的纯化胰岛素经受高效液相色谱法(HPLC)以从样品获得富含胰岛素的成分;(c)在适合生成可通过质谱法检测的胰岛素前体离子的条件下使富集的胰岛素经受电离源,其中胰岛素前体离子的m/z为1162.5±0.5;(d)在约40-70eV范围内的碰撞能下使胰岛素前体离子经受碰撞诱导解离以生成可通过质谱法检测的一种或多种碎片离子;以及(e)通过质谱法测定一种或多种所述碎片离子的量。在这些实施方案中,步骤(e)中测定的离子的量与所述样品中胰岛素的量有关。在一些实施方案中,萃取技术为固相萃取(SPE)。在一些实施方案中,在正离子模式下电离之前使所述样品经受酸性条件。在一些相关实施方案中,使所述样品经受酸性条件包括使样品经受甲酸。在替代实施方案中,在电离之前使所述样品经受碱性条件。在一些相关实施方案中,使所述样品经受碱性条件包括氨。在一些实施方案中,碰撞能在约40-60eV范围内,例如在约40-50eV范围内。在一些实施方案中,步骤(d)中生成的一种或多种碎片离子包括选自m/z为226.2±0.5和135.9±0.5的离子的一种或多种离子。在利用串联质谱法测定取自人类时的生物样品中胰岛素的量的一些实施方案中,所述方法包括:(a)使样品经受适合由胰岛素生成胰岛素A链的条件;(b)使来自步骤(a)的样品经受固相萃取(SPE)和高效液相色谱法(HPLC)以获得富含胰岛素A链的成分;(c)在适合生成可通过质谱法检测的一种或多种胰岛素A链离子的条件下使富集的胰岛素A链经受电离源;(d)通过串联质谱法测定一种或多种胰岛素A链离子的量。在这些实施方案中,步骤(d)中测定的离子的量与所述样品中胰岛素的量有关。在一些相关实施方案中,在正离子模式下电离之前使样品经受酸性条件。在一些相关实施方案中,使样品经受酸性条件包括使所述样品经受甲酸。在一些实施方案中,在电离之前未经化学修饰步骤(a)中生成的胰岛素A链。在一些相关实施方案中,步骤(d)中测定的所述一种或多种离子包括选自m/z为1192.9±0.5和795.4±0.5的离子的胰岛素A链前体离子。在一些相关实施方案中,步骤(d)中测定的所述一种或多种离子包括选自m/z为513.0±0.5、399.0±0.5、236.0±0.5和133.0±0.5的离子的一种或多种碎片离子。在一些相关实施方案中,步骤(d)中测定的所述一种或多种离子包括来自m/z为1192.9±0.5的胰岛素A链前体离子的一种或多种碎片离子和来自m/z为795.4±0.5的胰岛素A链前体离子的一种或多种碎片离子。在一些相关实施方案中,来自每种前体离子的所述一种或多种碎片离子包括选自m/z为513.0±0.5、399.0±0.5、236.0±0.5和133.0±0.5的离子的一种或多种碎片离子。在替代实施方案中,所述方法进一步包括在电离之前化学修饰步骤(a)中生成的胰岛素A链。在一些实施方案中,化学修饰包括烷基化胰岛素A链。在另外的相关实施方案中,步骤(d)中测定的一种或多种离子包括选自m/z为1306.0±0.5和871.0±0.5的离子的烷基化胰岛素A链前体离子。在其它相关实施方案中,步骤(d)中测定的一种或多种离子包括选自m/z为570.0±0.5、456.0±0.5、293.0±0.5和133.0±0.5的离子的一种或多种碎片离子。在其它相关实施方案中,步骤(d)中测定的一种或多种离子包括来自m/z为1306.0±0.5的烷基化胰岛素A链前体离子的一种或多种碎片离子和来自m/z为871.0±0.5的烷基化胰岛素A链前体离子的一种或多种碎片离子。在一些相关实施方案中,来自每种烷基化前体离子的一种或多种碎片离子包括选自m/z为570.0±0.5、456.0±0.5、293.0±0.5和133.0±0.5的离子的一种或多种碎片离子。在一些相关实施方案中,利用串联质谱法测定生物样品中胰岛素的量。在这些实施方案中,所述方法包括:(a)使样品经受适合由胰岛素生成胰岛素B链的条件;(b)处理来自步骤(a)的样品以获得富含胰岛素B链的成分;(c)在适合生成可通过质谱法检测的一种或多种胰岛素B链离子的条件下使富集的胰岛素B链经受电离源;(d)通过串联质谱法测定一种或多种胰岛素B链离子的量。在这些实施方案中,步骤(d)中测定的离子的量与样品中胰岛素的量有关。在一些实施方案中,步骤(b)的处理包括通过固相萃取(SPE)、高效液相色谱法(HPLC)或二者使胰岛素B链富集。在使用SPE和HPLC的一些相关实施方案中,两种富集技术可以在线方式进行。在一些实施方案中,生物样品包括人血浆或血清样品。在一些相关实施方案中,当取自人类时,测定的胰岛素的量是样品中存在的胰岛素的量。在一些实施方案中,电离源是电喷雾电离(ESI)源,例如加热ESI源。在一些实施方案中,在正离子模式下电离之前使样品经受酸性条件。在一些相关实施方案中,使样品经受酸性条件包括使所述样品经受甲酸。在一些实施方案中,在电离之前未经化学修饰胰岛素B链。在一些相关实施方案中,步骤(d)中测定的一种或多种离子包括选自m/z为1144.2±0.5、858.3±0.5和686.8±0.5的离子的胰岛素B链前体离子。在一些相关实施方案中,步骤(d)中测定的一种或多种离子包括选自m/z为906.0±0.5、825.0±0.5、768.5±0.5、753.0±0.5、703.0±0.5、345.0±0.5和226.2±0.5的离子,例如m/z为768.5±0.5、753.0±0.5、345.0±0.5和226.2±0.5的离子,例如m/z为768.5±0.5和753.0±0.5的离子的一种或多种碎片离子。在一些实施方案中,步骤(d)中测定的一种或多种离子包括选自以下的两种或更多种碎片离子:来自m/z为1144.2±0.5的胰岛素B链前体离子的碎片离子,来自m/z为858.3±0.5的胰岛素B链前体离子的碎片离子和来自m/z为686.8±0.5的胰岛素B链前体离子的碎片离子。在一些实施方案中,串联质谱法包括生成质荷比(m/z)为686.8±0.5的人胰岛素B链前体离子并将前体离子破碎成选自m/z为906.0±0.5、825.0±0.5、768.5±0.5、753.0±0.5、703.0±0.5、345.0±0.5和226.2±0.5的离子的一种或多种碎片离子,例如选自768.5±0.5和753.0±0.5的一种或多种碎片离子。在一些实施方案中,串联质谱法包括以在10-25V范围内且包括10V和25V的碰撞能破碎前体离子。在替代实施方案中,在电离之前化学修饰胰岛素B链。在一些实施方案中,化学修饰包括烷基化所述胰岛素B链。在一些实施方案中,步骤(d)中测定的一种或多种离子包括选自m/z为1181.9±0.5、886.9±0.5和709.8±0.5的离子的烷基化胰岛素B链前体离子。在一些实施方案中,步骤(d)中测定的一种或多种离子包括选自m/z为345.0±0.5和226.2±0.5的离子的一种或多种碎片离子。在一些实施方案中,步骤(d)中测定的一种或多种离子包括选自以下的两种或更多种碎片离子:来自质荷比(m/z)为1181.9±0.5的烷基化胰岛素B链前体离子的碎片离子,来自m/z为886.9±0.5的烷基化胰岛素B链前体离子的碎片离子和来自m/z为709.8±0.5的烷基化胰岛素B链前体离子的碎片离子。在一些相关实施方案中,来自每种前体离子的碎片离子包括选自m/z为345.0±0.5和226.2±0.5的离子的离子。在第二方面,本文提出的某些方法利用高分辨率/高精度质谱法来测定样品中胰岛素的量。在利用高分辨率/高精度质谱法的一些实施方案中,所述方法包括:(a)在适合生成多电荷胰岛素离子的条件下,使来自样品的胰岛素经受电离源,其中可通过质谱法检测胰岛素离子;以及(b)通过高分辨率/高精度质谱法测定一种或多种多电荷胰岛素离子的量。在这些实施方案中,步骤(b)中测定的一种或多种离子的量与样品中胰岛素的量有关。在一些实施方案中,在10,000或更高的FWHM和50ppm的质量精度下进行高分辨率/高精度质谱法。在一些实施方案中,用高分辨率/高精度飞行时间(TOF)质谱仪进行所述高分辨率/高精度质谱法。在一些实施方案中,电离条件包括在酸性条件下电离胰岛素。在一些相关实施方案中,酸性条件包括在电离之前用甲酸处理所述样品。在一些实施方案中,多电荷胰岛素离子选自4+、5+和6+电荷胰岛素离子。在一些实施方案中,一种或多种呈6+电荷态的胰岛素离子包括m/z在约968.0±1.5范围内的一种或多种离子。一种或多种呈6+电荷态的胰岛素离子包括选自m/z为968.28±0.1、968.45±0.1、968.62±0.1、968.79±0.1、968.95±0.1、969.12±0.1、969.28±0.1、969.45±0.1、969.61±0.1的离子的一种或多种离子;例如m/z为968.95±0.1的离子。在一些实施方案中,一种或多种呈5+电荷态的胰岛素离子包括m/z在约1162.5±1.0范围内的一种或多种离子。在一些实施方案中,一种或多种呈5+电荷态的胰岛素离子包括选自m/z为1161.72±0.1、1161.92±0.1、1162.12±0.1、1162.32±0.1、1162.52±0.1、1162.72±0.1、1162.92±0.1、1163.12±0.1和1163.32±0.1的离子的一种或多种离子;例如m/z为1162.54±0.1的离子。在一些实施方案中,一种或多种呈4+电荷态的胰岛素离子包括m/z在约1452.9±0.8范围内的一种或多种离子。在本文所述任何方法中,样品可包括生物样品。在一些实施方案中,生物样品可包括生物流体,例如尿、血浆或血清。在一些实施方案中,生物样品可包括来自人类的样品;例如来自成年男性或女性,或青少年男性或女性,其中青少年在18岁以下,15岁以下,12岁以下或10岁以下。可分析人类样品以诊断或监测疾病状态或病状,或监测疾病状态或病状治疗的疗效。在一些相关实施方案中,本文所述方法可用于测定取自人类时的生物样品中胰岛素的量。在利用串联质谱法的实施方案中,可通过本领域已知的任何方法进行串联质谱法,包括例如多反应监测、前体离子扫描或产物离子扫描。在一些实施方案中,串联质谱法包括将前体离子破碎成一种或多种碎片离子。在测定两种或更多种碎片离子的量的实施方案中,可使所述量进行本领域已知的任何数学运算以便使测量的离子量与样品中胰岛素的量相关。例如,可对两种或更多种碎片离子的量求合以作为测定样品中胰岛素的量的一部分。在本文所述任何方法中,可在电离之前通过高效液相色谱法(HPLC)从样品中纯化目标分析物(例如,胰岛素、经化学修饰或未经修饰的胰岛素A链或经化学修饰或未经修饰的胰岛素B链)。在本文所述任何方法中,可通过萃取技术,例如使样品经由固相萃取(SPE)柱,从样品中纯化目标分析物。在一些实施方案中,萃取技术不是免疫纯化技术。具体地,在一些实施方案中,SPE柱不是免疫亲和柱。在一些实施方案中,在所述方法的任何时候都不适用免疫纯化。在一些实施方案中,可以在线方式进行萃取技术和HPLC以允许自动化样品处理和分析。在一些实施方案中,在大于或等于约10,000,例如大于或等于约15,000,例如大于或等于约20,000,例如大于或等于约25,000的分辨力(FWHM)下进行高分辨率/高精度质谱法。在一些实施方案中,在小于或等于约50ppm,例如小于或等于约20ppm,例如小于或等于约10ppm,例如小于或等于约5ppm,例如小于或等于约3ppm的精度下进行高分辨率/高精度质谱法。在一些实施方案中,在大于或等于约10,000的分辨力(FWHM)和小于或等于约50ppm的精度下进行高分辨率/高精度质谱法。在一些实施方案中,分辨力大于约15,000而精度小于或等于约20ppm。在一些实施方案中,分辨力大于或等于约20,000而精度小于或等于约10ppm;优选分辨力大于或等于约20,000而精度小于或等于约5ppm,例如小于或等于约3ppm。在一些实施方案中,用轨道阱质谱仪、飞行时间(TOF)质谱仪或傅里叶变换离子回旋共振质谱仪(有时称为傅里叶变换质谱仪)进行高分辨率/高精度质谱法。在一些实施方案中,可通过高分辨率/高精度质谱法检测的所述一种或多种胰岛素离子是选自m/z在约1452.9±0.8、1162.5±1和968.8±1.5范围内的离子的一种或多种离子。这些范围内的离子分别对应带4+、5+和6+电荷的胰岛素离子。带这些电荷的单一同位素离子主要属于所提及的m/z范围。然而,低丰度天然同位素变体可能出现在这些范围外。1162.5±1范围内的胰岛素离子优选包括m/z为约1161.72±0.1、1161.92±0.1、1162.12±0.1、1162.32±0.1、1162.52±0.1、1162.72±0.1、1162.92±0.1、1163.12±0.1、1163.32±0.1的胰岛素离子;例如m/z为1162.54±0.1的离子。968.8±1.5范围内的胰岛素离子优选包括m/z为约968.28±0.1、968.45±0.1、968.62±0.1、968.79±0.1、968.95±0.1、969.12±0.1、969.28±0.1、969.45±0.1、969.61±0.1的胰岛素离子;例如m/z为968.95±0.1的离子。在一些实施方案中,将通过质谱法检测的一种或多种胰岛素离子的量与样品中胰岛素蛋白的量联系起来包括与内标比较;例如人或非人类胰岛素蛋白。可任选地用同位素标记内标。在本文提出的任何方法中,样品可包括生物样品;优选体液样品,包括(例如)血浆或血清。可在正电子模式下进行质谱法(串联或高分辨率/高精度)。或者,可在负电子模式下进行质谱法。可使用各种电离源,包括(例如)大气压化学电离(APCI)或电喷雾电离(ESI)源电离胰岛素。在一些实施方案中,在正电子模式下通过ESI电离胰岛素和/或经化学修饰或未经修饰的胰岛素A链或胰岛素B链。在本文提出的任何方法中,可在样品中提供可单独检测的内标,也测定了样品中内标的量。在利用可单独检测的内标的实施方案中,电离样品中存在的全部或部分目标分析物和内标以生成在质谱仪中可检测的多种离子,并通过质谱法检测各自生成的一种或多种离子。在这些实施方案中,可通过与检测的内标离子的量作比较,使目标分析物生成的离子的存在或量与样品中目标分析物的存在或量相关。或者,可通过与一种或多种外部参考标准作比较测定样品中胰岛素的量。示例性外部参考标准包括用人或非人类胰岛素、合成胰岛素类似物或其同位素标记变体示踪的空白血浆或血清。在一些实施方案中,所述方法能够测定样品中在约10μIU/mL至500μIU/mL(等于约60pmol/L至3000pmol/L,或约0.35ng/mL至17.4ng/mL),包括10μIU/mL和500μIU/mL范围内的水平的胰岛素的量。如本文所使用,除非另有说明,单数形式“一个”、“一种”和“所述”包括复数个指示物。因此,例如,提到“一种蛋白质”包括多个蛋白质分子。如本文所使用,术语“纯化”和“富集(enriching)”并不指从样品中去除除目标分析物外的所有物质。相反,这些术语指使一种或多种目标分析物的量相对于样品中可能干扰目标分析物的检测的其它组分富集的过程。通过各种方式纯化样品可使一种或多种干扰物质,例如可能或可能不干扰通过质谱法检测所选母离子或子离子的一种或多种物质相对减少。当使用该术语时,相对减少不需要通过纯化完全去除待纯化材料中与目标分析物一起存在的任何物质。如本文所使用,术语“免疫纯化”指利用抗体,包括多克隆或单克隆抗体,使所述一种或多种目标分析物富集的纯化过程。可使用本领域众所周知的免疫纯化方法进行免疫纯化。通常,免疫纯化过程利用结合、偶联或以其它方式附着于载体,例如柱、孔、管、凝胶、胶囊、颗粒等的抗体。如本文所使用的免疫纯化包括但不限于本领域中常称为免疫沉淀的过程,以及本领域中常称为亲和色谱法或免疫亲和色谱法的过程。如本文所使用,术语“免疫颗粒”指有抗体结合、偶联或以其它方式附着于其表面(颗粒上和/或内)的胶囊、珠粒、凝胶颗粒等。在某些优选实施方案中,免疫颗粒为琼脂糖凝胶或琼脂糖珠。在替代性优选实施方案中,免疫颗粒包括玻璃珠、塑料珠或硅珠或硅胶。如本文所使用,术语“抗胰岛素抗体”指对胰岛素有亲和力的任何多克隆或单克隆抗体。在各个实施方案中胰岛素抗体对除胰岛素外的化学物类的特异性可能不同;例如在某些优选实施方案中抗胰岛素抗体对胰岛素有特异性,因此对除胰岛素外的其它化学物类有很少或没有亲和力,而在其它优选实施方案中抗胰岛素抗体无特异性,因此结合除胰岛素外的某些化学物类。如本文所使用,术语“样品”指可能含有目标分析物的任何样品。如本文所使用,术语“体液”指可从各个体内分离的任何流体。例如,“体液”可包括血液、血浆、血清、胆汁、唾液、尿、眼泪、汗等。在优选实施方案中,样品包括来自人类的体液样品;优选血浆或血清。如本文所使用,术语“固相萃取”或“SPE”指由于溶于或悬浮于溶液(即,流动相)中的组分对溶液通过或围绕的固体(即,固相)的亲和力,使化学混合物分离成组分的过程。在一些情况下,当流动相通过或围绕固相时,固相可保留流动相不需要的组分,导致对流动相中分析物的纯化。在其它情况下,固相可保留分析物,使流动相不需要的组分通过或围绕固相。在这些情况下,然后使用第二流动相将保留的分析物从固相洗脱做进一步处理或分析。SPE,包括TFLC,可通过单一或混合模式机制操作。混合模式机制利用相同柱中的离子交换和疏水保留;例如,混合模式SPE柱的固相可表现出强的阴离子交换和疏水保留;或可表现出强的阳离子交换和疏水保留。通常,SPE柱填充材料对分析物的亲和力可能是由于多种机制中的任一种,例如一种或多种化学相互作用或免疫亲和性相互作用。在一些实施方案中,不使用免疫亲和柱填充材料进行胰岛素的SPE。即,在一些实施方案中,用不是免疫亲和柱的SPE柱从样品中纯化胰岛素。如本文所使用,术语“色谱法”指由于化学实体在固定液或固相周围或上面流动时,化学实体的差异性分布,使液体或气体携带的化学混合物分离成组分的过程。如本文所使用,术语“液相色谱法”或“LC”指流体均匀地渗过细碎物质柱或渗过毛细管通道时,选择性阻滞流体溶液的一种或多种组分的过程。阻滞是由该流体相对于固定相移动时,混合物组分分布于(多个)固定相和体相流体(即,流动相)之间引起。“液相色谱法”的实例包括反相液相色谱法(RPLC)、高效液相色谱法(HPLC)和湍流液相色谱法(TFLC)(有时称为高湍流液相色谱法(HTLC)或高通量液相色谱法)。如本文所使用,术语“高效液相色谱法”或“HPLC”(有时称为“高压液相色谱法”)指通过在压力下迫使流动相通过固定相,通常为密集填充柱,提高分离程度的液相色谱法。如本文所使用,术语“湍流液相色谱法”或“TFLC”(有时称为高湍流液相色谱法或高通量液相色谱法)指利用通过柱填充物的测定材料湍流作为进行分离的基础的一种色谱法形式。已经应用TFLC在通过质谱法分析之前制备含有两种不知名药物的样品。参见例如,Zimmer等,JChromatogrA854:23-35(1999);同样参见美国专利No.5,968,367、5,919,368、5,795,469和5,772,874,其进一步对TFLC进行了阐述。本领域的普通技术人员理解“湍流”。当流体缓慢平稳地流动时,将所述流称为“层流”例如,以低流速穿过HPLC柱的流体为层状。在层流中,流体颗粒的运动有序配合通常呈大体直线移动的颗粒。在更快的速率下,水的惯性克服流体摩擦力并导致湍流。未接触不规则边界的流体“超过”因摩擦减缓或因粗糙表面偏离的流体。当流体湍急地流动时,流体呈旋转涡流流动(漩涡),“拖曳力”比所述流为层状时更大。当流体流为层状或湍流时,许多参考可用于帮助测定(例如,TurbulentFlowAnalysis:MeasurementandPrediction,P.S.Bernard&J.M.Wallace,JohnWiley&Sons,Inc.,(2000);AnIntroductiontoTurbulentFlow,JeanMathieu&JulianScott,CambridgeUniversityPress(2001))。如本文所使用,术语“气相色谱法”或“GC”指汽化样品混合物并注入穿过含有由液体或固体微粒构成的固定相的柱的运载气体流(如氮气或氦气)中,并且根据化合物对固定相的亲和力分离成器组成化合物的色谱法。如本文所使用,术语“大颗粒柱”或“萃取柱”指含有平均粒径大于约50μm的色谱法。如该上下文中所使用,术语“约”指±10%。如本文所使用,术语“分析柱”指具有足够色谱板以实现样品中从柱上洗脱的物质的分离,足以允许测定分析物的存在或量的色谱柱。常常将此类柱与“萃取柱”加以区别,“萃取柱”具有从非保留物质中分离或萃取保留物质以便获得纯化样品做进一步分析的通用用途。如该上下文中所使用,术语“约”指±10%。在一个优选实施方案中,分析柱含有直径约5μm的颗粒。如本文所使用,如在“在线自动化形式”或“在线萃取”中使用的术语“在线(on-line)”和“在线(inline)”指不需要操作员干预而进行的过程。相反,如本文所使用的术语“离线(off-line)”指需要操作员人工干预的过程。因此,如果使样品沉淀,然后将上清液手动加载至自动取样器中,沉淀和加载步骤与后续步骤离线。在所述方法的各个实施方案中,可以在线自动化形式进行一个或多个步骤。如本文所使用,术语“质谱法”或“MS”指通过其质量鉴定化合物的分析技术。MS指基于其质荷比或“m/z”过滤、检测和测量的方法。MS技术通常包括(1)电离化合物以形成带电化合物;和(2)检测带电化合物的分子量并计算质荷比。可通过任何适合方式电离并检测化合物。“质谱仪”通常包括离子发生器、质量分析器和离子检测器。一般而言,电离一个或多个目标分子,并且随后将离子引入质谱仪中,其中由于磁场和电场的组合,离子在空间上跟随取决于质量(“m”)和电荷(“z”)的途径。参见例如,标题为“MassSpectrometryFromSurfaces”的美国专利No.6,204,500;标题为“MethodsandApparatusforTandemMassSpectrometry”的美国专利No.6,107,623;标题为“DNADiagnosticsBasedOnMassSpectrometry”的美国专利No.6,268,144;标题为“Surface-EnhancedPhotolabileAttachmentAndReleaseForDesorptionAndDetectionOfAnalytes”的美国专利No.6,124,137;Wright等,ProstateCancerandProstaticDiseases1999,2:264-76;和Merchant和Weinberger,Electrophoresis2000,21:1164-67。如本文所使用,“高分辨率/高精度质谱法”指用能够以足够精确性和精度测量带电物类的质荷比以确认独特化学离子的质量分析器进行的质谱法。当来自该离子的各个同位素峰易于辨别时,对于离子而言可能确认独特化学离子。确认独特化学离子所必需的特定分辨力和质量精度随离子的质量和电荷态变化。如本文所使用,术语“分辨力”或“分辨力(FWHM)”(在本领域中也称为“m/Δm50%”)指观察到的质荷比除以50%最大高度的质量峰宽度(半峰全宽,“FWHM”)。图1A-C中说明了分辨力差异的影响,其示出了m/z为约1093的离子的理论质谱。图1A示出了来自分辨力为约3000(常规四极质量分析器的典型操作条件)的质量分析器的理论质谱。如图1A所见,各个同位素峰不可辨别。通过比较,图1B示出了来自分辨力为约10,000的质量分析器的理论质谱,各个同位素峰清晰可辨别。图1C示出了来自分辨力为约12,000的质量分析器的理论质谱。在这个最高分辨力下,各个同位素峰包含小于1%的自基线的贡献。如本文所使用,关于质谱法的“独特化学离子”指具有单一原子构成的单离子。单离子可能带单个或多个电荷。如本文所使用,关于质谱法的“精度”(或“质量精度”)指仪器响应与调查离子的真实m/z的可能偏差。通常将精度表示为百万分之几(ppm)。图2A-D说明了质量精度差异的影响,其示出了对于m/z为1093.52094的理论峰值而言,测得m/z和实际m/z之间的可能差异界限。图2A示出了120ppm精度下测得m/z的可能范围。相反,图2B示出了50ppm精度下测得m/z的可能范围。图2C和2D示出了20ppm和10ppm精度下测得m/z甚至更窄的可能范围。可在能够以大于10,000、15,000、20,000、25,000、50,000、100,000或甚至更高的FWHM进行质量分析的仪器上进行本发明的高分辨率/高精度质谱法。同样,可在能够以小于50ppm、20ppm、15ppm、10ppm、5ppm、3ppm或甚至更低的精度进行质量分析的仪器上进行本发明的方法。有这些性能特征的仪器可并入某些轨道阱质量分析器、飞行时间(“TOF”)质量分析器或傅里叶变换离子回旋共振质量分析器。在优选实施方案中,用包括轨道阱质量分析器或TOF质量分析器的仪器进行所述方法。术语“轨道阱”描述了由桶形外电极和同轴内电极组成的离子阱。将离子切线注入电极之间的电场中并且因为当离子沿同轴内电极轨道运行时,离子和电极之间的静电相互作用被离心力平衡而捕获离子。当离子沿同轴内电极轨道运行时,捕获离子的轨迹在相对于离子质荷比的谐振频率下沿中心电极的轴振荡。检测轨道振荡频率允许将轨道阱用作具有高精度(低至1-2ppm)和高分辨力(FWHM)(高达约200,000)的质量分析器。在以引用方式整体并入本文的美国专利No.6,995,364中详细描述了基于轨道阱的质量分析器。已经报道使用轨道阱分析器进行各种分析物的定性和定量分析。参见例如,美国专利申请公布No.2008/0118932(2007年11月9日提交);等,RapidCommun.MassSpectrom.,2008,22:477-485;LeBreton等,RapidCommun.MassSpectrom.,2008,22:3130-36;Thevis等,MassSpectrom.Reviews,2008,27:35-50;Thomas等,J.MassSpectrom.,2008,43:908-15;Schenk等,BMCMedicalGenomics,2008,1:41;和Olsen等,NatureMethods,2007,4:709-12。如本文所使用,术语“在负离子模式下操作”指生成并检测负离子的那些质谱法。如本文所使用,术语“在正离子模式下操作”指生成并检测正离子的那些质谱法。在优选实施方案中,在正离子模式下进行质谱法。如本文所使用,术语“电离”指生成具有等于一个或多个电子单位的净电荷的分析物离子的过程。负离子是具有一个或多个电子单位的净负电荷的离子,而正离子是具有一个或多个电子单位的净正电荷的离子。如本文所使用,术语“电子电离”或“EI”指气相或汽相中的目标分析物与电子流相互作用的方法。电子与分析物的碰撞生成然后可进行质谱技术的分析物离子。如本文所使用,术语“化学电离”或“CI”指试剂气体(例如氨)经受电子碰撞,并且通过试剂气体离子和分析物分子的相互作用形成分析物离子的方法。如本文所使用,术语“快原子轰击”或“FAB”指一束高能原子(常常为Xe或Ar)碰撞非挥发性样品,解吸附并电离样品中所含的分子的方法。将试样溶于粘性液体基质,例如甘油、硫代甘油、间硝基苄醇、18-冠-6-冠醚、2-硝基苯基辛基醚、环丁砜、二乙醇胺和三乙醇胺。为化合物或样品选择适当的基质是经验性过程。如本文所使用,术语“基质辅助激光解吸电离”或“MALDI”指将非挥发性样品暴露于激光照射,通过各种电离途径,包括光致电离、质子化、去质子化和集团衰变,解吸附并电离样品中的分析物的方法。对于MALDI而言,将样品与吸能基质混合,促进分析物分子的解吸附。如本文所使用,术语“表面增强激光”解吸电离”或“SELDI”指将非挥发性样品暴露于激光照射,通过各种电离途径,包括光致电离、质子化、去质子化和集团衰变,解吸附并电离样品中的分析物的另一种方法。对于SELDI而言,通常使样品与优先保留一种或多种目标分析物的表面结合。与MALDI一样,这个过程也可采用吸能材料促进电离。如本文所使用,术语“电喷雾电离”或“ESI”指使溶液沿末端施加了高正或负电位的长度较短的毛细管通过的方法。使到达管末端的溶液蒸发(雾化)成于溶剂蒸汽中非常小的溶液液滴射流或喷雾。这种雾滴流过蒸发室。当液滴变小时,电气表面电荷密度增大,直至相同电荷之间的自然排斥引起离子以及中性分子被释放。如本文所使用,术语“大气压化学电离”或“APCI”指类似于ESI的质谱法;然而,APCI通过在大气压下血浆内发生的离子-分子反应生成离子。通过喷雾毛细管和对电极之间的放电保持血浆。然后通常通过使用一组差动泵送撇渣器阶段将离子萃取至质量分析器中。可使用逆流的干燥预热N2气体提高溶剂的去除。APCI中的气相电离可比ESI分析低极性物类更有效。如本文所使用,术语“大气压光致电离”或“APPI”指分子M电离的机制是光子吸收和电子发射以形成分子离子M+的质谱法形式。因为光子能量通常仅高于电离电位,所以分子离子不易受解离影响。在许多情况下,分析样品可能不需要色谱法,从而节约了大量时间和费用。在水蒸汽或质子溶剂存在下,分子离子可吸取H形成MH+。这往往在M具有高质子亲和力时发生。因为M+和MH+的总和为常数,所以这并不影响定量精度。通常观察到质子溶剂中的药物化合物为MH+,然而非极性化合物,例如萘或睾酮通常形成M+。参见例如,Robb等,Anal.Chem.2000,72(15):3653-3659。如本文所使用,术语“电感耦合等离子体”或“ICP”指在足够高的温度下,样品与部分电离气体相互作用,以致大部分元素分裂为原子并电离的方法。如本文所使用,术语“场解吸”指将非挥发性试样置于电离表面,并使用强电场生成分析物离子的方法。如本文所使用,术语“解吸”指将分析物从分析物的表面和/或入口移至气相中。激光解吸热解吸是其中通过激光脉冲将含有分析物的样品热解吸至气相中的技术。激光打中具有金属底座的特制96孔板的背面。激光脉冲加热底座并且热量使样品转移至气相中。然后将气相样品吸入质谱仪中。如本文所使用,术语“选择性离子监测”是质谱仪的一种检测模式,其中仅检测质量范围相对狭窄,通常约一个质量单位的离子。如本文所使用,术语“多反应模式”,有时称为“选择反应监测”,是质谱仪的一种检测模式,其中选择性检测前体离子和一种或多种碎片离子。如本文所使用,术语“量化下限”、“定量下限”或“LLOQ”指测量在数量上变得有意义的点。在这个LOQ的分析物反应可识别、不连续并且可重现,相对标准偏差(RSD%)小于20%并且精度为85%-115%。如本文所使用,术语“检测限”或“LOD”指测量值大于与之相关的不确定度的点。LOD是值超过与之测量相关的不准确度的点并且定义为零浓度下平均数RSD的3倍。如本文所使用,体液样品中分析物的“量”通常指反映样品体积中可检测的分析物质量的绝对值。然而,量也涵盖与另一分析物量相比的相对量。例如,样品中分析物的量可为大于样品中一般存在的分析物的对照或正常水平的量。如本文所使用,关于定量测量(不高考离子质量的测量)的术语“约”指指示值加上或减去10%。在测定指定分析物的质量中,质谱仪可稍有变化。在离子质量或离子质/荷比上下文中的术语“约”指+/-0.50个原子质量单位。上述本发明的概述是非限制性的,通过以下对本发明的详细描述和权利要求书,本发明的其它特征和优点将显而易见。附图详述图1A-C示出了通过分辨力为约3000(图1A)、约10,000(图1B)和约12,000(图1C)的质量分析器分析的m/z为约1093的离子的理论质谱。图2A-D示出了在为1093.52094的m/z下,在120ppm质量精度(图2A)、50ppm质量精度(图2B)、20ppm质量精度(图2C)和10ppm质量精度(图2D)下,仪器反应与研究理论峰值的离子的真实m/z的可能偏差。图3A和B分别示出了在酸性和碱性条件下,通过ESI离子正离子模式电离人胰岛素收集的示例光谱。实施例3中描述了详情。图4A示出了用QTOF质谱仪生成的人胰岛素约900-1200m/z范围的示例光谱。图4B示出了用QTOF质谱仪生成的来自反萃血清样品基质的污染物峰。实施例4中描述了详情。图5A示出了用QTOF质谱仪生成的人胰岛素约1154-1177m/z范围的示例性高分辨率/高精度光谱。图5B示出了约1159-1166m/z范围的展开图。实施例4中描述了详情。图6A示出了用QTOF质谱仪生成的人胰岛素约964-973m/z范围的示例性高分辨率/高精度光谱。图6B示出了约967-971m/z范围的展开图。实施例4中描述了详情。图7示出了用胰岛素高分辨率/高精度MS测量的示踪模拟血清标准中人胰岛素定量的线性图线。实施例4中描述了详情。图8示出了用胰岛素高分辨率/高精度MS测量的示踪反萃血清标准中人胰岛素定量的线性图线。实施例4中描述了详情。图9示出了显示生成呈5+和6+电荷态的人胰岛素的串联质谱Q1扫描。实施例5中描述了详情。图10示出了显示来自破碎呈6+电荷态的人胰岛素前体离子的产物离子扫描。实施例5中讨论了详情。图11示出了显示来自破碎呈5+电荷态的人胰岛素前体离子的产物离子扫描。实施例5中讨论了详情。图12示出了在不同碰撞能下破碎6+和5+人胰岛素前体离子生成的选择碎片离子的相对强度。实施例5中讨论了详情。图13示出了显示两种可能的人胰岛素A链前体离子(呈2+和3+电荷态)和两种可能的人胰岛素B链前体离子(呈3+和4+电荷态)的复合光谱。实施例6中讨论了详情。图14示出了显示生成呈3+、4+和5+电荷态的可能人胰岛素B链前体离子的串联质谱Q1扫描。实施例6中描述了详情。图15示出了在不同碰撞能下破碎3+人胰岛素A链前体离子生成的选择碎片离子的相对强度。实施例6中讨论了详情。图16示出了来自破碎呈4+电荷态的人胰岛素B链前体离子的产物离子扫描。实施例6中讨论了详情。图17示出了来自破碎呈3+电荷态的人胰岛素B链前体离子的产物离子扫描。实施例10中讨论了详情。图18示出了在不同碰撞能下破碎3+人胰岛素B链前体离子生成的选择碎片离子的相对强度。实施例10中讨论了详情。图19示出了用于通过人胰岛素B链的串联质谱法评估患者血清样品中人胰岛素的LLOQ的图。实施例12中讨论了详情。图20示出了用人胰岛素B链的串联质谱法测量的示踪反萃血清样品中人胰岛素定量的线性图线。实施例13中描述了详情。发明详述描述了测定样品中胰岛素的量的方法。更具体地,描述了检测并量化样品中的胰岛素的质谱法。所述方法可利用固相萃取(SPE)和/或液相色谱法(LC),进行所选分析物的纯化,与质谱法(MS)相结合,从而通过检测并量化样品中的胰岛素的测定系统。优选实施方案特别适合应用于大型临床实验室进行自动化胰岛素量化测定。适合用于本发明方法中的试样包括可能含有目标分析物的任何试样。在一些优选实施方案中,样品为生物样品;即,从任何生物来源,例如动物、细胞培养物或器官培养物等获得的样品。在某些优选实施方案中,从哺乳动物,例如狗、猫、马等获得样品。特别优选的哺乳动物为灵长类动物,最优选男性或女性。优选样品包括体液,例如血液、血浆、血清、唾液、脑脊髓液或组织样品;优选血浆和血清。例如,此类样品可从患者获得;即,自身处于临床环境下进行疾病或病状的诊断、预后或治疗的活着的男人或女人。在样品包括生物样品的实施方案中,当样品从生物来源获得时,可用所述方法测定样品中胰岛素的量。本发明还涵盖用于胰岛素定量测定的试剂盒。用于胰岛素定量测定的试剂盒可包括包含本文提供的组合物的试剂盒。例如,试剂盒可包括包装材料和测定量的同位素标记内标,量足以进行至少一次测定。通常,试剂盒还将包括以有形形式记录(例如,含于纸或电子媒介上)的使用包装试剂用于胰岛素定量测定的说明书。用于本发明实施方案中的校准和QC混合血清优选使用与预期样品基质相似的基质制备,条件是基本上不存在胰岛素。质谱分析的样品制备在对质谱分析的准备中,可通过本领域已知的各种方法,包括(例如)液相色谱法、过滤、离心、薄层色谱法(TLC)、电泳(包括毛细管电泳)、亲和分离(包括免疫亲和分离)、萃取法(包括乙酸乙酯或甲醇萃取)和使用离液剂或以上的组合等使胰岛素相对于样品中的一种或多种其它组分富集。可在质谱分析之前使用的一种样品纯化方法是在柱填充材料可逆性保留目标分析物被,而不保留一种或多种其它物质的条件下,将样品施加到固相萃取(SPE)柱上。这种技术中,可采用柱保留目标分析物的第一流动相条件,并且随后可采用第二流动相条件,以便一旦洗掉未保留的物质就将保留的物质从柱上去除。在一些实施方案中,样品中的胰岛素可被可逆性保留在具有包含烷基结合表面的填充材料的SPE柱上。例如,在一些实施方案中,在质谱分析之前可使用C-8在线SPE柱(例如来自Phenomenex,Inc.的OasisHLB在线SPE柱/盒(2.1mm×20mm)或等效物)富集胰岛素。在一些实施方案中,用HPLC级0.2%含水甲酸作为洗涤液并使用0.2%于乙腈中的甲酸作为洗脱液进行SPE柱的使用。在一些实施方案中,不通过免疫亲和技术纯化胰岛素。这些实施方案中的一些利用SPE柱。在这些实施方案中,SPE柱不是免疫亲和柱。在其它实施方案中,所述方法包括在质谱分析之前免疫纯化胰岛素。可使用本领域众所周知的任何免疫纯化方法进行免疫纯化步骤。常常免疫纯化过程利用结合、偶联或附着于载体,例如柱、孔、管、胶囊、颗粒等的抗体。通常,免疫纯化方法包括(1)用抗体培养含有目标分析物的样品,以致分析物与抗体结合,(2)进行有一个或多个洗涤步骤,和(3)将分析物从抗体上洗脱。在某些实施方案中,用溶液中的游离抗体进行免疫纯化的培养步骤,随后抗体在洗涤步骤之前结合或附着于固体表面。在某些实施方案中,这可使用为抗胰岛素抗体的一次抗体和附着于对一次抗胰岛素抗体有亲和力的固体表面的二次抗体完成。在替代实施方案中,在培养步骤之前,一次抗体与固体表面结合。适当的载体包括但不限于管、载玻片、柱、珠粒、胶囊、颗粒、凝胶等。在一些优选实施方案中,载体为多孔板,例如96孔板、384孔板等。在一些实施方案中,载体为琼脂糖凝胶或琼脂糖珠或凝胶。有许多本领域众所周知的方法,通过所述方法抗体(例如,胰岛素抗体或二次抗体)可结合、附着、固定或偶联于载体上,例如,共价或非共价键吸附、亲和结合、离子键等。在一些实施方案中,使用CNBr偶联抗体,例如可使抗体与CNBr活化琼脂糖凝胶偶联。在其它实施方案中,通过抗体结合蛋白,例如蛋白质A、蛋白质G、蛋白质A/G或蛋白质L使抗体附着于载体上。免疫纯化方法的洗涤步骤通常包括洗涤载体,以致胰岛素保持与载体上的抗胰岛素抗体结合。免疫纯化的洗脱步骤通常包括添加破坏胰岛素与抗胰岛素抗体的结合的溶液。示例性洗脱液包括有机溶液、盐溶液和高或低pH溶液。可在质谱分析之前使用的另一种样品纯化方法是液相色谱法(LC)。在液相色谱技术中,可通过在流动性条件下将样品施加到色谱分析柱上纯化分析物,其中目标分析物在与一种或多种其它物质相比的差异速率下洗脱。此类过程可使所述量的一种或多种目标分析物相对于样品的一种或多种其它组分富集。某些液相色谱法,包括HPLC,依赖于相对缓慢的层流技术。传统HPLC分析依赖于柱填充物,其中通过柱的层流样品是从样品中分离目标分析物的基础。技术人员将理解,在这种柱中的分离是分隔过程并且可选择适合与C肽一起使用的LC(包括HPLC)仪器和柱。色谱分析柱通常包括促进化学组成部分的分离(即,分馏)的介质(即,填充材料)。介质可包括细微颗粒。颗粒通常包括与各种化学组成部分相互作用以促进化学组成部分的分离的结合表面。一种适合的结合表面为疏水性结合表面,例如烷基结合表面或氰基结合表面。烷基结合表面可包括C-4、C-8、C-12或C-18结合的烷基。在一些实施方案中,色谱分析柱为整体式C-18柱。色谱分析柱包括接收样品的入口和排出包括分馏样品的流出物的出口。可向入口直接供给样品,或从SPE柱,例如在线SPE柱或TFLC柱供给。在一些实施方案中,可在SPE柱和或HPLC柱前面使用在线过滤器以在样品到达SPE和/或TFLC和/或HPLC柱之前去除样品中的微粒和磷脂。在一个实施方案中,可将样品施加到LC柱的入口处,用溶剂或溶剂混合物洗脱,并且在出口处排出。可选择不同溶剂模式洗脱目标分析物。例如,可使用梯度模式、恒组成模式或多型(即混合)模式进行液相色谱法。色谱法期间,物质的分离受变量影响,例如洗脱液(也称为“流动相”)、洗脱模式、梯度条件、温度等的选择。在一些实施方案中,用HPLC富集样品中的胰岛素。可用整体式C-18柱色谱系统,例如来自PhenomenexInc.的Onyx整体式C-18柱(50×2.0mm)或等效物进行这种HPLC。在某些实施方案中,使用作为溶剂A的HPLC级0.2%含水甲酸和作为溶剂B的于乙腈中的0.2%甲酸进行HPLC。通过精心选择阀门和连接器管道,需要时可连接两个或多个色谱柱,以使材料从一个柱转到下一个柱,无需任何手动步骤。在优选实施方案中,可通过预先编程为进行必需步骤的计算机控制阀门和管道的选择。最优选,还以这种在线方式将色谱系统连接到检测器系统,例如MS系统。因此,操作员可将一盘样品放在自动取样器中,在计算机控制下进行剩余操作,导致纯化并分析选择的所有样品。在一些实施方案中,TFLC可用于在质谱分析之前纯化胰岛素。在此类实施方案中,可使用捕获分析物的TFLC柱萃取样品。然后洗脱分析物并在线转移到分析HPLC柱中。例如,可用具有大粒径(50μm)填充物的TFLC萃取盒实现样品萃取。然后在质谱分析之前,可将从这个柱上洗脱的样品在线转移至HPLC分析柱上进行进一步纯化。因为可以自动化方式将这些色谱过程中牵涉的步骤连接起来,所以可将分析物纯化期间对操作员牵涉的需要减到最少。这个特征可导致时间和成本的节约,并且消除操作员错误的机会。在一些实施方案中,可并行使用以上一种或多种纯化技术纯化胰岛素以允许同时处理多种样品。在一些实施方案中,采用的纯化技术不包括免疫纯化技术,例如免疫亲和色谱法。通过质谱法检测并定量胰岛素使用包括用于电离分馏样品并产生带电分子做进一步分析的离子源的质谱仪进行质谱分析。在各个实施方案中,可通过技术人员已知的任何方法电离胰岛素。例如,可通过电子电离、化学电离、电喷雾电离(ESI)、质子电离、大气压化学电离(APCI)、光致电离、大气压光致电离(APPI)、激光二极管热解吸(LDTD)、快原子轰击(FAB)、液态二次电离(LSI)、基质辅助激光解吸电离(MALDI)、场电离、场解吸、热喷雾/等离子喷雾电离、表面增强激光解吸电离(SELDI)、电感耦合等离子体(ICP)和粒子束电离进行胰岛素的电离。技术人员将理解,可基于待测分析物、样品类型、检测器类型、正与负模式的选择等确定电离方法的选择,可在正或负模式下电离胰岛素。在优选实施方案中,可在正离子模式下通过ESI电离胰岛素。通常在质谱技术中,在电离样品之后,可分析由此产生的带正电或负电的离子以测定质荷比(m/z)。测定m/z的各种分析器包括四极分析器、离子阱分析器、飞行时间分析器、傅里叶变换离子回旋共振质量分析器和轨道阱分析器。在Bartolucci等,RapidCommun.MassSpectrom.2000,14:967-73中描述了一些示例性离子阱方法。可使用几种检测模式检测离子。例如,即可使用选择性离子监测模式(SIM)检测选择离子,或可选地,可监测由碰撞诱导解离或中性丢失引起的质量相变,例如,多反应监测(MRM)或选择反应监测(SRM)。在一些实施方案中,使用四极分析器测定质荷比。在“四极”或“四极离子阱”仪器中,振荡射频场中的离子经历与电极之间施加的DC电位、RF信号振幅和质/荷比成比例的力。可选择电压和振幅,以致仅仅具有特定质/荷比的离子沿四极长度移动,而使所有其它离子。因此,四极仪器可用作注入仪器中的离子的“滤质器”和“质量检测器”。当离子与检测器碰撞时,它们产生转化为数字信号的电子脉冲。将所需数据转发至计算机,计算机绘制收集离子计数与时间的图。所得质量色谱图与传统HPLC-MS方法中生成的色谱图类似。可测量与特定离子相对应的峰下面积或此类峰值的振幅并且与目标分析物的量相关联。在某些实施方案中,测量碎片离子和/或前体离子的曲线下面积或峰值振幅以测定胰岛素的量。可使用校准标准曲线,基于内部或外部分子标准的一种或多种离子的峰值,将指定离子的相对丰度转化为原始分析物的量。可通过“串联质谱法”或“MS/MS”提高采用某些质谱分析器的MS技术的分辨率。在这种技术中,可在MS仪器中过滤由目标分子生成的前体离子(也称为母离子),随后破碎驱离子以产生一个或多个碎片离子(也称为子离子或产物离子),然后在第二个MS过程中分析所述碎片离子。通过精心选择前体离子,仅使某些分析物产生的离子通过到达破碎室,在那里与惰性气体原子的碰撞产生碎片离子。因为在一系列指定电离/破碎条件下以可重现方式生成前体和碎片离子,所以MS/MS技术可提供极其强大的分析工具。例如,过滤/破碎的组合可用于消除干扰物质,并且可能在复合样品,例如生物样品中特别有用。在某些实施方案中,采用具有多个四极分析器的质谱仪(例如三级四极仪器)进行串联质谱分析。在使用MS/MS技术的某些实施方案中,分离前体离子做进一步破碎,并且使用碰撞活化解离(CAD)由前体离子生成碎片离子做进一步检测。在CAD中,前体离子通过与惰性气体的碰撞获得能量,随后通过称为“单分子分解”的过程破碎。必须在前体离子中存积足够能量,以致由于振动能增大,可破坏离子中的某些键。在一些实施方案中,如下使用MS/MS检测和/或量化样品中的胰岛素。通过首先使样品经受SPE,然后经受液相色谱法,优选HPLC使胰岛素在样品中富集;来自色谱分析柱的液体溶剂流进入MS/MS分析器的加热喷雾器接口;并且在接口的加热带电管道内将溶剂/分析物混合物转化为蒸汽。在这些过程期间,分析物(即,胰岛素)电离。离子,例如前体离子,通过仪器口并且进入第一个四极。四极1和3(Q1和Q3)为滤质器,允许基于其质荷比(m/z)选择离子(即,分别选择Q1和Q3中的“前体”和“碎片”离子)。四极2(Q2)是碰撞室,在碰撞室内破碎离子。质谱仪的第一个四极(Q1)选择具有胰岛素离子的m/z的分子。使具有恰当m/z的前体离子进入碰撞室(Q2),而具有任何其它m/z的不合需要的离子与四极的侧面碰撞并且被消除。进入Q2的前体离子与中性气体分子(例如氩分子)碰撞并且破碎。使生成的碎片离子进入四极3(Q3),在四极3中选择碎片离子进行检测。电离胰岛素可产生多电荷前体离子(例如4+、5+、6+前体离子等)。电离条件,特别是电喷雾技术中利用的缓冲液的pH,严重影响生成的胰岛素前体离子的同一性和量。例如,在酸性条件下,正电喷雾电离可能主要生成m/z分别为1162.5±0.5和968.5±0.5的5+和6+电荷胰岛素前体离子。然而,在碱性条件下,正电喷雾电离可能主要生成m/z分别为1453.75±0.5和1162.94±0.5的4+和5+电荷胰岛素前体离子。所述方法可利用酸性或碱性条件;优选酸性条件。所述方法可包括在正或负离子模式下进行的MS/MS;优选正离子模式。在某些实施方案中,电喷雾缓冲液为酸性并且Q1选择用于m/z为约1162.5±0.5或968.5±0.5的胰岛素前体离子。破碎这些胰岛素前体离子中的任一种生成m/z为约226.21±0.5和/或135.6±0.5的碎片离子。因此,在Q1选择用于选自m/z为约1162.5±0.5和968.5±0.5的离子的一种或多种胰岛素前体离子的实施方案中,Q3可选择选自m/z为约226.21±0.5和135.6±0.5的离子的一种或多种碎片离子。在某些实施方案中,可测量来自单个前体离子的单个碎片离子的相对丰度。或者,可测量自单个前体离子的两个或更多个碎片离子的相对丰度。在这些实施方案中,可使每个碎片离子的相对丰度受任何已知数学处理以定量评估最初样品中的胰岛素。在其它实施方案中,可测量来自两个或更多个前体离子的一个或多个碎片离子并如以上用于定量评估最初样品中的胰岛素。操作可用于某些实施方案中的串联质谱仪的替代模式包括产物离子扫描和前体离子扫描。这些操作模式的描述,参见例如,E.MichaelThurman等,Chromatographic-MassSpectrometricFoodAnalysisforTraceDeterminationofPesticideResidues,第8章(AmadeoR.Fernandez-Alba编辑,Elsevier2005)(387)。在其它实施方案中,高分辨率/高精度质量分析器可用于根据本发明的方法定量分析胰岛素。为达到定量结果可接受的精确度,质谱仪必须能够对目标离子表现出10,000或更大的分辨力(FWHM),精度为约50ppm或更低;优选质谱仪表现出18,000或更佳的分辨力(FWHM),精度为约5ppm或更低;例如20,000或更佳的分辨力(FWHM)和约3ppm或更低的精度;例如25,000或更佳的分辨力(FWHM)和约3ppm或更低的精度。3种能够对胰岛素离子表现出必需性能水平的示例分析器为轨道阱质量分析器、某些TOF质量分析器和傅里叶变换离子回旋共振质量分析器。生物活性分子中发现的元素,例如碳、氧和氮,以许多不同同位素形式天然存在。例如,大多数碳以12C存在,但是所有天然存在的碳的约1%以13C存在。因此,一定分数的天然存在的含有至少一个碳原子的分子将含有至少一个13C原子。分子中包括天然存在的元素同位素产生多种分子同位素形式。分子同位素形式质量的差异为至少1个原子质量单位(amu)。这是因为元素同位素相差至少一个中子(一个中子的质量≈1amu)。当使分子同位素形式电离为多电荷态时,同位素形式之间的质量区别可变得难以辨别,因为质谱检测基因质荷比(m/z)。例如,质量相差1amu,均电离为5+态的两种同位素形式将在其m/z中表现出仅为0.2的差异。高分辨率/高精度质谱仪能够辨别高度多电荷离子(例如带±2、±3、±4、±5或更高电荷的离子)的同位素形式。由于天然存在的元素同位素,对于每种分子离子而言,通常存在多种同位素形式(每种同位素形式可产生如果用足够灵敏的质谱仪分析,可单独检测的质谱峰)。多种同位素形式的m/z比和相对丰度共同包括分子离子的同位素特征。在一些实施方案中,可利用两种或更多种分子同位素形式的m/z比和相对丰度确认研究的分子离子的同一性。在一些实施方案中,使用来自一种或多种同位素形式的质谱峰定量分子离子。在一些相关实施方案中,使用来自一种同位素形式的单个质谱峰定量分子离子。在其它相关实施方案中,使用多个同位素峰定量分子离子。在这些后者实施方案中,所述多个同位素峰可进行任何恰当数学处理。在本领域中已知几种数学处理,包括但不限于求多个峰下面积的和,或平均来自多个峰的反应。在图4-6中观察到展示了5+和6+胰岛素离子的多种同位素形式的示例光谱。如图5A-B中所见,观察到来自5+胰岛素离子的各种同位素形式的峰值为约1161.72、1161.92、1162.12、1162.32、1162.52、1162.72、1162.92、1163.12和1163.32。如图6A-B中所见,观察到来自6+胰岛素离子的各种同位素形式的峰值为约968.28、968.45、968.62、968.79、968.95、969.12、969.28、968.45和969.61。然而应注意,由于仪器变化,对任何离子的同位素变体观察到的精确质量可能稍有改变。在一些实施方案中,用高分辨率/高精度质谱仪测量一种或多种离子的相对丰度以便定量评估样品中胰岛素的量。在一些实施方案中,通过高分辨率/高精度质谱法测量的所述一种或多种离子为多电荷胰岛素离子。这些多电荷离子可包括m/z在约1453±0.8(即,来自4+离子的一个或多个单同位素峰)和/或1162±1(即,来自5+离子的一个或多个单同位素峰)和/或约968.8±1.5(即,来自6+离子的一个或多个单同位素峰)范围内的一种或多种离子。已经报道使用高分辨率轨道阱分析器定性和定量分析各种分析物。参见例如,美国专利申请公布No.2008/0118932(2007年11月9日提交);等,RapidCommun.MassSpectrom.,2008,22:477-485;LeBreton等,RapidCommun.MassSpectrom.,2008,22:3130-36;Thevis等,MassSpectrom.Reviews,2008,27:35-50;Thomas等,J.MassSpectrom.,2008,43:908-15;Schenk等,BMCMedicalGenomics,2008,1:41;和Olsen等,NatureMethods,2007,4:709-12。可通过本领域已知的许多方法将分析物测定的结果与原样品中分析物的量联系起来。例如,考虑到仔细控制取样和分析参数,可将指定离子的相对丰度与将相对丰度转化为原分子绝对量的表作比较。或者,外标可与样品一起进行,并且基于由那些标准生成的离子作标准曲线。使用这种标准曲线,可将指定离子的相对丰度转化为原分子的绝对量。在某些优选实施方案中,使用内标生成用于计算胰岛素量的标准曲线。生成并且使用这种标准曲线的方法在本领域中众所周知并且普通技术人员能够选择恰当内标。例如,在优选实施方案中,可使用一种或多种形式的同位素标记胰岛素作为内标。将离子的量与原分子的量联系起来的许多其它方法将为本领域的普通技术人员众所周知。如本文所使用,当通过质谱技术分析时,相对于未标记分子,“同位素标记”在标记分子中产生质量位移。适合标记的实例包括氘(2H)、13C和15N。可在分子的一个或多个位置并入一个或多个同位素标记并且可在相同同位素标记分子上使用一种或多种同位素标记。通过用质谱法定量未修饰胰岛素A和/或B链来定量胰岛素在其它实施方案中,可在质谱分析之前使胰岛素受化学处理以生成胰岛素的组成链。可通过本领域已知的任何化学处理分离胰岛素的A链和B链以引起二硫化物还原。例如,可用TCEP(三(2-羧乙基)膦处理胰岛素以还原胰岛素的二硫桥键并分离A链和B链。然后可使A链和B链进行上述纯化胰岛素的一个或多个纯化步骤。在优选实施方案中,在质谱分析之前使A链和/或B链通过HPLC纯化。一经纯化,就使A链和/或B链经受电离源。与胰岛素一样,技术人员将理解,可基于待测分析、样品类型、检测器类型、正与负模式的选择等确定电离方法的选择。可在正或负模式下电离胰岛素A链和B链。在优选实施方案中,在正模式下通过ESI电离胰岛素A链和/或B链。电离胰岛素A链可产生多电荷A链前体离子(例如2+、3+前体离子等)。例如,正电喷雾电离胰岛素A链分子可生成m/z分别为1192.0±0.5和795.0±0.5的2+和3+电荷A链前体离子。与胰岛素相似,电离胰岛素A链生成的多电荷物类的同一性和量受采用的电离条件影响。在优选实施方案中,在酸性条件下电离胰岛素A链。在使胰岛素A链进行串联质谱分析的实施方案中,Q1可选择用于m/z为约1192.0±0.5和795.0±0.5的一种或多种胰岛素A链前体离子。破碎这些胰岛素A链前体离子的任一种可生成m/z为约513.0±0.5、399.0±0.5、236.0±0.5和133.0±0.5的碎片离子。因此,在Q1选择用于选自m/z为约1192.0±0.5和795.0±0.5的离子的一种或多种胰岛素A链前体离子的实施方案中,Q3可选择选自m/z为约513.0±0.5、399.0±0.5、236.0±0.5和133.0±0.5的离子的一种或多种碎片离子。在某些实施方案中,可测量来自单个前体离子的单个碎片离子的相对丰度。或者,可测量自单个前体离子的两个或更多个碎片离子的相对丰度。在这些实施方案中,可使每个碎片离子的相对丰度受任何已知数学处理以定量评估最初样品中的胰岛素。在其它实施方案中,可测量来自两个或更多个前体离子的一个或多个碎片离子并如以上用于定量评估最初样品中的胰岛素。类似地,电离胰岛素B链可产生多电荷B链前体离子(例如3+、4+、5+前体离子等)。例如,正电喷雾电离胰岛素B链分子可生成m/z分别为1144.2±0.5、858.3±0.5和686.8±0.5的3+、4+和5+电荷B链前体离子。与胰岛素相似,电离胰岛素B链生成的多电荷物类的同一性和量受采用的电离条件影响。在优选实施方案中,在酸性条件下电离胰岛素B链。在使胰岛素B链进行串联质谱分析的实施方案中,Q1可选择用于m/z为约1144.2±0.5、858.3±0.5和686.8±0.5的一种或多种胰岛素B链前体离子。破碎这3种胰岛素B链前体离子可生成m/z为约825.4±0.5、768.5±0.5、753.2±0.5、345.0±0.5和226.2±0.5的碎片离子。因此,在Q1选择用于选自m/z为约1144.2±0.5、858.3±0.5和686.8±0.5的离子的一种或多种胰岛素B链前体离子的实施方案中,Q3可选择选自m/z为约825.4±0.5、768.5±0.5、753.2±0.5、345.0±0.5和226.2±0.5的离子的一种或多种碎片离子;优选选自m/z为约345.0±0.5和226.2±0.5的离子。在某些实施方案中,可测量来自单个前体离子的单个碎片离子的相对丰度。或者,可测量自单个前体离子的两个或更多个碎片离子的相对丰度。在这些实施方案中,可使每个碎片离子的相对丰度受任何已知数学处理以定量评估最初样品中的胰岛素。在其它实施方案中,可测量来自两个或更多个前体离子的一个或多个碎片离子并如以上用于定量评估最初样品中的胰岛素。通过用质谱法定量经化学修饰的胰岛素A和/或B链来定量胰岛素在替代实施方案中,可在电离和/或纯化之前对单独的胰岛素A链和B链进行一个或多个化学修饰步骤。例如,一经分离,胰岛素A链和B链分子就可经受脲甲基化以使组成型半胱氨酸完全烷基化。例如,在用DTT(1,4-二硫苏糖醇)还原后,可通过使胰岛素A链和/或B链与碘乙酰胺反应实现脲甲基化。脲甲基化胰岛素A链导致4个半胱氨酸甲基化,导致质量增加约228.08amu(每个半胱氨酸约57.02)。脲甲基化胰岛素B链导致2个半胱氨酸甲基化,导致质量增加约114.04amu(每个半胱氨酸约57.02)。一经纯化,就使经化学修饰(例如,烷基化)的A链和/或B链经受电离源。与胰岛素一样,技术人员将理解,可基于待测分析、样品类型、检测器类型、正与负模式的选择等确定电离方法的选择。可在正或负模式下电离烷基化胰岛素A链和B链。在优选实施方案中,在正模式下通过ESI电离烷基化胰岛素A链和/或B链。电离烷基化胰岛素A链可产生多电荷烷基化A链前体离子(例如2+、3+等前体离子)。例如,正电喷雾电离烷基化胰岛素A链分子可生成m/z分别为1306.0±0.5和871.0±0.5的2+和3+电荷烷基化A链前体离子。与胰岛素相似,电离烷基化胰岛素A链生成的多电荷物类的同一性和量受采用的电离条件影响。在优选实施方案中,在酸性条件下电离烷基化胰岛素A链。在使烷基化胰岛素A链进行串联质谱分析的实施方案中,Q1可选择用于m/z为约1306.0±0.5和871.0±0.5的一种或多种烷基化胰岛素A链前体离子。破碎这些烷基化胰岛素A链前体离子的任一种可生成m/z为约570.0±0.5、456.0±0.5、293.0±0.5和133.0±0.5的碎片离子。因此,在Q1选择用于选自m/z为约1192.0±0.5和795.0±0.5的离子的一种或多种烷基化胰岛素A链前体离子的实施方案中,Q3可选择选自m/z为约570.0±0.5、456.0±0.5、293.0±0.5和133.0±0.5的离子的一种或多种碎片离子。在某些实施方案中,可测量来自单个前体离子的单个碎片离子的相对丰度。或者,可测量自单个前体离子的两个或更多个碎片离子的相对丰度。在这些实施方案中,可使每个碎片离子的相对丰度受任何已知数学处理以定量评估最初样品中的胰岛素。在其它实施方案中,可测量来自两个或更多个前体离子的一个或多个碎片离子并如以上用于定量评估最初样品中的胰岛素。类似地,电离烷基化胰岛素B链可产生多电荷烷基化B链前体离子(例如3+、4+、5+前体离子等)。例如,正电喷雾电离烷基化胰岛素B链分子可生成m/z分别为1181.9±0.5、886.9±0.5和709.8±0.5的3+、4+和5+电荷烷基化B链前体离子。与胰岛素相似,电离烷基化胰岛素B链生成的多电荷物类的同一性和量受采用的电离条件影响。在优选实施方案中,在酸性条件下电离烷基化胰岛素B链。在使烷基化胰岛素B链进行串联质谱分析的实施方案中,Q1可选择m/z为约1181.9±0.5、886.9±0.5和709.8±0.5的一种或多种胰岛素B链前体离子。破碎这3种烷基化胰岛素B链前体离子可生成m/z为约345.0±0.5和226.2±0.5的碎片离子。因此,在Q1选择用于选自m/z为约1144.2±0.5、858.3±0.5和686.8±0.5的离子的一种或多种烷基化胰岛素B链前体离子的实施方案中,Q3可选择选自m/z为约345.0±0.5和226.2±0.5的离子的一种或多种碎片离子。在某些实施方案中,可测量来自单个前体离子的单个碎片离子的相对丰度。或者,可测量自单个前体离子的两个或更多个碎片离子的相对丰度。在这些实施方案中,可使每个碎片离子的相对丰度受任何已知数学处理以定量评估最初样品中的胰岛素。在其它实施方案中,可测量来自两个或更多个前体离子的一个或多个碎片离子并如以上用于定量评估最初样品中的胰岛素。可使用自动化机器进行上述任何方法的一个或多个步骤。在某些实施方案中,在线进行一个或多个纯化步骤,并且更优选以在线方式进行所有纯化和质谱分析步骤。下列实施例用于说明本发明。这些实施例决非旨在限制所述方法的范围。实施例实施例1:样品制备通过在各种浓度下示踪模拟血清中的人胰岛素(40mg/mL牛血清白蛋白(BSA)于具有0.002%蛋白酶抑制剂的AEBSF磷酸盐缓冲盐(PBS)缓冲液中)制备含有不同量的胰岛素的模拟血清样品以评估线性响应(以下在实施例4中讨论)。还在各种浓度下,在从GoldenWestBiologicals,Inc.获得的双重活性炭反萃血清中示踪了人胰岛素以评估响应线性度(以下在实施例4中讨论)。实施例2:质谱分析之前富集胰岛素用CohesiveTechnologiesAriaTX-420系统,使用AriaOSV1.6或更新软件进行以上制备的人胰岛素示踪模拟和反萃血清的样品注射。将75μL样品引入WatersOasisHLB(25μm,2.1×20mm)、在线固相萃取(SPE)柱。SPE柱保留人胰岛素,而使其它血清蛋白和大分子流过。用0.2%于40%乙腈的甲酸将胰岛素从萃取柱上洗脱到分析柱上(来自PhenomenexInc.的整体式C18分析柱(粒径5μm,50×2.1mm))。将HPLC梯度应用于分析柱,以将胰岛素与样品所含的其它分析物分开。流动相A是0.2%于水中的甲酸而流动相B是0.2%于乙腈中的甲酸。HPLC梯度从28.5%有机梯度开始,在约90s内提高到37%。然后使胰岛素富集样品进行高分辨率/高精度MS或MS/MS以定量胰岛素。实施例3:pH对胰岛素电离的影响在正离子模式下用ESI源进行胰岛素的电离。在使用这种电离源生成正胰岛素离子时,观察到电喷雾载体溶液的pH影响生成的胰岛素离子的量和特性。在酸性条件下,以968.5±0.50(对于6+离子而言)和1162.3±0.50(对于5+离子而言)的m/z观察到多电荷胰岛素离子。图3A示出了从在酸性条件下电离胰岛素收集的示例性光谱。在碱性条件下,以1163.0±0.50(对于5+离子而言)和1453.8±0.50(对于4+离子而言)的m/z观察到多电荷胰岛素离子。图3B示出了从在碱性条件下电离胰岛素收集的示例性光谱。在酸性和碱性条件下生成足够信号,使得可在任一种条件下进行定量分析。实施例4:通过高分辨率/高精度MS检测并定量胰岛素使用AgilentTOFMS系统(AgilentTechnologies,Inc.)进行高分辨率/高精度MS。该系统采用能够进行高分辨率/高精度MS的MS分析器。在测量胰岛素的同时,仪器能够表现出约25,000FWHM的分辨率和约1ppm的质量精度。在正离子模式下用ESI源进行电离。如实施例3中讨论,电喷雾载体溶液的pH影响生成的胰岛素离子的量和同一性。当用甲酸溶液从SEP柱上洗脱实施例1中制备的样品时,在电离之前酸化样品。如实施例3中所述,观察到多电荷胰岛素离子呈6+和5+电荷态。观察污染物峰从反萃血清样品洗脱。图4A示出了用QTOF质谱仪生成的模拟血清样品中胰岛素在约900-1200m/z范围的示例光谱。图4B示出了用QTOF质谱仪生成的来自反萃血清样品基质的污染物峰。观察到污染物峰的来源在不同于胰岛素峰的时间洗脱(数据未示出)。在图5A中观察到示出了5+离子的各个同位素峰,在约1155-1176m/z范围的示例性高分辨率/高精度光谱。在图5B中观察到所述光谱在约1159和1166之间的部分的特写。如光谱中所见,在约1161.72、1161.92、1162.12、1162.32、1162.52、1162.72、1162.92、1163.12和1163.34的m/z下观察到各个示例性同位素峰。在图6A中观察到示出了6+离子的各个同位素峰,在约964-973m/z范围的示例性高分辨率/高精度光谱。在图6B中观察到所述光谱在约967和971.4之间的部分的特写。如光谱中所见,在约968.28、968.45、968.62、968.79、968.95、968.12、968.28、968.45和968.61的m/z下观察到各个示例性同位素峰。收集m/z为1162.54±0.10的离子数据,以对示踪模拟和反萃血清样品中的胰岛素进行定量以评估定量线性。两种样品类型在约1.22ng/mL-1250ng/mL的浓度范围均展示出线性。图7和8中分别示出了显示示踪模拟血清样品和示踪反萃血清样品中胰岛素检测的数据的线性。测定通过高分辨率/高精度质谱定量胰岛素的拟合优度(R2)在示踪模拟血清中为0.9981而在示踪反萃血清中为0.9979。实施例5:通过串联MS检测并定量胰岛素使用ThermoTSQVantageMS/MS系统(ThermoElectronCorporation)进行MS/MS。在本文所述实施例中使用全部来自ThermoElectron的下列软件程序:TSQVantageV2.0.0或更新版本、XcaliburV2.0或更新版本和LCQuanV2.5或更新版本。离开分析柱的液体溶剂/分析物流到MS/MS分析器的ESI源接口。在接口的加热管道内溶剂/分析物混合物转化为蒸汽。在正离子模式下,在酸性条件下通过ESI电离分析物。离子进入第一个四极(Q1)。在Q1处观察到几种可能的胰岛素前体离子。在图9中观察到示例性Q1光谱。对m/z为约1163.32±0.50(5+离子)和约969.56±0.50(6+离子)的多电荷胰岛素前体离子进行破碎研究。图10和11中分别示出了来自破碎每种前体离子的示例性产物离子扫描。研究了碰撞能对5+和6+前体离子的破碎模式的影响。在范围从约7eV至约80eV的碰撞能下破碎每种前体离子,并监测选择的3种碎片离子(m/z为约135.9±0.50、226.2±0.50和345.3±0.50)的相对强度。图12中展示了这些研究的结果。如图12所见,碎片离子的相对强度根据碰撞能显著变化。表1中示出了每个监测相变的最佳碰撞能值。表1.对胰岛素观察到的示例性质量相变的最佳碰撞能(正极性-酸性条件)前体离子(m/z)产物离子(m/z)最佳碰撞能969.56±0.50(6+)135.9±0.5030eV226.2±0.5032eV345.4±0.5028eV1163.32±0.50(5+)135.9±0.5045eV226.2±0.5042eV345.4±0.5044eV对于通过破碎6+离子定量胰岛素,进入四极2(Q2)的前体离子在30eV的碰撞能下与氩气碰撞生成离子碎片,离子碎片进入四极3(Q3)作进一步选择。破碎969.56±0.50前体离子观察到下列质量相变。图10中示出了从Q3扫描(产物离子扫描)收集的示例性破碎光谱。在MRM模式下监测观察到的其中两个相变并且加和作定量分析:969.56±0.50-135.9±0.50和226.2±0.50的前体离子(见表2)。虽然通过监测两个质量相变完成了定量,但是可通过仅监测单个质量相变完成定量。相反,可选择另外的质量相变(包括,例如,图10中观察到的任何其它碎片离子)以任何组合代替或增大以上监测的任何相变。类似地,虽然在30eV的碰撞能下完成定量,但是可使用产生足够离子信号的任何碰撞能并且可取决于监测碎片离子的同一性。例如,对于上面所指出的两种碎片离子而言,碰撞能可在约20至约50eV范围内,例如在约25至约40eV范围内,例如约28-32eV。为通过破碎5+离子定量胰岛素,进入四极2(Q2)的前体离子在49eV的碰撞能下与氩气碰撞生成离子碎片,离子碎片进入四极3(Q3)作进一步选择。破碎1163.32±0.50前体离子观察到下列质量相变。图11中示出了从Q3扫描(产物离子扫描)收集的示例性破碎光谱。在MRM模式下监测观察到的其中两个相变并且加和作定量分析:1163.32±0.50-135.9±0.50和226.2±0.50的前体离子(见表2)。虽然通过监测两个质量相变完成了定量,但是可通过仅监测单个质量相变完成定量。相反,可选择另外的质量相变(包括,例如,图10中观察到的任何其它碎片离子)以任何组合代替或增大以上监测的任何相变。类似地,虽然在49eV的碰撞能下完成定量,但是可使用产生足够离子信号的任何碰撞能并且可取决于监测碎片离子的同一性。例如,对于上面所指出的两种碎片离子而言,碰撞能可在约25至约70eV范围内,例如在约30至约60eV范围内,例如约35-50eV。表2.为定量胰岛素监测的示例性质量相变(正极性-酸性条件)前体离子(m/z)产物离子(m/z)碰撞能969.56±0.50(6+)135.9±0.50,226.2±0.5030eV1163.32±0.50(5+)135.9±0.50,226.2±0.5049eV实施例6:通过串联MS检测并定量胰岛素A链和B链用TCEP(三(2-羧乙基)膦处理如实施例1中所述制备的胰岛素示踪模拟血清和反萃血清样品以还原胰岛素的二硫桥键并分离A链和B链。二硫化物还原后,使含有分离A链和B链的样品进行实施例2中描述的相同纯化过程。所得胰岛素A链和B链进行如实施例5所述的MS/MS分析。在正模式下,在酸性条件下通过ESI电离两种分析物。在Q1处观察到几种可能的胰岛素A链和B链前体离子。图13中示出了显示两种可能A链前体离子(呈2+和3+电荷态)和可能B链前体离子(呈3+和4+电荷态)的复合光谱。观察到这两种A链前体离子m/z为约1192.86±0.50(2+离子)和795.43±0.50(3+离子)。观察到这两种B链前体离子m/z为约1144.09±0.50(3+离子)和858.40±0.50(4+离子)。还观察到第3种可能B链前体离子(图14中所示)m/z为约686.83±0.50(5+离子)。对以上所有A链和B链前体离子进行破碎研究。研究了碰撞能对A链3+前体离子(m/z/为约795.43±0.50)的影响。在范围从约7eV至约80eV的碰撞能下破碎前体离子,并检测选择的4种碎片离子(m/z为约513.0±0.50、399.0±0.50、236.0±0.50和133.0±0.50)的相对强度。图15中展示了这些研究的结果。如图15中所见,碎片离子的相对强度根据碰撞能显著变化。表3中示出了每个监测相变的最佳碰撞能值。表3.对胰岛素A链3+前体离子观察到的示例性质量相变的最佳碰撞能(正极性-酸性条件)前体离子(m/z)产物离子(m/z)最佳碰撞能795.4±0.50(3+)133.0±0.5028eV236.0±0.5023eV399.0±0.5016eV513.0±0.5012eV用m/z/为约1192.86±0.50(2+离子)和795.43±0.50(3+离子)的A链前体离子进行胰岛素定量。用每种前体离子进行定量实验。在这些定量实验中,选择2+离子(m/z/为约1192.86±0.50)或3+离子(m/z/为约795.43±0.50)作为前体离子并且在表3所示碰撞能下破碎。不管选择的前体离子如何,监测下列碎片离子:513.0±0.50、399.0±0.50、236.0±0.50和133.0±0.50。虽然通过监测4个质量相变完成定量,但是可通过仅监测单个质量相变完成定量。相反地,可选择另外的质量相变(包括,例如,观察到的任何其它碎片离子)以任何组合代替或增大以上监测的任何相变。表4.为定量胰岛素A链监测的示例性质量相变(正极性-酸性条件)前体离子(m/z)产物离子(m/z)1192.86±0.50(2+离子)513.0±0.50、399.0±0.50、236.0±0.50和133.0±0.50795.43±0.50(3+离子)513.0±0.50、399.0±0.50、236.0±0.50和133.0±0.50还用m/z/为约1144.09±0.50(3+离子)、858.40±0.50(4+离子)和686.83±0.50(5+离子)的B链前体离子进行胰岛素定量。用每种前体离子进行定量实验。在这些定量实验中,选择3+离子(m/z/为约1144.09±0.50)、4+离子(m/z/为约795.43±0.50)或5+离子(m/z/为约686.83±0.50)作为前体离子并且在30eV碰撞能下破碎。不管选择的前体离子如何,监测下列碎片离子:226.2±0.50和345.0±0.50。图16中示出了在30eV碰撞能下破碎B链4+离子(即,产物离子扫描)的示例性光谱。虽然通过监测2个质量相变完成定量,但是可通过仅监测单个质量相变完成定量。相反,可选择另外的质量相变(包括,例如,图16中观察到的任何其它碎片离子)以任何组合代替或增大以上监测的任何相变。表5.为定量胰岛素B链监测的示例性质量相变(正极性-酸性条件)前体离子(m/z)产物离子(m/z)1144.09±0.50(3+离子)226.2±0.50、345.0±0.50858.40±0.50(4+离子)226.2±0.50、345.0±0.50686.83±0.50(5+离子)226.2±0.50、345.0±0.50实施例7:通过串联MS检测并定量胰岛素A链(烷基化)和B链(烷基化)用DTT(1,4-二硫苏糖醇)处理胰岛素示踪模拟血清和反萃血清样品以生成含有分离A链和B链的模拟和反萃血清样品。在纯化之前,使胰岛素A链和B链分子进行脲甲基化以使分子中存在的每个组成型半胱氨酸完全烷基化。在A链中,通过这个过程使4个半胱氨酸烷基化,导致质量增加约228.08amu。在B链中,通过这个过程使2个半胱氨酸烷基化,导致质量增加约114.04amu。半胱氨酸烷基化后,使含有烷基化A链和烷基化B链的样品进行实施例2中描述的相同纯化过程。使所得烷基化A链和烷基化B链进行如实施例5所述的MS/MS分析。在正模式下,在酸性条件下通过ESI电离两种分析物。在Q1处观察到几种可能的烷基化A链和烷基化B链前体离子。选择m/z为约1306.0±0.50(2+离子)和871.0±0.50(3+离子)的2种可能A链前体离子进行破碎和定量。选择m/z为约1181.9±0.50(3+离子)、886.40±0.50(4+离子)和709.80±0.50(5+离子)的3种可能烷基化B链前体离子进行破碎和定量。用m/z/为约1306.0±0.50(2+离子)和871.0±0.50(3+离子)的烷基化A链前体离子进行胰岛素定量。用每种前体离子进行定量实验。在这些定量实验中,选择2+离子(m/z/为约1306.0±0.50)或3+离子(m/z/为约871.0±0.50)作为前体离子并且在30eV碰撞能下破碎。不管选择的前体离子如何,监测下列碎片离子:133.0±0.50,293.0±0.50,456.0±0.50和570.0±0.50。虽然通过监测4个质量相变完成定量,但是可通过仅监测单个质量相变完成定量。相反地,可选择另外的质量相变以任何组合代替或增大以上监测的任何相变。表6.为定量烷基化胰岛素A链监测的示例性质量相变(正极性-酸性条件)前体离子(m/z)产物离子(m/z)1306.0±0.50(2+离子)133.0±0.50,293.0±0.50,456.0±0.50和570.0±0.50871.0±0.50(3+离子)133.0±0.50,293.0±0.50,456.0±0.50和570.0±0.50还用约1181.9±0.50(3+离子)、886.9±0.50(4+离子)和709.8±0.50(5+离子)的烷基化B链前体离子进行胰岛素定量。用每种前体离子进行定量实验。在这些定量实验中,选择3+离子(m/z为约1181.9±0.50)、4+离子(m/z为约886.9±0.50)或5+离子(m/z为约709.8±0.50)作为前体离子并且在30eV碰撞能下破碎。不管选择的前体离子如何,监测下列碎片离子:226.2±0.50和345.0±0.50。虽然通过监测2个质量相变完成定量,但是可通过仅监测单个质量相变完成定量。相反地,可选择另外的质量相变以任何组合代替或增大以上监测的任何相变。表7.为定量烷基化胰岛素B链监测的示例性质量相变(正极性-酸性条件)前体离子(m/z)产物离子(m/z)1144.09±0.50(3+离子)226.2±0.50、345.0±0.50858.40±0.50(4+离子)226.2±0.50、345.0±0.50686.83±0.50(5+离子)226.2±0.50、345.0±0.50实施例8:制备人类样品以通过定量胰岛素B链进行胰岛素定量在人类样品中胰岛素的定量中使用两种内标溶液。用溶于0.2%于水中的甲酸的牛胰岛素制备浓度为10pmol/μL的第一内标溶液。然后用500mL含有比例为15:85的1.5MTris碱和乙醇的碱/萃取液稀释30μL该溶液。用同位素标记的人胰岛素B链(用具有5个13C和1个15N的脯氨酸标记),通过将1mg肽溶于1mL0.2%于水中的甲酸中制备第二内标溶液。用1000μL水稀释5μL这种浓溶液以制备第二内标溶液。解冻先前冷冻的人血清样品,使其达到室温并充分涡旋。一经解冻,就将各150μL样品添加到350μL用牛胰岛素示踪的碱/萃取液中。在1000rpm速度下涡旋所得混合物2min,并在-20℃冷冻机中培育60±5min,使沉淀形成。培育之后,在5500rpm下离心样品10min。然后将来自每种样品的250μL上清液转移到96-微量滴定板中。然后使2mLTCEP还原溶液(ThermoScientific目录号#77720)与100μL第二内标溶液混合,并且将20μL这种混合物添加到96-微量滴定板中的每种样品中。在1000rpm速度下再次涡旋样品2min,并且在37℃培育箱中培育60±5min以使样品中的胰岛素发生还原,而使样品中存在的任何完整胰岛素分离成A链和B链。然后在-20℃冷冻机中培育10min,使沉淀形成。在5500rpm下再次离心沉淀的样品10min。然后在MS/MS分析之前通过SPE和HPLC使来自每种样品225上清液进行富集。实施例9:进行质谱法之前使胰岛素B链从人类样品中富集用CohesiveTechnologiesAriaTX-420系统,使用AriaOSV1.6或更新的软件进行实施例8中制备的经处理血清样品的样品注射。将225μL样品引入WatersOasisHLB(25μm,2.1×20mm)、在线固相萃取(SPE)柱。SPE柱保留胰岛素B链,而使其它血清蛋白和大分子流过。用0.2%甲酸洗涤保留的胰岛素B链。用35%于0.2%甲酸中的乙腈(含有0.025%异丙醇)将胰岛素B链从萃取柱上洗脱到装有保护盒的分析柱上(MichromBioresources300ArmstrongMagicC4(2.1×50mm,5μm粒径)分析柱和Phenomenex安全保护柱盒(PhenomenexP/NAHO-4286))。将HPLC梯度应用于防护/分析柱,以将胰岛素与样品所含的其它分析物分开。流动相A是0.2%于水中的甲酸而流动相B是0.2%于乙腈中的甲酸(含有2.5%异丙醇)。HPLC梯度从12.0%有机梯度开始,在约90s内提高到42%。然后使胰岛素富集样品进行MS/MS以定量胰岛素。实施例10:通过串联MS检测并定量来自人血清的胰岛素B链使用ThermoTSQVantageMS/MS系统(ThermoElectronCorporation)进行MS/MS。在本文所述实施例中使用全部来自ThermoElectron的下列软件程序:TSQVantageV2.0.0或更新版本、XcaliburV2.0或更新版本和LCQuanV2.5或更新版本。离开分析柱的液体溶剂/分析物流到MS/MS分析器的ESI源接口。在接口的加热管道内溶剂/分析物混合物转化为蒸汽。在正离子模式下,在酸性条件下通过ESI电离分析物。如以上实施例6中所述,在Q1处观察到几种可能的胰岛素B链前体离子。选择m/z为约686.83±0.50(5+离子)的胰岛素B链前体离子进行破碎。破碎研究显示许多胰岛素B链碎片离子。图17中示出了示例性破碎光谱。研究了碰撞能对人胰岛素B链5+前体离子(m/z为约686.9±0.50)的破碎模式的影响。在范围从约7V至约80V的碰撞能下破碎前体离子,并监测选择的5种碎片离子(m/z为约906.0±0.50、825.0±0.50、768.5±0.50、753.0±0.50和703.0±0.50)的相对强度。图18中展示了这些研究的结果。如图18所见,碎片离子的相对强度根据碰撞能显著变化。表8中示出了每个监测相变的近似最佳碰撞能值。表8.对人胰岛素B链5+前体离子观察到的示例性质量相变的最佳碰撞能(正极性-酸性条件)前体离子(m/z)产物离子(m/z)最佳碰撞能(近似)686.9±0.50(5+)703.0±0.5017V753.0±0.5016V768.5±0.5020V825.0±0.5016V906.0±0.5014V选择m/z为约768.5±0.50和753.2±0.50的人胰岛素B链碎片离子用于定量。用实施例8中均有描述的牛胰岛素(内标1)和同位素标记胰岛素B链(内标2)进行类似研究。表9中示出了对选择用于进一步定量的每种类型的胰岛素B链监测到的质量相变。表9.为定量胰岛素B链监测的示例性质量相变(正极性-酸性条件)分析物前体离子(m/z)产物离子(m/z)人胰岛素B链686.9±0.50(5+离子)768.5±0.50、753.2±0.50牛胰岛素B链(内标1)680.8±0.50(5+离子)768.5±0.50、738.3±0.50同位素标记的人胰岛素B链(内标2)688.1±0.50(5+离子)768.5±0.50、756.0±0.50虽然可通过监测表8所示每条胰岛素B链的2个质量相变完成定量,但是可通过仅监测单个质量相变完成任何所示分析物的定量。相反,可选择另外的质量相变(包括,例如,图17中观察到的任何其它人胰岛素B链碎片离子)以任何组合代替或增大以上监测的任何相变。实施例11:测定内和测定间准确性、再现性和精度研究用由用8、12、20、40和80μIU/mL人胰岛素示踪的反萃血清(BiocellLaboratoriesInc.,1131-00,批次HHP03)制成的5种QC混合血清(pool)进行实施例8-10中所述测定的测定内和测定间准确性、再现性和精度研究,以覆盖假定可报道测定范围。在单次测定中分析了来自5种QC混合血清的每一种的8种复制品以确定测定中样品的变异系数(CV)。表10中示出了由这些研究产生的数据。对结果进行的统计证明,5种QC混合血清的再现性(CV)范围从3.0至7.9%,全部在可接受水平内(即,≤15%CV,除可接受≤20%CV的LOQ水平外)。对表10中提出的数据的进一步分析揭示每种混合血清的测定内精度在80-120%可接受范围内。表10.测定内变异和精度为研究测定间变异,在不同的5天分析来自5种QC混合血清的每一种的8种复制品。表11中示出了由这些研究产生的数据。所述混合血清的测定间变异(%CV)范围从7.1至14.0%。8、12、20、40和80μIU/mL靶向胰岛素水平的总变异分别为14.0%、10.2%、10.0%、7.5%和7.1%。对所有混合血清的分析满足可接受再现性≤15%CV的要求,除可接受≤20%CV的LOQ水平外。对表11中提出的数据的进一步分析揭示每种混合血清的测定间精度在80-120%可接受范围内。表11.测定间变异和精度实施例12:分析灵敏度:空白限(LOB)、检测限(LOD)和定量限(LOQ)选择性是分析方法在样品中有其它组分存在时区分并量化分析物的能力。LOB和LOD均为测量值大于与之测量相关的不确定度的指标。将LOB定义为与零浓度的2个标准偏差。将LOD定义为与零浓度的4个标准偏差。对于选择性试验,获得适当生物基质的空白样品(反萃血清),测试干扰,并通过实施例8-10中描述的方法分析。测量空白反萃血清样品14次。统计分析这些研究的结果,给定LOB为1.4μIU/mL而LOD为1.8μIU/mL。LLOQ是测量在数量上变得有意义的点。在这个LLOQ的分析物反应可识别、不连续并且可重现,准确性为20%并且精度为80%-120%。通过在接近预期LLOQ的浓度下(1.25、2.5、5、10、15和25μIU/mL),测定用人胰岛素示踪的6种反萃血清样本测定LLOQ,然后估计7次的测定内再现性。分析这些研究的数据并绘图(示于图19中)并且由曲线确定LLOQ为3μIU/mL,获得可接受性能的最低浓度,此时CV的95%置信区间仍低于20%。实施例13:测定可报道范围和线性度为确定实施例8-10中所述测定的线性范围,制备了8种示踪反萃血清样品(人胰岛素浓度为5、10、15、25、50、100、200和300μIU/mL)并且在单独的5天分析。连续5次的加权(1/X)线性回归产生0.995或更高的相关系数,精度为±20%,揭示可量化范围为5-300μIU/mL。图20中示出了示例性校准曲线。实施例14:样本类型研究可通过在6种不同类型的BDVacutainerTM管中收集10种人类患者混合血清(普通血清、SST、EDTA血浆、肝素钠血浆、肝素锂血浆和柠檬酸钠血浆)估计基质特异性。然后根据实施例8-10中描述的方法萃取并分析来自每种混合血清的样品的胰岛素。这些研究表明,不可接受柠檬酸钠血浆样品进行分析,但是所有其它样品类型可接受。实施例15:干扰研究通过示踪低、中和高溶血性患者样品中不同水平的胰岛素估计溶血干扰对胰岛素测定的影响。然后根据实施例8-10中描述的方法萃取并分析胰岛素。这些研究的结果表明,对高和中等溶血样品获得可接受的结果(即,在80-120%精度内)。高溶血样品不可接受。通过示踪低、中和高脂血性患者样品中不同水平的胰岛素估计脂血干扰对胰岛素测定的影响。然后根据实施例8-10中描述的方法萃取并分析胰岛素。这些研究的结果表明,对于所有水平的脂血均获得可接受的结果(即,在80-120%精度内)。通过示踪低、中和高黄疸患者样品中不同水平的胰岛素估计胆红素干扰对胰岛素测定的影响。然后根据实施例8-10中描述的方法萃取并分析胰岛素。这些研究的结果表明,对于所有水平的胆红素均获得可接受的结果(即,在80-120%精度内)。本文提及或引用的论文、专利和专利申请及所有其它文档和以电子方式提供的信息均以引用方式整体并入,如同特别单独地指出将每个单独的公布以引用方式并入一样。申请人保留将来自任何此类论文、专利、专利申请或其它物理和电子文档的所有任何材料完全并入本申请的权利。本文说明性描述的方法可适合在不存在本文未特别公开的任何元素、限制的情况下实施。因此,例如,应从广义上理解术语“包含”、“包括”、“含有”等并且不受限制。另外,已经将本文采用的术语和表达用作描述而非限制性术语,并且不打算使用不包括显示并描述的特征的任何等效形式或其部分的此类术语和表达。应认识到,在要求保护的本发明范围内可能有各种修改。因此,应理解,虽然已经通过优选实施方案和任选特征特别公开了本发明,但是本领域的技术人员可采取本文公开的其中体现的本发明的修改和变化,并且认为此类修改和变化在本发明范围内。本文已对本发明进行了广泛且一般性的描述。属于一般公开内容的每一狭窄种类和下位分组也构成所述方法的一部分。这包括对所述方法的带有限制型条款的一般描述,或对所述方法的带有从种中除去任何主题的负面限定的一般描述,无论所除去的主题是否在本文中被具体引用。其它实施方案在下列权利要求的范围之内。另外,当根据马库西群组(Markushgroup)描述所述方法的特征或方面时,本领域的技术人员将认识到,还据此根据马库西群组的任何单个成员或亚组成员来描述本发明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1