电喷雾离子源及包含该离子源的LC-MS联用接口的制作方法
本发明涉及一种离子源装置以及一种LC-MS联用接口设计,可实现离子化过程中的复杂样品体系在线电场分离及离子化效率提高。
背景技术:
质谱分析法(mass spectrometry)是将化合物按不同质荷比(m/z)进行分离检测,实现成分和结构鉴别的一种分析方法。质谱技术因其具有的高特异性和灵敏度,在生物分析领域中的重要地位日益凸显。生物质谱(Bio-mass spectrometry,Bio-MS)是应用于生物分子分析的质谱技术,其在蛋白质和多肽研究中有着广泛的应用:如蛋白质相对分子质量测定、肽谱测定、肽序列测定技术、巯基和二硫键定位、蛋白质翻译后修饰、定量蛋白质组分析、蛋白质相互作用研究等。此外,生物质谱还应用于多糖结构测定、寡核苷酸和核酸分析、微生物鉴定、药物研发等领域。
质谱的离子源装置,是最影响物质检测灵敏度的装置之一。对于液体的样品检测,最常用的离子源是(纳升)电喷雾离子源。电喷雾离子源,利用电场产生带电液滴,经过去溶剂化过程最终产生被测物离子,进入质谱分析。此过程包括带电液滴的形成、液滴收缩及产生气相离子3个阶段。后又发展出纳升电喷雾,大大降低了样品用量和溶液流速。电喷雾离子源广泛应用于液相质谱联用界面。
另一方面,采用电喷雾方法检测混合样品时,待测组分之间、待测组分与杂质之间会产生离子化竞争,不易检出低丰度、离子化效率低的组分,故实际操作中需对样品进行预处理、预分离。为了简化复杂样品预处理过程,消除此过程中可能产生的对待测组分的影响,本发明对传统的电喷雾方法进行改进设计,利用电场对离子化过程中的样品基于其带电性质进行分离,减少样品竞争,提高单一组分离子化效率,尤其可实现联用过程中的多模式分离。
技术实现要素:
本发明提供一种新的电喷雾离子源及操作方法,即在喷雾毛细管处添加辅助电场,使样品电场分离和电喷雾离子化同步实现。
本发明一方面一种电喷雾离子源,包括:毛细管,包括喷雾尖端;第一电极,为所述毛细管的喷雾尖端提供喷雾电压;和第二电极,其与所述第一电极之间的电势差形成分离电场。
所述第二电极前端距离所述毛细管的喷雾尖端的距离比所述第一电极前端距离所述毛细管的喷雾尖端的距离远。
所述第一电极和第二电极分别为直线电极、L形电极、环形电极或圆柱状套管形电极。
所述第一电极和第二电极为金属电极、非金属电极或复合材料电极。
所述第一电极和/或第二电极外表面有绝缘涂层。
所述第一电极和第二电极与样品溶液接触或不接触。
所述毛细管侧壁上设置有开孔,所述第一电极通过所述开孔设置于所述毛细管的包含喷雾尖端部分中。
所述毛细管被切开为两段或多段,所述第一电极通过切口设置于所述毛细管的包含喷雾尖端部分中。
所述第一电极和/或所述第二电极分别为环形电极或圆柱状套管形电极,所述环形电极或圆柱状套管形电极套接于所述毛细管外表面。
所述的电喷雾离子源,还包括:直流高压源,输出范围是0~+/-20000V;或/和交流高压源,输出电压范围是0~+/-20000V、频率范围是0~10kHZ。
本发明另一方面包括上述电喷雾离子源的LC-MS联用接口。
本发明的电喷雾离子源包括前后设置的两个辅助电极,前电极提供喷雾电压,后电极和前电极之间的电势差形成分离电场。因此,本发明的离子源可以在样品离子化过程之前/中产生分离电场区域,使样品电场分离和电喷雾离子化同步实现,提高电喷雾离子源的灵敏度。
本发明与现有技术相比具有如下有益效果:
1)具有分离效果:具有不同带电性质的样品可通过电场加以分离,具体体现为出峰时间的差异,实现样品快速预处理;
2)具有聚焦效果:对于样品中的单一组分,如蛋白质,能带多电荷的肽段等,可以提高离子化时样品浓度,进一步提高其检测灵敏度;
3)保护生物大分子样品自然结构:采用本发明无需对样品进行前处理,例如加酸等,保护了蛋白质等分子的自然结构;
4)有利于混合样品的检测:减少样品体系中的竞争效应,容易检测到低丰度样品或离子化效率低的样品。
附图说明
通过参照附图详细描述其示例实施方式,本发明的上述和其它特征及优点将变得更加明显。
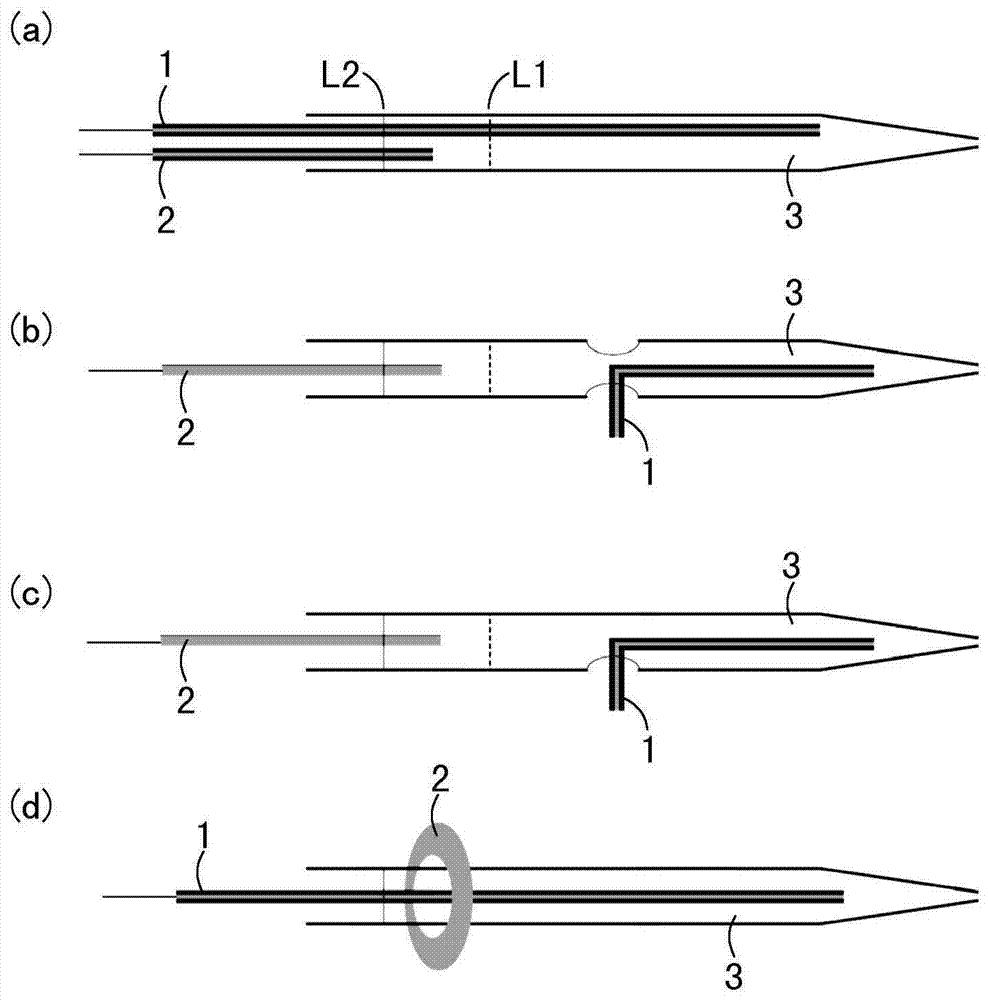
图1示出本发明的电喷雾离子源四种辅助电场的结构示意图;
图2示出本发明的两种LC-MS联用接口的结构示意图;
图3A-3E示出本发明与现有电喷雾单一样品对比现象图;
图4A-4G示出采用本发明和现有电喷雾离子源的检测混合样品的对比图;
图5A-5C示出采用本发明的电喷雾离子源的检测单一样品和现有电喷雾离子源加酸预处理后对蛋白出峰效果的对比图;以及
图6A-6F示出采用本发明的电喷雾离子源和现有纳升电喷雾离子源以及现有纳升电喷雾离子源加酸预处理方法检测复杂的细胞样品的对比质谱图。
具体实施方式
体现本发明特征与优点的典型实施例将在以下的说明中详细叙述。应理解的是本发明能够在不同的实施例上具有各种的变化,其皆不脱离本发明的范围,且其中的描述及附图在本质上是当作说明之用,而非用以限制本发明。
电喷雾离子源
如图1所示,电喷雾离子源包括带有喷雾尖端的毛细管3、第一电极1、第二电极2。
第一电极1通过接触或非接触样品溶液方式为电喷雾离子源的毛细管3的喷雾尖端提供喷雾电压,第二电极2前端与毛细管3的喷雾尖端距离比第一电极1距离毛细管3的喷雾尖端的距离远,也就是,第二电极2设置在第一电极1的后方,第二电极2不提供喷雾电压。第一电极1与第二电极2之间的电势差形成分离电场。第一电极1与第二电极2之间形成电场用于预分离电场内的样品。待测样品的被分离程度由电极施加电场和电极间距离决定,进一步讲是所形成分离电场长度和单位长度电场变化V/cm相关,电场长、单位变化大,有利于提高分离度。本领域技术人员可以根据待测样品的带电性质确定第一电极1和第二电极2之间电场的强度以及两者之间的设置方式。
第一电极1与第二电极2可以是直线电极、环形电极、圆柱状套管形电极或其他形状的电极。第一电极1与第二电极2可以选用金属电极、非金属电极、复合材料电极或其他多种导电介质形成的电极。第一电极1与第二电极2的外表面可以带有绝缘涂层。涂层为绝缘材料,使得电压暴露点在电极1和2的尖端,增加了前后电场的长度,也就是可以形成电场梯度的距离。相比于等电势、全部裸露的没有绝缘涂层的电极来说,可以一定程度上提高分离度。、。
毛细管3、第一电极1和第二电极2可以以多种不同方式设置。以下列举4种方式来解释说明本发明的发明构思,然而本发明并不以此为限,本发明的毛细管3、第一电极1和第二电极2还可以是其他能够实现本发明的构思的任何设置方式。
如图1(a)所示,第一电极1和第二电极2均为带绝缘涂层的直线电极。第一电极1和第二电极2直接插入毛细管3中,并形成前后的位置关系,第一电极1的前端接近毛细管3的喷雾尖端,为喷雾尖端提供喷雾电压。电极1和2的前端相距一定距离,如1厘米以上,也就是说,第二电极2与第一电极1相比远离毛细管3的喷雾尖端,第一电极1和第二电极2之间形成分离电场。
如图1(b)所示,毛细管3可以是两段,前一段包括喷雾尖端部分,后一段为毛细管。第一电极1为带绝缘涂层的L形电极,L形电极的一边设置于前段内,为喷雾尖端提供喷雾电压。第二电极2为直线电极,设置于后段内,与第一电极1之间形成分离电场。前段与后段之间的距离为样品溶液能以液桥形式连接并且容易设置第一电极1的适当距离,例如1厘米以上。以上描述以两段为例,当毛细管3也可以是多段的。
如图1(c)所示,第一电极1为带有绝缘涂层的L形电极,L形电极的一边通过距毛细管3喷雾尖端1厘米处的小孔设置于毛细管3内,为喷雾尖端提供喷雾电压。第二电极2为直线电极,从后端插入毛细管3,第二电极2的前端距离小孔1厘米以上,第二电极2与第一电极1之间形成分离电场。
如图1(d)所示,第一电极1为带绝缘涂层的直线电极。第一电极1直接插入毛细管3中,至接近毛细管3的喷雾尖端,为喷雾尖端提供喷雾电压。第二电极2为环形电极。环形第二电极2套接在毛细管3外,与第一电极1前端距离一定距离,与第一电极1之间的电势差形成分离电场。
本发明中,第一电极1和第二电极2可以与样品溶液接触,也可以不与样品溶液接触。如图1(a)-(d)所示,当毛细管3中样品溶液的液面在虚线L1处时,第二电极2不与样品溶液接触;当毛细管3中样品溶液的液面在虚线L2处时,第二电极2与样品溶液接触。如图2(a)所示,第一电极1套接与毛细管3外表面不与样品溶液接触。
对于两/多段式电喷雾离子源的毛细管3的喷雾尖端,前段与后段所加样品溶液体系可相同或不同;在施加电场后,可再次或持续加入样品溶液,加电前后所加样品溶液体系可相同或不同。
第一电极1和第二电极2连接高压源或接地,具体接电情况需要结合质谱仪的情况而定,以形成喷雾电压和分离电场。
高压源可以是直流高压源或交流高压电压源。直流高压源的输出范围是0~+/-20000V;交流高压源输出电压范围是0~+/-20000V,频率范围是0~10kHZ。
通过两电极施加电场的时间、强度不同,可实现不同操作模式。其中喷雾电压在不同时间可施加或不加,分离电场在不同时间可施加或不加,施加时强度可恒定或时变。
如第一电极1和第二电极2同时施加电压形成分离电场,且第一电极1电压高于样品喷雾电压,可实现分离/喷雾同步完成。
或第一电极1和第二电极2同时施加电压形成分离电场,且第一电极1电压低于样品喷雾电压,可实现分离电场内样品预分离;一段时间后,如5分钟,停止施加第二电极2电压,且调高第一电极1电压使之高于样品喷雾电压,可实现预分离-喷雾模式操作。
或第一电极1和第二电极2同时施加电压形成分离电场,且第一电极1电压低于样品喷雾电压,可实现分离电场内样品预分离;一段时间后,如5分钟,同时调高第一电极1和第二电极2电压,使第一电极1高于样品喷雾电压,保持第一电极1和第二电极2之间电场强度不变,可实现预分离-分离/喷雾模式操作。
或第一电极1和第二电极2同时施加电压形成分离电场,且第一电极1电压高于样品喷雾电压,可实现分离、喷雾,随时间延长改变第二电极2电压,使分离电场随时间而变化,变场分离/喷雾模式。
以上所描述的操作方式只是本发明的一部分实例,而不是全部的模式,本领域技术人员应当理解以上方式仅用于解释说明本发明的构思,并不意在限定本发明。
LC-MS联用接口
本发明涉及了一种LC-MS联用接口,即在液相联用接口处添加辅助电场,使样品电场分离和电喷雾离子化同步实现。具体发明设计方案实现如下:
采用电喷雾离子源的设计装置组成接口,其一种装配如图2(a)所示,采用圆柱状套管形第一电极1套接于毛细管3喷雾尖端,施加高压交流电场,作为喷雾电压。采用三通4连接液相出口端管路5、第二电极2、毛细管3,第二电极2施加高压直流电场,与第一电极1构成分离电场。
另一种装配如图2(b)所示,采用三通4连接第一电极1、包含喷雾尖端的毛细管3前段、毛细管3后段,施加高压直流电场,作为喷雾电压。采用三通4连接液相出口端管路5、第二电极2、毛细管3后段,第二电极2施加高压直流电场,与第一电极1构成分离电场。
以上所描述的LC-MS联用接口的设置方式只是本发明的一部分实例,而不是全部的模式,本领域技术人员应当理解以上方式仅用于解释说明本发明的构思,并不意在限定本发明。
以下结合实施例详细说明本发明。在以下的各实施例中,所涉及的样品有:细胞色素C(95%,SDS-PAGE)、血管紧张肽I(色谱级)、甲酸(色谱级)购自Sigma-Aldrich(美国);甲醇(色谱级)购自Fisher Scientific(美国);纯净水购自娃哈哈集团。所采用的仪器有:离子阱质谱仪(HCT Ultra PTM Discovery System,Bruker,德国)、电子天平(AR2140,OHAUS Corp.,美国)、离心机(Biofuge 22R,Heraeus Sepatech.Inc.,德国)等。
实施例1
样品为细胞色素C。
将10mg细胞色素C粉末溶于10ml甲醇/水(1:1)的溶剂中制成母液,采用甲醇/水(1:1)溶剂稀释母液直至样品最终浓度为0.1mg/ml。把带有喷雾尖端的毛细管3,用玻璃刀切为两段。毛细玻璃管前段加喷雾尖端约为2厘米,后段毛细管长约5厘米。先将前段加满样品,并插入带有绝缘层的L型电极作为第一电极1,接地。后段毛细管,切口与前端切口对齐,摆放在固定托架上,缓慢加入一些样品,使样品在切口处形成液桥,并向后段毛细管沿伸5毫米液面。后段毛细管3后方插入带有绝缘层的电极作为第二电极2,第二电极2与后段切口相距1.5厘米,与高压直流输出电源负极连接。将毛细管3的喷雾尖端对准质谱仪入口后,打开高压直流输出电源-8000V。打开质谱仪锥孔电压-1000V开始进行喷雾检测。
图3A-3E示出采用本实施例和现有电喷雾离子源的检测单一样品的结果。
图3A为采用本实施例的电喷雾离子源检测的细胞色素C的总离子流图。从图中可以看出,3分钟后总离子流开始上升,出现了待测样品细胞色素C的谱峰。图中曲线分为两个时段,时段1)为出峰前离子流、时段2)为出峰后离子流。
图3B为图3A中时间段1)的质谱图,可以看到只有杂质437.2出现,没有细胞色素C的特征峰。
图3C为图3A中时间段2)的质谱图,可以看到出现了细胞色素C的一簇蛋白谱峰。
图3D为采用现有纳升电喷雾方法检测细胞色素C的总离子流图。可以看出在记录的10分钟之内,无特征色谱峰出现。
图3E为采用现有纳升电喷雾方法质谱图。在检测时间内,没有检测到细胞色素C谱峰。
由此可以看出,采用本实施例的电喷雾离子源装置检测单一样品时有效提高检测的灵敏度。
实施例2
样品为罗丹明B、血管紧张肽I和细胞色素C的混合样品。
采用甲醇/水(1:1)的溶剂稀释三种样品母液,配置体系终浓度为1ppm的罗丹明B、1ppm血管紧张肽I、50ppm细胞色素C的混合样品。采用实施例1中方式,将混合样品加入前段毛细管中,通过液桥沿伸到后段毛细管3约4毫米液面。第二电极2不接触样品液面,与液面相距1.5厘米左右。第一电极1接地,第二电极2加电-8000V,并接通质谱仪锥孔电压-1000V,开始记录。
图4A-4G示出采用本实施例和现有电喷雾离子源的检测混合样品的结果。
图4A为采用本实施例电喷雾离子源检测混合样品的总离子流图。可以看出分为3个时间段。
图4E-4G分别为对应的罗丹明B、血管紧张肽I、细胞色素C三种样品特征峰的离子流图,其中细胞色素C选择带14个正电荷谱峰(质荷比883)作为特征峰监测离子流变化。可以看出三种样品出峰的先后顺序。
结合图4E-4G可以从图4B-4D中看出如下信息。图4B为时间段1)内的出峰情况,可以看出在开始检查的1分钟内,罗丹明B峰(质荷比443)明显较强,且没有蛋白质的峰出现。图4C为时间段2)内的出峰情况,可以看出该时间段内血管紧张肽I(质荷比592)峰信号强度超越罗丹明B。图4D为时间段3)内的出峰情况,可以看出细胞色素C的一簇蛋白峰出峰,而罗丹明B峰以及血管紧张肽I的强度都有所减弱。
再次参考图4A-4G,采用本实施例的LC-MS联用接口检测罗丹明B、血管紧张肽I和细胞色素C的混合样品,在开始的前1分钟里,罗丹明B信号最强,血管紧张肽I的强度逐渐上升,在1分钟后超过罗丹明B的信号,在3分钟后,出现细胞色素C的一簇蛋白峰,罗丹明B和血管紧张肽I强度相对减弱。提取三种样品的色谱图,可以看出出峰的先后顺序,分别是小分子罗丹明B、短肽血管紧张肽I、最后为蛋白质细胞色素C。由此可以看出,采用本实施例的电喷雾离子源装置检测混合样品时,简化复杂样品预处理过程、有效提高检测的灵敏度。
实施例3
样品细胞色素C。
由于蛋白没有其他小分子物质容易离子化,在进行纳升电喷雾时,经常要加酸预处理。采用现有纳升电喷雾离子源将20ppm的样品加入0.1%的甲酸,采用现有纳升电喷雾离子源获得细胞色素C的蛋白谱峰。检测结果如图5B所示。
本实施例采用终浓度为20ppm细胞色素C,不进行预处理,采用实施例1中所述方法,第一电极1接地,第二电极2加电压-9000V,质谱仪锥孔电压-1000V,在2分钟左右得到细胞色素C的蛋白谱峰。检测结果如图5A所示。
图5A-5C示出采用本实施例和现有电喷雾离子源的检测单一样品的结果。
图5A采用本实施例的电喷雾离子源检测的细胞色素C蛋白峰带电情况。
图5B加酸预处理后采用现有纳升电喷雾离子源检测的细胞色素C蛋白峰带电情况。
图5C对比采用本实施例和现有电喷雾离子源检测的蛋白峰带电分布及信号响应。
采用本实施例的电喷雾离子源装置的蛋白检测结果显示的蛋白峰带电分布更广,对应蛋白结构更完整。而采用现有纳升电喷雾离子源加酸预处理的蛋白检测结果显示信号强度有所提高,但是使蛋白带电更多,结构变化明显。
实施例4
样品单核巨噬细胞。
采用1640培养液与牛血清9:1混合加1%双抗对样品细胞进行培养,培养约3天后,取两皿细胞进行离心。得到细胞沉淀,加入甲醇/水(1:1)的溶液200微升。超声破碎,离心取上清,得到细胞破碎液。两培养瓶细胞个数约为367万个。将得到的细胞裂解液,采用实施例1所述方法,第一电极1接地,第二电极2加电压-9000v,质谱仪锥孔电压-1100v和现有纳升电喷雾离子源(加酸和不加酸处理)进行对比。检测结果如图6A-6F所示。
图6A-6B为单核巨噬细胞细胞裂解液采用现有纳升电喷雾离子源的出峰情况以及总离子流图,从图中可以看出,复杂生物样品不做任何处理时,质谱图只出现低质量端杂质,总离子流平稳强度低。图6C-6D为将单核巨噬细胞细胞裂解液加0.1%甲酸后采用现有纳升电喷雾离子源的出峰情况以及总离子流图,从图中可以看出,复杂生物样品酸化处理后,质谱图出现中质量端生物质特征峰,总离子流平稳,强度较图6A-6B更强。图6E-6F为单核巨噬细胞细胞裂解液采用本实施例电喷雾离子源的出峰后质谱图以及总离子流图,从图中可以看出,复杂生物样品经本实施例方法处理后,质谱图出现中、高质量端生物质特征峰,总离子流呈现色谱图似的出峰过程,图6F中1.3-4min离子强度上升,强度较前两种处理方法更强。
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员当可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!