电子无标签的DNA和基因组测序的制作方法
本申请要求2016年2月9日提交的名称为“电子、无标签的dna和基因组测序装置、及其制备方法和应用”的美国临时专利申请号62/293,239的优先权,其公开内容通过引用全部并入本文。
本公开一般涉及纳米技术、纳米制造和纳米电子学,并且更具体地涉及用于电子感测和分析单独生物分子(包括dna和蛋白质)的系统、装置和方法。
背景技术:
自从发现dna以来,人们一直在努力开发通过实验实际确定化学碱基序列组成的方法。1978年,sanger引入了第一种系统测序dna的方法。
这种基本方法在20世纪80年代后期在商业仪器平台中自动化,实现了第一个人类基因组的测序。这项努力的成功推动了许多“大规模并行”测序平台的开发,其目标是显著降低人类基因组测序所需的成本和时间。这些自动化方法通常依赖于以高度微型化的微流体形式同时处理数百万至数十亿的测序反应。
尽管后续出现了各种其他相关技术和商业平台,但仍然非常需要进一步改进测序的质量和准确性,且降低成本和时间。使基因组测序实际广泛运用到精确医学中尤其如此,其中需要对具有临床质量等级的数百万个体的基因组进行测序。此外,许多dna测序技术利用采用荧光报道分子的光学手段。这些方法可能很麻烦,检测速度慢,并且难以大规模生产或难以成本低廉。无标记dna或基因组测序方法具有不必使用荧光型标记过程和相关光学系统的优点,因此是特别需要的。
技术实现要素:
本发明公开了亚10nm纳米电极设计和制造的新的、可制造的和高度可扩展的技术,其包括无标记dna或基因组测序方法、装置和应用等部分。
本发明提供了用于电子dna测序系统的极小和高密度纳米电极阵列的独特结构、组合物和制造手段。这种纳米电极系统还可以用于分析其他类型的生物分子,例如蛋白质,这取决于纳米电极如何被功能化以与生物分子感测目标相互作用。通常,本文公开的纳米电极系统可以包括用于此类生物分子分析的系统的一部分,其中纳米电极系统与生物分子偶联以构成分子电子传感器,其特定应用于感测和表征生物分子靶标,特别是应用于对dna分子或构成整个基因组的此类分子的集合的测序。
在本公开的各个方面,公开了一种用于dna或基因组测序的装置的制造方法。所述方法包括:
将电极对设置在基材上,其中电极由纳米间隙隔开;
在该对电极上沉积抗蚀剂层;
图案化抗蚀剂层以在纳米间隙处或附近的各电极上产生暴露区域;
将电极暴露于等离子体蚀刻或金(au)离子束注入,以使每个暴露区域内的表面粗糙化;和
使暴露区域暴露于生物分子,其中生物分子至少具有第一和第二末端,各末端包含用于键合到所述电极对上的官能化,
其中所述生物分子桥接纳米间隙,所述生物分子的第一和第二末端结合至暴露区域。
在某些方面,抗蚀剂层可以是电绝缘聚合物或氧化物涂层,其厚度为约3nm至约20nm,并且电极可以是金(au)电极。在一些示例中,使用的图案化是电子束光刻或纳米光刻。
在各种实施方式中,等离子体蚀刻包括rf等离子体,dc等离子体或溅射蚀刻工艺。等离子体蚀刻或au离子束注入步骤导致每个暴露区域内的电极的表面积从等离子体蚀刻或au离子束注入之前的暴露区域的表面积增加至少50%。
在本公开的各个实施方式中,公开了用于dna或基因组测序的装置的制造方法。所述方法包括:
将电极对设置在基材上,其中电极由纳米间隙隔开;
在该对电极上沉积抗蚀剂层;
图案化抗蚀剂层以在纳米间隙处或附近的各电极上产生暴露区域;
将电极暴露于au纳米颗粒,其中au纳米颗粒附着到每个暴露区域内的电极表面;
将阵列在约200℃至约500℃退火以将au纳米颗粒结合至电极表面;和
使暴露区域暴露于生物分子,其中生物分子至少具有第一和第二末端,各末端包含用于键合到所述电极对上的官能化,
其中各生物分子桥接纳米间隙,所述生物分子的第一和第二末端结合至暴露区域。在某些示例中,抗蚀剂层是电绝缘陶瓷层,例如al2o3或sio2,并且电极是金(au)。图案化步骤可包括电子束光刻或纳米光刻。
在本公开的各个实施方式中,公开了用于dna或基因组测序的装置的制造方法。所述方法包括:将au金属合金电极对设置在基材上,其中电极由纳米间隙隔开;
在电极对上沉积抗蚀剂层;
图案化抗蚀剂层以在纳米间隙处或附近的各电极上产生暴露区域;
将电极暴露于蚀刻剂溶液以从每个暴露区域内的合金中选择性地除去非au金属;和
使暴露区域暴露于生物分子,其中生物分子至少具有第一和第二末端,各末端包含用于键合到所述电极对上的官能化,
其中各生物分子桥接纳米间隙,所述生物分子的第一和第二末端结合至暴露区域。au金属合金可选自au-si,au-ge,au-bi,au-co,au-mo,au-rh,au-ru和au-w。在某些方面,抗蚀剂层是电绝缘陶瓷层,例如al2o3或sio2。
在某些示例中,该方法可以进一步包括在约200℃至约600℃下退火约10分钟至约12小时的步骤,以促进au和非au金属之间的相分离。
在本公开的各个实施方式中,公开了用于dna或基因组测序的装置的制造方法。所述方法包括:
将电极对设置在基材上,其中电极由纳米间隙隔开;
在电极对上沉积抗蚀剂层;
图案化抗蚀剂层以在纳米间隙处或附近的各电极上产生暴露区域;
在各暴露区域内的电极表面上沉积au-ag或au-cu合金;
将电极暴露于蚀刻剂溶液以从每个暴露区域内沉积的合金中选择性地除去非au金属;和
使暴露区域暴露于生物分子,其中生物分子至少具有第一和第二末端,各末端包含用于键合到所述电极对上的官能化,
其中各生物分子桥接纳米间隙,所述生物分子的第一和第二末端结合至暴露区域。在某些示例中,抗蚀剂层是电绝缘陶瓷层,例如al2o3或sio2。而且,电极可以是金(au)电极。在各种示例中,图案化过程包括电子束光刻或纳米光刻。
在本公开的各个实施方式中,公开了用于dna或基因组测序的装置的制造方法。所述方法包括:
将电极对设置在基材上,其中电极由纳米间隙隔开;
在电极上沉积能锁存的(latchable)磁性层;
在能锁存的磁性层上沉积抗蚀剂层;
图案化抗蚀剂层以在纳米间隙处或附近产生暴露区域,其中能锁存的磁性层是暴露的;
将电极暴露于外部磁场或暴露于施加的电压以磁化所述能锁存的磁性层;和
使暴露区域暴露至生物分子,其中所述生物分子具有至少第一和第二末端,每个末端标记有磁性纳米颗粒,用于吸引磁化的能锁存的磁性层,
其中所述生物分子桥接纳米间隙,每个磁性纳米颗粒保持于暴露区域处的各电极。在某些示例中,能锁存的磁性层是fecrco或fecuni旋节合金(spinodalalloy),其hc高于10oe。该方法还可包括在图案化抗蚀剂层的步骤之前在能锁存的磁性层上沉积au层的步骤。此外,磁性层可以被磁化或去磁化,以使得磁性纳米颗粒标记的生物分子能够磁性吸引附着或者能够通过永磁扫掠来去除和清除附着的磁性纳米颗粒标记的生物分子,从而允许装置的多次重复操作。
在本公开的各个实施方式中,公开了用于dna或基因组测序的装置的制造方法。所述方法包括:
在基材上设置铂(pt)或铼(rh)电极对,电极通过纳米间隙隔开;
在电极对上沉积厚度约1nm至约10nm的金(au)膜;
图案化抗蚀剂层以在纳米间隙处或附近的各电极上产生暴露区域;
退火电极以诱导au膜球化成au球体,其中在每个暴露区域内设置一个球体;
蚀刻球体以降低球体的高度;
另重复退火和蚀刻步骤至少两次;和
使au球体暴露于生物分子,其中生物分子至少具有第一和第二末端,各末端包含用于键合到所述au球体上的官能化,
其中所述生物分子桥接纳米间隙,所述生物分子的第一和第二末端结合至au球体。在该方法中,退火可以是约200℃至约400℃,持续约10分钟至约12小时,或足以引起球化的时间/温度。蚀刻步骤可包括离子研磨、溅射蚀刻、掩蔽和化学溶解中的至少一种。
附图说明
本发明的主题将在说明书结束部分特别指出并明确地要求保护。然而,通过参考结合附图考虑的详细描述和权利要求,可以最好地获得对本公开的更完整的理解。
图1示出了具有包含5-20nm纳米间隙的结构的基因组测序兼容电极,其具有用于附着或固定生物分子(例如蛋白质或片段化dna)的一对au岛,用于通过电测量的核苷酸附着的无荧光(无标记)检测的目的;
图2示出了可用于获得局部区域限定的、大规模平行的au岛电极阵列的纳米图案化的实施方式;
图3是具有高表面积au岛的微结构的示意图,其通过颗粒诱导的多孔结构或蚀刻诱导的多孔结构方法引入;
图4示出了用于更强的、减少误差增强的生物分子黏附的高表面积au岛;
图5说明了在电极(pt,rh或au)上获得au岛的方法;
图6示出了通过重复球化和顺序顶部蚀刻步骤逐渐减少au岛直径;
图7(a)示出了同时将生物分子(蛋白质或dna片段)牢固地黏附到所有电极表面上的选定位置的磁吸引方法。图7(a)示出了用于将生物分子(蛋白质或dna片段)牢固地黏附到所有au基电极表面上的选定位置的磁吸引;
图7(b)示出了用于生物分子的牢固黏附的磁吸引。磁性层沉积在pt,pd或rh型电极表面上;
图8示出了大规模平行的金尖端暴露的电极阵列:(a)通过纳米压印或其他光刻法制成的锥形或尖锐尖端的au电极区域;(b)将除了突出尖端附近的岛位置之外的大部分au电极表面掩蔽的结构,以避免在au电极表面的其他区域上的不希望的生物分子附着;
图9示出了用于生物分子强黏附的电极对阵列,用于大规模平行、无标记地检测核苷酸附着或脱离事件(例如,100×100装置阵列或1,000×1,000阵列);
图10示出了一构造,其用于通过在阵列的一侧上使用公共引线来对电极进行顺序询查,并且其中左侧电极被一次一个地顺序询查;
图11示出了分子电子基因组测序平台的三维阵列。在除了最尖端金岛上之外的部分施加电绝缘顶部涂层例如聚合物或氧化物层;和
图12示出了显示根据本公开的基因组或dna测序系统的各个方面的流程图。
应理解,附图是出于说明本发明的概念的目的而未按比例绘制的。
具体实施方式
本文实施方式的详细描述参考了附图,附图通过图示的方式示出了特定实施方式。尽管这些实施方式被充分详细地描述以使本领域技术人员能够实施本发明,但是应当理解其它实施方式也可实现并且可做出逻辑、化学和机械改变而不背离本发明的精神和范围。因而,此处提供的详细描述出于说明的目的而非限制。例如,除非另外说明,任何方法或过程描述中所述的步骤可以任何次序执行且不必然受所提供的次序的限制。此外,任何对单数的引用均包括复数实施方式,并且任何对一个以上组件或步骤的引用可包括单个实施方式或步骤。此外,对附连、固定、连接等的任何引用可以包括永久的、可移除的、临时的、部分的、完整的和/或任何其他可能的附连选项。另外,任何对无接触(或类似短语)的引用也可包括减少接触或最小接触。
定义
任何未明确定义的术语应赋予本领域技术人员已知的共同含义。
如本文所用,术语“亚(sub)10nm”是指其中的装置和组件的尺寸,以及可以执行方法的规模。特别地,该术语是指尺寸小于约10nm的物理结构,以及以小于约10nm的尺度操纵各种过程中的步骤的能力。
如本文所用,术语“纳米间隙”是指尺寸在纳米范围内的元件之间的空间或“间隙”,例如在两个电极或两个导电岛之间。类似地,术语“纳米间隔的”是指之间具有纳米级间隙的两个元件。
如本文所用,术语“无标记”是指不需要荧光标记的过程,或换句话说,是“无荧光的”。
如本文所用,原子元素的符号和元素的相关名称可以互换使用或一起使用。例如,元素金在本文中可以表示为“au”、“金”或“金(au)”。
如本文所用,术语“能锁存的(latchable)磁条”(或“能锁存的磁性层”)是指可磁化材料的薄膜或层,其具有响应外部磁场而改变磁化方向的能力,例如具有磁性的层,其随着施加的场或施加的电压的改变而可编程和可重新配置。
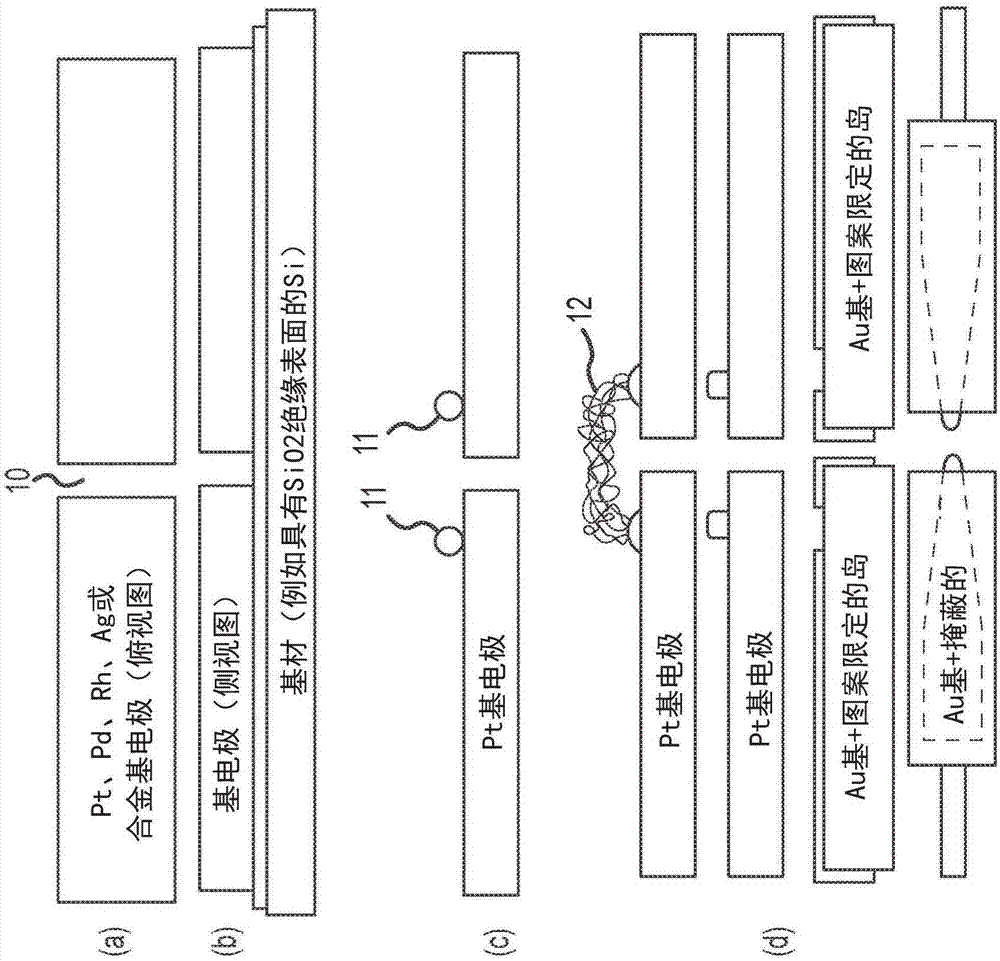
通过电子电导测量法进行的dna或基因组测序通常需要使用包括一对电分离的导电岛的装置,在所述岛上桥接有生物分子,并且由此检测电子电流或电压信号。参考附图,图1示出了具有5-20nm纳米间隙和一对金(au)岛的电极,用于附着或以其他方式固定生物分子(例如蛋白质或片段化dna),用于能够通过电子电导测量法以无标记方式检测核苷酸附着的装置。图1(a)的俯视图和图1(b)的侧视图显示了可用于通过电子电导测量法进行基因组/dna测序的纳米间隔的电极对的实施方式。电极可包括具有高导电性的稳定且惰性的金属。电极之间的纳米间隙10的宽度可以为约5-20nm。示例性电极金属包括但不限于铂(pt),钯(pd),铼(rh),钛(ti),银(ag)和金(au),或它们的合金,其中金(au)是最广泛使用的电极材料。然而,根据本公开的各种实施方式,可以使用au的替代物,例如pt,pd,rh及其合金,以防止生物分子、蛋白质或dna在电极表面上的非特异性随机附着。例如,通过使用pt基电极,生物分子更不易于直接附着在pt表面上。因此,通过在pt上添加尺寸为数纳米的au岛,可以将生物分子,尤其是单个生物分子的附着限制在金岛而不是pt电极表面本身。
纳米级颗粒,例如直径约5nm的金纳米颗粒,难以精确定位并直接放置在电极表面上,例如pt电极上。在某些情况下,原子力显微镜(afm)或扫描探针显微镜(spm)方法可用于拾取、移动和释放单个au纳米颗粒到电极表面上,由此范德华力有助于将纳米颗粒保持在其预定位置,例如图1(c)所示,表明au纳米颗粒11无差别地位于pt基极电极之上(参见,例如,huang等,美国专利申请公开号2014/0048776,2014年2月20日公开)。然而,纳米颗粒的这种精细移动和放置可导致纳米颗粒不能特别好地黏附到电极表面上。此外,单个纳米颗粒在所需位置的定位是不可再现的。这些纳米颗粒11不那么强烈地黏附,如图1(c)所示,将导致高接触电阻和降低的导电性。此外,这些au纳米颗粒可以容易地横向移动到不同的位置,或者在操作期间(例如,在生物分子的洗涤或微流体处理期间)完全脱离。因此,这种afm引导的纳米颗粒的逐一放置是费力、耗时的并且不可扩大规模用于低成本制造。
因此,根据本公开的实施方式,使au纳米颗粒更牢固地结合到电极表面上,从而用于与电极表面结合的au颗粒的接触面积包含au粒径的至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,优选至少80%,更优选至少90%,甚至更优选多至100%,如在图1(d)的顶部示例所示,其显示了半球形岛。在这个半球形岛的示例中,显示单个生物分子12与岛接触并桥接电极之间的间隙。图1(d)的第二示例示出了在pt基电极上包括“柱”形岛的实施方式,该岛可用于与生物分子桥键合。
根据本发明的另一个实施方式完全避免在pt电极上制造au岛,而是依赖于au电极的暴露部分来进行生物分子键合和桥接。如图1(d)的第三示例所示,纳米图案化掩模用于阻挡几乎整个au电极表面,除了留下的被暴露并可用于选择性生物分子附着的选定区域。在该概念的变型中,抗蚀剂层,例如pmma(聚甲基丙烯酸甲酯),甲基丙烯酸酯型共聚物,氢倍半硅氧烷(hsq)和各种硅氧烷聚合物,可用于覆盖仅除了电极尖端的大部分au电极,如图1(d)的第四示例所示。利用抗蚀剂层的这两种方法在此更详细地讨论。
图2示出了可用于获得局部区域限定电极的纳米图案化过程的实施方式,所述电极具有au电极上的暴露区域和单个生物分子键合和桥接。该过程从au电极对开始,如图2(a)所示。该横截面侧视图示出了两个au电极作为基材上的一对电极,所述基材包括具有sio2绝缘体表面的si。每个电极对中的纳米间隙20为约5nm至约20nm。电极标记为“阵列”以强调在装置中可存在多个这样的电极对,从少于一百到数百,或数千,或数百万或更多的电极对。图2所示过程的目的是在每个au电极上获得单个纳米限定的暴露区域,其直径约为3-10nm,这将允许在每个暴露区域中仅结合一个生物分子的一端。换句话说,每个电极上的暴露区域需要是亚10nm的。为此目的,并且如图2(b)所示,在电极对上添加正或负抗蚀剂层23。可以使用正性抗蚀剂(例如,聚甲基丙烯酸甲酯(pmma))或负性抗蚀剂(例如,氢倍半硅氧烷(hsq)或su-8环氧抗蚀剂),并且这些中的任何一种都与随后的电子束光刻或纳米压印光刻相容。在某些示例中,抗蚀剂层23包括负性抗蚀剂。然后使用电子束光刻或纳米压印光刻来图案化暴露区域24,如图2(c)所示。
在替代实施方式中,al2o3、sio2或si3n4或其他氧化物或氮化物层可以沉积在au电极上并且用作绝缘层而不是使用聚合物抗蚀剂层。在这种情况下,在施加氧化物或氮化物涂层之前,可以在au电极表面上沉积非常薄的黏附层,例如1-3nm厚的ti层。这种保护性涂层,无论是聚合物还是陶瓷,都可用作电绝缘体,也可用作涂层来防止或最小化生物分子在不期望位置处的黏附。
参考图2(c),暴露区域24的构造可以是任何形状,例如圆形,椭圆形,正方形,矩形或任何其他几何形状。au电极上的每个暴露区域24的尺寸平均为直径约3nm至约15nm(或者如果不是圆形形状,则为横跨并平行于电极表面的等效尺寸)。在某些实施方式中,每个暴露区域24的直径为约5nm至约10nm(或者如果不是圆形,则为跨越该区域的等效尺寸)。
在图2中顺序描绘的过程适用于大规模并行阵列测序装置的处理。纳米图案化方法,例如纳米压印,电子束光刻,阴影掩模图案化,euv(极紫外)光刻,x射线光刻和其他已知的图案化方法,允许同时制造至少1,000,优选至少10,000或者更多单电极对装置。测序装置中的这种大阵列电极极大地加快了测序速度并降低了测序成本。图2(d)示出了附着的生物分子22(例如,蛋白质,dna片段等),其在其每个末端附着到每个电极上的暴露区域以形成桥。在各种实施方式中,可以使用抗体-抗原,生物素-链霉亲和素,肽键合,功能化配体,表面电荷或其他生物分子固定技术将生物分子22固定到官能化末端所示的位置。图2(d)显示了完整电极对装置,包含来自每个电极的电连接,用于包括生物分子22与其他分子的相互作用的测序事件的电学询查(“i”)。
对于分子电子装置,包括用于蛋白质分析或dna/基因组测序的分子电子装置,需要使用许多电极对装置的阵列进行的并行电子感测。为了在给定空间内封装更多电测量装置和电路,电极尺寸必须减小到微米或纳米尺寸。可使用具有如图2所示的几何形状的纳米电极阵列。这种阵列可以通过使用方便且可扩大规模的处理方法(例如纳米压印光刻)来制造。也可以使用诸如电子束光刻,自组装和其他手段的替代方法。
在通常包括无标记电子检测以及分子电子装置的dna和基因组测序中,强大且可靠的生物分子-电极(或生物分子-导电岛)附着是必不可少的,以便获得在与生物分子的核苷酸相互作用的电子询查期间噪声低、可再现性强的信号。如果表面被“粗糙化”,则可以增强生物分子与表面的附着,这意味着以增加生物分子附着的表面积的方式来修饰表面。通常,难以在已经是纳米尺寸(例如,5-10nm区域)的结构上制造支化或多孔结构。然而,本发明克服了这种困难,由此实现了进一步细分的纳米结构,用于增强生物分子在电极表面上的黏附。包括在电极表面上的细分纳米结构的实施方式是其中沉积在电极表面上的au柱以使至少顶表面粗糙或多孔化的方式受到表面损伤。
au表面允许有机会使用生物分子上的巯基(-sh)基团通过au-硫键合将生物分子黏附(固定)到au表面。尽管如此,如果生物分子的黏附力可以增强到超过巯基基团提供的基础au-硫键合,则可以显著改善电子无标记测序中的可靠性和信噪比。根据本公开,增加au的纳米岛的表面积增加了生物分子与au的结合。本文公开了亚10nm的au岛的进一步表面纳米结构化。
现参照图3,提供了具有大表面积au岛的示例性微结构的示意图。根据本发明,表面积的增加可以是颗粒诱导的多孔结构(图3(a)中所示)或蚀刻诱导的多孔结构(图3(b)中所示)的结果,或其他方式的结果。本文详述了产生颗粒诱导的多孔结构和蚀刻诱导的多孔结构的方法。根据某些实施方式,在生物分子待附着的au岛的顶表面处或附近的表面积的增加超过平坦表面的au岛至少50%,优选至少100%。生物分子的黏附强度比平坦的未改性的au岛上的黏附性提高至少30%,优选至少60%。
现参照图4,示出了示例性大表面积au岛结构及其制造方法。如上所述,用于键合生物分子的增加的表面积导致更强、可再现,增强的生物分子黏附。在图4(a)至4(f)中,为了清楚起见,仅示出了每个电极对的左侧。图4(a)示意性地示出了基础电极结构的实施方式,包括电极49和抗蚀剂层48,其上具有暴露的岛位置44。在该区域44的内部,岛的表面积将增加。该过程开始于通过利用绝缘涂层48(例如pmma和其他聚合物)或氧化物层(例如溅射沉积的sio2或al2o3)在导电电极(例如,au,pd,pt,rh,ag或其合金)表面上形成图案限定的au岛区域。如所讨论的,电子束或纳米光刻可用于在电极上产生每个暴露区域44。基于所需的电绝缘性能和涂层对生物分子黏附的抗性来选择涂层的性质。
一旦抗蚀剂层48被图案化,则处理暴露区域44以增加暴露区域44内的表面积。图4(b)是通过等离子体蚀刻产生的多孔表面结构401的示例。在某些实施方式中,粗糙表面结构,例如多孔或垂直纳米线森林型表面结构,可以通过rf等离子体或dc等离子体蚀刻(或溅射蚀刻)处理,更选择性地在暴露的au岛区域上形成。可以调节等离子体蚀刻的强度和持续时间,以便最小化绝缘掩模层材料的完全等离子体蚀刻。抗蚀剂层的厚度可以为约3nm至约20nm,并且可以调节该厚度以减轻掩模层的完全等离子体蚀刻。
具有增加的表面积的粗糙表面也可以通过离子注入(例如通过使用au离子束)产生。通过离子束注入形成的粗糙表面的示例如图4(c)的表面441所示。然而,在绝缘涂层下面的au电极基底上可能发生离子注入损坏,这取决于由加速场和离子注入总剂量所决定的离子的穿透深度。因此,绝缘抗蚀剂涂层不一定保护下面的au表面免受离子注入影响。然而,在暴露的岛区域以外的区域中得到的粗糙表面不影响测序操作,因为绝缘层仍覆盖粗糙化的电极表面。在本公开的各种实施方式中,后退火(post-annealing)步骤可以在离子注入之后进行。
用于增加au岛表面积的另一个实施方式包括将au纳米颗粒421附着到暴露的au区域,如图4(d)所示。附着于au电极的au纳米颗粒增加了表面积,这导致生物分子附着增强。在各种示例中,通过已知方法制备的直径为约1nm至约2nm的au纳米颗粒倾向于优先自然地附着在暴露区域内的au电极上。如此沉积的au纳米颗粒然后可以任选地在约200至约500℃退火。如果绝缘层48是基于陶瓷的(例如,如果绝缘层包含al2o3或sio2),则仅可以使用更高的温度。在这些温度下的后退火改善了au纳米颗粒对暴露的au表面的黏附性。颗粒诱导的多孔结构的示例如在图3(a)所示。
图4(e)表示增加暴露的au岛表面的表面积的方法的另一个实施方式,利用au和fe在室温或接近室温下表现出的不混溶性。对于该方法,电极基层可以通过溅射或蒸发沉积,由例如具有约50重量%au和50重量%fe的au-fe合金制成。在室温下,合金相分离成嵌入有沉淀出来的fe纳米颗粒的au基质。然后可以蚀刻掉fe纳米颗粒以留下多孔au基质。这种类型的蚀刻诱导的多孔结构的示例如图3(b)所示。可以使用其他au基合金,例如au-si,au-ge,au-bi,au-co,au-mo,au-rh,au-ru,au-w,因为它们的性能表现方式与au-fe合金类似。在高温下退火(例如,在200-600℃下退火10分钟至12小时)增强了相分离。增强相分离的另一种方法是在温暖的基材温度(例如150-400℃)下进行溅射沉积或蒸发沉积,任选地施加偏压。
图4(f)说明用于增加au岛表面的表面积的方法的另一个实施方式,其包括去合金化。该过程开始于首先将au含量为约20至80重量%的au-ag,au-cu或其他au基合金层通过例如溅射或蒸发沉积而沉积到每个暴露区域44中。然后对非au金属进行强化学蚀刻,例如使用30%hno3或其他蚀刻剂。这种去合金化过程从表面除去ag或cu,留下高度多孔的结构。当这种去合金化技术应用于电子测序装置中的au纳米岛时,导致显著的表面积增加和生物分子黏附的相关改善。
图4(g)显示如何利用具有增加的表面积的au岛(例如通过图4(b)-(f)中示例的方法获得)来增强生物分子42(例如蛋白质或dna)的附着的实施方式。
在各种实施方式中,au岛区域(其特征在于支化或多孔)内的孔隙体积为至少10%,优选至少30%,甚至更优选至少50%,从而使au岛的顶表面处或附近的表面积比平坦且光滑的au岛结构增加至少20%,优选至少40%,甚至更优选至少60%。
继续参考附图,图5显示了在诸如pt,rh或au的电极上产生au岛的方法的三个实施方式。该过程开始于由纳米间隙50隔开的电极对。在这些图示的每一个中,为了清楚起见,未示出装置的下方基材,例如具有sio2绝缘体表面的si。第一实施方式(1)利用不能进行生物分子(例如蛋白质或dna片段)附着的pt基电极,使得生物分子仅黏附到au岛区而不是电极上。为了获得较小直径的au501,加热图案化的au岛51以使其球化成较小直径的球501。由于具有较低的电阻率(rh为-4.5uω.cm,相比pt为9.8uω.cm,au为2.1uω.cm),并且不希望的生物分子附着的倾向降低,rh电极也是一种有用的选择。而且,与pt不同,rh与au不(或非常小幅)互溶,因此使合金混合最小化。
第二实施方式(2)使用全au电极构造,其中au电极设置成矩形但是大部分表面被绝缘体涂层58掩蔽,除了电极末端的岛状区域。绝缘体涂层58可包括聚甲基丙烯酸甲酯(pmma),聚乙二醇(peg),聚二甲基硅氧烷(pdms)或它们的组合,氢倍半硅氧烷(hsq),或各种氧化物涂层,例如al2o3、sio2或氮化物涂层,例如si3n4涂层。
第三实施方式(3)包括制造具有尖锐尖端几何形状的锥形形状的au电极,然后在除电极的尖锐尖端之外的所有其他区域处通过绝缘体层580掩蔽电极的大部分表面。peg和pdms对蛋白质和细胞具有显著的非黏附特性,这对于其中不希望在au岛以外的位置处发生蛋白质黏附的电子测序装置是额外的优点。
由于生物分子的附着取决于au岛的大小,控制au岛的大小对于确保生物分子在测序装置中是至关重要的。在各种实施方式中,最佳au岛尺寸的直径为约5至约9nm。直径太大或直径太小的au岛不能实现生物分子的可再现且强的黏附。因此,在本公开的各个方面,示出了用于方便地控制au岛直径的技术。
继续参考附图,图6示出了渐进的au岛直径减小过程。该方法包括重复的“球化”(成球)和顶部蚀刻,从图6(a)至图6(f)的加工过程。在图示中,为了清楚起见,仅示出了每个电极对的左侧电极。此外,为清楚起见未示出下部的装置基材。通过采用重复的球化和岛顶蚀刻过程,可以更容易地实现直径为约5nm至约9nm的更小直径的au岛641。在该过程的第一步骤中,首先通过溅射、离子束沉积、蒸发、脉冲激光沉积或其他方法在pt或rh电极69上沉积薄au膜(例如,1-10nm厚度,未示出),然后,将其纳米图案化(例如通过纳米压印或其他光刻方法),以产生图6(a)中所示的限定的圆形或椭圆形膜几何形状61。随后的退火引起au区域的球化成较小直径的au岛601。在诸如氩气、氮气的气氛(形成气体型还原气氛)中,退火可以在约200至约400℃下持续约10分钟至12小时的时间。然后对成球的au岛601进行化学或等离子体蚀刻以降低高度(例如,通过离子研磨,溅射蚀刻,掩模和化学溶解蚀刻等)以产生更平坦的au岛几何形状611。随后的球化退火进一步减小au岛直径并产生au球形岛621。再次重复蚀刻和球化退火的步骤以将au岛621转变为631然后转变为641。
参考附图,图7(a)示出了用于形成测序装置的方法的实施方式,其中磁吸引使生物分子(蛋白质或dna区段)同时更牢固地附着到所有电极表面上的选定位置。如该图的顶部所示,该过程开始于具有由纳米间隙70隔开的电极的电极对。使能锁存的磁条785(例如基于fecrco或fecuni旋节合金的薄膜不锈钢磁体合金,或其他耐腐蚀磁体合金)沉积在au电极表面790上。选择矫顽性(hc)高于10奥斯特(oe)的磁硬度以防止杂散磁场的意外磁化,而非小于100oe以更容易地磁化或去磁化以吸引或不吸引磁性纳米颗粒。然后使用绝缘体间隔物层780的纳米图案化来产生暴露区域74,在该暴露区域74上可以通过良好的电连接牢固且可靠地附着磁性纳米颗粒。
一旦电子测序装置就位,就通过外部施加的磁场(例如使用铁氧体磁铁或电磁铁)在例如100-1000oe的磁场下使磁性层磁化。然后,使用周围的微流体室,引入包含已经用磁性纳米颗粒71标记的生物分子72的液体介质。具有与其结合的磁性纳米颗粒的生物分子可包括抗体-抗原结合,链霉亲和素-生物素结合,肽键合或电荷吸引,或其他结合方式。然后,附着有生物分子72的磁性颗粒71将被吸引到磁条791的暴露区域上,在那里它将被磁锚定和电锚定,如图7(a)中的下图所示。任选地,还可以将中间au纳米颗粒插入生物分子中用于各种控制目的。
待标记到生物分子上的磁性纳米颗粒可选自fe2o3、fe3o4,或具有比氧化铁更高磁矩的表面保护或表面官能化金属磁性颗粒,包括fe,co,ni及其合金。基于氧化物的磁性纳米颗粒是化学稳定的,但是基于金属的磁性纳米颗粒虽具有2-4倍的磁矩但可能在基因组测序的液体环境中缺乏化学稳定性。需要轻微的表面氧化作为抗氧化保护覆层。或者,磁性纳米颗粒的表面可以是au涂覆的,以提供化学稳定性,以及增强的导电性和对生物分子的更大亲和性。
一旦发生所需的磁吸引和生物分子附着,就将微流体室中的液体介质冲洗掉以除去未键合的生物分子,然后可以进行和完成测序电测量。这种磁性附着技术的特征是生物分子附着的可逆性,即,需要时易于使生物分子脱离。由于磁条(电极上的磁性层的部分)可以容易地被消磁(例如,通过使用在几秒钟内使用60hzac场从200oe逐渐减小到接近零场的磁场),一旦完成所需的测序测量,可以彻底除去所有磁性附着的生物分子,例如,通过使用扫掠永磁体脱离和收集所有磁性颗粒和相关的生物分子并丢弃它们。以这种方式,测序装置是可重复使用的,例如,该装置可以重复使用至少10次,至少100次,或甚至至少1000次。
利用由纳米间隙700分隔的pt,pd或rh基电极对代替au基电极的改进方法示于图7(b)。在该方法中,在磁性层790的表面的顶部添加薄的au涂层785,以允许生物分子的更好附着。au层不会显著影响纳米颗粒与下面的磁条之间的磁吸引,因为下面的磁性层非常靠近暴露的表面。根据图7(a)所示的实施方式,曝光区域740通过抗蚀剂层780的纳米图案化或电子束图案化产生。然后,用标记有磁性纳米颗粒710的生物分子720的溶液充满该装置,其中磁性纳米颗粒710结合到au层791并且被磁性吸引到下面的磁条。
图8显示大规模平行的au尖端暴露的电极阵列。锥形或尖锐的au电极区域89首先通过纳米压印或其他光刻制成,阵列中具有许多电极对,如图8(a)所示。为清楚起见,未示出例如具有sio2表面绝缘体的si的基材材料。如图8(b)所示,然后通过沉积的掩模层880掩蔽au电极89,然后将其图案化以覆盖除电极最尖端890之外的大部分电极表面区域,以减轻在电极其它区域上的不需要的生物分子附着。用于此目的的绝缘膜可包括例如pmma、peg、pdms、al2o3、sio2或si3n4。因此留下暴露的au电极尖端890的理想尺寸直径约为5-9nm。每个电极还包括引线802和820。用于同时制造如图9中详述的大量装置(例如超过10000个装置)的纳米压印是可能的。在各种实施方式中,大规模平行电极阵列可包括至少1000个,优选至少10000个,甚至更优选至少1百万个装置。
图9显示au纳米尖端结构化电极对90的示例性阵列,用于核苷酸附着或脱离事件的大规模平行、无标记地检测(例如,100×100装置阵列或1000×1000阵列),具有位于电极对间隙区域附近的图案限定的暴露的au电极尖端990(或经活化用于固定生物分子的其他导体岛)。引线920可以是au或任何其他导体(例如,ag,cu,pt,pd或rh),用图案化的顶部涂层98绝缘。用于无标记检测核苷酸附着或脱离的所有电极对被绝缘膜98(例如,pmma、peg、pdms或sio2、al2o3或si3n4)掩蔽,以覆盖除电极尖端990之外的au电极表面,如图所示。可以使用图9中示例的阵列结构配置(包括所示的各个引线920)实时进行核苷酸附着的询查。
使用图10所示的阵列配置,电信号询查的替代实施实施方式是可能的。在该配置中,将来自装置阵列1000的电极对右侧的所有引线短接(short)到公共引线1020中。该阵列还包括绝缘体层1008,其覆盖除暴露的au尖端1009之外的大部分电极阵列。使用所描绘的配置,核苷酸附着的询查包括:执行顺序询查,其中所有引线的右侧短接到公共引线1020,然后以一次(例如每毫秒)一个的方式与存在于电极对的左侧的各个电引线1021轮换。与一次处理数千个并行信号相比,该方法导致更少的电测量复杂性。
图11显示分子电子基因组测序平台的示例性三维阵列。根据前两个图中的实施方式,电绝缘顶部涂层1108,例如聚合物或氧化物层(例如,pmma,peg,pdms,氧化铝,硅氧化物,硅氮化物等)经施加并图案化以覆盖电极对1100中除了电极最尖端1109之外的所有电极表面。该保护涂层用作电绝缘体,但也用作防止或最小化生物分子在不希望的位置处黏附的涂层。根据图10中的配置,右侧电极引线可以短接到公共引线1120中,而左侧引线1121可以单独留下用于顺序询查。
如果图9或图10型天线阵列测序结构以三维方式堆叠,如图11所示,代表分子电子基因组测序平台的三维阵列,则可以获得甚至更大的数据。3d阵列还包括用于每个二维阵列的伴随微流体室(如图11(a)所示,其中100至1000层,每层包括约10000个装置和微流体室),或者在替代实施方式中,包括一个或多个常见微流体室包装整个三维阵列(如图11(b)所示,其中100至1000层传感层,每层具有约10000个装置,全部装入一个微流体室中)。在这种3d配置中,可以同时操作至少一百万到十亿个装置用于极快的dna或基因组测序。电子测序对装置的理想填充密度为至少10000/cm2,优选至少100000/cm2,更优选至少1,000,000/cm2,甚至更优选至少10000000/cm2。
根据本发明的基因组或dna测序结构和系统在图12的流程图中描述。并入适当的控制和信号分析/整合软件和计算机系统,并且使用生物分子和偶联剂以及待测序的dna和核苷酸将微流体系统连接到大规模并行电子检测系统。
其他实施方式
在各种实施方式中,dna或基因组测序结构包含电极对阵列,成对的每个电极由纳米间隙隔开并且包含具有降低的接触电阻的强黏附且高度导电的岛,以及生物分子,所述生物分子用其每个末端牢固连接在一个导电岛上以桥接纳米间隙,其中导电岛在au电极上包括纳米图案限定的au,au岛尺寸为亚10nm并且还包括dna或基因组测序的电子器件,其在核苷酸附着上使用dc、rf或脉冲信号,而不使用荧光元件。
在各种实施方式中,基于非au电极的dna或基因组测序结构包含电极阵列和强黏附且高度导电的au或具有降低的接触电阻的其他导电岛,其中生物分子牢固地附着在导电岛对上,au岛尺寸为亚10nm,并且电极基材选自pt,pd,rh和ag,具有dna或基因组测序的电子器件,该器件在核苷酸附着上使用dc、rf或脉冲信号而不使用荧光元件。
在各种实施方式中,黏附导体由au制成,其与电极表面的接触面积为au岛直径的至少50%,优选%100。
在各种实施方式中,黏附金纳米岛是支化的或多孔的,孔隙率为至少10%、优选至少30%、甚至更优选至少50%,以使金岛顶表面的表面积比平坦且光滑的au纳米岛结构增加至少20%、优选至少40%、甚至更优选至少60%。
在各种实施方式中,通过选自以下列的一种或多种方法获得au岛表面积的增加:i)等离子体蚀刻;ii)离子注入和任选的退火热处理;iii)金(au)纳米颗粒附着和键合;iv)从纳米复合结构中选择性溶解非au组分;或v)去合金化过程。
在各种实施方式中,该结构包括具有至少1000、优选至少10000、甚至更优选至少1百万个装置的并行装置,所述装置通过选自下述的的一种或多种方法制造:纳米图案化方法例如纳米压印光刻,阴罩式图案化、电子束光刻、极端uv光刻或x射线光刻。
在各种实施方式中,该结构包括与微流体系统组合的具有至少10000,优选至少1百万,甚至更优选至少1亿个装置的多层装置。
在各种实施方式中,通过连接的结构实现电极的顺序询查,其中装置阵列引线的一侧被组合成公共引线。
在各种实施方式中,使用抗体-抗原偶联,链霉亲和素-生物素偶联,肽键合,巯基-金结合,金结合性蛋白或其他偶联配置将生物分子附连至au岛。
在各种实施方式中,基因组或dna测序系统包括含有本文所述的多种生物分子传感装置的腔室,以及提供或维持生物分子、核苷酸、pbs或水溶液以及其他所需材料的微流体子系统。
在各种实施方式中,通过重复的球化退火和顶部蚀刻逐渐减小au岛直径,该过程通过至少2个球化循环和部分顶部蚀刻来重复以减小高度和直径。
在各种实施方式中,高度降低蚀刻包括化学蚀刻或等离子体蚀刻。
在各种实施方式中,该结构包括添加的磁性层以增强磁性颗粒标记的生物分子的附着,其中磁性颗粒基于具有天然化学稳定性的氧化物材料或表面涂有薄氧化物或金的金属合金材料,以用于抗腐蚀保护(腐蚀速率降低至少50%)和/或增强对生物分子的亲和性(生物分子附着的可能性增加至少50%)。
在各种实施方式中,磁性颗粒选自fe2o3、fe3o4、具有比氧化铁更高磁矩的表面保护的或表面官能化的金属磁性颗粒,包含fe,co,ni及其合金。
在各种实施方式中,磁性层被磁化或去磁以使得能够进行生物分子的磁性吸附附着或能够通过永磁体扫掠来去除和清除附连的生物分子,允许测序装置的多次重复操作至少10次,优选至少1000次。
在各种实施方式中,公开了与图1-12相关联的操作方法、组装方法和其中的说明。
在各种实施方式中,用于dna测序的这些装置结构可用于癌症检测和其他医学用途。
在各种实施方式中,这些装置可用于人类基因组测序。
上述实施方式仅用于举例说明本发明,而不是限制本发明的范围。根据本发明的精神的任何等同修改或变化也包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!