一种真菌灭蚊剂及配制方法与流程
本发明属于生物防治领域,具体涉及一种真菌灭蚊剂及配制方法。
背景技术:
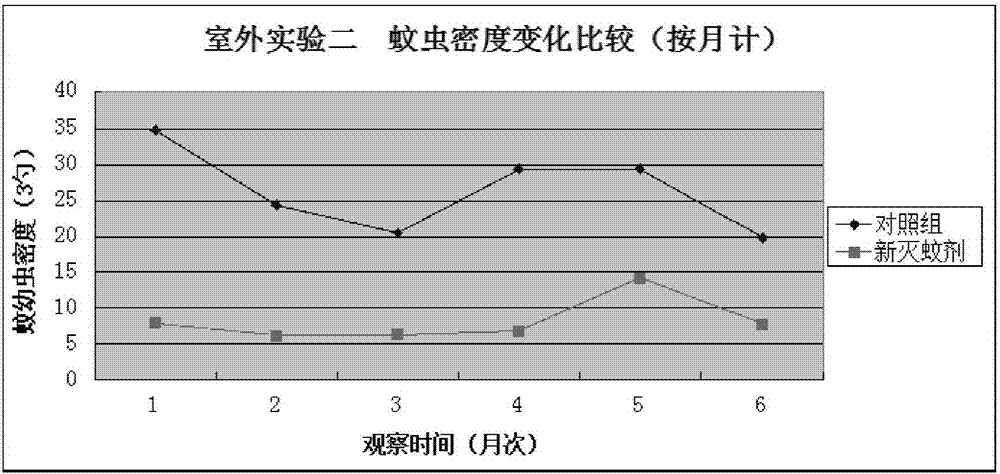
:目前,全世界控制蚊虫主要采用化学杀虫剂。化学杀虫剂对环境造成严重污染,破坏生态平衡、诱导害虫产生抗药性,迫使人们不断地开发新的化学杀虫剂,而进入恶性循环,因此需要开发绿色环保的控制蚊虫手段。害虫生物防治是采用自然界存在的生物或其产物控制害虫,此方法不污染环境、不破坏生态平衡,不易引起害虫的抗药性,成为害虫治理的理想手段。与农业害虫、森林害虫生物防治相比,医学昆虫的生物防治研究非常薄弱。其表现之一就是可用于控制医学昆虫的生物太少。从全世界范围来看,实际用于生物灭蚊的只有苏云金杆菌以色列变种(bacillusthuringiensisvar.israelensis,bti)和球形芽孢杆菌(bacillussphaericus,bs)这两种细菌。它们的灭蚊原理是胃毒作用。细菌芽孢所伴生或携带的毒素蛋白被蚊幼虫摄入,在蚊胃的碱性环境中发挥作用,破坏蚊幼虫的消化道壁后进入其血体腔导致蚊虫死亡。但这两种细菌制剂具有很大局限性。第一,持效期短。芽孢在蚊虫孳生水体中基本上不能定植。反而会被淤泥包裹不被蚊虫摄入而失去作用,或者受紫外线作用而分解。因此持效期比较短,特别是bti一般在室内可维持2周,在室外只能维持1周左右。照此计算,一个蚊虫季节(一般按3个月算)需要反复施药10次左右。bs的持效期稍长,但是实际应用中也很难达到30天。第二,bs对伊蚊的毒力比较弱,对登革热的媒介白纹伊蚊没有作用。而登革热在广东的传播媒介就是白纹伊蚊和埃及伊蚊,所以在控制登革热方面,其作用比较小。第三,有可能诱导蚊虫的抗药性,特别是bs,最近有报道说它很容易诱导蚊虫的抗性。真菌杀虫剂比细菌杀虫剂有很大优势。其中最明显的是1.因为入侵环节复杂而不诱导害虫的抗药性;2.可以引起害虫的流行病,因此有长持效期;3.可以从害虫体壁侵入,即使害虫不能经口摄入也能被感染。所以真菌是很好的杀虫微生物。但是到目前为止,真菌灭蚊还没有进入真正实用阶段。曾经有人采用绿僵菌分生孢子控制成蚊,或采用绿僵菌和白僵菌的分生孢子控制蚊幼虫效果都不理想,不方便推广使用。腐霉属真菌贵阳腐霉(pythiumguiyangense,简称pg)是一种灭蚊真菌,对环境适应性强,其无性繁殖阶段游动孢子可以在水中主动搜寻蚊幼虫,在幼虫体壁囊化,发出芽管,伸入后者体内,生长繁殖,夺取营养,破坏组织,使蚊幼虫死亡。其菌丝再从蚊尸中伸出体表,释放游动孢子进一步感染新的蚊幼虫,从而在蚊群中造成流行病,产生长期制约蚊虫种群的效果。同时,由于pg的灭蚊机理复杂,涉及很多环节,蚊虫不易产生抗药性。但是,pg的灭蚊过程比较慢,在刚施用时杀蚊作用不明显,因而不易被大家接受,其应用由此受限。腐霉属真菌卡地腐霉(pythiumcarolinaria,简称pc),也是一种灭蚊真菌,其灭蚊机理和灭蚊效果与pg类似。公告号为cn102907458a的专利公开了一种生物灭蚊剂,由灭蚊真菌pg或pc与灭蚊细菌bti或bs复配制得,但是因为bti和bs持效期短,可能出现其灭蚊作用与pg/pc衔接不上的现象,导致灭蚊效果下降。因此,寻找和开发效果良好的新型生物灭蚊剂是当务之急。技术实现要素:本发明的目的在于提供一种真菌灭蚊剂及配制方法。本发明提供了腐霉属真菌与大链壶菌联合使用在制备灭蚊药物中的用途,其中,所述的腐霉属真菌与大链壶菌的重量配比为:腐霉属真菌1-10份,大链壶菌1-10份。两种真菌的重量以湿菌丝计算,湿菌丝:是指把菌丝滤干,吸干水分至用手轻捏不出水为止。其中,所述的腐霉属真菌与大链壶菌的重量配比为:腐霉属真菌3份,大链壶菌3份。其中,所述的腐霉属真菌为贵阳腐霉和/或卡地腐霉;优选地,贵阳腐霉3份,大链壶菌3份。本发明还提供了一种真菌灭蚊剂,它是由下述重量配比的真菌制备而成:腐霉属真菌1-10份,大链壶菌1-10份。其中,它是由下述重量配比的真菌制备而成:腐霉属真菌3份,大链壶菌3份。其中,所述的腐霉属真菌为贵阳腐霉和/或卡地腐霉;优选地,贵阳腐霉3份,大链壶菌3份。其中,它是以腐霉属真菌和大链壶菌为活性成分,加入药学上可接受的辅料或辅助性成分制备而成的制剂;其中,所述制剂的剂型为胶囊剂、片剂、散剂、丸剂、混悬剂、乳剂。本发明还提供了上述药物的制备方法,它包括如下步骤:a、取腐霉属真菌、大链壶菌,分别培养;b、将培养后的两种真菌混合,加入药学上可接受的辅料或辅助性成分制备而成的制剂。其中,步骤a中,所述腐霉属真菌为贵阳腐菌和/或卡地腐霉;所述培养的培养基为sfe、kpyg2或大米液体培养基,培养的温度为25℃±1℃,培养的时间为6-7天。本发明还提供了上述药物组合物在制备灭蚊药物中的用途。持效期的意义:北温带,一般一个蚊虫季节按3个月算。如果用bti控制蚊虫,因为它的持效期只有7-10天,为保存控蚊效果就必须每10天重复施药一次,3个月施用至少9次。如果灭蚊剂可以持效3个月,只用一次就行。这样就可以节约大量的人力物力和财力,特别是在面积巨大的湿地进行灭蚊,持效期长的灭蚊剂非常有价值。大链壶菌(lagenidiumgiganteum,简称lg),属于链壶菌科链壶菌属(lagenidium),灭蚊能力强,对池塘、轮胎、树木、混凝土箱、花园蓄水缸积水和稻田中孳生的多种蚊幼虫均具有很好的防治作用。其感染蚊幼虫的机制类似于pg/pc,因此具有主动侵入蚊虫宿主,并引起蚊虫流行病的作用,且不易引起蚊虫的抗药性。本发明采用腐霉属真菌pg或pc,与大链壶菌lg进行一定比例复配制备的真菌灭蚊剂,具有如下优点:1、灭蚊范围广,其灭蚊谱比较二者单一使用时显著扩大,灭蚊效果好;2、持效期长,由于lg可以在蚊虫孳生水体中定植,因此有较长的持效期。它可以与起效比较慢的pg/pc的作用做很好的衔接,从而起到更好的控制蚊幼虫的作用;3、lg和pg/pc在生态系统中表现出协同作用。二者共同生长,相互有支持作用。即pg/pc的存在有利于lg在水中生长,它们在水中形成的真菌群落可以更好地发挥控制蚊虫的作用。本发明真菌灭蚊剂的灭蚊效果明显优于单独使用腐霉属真菌pg/pc或大链壶菌lg。因此,本发明将腐霉属真菌和大链壶菌lg组合在一起,发挥了二者的协同作用,取得了预料不到的技术效果,提供了一种效果优良的灭蚊药物。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1室外实验一,蚊虫密度变化比较(按月计)图2室外实验二,蚊虫密度变化比较(按月计)图3室外实验三,蚊虫密度变化比较(按周计)具体实施方式下面以实施例作进一步说明,但本发明不局限于这些实施例。本发明使用的试剂、设备均为已知产品,通过购买市售产品获得。本发明所用的培养基如下:1.kpyg2培养基(固体培养基加琼脂1.5-2%)2.葵花籽培养基(sfe)(1)取生葵花籽(去壳)100g高速粉碎1分钟(2)加入双蒸水1000ml高速粉碎2分钟(3)用4层纱布过滤(4)滤渣中加入双蒸水1000ml,混匀,再用4层纱布过滤(5)将两次滤液混合(6)分装,速冻备用(7)用时解冻,用双蒸水稀释1倍3.大米培养基(1)取生葵花籽(去壳)100g高速粉碎1分钟(2)加入双蒸水1000ml高速粉碎2分钟(3)用4层纱布过滤(4)滤渣中加入双蒸水1000ml,混匀,再用4层纱布过滤(5)将两次滤液混合(6)分装,速冻备用(7)用时溶解,每100ml加入维生素h20μg,高压灭菌。本发明中真菌的培养方式如下:1.琼脂平板培养上述培养基加1.5%-2%琼脂,倒平板。将菌丝接种于平板上,置25℃±1℃培养。2.液体培养将0.5g湿菌丝接种于100ml上述液体培养基,置摇床培养。摇床转速120r/min,温度25℃±1℃。实施例1本发明灭蚊剂的制备1、采用sfe液体培养基摇床分别培养灭蚊真菌pg,pc和lg6天,培养温度25℃±1℃,摇床转速120rpm;滤出菌丝,无菌水洗涤3次,加水至原体积,粉碎机高速粉碎(pg和pc10秒,lg6秒),过滤,吸去水分,做成湿菌丝(湿菌丝是指把菌丝滤干,吸干水分至用手轻捏不出水为止);2、按pg与lg1:1-10重量比例混合,或pc与lg1:1-10重量比例混合,或pg+pc与lg1:1-10比例混合,分别获得pg+lg和pc+lg,以及pg+pc+lg三种湿菌丝,无菌条件下包装。实施例2本发明灭蚊胶囊的制备1.采用sfe液体培养基摇床分别培养灭蚊真菌pg,pc和lg6天,培养温度25℃±1℃,摇床转速120rpm;滤出菌丝,无菌水洗涤3次,加水至原体积,粉碎机高速粉碎(pg和pc10秒,lg6秒),备用;2.配制1%~3%(w/v)海藻酸钠溶液;3.将灭蚊真菌菌丝悬液分别与海藻酸钠溶液按1:4比例混合,拌匀;4.将上述混合液分别缓慢滴入1%~5%(w/v)氯化钙溶液,微胶囊颗粒形成,沉淀,0.5~3小时后滤出微胶囊,清水冲洗备用;5.按pg微胶囊与lg微胶囊1:1-10比例混合,或pc微胶囊与lg微胶囊1:1-10比例混合,或pg+pc微胶囊与lg微胶囊1:1-10比例混合,分别获得pg+lg和pc+lg,以及pg+pc+lg三种产品,无菌条件下包装。实施例3本发明灭蚊胶囊的制备1.采用sfe、kpyg2或大米液体培养基摇床分别培养灭蚊真菌pg,pc和lg6天,培养温度25℃±1℃,摇床转速120rpm;滤出菌丝,无菌水洗涤3次,加水至原体积,粉碎机高速粉碎(pg和pc10秒,lg6秒),备用;2.配制1%~3%(w/v)海藻酸钠溶液;3.将灭蚊真菌菌丝悬液分别与海藻酸钠溶液按1:4比例混合,拌匀;4.将上述混合液分别缓慢滴入1%~5%(w/v)氯化钙溶液,微胶囊颗粒形成,沉淀,0.5~3小时后滤出微胶囊,清水冲洗备用;5.按1倍量pg或pc微胶囊与1-10倍量的lg微胶囊的比例混合,或按pg+pc与lg按1:1-10比例混合,分别获得pg+lg和pc+lg,以及pg+pc+lg三种不同的产品,无菌条件下包装。以下通过试验例具体说明本发明的有益效果:试验例1本发明灭蚊剂的效果测定一、室外人工模拟水体法1、实验方法:(1)塑料小桶(桶底直径13cm,桶深22cm),盛自来水4l,加入灭菌土壤50g,分别加入待测真菌(菌丝悬液或带菌丝琼脂块),不定期加入蚊幼虫或蚊卵,每周二次抽样检测桶内的蚊虫数目。计数方法:每桶在蚊虫聚集处取水3勺,按龄期分别计数蚊虫数。比较不同处理条件下,各桶中蚊虫的数目多少。(2)塑料大桶(桶底直径36cm,桶深80cm),水深65cm,加入灭菌土壤1000g,加入待测菌(菌丝悬液或带菌丝琼脂块),不定期加入蚊幼虫或蚊卵。(3)观察方法a观察蚊虫密度:每周二次抽样检测桶内的蚊虫数目。计数方法:每桶在蚊虫聚集处取水3勺,按龄期分别计数蚊虫数。比较不同处理条件下,各桶中蚊虫的数目多少。蚊虫密度越小说明灭蚊效果越好。b:采用哨位蚊观察:小尼龙网固定在塑料泡沫上漂浮在水中,取晚二龄或早三龄蚊幼虫25只放进小尼龙网中,置于测试真菌的水体内,48小时后取出,置实验室继续饲养,观察感染情况,以确定和比较不同处理的桶里真菌控制蚊虫的能力。哨位蚊感染得越多,说明桶内灭蚊真菌的作用越强。2、实验结果(1)小桶中蚊群变化情况共做了3次室外人工模拟,准自然环境灭蚊实验。采用6升容量的小桶,内盛自来水4升,加入灭菌泥土50g/桶,不定期加入实验室饲养的致倦库蚊蚊幼虫或蚊卵,桶上加盖不锈钢网篮,每周2-3次计数。每桶数3勺,取总数。采用spss进行统计分析。实验一共计观察54次;实验二共计观察29次;实验三共计观察23次。注:对照组指:不加灭蚊剂,其它条件与灭蚊剂组处理相同。实验一所用新型生物灭蚊剂为lg+pg,用的是带菌丝的琼脂块,分别加pg和lg琼脂块45cm2/桶(二者琼脂块体积相同,菌用量近似相当)。实验二所用新型生物灭蚊剂为lg+pg,用的是匀浆后的菌丝体,分别加pg和lg菌丝悬液各20ml/桶(二者菌丝悬液体积相同,菌数相同)。实验三所用新型生物灭蚊剂为lg+pc,用的是带菌丝的琼脂块,分别加pc和lg琼脂块45cm2/桶。其中,菌丝悬液培养方法如下:采用sfe液体培养基摇床分别培养灭蚊真菌pg,pc和lg6天,培养温度25℃±1℃,摇床转速120rpm;滤出菌丝,无菌水洗涤3次,加水至原体积,粉碎机高速粉碎(pg和pc10秒,lg6秒),即可;菌丝琼脂块培养方法如下:取lg或pg或pc的菌丝体悬液1ml,无菌条件下均匀涂抹在直径90mm的琼脂培养基上,加盖,置25℃±1℃培养6天。(菌丝琼脂块也可以按一种比较简便的方法:取约40mm2的长有lg或pg或pc菌丝的琼脂块,无菌条件下接种于90mm的琼脂培养基中央,加盖,置25℃±1℃培养6天)。实验结果见图1-3。可见,使用本发明真菌灭蚊剂可大大降低蚊虫密度,具有良好的灭蚊效果。(2)小实验桶中的哨位蚊感染情况(室外小桶法)2014年11月25日(实验第111天)加哨位蚊,观察真菌定植结果,见表1。表1小桶结果注:本实验为中所用真菌均为带菌丝的琼脂块,用量为每菌45cm2/桶。由表1可见,lg组的哨位蚊仅死亡5只,而且看不到真菌感染,说明其灭蚊作用已经不明显。而lg与pg或pc复配组中,不仅哨位蚊全部死亡并感染了pg或pc,而且还有蚊虫同时感染lg,说明由于pg或pc的存在,lg的生存时间和发挥作用的时间延长了。与bti+pg相比,lg与pg或pc的复配组哨位蚊不仅死亡,而且同时感染两种真菌,说明本灭蚊剂的灭蚊能力更强。可见,单独使用lg效果不佳,其持效期不如pg和pc的好,而当lg与pg或pc配合使用,lg的持效期也有改善,起到了协同增效的效果。(3)室外大桶实验结果室外大桶实验第一个月各种处理灭蚊效果比较(平均蚊虫密度),平均蚊虫密度计算:每周2次计数桶中的蚊虫密度,计数方法是用250ml的勺在桶里蚊虫聚集的地方取3勺,计数蚊虫,取平均数。再取每周两次所得数的平均数即为该周蚊虫的密度。结果见表2。表2大桶结果(各组蚊幼虫密度比较)组别(剂量)第一周第二周第三周第四周对照组150200180244lg(50ml)1081018pg(50ml)1801505025pc(50ml)2001809030lg+pg(25ml+25ml)10985lg+pc(25ml+25ml)98105注:大桶里的真菌采用的是匀浆后的菌丝悬液,每种真菌的单独用量分别是50ml/桶,复配用量是各25ml。可见,lg虽起效快,但持续时间较短,长期单独使用lg效果不佳;而pg或pc起效慢,单独使用效果较差;当lg与pg或pc配合使用时,发挥了二者的协同作用,在相同的剂量下,真菌复配时,灭蚊效果大大高于二者单独使用,取得了预料不到的技术效果。二、田间观察1、实验方法在野外蚊虫孳生水体加入待测真菌,观察加菌前和加菌后不同时期水里的蚊虫密度。用勺(250ml)在水体中5个不同部位各取一勺,以其中蚊虫的数目为指标进行前后比较,并和附近未加真菌的水体进行比较。对水中找到的死蚊取回镜检,以确认蚊虫是否被所施放的真菌感染。水中蚊幼虫数目越少说明灭蚊真菌的效果越好。待测真菌:为lg+pg复配组,制备方法如下:采用sfe液体培养基摇床分别培养灭蚊真菌pg和lg6天,培养温度25℃±1℃,摇床转速120rpm;滤出菌丝,无菌水洗涤3次,加水至原体积,粉碎机高速粉碎(pg10秒,lg6秒),分别得到二者的菌丝悬液;按菌丝悬液体积比lg:pg=2:3的比例混合,撒于水体边缘。用量为15ml/平米水面。2、实验结果投放本真菌灭蚊剂前调查该水体蚊虫密度,随机在5个不同部位取样,蚊虫密度约为平均每勺7条。投放5天后,蚊虫密度明显下降,约为每勺3条。至投放的第13天,蚊虫很少,偶尔可发现一条。此后2个月,基本上没有蚊虫。这时附近没有投放真菌的同样水体中蚊虫密度达到平均每勺10条。投药4个月后在水体中发现大量被真菌感染致死的蚊虫。这些蚊虫是后来孳生的,可是被水体内的真菌感染而死。持续观察发现该水体中第二年第三年蚊虫密度也明显低于比附近水体。可见,本发明真菌灭蚊剂实际使用时,灭蚊效果佳。三、室内实验1、实验方法:(1)白色塑料碗,消毒,盛200ml过夜自来水(使氯气散去),加入晚二龄或早三龄蚊幼虫25只,加入待测真菌(带菌丝的琼脂块133×3mm2三块,或菌丝体匀浆液若干微升),再加入鸡肝粉4%悬液6滴,每天观察2次,有死蚊虫便取出镜检,记录死蚊数和感染数,计算死亡率和感染率。感染标准为显微镜下看到虫体内有菌丝,包括活的和死的幼虫。只要看到菌丝,就记作感染。(2)塑料钵,容积2000ml.用于室内长期实验观察。内盛过夜自来水1000ml.少量灭菌泥土。不定期加入蚊幼虫。观察方法:随机取水样3次,计数其中蚊幼虫数,取3次取样的和,或取出死蚊,镜检,计数感染数,计算感染率。2、实验结果(1)第一周三种真菌的灭蚊效果比较采用白色塑料碗法,待测真菌为带菌丝的琼脂块133mm2。pg和pc每碗用三块,lg每碗用一块。结果见表3。表3实验第一周的室内结果注:实验组“校正感染率”为总感染率减去对照组死亡率;所用真菌为湿菌丝可见,早期灭蚊时,lg的效果较好,而pg、pc效果较差。(2)四个月各种处理情况的灭蚊效果比较(平均蚊虫密度)采用塑料钵法,结果见表4。表4实验四个月的室内结果(平均蚊虫密度)说明,本实验采用塑料钵。观察数据为蚊虫密度。可见,实验室结果与室外大桶结果一致。即lg虽起效快,但持续时间较短,长期单独使用lg效果不佳;而pg或pc起效慢,单独使用效果较差;当lg与pg或pc配合使用时,发挥了二者的协同作用,灭蚊效果大大提升,取得了预料不到的技术效果。(3)lg与pg不同配比的控蚊效果比较由于大链壶菌和腐霉对环境的适应性不一样,生长规律有差异,所以二者必须按一定的配比才能发挥很好的协同作用。采用塑料钵法,待测真菌为湿菌丝,结果见表5。湿菌丝制备方法如下:采用sfe液体培养基摇床分别培养灭蚊真菌pg和lg6天,培养温度25℃±1℃,摇床转速120rpm;滤出菌丝,清水洗净即可,称取后加入钵中。湿菌丝以手轻捏不出水为准。表5不同真菌配比(湿菌丝重量单位mg)控蚊效果比较(蚊虫感染率%)lg:pg(mg)第1月第2月第4月第6月10:506030306020:408050305030:3010095506040:2010095402050:10100905025注:感染蚊虫的两种真菌都有。两种真菌的感染率与投入的真菌比例有关。可见,lg与pgpg不同配比的灭蚊效果有差异,其中,lg与pg的比值为30:30时,短期、长期的蚊虫感染率都比较高,说明灭蚊效果均最优。低于此比值,短期灭蚊效果变差,而长期灭蚊效果也未见提高;高于此比值,短期灭蚊效果相当,但长期灭蚊效果下降。(4)不同真菌菌龄的选择采用塑料小碗法,不同菌龄真菌的灭蚊效果见表6-8。表6不同菌龄lg的灭蚊效果(蚊虫感染率,%)菌龄(天)第三天第六天第十天210152331525905608088680100100(第二批蚊虫)780100100(第二批蚊虫)注:1.lg用湿菌丝,30mg/碗。2.“第二批蚊虫”是指第一批蚊虫完全感染死亡后再加入的第二批蚊虫表7不同菌龄pg的灭蚊效果(蚊虫感染率,%)菌龄(天)第三天第六天第十天213537916525283063642467323842注:pg用带菌琼脂块133mm2,每碗三块。表8不同菌龄pc的灭蚊效果(蚊虫感染率,%)菌龄(天)第三天第六天第十天202334715527303262945507223944注:pc用带菌琼脂块133mm2,每碗三块。可见,三种真菌均是菌龄6-7天(即将真菌培养6-7天),蚊虫感染率最高,灭蚊效果最优,其中更佳菌龄为6天。(5)不同培养基的选择采用塑料小碗法,不同培养基对三种真菌的灭蚊效果见表9-11。表9不同培养基培养的6天龄lg的灭蚊效果(蚊虫感染率,%)培养基第三天第六天第十天kpyg2607085大米加维生素h808992sfe90100100(第二批蚊幼虫)注:lg用湿菌丝,30mg/碗。表10不同培养基培养的6天龄pg的灭蚊效果(蚊虫感染率,%)培养基第三天第六天第十天kpyg221018大米加维生素h304548sfe384849注:pg用带菌琼脂块133mm2,每碗三块。表11不同培养基培养的6天龄pc的灭蚊效果(蚊虫感染率,%)培养基第三天第六天第十天kpyg21619大米加维生素h283539sfe303845注:pc用带菌琼脂块133mm2,每碗三块。可见,各培养基均可用于培养三种真菌,其中,最佳培养基均为sfe。试验例2本发明灭蚊剂的制备方法筛选1、菌丝体粉碎成悬液时,粉碎的力度和时间的选择pc和pg的菌丝体比较细长而相互缠绕比较耐粉碎。对粉碎到不同尺寸的菌丝进行再培养观察,发现菌丝被打断以后,只要菌丝段在10微米以上,在条件适合的时候还是可以活的。最后定为pg(或pc)用匀浆机高速匀浆10秒钟就行了。如果时间太长,菌丝段太小,真菌不容易活。lg的菌丝不像pg和pc那样细长。它的菌丝比较粗,但是往往分成很多小圆珠(前孢子囊),比较容易分散。所以lg的粉碎时间要短,高速粉碎6秒就行。2、制作海藻酸钠微胶囊时,海藻酸钠浓度的选择比较了不同浓度的海藻酸钠溶液配制出来的pg、pc、和lg的海藻酸钠微胶囊。所试的海藻酸钠浓度从0.2%、0.3%、0.5%、1%和2%。经过比较发现:0.2%-0.5%浓度太低,做成的微胶囊不易成形,而且水分容易析出。2%浓度的海藻酸钠硬度太大,里面的菌丝不容易长出来发挥灭蚊作用。而采用1%浓度的海藻酸钠,加入菌丝体悬液后海藻酸钠的最终浓度为0.8%,做成的胶珠直径大约为350微米,硬度适中,便于施用,里面的真菌也很容易长出来。综上,本发明的真菌灭蚊剂具有显著的灭蚊效果,灭蚊效果好、持效期长,均明显优于单独使用腐霉属真菌或大链壶菌。本发明将腐霉属真菌和大链壶菌组合在一起,发挥了二者的协同作用,取得了预料不到的技术效果,提供了一种效果优良的灭蚊药物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1