粪生链霉菌产生的挥发性物质在植物病害防治中的应用的制作方法
本发明涉及植物病害生物防治领域,尤其涉及粪生链霉菌产生的挥发性物质在植物病害防治中的应用。
背景技术:
植物病害是影响农产品效益的重要因素之一,目前对植物病害的防治主要采用化学药物,但化学药物存在毒副作用强、容易残留、环境污染以及抗药性等一系列问题,化药的使用越来越受到限制。利用生防菌或其代谢产物进行植物病原菌的防治,具有周期短、低毒、无污染和便于生产等优点,是农产品绿色防控的有效途径。
但是目前利用单一生防菌进行生物防治存在功能单一的局限性,还不能满足生产需求,还需分离抗菌谱更广的菌株,应用此类菌株为多种病害的高效防控提供技术支撑。
技术实现要素:
本发明提供一种粪生链霉菌产生的挥发性物质在植物病害防治中的应用,解决现有技术中的单一生防菌功能单一的问题。
本发明采取的技术方案如下:
粪生链霉菌产生的挥发性物质在植物病害防治中的应用。
优选的,所述植物病害为由荔枝霜疫霉、辣椒疫霉、芋疫霉、群结腐霉、链格孢属、香蕉枯萎病菌4号小种、香蕉枯萎病菌1号小种、小麦赤霉病菌、荔枝炭疽病菌、香蕉炭疽病菌、水稻稻瘟病菌、火龙果黑斑病菌、新暗色柱节孢、葡萄溃疡病菌或番木瓜疮痂病菌引起的植物病害。
优选的,所述挥发性物质的制备方法为:
S1:将粪生链霉菌菌株在PDA平板上划线培养7d,刮取新鲜孢子接入ISP2培养基后,置于摇床上振荡培养,然后制备孢子悬浮液,接种到小麦粒培养基上培养,得粪生链霉菌小麦粒培养物;
S2:将小麦粒培养物放入小瓶中,密封放置后,萃取。
优选的,所述挥发性物质的制备方法中,步骤S1为:
S1:将粪生链霉菌菌株在PDA平板上划线培养7d,刮取新鲜孢子接入含有100mL ISP2培养基的三角瓶内,然后置于摇床上,以200rpm、28℃振荡培养3d,制备浓度1×107个孢子/mL的孢子悬浮液,按1mL/100g的比例接种到小麦粒培养基上,摇匀后,置于25℃条件下培养21-28d,其间每3d将小麦粒培养基摇匀一次。
优选的,所述挥发性物质的制备方法中,步骤S2为:
S2:称取培养21-28d的粪生链霉菌小麦粒培养物放入瓶中,密封后25℃下放置12h,然后用SPME萃取头萃取。
优选的,所述挥发性物质包括以下活性成分:
与现有技术相比,本发明的有益效果是:
(1)粪生链霉菌产生的挥发性物质能够抑制15种植物病原菌的生长,其中对荔枝霜疫霉、群结腐霉、链格孢属、小麦赤霉病菌、香蕉炭疽病菌和水稻稻瘟病菌抑制作用最强,抑制率达100%。
(2)明确了粪生链霉菌产生的挥发性物质中7种具有明显抑菌作用的化合物,为今后研究荔枝霜疫霉、群结腐霉、链格孢属、小麦赤霉病菌、香蕉炭疽病菌和水稻稻瘟病菌等植物病原菌的防治药物提供方向。
附图说明
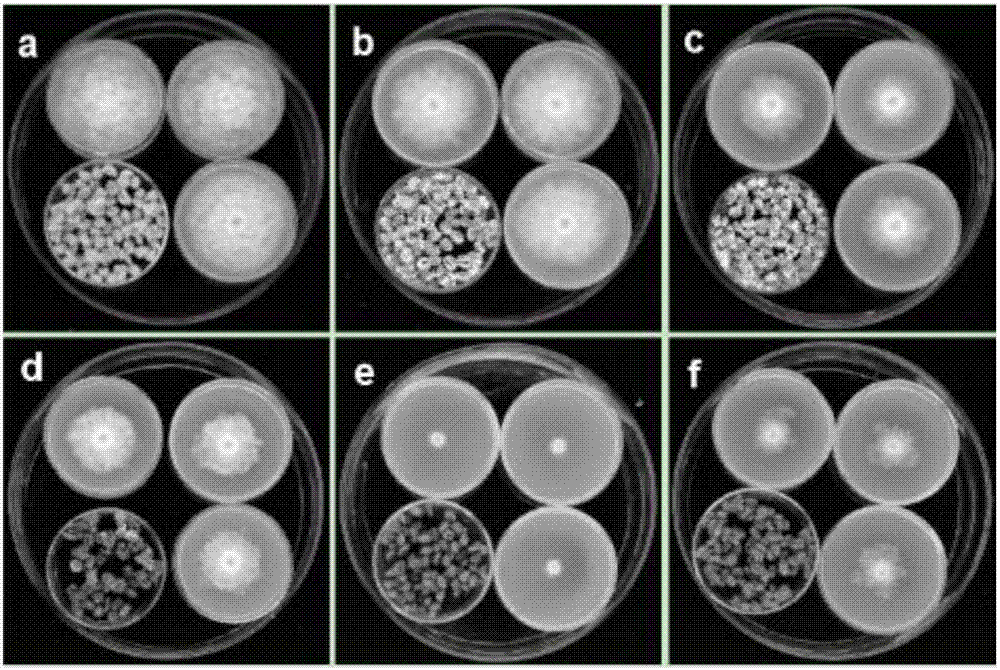
图1为粪生链霉菌BWL-H1产生的挥发性物质对各植物病原菌的抑制效果图;
图2为不同培养时间对粪生链霉菌BWL-H1产生挥发性物质抑菌活性影响效果图;图中a,b,c,d,e,f分别为对照和粪生链霉菌BWL-H1在小麦培养基上培养4d、7d、14d、21d、28d的培养物的处理。
图3为不同培养时间对粪生链霉菌BWL-H1产生挥发性物质抑菌活性影响结果统计图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。
本发明实施例所用的实验方法如无特殊说明,均为常规方法。
本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明所述粪生链霉菌菌株BWL-H1(Streptomyces fimicarius BWL-H1),由海南大学植物保护学院植物病害生物防治实验室分离保存,可由现有技术中的常规方法获得。
本发明所述荔枝霜疫霉(Peronophythora litchii)、辣椒疫霉(Phytophthora capsici)、芋疫霉(Phytophthora coloc asiae)、群结腐霉(Pythium myriotylum)、链格孢霉属(Alternaria alternata)、水稻稻瘟病菌(Pyricularia grisea)、新暗色柱节孢(Neoscytalidium dimidiatum)、葡萄溃疡病菌(Lasiodiplodia theobromae)、小麦赤霉病菌(Fusarium graminearum)、黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum)、火龙果黑斑病菌(Bipolaris cactivora)、香蕉炭疽病菌(Colletotrichum musarum)、荔枝炭疽病菌(Colletotrichum gloeosporioides)、香蕉枯萎病菌4号小种(Fusarium oxysporum f.sp.cubense Race 4)、香蕉枯萎病菌1号小种(Fusarium oxysporum f.sp.cubense Race 1)、苹果轮纹病菌(Botryosphaeria berengeriana f.sp.)、番木瓜疮痂病菌(Cladosporium caricinum)为海南大学植物保护学院植物病害生物防治实验室分离保存,可由现有技术中的常规方法获得。
本发明实施例所用马铃薯葡萄糖培养基(PDA):去皮马铃薯200g,葡萄糖15g,琼脂18g,蒸馏水1000mL。
酵母提取物麦芽糖培养基(ISP2):酵母膏10g,琼脂粉20g,麦芽浸粉10g,葡萄糖4g,琼脂粉20g,蒸馏水1000mL,pH 7.2-7.4。
小麦粒培养基:将小麦加足水煮沸至表皮开裂后过滤,晾干,分装灭菌。
实施例1、粪生链霉菌BWL-H1产生挥发性物质的制备
将粪生链霉菌BWL-H1菌株在PDA平板上划线培养7d,刮取新鲜孢子接入含有100mL ISP2培养基的250mL三角瓶内,然后置于200rpm的摇床上28℃振荡培养3d,制备孢子悬浮液(约1×107个孢子/mL),按1mL/100g(V/W)的比例接种量接种到无菌的小麦粒培养基上。摇匀后,置于25℃条件下培养21d,其间每3d将小麦粒培养基摇匀一次,以便菌株BWL-H1均匀生长。
实施例2、粪生链霉菌BWL-H1产生的挥发性物质的抑菌谱测定
将供试病原菌接种到PDA培养基上,25℃恒温培养箱中培养6d然后用打孔器在菌落外缘制取菌饼,置于新鲜PDA平板中央,称取20g/L粪生链霉菌BWL-H1小麦粒培养物(制备方法参见实施例1)移入90mm培养皿中,然后将两皿底相对扣在一起,最后用封口膜将两个培养皿紧密的封在一起,做成一个双皿对扣的装置,病原菌在上,小麦培养物在下,这样既可以防止粪生链霉菌BWL-H1与病原菌接触,又能让它之间的气体充分流动,以20g/L的无菌小麦粒为对照。将双皿对扣装置放置在25℃培养箱中培养,每天观察,待各病原菌对照菌落长满培养皿时测量抑菌圈的直径,用十字交叉法测量菌落直径,计算抑制率,每个处理3个重复,实验重复3次。结果见表1和图1。
菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
表1:粪生链霉菌BWL-H1产生的挥发性物质的抑菌谱
实验结果表明粪生链霉菌BWL-H1产生的挥发性物质能够抑制15种植物病原菌的生长,其中对荔枝霜疫霉、群结腐霉、链格孢属、小麦赤霉病菌、香蕉炭疽病菌和水稻稻瘟病菌的抑制作用最强,菌丝完全不生长,抑制率达100%。而不能完全抑制的病原菌,其菌丝体非常稀薄,肉眼很难看清楚。
实施例3、培养时间对粪生链霉菌BWL-H1产生挥发性物质抑菌活性的影响
在直径150mm,高30mm大培养皿中(内部总体积500mL)放置四个小培养皿底其中3个小培养皿含约5mL的PDA培养基,并在培养基中央接种一块荔枝霜疫霉菌饼另外一个小培养皿放置16g/L粪生链霉菌BWL-H1麦粒培养物(分别培养了4d、7d、14d、21d、28d),以16g/L的无菌小麦粒为对照,然后将大培养皿密封。在25℃恒温培养6d,测量菌落直径并计算抑菌率。每个处理3个重复,实验重复3次。结果见图1。
结果表明:不同的培养时间对粪生链霉菌BWL-H1产生挥发性抑菌活性物质具有显著的影响。粪生链霉菌BWL-H1在小麦培养基上培养21d产生的挥发性物质抑菌活最强,抑菌率达92.8%;其次为培养28d的处理,抑菌率达82.7%;而培养7d和14d的处理的抑菌率分别为51.6%和54.1%,它们之间没有显著性差异;培养4d的处理的抑菌率最低,为8.5%。
实施例4、挥发性物质的收集及鉴定
称取培养21天的粪生链霉菌BWL-H1麦粒培养物4g放入20mL小瓶中,用锡铂纸密封后25℃下放置12h,然后用SPME萃取头扦入瓶中,推出纤维头[metal alloy(PDMS 100μm)]吸附30min后收回纤维头,将萃取头手动进样到GC-MS(Agilent 7890B American),250℃下解吸附3min,进行GC-MS分析。GC-MS操作条件参照(Banerjee,2010)。计算机自动将所得到的气体成分质谱与国际标准数据库(NIST 14Mass Spectrometry Library databases)数据进行比对,鉴定出挥发性物质的成分。以无菌空白等量小麦为对照,将对照与粪生链霉菌BWL-H1麦粒培养物中同时存在的物质去掉。每个处理3个重复。
经GC-MS检测培养21d的粪生链霉菌BWL-H1产生的挥发性物质,获得34种化合物。这些化合物多数分属于烯类、醇类、酯类、烷烃和酚类等。前期的抑菌实验表明,培养21d的麦粒培养物产生的挥发性物质的抑菌活性显著高于14d的,因此从培养21d的麦粒培养物产生的挥发性物质中选出6种14d中没有且含量较大的化合物:Phenylethyl alcohol(结构如式①,中文名:苯乙醇),Methyl salicylate(结构如式②,中文名:水杨酸甲酯),Phenylacetic acid ethyl ester(结构如式③,中文名:苯乙酸乙酯),Caryophyllene(结构如式⑥,中文名:石竹烯),4-ethyl-Phenol(结构如式⑦,中文名:邻氨基苯甲酸甲酯)和Humulene(结构如式⑧,中文名:α-律草烯),另外,Methyl anthranilate(结构如式④,中文名:邻氨基苯甲酸甲酯),α-Copaene(结构如式⑤,中文名:α-蒎烯)在21d中的含量比在14d中的含量高约为10倍,因此选用了此八种化合物用于下一步实验研究。
实施例5、人工合成挥发性化合物对荔枝霜疫霉菌丝生长、孢子囊产量、孢子囊萌发和芽管生长的影响
1、人工合成挥发性化合物对荔枝霜疫霉菌丝生长及孢子囊产量的影响
将4个小培养皿放置在一个大培养皿中,其中3个小培养皿含约5mL的PDA培养基,在培养基中央接种一块荔枝霜疫霉菌饼另一个小培养皿放置一片无菌正方形滤纸片(20mm×20mm),将人工合成化合物滴到滤纸片上,立即密封大培养皿,25℃恒温培养6d,测量菌落直径,然后用10mL无菌水分两次冲洗菌落表面,每次5mL,滤去菌丝,统计孢子囊产量。每个化合物设置5个不同浓度的处理,分别为2μL/L、20μL/L、200μL/L、500μL/L和1000μL/L,以等量无菌水为对照,每个处理3个重复,实验重复3次。结果见表2-表3。
2、人工合成挥发性化合物对荔枝霜疫霉孢子囊萌发、芽管生长的影响
在3个小培养皿中加入约3mL的PDA培养基,在培养基上5个点分别滴上2μL孢子囊悬浮液(5×104个孢子囊/mL),用封口膜密封大培养皿,25℃恒温培养2h后统计各处理孢子囊的萌发率(以芽管长度大于或等于孢子囊直径的1.5倍为萌发),每个处理统计200个孢子囊。培养3h后,测量芽管直径,每个处理测量50个孢子囊。每个处理3个重复,实验重复3次。结果见表4-表5。
表2:人工合成挥发性化合物对荔枝霜疫霉菌丝生长的影响
表3:人工合成挥发性化合物对荔枝霜疫霉孢子囊产量的影响
表4:人工合成挥发性化合物对荔枝霜疫霉孢子囊萌发的影响
表5:人工合成挥发性化合物对荔枝霜疫霉芽管生长的影响
在八种测定人工合成挥发性化合物抑菌活性测定中,Humulene对菌丝生长,孢子囊的形成均无抑制作用,在2μL/L、20μL/L时对孢子囊萌发、芽管生均无抑制作用,但200μL/L、500μL/L、1000μL/L表现出微弱的抑制作用。而另外的七种化合物在浓度为200μL/L、500μL/L、1000μL/L对菌丝生长、孢子囊产量、孢子囊萌发和芽管生长均具有强烈的抑制作用。特别是4-ethyl-phenol在浓度20μL/L-1000μL/L时完全抑制了荔枝霜霉孢子囊形成、孢子囊萌发和芽管生长(表3-表5)。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换。
- 还没有人留言评论。精彩留言会获得点赞!