一种中性突变体搭桥的植物自发突变基因的快速定位和克隆方法与流程
本发明属于植物基因工程技术领域。具体涉及一种中性突变体搭桥的植物自发突变基因的快速定位和克隆方法。即利用ems诱变产生的中性突变体来快速定位自发突变体基因的方法。
背景技术:
自发突变(spontaneousmutation)是指在没有经过人为干扰的情况下,生物体自然发生的突变。这种突变主要来源于生物体dna在复制过程中出现的碱基错配,自发病变或者转座子转座(griffiths等.anintroductiontogeneticanalysis.macmillan,2005)。生物体由于自发突变产生的突变体称为自发突变体,这种突变体不仅包括生物体正常繁殖过程中产生突变体,也包括生物体在组织培养过程中产生的突变体。自发突变体的基因定位目前只能通过图位克隆(map-basedcloning)的方法,即将自发突变体和另一个遗传背景不一样的亲本杂交,得到f2分离群体后,利用两亲本之间的核酸差异(分子标记)来进行基因定位。这种通过两亲本杂交产生f2分离群体的基因定位方法适用于造成植物发育和生长特征严重变异的主效突变基因的定位,例如水稻少分蘖突变体基因moc1和半矮秆基因sd1(li等.controloftilleringinrice.nature,2003,422:618-621;monna等.positionalcloningofricesemidwarfinggene,sd-1:rice“greenrevolutiongene”encodesamutantenzymeinvolvedingibberellinsynthesis.dnaresearch,2002,9:11-17)以及番茄成熟抑制基因rin(vrebalov等.amads-boxgenenecessaryforfruitripeningatthetomatoripening-inhibitor(rin)locus.science,2002,296:343-346)的定位与克隆。但是这种方法不适用于造成数量性状变异的微效突变基因定位,这是因为在来源于两个遗传背景不同的亲本产生的f2群体中,有多个其它控制突变表型的基因存在分离,将会掩盖了微效突变基因的效应。这种掩盖效应将会导致表型与基因型不共分离,进而无法定位目标基因。
对于自发突变的微效基因定位,目前只能通过把自发突变体与另一个亲本杂交,并通过回交的方式使背景纯合,使得群体只存在野生型和突变型两种表型,从而进行基因定位:例如水稻叶型基因nal7的定位就是通过回交的方法(fujino等.narrowleaf7controlsleafshapemediatedbyauxininrice.molgenetgenomics,2008,279:499-507)。但是通过回交群体进行基因定位的方法有以下不足之处:一是由于不清楚目标基因所在的物理位置,导致在回交过程中选择供体单株具有盲目性,稍有不慎就可能在回交过程回交掉了目的基因片段,使突变基因定位存在较大风险;二是即使每世代回交单株携带突变基因,为了使该基因效应不受其它基因影响,就必须保证回交后代背景纯合度更高,则需要更多的回交世代。以上两个因素大大增加了自发突变基因定位的时间、人力和物力成本。
基因定位以分子标记为基础,通过表型与分子标记的连锁关系寻找目标位点。分子标记不仅仅包括传统的rflp(restrictionfragmentlengthpolymorphism,限制性内切酶片段长度多态性)、rapd(randomamplifiedpolymorphicdna,随机扩增多态性dna)或者ssr(simplesequencerepeats,简单重复序列)标记,还包括测序产生的snp(singlenucleotidepolymorphism,单核苷酸多态性)及indel(insertionanddeletion,插入与缺失)标记。利用化学诱变剂ems(ethylmethanesulfonate,甲基磺酸乙酯)诱变会产生丰富的snp变异,它的主要原理是诱变碱基发生烷化反应,从而导致碱基在复制过程中发生错配反应。例如,ems诱变中99%的烷基化发生在g(guanine,鸟嘌呤)的o6位置上,使之变成o6-乙基鸟嘌呤,导致本来和g互补配对的c(cytosine,胞嘧啶)变成了t(thymine,胸腺嘧啶)。在随后的dna复制过程中,原来的g/c碱基对变成了a/t(ashburnerm.drosophila.alaboratoryhandbook.coldspringharborlaboratorypress,1989;greene等.spectrumofchemicallyinducedmutationsfromalarge-scalereverse-geneticscreeninarabidopsis.genetics,2003,164:731-740);但是也有很少一部分烷基化发生在其它位置,例如g突变成7-乙基鸟嘌呤将会导致g/c到c/g或g/c到t/a的突变,而a由于烷基化形成的3-乙基腺嘌呤导致a/t到g/c的突变(kriegdr.ethylmethanesulfonate-inducedreversionofbacteriophaget4riimutants.genetics,1963,48:561)。ems诱变近年来被广泛用于突变体的人工诱导及基因定位,例如tilling(till等.large-scalediscoveryofinducedpointmutationswithhigh-throughputtilling.genomeres,2003,13:524-530)和mutmap技术(abe等.genomesequencingrevealsagronomicallyimportantlociinriceusingmutmap.natbiotechnol,2012,30:174-178)均建立在ems诱变的基础上。
随着第二代测序技术的发展,通过测序的方式进行基因定位已经变得越来越成熟,例如mutmap方法(见上文)和qtl-seq方法(takagi等.qtl-seq:rapidmappingofquantitativetraitlociinricebywholegenomeresequencingofdnafromtwobulkedpopulations.plantj,2013,74:174-183)。以测序方式鉴定snp和indel信息并用于基因定位,大大节约了时间和人力成本,是未来基因定位的主要方向。
技术实现要素:
本发明的目的在于克服现有技术的缺陷,利用ems诱变产生的中性突变体来快速定位自发突变体基因。在同一遗传背景下,利用ems诱变剂组合物产生的中性突变体(和野生型相比没有表型变异)和自发突变体杂交得到f1,再自交得到f2代。通过筛选f2群体中极端隐性表型单株混合测序,结合ems诱变的中性突变体测序数据,借助于生物信息学方法快速定位突变基因。
本发明要解决的技术问题是:目前对于自发突变体的基因定位和克隆,不管是主效基因还是微效基因,只能通过将自发突变体和其它背景的亲本杂交,得到f2分离群体后进行图位克隆或者qtl-seq。但是这种分离群体的后代表型受到两亲本间多个基因(quantitativetraitlocus,数量性状位点)的共同调控,在f2分离群体中,这些数量性状位点随机组合,导致表型与突变基因之间不存在共分离关系。要屏蔽遗传背景的干扰,例如可以参考mutmap的方法,将野生型与自发突变体杂交,得到f2分离群体,后代虽然会产生单基因效应的表型分离比(3:1或者1:2:1),但是由于基因组高度一致,没有覆盖全基因组的核酸变异,很难定位自发突变基因。为了减少遗传背景对于基因定位的干扰,同时可以通过测序的方法快速定位基因,就必须使这种分离群体的全基因组存在一定的碱基分离。因此,人为诱变一个中性突变材料,使其全基因组与自发突变体之间存在核苷酸差异,同时这种材料的表型与野生型没有差异。利用这个中性突变材料与自发突变体杂交产生的f2群体,就可以用于突变基因的快速定位。这种方法可以快速高效地定位自发突变基因。
本发明的技术方案如下:
(1)首先根据自发突变体的遗传背景确定ems诱变的野生型品种x,例如本实例中自发突变体来源于粳稻品种中花11(以下称zh11),故ems诱变剂组合物诱变的水稻品种x必须是没有经过任何处理的野生型zh11,以保证遗传背景一致。ems诱变剂组合物诱变处理后并经自交3代后观察表型,选择表型和野生型相比没有差异的家系用于后续发明。例如申请人挑选其中一株并命名为ems-x,申请人将这种既存在snp变异又没有表型变异的材料称之为中性突变体。
(2)将所得的ems-x材料和自发突变体材料进行杂交得到f1代,自交得到f2代,种植300-400株f2单株为一个群体,例如本实施例中种植了300株。
(3)调查表型,统计分离比。若性状分离比符合单基因分离比即可进行基因定位。在f2群体中挑选25-30株极端隐性表型单株混合测序。如果ems-x自交世代较低,此步骤也可以在f2群体中挑选两个极端表型混合池分别进行测序:隐性混合池为突变体表型的混合单株,显性表型混合池为非突变表型的混合单株。
(4)通过生物信息学方法分析提取ems-x和极端隐性单株混合池测序的snp/indel,然后筛选候选目标位点;如果上一步测序使用的是两个极端表型单株混合池,这一步骤就需要提取这两个极端表型混合池之间的snp/indel,然后筛选候选目标位点。
(5)通过提取的snp/indel计算snpindex值并绘图,结合上一步提取的目标位点的变异类型(例如:导致移码突变,错义突变,提前终止突变的snp等),挑选最终候选基因。
(6)利用第一代测序技术对自发突变体和ems-x进行候选基因测序,验证第二代测序数据和分析结果是否正确。同时根据两者候选基因的核苷酸差异设计分子标记(snp、indel)或者直接测序,在f2群体中进行共分离检测。
(7)如果共分离检测显示候选基因和表型共分离,即可进行候选基因的转基因验证。
生物材料保藏信息(举例说明):
申请人将利用ems诱变剂组合物诱变得到的水稻材料命名为水稻ems-zh11,oryzasatival.ems-zh11,于2019年5月27日送交中国.武汉.武汉大学中国典型培养物保藏中心保藏,保藏编号为cctccno:p201908。
本发明产生的有益效果:
ems诱变剂组合物诱变产生的中性突变体和自发突变体相比,具有丰富的snp变异。在进行基因定位时,这些snp可以作为定位的分子标记。同时在表型上,这种f2群体除了在目标性状表型上出现分离外,理论上不会存在其它表型的分离,因而这类群体既具有丰富的核苷酸多态性,表型又不会受到其它基因的干扰,非常适用于自发突变基因的快速定位。
虽然申请人这种中性突变体搭桥方法采用了mutmap一样的数据分析方法,但申请人的方法和mutmap的方法适用对象明显不同:申请人的方法主要针对自发突变,自发突变体中除目标基因外,背景与野生型一样。而mutmap方法针对诱导突变,诱导突变体除了目标基因外,背景也存在数量巨大的变异。两种方法的基本过程也不同:mutmap的方法是利用ems诱变产生的突变体和同一背景的野生型水稻品种做杂交,然后在f2群体中挑选极端表型单株混合测序。申请人的方法是先利用ems诱变剂组合物诱导野生型水稻材料,使之产生中性突变体,并与自发突变体杂交,然后在f2群体中挑选极端表型单株混合测序。mutmap方法是将突变体与野生型水稻杂交,而本发明是利用自发突变体与中性突变体杂交。
附图说明
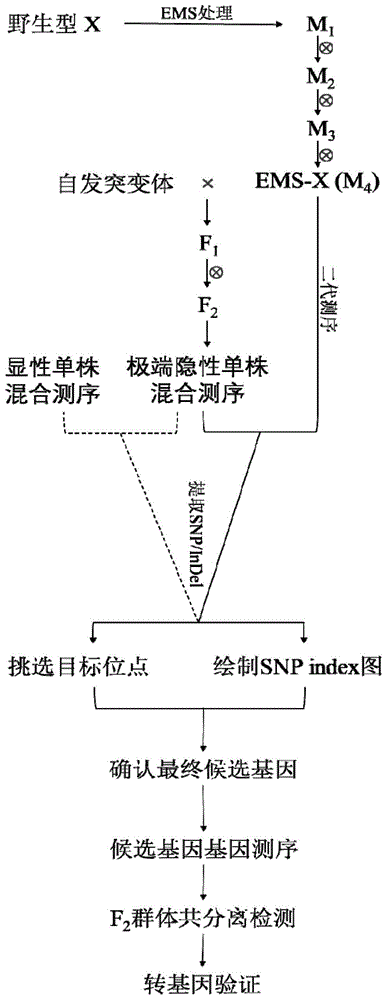
图1:本发明流程示意图。附图标记说明:野生型x是一个和自发突变体同样背景的品种。经过ems试剂诱变之后得到m1代,然后通过自交3代得到m4代,选择其中一株和野生型表型没有差异的单株,命名为ems-x并进行二代测序。随后将ems-x和自发突变体进行杂交得到f1,并自交得到f2,挑选f2中极端隐性表型单株混合后进行二代测序。通过比较极端隐形单株混合池和ems-x的测序数据,提取snp和indel,计算snpindex的数值并挑选目标位点和绘制snpindex的图;这一步骤中,也可以对显性表型单株进行混合测序,通过对比极端隐性单株混合池和显性表型混合池的测序数据进行数据分析,见图1中虚线部分。结合上一步筛选的目标位点(目标位点可能不止一个)和snpindex信息,挑选最可能的候选基因。随后对ems-x和自发突变体的候选基因进行测序,验证生物信息学分析结果是否准确。然后根据候选基因之间的核苷酸差异设计分子标记,在f2群体中进行共分离检测。如果共分离检测显示候选基因预测正确,即可进行下一步的候选基因转基因验证。
图2:ems-zh11和3tmutant表型变异。附图标记说明:图2中的a图中ems-zh11即是ems处理后的水稻品种中花11(简称zh11),即没有表型变异的ems-x,3tmutant是一个少分蘖叶色偏黄的自发突变体;图2中的b图是ems-zh11和3tmutant叶色表型差异;图2中的c图是对两个亲本的叶绿素和类胡萝卜素的测定,其中叶绿素a存在差异(p<0.05),已在图2中用“*”进行了标注。
图3:snpindex散点图。附图标记说明:横坐标代表水稻12条不同的染色体,纵坐标代表abs.ratio的值。数值越大和候选基因基因连锁或者共分离的可能性越大。
图4:ems-zh11和3t突变体候选基因测序及f2群体共分离检测。附图标记说明:图4中的a图是对候选基因进行测序比较。该突变发生在相邻的位置,其中2bp缺失发生在内含子区,1bp缺失发生在外显子区,导致氨基酸发生移码突变。这两个突变也导致限制性内切酶sali酶切位点发生突变,这种突变可以设计caps(cleavedamplifiedpolymorphicsequence,酶切扩增多态性序列)标记对f2群体进行共分离检测;图4中的b图即是利用caps标记对f2群体进行共分离鉴定的结果,其中“w”表示野生型基因型(wildtype),“m”表示3t突变体基因型(mutant),而“h”代表杂合基因型(heterozygote)。
图5:f2群体中分蘖数频率分布。附图标记说明:图中不同颜色的分类依据是来源于caps标记鉴定的基因型,箭头所指的是两种材料对应的分蘖数。
图6:候选基因转化载体。图6中的a图是pu2301-3×flag载体骨架,载体图片来源(sunq.andzhoud.procnatlacadsciusa,2008,105:13679-13684);图6中的b图是候选基因os07g0141400-pu2301-3×flag载体骨架。
图7:3t突变体转基因验证。附图标记说明:图7中的a图是候选基因超表达阴性和阳性单株对照,其中#3和#8是超表达阴性单株,#1、#2和#4为超表达阳性单株;图7中的b图是转基因单株dna水平的阳性检测;图7中的c图是叶色表型对比;图7中的d图是转基因阴性和阳性单株叶绿素和类胡萝卜素的测定,其中超表达阳性单株的叶绿素a和阴性相比具有显著性差异(p<0.01),在图中已经用“**”进行了标注。
具体实施方式
通过参照图1的流程示意图,本实施例快速定位并克隆了少分蘖叶色偏黄突变体基因。
以下实施案例进一步定义本发明,并描述了新方法定位自发突变体基因的详细步骤。根据以下的描述和这些实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用各种用途和条件。
实施例1:利用0.4%ems诱变获得野生型水稻材料ems-zh11
申请人得到了一个少分蘖和叶色偏黄的自发突变体基因,来源于水稻粳稻品种中花11。根据本发明流程,首先要根据自发突变体的背景使用ems试剂处理野生型中花11(特别说明:本发明的技术文件中所述的“野生型”材料,在本领域实质上是指相对于突变体而言未经过任何人为的或非人为遗传改良的原始材料。为简约表述,本发明中涉及的“野生型”,是植物领域的专业术语,不指代另外含义或其衍生的含义;中花11是本领域通用的一种水稻品种,是水稻科研和发明创造中经常用的一种材料)得到ems-zh11。在本发明中,使用的是0.4%甲基磺酸乙酯(简称ems,即该化学诱变剂的缩写。为了叙述方便,本发明会直接写成ems)诱变剂组合物(配制方法:61ml0.2mol/lna2hpo4溶液;39ml0.2mol/lnah2po4溶液;补充ddh2o至200ml配制成ph7.0的0.1m磷酸缓冲液;按照ems原液与磷酸缓冲液0.4%的体积比加入800μlems原液,得到0.4%ems诱变剂组合物。)
(1)试剂准备:
磷酸缓冲液配制(0.2mol/lna2hpo4):称取na2hpo4(sigma_fw=142)28.4g,溶于1000mlddh2o。
的0.2mol/lnah2po4:称取nah2po4·2h2o31.2g,溶于1000mlddh2o中。
灭活剂(inactivationsolution):0.1mol/lnaoh,20%w/vna2s2o3(sodiumthiosulfate),称取4gnaoh,溶于1000mlddh2o中,再称取200gna2s2o3溶于该溶液中,混匀备用。
(2)种子清洗:将野生型水稻品种中花11的种子用网袋装好,用自来水清洗干净,除去灰尘,最后用dh2o清洗2-3次。
(3)浸种:将清洗好的种子在室温(24-28℃)下,dh2o中浸泡24h。ems磷酸缓冲液的准备:按照61mlna2hpo4溶液+39mlnah2po4溶液+100mlddh2o的比例配制0.1m磷酸缓冲液(ph7.0),混匀后加入800μlems(sigmausa)原液(体积比约为0.8/200=0.4%),磷酸缓冲液的量需没过种子1-2cm。
(4)ems处理:将装有种子的网袋整个放入ems试剂组合物的磷酸缓冲液中,室温条件,放在摇床上,转速140rpm,处理18h。
(5)清洗:先将ems溶液倒入一个容器中,尽量倒干;然后用自来水清洗,前两次的清洗废液需同ems溶液一样收集起来,之后在自来水下冲洗24h;ems溶液的处理:用等量的inactivatesolution与ems溶液混合放置24h,交给危废回收单位统一处理,其余ems污染器具用inactivatesolution浸泡24h之后丢弃。
(6)催芽:将整个网袋用吸水纸包裹然后,放于37度恒温箱,每12h冲洗一次。
(7)纯合背景:m1代(ems处理的第一代)不用观察表型,直接收种种植m2代。然后再自交一代得到m3代,此步骤是为了通过自交清除杂合的snp,使背景更加纯合。
(8)挑选ems-zh11:m3代每家系种植30株。在m3代挑选家系长势一致的材料作为后续材料(m4)并测序。
申请人将利用ems诱变剂组合物诱变得到的水稻材料命名为水稻ems-zh11,oryzasatival.ems-zh11,于2019年5月27日送交中国.武汉.武汉大学中国典型培养物保藏中心保藏,保藏编号为cctccno:p201908。
实施例2:基因定位群体与极端隐性单株混合测序
(1)亲本表型考察:本实例所用的自发突变体是一个少分蘖和叶色偏黄的突变体,通过对主要农艺性状进行考察,发现两亲本在分蘖数、株高和叶绿素a上存在显著差异(表1和图2)。
表1ems-zh11和3t突变体主要表型差异
(2)以3t突变体为母本,ems-zh11为父本进行杂交得到f1种子(由于这种杂交无法通过分子标记鉴定真假杂种,因而杂交时母本必须是自发突变体,以便在f1代根据表型选择正确杂交种:凡是杂交种表型恢复至野生型表型的f1单株,即是正确的杂交种)。
(3)种植f1代,通过表型鉴定真假杂种,然后挑选正确的单株收获f2种子。种植300株f2群体,插秧30天后进行表型调查,调查分蘖数和叶色表型。申请人发现分蘖数和叶色共分离,分蘖数少于4个的单株叶色偏黄,而分蘖数大于5个的单株一般叶色均正常。以叶色为标准,去掉300株f2群体的保护行和每行的首尾两株,申请人对剩下的224株f2群体进行了分类:其中正常叶色植株163株,叶色偏黄植株61株,按照3:1(正常叶色:偏黄叶色)的分离比对这两种表型进行卡方检测,χ2=0.60<χ20.05,1=3.84,p=0.44,符合期望。分蘖数的频率分布符合双峰分布(见图5)。说明这个突变体是单基因隐性突变体。
(4)挑选分蘖数少于3个且叶色偏黄的单株30株,取等量叶片后混合送公司测序。
本实施例步骤(1)中分分蘖数和株高通过肉眼即可统计调查,而叶绿素含量测定主要通过抽提叶片总叶绿素并测吸光度值的方法测量,方法如下:
将水稻种子消毒后置于生根培养基中,放置于28℃培养箱中(光照/黑暗,各12小时),培养10天后,取每钵内长势一致的水稻幼苗倒二叶的中部剪碎后,搅拌混匀,用分析天平称取50mg左右的叶片,加入95%乙醇8ml,4℃下避光浸提24小时,不时上下颠倒混匀。
使用紫外分光光度计du640检测,以浸提液95%乙醇为空白对照,测量在665nm、649nm及470nm下的吸光度值。使用修正过的lichtenthaler法计算叶绿素含量(lichtenthalerhk.chlorophyllsandcarotenoids:pigmentsofphotosyntheticbiomembranes,methodenzymol.elsevier,1987.350-382.),公式如下:
叶绿素a:ca=13.95*a665-6.88*a649
叶绿素b:cb=24.96*a649-7.32*a665
类胡萝卜素:cx·c=(1000*a470-2.05*ca-114.8*cb)/245
叶绿素色素含量(mg/g)=c*v*n/w
式中:c为色素含量(mg/g);v为提取液体积(l);n为稀释倍数;w为样品鲜质量(g)。注:a665、a649、a470分别指在665、649、470nm波长下的吸光度。
实施例3:测序数据分析
(1)通过md5命令校验压缩数据是否正确。
(2)使用fastqc软件(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)对测序质量进行评估。
(3)参考wachsman的方法进行数据分析(wachsman等.asimplepipelineformappingpointmutations.plantphysiol,2017,174:1307-1313),具体代码见https://github.com/wacguy/simple-1.8.1。有两处改进,改进部分1:如果定义某位点显性为“+”,隐性为“-”的话,wachsman筛选候选基因的标准是筛选突变型混合池(mut)某位点的测序reads全部为-/-,而对应的野生型混合池(wt)该位点的测序reads是+/+和+/-的位点。而申请人采用的是极端突变表型混合池(mut)和经过ems诱变的“野生型”(wt),经过自交后,申请人的wt理论上属于纯合状态(只有+/+),因此,在筛选候选基因的时候,申请人的选择标准是筛选mut混合池测序reads全部是-/-,而对应wt的reads全部为+/+。改进部分2:wachsman的snpindex计算公式为ratio=wt.ratio-mut.ratio,其中wt.ratio是wt混合池中,参考基因组reads占总reads的比例;mut.ratio是极端隐性表型混合池mut中,参考基因组reads占总reads的比例。而申请人由于引入了ems诱变的材料作为野生型,ratio在目标基因位点会出现负值,因而申请人将snpindex公式修改为abs.ratio,即(wt-mut)的绝对值,以便做出的snpindex的图更加直观。
实施例4:候选基因测序及f2群体共分离检测
根据实施例4中分析的结果,得到了目标位点,见表2。目标位点在相邻位置发生两处突变,一个缺失2bp,一个缺失1bp。同时snpindex的图也证明了这一结果(见图3)。
表23t突变体候选位点信息表
目标基因测序验证:利用表3中引物“os07g0141400-seq”,申请人使用rtaq酶(宝生物工程大连有限公司)分别扩增了ems-zh11和3t突变体的候选基因序列。所用扩增体系如下:10xbuffer,2μl;dna模板,40-60ng;2mmdntp,1.5μl;10μmprimer(f+r),0.8μl;rtaq,0.2μl;用ddh2o补齐到20μl。所用pcr反应程序为:95℃4min;(94℃30sec,58℃1min,72℃90sec)35循环;72℃,7min;25℃,1min。随后将扩增产物送商业测序公司测序,所用测序引物也为“os07g0141400-seq”。如图4a所示,3t突变体确实出现了相邻位置的两处缺失。其中2bp的缺失出现在内含子区,1bp的缺失发生在外显子区,导致编码氨基酸发生突变。
根据突变位点的核苷酸信息,申请人设计了caps标记“os07g0141400-caps”(表3)对f2群体进行了共分离检测(其中野生型870bp,突变型为867bp,杂合性为867/870bp),扩增方法同上。随后使用thermoscientific公司的fastdigest快切酶sali进行酶切:取扩增产物10μl;10xfastdigestgreenbuffer1.5μl;fastdigestsali0.2μl;补ddh2o至15μl,37℃酶切4小时后进行琼脂糖胶电泳检测:其中野生型扩增的产物经酶切后变成554bp和316bp,两条带;杂合子扩增的产物经酶切后变成870/867bp、554bp和316bp,显示三条带;而突变型由于酶切位点突变,酶切产物大小仍然是867bp,一条带(图4b)。检测结果显示凡是突变体基因型的单株,均显示出少分蘖和叶色偏黄的表型,而杂合基因型和野生型基因型,表型基本一致,叶色均正常,但是分蘖数在5-18个之间,控制分蘖数和叶色的基因属于显性基因。
表3候选基因测序及共分离检测引物
实施例5:候选基因转基因验证
申请人使用“oe-os07g0141400”引物(表4)扩增了候选基因的基因组全长(1111bp)并连接到玉米ubiquitin启动子驱动的pu2301-flag载体上(图6)。该载体是本申请人所在作物遗传改良国家重点实验室改造的植物超表达载体,通过在pcambia2301多克隆位点插入一个玉米的ubiquitin启动子、3×flag标签和一个nos(synthasepolyadenylationsignal)终止子改造而来(sun等.ricejmjcdomain-containinggenejmj706encodesh3k9demethylaserequiredforfloralorgandevelopment.pnas,2008)。pu2301-flag载体用fastdigestkpni单酶切,将pcr产物和载体酶切产物利用fermentas公司的回收试剂盒回收(方法见说明书,货号#k0513),并做一步法连接(gibsondg.enzymaticassemblyofoverlappingdnafragments,methodenzymol.elsevier,2011.349-361)。随后将载体转化到农杆菌eha105中,并转化3t突变体。
表4候选基因测序超表达引物
随后对转基因植株进行了阳性鉴定,使用的标记为caps标记“os07g0141400-caps”,如果是阳性单株,caps标记基因型将会显示杂合,三条带;而阴性单株由于酶切位点突变,只会显示一条带(图7b)。随后对阳性阴性单株进行了叶绿素含量测定,发现阳性单株的叶绿素a含量得以提升,同时分蘖数也呈现增加的趋势(图7d)。
以上实施例说明使用ems诱变剂组合物诱变的中性突变体,可以快速定位自发突变基因。
本实施例中所用的遗传转化的主要步骤、培养基及其配制的方法如下所述:
(1)试剂和溶液缩写
本发明中培养基所用到的植物激素的缩写表示如下:6-ba(6-benzylaminopurine,6-苄基腺嘌呤);cn(carbenicillin,羧苄青霉素);kt(kinetin,激动素);naa(napthaleneaceticacid,萘乙酸);iaa(indole-3-aceticacid,吲哚乙酸);2,4-d(2,4-dichlorophenoxyaceticacid,2,4-二氯苯氧乙酸);as(acetosringone,乙酰丁香酮);ch(caseinenzymatichydrolysate,水解酪蛋白);g418(geneticin,遗传霉素);dmso(dimethylsulfoxide,二甲基亚砜);n6max(n6大量元素成分溶液);n6mix(n6微量元素成分溶液);msmax(ms大量元素成分溶液);msmix(ms微量元素成分溶液)
(2)主要溶液配方
1)n6培养基大量元素母液(按照10倍浓缩液(10x)配制):
将上述试剂逐一溶解,然后室温下用蒸馏水定容至1000ml。
2)n6培养基微量元素母液(按照100倍浓缩液(100x)配制
将上述试剂在室温下溶解并用蒸馏水定容至1000ml。
3)铁盐(fe2edta)贮存液(按照100x浓缩液配制)
将3.73g乙二铵四乙酸二钠(na2edta·2h2o)和2.78gfeso4·7h2o分别溶解,混合并用蒸馏水定容至1000ml,至70℃温浴2小时,4℃保存备用。
4)维生素贮存液(按照100x浓缩液配制)
加蒸馏水定容至1000ml,4℃保存备用。
5)ms培养基大量元素母液(msmax母液)(按照10x浓缩液配制)
将上述试剂在室温下溶解,并用蒸馏水定容至1000ml。
6)ms培养基微量元素母液(msmin母液)(按照100x浓缩液配制)
将上述试剂在室温下溶解,并用蒸馏水定容至1000ml。
7)2,4-d贮存液(1mg/ml)的配制:
称取2,4-d100mg,用1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,于室温下保存。
8)6-ba贮存液(1mg/ml)的配制:
称取6-ba100mg,用1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,室温保存。
9)萘乙酸(naa)贮存液(1mg/ml)的配制:
称取naa100mg,用1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,4℃保存备用。
10)吲哚乙酸(iaa)贮存液(1mg/ml)的配制:
称取iaa100mg,用1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,4℃保存备用。
11)葡萄糖贮存液(0.5g/ml)的配制:
称取葡萄糖125g,然后用蒸馏水溶解定容至250ml,灭菌后4℃保存备用。
12)as贮存液的配制:
称取as0.392g,加入dmso10ml溶解,分装至1.5ml离心管内,4℃保存备用。
13)1n氢氧化钾贮存液:
称取氢氧化钾5.6g,用蒸馏水溶解定容至100ml,室温保存备用。
(3)用于水稻遗传转化的培养基配方
1)诱导培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值到5.9,煮沸并定容至1000ml,分装到50ml三角瓶(25ml/瓶),封口后按常规方法灭菌(例如121℃下灭菌25分钟,下述的培养基灭菌方法与本培养基的灭菌方法相同)。
2)继代培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值到5.9,定容至1000ml,煮沸并分装到50ml三角瓶(25ml/瓶),封口,按上述方法灭菌。
3)共培养培养基
加蒸馏水至250ml,1n氢氧化钾调节ph值到5.6,封口,按上述方法灭菌。
使用前加热溶解培养基并加入5ml葡萄糖贮存液和250μlas贮存液,分装倒入培养皿中(25ml/每皿)。
4)悬浮培养基
加蒸馏水至100ml,调节ph值到5.4,分装到两个100ml的三角瓶中,封口,按上述方法灭菌。
使用前加入1ml无菌葡萄糖贮存液和100μlas贮存液。
5)选择培养基
加蒸馏水至250ml,调节ph值到6.0,封口,按上述方法灭菌。
使用前溶解培养基,加入250μlg418(50mg/ml)和400μlcn(250mg/ml)分装倒入培养皿中(25ml/皿)。(注:第一次选择培养基羧苄青霉素浓度为400mg/l,第二次及以后选择培养基羧苄青霉素浓度为250mg/l)。
6)分化培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值到6.0。
用蒸馏水定容至1000ml,煮沸并分装到50ml三角瓶(50ml/瓶),封口,按上述方法灭菌。
7)生根培养基
加蒸馏水至900ml,用1n氢氧化钾调节ph值到5.8。
用蒸馏水定容至1000ml,煮沸并分装到生根管中(25ml/管),封口,按上述方法灭菌。
(4)农杆菌介导的遗传转化步骤
1)愈伤组织诱导
将成熟的3t突变体水稻种子去壳,然后依次用75%的乙醇处理1分钟,0.15%氯化汞(hgcl2)种子表面消毒15分钟;
用灭菌单蒸水洗种子8-10次;
将种子放在诱导培养基上;
将接种后的培养基置于黑暗处培养4周,温度25±1℃。
2)愈伤组织继代
挑选亮黄色、紧实且相对干燥的胚性愈伤组织,放于继代培养基上黑暗下培养2周,温度25±1℃。
3)农杆菌培养
在带有对应抗性选择的la培养基(la培养基的配制参照j.萨姆布鲁等,分子克隆隆实验指南,第三版,金冬雁等(译),科学出版社,2002,北京)上预培养农杆菌eha105(该菌株来自cambia公司公开使用的农杆菌菌株)两天,温度28℃;
将农杆菌转移至悬浮培养基里,28℃摇床上培养30min。
4)农杆菌侵染
将预培养的愈伤组织转移至灭好菌的瓶子内;
调节农杆菌的悬浮液至od6000.8-1.0;
将愈伤组织在农杆菌悬浮液中浸泡30分钟;
转移愈伤组织至灭菌好的滤纸上吸干;然后放置在共培养基上培养2天,温度19-20℃。
5)愈伤组织洗涤和选择培养
灭菌单蒸水洗涤愈伤组织至看不见农杆菌;
最后一次洗涤后浸泡在含400mg/l羧苄青霉素(cn)的灭菌水中30分钟;
转移愈伤组织至灭菌好的滤纸上吸干;
转移愈伤组织至选择培养基上选择培养2-3次,每次2周。
6)分化
将抗性愈伤组织转移至分化培养基上,光照下培养至长出绿色幼苗,温度26℃。
7)生根
剪掉分化时产生的根,然后将其转移至生根培养基中光照下培养2-3周,温度26℃。
8)移栽
洗掉根上的残留培养基,将具有良好根系的幼苗转入大田隔离环境,田间管理同普通大田。
- 还没有人留言评论。精彩留言会获得点赞!