生产具有游离二价阳离子乳蛋白质和植物蛋白质聚集的食品或饮料产品的方法与流程
本发明涉及生产食品或饮料产品的方法,具体地讲,涉及用于在成分组合物中形成凝聚蛋白质的方法。本发明还涉及包含聚集蛋白质的食品或饮料产品,该聚集蛋白质包含胶束酪蛋白和乳清蛋白质以及植物蛋白质聚集体。
背景技术:
已知通过蛋白质聚集向食物和饮料产品提供质地和口感,并且持续需要表现出常量营养素的营养平衡同时递送极好的味道和质地的食物和饮料产品。
cn104489097a描述了用以获得用于乳酸菌或益生菌的热对流干燥保护剂制剂的方法。该方法包括在60℃热处理富含钙的乳制剂以便诱导蛋白质聚集并随后对制剂进行机械均质化处理。
wo07040113a描述了在乳源复合脂质中表现出高含量的成分的生产。它是通过在钙存在下在ph4.0至5.0下沉淀黄油乳清的蛋白质级分并过滤上清液以浓缩复合脂质而获得的。
wo06065135a2公开了富含游离二价阳离子的液体食物产品的生产,其中由蛋白质实现的20%赖氨酸残基已被糖基化,以便在钙存在下增加它们的聚集抗性。因此,wo06065135a2涉及在二价阳离子、钙等存在下防止蛋白质聚集。
us20130011515a1描述了用于生产富含乳清蛋白质的乳蛋白质浓缩物的方法。在6.5-7.0的ph范围内加热脱脂乳,以便促进乳清蛋白质与酪蛋白的聚集。随后将加热的产物过滤以浓缩蛋白质聚集体并去除乳糖。
d.l.vanhekken等人[rheologyandmicrostructureofchemicallysuperphosphorylatedwholecasein,1997,j.dairysci.802740-2750(化学超磷酸化全酪蛋白的流变学和微观结构,1997年,《乳品科学杂志》,第80卷,第2740-2750页)]描述了添加游离钙对超磷酸化酪蛋白的粘度的影响。结果表明,在ph8.4下添加30mm钙将增大4重量%超磷酸化酪蛋白(190%磷酸化)的粘度。此研究不涉及植物蛋白质和乳蛋白质的混合物。此外,就植物蛋白质和乳蛋白质的混合物而言,超磷酸化酪蛋白作为化学改性的昂贵成分是不期望的。
c.holt在他的论文中描述了[anequilibriumthermodynamicmodelofthesequestrationofcalciumphosphatebycaseinmicellesanditsapplicationtothecalculationofthepartitionofsaltsinmilk,2004,eur.j.phys.,33,421-434(酪蛋白胶束螯合磷酸钙的平衡热力学模型及其对乳中盐分配计算的应用),2004年,《欧洲物理学杂志》,第33卷,第421-434页],报道了在ph为6.70时牛乳中游离钙离子的量为10.2mm,并且当乳ph降低至6.0时,该值降低至8mm。本文不涉及植物蛋白质。
i.r.mckinnon等人[diffusing-wavespectroscopyinvestigationofheatedreconstitutedskimmilkscontainingcalciumchloride,2009,foodhydrocolloids,1127-1133(含氯化钙的加热重构脱脂乳的扩散波光谱研究,2009年,《食物亲水胶体》,第1127-1133页)]研究了将氯化钙添加到在6.0至7.2的ph范围内以10重量%重构的脱脂乳的效果,以及当在60℃、75℃和90℃下加热乳10分钟时对粘度的随后影响。他们报道,在90℃加热含量高至10mm的氯化钙时,乳的临界不稳定ph为5.9。本文不涉及植物蛋白质。
l.ramasubramanian等人[therheologicalpropertiesofcalcium-inducedmilkgels,2014,j.foodengineering,45-51(钙诱导乳凝胶的流变学特性,2014年,《食品工程杂志》,第45-51页)]确定了在70℃加热时将氯化钙加入全脂乳(3.5%脂肪)中的影响。据报道,低于12.5mm的氯化钙添加产生粘性分散体,而较高的氯化钙浓度诱导形成更强的凝胶。有趣的是,在添加氯化钙并随后在70℃加热之前,在90℃下预处理乳10分钟,产生最强的凝胶。在许多半固体食物和饮料产品中凝胶形成是不期望的。本文不涉及植物蛋白质。
t.phan-xuan等人[tuningthestructureofproteinparticlesandgelswithcalciumorsodiumions.2013,biomacromolecules,14,6,1980-1989(用钙或钠离子调节蛋白质颗粒和凝胶的结构,2013年,《生物大分子》,第14卷,第6期,第1980-1989页)]报道了当在ph7.0下通过向β-乳球蛋白添加氯化钙来处理100%乳清蛋白质(β-乳球蛋白)时,当钙含量为5mm-6mm,蛋白质浓度为4重量%时,在68℃或85℃下加热时导致微凝胶或凝胶形成。同样,在许多半固体食物和饮料产品中凝胶形成是不期望的。
n.chen等人[thermalaggregationandgelationofsoyglobulinatneutralph.2016,foodhydrocolloids,61,740-746(在中性ph下热聚集和凝胶化大豆球蛋白质,2016年,《食物亲水胶体》,第61期,第740-746页)]报道了在中性ph、介于50℃和90℃之间的温度范围以及介于5重量%和9重量%之间的蛋白质浓度范围条件下,大豆蛋白质分离物在加热之后形成分形聚集体。未描述钙对蛋白质聚集的影响。
j.m.franco等人[influenceofphandproteinthermaltreatmentontherheologyofpeaprotein-stabilizedoil-in-wateremulsions.2000,jaocs,77,9,975-984(ph和蛋白质热处理对用豌豆蛋白质稳定的水包油乳剂流变特性的影响,2000年,《美国油脂化学协会杂志》,第77卷,第9期,第975-984页)]报道了用6重量%豌豆蛋白质稳定的浓缩的65重量%向日葵乳剂在高于70℃的温度下加热最长60分钟后表现出粘度增大,并且报道了最高粘度增大是在豌豆蛋白质的等电位点左右的ph(即,ph5.3)下获得的。
胶束酪蛋白与豌豆蛋白质之间的相互作用已描述于j.-l.mession等人[interactionsoncaseinmicelle-peasystem(part1):heat-induceddenaturationandaggregation.2017,foodhydrocolloids,67,229-242(酪蛋白胶束-豌豆体系中的相互作用(部分1):热诱导变性和聚集,2017年,《食物亲水胶体》,第67期,第229-242页)]中。将胶束酪蛋白和豌豆蛋白质分离物的分散体在ph7.1下加热至介于40℃和85℃之间,获得1:1的重量混合比和1.8重量%的蛋白质含量。结论是,酪蛋白在促进豌豆蛋白质亚基离解的同时不参与豌豆蛋白质的聚集。本文档未披露游离钙的影响。
c.m.beliciu和c.i.moraru[theeffectofproteinconcentrationandheattreatmenttemperatureonmicellarcasein-soyproteinmixtures.2011,foodhydrocolloids,25,1448-1460(蛋白质浓度和热处理温度对胶束酪蛋白-大豆蛋白质混合物的影响),2011年,《食物亲水胶体》,第25期,第1448-1460页)]研究了在介于40℃至90℃的温度范围、ph7.0、介于2重量%至15重量%的蛋白质含量范围下,加热1:1的胶束酪蛋白和大豆蛋白质分离物15分钟的影响。他们发现,在相同蛋白质浓度下,混合物的流动特性低于大豆蛋白质分离物的流动特性。此外,作者声称,钙从溶液中沉淀出来,并且不增加聚集体的总电荷,对质地/粘度也没有影响。
现有技术的教导显示,虽然粘度增加可通过在乳产品中添加钙来获得,但没有公开显示可获得乳蛋白质/植物蛋白质混合物的粘度增加。从现有技术中也熟知胶凝效应在食品生产中可能是不可取的。此外,产品的ph可改变并影响过程,然而可能导致产品不稳定。现有技术没有显示如何提供食物和饮料产品,该食物和饮料产品提供期望的味道和质地。
因此,需要食品和饮料产品表现出宏量营养素的营养平衡,同时提供很好的味道和质地。
发明目的
本发明的目的是提供具有改善的质地和口感的食品或乳蛋白质/植物蛋白质产品。
技术实现要素:
本发明提供了通过在特定浓度的添加的二价阳离子存在下通过特定热处理使用基于乳蛋白质/植物蛋白质的聚集体的改进。
在第一方面,本发明涉及生产食品或饮料产品的方法,该方法包括以下步骤:
提供包含胶束酪蛋白、乳清蛋白质和植物蛋白质的成分组合物,所述成分组合物具有5.9至7.1、优选6.2至6.8的ph并且具有1重量%至15重量%的总蛋白质浓度,并且其中
所述组合物具有90/10至60/40的胶束酪蛋白对乳清蛋白质的比例,以及
80/20至20/80的胶束酪蛋白和乳清蛋白质对植物蛋白质的比例,
添加二价阳离子以在所述成分组合物中提供浓度为2.0mm至10mm的游离二价阳离子,
以及随后
热处理所述成分组合物以形成包含胶束酪蛋白、乳清蛋白质和植物蛋白质的凝聚蛋白质,所述凝聚物具有5微米至50微米的尺寸,如通过激光衍射测得的d(4,3)平均直径所测量。
本发明使用在添加的游离二价阳离子存在下在热处理时生成的基于乳蛋白质/植物蛋白质的聚集体,以便提供最佳感官特性,同时允许减少产品中的总脂肪含量。此外,所述发明使得能够在不使用额外稳定剂或亲水胶体的情况下配制基于乳品的质地化产品。
在本发明的优选方法中,热处理时成分组合物经受80℃至125℃的温度30秒至900秒的时间段,或经受126℃或更高温度3秒至45秒。在本发明的一个更优选实施方案中,成分组合物经受80℃至100℃的温度0.5分钟至4分钟的时间段,或经受高于135℃的uht(超高温)热处理3秒至45秒。
根据权利要求1所述的方法,其中所述成分组合物在80℃至125℃的温度下加热处理30秒至900秒的时间段,或在126℃或更高温度下加热处理3秒至45秒。
在第二方面,本发明涉及通过上述方法获得的食品或饮料产品。
在另一个方面,本发明涉及包含聚集蛋白质的食品或饮料产品,该聚集蛋白质包含胶束酪蛋白、乳清和植物蛋白质聚集体,其中所述产品具有5.9至7.1、优选地6.2至6.8的ph并且具有1重量%至15重量%的总蛋白质浓度,并且其中所述组合物具有90/10至60/40的胶束酪蛋白对乳清蛋白质的比例以及80/20至20/80的胶束酪蛋白和乳清蛋白质对植物蛋白质的比例,所述成分组合物中具有2.0mm至10mm的游离二价阳离子浓度,凝聚的蛋白质包含酪蛋白、乳清蛋白质和植物蛋白质,所述凝聚物具有5微米至50微米的尺寸,如通过激光衍射测得的d(4,3)平均直径所测量。
附图说明
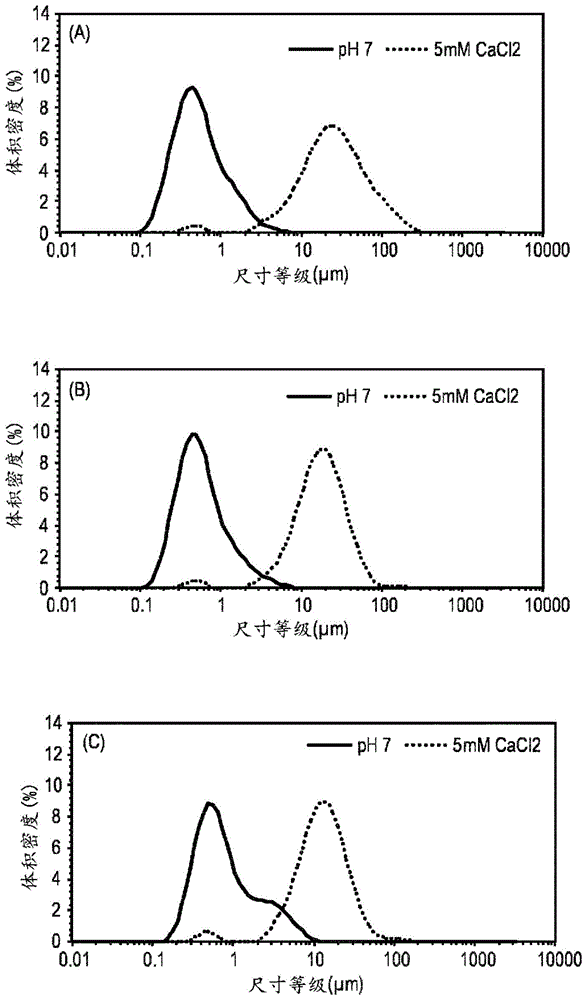
图1示出了在存在或不存在5mmcacl2的情况下,在ph7.0下加热(95℃,15分钟)并剪切之后,由总蛋白质含量为3重量%和混合比例为75/25的乳蛋白质浓缩物(mpc)/大豆蛋白质分离物(spi)稳定的基于高油酸向日葵的乳剂的颗粒尺寸分布。(a)2.5重量%的向日葵油,(b)5重量%的向日葵油,(c)10重量%的向日葵油。实线:ph7.0,不添加cacl2;虚线:ph7.0,添加5mmcacl2。
图2示出了在存在或不存在10mmcacl2的情况下,在ph7.0下加热(95℃,15分钟)并剪切之后,由总蛋白质含量为3重量%和混合比例为50/50的乳蛋白质浓缩物/大豆蛋白质分离物稳定的基于高油酸向日葵的乳剂的颗粒尺寸分布。(a)2.5重量%的向日葵油,(b)5重量%的向日葵油,(c)10重量%的向日葵油。实线:ph7.0,不添加cacl2;虚线:ph7.0,添加10mmcacl2。
图3示出了在95℃下热处理并剪切15分钟之后,由混合比例为75/25的3重量%乳蛋白质浓缩物/大豆蛋白质分离物稳定的5重量%高油酸向日葵乳剂的共焦扫描激光显微图。(a)ph7.0,不添加cacl2;(b)ph7.0,添加5mmcacl2。刻度条为10微米。mc代表胶束酪蛋白,sp代表大豆蛋白质,并且o代表箭头旁边的油滴。
图4示出了在95℃下热处理并剪切15分钟之后,由混合比例为50/50的3重量%乳蛋白质浓缩物/大豆蛋白质分离物稳定的5重量%高油酸向日葵乳剂的共焦扫描激光显微图。(a)ph7.0,不添加cacl2;(b)ph7.0,添加10mmcacl2。刻度条为10微米。mc代表胶束酪蛋白,sp代表大豆蛋白质,并且o代表箭头旁边的油滴。
图5示出了在存在或不存在5mmcacl2的情况下,在ph7.0和95℃下热处理并剪切15分钟之后,由混合比例为75/25的3重量%乳蛋白质浓缩物/大豆蛋白质分离物混合物稳定的高油酸向日葵乳剂在20℃时的流动曲线。(a)2.5重量%的向日葵油,(b)5重量%的向日葵油,(c)10重量%的向日葵油。圆圈:ph7.0,不添加cacl2;十字:ph7.0,添加5mmcacl2。
图6示出了在存在或不存在5mmcacl2的情况下,在ph7.0和95℃下热处理并剪切15分钟之后,由混合比例为75/25的3重量%乳蛋白质浓缩物/大豆蛋白质分离物混合物稳定的高油酸向日葵乳剂在20℃时的流动曲线。(a)2.5重量%的向日葵油,(b)5重量%的向日葵油,(c)10重量%的向日葵油。圆圈:ph7.0,不添加cacl2;十字:ph7.0,添加10mmcacl2。
图7示出了在存在或不存在cacl2的情况下,在ph7.0和95℃下热处理并剪切15分钟之后,由3重量%乳蛋白质浓缩物/大豆蛋白质分离物混合物稳定的高油酸向日葵乳剂在10l/s的剪切速率下的粘度。(a)75/25mpc/spi混合比例,添加5mmcacl2,(b)50/50mpc/spi混合比例,添加10mmcacl2。
图8示出了在试验厂于95℃下热处理并剪切3分钟之后,由混合比例为75/25的3重量%乳蛋白质浓缩物/大豆蛋白质分离物稳定的5重量%高油酸向日葵乳剂的共焦扫描激光显微图。(a)ph7.0,不添加cacl2;(b)ph7.0,添加10mmcacl2。刻度条为10微米。p代表蛋白质,并且o代表箭头旁边的油滴。
图9示出了在试验厂于95℃下热处理并剪切3分钟之后,由混合比例为50/50的3重量%乳蛋白质浓缩物/大豆蛋白质分离物稳定的5重量%高油酸向日葵乳剂的共焦扫描激光显微图。(a)ph7.0,不添加cacl2;(b)ph7.0,添加20mmcacl2。刻度条为10微米。p代表蛋白质,并且o代表箭头旁边的油滴。
图10示出了用于配制乳-豌豆或乳-大豆体系的方法。
具体实施方式
在进行向乳蛋白质/植物蛋白质的混合物中添加二价阳离子(特别是钙)对蛋白质聚集和粘度建立的影响的实验时,令人惊讶地发现,存在二价阳离子添加的临界范围,该临界范围可导致最佳蛋白质聚集,而在加热后所形成的聚集体不沉淀或胶凝。当该最佳浓度的钙通过时,体系表现出过度聚集与沉淀或聚集体尺寸减小。
不受理论束缚,将氯化钙加入蛋白质导致吸附在蛋白质的表面处的质子与具有较高亲和力的钙离子之间的交换。该现象导致分散体的ph降低,从而减小蛋白质之间的静电排斥。在这些条件下,随后对基于乳蛋白质/植物蛋白质的分散体和乳剂进行热处理导致蛋白质的受控聚集,这被示为对成品的质地和感官性质产生积极影响。
本发明的主要优点是其允许使基于减脂乳蛋白质/植物蛋白质的体系质地化,并且能够减少额外亲水胶体的使用。
在本上下文中,用根据发明的方法产生并且存在于本发明的产品中的凝聚物具有5微米至50微米的尺寸,如通过d(4,3)平均直径所测量。凝聚物的颗粒尺寸分布(psd)使用mastersizer2000(英国马尔文仪器公司(malvernintruments,uk))或等同测量系统测得。对于测量,样品可例如被分散在hydrosm测量池中,直到获得9%-10%的遮蔽率,然后在mastersizer中进行分析。
此外,在本发明的上下文中,游离二价阳离子可通过选择性电极测量。例如,游离(离子)钙浓度由mettlertoledo钙选择性电极perfectiontmdx系列半电池测定,其中bnc连接器p/n51344703连接到692ph/离子计(瑞士万通公司(metrohmswitzerland))。
另外,在本发明的上下文中,除非另外指明,否则组分的%是指基于组合物的重量的重量%,即重量/重量%。
优选地,成分组合物中的蛋白质浓度为1重量%至10重量%,更优选地为2重量%至9重量%。
在本发明的一个优选实施方案中,聚集体为10微米至40微米,优选地为10微米至30微米,通过d(4,3)平均直径所测量。这为产品提供了理想的口感,而没有聚集体提供砂砾感。
在本发明的上下文中,植物蛋白质可选自大豆、豌豆、燕麦、马铃薯、低芥酸菜籽、花生或稻。
在本发明的一个优选实施方案中,植物蛋白质选自豌豆蛋白质、大豆蛋白质或它们的组合。已发现,这些植物蛋白质为本发明的产品提供良好的质地。
在根据本发明的方法中,有利的是通过物理处理(例如加热、均质化)改善了植物蛋白质的溶解度。
优选的是,根据本发明的方法,成分组合物经受均质化。然而,已发现如果在根据本发明的方法中产生的凝聚物经受过高剪切,则该凝聚物可能被破坏。有利的是,均质化在成分组合物的热处理之前进行。
根据本发明,优选的是二价阳离子选自钙阳离子、或镁阳离子或它们的组合。这些二价阳离子是食品级的,并且不促进容易的油或脂肪氧化。
在本发明的优选实施方案中,二价阳离子是钙阳离子。
有利的是,添加二价阳离子,优选地添加钙盐,直至游离二价钙阳离子浓度为2.0mm至6.0mm,优选地为2.0mm至4.0mm,更优选地为2.0mm至3.0mm。
在本发明的一个优选实施方案中,植物蛋白质为豌豆蛋白质,并且添加钙盐,直至游离二价钙阳离子浓度为2.0mm至3.0mm,优选地为2.0mm至2.5mm。本发明的此实施方案的优点在于不导致由添加的盐引起的一些感官缺陷(金属味道、肥皂感)。
植物蛋白质为豌豆蛋白质,并且添加钙盐,直至游离二价钙阳离子浓度为2.0mm至3.0mm,优选地为2.0mm至2.5mm。
在本发明的另一个优选实施方案中,植物蛋白质为大豆蛋白质,并且添加钙盐,直至游离二价钙阳离子浓度为2.0mm至3.0mm,优选地为2.0mm至3.0mm。本发明的此实施方案的优点在于不导致由添加的盐引起的一些感官缺陷(金属味道、肥皂感)。
在添加阳离子之后,可将成分组合物的ph调节至5.9至6.8。
此外,优选的是,二价阳离子以无机盐的形式添加。优选地,无机盐是选自氯化钙、氢氧化钙、碳酸钙、柠檬酸钙、磷酸钙、硬脂酸苹果酸、甘油磷酸钙、乳酸钙和葡萄糖酸钙的钙盐。在本发明的一个特定优选实施方案中,钙盐是氯化钙或乳酸钙。在本发明的全天然的实施方案中,钙是通过例如膜分馏在蛋白质、脂肪和乳糖分离后从来自乳的浓缩矿物质中获得的。
在添加钙阳离子之前,成分组合物的ph优选地为6.2至7.1。
相对于总蛋白质含量,在成分组合物中发生聚集反应之后的可溶性蛋白质的含量优选低于或等于30%,优选低于或等于20%,显示大多数蛋白质嵌入聚集的结构中。
在本发明的一个实施方案中,成分组合物包含0重量%至36重量%的脂肪,优选地1.0重量%至20重量%,更优选地3.0重量%至15重量%,最优选地5重量%至10重量%的脂肪。已发现,即使用少量脂肪,由于产品内产生的凝聚,产品的质地是乳脂状的。
成分组合物中的酪蛋白和乳清蛋白质优选地以选自以下的形式提供:原料乳、巴氏杀菌乳、低热浓缩乳、低热乳粉、乳蛋白质浓缩物、液体或粉末形式的乳分离物或它们的组合,而另外的乳清蛋白质以选自以下的形式提供:甜乳品乳清、乳清蛋白质浓缩物,液体、浓缩物或粉末形式的乳清蛋白质分离物或它们的组合。
优选地,乳清蛋白质源是非变性的。
植物蛋白质优选地选自粉末状植物蛋白质浓缩物或分离物。
胶束酪蛋白可从由乳、乳蛋白质浓缩物以及液体或粉末形式的分离物或它们的组合组成的组中获得。
本发明还涉及通过上述方法获得的乳制品浓缩物。
在本发明的一个具体优选的实施方案中,使用冷冻干燥、喷雾干燥或辊式干燥将浓缩物干燥成粉末。
根据本发明的产品可以是乳基产品诸如冰淇淋或冷冻甜食、乳品浓缩物或甜点、酱汁等。产品形式包括冷冻、室温、冷藏、液体和粉末。
实施例
以下实施例以举例而非限制的方式说明本发明的各个实施方案。
实施例1:
通过在重组全脂肪乳和豌豆蛋白质分离物中添加乳酸钙获得的乳蛋白质和豌豆蛋白质聚集体,其中75%的总蛋白质含量是乳蛋白质,25%是豌豆蛋白质。
材料和方法
低热脱脂乳粉(msk)由瑞士的赫尔达夫公司(hochdorf,switzerland)提供,并且豌豆蛋白质分离物nutralysxf由法国的罗盖特公司(roquette,france)提供。
由于豌豆蛋白质分离物的蛋白质浓度高于脱脂乳粉,因此总固体(ts)通过添加麦芽糖糊精de38-41(法国罗盖特公司(roquette,france))调节为平均全脂乳,以获得13%ts。使用高油酸向日葵油(瑞士oleificiosabo公司(oleificiosabo,switzerland))替代乳脂。
在13%ts下,配制具有3.3%总蛋白质(2.5%乳蛋白质,0.8%豌豆蛋白质)和3.5%油的体系。
表1示出了乳-豌豆体系的组成。
表1:混合的75:25msk-豌豆蛋白质体系(13%ts)的主要成分和示例性配方。
对于钙添加,在过程中将乳酸钙(荷兰普拉克生物化学公司(puracbiochem,thenetherlands))与麦芽糖糊精一起干燥混合并且添加。
图10示出了用于配制乳-豌豆体系的方法。
为了提高豌豆蛋白质的溶解度,将豌豆蛋白质添加到55℃的反渗透水中并搅拌30分钟。使用盘绕管(4mm内半径,7个直径94mm、长度2100cm的绕组)将蛋白质分散体在95℃下加热并浸没于110℃的油浴(hbr4型,德国艾卡公司(ika,germany))中。流速为425ml/分钟,以确保线圈的出口处达到目标温度。将加热的分散体收集在设置在95℃水浴(hbr4型,德国艾卡公司(ika,germany))中并设置有磁力搅拌器的schott瓶中。将豌豆蛋白质分散体在95℃下搅拌10分钟,然后在冷水浴中冷却至50℃,随后在台式均质机pandaplus(意大利geanirosoavi公司(geanirosoavi,italy))中在200+50巴下均质化。
将其它成分(msk、油(如果存在的话)、麦芽糖糊精和钙盐)添加到50℃的均质化的豌豆蛋白质分散体中,然后将混合物在50℃下搅拌40分钟。通过ultraturrax(t25型,德国艾卡公司(ika,germany))以14000rpm的速度运行1分钟,获得预乳剂。
随后将预均质化的混合物在200+50巴和50℃的条件下均质化,然后在冰浴中冷却至4℃。将混合物分成不同的等分试样并保持在10℃以下,同时用5%w/w氢氧化钾溶液(德国默克公司(merck,germany))或10%w/w柠檬酸溶液(奥地利永本兹劳尔公司(jungbunzlauer,austria))将每个等分试样的ph调节至目标值。
在ph平衡之后,连续搅拌,同时在平板加热器(rtc基本型,徳国艾卡公司(ika,germany))上的schott瓶中预热每种乳剂。以115ml/分钟的速度将预热的乳剂泵送通过加热线圈(4mm内半径,7个直径94mm、长度210cm的绕组),该线圈被浸入110℃的油浴(hbr4型,德国艾卡公司(ika,germany))中,以确保线圈的出口处达到目标温度。将线圈连接到浸入96℃水浴(hbr4型,德国艾卡公司(ika,germany))中的保持管(内半径7mm,长度3400mm)。线圈与水浴连同保持管之间的连接在96℃下提供60秒的总加热时间。
加热之后,将样品泵送通过浸入冰水中的附加盘绕管(内半径4mm,4个直径94mm、长度120cm的绕组),以便在短于30秒内冷却至<50℃。
流动特性
对于非加热和加热的乳剂,使用与配备有板/板几何形状(60mm直径)和1mm间隙的umtc(徳国赛默公司(thermoscientific,germany))耦合的受控应力流变仪haakerheostress6000执行流动实验。
在25℃+/-0.1的恒定温度下,以0l/s至300l/s(线性增加)范围内的剪切速率测定稳定剪切流动曲线。记录表观粘度作为剪切速率的函数。
颗粒尺寸分布
为了评估颗粒尺寸分布,使用malvernmastersizer2000粒度计(英国马尔文仪器公司(malverninstruments,uk))通过动态光散射来分析未加热和加热的乳剂。使用霍尼韦尔水压减压器(最大去离子水压:1巴)和erma水脱气器(以减少去离子水中的溶气)制备用于分散液体样品的超纯无气体水。
所用的测量设置为:在0.01的吸收度下,脂肪小滴的折射率为1.46,水的折射率为1.33。所有样品在2.0%至2.5%的遮蔽率下进行测量。测量结果在malvern软件中基于米氏理论计算。报告基于体积的平均直径值d(4,3)。
离子(游离钙)测定
使用orion离子分析仪ea940钙离子敏感电极和处于mv模式的ph/mv计(美国赛默奥立龙公司(thermoorion,usa))测量离子钙浓度。基于来自包含80mmkcl的1mm、5mm和10mm钙标准溶液的mv读数标准曲线的回归方程,由毫伏读数计算钙离子浓度,以标准化离子强度。这些标准样由美国赛默飞世尔公司(thermofisherscientific,usa)供应的0.1m氯化钙标准溶液和4m氯化钾溶液(离子强度调节钙,美国赛默奥立龙公司(thermoorion,usa))制备。
结果
表2示出了在添加2.5mm乳酸钙并在不同ph下调节后,从用乳-豌豆蛋白质(75:25-表1中的配方)制备的样品的分析获得的结果。
表2显示,通过降低ph,体系中的钙在ph6.06下渐进释放至多2.8mm。可以观察到在乳酸钙的存在下加热乳剂之后颗粒尺寸和粘度均增加。对粘度增加的影响在较低ph下较大。
当ph进一步降低至5.84时,游离钙增加到3.6,导致形成非常大的聚集体(239.541μm),从而失去任何粘度效应(在100l/s下为3mpa.s)。然而,该体系没有凝胶化。
实施例2:
通过在双重浓缩的重组全脂乳中添加乳酸钙获得的乳蛋白质和豌豆蛋白质聚集体,其中25%的乳蛋白质被豌豆蛋白质取代。
低热脱脂乳粉(msk)由瑞士的赫尔达夫公司(hochdorf,switzerland)提供,并且豌豆蛋白质分离物nutralysxf由法国的罗盖特公司(roquette,france)提供。
由于豌豆蛋白质分离物的蛋白质浓度高于脱脂乳粉,因此总固体(ts)通过添加麦芽糖糊精de38-41(法国罗盖特公司(roquette,france))调节为平均全脂乳,以获得13%ts。使用高油酸向日葵油(瑞士oleificiosabo公司(oleificiosabo,switzerland))替代乳脂。
在26%ts下,用6.6%的总蛋白质(4.95%的乳蛋白质,1.65%的豌豆蛋白质)和7%的油配制该体系。
表1示出了乳-豌豆体系的组成。
表3:混合的75:25msk-豌豆蛋白质体系(26%ts)的主要成分和示例性配方。
对于钙添加,在过程中将乳酸钙(荷兰普拉克生物化学公司(puracbiochem,thenetherlands))与麦芽糖糊精一起干燥混合并且添加。
图10示出了用于配制乳-豌豆体系的方法。
对豌豆蛋白质进行预处理,并且如实施例1中所示那样配制和处理乳-豌豆体系。
流动特性
使用未加热和加热的乳剂,如实施例1中那样执行流动实验。
颗粒尺寸分布
如实施例1中那样分析颗粒尺寸分布。
离子(游离钙)测定
如实施例1中所示那样测量离子钙浓度。
结果
表4:
表4显示添加了2.5mm乳酸钙的乳剂的特征在于ph6.7下1.4mm的游离钙值,这在热处理期间不引起显著的蛋白质聚集。随着ph降低,体系中的钙在ph6.11下渐进释放至多3.0mm。可以观察到在乳酸钙的存在下并且在2.0mm或更高的游离钙浓度下加热乳剂后,颗粒尺寸和粘度均增加。对粘度增加的影响在较低ph下较大,因此在较高游离钙浓度下较大。
实施例3:
通过在双重浓缩的重组减脂乳中添加乳酸钙获得的乳蛋白质和豌豆蛋白质聚集体,其中25%的乳蛋白质被豌豆蛋白质取代。
低热脱脂乳粉(msk)由瑞士的赫尔达夫公司(hochdorf,switzerland)提供,并且豌豆蛋白质分离物nutralysxf由法国的罗盖特公司(roquette,france)提供。
由于豌豆蛋白质分离物的蛋白质浓度高于脱脂乳粉,因此总固体(ts)通过添加麦芽糖糊精de38-41(法国罗盖特公司(roquette,france))调节为平均全脂乳,以获得13%ts。使用高油酸向日葵油(瑞士oleificiosabo公司(oleificiosabo,switzerland))替代乳脂。在26%ts下,用6.6%的总蛋白质(4.95%的乳蛋白质,1.65%的豌豆蛋白质)和1%的油配制该体系。
表5示出了乳-豌豆体系的组成。
表5:混合的75:25msk-豌豆蛋白质体系(26%ts)的主要成分和示例性配方。
对于钙添加,在过程中将乳酸钙(荷兰普拉克生物化学公司(puracbiochem,thenetherlands))与麦芽糖糊精一起干燥混合并且添加。
图10示出了用于配制乳-豌豆体系的方法。
对豌豆蛋白质进行预处理,并且如实施例1中所示那样配制和处理乳-豌豆体系。
流动特性
使用未加热和加热的乳剂,如实施例1中那样执行流动实验。
颗粒尺寸分布
如实施例1中那样分析颗粒尺寸分布。
离子(游离钙)测定
如实施例1中所示那样测量离子钙浓度。
结果
表6:
表6显示,具有乳酸钙的乳剂在ph6.59下具有1.5mm的游离离子钙值,这与在全脂肪体系中观察到的值相当。在这些条件(ph6.59,1.5mm的游离钙浓度)下,在热处理期间未诱导显著的蛋白质聚集。随着ph降低,游离钙在ph6.20下增加至多2.4mm,并且在加热乳剂后颗粒尺寸和粘度均增加。对粘度增加的影响在较低ph下较大。通过添加乳酸钙并降低ph,在减脂体系中,在不添加钙的情况下,能够获得与全脂体系相似或甚至更高的粘度(在100l/s下为16mpa.s)。
实施例4:
通过在双重浓缩的重组脱脂乳中添加乳酸钙获得的乳蛋白质和豌豆蛋白质聚集体,其中25%的乳蛋白质被豌豆蛋白质取代。
低热脱脂乳粉(msk)由瑞士的赫尔达夫公司(hochdorf,switzerland)提供,并且豌豆蛋白质分离物nutralysxf由法国的罗盖特公司(roquette,france)提供。由于豌豆蛋白质分离物的蛋白质浓度高于脱脂乳粉,因此总固体(ts)通过添加麦芽糖糊精de38-41(法国罗盖特公司(roquette,france))调节为平均全脂乳,以获得13%ts。使用高油酸向日葵油(瑞士oleificiosabo公司(oleificiosabo,switzerland))替代乳脂。在26%ts下,用6.6%的总蛋白(4.95的%乳蛋白质,1.65%的豌豆蛋白质)配制该体系,不添加任何脂肪。
表5示出了乳-豌豆体系的组成。
表7:混合的75:25msk-豌豆蛋白质体系(26%ts)的主要成分和示例性配方。
对于钙添加,在过程中将乳酸钙(荷兰普拉克生物化学公司(puracbiochem,thenetherlands))与麦芽糖糊精一起干燥混合并且添加。
图10示出了用于配制乳-豌豆体系的方法。
对豌豆蛋白质进行预处理,并且如实施例1中所示那样配制和处理乳-豌豆体系。
流动特性
使用未加热和加热的乳剂,如实施例1中那样执行流动实验。
颗粒尺寸分布
如实施例1中那样分析颗粒尺寸分布,但使用的测量设置是蛋白质的折射率为1.52。
离子(游离钙)测定
如实施例1中所示那样测量离子钙浓度。
结果:
表8:
表8显示,添加乳酸钙的蛋白质分散体在ph6.69下具有1.5的游离离子钙值,这与在全脂和减脂体系中观察到的值相当。在这些条件(ph6.69,1.5mm的游离钙浓度)下,在热处理期间未诱导显著的蛋白质聚集。在ph降低的蛋白质分散体中,游离钙在ph6.03下增加至多2.8mm,并且在加热蛋白质分散体后颗粒尺寸和粘度均增加。对粘度增加的影响在较低ph下较大。通过添加乳酸钙并降低ph,在不含脂肪的体系中,在不添加钙的情况下,能够获得与全脂体系相似或甚至更高的粘度(在100l/s下为16mpa.s)。
实施例5:
以实验室规模在用乳蛋白质浓缩物(mpc)/大豆蛋白质分离物(spi)稳定的乳剂中添加氯化钙
材料和方法
mpc分散体的制备
以10重量%的蛋白质浓度制备胶束酪蛋白分散体的储备溶液。富含胶束酪蛋白promilk852b的乳蛋白质浓缩物购自法国阿拉斯的安迪亚公司(ingredia,arras,france)。粉末组合物为(g/100g湿粉末):蛋白质(nx6.38)82.3、ca2.6、mg0.1、na0.07、k0.29、cl0.05、p1.56。计算制备分散体所需的粉末质量作为粉末中蛋白质含量的函数。
在室温搅拌下,将mpc粉末在milliq水中水合3小时。在3小时后,用emulsiflexc-5高压单级均化器(
在均质化之后,使用nanosizerzs设备(英国马尔文仪器公司(malvern
spi分散体的制备
为了改善大豆蛋白质的溶解度,从非gmo大豆粉(得自美国伊利诺伊州迪凯特的adm公司(adm,decatur,il,usa)的大豆粉7bip;批次413936)中提取大豆蛋白质,使用温和等电沉淀方法最小化蛋白质变性。为此,在室温搅拌下,将大豆粉分散在milliq水中90分钟。大豆粉对水的比例为1:8(在ph6.7下,800g水使用100g大豆粉)。分散之后,使用1mnaoh将ph调节至7.5,并且在室温下以9,000g的离心力在1升的瓶中离心分散体30分钟。收集上清液后,使用1mhcl将ph调节至4.8以沉淀蛋白质。然后,在与之前相同的条件下再次离心分散体。离心后,提取沉淀并用研钵研磨,以减小颗粒尺寸并改善水合能力。之后,搅拌至少10分钟,将沉淀尽可能地溶解于最少量的水中(1:4的沉淀/水质量比),并且通过添加1mnaoh将ph调节至7.0。完全溶解后,将大豆蛋白质分离物分散体冷冻并冷冻干燥以获得粉末。粉末的组成为(g/100g湿粉末):蛋白质(nx6.25)91.3、ca0.057、mg0.073、na1.59、k0.37、cl0.62、p0.63。可以注意到,由于蛋白质提取所需的ph调节步骤,矿物质na和cl的量相当高。大豆蛋白质的不同级分通过sds-page电泳进行鉴定,揭示出大豆蛋白质的两个主要级分的存在:7s和11s。
以10重量%的蛋白质浓度制备spi的储备分散体。在搅拌下,于室温下将spi分散在milliq水中4小时。然后将分散体在4℃下存储过夜,以允许完全水合并减少搅拌期间形成的泡沫层。
mci/spi混合物的制备
将如下所述制备的mci和spi的分散体以75:25和50:50的mpc:spi比例按重量进行混合,在室温下使用磁力搅拌器搅拌至少10分钟。
乳剂制备
通过向蛋白质分散体中添加高油酸向日葵油(瑞士曼诺的oleificiosabo公司(oleificiosabo,manno,switzerland))来制备o/w乳剂,通过稀释以10重量%制备的储备分散体,使得总样品得到2.5重量%、5重量%和10重量%的油含量和3重量%的恒定蛋白质含量。随后使用ultra-turraxt25基本型(瑞士艾卡公司(
通过该方法将乳剂均质化两次。在均质化后,通过添加1mnaoh将ph调节至7.0。对于含钙样品,向ph7.0样品中添加所需量的cacl2,2(h2o),并且在室温下搅拌乳剂1小时。然后在被调节至97℃的热水浴中,在15分钟内将样品加热至95℃。将乳剂在冰水中冷却20分钟后,在4℃下储存1小时。
在冷却后,随后在体积为60ml的烧杯中,使用ultra-turraxt25基本型(瑞士艾卡公司(
颗粒尺寸分布
为了评估颗粒尺寸分布,在剪切之后,使用mastersizer3000(malverninstruments
蛋白质聚集体的微观结构
样品的低温切片
进行低温切割以通过clsm分析样品。为此,在样品中添加蔗糖和甲醛以便保存它们。蔗糖的百分比为总体积的30重量%,甲醛的百分比为3.7重量%。在开始分析前,使用涡旋将样品均质化并在4℃储存过夜。
然后,固定样品。该步骤包括在1g用于低温恒温切片的最佳切割温度(oct)化合物
将低温恒温样品保持器浸入含有80ml的2-甲基丁烷(99%,得自美国的西格玛奥德里奇公司(sigma
然后将样品置于cryostatcm3050(
预先用histogrip(来自美国thermofisher
共焦扫描激光显微镜
使用特定的蛋白质免疫标记分析混合的蛋白质乳剂以区分乳蛋白质和大豆蛋白质。根据auty(2013),免疫标记更常用于蛋白质,并且需要特异性抗体来靶向所关注的蛋白质,即mpc和spi。免疫标记的结果在很大程度上取决于一级抗体对靶表位的特异性。热变性可影响靶蛋白质的免疫反应性,尤其是当蛋白质经历了我们实验中的剧烈热处理时。此处理可影响抗体特异性并降低标记的功效。
执行两步免疫标记,使用荧光标记的二级抗体结合一级抗体,因为这增大了信噪比。
在使用抗体检测蛋白质之前,必须阻断剩余的结合表面以防止抗体的非特异性结合。使用普通山羊血清invitrogenpcn5000(美国赛默飞世尔公司(thermofisher
为了使油滴可视化,还用溶解于乙醇中的尼罗红染色显微镜载片10分钟,然后在milliq水中冲洗。然后使用固定安装的vectashield硬固定安装介质(
之后使用
饱和度控制能够检查一级抗体对蛋白质的特异性,并且确保二级抗体对第一个是特异性的。为此,以2.5μl/ml的量添加蛋白质以制备一级抗体。如果一级抗体和二级抗体是特异性的,则在clsm中不应具有信号和背景。也对尼罗红光谱发射进行了控制,以确保每个光谱发射足够分离以避免叠加。
流动特性
剪切后一天,使用受控应力流变仪physicamcr501(anton
在25℃的恒定温度下进行稳态流动测量,在5分钟期间对样品施加100l/s的剪切应力,之后施加四种剪切速率,一种为0.1l/s至500l/s并且另一种为500l/s至0.1l/s,这些速率操作两次;每30秒进行15次测量。记录表观粘度作为剪切速率的函数。
对于每次测量,将等分试样(19ml)的乳剂样品倒入杯中。测量进行三次,并且报告三次重复的平均值。
可溶性蛋白质含量
为了表征本发明产品中可溶性蛋白质的含量,在生产后一天,使用
uplc系统(美国马萨诸塞州米尔福德的沃特世公司(waterscorpmilfordma,usa))由二元泵、温控自动采样器(样品管理器-upsmpm6r)和光电二极管阵列检测器(uppda-e)组成。该设备由
在反相分析柱acquity
通过将10重量%的参比溶液稀释在milliq水中,制备浓度为0.1重量%、0.3重量%、1重量%、3重量%和5重量%的酪蛋白和大豆蛋白质的标准样。在1.5ml
在温育后,将样品均质化并在室温使用
进行梯度洗脱,其中在洗脱期间混合两种溶剂。溶剂a由水中的0.1%tfa组成,溶剂b为乙腈/水(90/10)(v:v)中的0.1%tfa。分离以线性梯度进行,在4分钟内从15%至35%b(5%b.min-1),在24分钟内35%至47%b(0.5%b.min-1),并且在4分钟内从47%b至80%b(8.25%b.min-1)。然后在80%b在1分钟期间进行等度洗脱。然后在2分钟内线性返回到起始条件,然后重新平衡柱5分钟。
流率为0.6ml.min-1,并且柱温保持恒定在40℃±1℃。采集在λ=214nm(分辨率2.4nm-20点/秒-自动曝光时间)下实现。
每个色谱图都是手动整合的。对于校准曲线,将总面积绘制为注射的蛋白质量的函数。可溶性蛋白质含量由离心后上清液中存在的蛋白质量与未经离心的乳剂中存在的蛋白质总量的比例计算,并以百分比表示。
结果
颗粒尺寸分布
图1a、b和c示出,在以75:25的mpc:spi比例进行热处理和剪切后,对于测试的3种向日葵油含量(2.5重量%、5重量%和10重量%),在ph7.0的乳剂的颗粒尺寸分布显示出约400nm至600nm的峰。相反,当在5mm添加的游离钙存在下实现热处理时,形成较大的颗粒。因此,颗粒尺寸分布的峰明显偏移至约10微米至25微米,表明初始油滴聚集成较大的基于蛋白质的颗粒。
图2a、b和c示出,在以50:50的mpc:spi比例进行热处理和剪切后,对于测试的3种向日葵油含量(2.5重量%、5重量%和10重量%),在ph7.0的乳剂的颗粒尺寸分布显示出约400nm至600nm的峰。相反,当在10mm添加的游离钙存在下实现热处理时,形成较大的颗粒。因此,颗粒尺寸分布的峰明显偏移至约10微米至25微米,表明初始油滴聚集成较大的基于蛋白质的颗粒。
微结构和可溶性蛋白质含量
对于包含5重量%高油酸向日葵油的乳剂,图3(75:25比例)和图4(50:50比例)清楚地示出了本发明的基于蛋白质的聚集体的微观结构。图3a以75/25的mpc/spi比例示出了在明确限定的油滴周围获得的连接的小聚集体。mpc和spi两者的标记显示蛋白质不是紧密地位于聚集体中,因为两种特异性的标记均可容易地区分开来。可溶性蛋白质的量为约97%,表明两种蛋白质来源中仅有一小部分参与聚集体形成。相反,在存在5mm钙的情况下获得较大且更紧凑的颗粒(图3b)。油滴不太可见并且牢固地嵌入聚集体结构。mpc和spi标记位于颗粒内,表明它们在空间上非常接近。此样品中的可溶性蛋白质的量小于4%,表明mpc和spi中的大多数涉及聚集结构。图4示出在10mmcacl2的存在下重量比为50/50的mpc/spi混合物的显微图。在不存在添加的游离钙的情况下(图4a),观察到表现出嵌入的许多离散油滴的小聚集体。具有添加的cacl2时,油滴更多地嵌入其中涉及mpc和spi两者的较大蛋白质聚集体,通过两个蛋白质来源的共同标记可以看出这一点(图4b)。经uplc测量,发现在ph7.0下的可溶性蛋白质的量为约85.9%。这表明大多数蛋白质未参与聚集结构。在氯化钙的存在下,可溶性蛋白质的量大幅下降达到13.4%,表明大部分蛋白质是聚集体的一部分,因此有助于形成较大颗粒。
流动特性和剪切粘度
具有不同高油酸向日葵油含量的mpc/spi混合物的流动曲线示于图5和图6中。图5显示,对于75/25的混合比例,添加氯化钙促进剪切致稀行为,并且该效应随初始混合物中油的含量而增强(图5a、b和c)。有趣的是,在不存在氯化钙的情况下,ph7.0下的体系始终表现出较低的剪切致稀行为,并且对表明所形成的蛋白质结构不能强烈影响体系体粘度的脂肪含量的影响更小。对于本发明的样品而言,这是非常不同的,在这些样品中,氯化钙添加明显促进了蛋白质聚集,导致颗粒极大地影响粘度并因此允许脂肪减少。
重量混合比例为50/50的mpc/spi混合物的相关流动数据示于图6中。可以看出,对于比例75/25,在10mmcacl2的存在下,曲线表现出通过在高油酸向日葵油中存在含量增加而增强的强剪切致稀行为(图6a、b和c)。这证实,本发明的蛋白质聚集体能够占据更多空间并影响体粘度,在不存在钙的情况下ph7.0下的控制系统不是这种情况。在ph7.0产生的乳剂表现出牛顿流动行为,与作为剪切速率的函数的粘度无关。这可通过粘度主要由油体积分数驱动并且油滴不相互作用的事实来解释。
图7汇总了从与口腔生理条件相关的剪切速率为10l/s的流动曲线提取的剪切粘度。就这两种mpc/spi体系而言,明显的是,油的添加增加剪切粘度,但有趣的是,在不存在添加的cacl2的情况下,对于两种比例的mpc/spi,在本发明的样品中获得的值均大于ph7.0下的相应对照物。这再次显示了本发明降低脂肪含量同时保持粘度和口感的潜力。
实施例6:
以试验规模在用乳蛋白质浓缩物/大豆蛋白质分离物稳定的乳剂中添加氯化钙
以试验规模再现在实施例6中测试的体系,以测试本发明对工业条件的敏感性。所用的mpc类似于实施例5,即promilk852b,其购自法国阿拉斯的安迪亚公司(ingredia,arras,france)。大豆蛋白质分离物是得自美国伊利诺伊州迪凯特的adm公司(adm,decatur,il,usa)的商用profam974-ip。它通过从脱脂大豆粉中等电沉淀蛋白质而获得。干粉中的蛋白质含量为95.4重量%,而脂肪含量为0.6重量%。
样品的制备
在反渗透(ro)水中制备3重量%蛋白质含量的mcp和spi分散体。在50℃下在不锈钢槽中机械搅拌173.4kgro水中的6.6kgmpc粉末30分钟以进行分散,由此制备180kg批量的mpc。对于spi,在20℃下将2.1kg的spi粉末分散于57.9kg的ro水中。30分钟后,使用高压均质机以250/50巴的压力均质化mpc分散体。使用10%盐酸,在20℃下将mpc和spi的ph调节至ph7.0。将调节至ph7.0的mpc和spi分散体以40kg的批量重量混合以获得75/25和50/50的mpc/spi混合比例,并且在20℃下搅拌30分钟。然后向蛋白质分散体中添加高油酸向日葵油(瑞士oleificiosabo公司(oleificiosabo,switzerland)),在高剪切下制备5重量%乳剂。然后使用高压均质机在250/50巴的压力下均质化预乳剂,并且将样品冷却至10℃。再次检查ph,在本发明的样品中,添加必要量的cacl2,2(h2o),以使游离钙含量提高10mm(对于75mpc/25spi比例)和20mm(对于50mpc/50spi比例)。然后使用以180l/小时的速度操作的直接蒸汽注入管线在95℃下对样品进行热处理3分钟。将样品在60℃下预热以进行dsi处理,然后使用管式热交换器将样品冷却至10℃。然后将样品填充到聚丙烯500ml瓶中并保存在4℃下供分析。
颗粒尺寸分布
如实施例1中所述的那样测定样品的颗粒尺寸分布。已经报告了不同样品的d(4,3)平均直径。
流动特性
样品的流动曲线已如实施例1中所述的那样进行测定。已经报告了样品在10s-1处的剪切粘度。
共焦扫描激光显微镜
如实施例5中所述的那样制备样品并表征样品,不同的是样品不是冷冻切片的,而是以液体形式成像的,并且没有使用特异性的免疫标记来区分mpc和spi。为此,将样品置于1mm深的塑料室内,该塑料室被载玻片闭合以防止压缩和干燥伪影。为进行标记,将快速绿色染料(1重量%水溶液,稀释100倍以供使用)用于蛋白质,而将尼罗红(0.25重量%乙醇溶液,稀释100倍以供使用)用于油滴。
可溶性蛋白质
按实施例5中所述的uplc测定样品中存在的可溶性蛋白质。
结果
颗粒尺寸、粘度和可溶性蛋白质
对于两种mpc/spi混合比例,与不包含添加的cacl2的样品相比,本发明样品的颗粒尺寸增大(表9)。这表明初始油滴与蛋白质聚集在一起以形成较大聚集体。10l/s下的粘度类似于或大于对应的对照样品,显示对于样品中类似的油含量,蛋白质聚集体影响样品的体粘度。应当指出的是,本发明的样品的流动曲线表现出剪切致稀行为,而对于对照物,这些为牛顿流动行为,如实施例5中所述。本发明的样品中的可溶性蛋白质含量非常低(小于3%),而对照物的可溶性蛋白质含量较高(对于50/50比例,高达62.2%)。这表明,如前一个实施例中所述,本发明促进大多数蛋白质与油滴聚集以形成影响体粘度的较大聚集体。
表9:以试验规模制备的样品的物理化学特性。
聚集体的微观结构
通过cslm研究样品的结构(图8和图9)。对于两种mpc/spi混合比例,对照样品表现出均匀分布的油滴,没有明显的聚集迹象(图8a和图9a)。这解释了为什么大多数蛋白质保持可溶的原因,因为仅有限的部分涉及油滴界面的稳定。在用于本发明样品的添加的cacl2的存在下,对于两种比例,油滴聚集以形成嵌入油滴的较大聚集体(图8b和图9b)。
实施例7:
通过在双重浓缩的重组全脂乳中添加乳酸钙获得的乳蛋白质和大豆蛋白质聚集体,其中50%的乳蛋白质被大豆蛋白质取代。
低热脱脂乳粉(msk)由瑞士的赫尔达夫公司(hochdorf,switzerland)提供,大豆蛋白质分离物clarisoy170由美国伊利诺伊州的adm公司(adm,illinois)提供。
由于大豆蛋白质分离物的蛋白质浓度高于脱脂乳粉,因此总固体(ts)通过添加麦芽糖糊精de38-41(法国罗盖特公司(roquette,france))进行调节,以获得26%ts。使用高油酸向日葵油(瑞士oleificiosabo公司(oleificiosabo,switzerland))替代乳脂。
在26%ts下,用6.6%的总蛋白质(3%的乳蛋白质,3%的大豆蛋白质)和7%的油配制该体系。
表10示出了乳-大豆体系的组成。
表10:混合的50:50msk-大豆蛋白质体系(26%ts)的主要成分和示例性配方。
对于钙添加,将乳酸钙(德国默克公司(merck,germany))干燥混合,并且在过程中与麦芽糖糊精一起添加。
图10示出了用于配制乳-豌豆体系的方法。
对大豆蛋白质进行处理以改善溶解度,并且如实施例1中所述配制和处理乳-大豆体系。
结果:
表11:
表11示出了不添加乳酸钙的乳剂包含可溶性钙形式的1.8mm游离离子钙,这些钙不足以在热处理期间诱导显著的蛋白质聚集。向体系中添加乳酸钙导致游离离子钙的增加。随着ph降低,体系中的钙在ph6.39下渐进释放至多2.9mm,并且在加热乳剂后颗粒尺寸和粘度均增加。对粘度增加的影响在较低ph下较大。
当ph进一步降低至6.25时,游离钙增加到3.1,导致形成中等尺寸的聚集体(49.733μm),但是与ph6.39相比失去一些粘度效应。这表明对于此特定体系,ph6.25下3.1的游离钙已经过高。为了使粘度增加最大化,需要使用较低的游离钙和/或较高的ph(例如,ph6.39和3.1mm游离钙)。
- 还没有人留言评论。精彩留言会获得点赞!