含C‑肽的用于预防或治疗糖尿病性血管渗漏诱导的疾病的组合物的制作方法与工艺
含C-肽的用于预防或治疗糖尿病性血管渗漏诱导的疾病的组合物技术领域本发明涉及使用C-肽预防或治疗糖尿病相关疾病。更具体的,本发明涉及使用C-肽预防或治疗糖尿病性血管渗漏诱导的疾病的方法,使用C-肽预防或治疗糖尿病性视网膜病变的方法,和包括C-肽的用于预防或治疗上述疾病的组合物。
背景技术:
本领域技术人员公知的,糖尿病是一组具有多种病因的代谢性疾病,特征在于由胰岛素活性的完全缺乏或功能性缺乏引起的慢性高血糖。维持很长时间的高血糖水平会引起慢性代谢性障碍并且引起血管的损伤,并伴随各种并发症的随后发病。这些疾病典型地在糖尿病发病10年之后显现出来,因为几乎身体所有的器官都已经受到了损伤。具体的,在糖尿病患者中观察到异常的血管渗漏,并且糖尿病性血管渗漏诱导各种并发症,包括糖尿病性视网膜病变、糖尿病性神经病、糖尿病性肾病、糖尿病性血管功能障碍、糖尿病性炎症等。这些糖尿病并发症与VEGF(血管内皮生长因子)的过表达相关。VEGF可能诱导血管渗漏,并且已知在糖尿病患者的视网膜中VEGF的水平升高会诱导血管生成和肌肉水肿。进一步的,最近的研究已经表明ROS生成和应力纤维的形成中断了在粘着连接处的基于VE-钙粘着蛋白的细胞-细胞粘附。此外,已知VE-钙粘着蛋白是防止血管壁的解体及协调大分子穿过内皮的必要组分。人类的C-肽是从胰岛素原中切下的短肽,并且以与胰岛素等摩尔浓度地被胰腺β细胞分泌到循环中。伴随胰岛素的C-肽的缺乏是I型糖尿病和II型糖尿病晚期的典型的特征。视网膜病变是糖尿病诱导的主要并发症之一,并且是成人中导致失明的首要原因。C-肽用于诊断糖尿病,但是还没有报道C-肽在治疗糖尿病性血管渗漏或由糖尿病性血管渗漏诱导的间接疾病中的应用。在此背景下,本发明人对治疗糖尿病性血管渗漏进行了深入且彻底的研究,并且发现C-肽可以用于在糖尿病性视网膜病变中保护VEGF诱导的血管渗漏,从而得到了本发明。
技术实现要素:
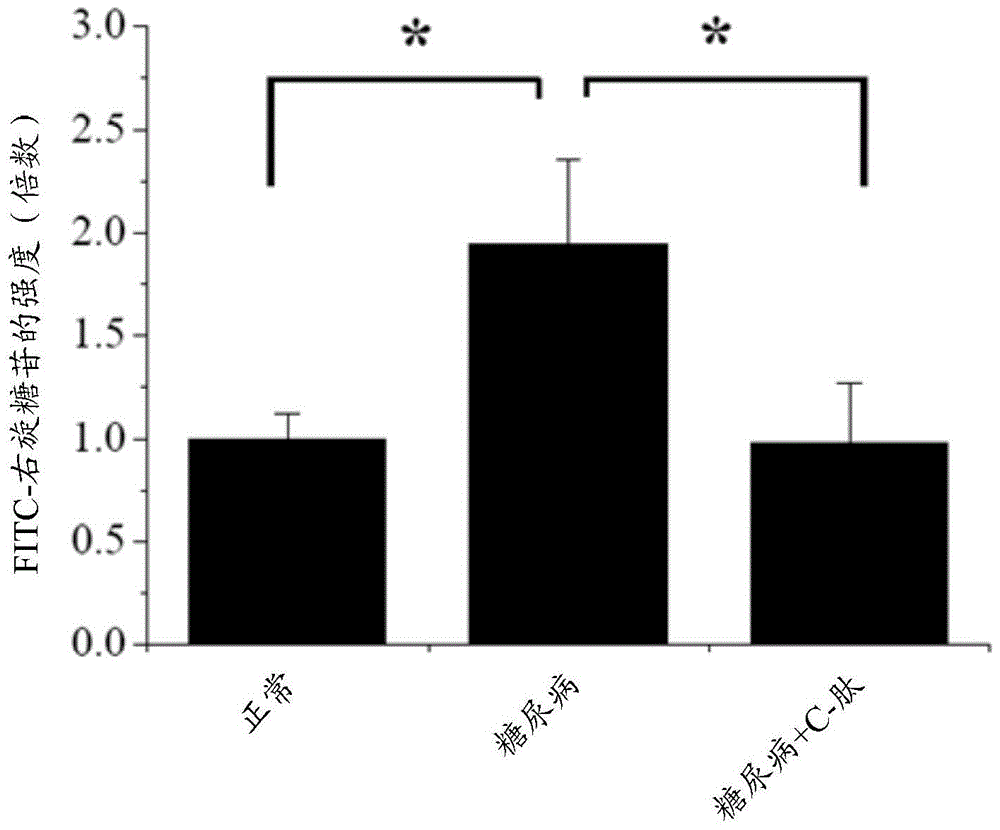
因此,本发明的主要目的是提供一种使用C-肽预防或治疗糖尿病性血管渗漏诱导的疾病的方法或组合物。本发明的另一目的是提供一种使用C-肽预防或治疗糖尿病性视网膜病变的方法或组合物。根据本发明的一个方面,本发明提供了一种预防或治疗糖尿病性血管渗漏诱导的疾病的方法,该方法包括给予有需要的动物有效量的C-肽。根据本发明的另一方面,本发明提供了一种预防或治疗糖尿病性血管渗漏诱导的疾病的药物组合物,该药物组合物包括作为活性成分的C-肽。根据本发明的又一方面,本发明提供了一种预防或治疗糖尿病性视网膜病变的方法,该方法包括给予有需要的动物有效量的C-肽。根据本发明的再一方面,本发明提供了一种预防或治疗糖尿病性视网膜病变的药物组合物,该药物组合物包括作为活性成分的C-肽。本发明发现了,通过抑制VE-钙粘着蛋白的VEGF诱导的解体防止血管渗漏,以及根据本发明的包括C-肽的药物组合物对伴随有血管渗漏的广谱的糖尿病并发症具有预防性或治疗性应用。附图说明图1示出了如在链脲霉素糖尿病小鼠和正常小鼠的视网膜中测量的,C-肽对糖尿病诱导的血管渗漏的抑制活性,其中将2μlC-肽(糖尿病+C-pep)玻璃体内注射到链脲霉素糖尿病小鼠的一只眼睛中,并且将等体积的PBS玻璃体内注射到该链脲霉素糖尿病小鼠的对侧眼睛中(糖尿病;n=6/组),并且还将2μlPBS玻璃体内注射到正常(非糖尿病)小鼠的眼睛中(正常;n=6/组)。通过共聚焦显微镜可视化视网膜。图1A示出视网膜的荧光图像,其中上图的方形区域在各图片的下图中以放大图像给出。图1B是柱状图,其中视网膜通透性通过测量整个视网膜组织(n=6)的荧光强度进行了量化,并且表示为来自六次独立实验的平均值±S.D.。*p<0.05。图2示出C-肽抑制VEGF诱导的ROS生成,但对细胞内的钙离子没有作用。图2A是在HUVEC与1mMNAC、0.5mMTrolox或5μMBAPTA-AM预孵育30min,并且经10ng/mlVEGF刺激10min之后,使用共聚焦显微镜确定的细胞内ROS的水平的柱状图,其中数据表示为来自三次独立实验的平均值±S.D.。图2B是曲线图,其中在HUVEC经各种浓度的C-肽预处理30min,然后经10ng/mlVEGF刺激之后,依据C-肽浓度绘制的ROS水平,示出了C-肽以剂量依赖的方式抑制VEGF诱导的细胞内ROS的生成。图2C是如在单个细胞水平(n=3)上通过共聚焦显微镜随着时间监测的,在经1μMFluo-4AM标记的HUVEC中的细胞内钙离子水平的曲线图。图3示出了HUVEC的荧光照片,证明了C-肽抑制VEGF诱导的应力纤维的形成和VEGF诱导的粘着连接的解体。在HUVEC与单独的10ng/mlVEGF或0.5nMC-肽,或在0.5nMC-肽、1mMNAC或0.5mMTrolox的存在下与10ng/mlVEGF孵育1h之后,观察到如图1中所示的C-肽对VEGF诱导的应力纤维形成的抑制活性。显微细丝经罗丹明-鬼笔环肽染色,并且通过共聚焦显微镜观察(n=3)。比例尺代表30μm。图4A和4B示出,如在HUVEC与单独的10ng/mlVEGF或0.5nMC-肽,或在0.5nMC-肽、1mMNAC或0.5mMTrolox的存在下与10ng/mlVEGF孵育90min之后(n=3)测定的,C-肽对VEGF诱导的粘着连接破裂的抑制活性。图4A示出,在对VE-钙粘着蛋白进行染色和使用共聚焦显微镜可视化之后的VE-钙粘着蛋白的荧光图像(n=3)。比例尺代表20μm。图4B示出VE-钙粘着蛋白的柱状图,其中粘着连接由虚线所示。图4C示出,C-肽恢复了糖尿病小鼠的视网膜中高血糖症诱导的粘着连接的破裂。将2μlC-肽玻璃体内注射到糖尿病小鼠的一只眼睛中(糖尿病+C-pep),并且将等体积的PBS注射到对侧眼睛中(糖尿病;n=3)。将2μlPBS玻璃体内注射到非糖尿病小鼠的眼睛中(正常;n=3)。对视网膜中的VE-钙粘着蛋白进行染色,并且使用共聚焦显微镜可视化VE-钙粘着蛋白(n=3)。尺,30μm。图5示出抗VEGF和ROS清除剂防止了糖尿病小鼠视网膜中的血管渗漏。在这一方面,将2μlC-肽(糖尿病+C-Pep)、抗-VEGF(糖尿病+抗-VEGF)、N-乙酰基-半胱氨酸(糖尿病+NAC)和Trolox(糖尿病+Trolox)玻璃体内注射到糖尿病小鼠的一只眼睛中,并且将等体积的PBS玻璃体内注射到对侧眼睛中(糖尿病;n=6/组)。还将2μlPBS玻璃体内注射到正常(非糖尿病)小鼠的眼睛中(正常;n=6/组)。通过共聚焦显微镜可视化视网膜。图5A示出视网膜的荧光图像(尺,100μm)。图5B是视网膜通透性的柱状图,该视网膜通透性通过测量整个视网膜组织(n=6)的荧光强度进行了量化分析。*p<0.01;图6A示出了在通过渗透泵注入小鼠中之后,剩余的血清C-肽的水平。图6B和6C示出,当通过皮内注射给予时,C-肽防止了糖尿病小鼠的外周血管中VEGF诱导的血管渗漏。图6D是曲线图,其中依据玻璃体内注射之后的时间绘制血清C-肽的水平。以及图7是参与C-肽介导的防止VEGF诱导的血管通透性的可能的信号传导途径的示意图,示出了C-肽通过抑制VEGF诱导的ROS生成防止了VEGF诱导的血管渗漏。具体实施方式得到本发明的,对预防和治疗糖尿病患者中的糖尿病诱导的血管渗漏的深入且彻底的研究得到以下发现:C-肽抑制VEGF诱导的细胞内ROS的生成,并且对VEGF诱导的细胞内钙离子升高没有影响,这与VEGF完全相反,其中VEGF通过使进入细胞的钙离子流升高而生成细胞内的ROS;C-肽抑制内皮细胞中VEGF诱导的应力纤维的形成,以及VEGF诱导的VE-钙粘着蛋白的破裂;以及,C-肽通过抑制VEGF诱导的细胞内ROS的生成,防止糖尿病小鼠的视网膜中的微血管的渗漏,从而产生微血管的通透性,其中VEGF诱导的细胞内ROS的生成刺激应力纤维的形成和粘着连接的解体。C-肽抑制糖尿病诱导的血管渗漏的机制例示在图7中。因此,本发明涉及使用C-肽预防或治疗糖尿病性血管渗漏诱导的疾病的方法和组合物;以及预防或治疗糖尿病性视网膜病变的方法和组合物。根据本发明的一个方面,本发明解决了一种使用C-肽预防或治疗糖尿病性血管渗漏的方法和组合物。更具体的,本发明提供了一种预防或治疗血管渗漏诱导的疾病的方法,该方法包括给予有需要的动物有效量的C-肽。另外,本发明还提供了预防或治疗糖尿病性血管渗漏诱导的疾病的药物组合物,该药物组合物包括作为活性成分的C-肽。如本文所使用的,术语“C-肽”指在哺乳动物和鸟中发现的胰岛素原的短的蛋白成分,该胰岛素原由胰岛的胰腺β细胞生成。它的长度依赖于它的来源在21个氨基酸至31个氨基酸之间变化。来自各种哺乳动物(包括狗、猫、大鼠、黑猩猩、小鼠、母牛等)的哺乳动物的C-肽,以及人类的C-肽,和来自例如鸫的鸟类的C-肽,都在本发明的范围内。例如,来源于人类(Homosapiens,SEQIDNO:1)、大鼠(Rattusnorvegicus,SEQIDNO:2)和黑猩猩(Pantroglodytes,SEQIDNO:3)的所有C-肽都由31个氨基酸构成,同时发现C-肽在小鼠(Musmusculus,SEQIDNO:4)中为29-mer肽,在牛(BosTaurus,SEQIDNO:5)中为26-mer肽,在鸫(Turdusmerula,SEQIDNO:6)和红脚鲣鸟(Sulasula,SEQIDNO:7)中为21-mer肽。本发明的C-肽可以具有选自由SEQIDNO:1至SEQIDNO:7组成的组中的氨基酸序列。为了本发明的目的,C-肽在本发明提供的方法或组合物中用作活性成分。所述方法或组合物可以应用于可能受糖尿病性血管渗漏诱导的疾病影响的任何动物,以及人类。在此上下文中,C-肽优选应用于它的来源的动物。例如,如果它应用于人类,则本发明的方法或组合物优选包括人来源的C-肽(SEQIDNO:1)。在本发明的一个实施方式中,发现C-肽在糖尿病的模型小鼠中阻止血管外的渗漏,从而C-肽或包括C-肽的组合物可应用于预防或治疗糖尿病性血管渗漏。详细来说,本发明的方法或组合物对糖尿病性血管渗漏诱导的疾病的预防性或治疗性效果可以归因于:C肽对细胞内ROS生成的抑制活性,不升高细胞内钙离子(Ca2+)的水平;对防止应力纤维的形成的抑制活性;和/或对防止粘着连接的解体的抑制活性。C-肽对糖尿病性血管渗漏的预防性或治疗效果可以应用于人类,以及会受到糖尿病影响的任何动物。此外,抑制VEGF诱导的VE-钙粘着蛋白的解体所产生的效果,不仅可以应用于视网膜(如在下面的实施例部分中所证明的),而且还可以应用于其它组织的外周血管。也就是说,糖尿病性血管渗漏可以是视网膜渗漏或其它组织的外周血管中的微血管渗漏。相应的,在任何糖尿病患者(动物或人类)中出现各种糖尿病并发症的发病之后,本发明的方法或组合物可以应用于血管渗漏的预防或治疗;其中各种糖尿病并发症包括糖尿病性视网膜病变、糖尿病性神经病、糖尿病性肾病、糖尿病性血管功能障碍、糖尿病性炎症等。本发明的组合物是药物组合物,该药物组合物可进一步包括药学上可接受的递送剂、赋形剂或稀释剂。如本文所使用的,术语“药学上可接受的递送剂、赋形剂或稀释剂”旨于包括任何和所有的溶剂,分散介质,包衣剂,佐剂,稳定剂,防腐剂,抗菌剂和抗真菌剂,等渗剂,和吸收延迟剂。在本发明中有用的递送剂、赋形剂或稀释剂的实例包括乳糖、右旋葡萄糖(dextrose)、蔗糖、山梨醇、甘露醇、木糖醇、麦芽糖醇、葡萄糖、甘油、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、甲基羟基苯甲酸盐、丙基羟基苯甲酸盐、滑石、硬脂酸镁、矿物油等。使用常规方法,可以将本发明的药物组合物配制成口服剂型(诸如粉剂、颗粒剂、片剂、胶囊、悬浮液、乳液、糖浆和喷雾剂),或配制成无菌的注射剂。对于根据本发明的组合物的制剂,通常使用稀释剂或赋形剂,诸如填充剂、增稠剂、粘合剂、湿润剂、崩解剂和表面活性剂。用于口服剂量的固体制剂包括片剂、丸剂、粉剂、颗粒剂和胶囊。使用卵磷脂样的乳化剂与诸如淀粉、碳酸钙、蔗糖、乳糖或明胶的至少一种赋形剂的组合,制备这些固体制剂。除了赋形剂之外,可以使用润滑剂,诸如镁、硬脂酸盐、滑石等。用于口服给药的液体制剂包括悬浮液、内部溶液、乳液和糖浆。在这些液体制剂中,可以含有各种赋形剂(诸如湿润剂、甜味剂和防腐剂),以及简单的稀释剂(诸如水和液体石蜡)。用于非口服剂量的制剂的代表可以是无菌水溶液、非水溶液、悬浮液、乳液、冻干剂和栓剂。对于非水溶液和悬浮液,可以使用植物油(诸如丙二醇、聚乙二醇和橄榄油),或可注射的酯(诸如油酸乙酯)。只要导向靶组织,则根据本发明的使用C-肽的方法或组合物可采用任何口服或非口服的给药途径。优选的是使用渗透泵的皮下注射,皮内注射,静脉注射,腹膜内注射或玻璃体内注射。在本发明中,C-肽可以以“有效量”或“药学上的有效量”给予。如本文所使用的,术语“有效量”或“药学上的有效量”指在不诱导显著或过度的免疫应答的情况下,足以提供预防或治疗效果的量。它是依赖于药学或药物领域中已知的各种因素确定的;该已知的各种因素包括疾病的种类和严重程度,药物活性,给药途径,排出速率,给药时间段,共给予的药物,和其它,患者的年龄、体重和性别,饮食习惯,健康状态等。在确定“有效量”或“药学上的有效量”时考虑到的各种因素对于本领域技术人员来说是已知的,并且例如在Gilman等人编辑的GoodmanAndGilman's:ThePharmacologicalBasesofTherapeutics(第8版,培格曼出版社(PergamonPress),1990)和Remington'sPharmaceuticalSciences(第17版,马克出版有限公司(MackPublishingCo.),Easton,Pa.,1990)中进行了解释。本发明的组合物可以单独给予,或者与其它疗法组合给予。本发明的组合物和其它疗法的共给予可以同时进行或顺序进行。可以有单一剂量或多种剂量。重要的是,以尽可能少的量,但在没有导致副作用的情况下足以获得最大治疗效果的量,使用上述组合物。此外,可以使用装置进行上述组合物的给予,该装置帮助活性成分导向靶细胞。根据本发明的另一方面,本发明解决了一种使用C-肽预防或治疗糖尿病性视网膜病变的方法和组合物。更具体的,本发明提供了一种预防或治疗糖尿病性视网膜病变的方法,该方法包括给予有需要的动物有效量的C-肽。另外,本发明还提供了一种预防或治疗糖尿病性视网膜病变的药物组合物,该药物组合物包括作为活性成分的C-肽。如上所述,发现了C-肽在糖尿病的模型小鼠中阻止血管外的渗漏,这样C-肽或包括C-肽的组合物可应用于预防或治疗糖尿病性视网膜病变。C-肽对糖尿病性视网膜病变的预防性或治疗性效果可以应用于人类,以及会受到糖尿病影响的任何动物。在糖尿病性视网膜病变的预防或治疗的背景中使用的术语“C-肽”、“剂量”、“给药”和“有效量(药学上的有效量)”如在本发明的前述方面中所述。具体的,对于糖尿病性视网膜病变的预防或治疗,可以经由玻璃体内或皮内途径以2.4μg至60μg的单次剂量,并且优选以18μg的单次剂量给予本发明的组合物,或C-肽,或者使用微型渗透泵以1.45pmol/kg/min至36.5pmol/kg/min的速率给予本发明的组合物,或C-肽。但是,这一量并不受限于这些范围,而是可以依赖于患者的年龄、体重、性别、健康状态和饮食、给药时间、给药途径、排泄率以及疾病的严重程度,在总日剂量内进行改变。通过以下实施例可以获得对本发明的更好的理解,其中给出以下实施例以例示本发明,但不应理解为限制本发明。实例1:实验的准备实例1-1:实验动物六周龄的雄性C57BL/6小鼠购自奈良生物科技(首尔,韩国)。这些小鼠饲养在温度受控的清洁的架子上,该架子具有12-h的光/暗周期。所有实验都依据国立江原大学的实验动物管理与使用委员会的指导进行。实例1-2:细胞培养根据公知的方法从人类的脐带静脉中分离HUVEC,并且在以下的实验中使用来自传代3至6次的细胞。将细胞接种在2%明胶包被的盖玻片、盘或板中的M199培养基(补充有20%FBS,3ng/mlbFGF,5U/ml肝素,100U/ml青霉素,和100μg/ml链霉素)中,并且在37℃潮湿的5%CO2的恒温箱中生长。对于实验,通过将细胞在低血清的培养基(如上补充的M199,但仅具有1%FBS)中培养6h,并且在存在或不存在各种浓度的C-肽的情况下使用10ng/mlVEGF处理适当的时间。实例1-3:统计学分析使用Origin6.1(OriginLab,北安普敦(Northampton),MA,USA)对在每一实例中获得的数据进行处理,并用图表表示出来。使用t-检验和ANOVA确定统计学的显著性。认为小于0.05的p-值是有统计学显著性的。实例2:在糖尿病模型动物中,C-肽对微血管渗漏的防护效果VEGF水平在糖尿病动物和糖尿病患者的视网膜中升高了。在患有糖尿病性视网膜病变的链脲霉素糖尿病小鼠中,研究了C-肽对视网膜血管渗漏的效果。通过链脲霉素(150mg/kg体重)的单次腹膜内注射产生糖尿病小鼠,其中链脲霉素新鲜制备在100mM柠檬酸盐的缓冲液(pH4.5)中。所有小鼠均过夜供应10%的蔗糖。如通过Accu-Check活力血糖监测仪(罗氏诊断(RocheDiagnostics),德国)测量的,在注射之后2天观察到足够的高血糖症。在链脲霉素注射之后1周,将具有高于16mM的非空腹血糖水平、多尿和糖尿的小鼠定义为糖尿病,并且用于实验中。将在PBS中的2μlC-肽(3.7μg/ml)玻璃体内注射到糖尿病小鼠的一只眼睛中,并且将等体积的PBS注射到对侧眼睛中(n=6/组)。还将2μlPBS玻璃体内注射到正常(非糖尿病)小鼠的眼睛中(正常;n=6/组)。在玻璃体内注射之后,使玻璃体房中的C-肽浓度维持在生理范围内(0.9nM至2.0nM)12h。在注射之后24h,使用荧光素血管造影术量化视网膜渗漏。在这一方面,将1.25mg500-kDa的FITC-右旋糖苷(西格玛奥德里奇(Sigma-Aldrich))注射到小鼠的左心室中,并且使染料循环5min。摘除眼睛,并且立即使用4%多聚甲醛固定45min。解剖视网膜,在马尔它十字构造中切割,并且平坦地放置在载玻片上。使用共聚焦显微镜观察视网膜。通过使用FV-300软件,确定从整个视网膜组织(n=6/组)中溢出的FITC-右旋糖苷的强度,定量分析视网膜渗漏。结果示于图1中。在照片(a)和柱形图(b)中,图1证明了C-肽对糖尿病诱导的血管渗漏的抑制活性。将2μlC-肽(糖尿病+C-pep,n=6)玻璃体内注射到糖尿病小鼠的一只眼睛中,并且将等体积的PBS注射到对侧眼睛中(糖尿病;n=6/组)。还将2μlPBS玻璃体内注射到正常(非糖尿病)小鼠的眼睛中(正常;n=6/组)。通过共聚焦显微镜可视化视网膜。图1A示出视网膜的代表性荧光图像。上图中的方形区域在各图片的下图中以放大图像给出。参考图1A,在糖尿病小鼠(n=6)的视网膜中观察到了显著高水平的FITC-右旋糖苷的溢出,而该渗漏在C-肽注射的对侧眼睛的视网膜中被阻断了(n=6;图1A)。图1B是柱状图,其中通过测量整个视网膜组织(n=6)的荧光强度,量化了视网膜通透性。结果表示为来自六次独立实验的平均值±S.D.。*p<0.05。参考图1B,如通过确定整个视网膜组织(n=6,p<0.05;图1B)中的FITC-右旋糖苷的荧光强度进行的定量分析,证明了在糖尿病小鼠的视网膜中C-肽防止血管渗漏。实例3:C-肽对细胞内ROS(活性氧类)生成和钙离子水平的作用(1)C-肽对VEGF诱导的细胞内ROS生成的作用在糖尿病中,视网膜内皮细胞中升高的VEGF表达通过细胞内ROS的生成参与了视网膜血管渗漏。在此上下文中,使用HUVEC对C-肽对VEGF诱导的ROS生成的保护效果,以及从而防止了血管渗漏进行了检验。详细来说,接种在盖玻片上的HUVEC经VEGF和C-肽进行处理,并且与在无酚红的培养基中的10μM2',7'-二氯荧光素二乙酸酯(分子探针(MolecularProbes),尤金市(Eugene),OR)一起孵育最后的10min。将盖玻片封固在灌注室中,并且使用共聚焦显微镜快速扫描经标记的细胞。通过对比经处理的细胞与对照细胞的荧光强度来确定细胞内ROS的水平,并且将确定的细胞内ROS的水平表示为倍数差异。结果示于图2中。图2示出C-肽抑制VEGF诱导的ROS生成,但对细胞内的钙离子没有作用。图2A是细胞内ROS水平的柱状图,该细胞内ROS水平是在HUVEC与1mMNAC、0.5mMTrolox(水溶性维生素E),或5μMBAPTA-AM(1,2-双(2-氨基苯氧基)-乙烷-N,N,N',N'-四乙酸四(乙酰氧基甲酯))预孵育30min,并且用10ng/mlVEGF刺激10min之后,使用共聚焦纤维镜确定的。数据表示为来自三次独立实验的平均值±S.D.。如之前报道的,VEGF生成了细胞内ROS(p<0.01),并且通过ROS清除剂Trolox和NAC(N-乙酰基-L-半胱氨酸)的处理,完全破坏了该ROS的生成(图2A)。同时,Ca2+螯合剂BAPTA-AM也阻断了VEGF诱导的细胞内ROS的生成,表明VEGF通过升高细胞内的Ca2+产生了细胞内ROS。图2B是曲线图,其中在HUVEC经各种浓度的C-肽预处理30min,然后经10ng/mlVEGF刺激之后,依据C-肽浓度绘制ROS水平。从图2B的数据中可以看出,C-肽以剂量依赖的方式抑制了细胞内ROS的VEGF诱导的生成,并且在0.5nM时观察到ROS完全的预防。(2)C-肽对VEGF诱导的细胞内Ca2+升高的作用为了监测细胞内Ca2+的水平,使接种在盖玻片上的细胞与1μMFluo-4AM孵育30min。将盖玻片封固在灌注室上,并且通过共聚焦显微镜(FV-300)每10秒扫描一次。处理来自上述扫描的系列图像,以分析单个细胞水平上的细胞内Ca2+水平的变化。数据表示为相对荧光强度(RFI)。结果示于图2C中。图2C是如在单个细胞水平(n=3)上通过共聚焦显微镜随着时间监测的,在经1μMFluo-4AM标记的HUVEC中的细胞内钙离子水平的曲线图。如从图2C的数据理解的,VEGF诱导了细胞内Ca2+的快速增加,并且升高的细胞内的Ca2+水平维持直至600sec。如预期的,BAPTA-AM阻断了响应于VEGF的细胞内Ca2+水平的变化。相对比的,C-肽不增加细胞内的Ca2+(图2C),并且对VEGF诱导的细胞内Ca2+的变化没有作用。从这些数据,应理解到,VEGF通过升高细胞内Ca2+的水平生成细胞内的ROS,而C-肽抑制了VEGF诱导的细胞内ROS的升高,且对细胞内的Ca2+水平没有作用。实例4:C-肽对VEGF诱导的应力纤维形成的作用VEGF激活应力纤维的形成,以及基于VE-钙粘着蛋白的粘着连接完整性的破坏,从而导致血管渗漏。在这一方面,检验了C-肽对VEGF诱导的应力纤维形成和VEGF诱导的粘着连接的解体的作用。视网膜内皮细胞中的VEGF水平的升高可以通过增加的ROS生成诱导应力纤维的形成。为了研究C-肽在VEGF诱导的应力纤维形成中的保护作用,通过使用罗丹明-鬼笔环肽染色可视化HUVEC中的肌动蛋白细丝。使HUVEC生长在12孔培养板中经明胶包被的圆盖玻片上,并且在37℃,与10ng/mlC-肽或0.5mMVEGF单独或组合的孵育1h,或在ROS清除剂(即1mMNAC或0.5mMTrolox)的存在下与10ng/mlVEGF孵育1h。细胞经PBS快速清洗,并且经在PBS中的3.7%甲醛固定30min。然后,细胞经在PBS中的0.2%TritonX-100通透化,并且经在PBS中的罗丹明-鬼笔环肽(MolecularProbes)染色1h。使用封固溶液(mountingsolution)将得到的染色细胞封固在载玻片上,然后通过共聚焦显微镜使肌动蛋白细丝可视化。结果示于图3中。图3示出了HUVEC的荧光照片,证明了C-肽抑制VEGF诱导的应力纤维的形成和VEGF诱导的粘着连接的解体。图3示出了C-肽对VEGF诱导的应力纤维形成的抑制活性。HUVEC与单独的10ng/mlVEGF或0.5nMC-肽,或在0.5nMC-肽、1mMNAC或0.5mMTrolox的存在下与10ng/mlVEGF孵育1h。显微细丝经罗丹明-鬼笔环肽染色,并且通过共聚焦显微镜观察(n=3)。比例尺代表30μm。参考图3,VEGF激活了应力纤维的形成,而通过C-肽的处理充分阻止了该应力纤维的形成。通过ROS清除剂NAC和Trolox的处理也抑制了VEGF激活的应力纤维的形成,表明细胞内ROS对于VEGF诱导的应力纤维的形成是必要的。当考虑到在实例2中获得的数据(即C-肽抑制VEGF刺激的ROS生成)时,这些结果证明C-肽通过防止细胞内ROS的生成,抑制了VEGF诱导的应力纤维的形成。实例5:C-肽对粘着连接解体的作用(1)HUVEC中C-肽对粘着连接解体的作用为了揭示参与C-肽对糖尿病诱导的血管渗漏的保护机制,在HUVEC中,检验了C-肽对VEGF诱导粘着连接蛋白VE-钙粘着蛋白的变化的作用。在六孔板中的融合的细胞层(HUVEC)与C-肽或ROS清除剂孵育30min,然后在37℃经VEGF处理90min。经处理的细胞经PBS清洗,并且经在PBS中的3.7%甲醛固定30min。细胞经在PBS中的0.2%TritonX-100通透化30min,并且在4℃经在PBS中的VE-钙粘着蛋白的单克隆抗体(SantaCruzBiotechnology,圣克鲁兹(SantaCruz),CA)染色过夜。之后,使用山羊抗小鼠FITC的抗体(异硫氰酸荧光素;Sigma,圣路易斯(St.Louis),MO)探测细胞,然后通过共聚焦显微镜使VE-钙粘着蛋白可视化。结果示于图4中。图4A和图4B示出C-肽对VEGF诱导的粘着连接的破坏的抑制活性。HUVEC与单独的10ng/mlVEGF或0.5nMC-肽,或在0.5nMC-肽、1mMNAC或0.5mMTrolox的存在下与10ng/mlVEGF孵育90min(n=3),然后对VE-钙粘着蛋白进行染色,并且使用共聚焦显微镜可视化(n=3)。比例尺代表20μm。参考图4A,VEGF刺激VE-钙粘着蛋白的解体,而C-肽抑制了该解体。NAC和Trolox也防止了VEGF诱导的VE-钙粘着蛋白的解体,这表明细胞内ROS介导了VEGF诱导的VE-钙粘着蛋白的解体。参考图4B,其中示出直方图,在该直方图中,由VE-钙粘着蛋白的解体产生的通透性的变化由相对荧光强度(RFI)表示。如在图4B中可以看出的,通过C-肽和ROS清除剂的处理,恢复了VEGF诱导的粘着连接荧光强度的降低。因此,通过抑制内皮细胞中的细胞内ROS的生成,C-肽对抗了在细胞连接处的VEGF诱导的VE-钙粘着蛋白的解体。(2)C-肽对视网膜中粘着连接解体的作用将2μlC-肽玻璃体内注射到糖尿病小鼠的一只眼睛中(糖尿病+C-pep),并且将等体积的PBS注射到对侧眼睛中(糖尿病;n=3)。还将2μlPBS玻璃体内注射到正常(非糖尿病)小鼠的眼睛中(正常;n=3)。如下所述,对视网膜中的VE-钙粘着蛋白进行染色,并且使用共聚焦显微镜可视化VE-钙粘着蛋白。在整装视网膜中,对微血管中的VE-钙粘着蛋白进行染色。详细来说,分离的视网膜在100%乙醇中固定30min,在100%冰冷的丙酮中去脂10min,并且经0.3%TritonX-100通透化1h。视网膜与抗VE-钙粘着蛋白的抗体(EnzoLifeSciences,法明代尔(Farmingdale),NY,USA)在4℃孵育24h,并且用山羊抗小鼠FITC的抗体(Sigma)在4℃探测24h,然后用共聚焦显微镜(FV-300,奥林帕斯(Olympus))使VE-钙粘着蛋白可视化。结果示于图4C中。如图4C中所示,与HUVEC中C-肽对VEGF诱导的VE-钙粘着蛋白解体的防护性作用一致,C-肽的玻璃体内注射在糖尿病小鼠视网膜的微血管中抑制了糖尿病诱导的粘着连接的解体。因此,通过抑制内皮细胞中的细胞内ROS的生成,C-肽对抗了在细胞连接处的VEGF诱导的VE-钙粘着蛋白的解体。实例6:在糖尿病小鼠的视网膜中C-肽对微血管渗漏的抑制活性从培养的内皮细胞的体外发现,证明了C-肽通过抑制细胞内ROS的生成以及应力纤维的形成,对抗VEGF诱导的粘着连接的解体。还报道了,VEGF水平在糖尿病动物和糖尿病患者的视网膜中是升高的。为了证实该体外发现,在链脲霉素糖尿病小鼠中,对抗VEGF的抗体和ROS清除剂对视网膜血管渗漏的作用进行了研究。将VEGF的单克隆抗体(100μg/ml)、N-乙酰基-半胱氨酸(81.5mg/ml)或Trolox(125μg/ml)玻璃体内注射到糖尿病小鼠的一只眼睛中,并且将等体积的PBS注射到对侧眼睛中(n=6/组)。在注射之后24h,使用荧光素血管造影术量化视网膜的血管渗漏。对于该实验,将1.25mg500-kDa的FITC-右旋糖苷(Sigma)注射到小鼠的左心室中,并且使染料循环5min。摘除眼睛,并且立即使用4%多聚甲醛固定45min。解剖视网膜,在马尔它十字构造中切割,并且平坦地放置在载玻片上,然后使用共聚焦显微镜进行观察。通过使用共聚焦显微镜(FV-300,Olympus,东京,日本)确定来自整个视网膜组织(n=6/组)的溢出的FITC-右旋糖苷的强度,并且将该强度数据应用至FV-300软件,定量分析视网膜的血管渗漏。结果示于图5中。如图5A中所示,抗VEGF的单克隆抗体的玻璃体内注射显著抑制了糖尿病小鼠视网膜中的微血管渗漏,证明了VEGF参与糖尿病小鼠中的视网膜的血管渗漏。ROS清除剂NAC和Trolox的玻璃体内注射也防止了糖尿病小鼠中的视网膜的血管渗漏。如预期的,C-肽的注射也阻断了糖尿病小鼠视网膜中的FITC-右旋糖苷的溢出。通过确定整个视网膜组织中的FITC-右旋糖苷的荧光强度(n=6,p<0.01;图5B),定量分析糖尿病小鼠中C-肽对视网膜的血管渗漏的预防,并且将结果以柱形图的方式示于图5B中。如根据图5B的数据所理解的,C-肽通过抑制视网膜内皮细胞中的细胞内ROS的生成,对抗VEGF诱导的视网膜的血管渗漏。实例7:C-肽根据注射途径的作用(1)使用渗透泵的皮下注射在植入递送C-肽的微型渗透泵之后,测量血液C-肽的水平。一组糖尿病小鼠(n=7)经皮下植入递送速率为35pmol/min/kg的Alzet微型渗透泵2004(DURECT,库比蒂诺(Cupertino),CA),该Alzet微型渗透泵2004含有在PBS中的C-肽。对其它糖尿病组(n=7)和对照组(n=7)进行假手术。在持续进行皮下C-肽灌注的过程中,使用C-肽酶免疫测定试剂盒(RayBiotech,诺克斯(Norcross),GA)测量血清C-肽的水平。结果示于图6A中。图6A示出了在通过渗透泵注入小鼠中之后,血清C-肽的水平。如根据图6A的数据所理解的,血清C-肽水平升高至正常值。因此,微型渗透泵使得可能以1.45pmol/kg/min至36.5pmol/kg/min的递送速率进行皮下注射。(2)皮内注射C-肽对微血管渗漏的防护性作用得到了在链脲霉素糖尿病小鼠的皮肤中的体内迈尔斯(Miles)血管通透性测定的支持。如下在糖尿病小鼠中进行Miles血管通透性测定。在剃毛之后2至3天,麻醉小鼠,并且静脉内注射150μl1%的伊文思蓝(Evansblue)溶液。15min之后,将含有0、7.5ng或15ngC-肽的15μlVEGF(10ng)溶液皮内注射到小鼠被剃毛的皮肤中(n=12/组)。对照组注射PBS(n=12)。解剖皮肤中包括由于染料渗漏产生的蓝色斑点的区域,并且通过在56℃与甲酰胺孵育2天从解剖的皮肤中洗脱出伊文思蓝染料。通过620nm处的分光光度法量化染料的量。结果示于图6B和图6C中。图6B示出经VEGF单独处理或经VEGF与各种量的C-肽组合处理的小鼠组,或未经处理的小鼠组的代表图像。图6C是与对照(n=12)相比,量化的从解剖的皮肤中洗脱出来的伊文思蓝染料含量的柱状图。*p<0.01。从图6B的数据能够明显看出,VEGF的皮内注射在糖尿病小鼠中显著诱导了血管通透性,而C-肽以剂量依赖的方式阻止了该血管通透性。但是,C-肽单独不会引起血管通透性的显著变化。通过染料提取和分光光度吸收测量,量化皮肤中心活检中的VEGF诱导的伊文思蓝染料从血浆进入胞间隙的血管渗漏(n=12,p<0.01;图6C)。这些结果证明,C-肽防止链脲霉素糖尿病小鼠的外周血管中的微血管渗漏。总之,上面获得的数据表明,C-肽通过抑制VEGF诱导的细胞内ROS的生成,防止糖尿病小鼠的视网膜中的微血管渗漏,其中抑制VEGF诱导的细胞内ROS的生成刺激应力纤维的形成和粘着连接的解体,从而导致微血管的通透性。(3)玻璃体内注射在玻璃体内注射之后,随着时间监测玻璃体液中的C-肽的水平。在这一方面,以7.5ng的剂量玻璃体内注射C-肽,之后使用人类C-肽ELISA试剂盒(MilliporeCo.比尔里卡(Billerica),MA)量化玻璃体房中的C-肽(n=4)。结果示于图6D中。之前已经发现了,C-肽的玻璃体内注射在注射后24h防止视网膜的渗漏。如在图6D中所示,直至玻璃体内注射之后12h,玻璃体房都维持正常水平的C-肽。也就是说,根据图6D的数据理解的是,在玻璃体内注射期间维持了正常的玻璃体内的C-肽水平,从而阻止VEGF诱导的视网膜渗漏。综合以上数据,得出结论:C-肽通过抑制VEGF诱导的细胞内ROS的生成,防止糖尿病小鼠的视网膜中的微血管渗漏,其中VEGF诱导的细胞内ROS的生成刺激应力纤维的形成和粘着连接的解体,从而导致微血管的通透性。工业实用性本发明发现了,通过抑制VE-钙粘着蛋白的VEGF诱导的解体防止血管渗漏,以及根据本发明的包括C-肽的药物组合物对伴随有血管渗漏的广谱的糖尿病并发症具有预防性或治疗性应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1