寡聚物和寡聚物缀合物的制作方法
本发明涉及寡聚物治疗药领域,并且尤其涉及的寡聚物和寡聚物缀合物靶向乙型肝炎病毒(HBV)。特别地,本发明涉及寡聚物缀合物治疗药领域,其中反义寡核苷酸与载体组分连接。在某些方面,本发明涉及寡聚物缀合物治疗药领域,其中反义寡核苷酸借助生理不稳定接头与载体组分共价连接。
更具体地,本发明涉及靶向细胞中HBV mRNA,导致治疗病毒性疾病的寡聚物、尤其寡聚物缀合物治疗药。
背景
正在开发多项分子策略以调节直接造成、参与或加重疾病状态的不想要的基因表达。这样一种策略涉及用序列上与有害靶基因的信使RNA互补的寡核苷酸抑制基因表达。信使RNA链是编码性DNA链的副本并且因此如同DNA链那样被称作有义链。与有义链杂交的寡核苷酸称作反义寡核苷酸。这些链与mRNA的结合干扰翻译过程并因而干扰基因表达。
某些基于核苷酸的化合物已经用于多种治疗性应用中。特别地,已经研究多种寡核苷酸包括单链和双链寡核苷酸,及类似物。为了可用于体内应用,寡核苷酸必须具有大量特性,包括穿透细胞膜的能力、具有良好的胞外和胞内核酸酶抗性、对靶具有高亲和力和特异性并且优选地具有召集内源酶如RNAseH、RNAaseIII、RNAseL等的能力。
寡核苷酸的奠定其诸多潜在治疗性应用的基础特性是它们利用Watson-Crick成氢键机制(A-T和G-C)或其他成氢键机制如Hoogsteen/反向Hoogsteen模式识别并特异性杂交至互补性单链核酸的能力。亲和力和特异性是常用来表征特定寡核苷酸的杂交特征的特性。亲和力是寡核苷酸与其互补靶的结合强度的量度(表达为双链体的热稳定性(Tm))。双链体中的每个核碱基对增加热稳定性并且因此亲和力随寡核苷酸的大小(核碱基数目)渐增而增长。特异性是寡核苷酸区分完全互补和错配靶序列的能力的量度。
修饰的核酸已知用来改善例如寡核苷酸的稳定,尤其对于缺口聚物(gapmer)设计如此,如当1个或更多个修饰的核苷酸在任一个或两个翼区中存在时。修饰的例子包括2’-O-烷基-RNA单元、2’-氨基-DNA单元、2’-氟-DNA单元、LNA单元、阿糖核酸(ANA)单元、2’-氟-ANA单元、HNA单元、INA(嵌入性核酸-Christensen,2002.Nucl.Acids.Res.2002 30:4918-4925,所述文献因而通过引用的方式并入)单元、2’MOE单元、ENA(亚乙基核酸)、UNA(非锁核酸,Fluiter等人,Mol.Biosyst.,2009,10,1039)、三环DNA(R.Steffens和C.J.Leumann,J.Am.Chem.Soc,1997,119,11548-49)、cET-LNA(本文中所显示)和LNA。图4展示这些类似物中某些类似物的图。
一种特别有效的修饰的核酸称作锁核酸(LNA)。LNA已经在本领域报道–例如参见国际专利申请WO 99/14226;P.Nielsen等人,J.Chem.Soc.,Perkin Trans.1,1997,3423;P.Nielsen等人,Chem.Commun.,1997,9,825;N.K.Christensen等人,J.Am.Chem.Soc.,1998,120,5458;A.A.Koshkin等人,J.Org.Chem.,1998,63,2778;A.A Koshkin等人J.Am.Chem.Soc.1998,120,13252-53;Kumar等人Bioorg,&Med.Chem.Lett.,1998,8,2219-2222;和S.Obika等人,Bioorg.Med.Chem.Lett.,1999,515。有趣地,向寡核苷酸序列掺入含有2’-O,4’-C-亚甲基桥的LNA单元导致修饰的寡核苷酸的杂交稳定性空前改善(见上文和例如,S.K.Singh等人,Chem.Commun,1998,455)。包含2’-O,4’-C-亚甲基桥的寡核苷酸(LNA)单元以及相应的2’-硫代-LNA(硫代-LNA)、2’-HN-LNA(氨基-LNA)和2’-N(R)-LNA(氨基-R-LNA)类似物,与互补性DNA和RNA形成双链体,其具有先前对双环状和三环状核苷修饰的寡核苷酸未观察到的热稳定性。每处修饰的Tm增长从+3至+11℃,并且另外,选择性也改善。尚无其他DNA类似物可重复地对核酸显示这种高亲和力。
在一个特定方面,本发明涉及乙型肝炎病毒(HBV)治疗药。乙型肝炎是乙型肝炎病毒(HBV)引起的病毒病。它通过沾染的材料如血液和血液制品、沾染的针头以肠胃外方式传播、以性方式传播以及从感染母体或携带者母体垂直传播至其后代。在其中本疾病常见的世界那些地区,幼龄时垂直传播导致高比例的感染个体变成乙型肝炎的慢性携带者。据世界卫生组织估计,全球超过20亿人已经感染,每年约4百万急性病例,每年一百万例死亡,以及3.5-4亿慢性携带者。大约25%携带者死于慢性肝炎、肝硬化或肝癌并且几乎75%的慢性携带者是亚洲人。乙型肝炎病毒是位居烟草之后的第二种最重大的致癌原,造成全部原发性肝癌的60%至80%。HBV的传染性比HIV高100倍。
乙型肝炎病毒(HBV)是一种有包膜、部分双链的DNA病毒。紧凑的3.2kb HBV基因组由4个重叠开放阅读框(ORF)组成,编码核心、聚合酶(Pol)、包膜和X-蛋白。Pol ORF最长并且包膜蛋白ORF位于其内部,而X和核心ORF与Pol ORF重叠。HBV的生活周期具有两个主要事件:1)从松弛环状(RC)DNA产生闭合环状DNA(cccDNA),和2)逆转录前基因组RNA(pgRNA)以产生RC DNA。在感染宿主细胞之前,HBV基因组在病毒粒内部作为RC DNA存在。已确定HBV病毒粒能够通过非特异性结合至人肝细胞表面上存在的带负电荷的蛋白聚糖以及借助HBV表面抗原(HBVsAg)的特异性结合而进入宿主细胞。一旦病毒粒已经进入细胞,则病毒核芯和衣壳化的RC DNA由宿主因子,借助核定位信号,通过Impβ/Impα核运输受体运输入胞核。在胞核内部,宿主DNA修复酶将RC DNA转化成cccDNA。cccDNA充当全部病毒mRNA的模板,并且如此导致感染个体中的HBV持续存在。从cccDNA产生的转录物划分成两类:pgRNA和亚基因组RNA。亚基因组转录物编码三种包膜(L、M和S)和X蛋白,并且pgRNA编码前核心、核心和pol蛋白。抑制HBV基因表达或HBV RNA合成导致抑制HBV病毒复制和抗原产生。例如,显示IFN-α通过减少前基因组RNA(pgRNA)和亚基因组RNA从HBV共价闭合的环状DNA(cccDNA)微型染色体转录抑制HBV复制和病毒HBsAg产生。全部HBV病毒mRNA均加帽及聚腺苷酸化,并且随后输出到细胞质供翻译。在细胞质中,新病毒粒的装配启动并且新生性pgRNA随病毒Pol一起包装,从而pgRNA借助单链DNA中间体逆转录成RC DNA可以开始。含有RC DNA的成熟核衣壳用细胞脂质和病毒L、M和S蛋白包裹,并且随后传染性HBV粒子通过出芽在胞内膜释放。有趣地,也产生数量大大超过传染性病毒粒的无感染性粒子。这些空的带包膜粒子(L、M和S)称作亚病毒粒子。重要地,由于亚病毒粒子共有与感染性粒子相同的包膜蛋白,所以已经推测它们充当宿主免疫系统的诱饵并且已经用于HBV疫苗。S、M和L包膜蛋白从含有三个不同起始密码子的单个ORF表达。全部三个蛋白质在其C-'末端共有226aa序列,S结构域。M和L具有额外的前S结构域,分别是Pre-S2和Pre-S2和Pre-S1。但是,正是S结构域才具有HBsAg表位。
乙型肝炎病毒性感染是一个持久的医学问题,因为如同任何快速复制的传染因子那样,存在有助于某些HBV子群体变得抵抗当前治疗方案的持续突变。目前,美国肝病研究学会(AASLD)和欧洲肝脏研究学会(EASL)推荐的慢性HBV感染治疗药包括干扰素α(INFa)、PEG化干扰素α-2(Peg-IFN2a)、恩替卡韦和替诺福韦。但是,常见的干扰素疗法为48周并且导致严重和不快的副作用,并且疗法停止后24周,HBeAg血清转换率仅为27-36%。HBeAg血清转换率甚至更低-疗法停止后马上观察仅为3%,5年后上增直至12%。
肝细胞和/或肝内免疫细胞响应于HBV感染分泌抗病毒细胞因子在已感染肝脏的病毒清除过程中发挥核心作用。但是,慢性感染患者仅显示弱免疫应答,原因在于病毒采用多种逃逸策略对抗宿主细胞识别系统和后续抗病毒应答。
许多观察结果显示,几种HBV病毒蛋白可能通过干扰病毒识别信号传导系统及随后干扰干扰素(IFN)抗病毒活性,对抗初始宿主细胞应答。在这些策略当中,HBV亚病毒空粒子(SVP,HBsAg)的过多分泌可能参与维持慢性感染患者(CHB)中观察到的免疫耐受状态。特别地,SVP可能促成树状细胞呈递抗原的缺失连同HBV特异性T细胞免疫活化的缺失,从而令病毒持续存在成为可能。HBsAg定量是预测感染结局的重要生物标记物;然而,慢性感染患者中很少观察到HBsAg血清转换的实现。将减少SVP和HBsAg负荷视为恢复抗病毒免疫功能的途径并且抗病毒疗法后血清转换成HBsAg阴性可以视为功能性治愈的指标和仍旧是最终治疗目的。因此,CHB患者中靶向HBV基因表达导致减少HBsAg连同HBV DNA水平,可以显著地改善CHB患者的免疫再活化及缓解。
核苷和核苷酸治疗药恩替卡韦和替诺福韦成功减少病毒载量,但是HBeAg血清转换率和HBsAg消失率甚至低于使用IFNa治疗获得的那些比率。还使用其他相似的治疗药,包括拉米夫定(3TC)、替比夫定(LdT)和阿德福韦,但是通常对于核苷/核苷酸治疗药,耐药性的出现限制了治疗功效。
US 8,598,334和WO 2012/145697提到了反义寡核苷酸靶向HBV的用途。
控制病毒性感染需要密切监测宿主天然免疫系统,其可能在感染后数分钟至数小时内作出响应以影响病毒初始生长并限制慢性和持续性感染形成。尽管可获得基于IFN和核苷(酸)类似物的现有治疗,但是乙型肝炎病毒(HBV))感染仍是全球重大健康问题,其涉及估计3.5亿具有更高肝硬化和肝细胞癌风险的慢性携带者。
需要新的抗病毒治疗药,尤其抗HBV治疗药。还需要使得靶向不同类型的HBV基因型成为可能的治疗策略。
发明简述
本发明涉及适用于医疗中如治疗病毒性疾病的寡聚物缀合物、其用途、其使用方法。
特别地,本发明提供适用于治疗病毒性疾病的寡聚物或寡聚物缀合物–其中所述寡聚物或所述寡聚物缀合物的寡聚物能够调节乙型肝炎病毒的靶序列(HBV),优选地HBV的HBx或HBsAg。在某些实施方案中,载体组分与寡聚物缀合。
本发明提供如本文定义的寡聚物或寡聚物缀合物,其中寡聚物或寡聚物缀合物的寡聚物组分包含至少6、优选地至少7、优选地至少8、优选地至少9、优选地至少10个单元、优选地至少11个单元、优选地至少12个单元、优选地至少13个单元、优选地至少14个单元、优选地至少15个单元、优选地至少16个单元,所述单元与下述区域至少80%相同、优选地至少85%相同、优选地至少90%相同、优选地至少91%相同、优选地至少92%相同、优选地至少93%相同、优选地至少94%相同、优选地至少95%相同、优选地至少96%相同、优选地至少97%相同、优选地至少98%相同、优选地至少99%相同、优选地相同,所述区域与HBV HBx基因或HBsAg基因或与编码HBV HBx或HBV HBsAg的核酸的靶区域的反向互补序列对应。
本发明提供如本文定义的寡聚物或寡聚物缀合物,其中寡聚物或寡聚物缀合物的寡聚物组分包含至少6、优选地至少7、优选地至少8、优选地至少9、优选地至少10个单元,所述单元与下述区域相同,所述区域与HBV HBx基因或HBsAg基因或与编码HBV HBx或HBV HBsAg的核酸的靶区域的反向互补序列对应。
对于某些实施方案,本发明提供如本文定义的寡聚物或寡聚物缀合物,其中寡聚物或寡聚物缀合物的寡聚物组分包含少于20个单元,如少于19个单元,如少于18个单元,如少于17个单元,如16个或更少单元。
对于某些实施方案,本发明提供如本文定义的寡聚物或寡聚物缀合物,其中寡聚物或寡聚物缀合物的寡聚物组分包含15个单元或16个单元。
本发明提供一种缀合物,其包含本发明寡聚物,和至少一种与所述寡聚物共价连接的非核苷酸或非多核苷酸部分。
本发明提供一种药物组合物,其包含本发明的寡聚物或缀合物根据和可药用的稀释剂(如水或盐水)、载体、盐或佐剂。
本发明提供用作药物的本发明寡聚物或缀合物,如用于治疗病毒性疾病。
本发明提供本发明寡聚物或缀合物用于制造用于治疗病毒性疾病的药物的用途。
本发明提供一种治疗病毒性疾病的方法,所述方法包括向患有或可能患有病毒性疾病的动物(如患有或易患疾病或病症的动物)施用有效量的本发明寡聚物、寡聚物缀合物或药物组合物。
本发明提供一种治疗病毒性疾病的方法,所述方法包括向患有或可能患有病毒性疾病的非人动物(如患有或易患疾病或病症的非人动物)施用有效量的本发明寡聚物、寡聚物缀合物或药物组合物。
本发明提供一种治疗病毒性疾病的方法,所述方法包括向患有或可能患有病毒性疾病的人类患者(如患有或易患疾病或病症的人类患者)施用有效量的本发明寡聚物、寡聚物缀合物或药物组合物。
还公开了通过向非人动物或人类施用治疗有效量或预防有效量的本发明寡聚物、缀合物或药物组合物中的一种或多种,治疗疑似患有或易患与表达或过量表达HBx或HBsAg相关的疾病或病状的动物(非人动物或人类)的方法。进一步,提供了使用寡聚物抑制HBx或HBsAg表达的方法和用于治疗与HBx或HBsAg活性相关的疾病的方法。
本发明还提供一种包含本发明药物组合物和额外药物实体/治疗性实体的药物系统。额外的药物实体可以是本发明的寡聚物或寡聚物缀合物。额外的药物实体可以是能够调节HBV中不在HBx或HBsAg内部的靶序列的寡聚物或寡聚物缀合物。例如,至少一种寡聚物或寡聚物缀合物可以能够调节在HBV HBsAg、HBeAg或DNA聚合酶的基因或mRNA内部的靶序列。
在一个实施方案中,施用本发明的多种寡聚物或缀合物至需要治疗的受试者。寡聚物或缀合物可以随额外的药物/治疗药一起施用。
在一个实施方案中,疾病或病症或病状与HBx或HBsAg过量表达相关。
本发明提供用于调节细胞或组织中HBx或HBsAg表达的方法,所述方法包括步骤:使细胞或组织在体外或体内与有效量的一种或多种寡聚物、缀合物或其药物组合物接触,以实现对HBx或HBsAg表达的调节。
本发明提供用于抑制(例如通过下调)细胞或组织中HBx表达的方法,所述方法包括步骤:使细胞或组织在体外或体内与有效量的一种或多种寡聚物、缀合物或其药物组合物接触,以实现对HBx或HBsAg表达的下调。
本发明提供一种在正在表达HBx或HBsAg的细胞中抑制HBx或HBsAg的方法,所述方法包括向所述细胞施用本发明的寡聚物或缀合物,从而影响所述细胞中对HBx或HBsAg的抑制。
进一步提供下调细胞或组织中HBx或HBsAg表达的方法,所述方法包括:使所述细胞或组织在体外或体内与有效量的本发明寡聚物、寡聚物缀合物或组合物中的一种或多种接触。
现在提供本发明的多个方面。
在一个方面,本发明提供用于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分。优选地,用于递送所述第一寡聚物至肝脏。
在一个方面,本发明提供适于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分。优选地,用于递送所述第一寡聚物至肝脏。
在一个方面,本发明提供一种适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物缀合物和至少一种额外的不同寡核苷酸;其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分。优选地,用于递送所述第一寡聚物至肝脏。
在一个方面,本发明提供与靶序列杂交的寡聚物或寡聚物缀合物的寡聚物组分,所述靶序列选自任何一个或多个以下位置:SEQ ID NO:3的1530至1598;1264-1278和670至706。
在一个方面,本发明提供寡聚物,所述寡聚物基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO 18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO 4);
CGAACCACTGAACAAA(SEQ ID NO 5);
CGAACCACTGAACAA(SEQ ID NO 6);
CGAACCACTGAAC(SEQ ID NO 8)
CCGCAGTATGGATCG(SEQ ID NO 9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO 12);
AGAAGGCACAGACGG(SEQ ID NO 14);
GAGAAGGCACAGACGG(SEQ ID NO 15)
GAAGTGCACACGG(SEQ ID NO 16);
GCGAAGTGCACACGG(SEQ ID NO 17);
CGAAGTGCACACG(SEQ ID NO 19);
AGGTGAAGCGAAGT(SEQ ID NO 27);和
TAGTAAACTGAGCCA(SEQ ID NO:834),
所述寡聚物能够调节HBV的HBx或HBsAg中的靶序列以治疗病毒性疾病。
在一个方面,本发明提供一种适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物和至少一种额外的不同寡核苷酸;其中所述寡聚物包含能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域。
在一个方面,本发明提供一种用于治疗病毒性疾病的方法,所述方法包括向需要治疗的受试者施用有效量的本发明寡聚物缀合物。
在一个方面,本发明提供一种用于治疗病毒性疾病的方法,所述方法包括向需要治疗的受试者施用有效量的本发明组合物。
在一个方面,本发明提供一种用于治疗病毒性疾病的方法,所述方法包括向需要治疗的受试者施用有效量的本发明寡聚物。
在一个方面,本发明提供一种药物组合物,所述药物组合物包含本发明的寡聚物缀合物;和一种或多种可药用的稀释剂、载体、盐或佐剂。
在一个方面,本发明提供一种药物组合物,所述药物组合物包含本发明的物组合物;和一种或多种可药用的稀释剂、载体、盐或佐剂。
在一个方面,本发明提供一种药物组合物,所述药物组合物包含本发明的寡聚物;和一种或多种可药用的稀释剂、载体、盐或佐剂。
在一个方面,本发明提供一种包含本发明药物组合物和额外药物实体的药物系统。
在一个方面,本发明提供一种选自以下任一者或多者的基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
用于构建本发明的寡聚物缀合物。
在一个方面,本发明提供一种选自以下任一者或多者的基序:SEQ ID NO:13)GCGTAAAGAGAGGT(SEQ ID NO:11)和CGCGTAAAGAGAGGT(SEQ ID NO:12)用于构建本发明的组合物。
在一个方面,本发明提供一种选自以下任一者或多者的基序:AGCGAAGTGCACACG(SEQ ID NO:20);AGGTGAAGCGAAGTG(SEQ ID NO:26);AGCGAAGTGCACACGG(SEQ ID NO:18);GAAGTGCACACGG(SEQ ID NO:16);GCGAAGTGCACACGG(SEQ ID NO:17);CGAAGTGCACACG(SEQ ID NO:19)和AGGTGAAGCGAAGT(SEQ ID NO:27)于构建本发明的寡聚物。
在一个方面,本发明提供一种制造本发明寡聚物缀合物的方法,所述方法包括将一种或多种本发明寡聚物与本发明的载体组分缀合。
在一个方面,本发明提供一种制造本发明组合物的方法,所述方法包括将本发明的寡聚物缀合物与可药用的稀释剂、载体、盐或佐剂混合。
附图简述
图1:展示用于LNA寡聚物GalNAc缀合步骤的方案。
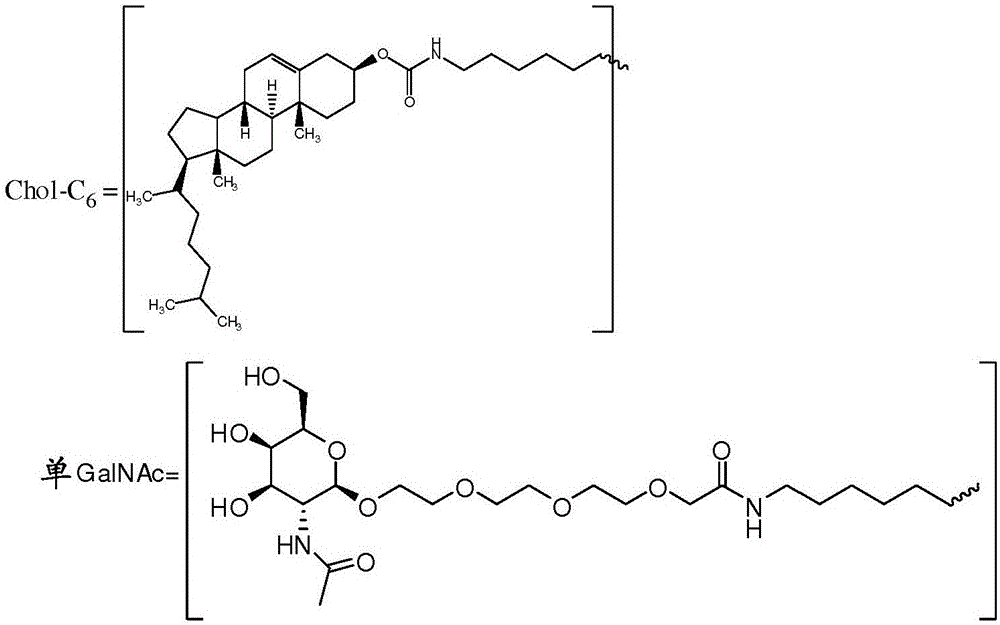
图2:展示包含用来连接载体组分至寡聚物(区域A或至生理不稳定接头区域PL,如PO接头)的C6接头部分(区域E)的胆固醇或单-GalNAc载体组分的实例。波浪线表示与寡聚物或区域PL的共价连接。
图3:展示了三-GalNAc载体组分的例子。缀合物1–4显示了4种合适的GalNAc载体组分,并且缀合物1a–4a指具有额外C6接头部分(区域E)的相同载体组分,所述C6接头部分用来连接载体组分至寡聚物(区域A或至生理不稳定接头,区域PL,如PO接头)。波浪线表示与寡聚物或区域PL的共价连接。
图4:展示了具有三价GalNAc载体组分的寡聚物缀合物的例子。
图5:展示了一系列核苷类似物的结构。
图6:展示了SEQ ID NO:808的结构
图7:展示了SEQ ID NO:814的结构
图8:展示了SEQ ID NO:815的结构
图9:展示了SEQ ID NO:825的结构
图10:展示了SEQ ID NO:826的结构
图11:HBsAg在剂量0.28mpk(■)、1.4mg/kg(▲)和7.1mpk()SEQ ID NO:807;在剂量7.1mg/kg(■)、1.42mg/kg(▲)和0.29mg/kg()SEQ ID NO:808;在剂量0,252mg/kg(▲)和1.26mg/kg()、6.15mg/kg(◆)SEQ ID NO:814;在剂量0.3mg/kg(■)、1.5mg/kg(▲)和7.5mg/kg()SEQ ID NO:815;在剂量0.3mg/kg(▲)、1.5mg/kg()、和7.5mg/kg(◆)SEQ ID NO:825;在剂量7.1mg/kg(■)、1.42mg/kg(▲)和0.29mg/kg()SEQ ID NO:826的减少。
图12:HBeAG在剂量0.28mpk(■)、1.4mg/kg(▲)和7.1mg/kg()SEQ ID NO:807;在剂量7.1mg/kg(■)、1.42mg/kg(▲)和0.29mg/kg()SEQ ID NO:808;在剂量0,252mg/kg(▲)和1.26mg/kg()、6.15mg/kg(◆)SEQ ID NO:814;在剂量0.3mg/kg(■)、1.5mg/kg(▲)和7.5mg/kg()SEQ ID NO:815;在剂量0.3mg/kg(▲)、1.5mg/kg()、和7.5mg/kg(◆)SEQ ID NO:825;在剂量7.1mg/kg(■)、1.42mg/kg(▲)和0.29mg/kg()SEQ ID NO:826的减少。
图13:HBV DNA在剂量0.28mpk(■)、1.4mg/kg(▲)和7.1mg/kg()SEQ ID NO:807;在剂量7.1mg/kg(■)、1.42mg/kg(▲)和0.29mg/kg()SEQ ID NO:808;在剂量0,252mg/kg(▲)和1.26mg/kg()、6.15mg/kg(◆)SEQ ID NO:814;在剂量0.3mg/kg(■)、1.5mg/kg(▲)和7.5mg/kg()SEQ ID NO:815;在剂量0.3mg/kg(▲)、1.5mg/kg()、和7.5mg/kg(◆)SEQ ID NO:825;在剂量7.1mg/kg(■)、1.42mg/kg(▲)和0.29mg/kg()SEQ ID NO:826的减少。
图14:展示了来自SEQ ID NO:807在剂量0.2mg/kg、1.0mg/kg和5.0mg/kg时皮下(SC)和静脉内(IV)施用途径的结果。A)展示了HBsAG减少。B)展示了HBeAG减少。C)展示了DNA减少
图15:展示了等摩尔寡聚物剂量时测试的未缀合的寡聚物(■)(SEQ ID NO:308和303)和缀合的寡聚物()(SEQ ID NO:807和815)的结果。A)展示了HBsAG减少。B)展示了HBeAG减少。C)展示了DNA减少。
本发明的定义/要素
下文提供适用于本发明全部方面的术语的定义。这些定义不是互斥的。这些定义还教授了关于本发明全部方面的额外实施方案。
寡聚物/寡核苷酸
在本发明的上下文中,如本文所用的称谓“寡聚物”和“寡核苷酸”还适用于第一寡聚物区域和/或第二寡聚物区域–如当第一寡聚物区域位于寡聚物缀合物中时或当它不处于游离形式时(即当不位于寡聚物缀合物中时)。
术语“寡聚物”指由两个或更多个核苷酸共价连接形成的分子(即寡核苷酸)。因此如本文所用,术语“寡聚物”和“寡核苷酸”是可互换的并已经相同含义。本文中,单核苷酸(单元)也可以称作单体或单元。在一些实施方案中,术语“核苷”、“核苷酸”、“单元”和“单体”互换使用。将认识到,当提及核苷酸或单位的序列时,所指的是碱基(如A、T、G、C或U)的序列。
如本文所用,术语“寡聚物”和“寡核苷酸”包括天然和/或修饰的单位或键的线型或环状寡聚物,包括脱氧核糖核苷、核糖核苷、其取代形式和α-异头物形式、肽核酸(PNA)等,所述寡聚物能够借助单元-对-单元相互作用的规律样式(如Watson-Crick型碱基对、Hoogsteen或反向Hoogsteen型碱基对等)与靶多核苷酸特异性结合。
寡核苷酸可以由单个区域组成或可以由几个区域组成。寡核苷酸可以是“嵌合的”,即,由不同区域组成。在本发明的上下文中,“嵌合”反义化合物是含有两个或更多个化学区域(例如,DNA区域、RNA区域、PNA区域等)的反义化合物,尤其寡核苷酸。每种化学区域由至少一个单元(即,在寡核苷酸化合物情况下核苷酸构成)。这些寡核苷酸一般含有其中修饰寡核苷酸以显示出一个或多个诉求特性的至少一个区域。寡核苷酸的诉求特性可能是增加的核酸酶降解抗性、增加的细胞摄取和/或增加的靶核酸结合亲和力。寡核苷酸的不同区域因此可以具有不同的特性。寡核苷酸的一个或多个区域可以充当能够切割RNA:DNA或RNA:RNA杂交分子的酶的底物。存在具有这类催化作用的几种酶。一种用反义寡核苷酸和RNA酶H在特定位置消化RNA方法已经由Minshull等人展示(Nucleic Acids Research,14:6433-6451(1986))。RNA酶H是切割RNA:DNA双链体的RNA链的细胞核酸内切酶。因此,RNA酶H的激活导致RNA靶的切割。因而寡核苷酸抑制基因表达的效率增强。其他能够切割的酶是RNA酶L和RNA酶P。
核碱基
术语“核碱基”指核苷酸的碱基部分并且涵盖天然存在的变体以及非天然存在的变体。
因此,“核碱基”不仅涵盖已知的嘌呤杂环和嘧啶杂环,还涵盖杂环类似物及其互变异构体。
核碱基的例子包括但不限于腺嘌呤、鸟嘌呤、胞嘧啶、胸苷、尿嘧啶、黄嘌呤、次黄嘌呤、5-甲基胞嘧啶、异胞嘧啶、假异胞嘧啶、5-溴尿嘧啶、5-炔丙基尿嘧啶、6-氨基嘌呤、2-氨基嘌呤、肌苷、二氨基嘌呤和2-氯-6-氨基嘌呤。
在一些实施方案中,至少一个在寡聚物中存在的核碱基选自5-甲基胞嘧啶、异胞嘧啶、假异胞嘧啶、5-溴尿嘧啶、5-炔丙基尿嘧啶、6-氨基嘌呤、2-氨基嘌呤、肌苷、二氨基嘌呤和2-氯-6-氨基嘌呤的修饰核碱基。
单元
如本文所用,术语“单元”或“单体”一般表示核苷单元,所述核苷单元由磷酸二酯键或其类似物连接以形成大小范围从数个单体单元(例如,从约3-4个)至约几百个单体单元的寡核苷酸。磷酸二酯键的类似物包括:硫代磷酸酯、二硫代磷酸酯、甲基磷酸酯、硒代磷酸酯、磷酰胺酯等。
核苷和核苷类似物
在一些实施方案中,术语“核苷类似物”和“核苷酸类似物”互换使用。
如本文所用,术语“核苷酸”指包含糖部分、碱基部分和共价连接的基团(连接基团)如磷酸酯或硫代磷酸酯核苷酸间连接基团的糖苷,并且涵盖天然存在的核苷酸如DNA或RNA,和包含修饰糖和/或碱基部分的非天然存在核苷酸,这在本文中也称作“核苷酸类似物”。本文中,单核苷酸(单元)也可以称作单体或核酸单元。
在生物化学领域,术语“核苷”常用来指包含糖部分和碱基部分的糖苷,并且因此可以在提到核苷酸单元时使用,所述核苷酸单元由寡聚物的核苷酸之间的核苷酸间键共价连接。
在生物技术领域,术语“核苷酸”经常用来指核酸单体或单位,以及如在寡核苷酸背景下可以指碱基–如“核苷酸序列”–并且一般可以指核碱基序列(即暗示存在糖主链和核苷间键)。
同样地,特别地在其中修饰一个或多个核苷间连接基团的寡核苷酸情况下,术语“核苷酸”可以指“核苷”,例如甚至当说明核苷之间键的存在或性质时,可以使用术语“核苷酸”。
如本领域普通技术人员将认识,寡核苷酸的5’末端核苷酸不包含5’核苷酸间连接基团,尽管可以或可以不包含5’末端基团。
非天然存在的核苷酸包含具有修饰的糖部分的核苷酸,如双环核苷酸或2’修饰的核苷酸,如2’取代的核苷酸。
“核苷酸类似物”是天然核苷酸如DNA核苷酸或RNA核苷酸的变体,原因在于糖部分和/或碱基部分中的修饰。在寡核苷酸的背景下,类似物可以原则上仅是“沉默的”或“等同”于天然核苷酸,即对寡核苷酸发挥抑制靶基因表达作用的方式不产生功能性影响。然而,这类“等同的”类似物可能是有用的,例如,如果它们更易制造或制造更便宜,或对储存或制造条件更稳定,或代表一种标签或标记物。然而,优选地,类似物将对寡核苷酸发挥抑制表达作用的方式产生功能性影响;例如通过产生对靶增加的结合亲和力和/或对胞内核酸酶增加的抵抗性和/或导致更易转运入细胞。核苷类似物的具体例子例如由Freier和Altmann;Nucl.Acid Res.,1997,25,4429-4443及Uhlmann;Curr.Opinion in Drug Development,2000,3(2),293-213描述,以及在图4中提供的方案1内描述。
接头/接头基团等
术语“接头基团”、“连接基团”、“接头”、“接头分子”或“核苷间键”意指能够将两个实体(如核苷酸)共价连接在一起的基团。具体的例子包括磷酸酯基团和硫代磷酸酯基团。这类接头可以含有与一个或多个活化的基团或官能团共价连接的间隔分子。任选地,接头分子的官能团可以用偶联剂处理以形成活化的基团。此类接头还包括如本文所述的系索分子。
术语“分支区域”意指能够将两个或更多个实体如多个核苷酸共价偶联在一起或用于产生载体组分簇如半乳糖簇的基团或区域。
备选地,如本文所述的“接头基团”和“分支区域”可以用来共价偶联核苷酸区域和非核苷酸区域,这种接头基团是称作L。例如,接头基团可以用来缀合本发明的寡聚物至本文所述的载体组分。例如,分支区域可以用来缀合本发明的寡聚物至本文所述的一种或多种载体组分。例如,分支区域可以用来缀合一种或多种本发明寡聚物至本文所述的载体组分。例如,分支区域可以用来缀合一种或多种本发明寡聚物至本文所述的一种或多种载体组分。
寡聚物缀合物
术语“寡聚物缀合物”意在表示通过将本文所述的寡聚物接合(“缀合”)(如通过将其共价接合)至载体组分所形成的异质性分子。
键,如共价缀合,可以在本质上是化学,如通过接头基团,或在本质上是遗传的,例如通过重组遗传技术,如在与例如报道分子(例如绿色荧光蛋白、β-半乳糖苷酶,His标签等)的融合蛋白中。备选地,寡聚物可以在不需要任何系索分子或接头基团的情况下直接与载体组分缀合。
载体组分
如本文所用,术语“载体组分”指意在携带或传输本发明寡聚物到其所需位置如所需的解剖学位置的分子载体。
本发明的载体组分可以用来增强活性、细胞分布和/或细胞摄取寡聚物。
可以使用任何合适的载体组分。
载体组分可以是多核苷酸。但是,一般,载体组分是非核苷酸部分或非多核苷酸部分。
非核苷酸或非多核苷酸部分的例子包括选自糖、细胞表面受体配体、原料药、激素、亲脂物质、聚合物、蛋白质、肽、毒素(例如细菌毒素)、维生素、病毒蛋白或其组合的大分子物质。常见的聚合物可以是聚乙二醇和/或聚丙二醇(PPG)。
在一些实施方案中,载体组分可以是氨基酸、蛋白质、肽或多肽。一般,蛋白质可以是酶、血清蛋白(例如人血清白蛋白(HSA)、转铁蛋白或糖蛋白)、受体、抗体或抗体其衍生物如设计成结合所需靶抗原的单链可变片段、双特异性抗体、三体等。
肽载体组分的例子是显著增加细胞渗透作用的多聚(L-赖氨酸)和触角足运输肽。这类缀合物由Lemaitre等人,"Specific antiviral activity of a poly(L-lysine)-conjugated oligodeoxyribonucleotide sequence complementary to vesicular stomatitis virus N protein mRNA initiation site,"Proc.Natl.Acad.Sci.USA,84:648-652,1987;美国专利号6,166,089和6,086,900描述。以上出版物中的方法要求3'-终端核苷酸应是核糖核苷酸。所产生的醛基团随后通过西夫碱形成过程与多聚(L-赖氨酸)的赖氨酸残基的ε-氨基随机偶联并且随后用氰基硼氢化钠还原。这种方法将3'末端核糖环转化成吗啉结构反义寡聚物。肽区段也可以通过与DNA/RNA合成相容的策略例如Mmt/Fmoc策略合成。在这种情况下,肽可以在寡核苷酸区段之前或之后直接合成。还存在合成后(例如,通过形成二硫键)制备肽寡核苷酸缀合物的方法。
在一些实施方案中,缀合物部分可以是或包含亲脂缀合物部分。亲脂缀合物部分可以选自固醇、甾烷醇、类固醇、多环芳基、脂族基团、脂质、磷脂、亲脂醇、脂肪酸和脂肪酯。在一些实施方案中,缀合物部分包含胆固醇。
载体组分可以是或包含药代动力调节物,如亲脂或疏水部分。这类部分在WO 2012/082046中siRNA缀合物的背景下公布。疏水部分可以包含C8–C36脂肪酸,所述脂肪酸可以是饱和或不饱和的。在一些实施方案中,可以使用C10、C12、C14、C16、C18、C20、C22、C24、C26、C28、C30、C32和C34脂肪酸。疏水基团可以具有16个或更多个碳原子。示例性的合适疏水基团可以选自:固醇、胆固醇、棕榈酰、十六碳-8-烯酰、油基、(9E,12E)-十八碳-9,12-二烯酰、二辛酰和C16-C20酰基。根据WO 2012/082046,具有少于16个碳原子的疏水基团在增强多核苷酸靶向作用方面效率较低,但是它们可以按多拷贝使用(例如2x,如2x C8或C10、C12或C14)以提高有效性。可用作多核苷酸靶向部分的药代动力调节物可以选自:胆固醇,烷基、烯基、炔基、芳基、芳烷基、芳烯基、和芳炔基,所述基团各自可以呈直链、支链或环状。药代动力调节物优选地是仅含有碳原子和氢原子的烃。然而,可以允许维持疏水性的取代或杂原子例如氟。
WO 2007/031091提供其他合适配体和载体组分的例子,所述文献因而通过引用的方式并入。
在一些实施方案中,载体组分是或包含糖部分。糖缀合物部分包括但不限于半乳糖、乳糖、N-乙酰半乳糖胺、甘露糖和甘露糖-6-磷酸。糖缀合物可以用来增强在一系列组织如肝脏和/或肌肉中的递送或活性。参见,例如EP 1495769、WO 99/65925、Yang等人,Bioconjug Chem(2009)20(2):213-21;Zatsepin和Oretskaya Chem Biodivers.(2004)1(10):1401-17。
此外,寡聚物还可以包含一个或多个额外的缀合物部分,所述缀合物部分的亲脂或疏水部分特别有意义。这些部分可以例如充当药代动力调节物,并且可以共价连接至糖缀合物、将糖缀合物与寡聚物连接的接头或连接多个(多价)糖缀合物的接头,或共价连接至寡聚物,任选地经接头,如生理不稳定接头。
在一些实施方案中,载体组分包含亲和力等于或大于半乳糖的脱唾液酸糖蛋白受体(ASGP-R)靶向部分。ASPG-R靶向部分可以选自半乳糖、半乳糖胺、N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、和N-异丁酰半乳糖胺。在一些实施方案中,靶向缀合物部分的脱唾液酸糖蛋白受体是单价的。在其他实施方案中,载体组分包含半乳糖簇,如靶向缀合物部分的二价、三价或四价脱唾液酸糖蛋白受体(即含有1、2、3或4个能够与脱唾液酸糖蛋白受体结合的末端糖部分)。在一些实施方案中,载体组分包含GalNAc(N-乙酰半乳糖胺),如单价、二价、三价或四价GalNAc。GalNAc缀合物可以用来将化合物靶向肝脏。优选的载体组分是N-乙酰半乳糖胺三聚体。GalNAc缀合物已经随甲基磷酸酯和PNA反义寡核苷酸(例如US 5,994517和Hangeland等人,Bioconjug Chem.1995Nov-Dec;6(6):695-701)及siRNA(例如WO 2009/126933、WO 2012/089352和WO 2012/083046)一起使用以及随LNA和2'-MOE修饰的核苷WO 2014/076196、WO 2014/207232,WO 2014/179620和WO 2014/179627一起使用。7232,WO 2014/179620和WO 2014/179627。本文中所用的GalNAc参考文献和具体缀合物因而通过引用的方式并入。WO 2012/083046公开了适用于本发明的具有包含可切割性药代动力调节物的GalNAc缀合物部分的iRNA,优选的药代动力调节物是C16疏水基团如棕榈酰、十六碳-8-烯酰、油基、(9E,12E)-十八碳-9,12-二烯酰、二辛酰和C16-C20酰基。WO2012/083046的可切割性药代动力调节物也可以是胆固醇。
载体组分可以选自:半乳糖、半乳糖胺、N-甲酰半乳糖胺、N-乙酰半乳糖胺、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰基半乳糖胺、半乳糖簇和N-乙酰半乳糖胺三聚体,并且可以具有选自以下的药代动力调节物:具有16个或更多个碳原子的疏水基团、具有16-20个碳原子的疏水基团、棕榈酰、十六碳-8-烯酰、油基、(9E,12E)-十八碳-9,12-二烯酰、二辛酰和C16-C20酰基以及胆固醇。在‘046中公布的某些GalNac簇包含:(E)-十六碳-8-烯酰(C16)、油基(C18)、(9E,12E)-十八碳-9,12-二烯酰(C18)、辛酰-(C8)、十二碳酰(C12)、C-20酰基、C24酰基、二辛酰(2xC8)。载体组分-药代动力调节物可以借助生理不稳定键或例如二硫键(PO-接头)或PEG接头与多核苷酸连接。本发明还涉及寡聚物和载体组分之间(适当地安置在寡聚物和糖缀合物基团之间)的磷酸二酯接头的用途。
在本发明的一个实施方案中,寡聚物连接、优选地缀合至载体组分,所述载体组分可以用来递送寡聚物至受试者的肝脏,例如通过增加细胞摄取寡聚物。
在一个具体实施方案中,载体组分可以是GalNAc或GalNAc簇。图2和图3展示了某些载体组分。
为了靶向肝脏中的肝细胞,优选的靶向配体是半乳糖簇。
半乳糖簇包括具有例如包含两个至四个末端半乳糖衍生物的分子。如本文所用,术语“半乳糖衍生物”包括半乳糖和对ASGP-R的亲和力等于或大于半乳糖亲和力的半乳糖衍生物。末端半乳糖衍生物通过其C-1碳与分子连接。ASGP-R是肝细胞独有的并且结合分枝的半乳糖末端糖蛋白。优选的半乳糖簇具有各自对脱唾液酸糖蛋白受体具有亲和力的三个末端半乳糖胺或半乳糖胺衍生物。更优选的半乳糖簇具有三个末端N-乙酰半乳糖胺。本领域常见的其他术语包括三天线状半乳糖、三价半乳糖和半乳糖三聚体。已知三天线状半乳糖衍生物簇以比二天线状或三天线状半乳糖衍生物结构更大的亲和力与ASGP-R结合(Baenziger和Fiete,1980,Cell,22,611-620;Connolly等人,1982,1.Biol.Chern.,257,939-945)。为实现nM亲和力要求多价态。
优选的半乳糖衍生物是N-乙酰半乳糖胺(GalNAc)。对脱唾液酸糖蛋白受体具有亲和力的其他糖可以选自包括:半乳糖胺、N-正丁酰半乳糖胺和N-异丁酰半乳糖胺的清单。已经研究(参见例如:Jobst,S.T.和Drickamer,K.JB.C.1996,271,6686)或使用本领域常见的方法轻易地测定许多半乳糖衍生物对脱唾液酸糖蛋白受体的亲和力。
半乳糖簇可以包含各自与中央分支点连接的两个或优选地三个半乳糖衍生物。半乳糖衍生物通过糖C-1碳与中央分支点连接。半乳糖衍生物优选地借助接头或间隔团与分支点连接。优选的间隔团是柔性亲水间隔团(美国专利5885968;Biessen等人,J.Med.Chern.1995第39卷第1538-1546页)。优选的柔性亲水间隔团是PEG间隔团。优选的PEG间隔团是PEG3间隔团(三个亚乙基单元)。分支点可以是允许接合三个半乳糖衍生物并进一步允许分支点接合至寡聚物的任何小分子。GalNAc簇(例如GalNAc)中的每种半乳糖衍生物(糖部分)可以经接头如聚乙二醇接头(PEG),如二、三、四、五、六乙二醇接头与寡聚物接合。PEG部分可以在半乳糖衍生物糖部分和肽(显示双赖氨酸)接头之间形成间隔团。示例性分支点基团是双赖氨酸。双赖氨酸分子含有藉此可以连接三个半乳糖衍生物的三个胺基和双赖氨酸可以藉此与寡聚物连接的羧基反应基团(件例如图4)。
糖缀合物(例如GalNAc)或糖-接头部分(例如糖-PEG部分)可以借助分支点基团如适当包含两个或更多个氨基(如3、4或5个)的氨基酸或肽如赖氨酸、双赖氨酸或三赖氨酸或四赖氨酸与寡聚物共价接合(接合)。三赖氨酸分子含有藉此可以连接三个糖缀合物基团如半乳糖和衍生物(例如GalNAc)和其他缀合物如疏水性或亲脂部分/基团的三个胺基以及三赖氨酸可以藉此与寡聚物连接的羧基反应基团。其他缀合物,如亲脂/疏水部分可以与连接至寡聚物的赖氨酸残基连接。
在一些实施方案中,GalNac簇包含借助双基接头连接至寡聚物的肽接头,例如Tyr-Asp(Asp)三肽或Asp(Asp)二肽,例如GalNac簇可以包含以下双基接头,例如,如图3中的Conj 3、3a、4和4a所示的那些。
备选的分支分子可以选自1,3-双-[5-(4,4'-二甲氧基三苯甲氧基)戊基酰氨基]丙基-2-[(2-氰基乙基)-(N,N-二异丙基)]磷酰亚胺(Glen Research目录号:10-1920-xx)、三-2,2,2-[3-(4,4'-二甲氧基三苯甲氧基)丙氧甲基]乙基-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺(Glen Research目录号:10-1922-xx)、三-2,2,2-[3-(4,4'-二甲氧基三苯甲氧基)丙氧甲基]亚甲氧基丙基-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺和1-[5-(4,4'-二甲氧基-三苯甲氧基)戊基酰氨基]-3-[5-芴甲氧基-羰基-氧-戊基酰氨基]-丙基-2-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺(Glen Research目录号:10-1925-xx)。WO 2014/179620和欧洲申请号14188444.5描述了多种GalNac缀合物部分的产生(所述文献因而通过引用的方式并入)。分支点与寡聚物的接合可以通过接头或间隔团进行。优选的间隔团是柔性亲水间隔团。优选的柔性亲水间隔团是PEG间隔团或C6接头。优选的PEG间隔团是PEG3间隔团(三个亚乙基单元)。在一个优选实施方案中,接头是生理不稳定接头。使用本领域已知的方法,可以将半乳糖簇与寡聚物的3'或5'末端连接。在优选的实施方案中,靶向缀合物部分的脱唾液酸糖蛋白受体连接至寡核苷酸的5'末端。
优选的半乳糖簇包含借助PEG间隔团与双赖氨酸分支分子连接的三个末端GalNAc部分(GalNAc簇)。优选地,PEG间隔团是3PEG间隔团。优选的GalNAc簇是Conj 1、1a、2和2a。最优选的是Conj2a(还称作GalNAc2)。
图3中展示了半乳糖簇。载体组分接头
载体组分可以借助接头(L)连接至第一寡聚物区域和/或第二寡聚物区域。可以使用任何合适的接头。
糖缀合物(例如GalNAc)可以借助生物可切割接头(也称作生理不稳定接头)连接至寡聚物。
如本文所用,生理不稳定键是在哺乳动物身体内部通常遇到的条件或与哺乳动物身体内部遇到的那些条件类似的条件下可切割的不稳定键(也称作生理不稳定接头)。如此选择生理不稳定的连接基团,从而它们在某些生理状况下存在时发生化学转化(例如,裂解)。哺乳动物胞内条件包括在哺乳动物细胞中存在或与哺乳动物细胞中遇到的那些相似的化学条件如pH、温度、氧化或还原条件或物质以及盐浓度。哺乳动物胞内条件还包括存在哺乳动物细胞中正常出现的酶活性,如来自蛋白酶解酶或水解酶。
化学转化(切割不稳定键)可以通过添加可药用物质至细胞来引发或可以在含有不稳定键的分子到达适宜的胞内和/或胞外环境时自发出现。例如,当分子进入酸化内体时,可以切割pH不稳定键。因此,可以将pH不稳定键视为一种内体可切割键。当暴露于酶如内体或溶酶体中或在细胞质中存在的那些酶时,酶可切割键可以被切割。当分子进入还原型更强的细胞胞质环境时,二硫键可以被切割。因此,可以将二硫键视为一种胞质可切割键。如本文所用,pH不稳定键是在酸性条件(pH<7)下选择性断裂的不稳定键。这类键也可以称作内体不稳定键,因为细胞内体和溶酶体具有小于7的pH。另一个生理不稳定接头的例子是如图3的GalNAc簇中使用的双赖氨酸。
在一些实施方案中,本发明的寡聚物缀合物包含将本发明的寡聚物(区域A)接合至载体组分(或区域C)的生理不稳定接头(区域PL,也称作生物可切割接头或核酸酶敏感接头)。
关于与载体组分结合用于定向递送的生理不稳定接头,优选靶组织(例如肌肉、肝、肾或肿瘤)中所见的切割速率大于血清中观察到的切割速率。相对于血清确定靶组织中切割水平的适合方法在“组织特异性体外接头切割测定法”章节中描述。在一些实施方案中,在“材料和方法”章节的“组织特异性体外接头切割测定法”中,本发明化合物中的生理不稳定接头(也称作生物可切割接头,或核酸酶敏感接头)至少约20%被切割,如至少约30%被切割,如至少约40%被切割,如至少约50%被切割,如至少约60%被切割,如至少约70%被切割,如至少约75%被切割。在一些实施方案中,血清中的切割(%),如“组织特异性体外接头切割测定法”中使用,小于约30%、小于约20%,如小于约10%,如小于5%,如小于约1%。
在一些实施方案中,本发明的寡聚物缀合物包含三个区域:i)第一区域(区域A),其包含10–18个连续核苷酸;ii)包含生理不稳定接头的第二区域(区域PL)和iii)包含载体组分的第三区域(C),其中第三区域共价连接至第二区域,所述第二区域共价连接至第一区域。
在一些实施方案中,区域A和区域PL借助磷酸酯核苷键(例如磷酸二酯、硫代磷酸酯、二硫代磷酸酯、硼烷磷酸酯或甲基磷酸酯)或三唑基团共价连接。在一些实施方案中,区域PL和区域C借助磷酸酯核苷键(例如磷酸二酯、硫代磷酸酯、二硫代磷酸酯、硼烷磷酸酯或甲基磷酸酯)或三唑基团共价连接。在一些实施方案中,区域PL和区域C借助第二接头如下文描述的区域E接头共价连接。
在一些实施方案中,生理不稳定接头可以位于寡聚物(区域A)的5'末端和/或3’末端。在一个优选实施方案中,生理不稳定接头在5'末端。
在一些实施方案中,生理不稳定接头在其3’末端连接至区域A的5'末端并且载体组分(区域C)连接至5'末端或接头区域E连接。
核酸酶敏感接头-磷酸二酯接头(PO-接头)
在一些实施方案中,生理不稳定接头对核酸酶敏感,所述核酸酶可以例如是在靶细胞中表达–,并且因而如本文中详述,接头可以是短区域(例如1–10)磷酸二酯连接的核苷,如DNA核苷。
在可以是相同或不同的一些实施方案中,生理不稳定接头(区域PL)易遭S1核酸酶切割。可以使用“S1核酸酶切割测定法”章节中描述的S1核酸酶测定法评价S1切割作用敏感性。在一些实施方案中,生理不稳定接头(也称作生理不稳定接头,或核酸酶敏感接头)(如区域PL)如材料和方法”章节的“S1核酸酶切割测定法中与S1核酸酶温育120分钟后至少约20%被切割,如至少约30%被切割,如至少约40%被切割,如至少约50%被切割,如至少约60%被切割,如至少约70%被切割,如至少约75%被切割、至少95%被切割。
在一些实施方案中,生理不稳定接头(区域PL)是核酸酶敏感接头,所述核酸酶敏感接头包含的1和10之间个核苷,如1、2、3、4、5、6、7、8、9或10个核苷,更优选地2和6之间个核苷和最优选地2和4之间个连接的核苷。在一些实施方案中,核酸酶敏感接头是磷酸二酯核苷酸接头,这种接头也称作PO-接头。在优选的实施方案中,核酸酶敏感接头(PO-接头)包含至少一个磷酸二酯连接的核苷。优选地,核酸酶敏感性PO-接头包含至少两个连续的磷酸二酯键,如至少3或4或5个连续的磷酸二酯键。
在一些实施方案中,PO-接头中的核苷(任选地独立)选自DNA和RNA或其不干预核酸酶切割的修饰物。不干扰核酸酶切割的DNA和RNA核苷修饰物可以是非天然存在的核碱基。某些糖修饰的核苷还可以允许核酸酶切割,如α-L-氧代-LNA。在一些实施方案中,全部PO-接头的核苷(任选独立地)包含2’-OH核糖(RNA)或2’-H糖,即RNA或DNA。在一些实施方案中,PO-接头的核苷是DNA核苷。在一些实施方案中,至少两个连续的PO-接头核苷是DNA核苷或RNA核苷(如至少3或4或5个连续的DNA核苷或RNA核苷)。优选地,PO-接头由1至5或1至4个之间如2、3、4个连续的磷酸二酯连接的DNA核苷组成。在优选的实施方案中,PO-接头如此短,从而它不召集RNA酶H。在一些实施方案中,PO-接头包含不多于3个或不多于4个连续的磷酸二酯连接的DNA和/或RNA核苷(如DNA核苷)。
在一些实施方案中,PO-接头不互补于所述靶核酸序列或不互补于区域A中的寡聚物。
在一些实施方案中,PO-接头与靶核酸序列互补。在这个方面,区域A和PO-接头共同可以形成与靶序列互补的单一连续序列。
在一些实施方案中,区域A和PO-接头形成10–22个如12-20个核苷酸长度的单一连续核苷酸序列。在这种情况下,区域A可以不同于PO-接头,在于它始于至少一个、优选地至少两个对靶核酸的结合亲和力增加的修饰的核苷(例如LNA或具有2’取代的糖部分的核苷)并且区域A本身能够调节有关细胞系中靶核酸的表达。另外,如果区域A包含DNA核苷或RNA核苷,则这些核苷与核酸酶抗性核苷间键如硫代磷酸酯或硼烷磷酸酯连接。
在一些方面,可以将第一(区域A)和第二区域(PO-接头)之间的核苷间键视为第二区域的部分。
在一些实施方案中,基于靶组织或细胞或亚细胞区室中存在的优势核酸内切酶、切割酶,PO-接头中碱基的序列以提供最佳核酸内切酶切割位点。在这个方面,通过从靶组织和非靶组织分离细胞提取物,与非靶细胞(例如肾)相比,可以基于所需靶细胞(例如肝脏/肝细胞)中的偏好性切割活性,选择可用于PO-接头中的核酸内切酶切割序列。在这个方面,化合物用于目标下调的效力可以针对所需的组织/细胞进行优化。
在一些实施方案中,PO-接头包含序列为AA、AT、AC、AG、TA、TT、TC、TG、CA、CT、CC、CG、GA、GT、GC或GG的二核苷酸,其中C可以是5-甲基胞嘧啶和/或T可以替换为U。优选地,核苷间键是磷酸二酯键。在一个优选实施方案中,PO-接头是具有至少两个磷酸二酯键(一个属于区域A)的CA二核苷酸。在一些实施方案中,PO-接头包含序列为AAA、AAT、AAC、AAG、ATA、ATT、ATC、ATG、ACA、ACT、ACC、ACG、AGA、AGT、AGC、AGG、TAA、TAT、TAC、TAG、TTA、TTT、TTC、TAG、TCA、TCT、TCC、TCG、TGA、TGT、TGC、TGG、CAA、CAT、CAC、CAG、CTA、CTG、CTC、CTT、CCA、CCT、CCC、CCG、CGA、CGT、CGC、CGG、GAA、GAT、GAC、CAG、GTA、GTT、GTC、GTG、GCA、GCT、GCC、GCG、GGA、GGT、GGC和GGG的三核苷酸,其中C可以是5-甲基胞嘧啶和/或T可以替换为U。优选地,核苷间键是磷酸二酯键。在一些实施方案中,,PO-接头包含序列为AAAX、AATX、AACX、AAGX、ATAX、ATTX、ATCX、ATGX、ACAX、ACTX、ACCX、ACGX、AGAX、AGTX、AGCX、AGGX、TAAX、TATX、TACX、TAGX、TTAX、TTTX、TTCX、TAGX、TCAX、TCTX、TCCX、TCGX、TGAX、TGTX、TGCX、TGGX、CAAX、CATX、CACX、CAGX、CTAX、CTGX、CTCX、CTTX、CCAX、CCTX、CCCX、CCGX、CGAX、CGTX、CGCX、CGGX、GAAX、GATX、GACX、CAGX、GTAX、GTTX、GTCX、GTGX、GCAX、GCTX、GCCX、GCGX、GGAX、GGTX、GGCX和GGGX的四核苷酸,其中X可以选自A、T、U、G、C及其类似物,其中C可以是5-甲基胞嘧啶和/或T可以替换为U。优选地,核苷间键是磷酸二酯键。将认识到,当提到(天然存在的)核碱基A、T、U、G、C时,这些核碱基可以用作为等同的天然核碱基发挥作用(例如与互补核苷发生碱基配对)的核碱基类似物置换。
在一些实施方案中,区域PL是与亲脂缀合物部分,如脂质、脂肪酸、固醇如胆固醇或生育酚共价连接磷酸二酯核苷酸接头(PO-接头)。在一些实施方案中,区域PL是与脱唾液酸糖蛋白受体靶向部分如GalNAc载体组分共价连接磷酸二酯核苷酸接头(PO-接头)。
WO 2014/076195中详述在寡聚物和载体组分之间插入生理不稳定接头的构思(所述文献因而通过引用的方式并入,尤其图3和4通过引用的方式并入)。
备选的接头(区域E)
在一些情况下,接头并不必然地生理不稳定,而主要起到共价连接第三区域例如载体组分(区域C)至寡聚物(区域A)的作用。本文中,这些接头也称作区域E。本发明的寡聚物缀合物可以由以下区域元件A-C/C-A、A-PL-C/C-PL-A、A-PL-E-C/C-E-PL-A、A-E-PL-C/C-PL-E-A或A-E-C/C-E-A构成。
在一些实施方案中,接头E包含重复单元如乙二醇、氨基酸单元或氨基烷基的链结构或寡聚物。接头E可以具有至少两个官能团,一个官能团用于接合至寡聚物(任选地其中生理不稳定接头)并且另一个官能团用于接合至载体组分。示例接头官能团可以是亲电的,以与寡聚物或载体组分上的亲核基团反应,或是亲核的,以与亲电基团反应。在一些实施方案中,接头官能团包含氨基、羟基、羧酸、巯基、磷酰胺酯、硫代磷酸酯、磷酸酯、亚磷酸酯、不饱和键(例如,双键或叁键)等。例如,糖载体组分(例如GalNAc)因此可以经接头如聚乙二醇接头(PEG)如二、三、四、五、六个乙二醇接头连接至寡聚物。
在一些实施方案中,接头(区域E)是氨基烷基,如C2–C36氨基烷基,例如包括C6至C12氨基烷基。在一个优选实施方案中,接头(区域E)是C6氨基烷基。作为标准寡聚物合成合成的部分,例如使用(例如保护的)氨基烷基磷酰亚胺,可以将氨基烷基添加至寡聚物(区域A或区域A-L/L-A)。氨基烷基和寡聚物之间的连接基团可以例如是硫代磷酸酯或磷酸二酯,或本文中提及的其他核苷连接基团之一。氨基烷基共价连接至寡聚物的5’或3’末端。市售氨基烷基接头例如是用于寡聚物3'末端处键的3'-氨基修饰试剂并且对于寡聚物5'末端处键的键,5'-氨基修饰剂C6可获得。这些试剂从Glen Research Corporation(Sterling,Va.)可获得。这些化合物或相似的化合物由Krieg等人,Antisense Research and Development 1991,1,161用来将荧光素与寡聚物的5'末端连接。多种类型的其他步接头基团是本领域已知的并且可以用于将载体组分接合至寡聚物。多种可用接头基团的综述可以在例如Antisense Research and Applications,S.T.Crooke和B.Lebleu编著,CRC Press,Boca Raton,Fla.,1993,第303-350页中找到。其他化合物如吖啶已经借助多亚甲基键与寡聚物的3'-末端磷酸酯基团连接(Asseline等人,Proc.Natl.Acad.Sci.USA 1984,81,3297)。前述任一个基团可以作为单个接头(区域E)使用或与一个或多个其他接头(区域E-E’或区域E-L或L-E)组合使用。
在本领域充分提供了接头和它们在制备寡聚物的缀合物中的用途,如在以下文献中提供:WO 96/11205和WO 98/52614和美国专利号4,948,882;5,525,465;5,541,313;5,545,730;5,552,538;5,580,731;5,486,603;5,608,046;4,587,044;4,667,025;5,254,469;5,245,022;5,112,963;5,391,723;5,510475;5,512,667;5,574,142;5,684,142;5,770,716;6,096,875;6,335,432和6,335,437、WO 2012/083046,所述文献各自通过引用的方式完整并入。图3展示了具有示例GalNAc簇、具有将GalNac簇与寡聚物接合的任选C6接头的缀合物1、2、3、4和缀合物1a、2a、3a和4a。
脱唾液酸糖蛋白受体(ASGP-R)靶向部分
如本文所用,术语“脱唾液酸糖蛋白受体(ASGP-R)靶向部分”指这样的部分,所述部分与ASGP-R相互作用并因而使寡聚物接触于或接近于表达表面ASGP-R的细胞。
缀合物部分
在一些实施方案中,载体组分是缀合物部分。
此外,一种或多种缀合物部分可以接合至载体组分之外的寡聚物或寡聚物缀合物。
在一些实施方案中,一个或多个缀合物部分可以接合至本发明的寡聚物。
缀合物部分可以是非核苷酸部分或非多核苷酸部分。
缀合物部分可以增强本发明寡聚物的活性、细胞分布或细胞摄取作用。这类部分包括但不限于抗体、多肽、脂质部分如胆固醇部分、胆酸、硫醚例如己基-s-三苯甲基硫醇、巯基胆固醇、脂族链例如十二醇残余物或十一基残余物、磷脂例如二鲸蜡基-外消旋-甘油或三乙基铵1,2-双-o-十六烷基-外消旋-甘油酰-3-h-膦酸酯、多胺或聚乙烯二醇链、金刚烷乙酸、棕榈基部分、十八烷基胺或己基氨基-羰酰氧基胆固醇部分部分。
本发明的寡聚物也可以缀合至活性原料药例如,阿司匹林、布洛芬(ibuprofen)、磺胺药、抗糖尿病药、抗细菌药或抗生素。
在某些实施方案中,缀合的部分是固醇,如胆固醇。
在多种实施方案中,缀合物部分包含或带正电荷的聚合物,如例如1-50个如2–20个如3–10个氨基酸残基长度的带正电荷的肽,和/或聚亚烷基氧化物如聚乙二醇(PEG)或聚丙二醇由其组成–参见WO 2008/034123,所述文献因而通过引用的方式并入。适当地,带正电荷的聚合物,如聚亚烷基氧化物,可以经接头如WO 2008/034123中描述的可释放接头接合至本发明的寡聚物。
本发明的寡聚物和寡聚物缀合物可以包含适宜的配体-结合分子作为缀合物部分。例如,如根据国际专利申请WO 91/04753,可以缀合寡核苷酸用于治疗性施用识别细胞表面分子的配体-结合分子。配体-结合分子可以包含例如,针对表面抗原的抗体细胞、针对细胞表面受体的抗体、具有相应的细胞表面受体的生长因子、针对这种生长因子的抗体或识别生长因子和其受体的复合物的抗体。用于缀合配体-结合分子至寡核苷酸的方法详述于WO 91/04753中。另外,以下国际专利申请中描述了可以使用的缀合方法和改善细胞摄取的方法:WO 9640961、WO 9964449、WO 9902673、WO 9803533、WO 0015265和美国专利5856438和5138045。
借助又一个例子,缀合物部分可以是生长因子如转铁蛋白或叶酸。可以制备转铁蛋白-聚赖氨酸-寡核苷酸复合物或叶酸-聚赖氨酸-寡核苷酸复合物,以便由表达高水平转铁蛋白或叶酸受体的细胞摄取。制备转铁蛋白复合物作为促进寡核苷酸摄入细胞中的载体组分由Wagner等人,Proc.Natl.Acad.Sci.USA 87,3410-3414(1990)描述。借助叶酸受体内吞作用向细胞递送叶酸-大分子缀合物(包括递送反义寡核苷酸)由Low等人,美国专利5,108,921描述。还参见,Leamon等人,Proc.Natl.Acad.Sci.88,5572(1991)。
靶核酸/靶序列
在优选的方面,如本文所用的术语“靶核酸”和“靶序列”指编码HBx或HBsAg多肽的DNA或RNA,如含于SEQ ID No.1或SEQ ID No.2任一者内部的序列。术语“靶核酸”和“靶序列”因此包括编码HBx或HBsAg的核酸或其天然存在的变体及从中衍生的RNA核酸,优选地mRNA,如前mRNA,不过优选地是成熟mRNA。在一些实施方案中,例如在研究或诊断中使用时,靶核酸”或“靶序列”可以是从上述DNA或RNA核酸靶衍生的cDNA或合成性寡核苷酸。本发明寡聚物优选地能够与靶核酸杂交。
同一性/同源性
如本文所用,术语“同源的”和“同源性”与术语“同一性”和“相同的”可互换。
相对应/对应于
术语“与……对应”和“对应于”指在寡聚物(即核碱基或碱基序列)或其连续核苷酸序列的核苷酸序列和其他序列的等同连续核苷酸序列的之间比较,所述其他序列选自i)核酸靶(如编码靶序列蛋白质的mRNA,如SEQ ID No.1或SEQ ID No.2或SEQ ID No.3内部的任何序列)的反向互补序列的子序列,和/或ii)本文中提供的任何特定核苷酸序列的序列或其子序列。核苷酸类似物与其等同物或相应的核苷酸直接比较。对应于i)或ii)下其他序列的序列一般与这个序列在第一序列(如连续核苷酸序列)的长度范围内相同,或如本文所述,可以在一些实施方案中与至相应序列少80%同源,如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%同源,如100%同源(相同)。通过计数在2个序列之间相同的比对碱基的数目,除以寡聚物中连续单元的总数和乘以100,计算百分数序列同一性。
术语“相应的核苷酸类似物”和“相应的核苷酸”意在表示核苷酸类似物中的核苷酸和天然存在的核苷酸是相同的。例如,当核苷酸的2-脱氧核糖单元与腺嘌呤连接时,“相应的核苷酸类似物”含有与腺嘌呤连接的戊糖单元(与2-脱氧核糖不同)。
互补的
术语,“互补的”意指当序列之一可以按以下反平行意义与另一个序列结合时,两个序列互补,其中每个序列的3'末端与另一个序列的5'末端结合并且一个序列的每个A、T(U)、G和C随后与另一个序列的T(U)、A、C和G分别比对。正常情况下,寡核苷酸的互补序列与限定的序列具有至少90%、优选地95%、最优选地100%互补性。
在确定本发明寡聚物(或其区域)和靶序列如HBx或HBsAg靶序列之间的“互补性”程度时,“互补性”程度(又作,“同源性”或“同一性”)表述为寡聚物(或其区域)序列和与之最佳对齐的靶区域序列(或靶区域的反向互补序列)之间的同一性百分数(或同源性百分数)。通过计数在2个序列之间相同的比对碱基的数目,除以寡聚物中连续单元的总数和乘以100,计算该百分数。在这种比较中,如果空位存在,优选这类空位仅是错配而非其中空位内部单元的数目在本发明寡聚物和靶区域之间不同的区域。
特别地,术语“互补的”意指第一核酸和第二核酸的核碱基之间配对的能力。当序列之一可以按以下反平行意义与另一个序列结合时,两个序列互补,其中每个序列的3'末端与另一个序列的5'末端结合并且一个序列的每个核碱基A、T(U)、G和C随后与另一个序列的T(U)、A、C和G分别比对。在确定本发明寡聚物(或其区域)和靶序列如HBx或HBsAg靶序列之间的“互补性”程度时,“互补性”程度表述为寡聚物的序列和与之最佳对齐的靶区域的序列之间的互补性百分数。通过计数在2个序列之间形成配对的比对碱基的数目,除以寡聚物中连续单元的总数和乘以100,计算该百分数。在这种比较中,未对齐的核碱基/核苷酸称作错配。正常情况下,本发明寡核苷酸的互补序列与限定的序列具有至少80%、优选地85%、优选地90%、更优选地95%、最优选地100%互补性。
如涉及多核苷酸序列,术语“互补序列”指另一个核酸分子中依照碱基配对法则的碱基序列。更具体地,术语或类似术语指在核苷酸或核酸之间(例如,在双链DNA分子的两条链之间或在寡核苷酸引物和待测序或待扩增单链核酸上的引物结合位点之间)的杂交或碱基配对。通常,互补的核苷酸是A和T(或A和U),或C和G。当最佳比对并比较以及具有适宜核苷酸插入或缺失的一条链的核苷酸与另一条链的至少约95%、通常至少约98%和更优选地约99%至约100%的核苷酸配对时,两个单链RNA或DNA分子称作基本上互补。可以通过多种方案,包括使用熟知的计算机算法和软件例如BLAST程序,鉴定互补性多核苷酸序列。
反向互补序列/反向互补的/反向互补性
如本文所用的术语“反向互补序列”、“反向互补的”和“反向互补性”与术语“互补序列”、“互补的”和“互补性”可互换。
错配
术语“错配”–有时称作非互补核碱基-指当第一核酸与第二核酸对齐时,在第一核酸的给定位置处不与第二核酸中相应核碱基或核苷酸发生Watson-Crick碱基配对的核碱基或核苷酸。第一核酸可以例如是本发明的寡聚物或寡聚物缀合物并且第二核酸可以例如是靶序列。在含有多个错配的寡聚物或寡聚物缀合物中,错配可以是彼此相邻或散布的。
其天然存在的变体
术语“其天然存在的变体”指在限定的分类群内部(如HBV基因型A-H)天然存在的靶序列变体。一般,当指多核苷酸的“天然存在的变体”时,该术语还可以涵盖编码靶序列的基因组DNA的因染色体转位或复制而存在的任何等位变体,和RNA,如从中衍生的mRNA。“天然存在的变体”还可以包括衍生自靶序列mRNA可变剪接的变体。当指特定多肽序列时,例如,本术语还包括该蛋白质的天然存在形式,所述天然存在形式因此可以例如通过共翻译或翻译后修饰如信号肽切割、蛋白酶剪切、糖基化等加工。
下游
如本文所用,当沿核苷酸序列指称方向使用时,术语“下游”意指处于从5’至3’末端的方向。类似地,术语“上游”意指处于从5’至3’末端的方向。
LNA
术语“LNA”指双环核苷类似物,称作“锁核酸”。它可以指LNA单元,或在“LNA寡核苷酸”的背景下使用时,LNA指含有一个或多个这类双环核苷酸类似物的寡核苷酸。LNA核苷酸以核糖糖环的C2’和C4’之间存在接头基团(如桥)为特征-例如,如下文描述的双基R4*-R2*显示。
如本文所用,术语“LNA寡核苷酸”和“LNA-修饰的寡核苷酸”包括用LNA单元完全或部分修饰的任何寡核苷酸。因此,LNA-修饰的寡核苷酸可以完全由LNA单元组成,或LNA-修饰的寡核苷酸可以包含一个LNA单元。
在本发明的寡核苷酸化合物中使用的LNA优选地具有通式I的结构:
其中对于全部手性中心,非对称基团可以按R或S方向存在;
其中X选自-O-、-S-、-N(RN*)-、-C(R6R6*)-,如在一些实施方案中,–O-;B选自氢、任选取代的C1-4-烷氧基、任选取代的C1-4-烷基、任选取代的C1-4-酰氧基、核碱基(包括天然存在的类似物和核碱基类似物)、DNA嵌入剂、光化学活性基团、热化学活性基团、螯合基团、报道基团和配体;优选地,B是核碱基或核碱基类似物;
P指毗邻单元的核苷酸间键或5'末端基团,这类核苷酸间键或5'末端基团任选地包括取代基R5或同等施用取代基R5*;
P*指毗邻单元的核苷酸间键或3'末端基团;R4*和R2*一起指由选自以下的1-4个基团/原子组成的双价接头基团:-C(RaRb)-、-C(Ra)=C(Rb)-、-C(Ra)=N-、-O-、-Si(Ra)2-、-S-、-SO2-、-N(Ra)-和>C=Z,其中Z选自-O-、-S-和-N(Ra)-,并且Ra和Rb各自独立地选自氢、任选取代的C1-12-烷基、任选取代的C2-12-链烯基、任选取代的C2-12-炔基、羟基、任选取代的C1-12-烷氧基、C2-12-烷氧烷基、C2-12-链烯氧基、羧基、C1-12-烷氧羰基、C1-12-烷基羰基、甲酰基、芳基、芳氧基-羰基、芳氧基、芳基羰基、杂芳基、杂芳氧基-羰基、杂芳氧基、杂芳基羰基、氨基、单和双(C1-6-烷基)氨基、氨甲酰基、单和双(C1-6-烷基)氨基-羰基、氨基-C1-6-烷基-氨基羰基、单和双(C1-6-烷基)氨基-C1-6-烷基-氨基羰基、C1-6-烷基-羰氨基、脲、C1-6-烷酰氧基、砜基(sulphono)、C1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、C1-6-烷硫基、卤素、DNA嵌入剂、光化学活性基团、热化学活性基团、螯合基团、报道基团和配体,其中芳基和杂芳基可以是任选取代的并且其中两个谐位取代基Ra和Rb一起可以指任选取代的亚甲基(=CH2),其中对于全部手性中心,非对称基团可以按R或S方向存在,并且;
存在的取代基R1*、R2、R3、R5、R5*、R6和R6*每一者独立地选自氢、任选取代的C1-12-烷基、任选取代的C2-12-链烯基、任选取代的C2-12-炔基、羟基、C1-12-烷氧基、C2-12-烷氧烷基、C2-12-链烯氧基、羧基、C1-12-烷氧羰基、C1-12-烷基羰基、甲酰基、芳基、芳氧基-羰基、芳氧基、芳基羰基、杂芳基、杂芳氧基-羰基、杂芳氧基、杂芳基羰基、氨基、单和双(C1-6-烷基)氨基、氨甲酰基、单和双(C1-6-烷基)氨基-羰基、氨基-C1-6-烷基-氨基羰基、单和双(C1-6-烷基)氨基-C1-6-烷基-氨基羰基、C1-6-烷基-羰氨基、脲、C1-6-烷酰氧基、砜基(sulphono)、C1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、C1-6-烷硫基、卤素、DNA嵌入剂、光化学活性基团、热化学活性基团、螯合基团、报道基团和配体,其中芳基和杂芳基可以是任选取代的,并且其中两个谐位取代基一起可以指氧代、硫代、亚胺基或任选取代的亚甲基;其中RN选自氢和C1-4-烷基,并且其中两个毗邻(非谐位)取代基可以指产生双键的额外键;并且当存在且不参与双基时,RN*选自氢和C1-4-烷基;以及其碱式盐和酸加成盐。对于全部手性中心,非对称基团可以按R或S方向存在。
在一些实施方案中,R4*和R2*一起指由选自以下的官能团组成的双基:C(RaRb)-C(RaRb)-、C(RaRb)-O-、C(RaRb)-NRa-、C(RaRb)-S-和C(RaRb)-C(RaRb)-O-,其中每种Ra和Rb可以任选地独立选择。在一些实施方案中,Ra和Rb可以任选地独立选自氢和C1-6烷基,如甲基,如氢。
在一些实施方案中,R4*和R2*一起指处于R构型或S构型的双基–O-CH(CH2OCH3)-(2’O-甲氧乙基双环核酸-Seth等人,2010,J.Org.Chem)。
在一些实施方案中,R4*和R2*一起指处于R构型或S构型的双基–O-CH(CH2CH3)-(2’O-乙基双环核酸-Seth等人,2010,J.Org.Chem)。
在一些实施方案中,R4*和R2*一起指处于R构型或S构型的双基–O-CH(CH3)-。在一些实施方案中,R4*和R2*一起指双基–O-CH2-O-CH2--(Seth等人,2010,J.Org.Chem).
在一些实施方案中,R4*和R2*一起指双基–O-NR-CH3-(Seth等人,2010,J.Org.Chem).
在一些实施方案中,LNA单元具有选自以下基团的结构:
在一些实施方案中,R1*、R2、R3、R5、R5独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基。对于全部手性中心,非对称基团可以按R或S方向存在。
在一些实施方案中,R1*、R2、R3、R5、R5是氢。
在一些实施方案中,R1*、R2、R3独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基。对于全部手性中心,非对称基团可以按R或S方向存在。
在一些实施方案中,R1*、R2、R3是氢。
在一些实施方案中,R5和R5*各自独立选自H、–CH3、-CH2-CH3、-CH2-O-CH3和-CH=CH2。适当地在一些实施方案中,R5或R5*是氢,其中此时其他基团(R5或R5*分别)选自C1-5烷基、C2-6链烯基、C2-6炔基、取代的C1-6烷基、取代的C2-6链烯基、取代的C2-6炔基或取代的酰基(-C(=O)-);其中每个取代的基团是用独立选自以下的取代基单取代或多取代的:卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基、取代的C2-6炔基、OJ1、SJ1、NJ1J2、N3、COOJ1、CN、O-C(=O)NJ1J2、N(H)C(=NH)NJ1JJ2或N(H)C(=X)N(H)J2其中X是O或S;并且每个J1和J2独立地是H、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基、取代的C2-6炔基、C1-6氨烷基、取代的C1-6氨烷基或保护基。在一些实施方案中,R5或R5*是取代的C1-6烷基。在一些实施方案中,R5或R5*是取代的亚甲基,其中优选的取代基包括独立选自以下的一个或多个基团:F、NJ1J2、N3、CN、OJ1、SJ1、O-C(=O)NJ1J2、N(H)C(=NH)NJ1J2或N(H)C(O)N(H)J2。在一些实施方案中,每个J1和J2独立地是H或C1-6烷基。在一些实施方案中,R5或R5*是甲基、乙基或甲氧甲基。在一些实施方案中,R5或R5*是甲基。在又一个实施方案中,R5或R5*是乙烯基。在一些实施方案中,R5或R5*是取代的酰基。在一些实施方案中,R5或R5*是C(=O)NJ1J2。对于全部手性中心,非对称基团可以按R或S方向存在。这类5’修饰的双环核苷酸在因而通过引用方式完整并入的WO 2007/134181中公开。
在一些实施方案中,B是核碱基,包括核碱基类似物和天然存在的核碱基,如嘌呤或嘧啶,或取代的嘌呤或取代的嘧啶,如本文中提及的核碱基,如选自以下的核碱基:腺嘌呤、胞嘧啶、胸腺嘧啶、腺嘌呤、尿嘧啶和/或修饰的或取代的核碱基,如5-噻唑并-尿嘧啶、2-硫代-尿嘧啶、5-炔丙基-尿嘧啶、2’硫代-胸腺嘧啶、5-甲基胞嘧啶、5-硫代-胞嘧啶、5-炔丙基-胞嘧啶和2,6-二氨基嘌呤。
在一些实施方案中,R4*和R2*一起指选自以下的双基:-C(RaRb)-O-、-C(RaRb)-C(RcRd)-O-、-C(RaRb)-C(RcRd)-C(ReRf)-O-、-C(RaRb)-O-C(RcRd)-、-C(RaRb)-O-C(RcRd)-O-、-C(RaRb)-C(RcRd)-、-C(RaRb)-C(RcRd)-C(ReRf)-、-C(Ra)=C(Rb)-C(RcRd)-、-C(RaRb)-N(Rc)-、-C(RaRb)-C(RcRd)-N(Re)-、-C(RaRb)-N(Rc)-O-、和-C(RaRb)-S-、-C(RaRb)-C(RcRd)-S-,其中Ra、Rb、Rc、Rd、Re和Rf各自独立地选自氢、任选取代的C1-12-烷基、任选取代的C2-12-链烯基、任选取代的C2-12-炔基、羟基、C1-12-烷氧基、C2-12-烷氧烷基、C2-12-链烯氧基、羧基、C1-12-烷氧羰基、C1-12-烷基羰基、甲酰基、芳基、芳氧基-羰基、芳氧基、芳基羰基、杂芳基、杂芳氧基-羰基、杂芳氧基、杂芳基羰基、氨基、单和双(C1-6-烷基)氨基、氨甲酰基、单和双(C1-6-烷基)氨基-羰基、氨基-C1-6-烷基-氨基羰基、单和双(C1-6-烷基)氨基-C1-6-烷基-氨基羰基、C1-6-烷基-羰氨基、脲、C1-6-烷酰氧基、砜基(sulphono)、C1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、C1-6-烷硫基、卤素、DNA嵌入剂、光化学活性基团、热化学活性基团、螯合基团、报道基团和配体,其中芳基和杂芳基可以是任选取代的并且其中两个谐位取代基Ra和Rb一起可以指任选取代的亚甲基(=CH2)。对于全部手性中心,非对称基团可以按R或S方向存在。
在又一个实施方案中,R4*和R2*一起指选自以下的双基(双价基团):-CH2-O-、-CH2-S-、-CH2-NH-、-CH2-N(CH3)-、-CH2-CH2-O-、-CH2-CH(CH3)-、-CH2-CH2-S-、-CH2-CH2-NH-、-CH2-CH2-CH2-、-CH2-CH2-CH2-O-、-CH2-CH2-CH(CH3)-、-CH=CH-CH2-、-CH2-O-CH2-O-、-CH2-NH-O-、-CH2-N(CH3)-O-、-CH2-O-CH2-、-CH(CH3)-O-和–CH(CH2-O-CH3)-O-和/或,-CH2-CH2-和-CH=CH-。对于全部手性中心,非对称基团可以按R或S方向存在。
在一些实施方案中,R4*和R2*一起指双基C(RaRb)-N(Rc)-O-,其中Ra和Rb独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基,如氢,并且其中Rc选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基,如氢。
在一些实施方案中,R4*和R2*一起指双基C(RaRb)-O-C(RcRd)-O-,其中Ra、Rb、Rc和Rd独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基,如氢。
在一些实施方案中,R4*和R2*形成双基–CH(Z)-O-,其中Z选自C1-6烷基、C2-6链烯基、C2-6炔基、取代的C1-6烷基、取代的C2-6链烯基、取代的C2-6炔基、酰基、取代的酰基、取代的酰胺、巯基或取代的硫代;并且其中每个取代的基团独立地用任选保护的取代基单取代或多取代,所述保护的取代基独立选自卤素、氧代、羟基、OJ1、NJ1J2、SJ1、N3、OC(=X)J1、OC(=X)NJ1J2、NJ3C(=X)NJ1J2和CN,其中每个J1、J2和J3独立地是H或C1-6烷基,并且X是O、S或NJ1。在一些实施方案中,Z是C1-6烷基或取代的C1-6烷基。在一些实施方案中,Z是甲基。在一些实施方案中,Z是取代的C1-6烷基。在一些实施方案中,所述取代基是C1-6烷氧基。在一些实施方案中,Z是CH3OCH2-。对于全部手性中心,非对称基团可以按R或S方向存在。这类双环核苷酸在因而通过引用方式完整并入的US7,399,845中公开。在一些实施方案中,R1*、R2、R3、R5、R5是氢。在一些实施方案中,R1*、R2、R3*是氢,并且R5、R5*一者或两者均可以除氢之外的基团,如上文和WO 2007/134181中所提及。
在一些实施方案中,R4*和R2*一起指在桥中包含取代的氨基的双基,如由双基–CH2-N(Rc)-构成或组成,其中Rc是C1–12烷氧基。在一些实施方案中,R4*和R2*一起指双基–Cq3q4-NOR-,其中q3和q4独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基;其中每个取代的基团独立地用选自以下的取代基单取代或多取代:卤素、OJ1、SJ1、NJ1J2、COOJ1、CN、O-C(=O)NJ1J2、N(H)C(=NH)NJ1J2或N(H)C(=X=N(H)J2其中X是O或S;并且每个J1和J2独立地是H、C1-6烷基、C2-6链烯基、C2-6炔基、C1-6氨烷基或保护基。对于全部手性中心,非对称基团可以按R或S方向存在。这类双环核苷酸在因而通过引用方式完整并入的WO 2008/150729中公开。在一些实施方案中,R1*、R2、R3、R5、R5独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基。在一些实施方案中,R1*、R2、R3、R5、R5是氢。在一些实施方案中,R1*、R2、R3是氢并且R5、R5*一者或两者均可以不是氢,如上文和WO 2007/134181中所提及。在一些实施方案中,R4*和R2*一起指双基(双价基团)C(RaRb)-O-,其中Ra和Rb各自独立地是卤素、C1-C12烷基、取代的C1-C12烷基、C2-C12链烯基、取代的C2-C12链烯基、C2-C12炔基、取代的C2-C12炔基、C2-C12烷氧基、取代的C2-C12烷氧基、OJ1、SJ1、SOJ1、SO2J1、NJ1J2、N3、CN、C(=O)OJ1、C(=O)NJ1J2、C(=O)J1、O-C(=O)NJ1J2、N(H)C(=NH)NJ1J2、N(H)C(=O)NJ1J2或N(H)C(=S)NJ1J2;或Ra和Rb在一起是=C(q3)(q4);q3和q4各自独立地是H、卤素、C1-C12烷基或取代的C1-C12烷基;每个取代的基团独立地用选自以下的取代基单取代或多取代:卤素、C1-C6烷基、取代的C1-C6烷基、C2-C6链烯基、取代的C2-C6链烯基、C2-C6炔基、取代的C2-C6炔基、OJ1、SJ1、NJ1J2、N3、CN、C(=O)OJ1、C(=O)NJ1J2、C(=O)J1、O-C(=O)NJ1J2、N(H)C(=O)NJ1J2或N(H)C(=S)NJ1J2;并且每个J1和J2独立地是H、C1-C6烷基、取代的C1-C6烷基、C2-C6链烯基、取代的C2-C6链烯基、C2-C6炔基、取代的C2-C6炔基、C1-C6氨烷基、取代的C1-C6氨烷基或保护基。这类化合物在因而通过引用方式完整并入的WO 2009006478A中公开。
在一些实施方案中,R4*和R2*形成双基-Q-,其中Q是C(q1)(q2)C(q3)(q4)、C(q1)=C(q3)、C[=C(q1)(q2)]-C(q3)(q4)或C(q1)(q2)-C[=C(q3)(q4)]];q1、q2、q3、q4各自独立地是H、卤素、C1-12烷基、取代的C1-12烷基、C2-12链烯基、取代的C2-12烷氧基、OJ1、SJ1、SOJ1、SO2J1、NJ1J2、N3、CN、C(=O)OJ1、C(=O)-NJ1J2、C(=O)J1、-C(=O)NJ1J2、N(H)C(=NH)NJ1J2、N(H)C(=O)NJ1J2或N(H)C(=S)NJ1J2;每个J1和J2独立地是H、C1-6烷基、C2-6链烯基、C2-6炔基、C1-6氨烷基或保护基;并且任选地其中当Q是C(q1)(q2)(q3)(q4)并且q3或q4之一是CH3时,则其他q3或q4的至少一个或q1和q2之一不是H。在一些实施方案中,R1*、R2、R3、R5、R5是氢。对于全部手性中心,非对称基团可以按R或S方向存在。这类双环核苷酸在因而通过引用方式完整并入的WO 2008/154401中公开。在一些实施方案中,R1*、R2、R3、R5、R5独立地选自氢、卤素、C1-6烷基、取代的C1-6烷基、C2-6链烯基、取代的C2-6链烯基、C2-6炔基或取代的C2-6炔基、C1-6烷氧基、取代的C1-6烷氧基、酰基、取代的酰基、C1-6氨烷基或取代的C1-6氨烷基。在一些实施方案中,R1*、R2、R3、R5、R5是氢。在一些实施方案中,R1*、R2、R3是氢并且R5、R5*一者或两者均可以不是氢,如上文和WO 2007/134181或WO 2009/067647中所提及(α-L-双环核酸类似物)。
其他双环核苷类似物及其在反义寡核苷酸中的用途在WO 2011/115818、WO 2011/085102、WO 2011/017521、WO 09/100320、WO 10/036698、WO 09/124295&WO 09/006478中公开。在一些方面,这类核苷类似物可以用于本发明的化合物中。
在一些实施方案中,在本发明的寡核苷酸化合物中使用的LNA优选地具有通式II的结构:
其中Y选自-O-、-CH2O-、-S-、-NH-、N(Re)和/或–CH2-;Z和Z*独立地选自核苷酸间键、RH、端基或保护基;B构成天然或非天然的核苷酸碱基部分(核碱基)并且RH选自氢和C1-4-烷基;Ra、Rb、Rc、Rd和Re任选地独立选自氢、任选取代的C1-12-烷基、任选取代的C2-12-烯基、任选取代的C2-12-炔基、羟基、C1-12-烷氧基、C2-12-烷氧烷基、C2-12-链烯氧基、羧基、C1-12-烷氧羰基、C1-12-烷基羰基、甲酰基、芳基、芳氧基-羰基、芳氧基、芳基羰基、杂芳基、杂芳氧基-羰基、杂芳氧基、杂芳基羰基、氨基、单和双(C1-6-烷基)氨基、氨甲酰基、单和双(C1-6-烷基)氨基-羰基、氨基-C1-6-烷基-氨基羰基、单和双(C1-6-烷基)氨基-C1-6-烷基-氨基羰基、C1-6-烷基-羰氨基、脲基、C1-6-烷酰氧基、砜基(sulphono)、C1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、C1-6-烷硫基、卤素、DNA嵌入剂、光化学活性基团、热化学活性基团、螯合基团、报道基团和配体,其中芳基和杂芳基可以是任选取代的并且其中两个谐位取代基Ra和Rb共同可以指任选取代的亚甲基(=CH2);并且RH选自氢和C1-4-烷基。在一些实施方案中,Ra,Rb Rc,Rd和Re任选地独立选自氢和C1-6烷基,如曱基。对于全部手性中心,非对称基团可以在R或S方向存在,例如,两个示例性立体化学异构体包括可以如下显示的β-D和α-L同工型:
下文显示具体的示例性LNA单元:
术语“硫代-LNA”包括一种锁核苷酸,其中以上通式中的Y选自S或-CH2-S-。硫代-LNA可以处于β-D-构型和α-L-构型。
术语“氨基-LNA”包含一种锁核苷酸,其中以上通式中的Y选自-N(H)-、N(R)-、CH2-N(H)-和-CH2-N(R)-,其中R选自氢和C1-4-烷基。氨基-LNA可以处于β-D-构型和α-L-构型。
术语“氧代-LNA”包括一种锁核苷酸,其中以上通式中的Y表示–O-。氧代-LNA可以处于β-D-构型和α-L-构型。
术语“ENA”包含一种锁核苷酸,其中以上通式中的Y是-CH2-O-(其中–CH2-O-的氧原子相对于碱基B与2’-位置连接)。Re是氢或甲基。
在一些示例性实施方案中,LNA选自β-D-氧代-LNA、α-L-氧代-LNA、β-D-氨基-LNA和β-D-硫代-LNA,尤其β-D-氧代-LNA。
LNA-修饰的反义寡核苷酸可以组合使用。例如,可以同时或分别施用针对相同基因的不同区域的几种不同LNA修饰的寡核苷酸的混合物。
头聚物(headmer)
“头聚物”定义为包含区域X’和与其相连的区域Y’的寡聚体,其中区域Y’的5’最末端单元与区域X’的3’最末端单元连接。区域X’包含一段连续的不召集RNA酶的核苷类似物,并且区域Y’包含一段由RNA酶可识别和可切割的连续(如至少7个连续单元)的DNA单元或核苷类似物单元。
尾聚物(tailmer)
“尾聚物”定义为包含区域X”和与其相连的区域Y”的寡聚体,其中区域Y”的5’最末端单元与区域X”的3’最末端单元连接。区域X”包含一段由RNA酶可识别和可切割的连续(如至少7个连续单元)的DNA单元或核苷类似物单元,并且区域X”包含一段连续的不召集RNA酶的核苷类似物。
嵌合寡聚物/混聚物
“嵌合”寡聚体,称作“混聚物”,由(i)RNA酶可识别和可切割的DNA单元或核苷类似物单元和(ii)不召集RNA酶的核苷类似物单元的交替组合物组成。
光化学活性基团
在本发明语境下,术语“光化学活性基团”指用光照射时能够发生化学反应的化合物。本文中的官能团的示意性例子是醌、尤其6-甲基-1,4-萘醌、蒽醌、萘醌和1,4-二甲基-蒽醌、二氮丙啶、芳族叠氮化物、二苯酮、补骨脂素、重氮基化合物和双吖丙啶化合物。
基于
如本文所用,术语“基于”意指寡聚物或寡聚物缀合物的寡聚物包含核心基序或序列的至少80%、优选地至少85%、优选地至少90%、优选地至少95%、优选地全部核苷酸并且任选地其中一个或多个核苷酸可以是修饰的核苷酸。
因此,对于某些实施方案,术语“基于”意指寡聚物或寡聚物缀合物的寡聚物包含核心基序或序列全部核苷酸并且任选地其中一个或多个核苷酸可以是修饰的核苷酸。
对于某些实施方案,术语“基于”意指寡聚物或寡聚物缀合物的寡聚物包含核心基序或序列全部核苷酸并且其中一个或多个核苷酸是修饰的核苷酸。
对于某些实施方案,术语“基于”意指寡聚物或寡聚物缀合物的寡聚物包含核心基序或序列的至少80%、优选地至少85%、优选地至少90%、优选地至少95%、优选地全部核苷酸并且其中一个或多个核苷酸可以是修饰的核苷酸;并且其中所述寡聚物是基序X-Y-Z的缺口聚物,其中每个X和Z独立地是包含至少一个修饰的核苷酸的翼和Y是核苷酸的中央区。
因此,对于某些实施方案,术语“基于”意指寡聚物或寡聚物缀合物的寡聚物包含核心基序或序列的全部核苷酸并且其中一个或多个核苷酸可以是修饰的核苷酸;并且其中所述寡聚物是基序X-Y-Z的缺口聚物,其中每个X和Z独立地是包含至少一个修饰的核苷酸的翼和Y是核苷酸的中央区。
稳定性
指称双链体或三链体形式的术语“稳定性”通常指反义寡核苷酸如何与其预期靶序列牢固结合;更具体地,“稳定性”指生理条件下形成双链体或三链体的自由能。(例如,如下文描述的)标准条件集合下的解链温度是双链体和/或三链体稳定性的便利量度。优选地,选择本发明的反义寡核苷酸,在反义寡核苷酸和靶核酸的链浓度均为1.5μM在100mM NaCl,0.1mM EDTA和10mM磷酸盐缓冲液水溶液,pH 7.0中测量时,所述反义寡核苷酸具有至少45℃的解链温度。因此,在生理条件下使用时,相对于其中反义寡核苷酸和其靶解离的状态,双链体或三链体形式将实质地有利。可以理解在一些实施方案中,稳定的双链体或三链体可以在碱基对之间和/或在三链体情况下碱基三联体之间包含错配。优选地,本发明的LNA修饰的反义寡核苷酸优选地与其靶核酸形成匹配的双链体和/或三链体。
强力抑制剂
在一些实施方案中,寡聚物或寡聚物缀合物是强力抑制剂,尤其是HBx或HBsAg的强力抑制剂。
如本文所用,短语“强力抑制剂”指如通过脂质胺转染测定法所测定,IC50小于5nM的寡聚物。在一些实施方案中,IC50小于4nM,如小于2nM。
如通过“裸剥(gymnosis)”所测定的“强力抑制剂”指在裸剥测定法中的或在体内AAV/HBV小鼠模型中小于5μM的IC50,其中裸剥描述了在不使用转染剂的情况下递送寡聚物至培养的细胞。在一些实施方案中,IC50小于2μM,如小于1μM。
疗法/治疗
术语“治疗”/“治疗法”等包括治愈、减轻、预防或检测中一种或多种情况。在某些优选的实施方案中,术语“治疗”/“治疗法”等意指治愈或减轻。术语“减轻”包括减轻归因于病毒性疾病或与之相关的症状和/或状况。
因此,在一些方面,本发明涉及适于治愈、减轻、防止或检测病毒性疾病的寡聚物或寡聚物缀合物及其用途和其使用方法。
因此,在某些方面,本发明涉及适于治愈或减轻病毒性疾病的寡聚物或寡聚物缀合物及其用途和其使用方法。
在一些实施方案中,如本文所用的术语’治疗’指治疗现有疾病(例如如本文中提到的疾病或病症)或防止疾病即预防。因此将认识到在一些实施方案中,如本文提到的治疗可以是预防性的。
“治疗”受试者中的疾病或病状或“治疗”患有疾病或病状的受试者指使个体接受药物治疗,例如,施用药物,从而减少或稳定该疾病或病状的至少一种症状。
需要治疗的患者是患有或可能患有该疾病或病症的患者。
“预防性治疗”受试者中的疾病或病状意指在疾病至少一种症状出现之前减少或消除疾病或病状形成的风险(即,发生率)或降低其严重程度。
活性剂
术语“活性剂”意指任何化合物,例如,抗体或治疗剂、可检测标记物(例如,标记物、示踪剂或成像化合物)。
治疗药
术语“治疗药”意指具有生物学活性的任何化合物。治疗药可以用于治疗病状或疾病。本发明的特定治疗药可以是寡聚物。特定治疗药可以是本发明的寡聚物或寡聚物缀合物。
递送所述寡聚物至肝脏
如本文所用,术语“递送所述寡聚物至肝脏”指使寡聚物与肝脏细胞或组织接触或靠近的过程。这包括递送寡聚物至肝脏内部或包围肝脏的血液供应。可以将寡聚物从进入身体的部位递送或运输至肝脏或包围肝脏的组织。
递送所述寡聚物至肝细胞
如本文所用,术语“递送所述寡聚物至肝细胞”指使寡聚物与肝细胞接触或靠近的过程。这包括递送寡聚物至肝细胞内部或包围肝细胞的血液供应。可以将寡聚物从进入身体的部位递送或运输至肝细胞。
病毒性疾病
在本发明的上下文中,术语“病毒性疾病”指与病毒性感染相关的任何病症或疾病。
药用载体/可药用载体
“药用载体”或“可药用载体”将与上文所述的本发明“载体组分”区分。在本发明的上下文中,“药用载体”和“载体组分”待作为互斥术语处理。
施用/给药
术语“施用”和“给药”意指递送模式,包括而不限于动脉内、鼻内、腹内、静脉内、肌内、皮下透皮或口服。每日剂量可以划分成一个、两个或更多个合适形式的剂量以在某个时间段期间的一个、两个或更多个时间施用。
本发明的具体描述
引言
本发明涉及寡聚物(也称作寡聚分子)和/或寡聚物缀合物。
寡聚物和寡聚物缀合物可用于治疗病毒性疾病。
在具体的实施方案中,本发明的寡聚物或寡聚物缀合物能够调节HBVHBx或HBsAg中的靶序列。
本发明的寡聚物可以与载体组分缀合。
优选地,载体组分可以能够递送寡聚物到待治疗的受试者的肝脏。
本发明因此利用寡聚物或寡聚物缀合物调节编码HBV HBx或HBsAg的核酸分子(如作为SEQ ID No:1或SEQ ID No:2展示的HBV核酸分子和这种编码HBV HBx或HBV HBsAg的核酸分子的天然存在的变体)的功能。
寡聚物特征
寡聚物或寡聚物缀合物的寡聚物可以由8-50、8-30、8-25、8-20、8-18、8-17、8-16、8-15、8-14、8-13、或8-12个核苷酸长度、优选地8-16个核苷酸长度、更优选地10至20个核苷酸长度的连续核苷酸序列组成或包含所述连续核苷酸序列。
对于一些实施方案,寡聚物或寡聚物缀合物的寡聚物可以包含10–50个如10–30、10-20、10-18、10-17、10-16、10-15、10-14、10-13或10-12个核苷酸长度、优选地10-20个核苷酸长度、更优选地10至18个核苷酸长度、最优选地10至16个核苷酸长度的连续核苷酸序列或由其组成。
对于一些实施方案,寡聚物或寡聚物缀合物的寡聚物可以包含12–50个如12–30、12-20、12-18、12-17、12-16、12-15、12-14或12-13个核苷酸长度、优选地12-16个核苷酸长度的连续核苷酸序列或由其组成。
对于一些实施方案,寡聚物或寡聚物缀合物的寡聚物可以包含8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸长度的连续核苷酸序列或由其组成。
对于一些实施方案,本发明的寡聚物或寡聚物缀合物的寡聚物组分可以包含总计8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个连续核苷酸长度的连续核苷酸序列或由其组成。
在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物包含总计自8–22个,如8-20个如8–18个,如8–17或8–16个连续核苷酸长度的连续核苷酸序列或由其组成。
在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物包含总计8、9、10、11、12、13、14、15、或16个连续核苷酸长度的连续核苷酸序列或由其组成。
在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物包含总计15或16个连续核苷酸长度的连续核苷酸序列或由其组成。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物的寡聚物由不多于22个核苷酸,如不多于20个核苷酸,如不多于个18核苷酸-如15、或16或17个核苷酸组成。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物的寡聚物优选地包含少于20个核苷酸。
应当理解,给予寡聚物或连续核苷酸序列长度的一个范围时,它包括该范围中提供的下限长度和上限长度,例如从10–30(或其之间),包括10和30。
寡核苷酸部分的长度足够地大,以确保特异性结合仅在所需的靶多核苷酸处发生并且不在其他偶然位点处发生,如许多参考文献中解释,例如,Rosenberg等人,国际申请PCT/US92/05305;或Szostak等人,Meth.Enzymol,68:419-429(1979)。长度的上限范围由几个因素决定,所述因素包括合成和纯化大于约30-40个核苷酸长度的寡聚物的不便性和花费、较长的寡核苷酸比较短的寡核苷酸更耐受错配、是否存在增强结合或特异性的修饰、是否需要双链体或三链体结合作用等。
寡聚物或寡聚物缀合物的寡聚物可以包含天然存在的核苷酸–优选地2’-脱氧核苷酸(本文总体上称作“DNA”),还可能核糖核苷酸(本文总体上称作“RNA”)的简单序列,或这类天然存在的核苷酸和一个或多个非天然存在的核苷酸(即核苷酸类似物)组合的简单序列或由其组成。这类核苷酸类似物可以适当地增强寡聚物对靶序列的亲和力。
适用和优选的核苷酸类似物的例子由WO 2007/031091提供或在其中提及。
核苷酸类似物的例子包括已经修饰的核苷酸。这类修饰的例子包括修饰糖部分以提供2’-取代基或以产生增强结合亲和力并还可以提供增加的核酸酶抗性的桥接(锁核酸)结构。这些修饰的核苷酸类似物可以因此是增强亲和力的核苷酸类似物。
在寡聚物或寡聚物缀合物的寡聚物中掺入增强亲和力的核苷酸类似物,如LNA或2’-取代的糖,可以允许减低特异结合性寡聚体的尺寸,并且还可以在非特异性结合或异常结合发生之前降低寡聚体的尺寸上限。
在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物包含至少1个核苷酸类似物。在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物包含至少2个核苷酸类似物。在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物包含2-8个核苷酸类似物,例如6或7个核苷酸类似物。在迄今最优选的实施方案中,所述核苷酸类似物至少之一是锁核酸(LNA);例如至少2、3个或至少4个、或至少5个、或至少6个、或至少7个、或8个核苷酸类似物可以是LNA。在一些实施方案中,全部核苷酸类似物均可以是LNA。
将认识到,当谈及仅由核苷酸组成的优选核苷酸序列基序或核苷酸序列时,由该序列定义的本发明的寡聚物或寡聚物缀合物的寡聚物可以包含替代一个或多个在所述序列中存在的核苷酸的相应核苷酸类似物,如LNA单元或其他核苷酸类似物,其提高寡聚体/靶双链体的双链体稳定性/Tm(即增强亲和力的核苷酸类似物)。
优选的核苷酸类似物是LNA,如氧代-LNA(如β-D-氧代-LNA和α-L-氧代-LNA),和/或氨基-LNA(如β-D-氨基-LNA和α-L-氨基-LNA)和/或硫代-LNA(如β-D-硫代-LNA和α-L-硫代-LNA)和/或ENA(如β-D-ENA和α-L-ENA)。最优选的是β-D-氧代-LNA。
在一些实施方案中,在本发明寡聚物或寡聚物缀合物的寡聚物(如在缺口聚物的区域W和区域Y中–如本文中提到)内部存在的核苷酸类似物独立选自例如:2’-O-烷基-RNA单元、2’-氨基-DNA单元、2'-氟-DNA单元,例如LNA单元、阿糖核酸(ANA)单元、2'-氟-ANA单元、HNA单元、INA(嵌入性核酸-Christensen,2002.Nucl.Acids.Res.2002 30:4918-4925,所述文献因而通过引用的方式并入)单元和2’MOE单元。在一些实施方案中,仅一个上述类型的在本发明寡聚物或其连续核苷酸序列中存在的核苷酸类似物。
在一些实施方案中,核苷酸类似物是2’-O-甲氧乙基-RNA(2’MOE)、2'-氟-DNA单元或LNA核苷酸类似物,并且本发明的寡核苷酸本身可以包含独立选自这三个类型类似物的核苷酸类似物,或可以包含选自这三个类型的仅一个类型的类似物。在一些实施方案中,至少一个所述核苷酸类似物是2’-MOE-RNA,如2、3、4、5,6、7、8、9或10个2’-MOE-RNA核苷酸单元。在一些实施方案中,至少一个所述核苷酸类似物是2'-氟DNA,如2、3、4、5,6、7、8、9或10个2'-氟DNA核苷酸单元。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物的寡聚物包含至少一种锁核酸(LNA)单元,如1、2、3、4、5、6、7或8个LNA单元,如3–7或4至8个LNA单元、或3、4、5、6或7个LNA单元。在一些实施方案中,全部核苷酸类似物均是LNA。
在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物可以包含β-D-氧代-LNA和以下一个或多个LNA单元:处于β-D构型或α-L构型或其组合的硫代-LNA、氨基-LNA、氧代-LNA和/或ENA。在一些实施方案中,全部LNA胞嘧啶单元均是5’甲基-胞嘧啶。
在本发明的一些实施方案中,寡聚物或寡聚物缀合物的寡聚物可以包含LNA单元和DNA单元。优选地,LNA单元和DNA单元的合计总数是10-25,如10–24、优选地10-20,如10–18、甚至更优选地12-16。在本发明的一些实施方案中,寡聚物的核苷酸序列如连续核苷酸序列由至少一个LNA组成,并且剩余的核苷酸单元是DNA单元。
在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物仅包含LNA核苷酸类似物和天然存在的核苷酸(如RNA或DNA,最优选地DNA核苷酸),任选地带有修饰的核苷酸间键如硫代磷酸酯。
在一些实施方案中,在寡聚物的核苷酸序列和靶序列之间的任何错配优选地存在于增强亲和力的核苷酸类似物外部的区域内。缺口聚物中这类在增强亲和力的核苷酸类似物外部的区域的例子包括如本文提到的区域X和/或如本文提到的区域V和/或如本文提到的区域Z、和/或在寡核苷酸中非修饰的核苷酸位点处和/或在对于连续核苷酸序列为5’或3’的区域内。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物的寡聚物不包含RNA(单元)。优选本发明的寡聚物或寡聚物缀合物的寡聚物是线型分子或作为线型分子合成。优选地,寡聚物或寡聚物缀合物的寡聚物是单链分子,并且优选地不包含例如至少3、4或5个连续核苷酸的短区域,所述短区域与相同寡聚物内部的等同区域互补(即双链体)。在这个方面,寡聚物或寡聚物缀合物的寡聚物(基本上)不是双链的。在一些实施方案中,寡聚物或寡聚物缀合物的寡聚物基本上是单链的。在多种实施方案中,本发明的寡聚物或寡聚物缀合物的寡聚物可以完全由连续核苷酸区域组成。因此,优选地寡聚物或寡聚物缀合物的寡聚物基本上不自身互补。
因此,在某些方面,本发明提供了具有5–50个,如5–30个、或如5-20个,如8–30个,如8-20,如8-18个,如8-16个,如10-16个,如10-15个,如12-16个,如12-15个核苷酸长度的寡聚物组分的寡聚物或寡聚物缀合物,所述寡聚物组分包含总计至少5个如至少8个核苷酸的连续核苷酸序列(第一区域),其中所述连续核苷酸序列(第一区域)至少80%(例如,85%、90%、95%、98%、或99%)同源于这样的区域,所述区域对应于HBV HBx或HBsAg基因或mRNA(如SEQ ID No:1、SEQ ID No:2和SEQ ID No:3任一者内部的任何序列)或其天然存在的变体的反向互补序列。因此,例如,寡聚物或寡聚物缀合物的寡聚物组分杂交至具有SEQ ID No:1、SEQ ID No:2和SEQ ID No:3任一者的一部分的序列、优选地SEQ ID No:1和SEQ ID No:2任一者内部序列的单链核酸分子。寡聚物或寡聚物组分可以与单链核酸分子杂交,所述单链核酸分子具有如SEQ ID No:3的位置200至1900所示部分序列的序列。寡聚物或寡聚物缀合物的寡聚物组分可以与单链核酸分子杂交,所述单链核酸分子具有如SEQ ID NO:3的位置1264至1598或691至706所示的序列。寡聚物或寡聚物缀合物的寡聚物组分可以与单链核酸分子杂交,所述单链核酸分子具有选自SEQ ID NO:3中以下位置的序列:位置1至1944、位置157至1840、位置1196至1941、位置1376至1840和位置3158-3182。优选地,寡聚物缀合物与单链核酸分子杂交,所述单链核酸分子具有在SEQ ID NO:3的位置1530至1598内部、更优选在SEQ ID NO:3的位置1577至1598内部和最优选地在SEQ ID NO:3的位置1530至1543内部选出的序列。寡聚物或寡聚物缀合物的寡聚物组分可以与单链核酸分子杂交,所述单链核酸分子选自SEQ ID NO:3的以下位置:1264-1278;1265-1277;1530-1543;1530-1544;1531-1543;1551-1565;1551-1566;1577-1589;1577-1591;1577-1592;1578-1590;1578-1592;1583-1598;1584-1598;和1585-1598;或670-706、691-705;691-706;692-706;693-706;和694-706。优选地,寡聚物或寡聚物缀合物的寡聚物组分可以与单链核酸分子杂交,所述单链核酸分子在SEQ ID NO:3的位置1530至1598、更优选地SEQ ID NO:3的位置1530-1543或位置1577-1598内部。
对于某些实施方案,本发明提供寡聚物或具有寡聚物的寡聚物缀合物,所述寡聚物基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834),
所述寡聚物能够调节HBV的HBx或HBsAg中的靶序列以治疗病毒性疾病。
寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
AGCgaagtgcacACG(SEQ ID NO:310)
AGgtgaagcgaAGTG(SEQ ID NO:668);
AGCgaagtgcacaCGG(SEQ ID NO:308);
CGAaccactgaACA(SEQ ID NO:297);
CGCagtatggaTC(SEQ ID NO:300);
AGGtgaagcgaagTGC(SEQ ID NO:315);
AGGtgaagcgaaGTG(SEQ ID NO:316);
GAAccactgaacAAA(SEQ ID NO:294);
CGAaccactgaacAAA(SEQ ID NO:295);
CGAaccactgaaCAA(SEQ ID NO:296);
CGAaccactgaAC(SEQ ID NO:298);
CCGcagtatggaTCG(SEQ ID NO:299);
CGCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagaCGG(SEQ ID NO:304);
GAGaaggcacagaCGG(SEQ ID NO:305);
GAAgtgcacacGG(SEQ ID NO:306);
GCGaagtgcacaCGG(SEQ ID NO:307);
CGAagtgcacaCG(SEQ ID NO:309);
GAAccactgaaCAAA(SEQ ID NO:585);
CGAAccactgaacAAA(SEQ ID NO:588);
GAAgtgcacaCGG(SEQ ID NO:628);
TAGtaaactgagCCA(SEQ ID NO:678);
CGAaccactgAAC(SEQ ID NO:600);
AGGtgaagcgaAGT(SEQ ID NO:317);和
CGAaccactgAACA(SEQ ID NO:597),
其中大写字母指LNA单元并且小写字母指DNA单元。
在某些实施方案中,寡聚物、或额外的寡聚物、或寡聚物缀合物的寡聚物组分、或额外的寡聚物缀合物的寡聚物组分可以包含序列,所述序列基于选自以下列表的序列:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15);
AGCGAAGTGCACACGG(SEQ ID NO:18);
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
AGCGAAGTGCACACG(SEQ ID NO:20);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGTG(SEQ ID NO:26);和
AGGTGAAGCGAAGT(SEQ ID NO:27)。
在另一个实施方案中,基序序列选自:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);和
AGCGAAGTGCACACGG(SEQ ID NO:18)。
在另一个实施方案中,基序序列选自GCGTAAAGAGAGG(SEQ ID NO:13)、GCGTAAAGAGAGGT(SEQ ID NO:11)和CGCGTAAAGAGAGGT(SEQ ID NO:12)。
在另一个实施方案中,基序序列选自AGCGAAGTGCACACG(SEQ ID NO:20);AGGTGAAGCGAAGTG(SEQ ID NO:26);AGCGAAGTGCACACGG(SEQ ID NO:18);GAAGTGCACACGG(SEQ ID NO:16);GCGAAGTGCACACGG(SEQ ID NO:17);CGAAGTGCACACG(SEQ ID NO:19)和AGGTGAAGCGAAGT(SEQ ID NO:27)。
在另一个实施方案中,基序序列选自CGAACCACTGAACA(SEQ ID NO:7);GAACCACTGAACAAA(SEQ ID NO:4);CGAACCACTGAACAAA(SEQ ID NO:5);CGAACCACTGAACAA(SEQ ID NO:6);CGAACCACTGAAC(SEQ ID NO:8)和TAGTAAACTGAGCCA(SEQ ID NO:834)。
在另一个实施方案中,基序序列选自CCGCAGTATGGATCG(SEQ ID NO:9)和CGCAGTATGGATC(SEQ ID NO:10)。
在另一个实施方案中,基序序列选自AGAAGGCACAGACGG(SEQ ID NO:14)和GAGAAGGCACAGACGG(SEQ ID NO:15)。
在某些实施方案中,寡聚物、或额外的寡聚物、或寡聚物缀合物的寡聚物组分、或额外的寡聚物缀合物的寡聚物组分可以包含选自下文提供的序列或由其组成:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
AGCgaagtgcacACG(SEQ ID NO:310)
AGgtgaagcgaAGTG(SEQ ID NO:668);
AGCgaagtgcacaCGG(SEQ ID NO:308);
CGAaccactgaACA(SEQ ID NO:297);
CGCagtatggaTC(SEQ ID NO:300);
AGGtgaagcgaagTGC(SEQ ID NO:315);
AGGtgaagcgaaGTG(SEQ ID NO:316);
GAAccactgaacAAA(SEQ ID NO:294);
CGAaccactgaacAAA(SEQ ID NO:295);
CGAaccactgaaCAA(SEQ ID NO:296);
CGAaccactgaAC(SEQ ID NO:298);
CCGcagtatggaTCG(SEQ ID NO:299);
CGCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagaCGG(SEQ ID NO:304);
GAGaaggcacagaCGG(SEQ ID NO:305);
GAAgtgcacacGG(SEQ ID NO:306);
GCGaagtgcacaCGG(SEQ ID NO:307);
CGAagtgcacaCG(SEQ ID NO:309);
GAAccactgaaCAAA(SEQ ID NO:585);
CGAAccactgaacAAA(SEQ ID NO:588);
GAAgtgcacaCGG(SEQ ID NO:628);
TAGtaaactgagCCA(SEQ ID NO:678);
CGAaccactgAAC(SEQ ID NO:600);
AGGtgaagcgaAGT(SEQ ID NO:317);和
CGAaccactgAACA(SEQ ID NO:597)。
其中大写字母指增强亲和力的核苷酸类似物并且小写字母指DNA单元。
在另一个实施方案中,序列选自:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
CGCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagaCGG(SEQ ID NO:304);
GAGaaggcacagaCGG(SEQ ID NO:305);
GAAgtgcacacGG(SEQ ID NO:306);
GCGaagtgcacaCGG(SEQ ID NO:307);
GAAgtgcacaCGG(SEQ ID NO:628);
AGCgaagtgcacaCGG(SEQ ID NO:308);
CGAagtgcacaCG(SEQ ID NO:309);
AGCgaagtgcacACG(SEQ ID NO:310)
AGGtgaagcgaagTGC(SEQ ID NO:315);
AGGtgaagcgaaGTG(SEQ ID NO:316);
AGGtgaagcgaAGT(SEQ ID NO:317);和
AGgtgaagcgaAGTG(SEQ ID NO:668)。
在一个实施方案中,序列选自:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
AGCgaagtgcacACG(SEQ ID NO:310)
AGgtgaagcgaAGTG(SEQ ID NO:668);和
AGCgaagtgcacaCGG(SEQ ID NO:308)。
在一个实施方案中,序列选自GCGtaaagagaGG(SEQ ID NO:303)GCGtaaagagaGGT(SEQ ID NO:301);GCGtaaagagAGG(SEQ ID NO:618)和CGCgtaaagagaGGT(SEQ ID NO:302)。
在另一个实施方案中,序列选自AGCgaagtgcacACG(SEQ ID NO:310);AGGtgaagcgaagTGC(SEQ ID NO:315);AGGtgaagcgaaGTG(SEQ ID NO:316);GAAgtgcacaCGG(SEQ ID NO:628);AGgtgaagcgaAGTG(SEQ ID NO:668);AGCgaagtgcacaCGG(SEQ ID NO:308);GAAgtgcacacGG(SEQ ID NO:306);GCGaagtgcacaCGG(SEQ ID NO:307);CGAagtgcacaCG(SEQ ID NO:309);和AGGtgaagcgaAGT(SEQ ID NO:317)。
在另一个实施方案中,序列选自CGAaccactgaACA(SEQ ID NO:297);GAAccactgaacAAA(SEQ ID NO:294);CGAaccactgaacAAA(SEQ ID NO:295);CGAaccactgaaCAA(SEQ ID NO:296);CGAaccactgaAC(SEQ ID NO:298);CGAaccactgAACA(SEQ ID NO:597)和TAGtaaactgagCCA(SEQ ID NO:678)。
在另一个实施方案中,序列选自CCGcagtatggaTCG(SEQ ID NO:299)和CGCagtatggaTC(SEQ ID NO:300)。
在另一个实施方案中,序列选自AGAaggcacagaCGG(SEQ ID NO:304)和GAGaaggcacagaCGG(SEQ ID NO:305)。
寡聚物缀合物可以基于选自以下任一者或多者的序列:
其中大写字母指β-D-氧代-LNA单元;小写字母指DNA单元;下标“s”指硫代磷酸酯键;上标m指含有5-甲基胞嘧啶碱基的DNA或β-D-氧代-LNA单元;GN2-C6指带有C6接头的GalNAc2载体组分。
在另一个实施方案中,寡聚物缀合物选自:
在另一个实施方案中,寡聚物缀合物选自:
在另一个实施方案中,寡聚物缀合物选自:
在另一个实施方案中,寡聚物缀合物选自:
在另一个实施方案中,寡聚物缀合物选自:
在另一个实施方案中,寡聚物缀合物选自:
5'-GN2-C6 camCsmCsGscsasgstsastsgsgsasTsmCsG-3' (SEQ ID NO:802)
5'-GN2-C6 camCsGsmCsasgstsastsgsgsasTsmC-3' (SEQ ID NO:813)
在另一个实施方案中,寡聚物缀合物选自:
5'-GN2-C6 caAsGsAsasgsgscsascsasgsasmCsGsG-3' (SEQ ID NO:804)
5'-GN2-C6 caGsAsGsasasgsgscsascsasgsasmCsGsG-3' (SEQ ID NO:805)
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序GCGTAAAGAGAGG(SEQ ID NO:13)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序AGCGAAGTGCACACG(SEQ ID NO:20)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序GCGTAAAGAGAGGT(SEQ ID NO:11)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序AGGTGAAGCGAAGTG(SEQ ID NO:26)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序AGCGAAGTGCACACGG(SEQ ID NO:18)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序CGAaccactgaACA(SEQ ID NO:7)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由序列基序CCGCAGTATGGATCG(SEQ ID NO:9)或其子序列组成或包含或基于所述序列基序或其子序列。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由GCGtaaagagaGG(SEQ ID NO:303)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由GCGtaaagagaGGT(SEQ ID NO:301)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由GCGtaaagagAGG(SEQ ID NO:618)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由AGCgaagtgcacACG(SEQ ID NO:310)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由AGgtgaagcgaAGTG(SEQ ID NO:668)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由AGCgaagtgcacaCGG(SEQ ID NO:308)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由CGAaccactgaACA(SEQ ID NO:297)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物由CCGcagtatggaTCG(SEQ ID NO:299)组成或包含或基于前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 caGsmCsGstsasasasgsasgsasGsG-3'(SEQ ID NO:815)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 caGsmCsGstsasasasgsasgsasGsGsT-3'(SEQ ID NO:814)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 caGsmCsGstsasasasgsasgsAsGsG-3'(SEQ ID NO:825)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 caAsGsmCsgsasasgstsgscsascsAsmCsG-3'(SEQ ID NO:808)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5’-GN2-C6 caAsGsgstsgsasasgsmcsgsasAsGsTsG-3'(SEQ ID NO:826)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 caAsGsmCsgsasasgstsgscsascsasmCsGsG-3'(SEQ ID NO:807)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 camCsGsAsascscsascstsgsasAsmCsA-3'(SEQ ID NO:811)组成或包含前者。
在一些实施方案中,本发明的寡聚物缀合物由5'-GN2-C6 camCsmCsGscsasgstsastsgsgsasTsmCsG-3'(SEQ ID NO:802)组成或包含前者。
缺口聚物
优选地,本发明的寡聚物或寡聚物缀合物的寡聚物组分是缺口聚物(有时称作缺口聚物寡聚物)。优选地,寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,其中每个翼独立地包含一个或多个LNA单元。
一般,本发明的缺口聚物寡聚物或本发明的寡聚物缀合物的缺口聚物寡聚物组分可以由以下任一式代表:
W–X–Y;
V-W–X–Y;
W–X–Y–Z;
V-W–X–Y-Z;
其中对于每个式:
W代表一个或多个增强亲和力的核苷酸类似物的区域(区域W)
X代表包含一段能够召集RNA酶的核苷酸的区域(区域X)
Y代表一个或多个增强亲和力的核苷酸类似物的区域(区域Y)
V代表一个或多个核苷酸单元的区域(区域V)
Z代表一个或多个核苷酸单元的区域(区域Z)。
区域V、W、X、Y或Z的任一者可以含有额外的核苷酸或增强亲和力的核苷酸类似物。
因此,缺口聚物寡聚物一般是这样的寡聚物,所述寡聚物包含能够召集RNA酶如RNA酶H的一段连续核苷酸,如至少6或7个DNA核苷酸的作为区域X的区域;其中区域X在5’和3’均旁侧分布有增强亲和力的核苷酸类似物(如在能够召集RNA酶的一段连续核苷酸5’和3’的1–6个核苷酸类似物)的区域–-这些区域分别是区域W和区域Y。
在一些实施方案中,能够召集RNA酶的单元选自DNA单元、α-L-LNA单元、C4’烷基化DNA单元(参见PCT/EP 2009/050349和Vester等人,Bioorg.Med.Chem.Lett.18(2008)2296–2300,所述文献因而通过引用的方式并入),和UNA(未连接的核酸)核苷酸(参见Fluiter等人,Mol.Biosyst.,2009,10,1039,所述文献因而通过引用的方式并入)。UNA是非锁核酸,通常其中核糖的C2–C3C-C键已经移除,形成非锁定的“糖”残基。优选地,缺口聚物包含(5’至3’)式W-X-Y或任选地W-X-Y-Z或V-W-X-Y的(多)核苷酸序列,其中:区域W(W)(5’区域)由至少一个核苷酸类似物(如至少一个LNA单位,如1-6个核苷酸类似物,如LNA单位)组成或包含前者;并且;区域X(X)由(在与互补性RNA分子(如mRNA靶)构成双链体时)能够召集RNA酶的至少五个连续核苷酸(如DNA核苷酸)组成或包含前者;并且区域Y(Y)(3’区)由至少一个核苷酸类似物(如至少一个LNA单位,如1-6个核苷酸类似物,如LNA单位)组成或包含前者,并且当存在时,区域V(V)和/或区域Z(Z)由1、2或3个核苷酸单元(如DNA核苷酸)组成或包含前者。
在一些实施方案中,区域W由1、2、3、4、5或6个核苷酸类似物,如LNA单元,如2-5个核苷酸类似物,如2-5个LNA单元,如3或4个核苷酸类似物,如2、3或4个LNA单元组成。
在一些实施方案中,区域Y由1、2、3、4、5或6个核苷酸类似物,如LNA单元,如2-5个核苷酸类似物,如2-5个LNA单元,如2、3或4个核苷酸类似物,如3或4个LNA单元组成。
在一些实施方案中,区域X由5、6、7、8、9、10、11或12个能够召集RNA酶的连续核苷酸或6-10个或7-9个,如8个能够召集RNA酶的连续核苷酸组成或包含前者。
在一些实施方案中,区域X由至少一个DNA核苷酸单位,如1-12个DNA单位,优选地4-12个DNA单位,更优选地6-10个DNA单位,如7-10个DNA个单位,最优选地8、9或10个DNA单位组成或包含前者。
在一些实施方案中,区域W由2、3或4个核苷酸类似物如LNA组成,区域X由7、8、9或10个DNA单位组成,并且区域Y由2、3或4个核苷酸类似物如LNA组成。这类设计包括(W-X-Y)3-10-3、3-10-4、4-10-3、3-9-3、3-9-4、4-9-3、3-8-3、3-8-4、4-8-3、3-7-3、3-7-4、4-7-3、3-10-2、3-9-2、3-8-2、3-7-2、4-10-2、4-9-2、4-8-2、4-7-2;并且还可以包括可以具有1、2或3个核苷酸单元如DNA单元的区域V和/或可以具有1、2或3个核苷酸单元如DNA单元的区域Z。
其他缺口聚物设计在WO 2004/046160中公开,所述文献因而通过引用的方式并入。WO 2008/113832,其要求来自通过引用方式并入的美国临时申请60/977,409的优先权,涉及‘短聚物(shortmer)’缺口聚物寡聚物。在一些实施方案中,这里呈现的寡聚物可以是这类短聚物缺口聚物。
在一些实施方案中,寡聚物由总计10、11、12、13或14个核苷酸单元的连续核苷酸序列组成,其中连续核苷酸序列具有(5’–3’)式W-X-Y、或任选地W-X-Y-Z或V-W-X-Y,其中;W由1、2或3个核苷酸类似物单元如LNA单元组成;X由7、8或9个(在与互补性RNA分子(如mRNA靶)构成双链体时)能够召集RNA酶的连续核苷酸单元组成;并且Y由1、2或3个核苷酸类似物单元如LNA单元组成。当存在时,V由1或2个DNA单元组成。当存在时,Z由1或2个DNA单元组成。
在一些实施方案中,W由1个LNA单元组成。在一些实施方案中,W由2个LNA单元组成。在一些实施方案中,W由3个LNA单元组成。
在一些实施方案中,Y由1个LNA单元组成。在一些实施方案中,Y由2个LNA单元组成。在一些实施方案中,Y由3个LNA单元组成。
在一些实施方案中,X由7个核苷酸单元组成。在一些实施方案中,X由8个核苷酸单元组成。在一些实施方案中,X由9个核苷酸单元组成。在某些实施方案中,区域X由10个核苷单元组成。在某些实施方案中,区域X包含1–10个DNA单元。在一些实施方案中,X包含1–9个DNA单元,如2、3、4、5、6、7、8或9个DNA单元。在一些实施方案中,X由DNA单元组成。在一些实施方案中,X包含至少一个处于α-L构型的LNA单元,如2、3、4、5、6、7、8或9个处于α-L构型的LNA单元。在一些实施方案中,X包含至少一种α-L-氧代LNA单元或其中全部处于α-L构型的LNA单元均是α-L-氧代LNA单元。
在一些实施方案中,W-X-Y中存在的核苷酸数目选自(核苷酸类似物单元–区域X–核苷酸类似物单元):1-8-1、1-8-2、2-8-1、2-8-2、3-8-3、2-8-3、3-8-2、4-8-1、4-8-2、1-8-4、2-8-4;或1-9-1、1-9-2、2-9-1、2-9-2、2-9-3、3-9-2、1-9-3、3-9-1、4-9-1、1-9-4;或1-10-1、1-10-2、2-10-1、2-10-2、1-10-3、3-10-1、3-10-2、2-10-3、3-10-3。
在一些实施方案中,W-X-Y中的核苷酸数目选自:2-7-1、1-7-2、2-7-2、3-7-3、2-7-3、3-7-2、3-7-4和4-7-3;在一些实施方案中,优选的基序是3-10-3、3-9-3、3-8-3、3-8-2。
在某些实施方案中,区域W和Y各自由2或3个LNA单元组成,并且区域X由8或9或10个核苷单元、优选地DNA单元组成。
在一些实施方案中,W和Y均各自由2或3个LNA单元组成,并且X由8个或9个核苷酸单元、优选地DNA单元组成。
在多种实施方案中,其他缺口聚物设计包含这些设计,其中区域W和/或Y由3、4、5或6个核苷类似物如含有2’-O-甲氧乙基-核糖(2’-MOE)的单元或含有2'-氟-脱氧核糖的单元组成,并且区域X由8、9、10,11或12个核苷如DNA单元组成,其中区域W-X-Y具有3-9-3、3-10-3、5-10-5或4-12-4个单元。
其他缺口聚物设计在WO 2007/146511A2中公开,所述文献因而通过引用的方式并入。
因此,寡聚物或寡聚物缀合物的寡聚物组分可以在上述序列的5'末端包含至少1个、至少2个或至少3个修饰的核苷酸。例如,一个或多个、优选地全部修饰的核苷酸可以是LNA单元。
寡聚物或寡聚物缀合物的寡聚物组分可以在上述序列的3'末端包含至少1个、至少2个或至少3个修饰的核苷酸。例如,一个或多个、优选地全部修饰的核苷酸可以是LNA单元。
寡聚物或寡聚物缀合物的寡聚物组分可以在本文公开的序列的5’和/或3’末端包含至少1个、至少2个或至少3个修饰的核苷酸。例如,一个或多个、优选地全部修饰的核苷酸可以是LNA单元。
对于某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以在本文公开的序列的5’和/或3’末端包含至少2个或至少3个修饰的核苷酸。例如,两个或多个、优选地全部核苷酸可以是LNA单元。
对于某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以在本文公开的序列的5’和/或3’末端包含至少3个修饰的核苷酸。例如,三个或更多个、优选地全部修饰的核苷酸可以是LNA单元。
对于某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以在本文公开的序列的5’和/或3’末端包含3个修饰的核苷酸。例如,修饰的核苷酸可以是LNA单元。
对于某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以在本文公开的序列的5’末端和在3'末端包含3个修饰的核苷酸。例如,一个或多个、优选地全部修饰的核苷酸可以是LNA单元。
对于一些实施方案,寡聚物可以包含额外的CA二核苷酸基序。
在某些方面,优选地寡聚物不是GAGGCATAGCAGCAGG(SEQ ID NO:102)。
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分包含以下任一个基序:2-8-2、3-8-3、2-8-3、3-8-2、2-9-2、3-9-3、2-9-3、3-9-2、2-10-2、3-10-3、3-10-2、2-10-3,其中第一数字是LNA翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是LNA翼区中LNA单元的数目。
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分包含以下任一个基序:3-8-3、3-8-2、3-9-3、3-9-2、3-10-3、3-10-2,其中第一数字是LNA翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是LNA翼区中LNA单元的数目。
对于某些实施方案,本发明提供如本文定义的寡聚物或寡聚物缀合物,其中寡聚物或寡聚物缀合物的寡聚物组分是缺口聚物,并且其中整个序列包含至少6、优选地至少7、优选地至少8、优选地至少9、优选地至少10个单元、优选地至少11个单元、优选地至少12个单元,所述单元与下述区域至少80%、至少85%、至少90%、至少95%、至少98%相同,所述区域与HBV HBx基因的部分(如SEQ ID No.1的部分)或HBsAg基因的部分(如SEQ ID No.2)或与编码HBV HBx或HBV HBsAg的核酸的靶区域的反向互补序列对应。
对于某些实施方案,本发明提供如本文定义的寡聚物或寡聚物缀合物,其中寡聚物或寡聚物缀合物的寡聚物组分是缺口聚物,并且其中中央区域的序列包含至少6、优选地至少7、优选地至少8、优选地至少9、优选地至少10个单元,所述单元与下述区域至少80%、至少85%、至少90%、至少95%、至少98%相同,所述区域与HBV HBx基因的部分(如SEQ ID No.1的部分)或HBsAg基因的部分(如SEQ ID No.2)或与编码HBV HBx或HBV HBsAg的核酸的靶区域的反向互补序列对应。
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834),
其中,三至四个5’末端核苷酸中的2、3或4个是修饰的核苷酸,例如LNA单元;和三至四个3’末端核苷酸中的1、2、3或4个是修饰的核苷酸,例如LNA单元。
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
GCGTAAAGAGAGG(SEQ ID NO:13);
AGCGAAGTGCACACG(SEQ ID NO:20);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834),
其中
三个5’末端核苷酸中的2或3个是修饰的核苷酸,例如LNA单元;
三个3’末端核苷酸中的2或3个是修饰的核苷酸,例如LNA单元;
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834),
其中
三个5’末端核苷酸是修饰的核苷酸,例如LNA单元;
三个3’末端核苷酸中的2或3个是修饰的核苷酸,例如LNA单元;
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
AGCgaagtgcacACG(SEQ ID NO:310)
AGgtgaagcgaAGTG(SEQ ID NO:668);
AGCgaagtgcacaCGG(SEQ ID NO:308);
CGAaccactgaACA(SEQ ID NO:297);
CGCagtatggaTC(SEQ ID NO:300);
AGGtgaagcgaagTGC(SEQ ID NO:315)
AGGtgaagcgaaGTG(SEQ ID NO:316);
GAAccactgaacAAA(SEQ ID NO:294);
CGAaccactgaacAAA(SEQ ID NO:295);
CGAaccactgaaCAA(SEQ ID NO:296);
CGAaccactgaAC(SEQ ID NO:298);
CCGcagtatggaTCG(SEQ ID NO:299);
CGCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagaCGG(SEQ ID NO:304);
GAGaaggcacagaCGG(SEQ ID NO:305);
GAAgtgcacacGG(SEQ ID NO:306);
GCGaagtgcacaCGG(SEQ ID NO:307);
CGAagtgcacaCG(SEQ ID NO:309);
GAAccactgaaCAAA(SEQ ID NO:585);
CGAAccactgaacAAA(SEQ ID NO:588);
GAAgtgcacaCGG(SEQ ID NO:628);
TAGtaaactgagCCA(SEQ ID NO:678);
CGAaccactgAAC(SEQ ID NO:600);
AGGtgaagcgaAGT(SEQ ID NO:317);和
CGAaccactgAACA(SEQ ID NO:597),
其中大写字母指可以是修饰的核苷酸(例如LNA单元)的核苷酸。
对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
其中
大写字母指β-D-氧代-LNA单元;
小写字母指DNA单元;
下标“s”指硫代磷酸酯键;
上标m指含有5-甲基胞嘧啶碱基的DNA或β-D-氧代-LNA单元;
AM-C6是氨基-C6接头;其中5’末端基团“AM-C6c a”是任选的。
AM-C6是氨基-C6接头:经由磷酸二酯或硫代磷酸酯连接的寡核苷酸5'末端中的6-氨基己醇
因此,对于本发明的某些实施方案,寡聚物或寡聚物缀合物的寡聚物组分可以基于选自以下任一者或多者的序列:
GmCGtaaagagaGG(SEQ ID NO:303);
GmCGtaaagagaGGT(SEQ ID NO:301);
GmCGtaaagagAGG(SEQ ID NO:618);
AGmCgaagtgcacAmCG(SEQ ID NO:310)
AGgtgaagmcgaAGTG(SEQ ID NO:668);
AGmCgaagtgcacamCGG(SEQ ID NO:308);
mCGAaccactgaAmCA(SEQ ID NO:297);
mCGmCagtatggaTmC(SEQ ID NO:300);
AGGtgaagcgaagTGC(SEQ ID NO:315);
AGGtgaagmcgaaGTG(SEQ ID NO:316);
GAAccactgaacAAA(SEQ ID NO:294);
mCGAaccactgaacAAA(SEQ ID NO:295);
mCGAaccactgaamCAA(SEQ ID NO:296);
mCGAaccactgaAmC(SEQ ID NO:298);
mCmCGcagtatggaTmCG(SEQ ID NO:299);
mCGmCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagamCGG(SEQ ID NO:304);
GAGaaggcacagamCGG(SEQ ID NO:305);
GAAgtgcacamcGG(SEQ ID NO:306);
GmCGaagtgcacamCGG(SEQ ID NO:307);
mCGAagtgcacamCG(SEQ ID NO:309);
GAAccactgaamCAAA(SEQ ID NO:585);
mCGAAccactgaacAAA(SEQ ID NO:588)
GAAgtgcacamCGG(SEQ ID NO:628);
TAGtaaactgagmCmCA(SEQ ID NO:678);
mCGAaccactgAAmC(SEQ ID NO:600);
AGGtgaagmcgaAGT(SEQ ID NO:317);和
mCGAaccactgAAmCA(SEQ ID NO:597),
其中
大写字母指β-D-氧代-LNA单元;
小写字母指DNA单元;
全部核苷间键均是硫代磷酸酯键;
上标m指含有5-甲基胞嘧啶碱基的DNA或β-D-氧代-LNA单元。
在某些优选的方面,寡聚物或寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中修饰的核苷酸的数目,所述修饰的核苷酸优选地至少一个是LNA单元、优选地全部是LNA单元;第二数字是缺口区中修饰的核苷酸的数目,所述修饰的核苷酸优选地至少一个是LNA单元、优选地全部是LNA单元;并且第三数字是翼区中修饰的核苷酸的数目,所述修饰的核苷酸优选地至少一个是LNA单元、优选地全部是LNA单元。
如所示,本发明的寡聚物可以包含或可以是缺口聚物。备选表述,缺口聚物寡聚物是一种寡聚物,所述寡聚物包含能够召集RNA酶如RNA酶H的一段连续核苷酸,如至少6或7个DNA核苷酸的区域,本文中称作区域GH(GH),其中区域GH在5’和3’旁侧分布有增强亲和力的核苷酸类似物的区域(如在能够召集RNA酶的一段连续核苷酸5’和3’的1–6个核苷酸类似物)–这些区域称作区域GX’(GX’)和GZ’(GZ’)。区域GX、GH和GZ分别对应于区域W、X和Y。
在一些实施方案中,能够召集RNA酶的单元选自DNA单元、α-L-LNA单元、C4’烷基化DNA单元(参见PCT/EP 2009/050349和Vester等人,Bioorg.Med.Chem.Lett.18(2008)2296–2300,所述文献因而通过引用的方式并入),和UNA(未连接的核酸)核苷酸(参见Fluiter等人,Mol.Biosyst.,2009,10,1039,所述文献因而通过引用的方式并入)。UNA是非锁核酸,通常其中核糖的C2–C3C-C键已经移除,形成非锁定的“糖”残基。优选地,缺口聚物包含(5’至3’)式GX’-GH-GZ’的(多)核苷酸序列,其中区域GX’(GX’)(5’区域)由至少一个核苷酸类似物(如至少一个BNA(例如LNA)单元,如1-6个核苷酸类似物,如BNA(例如LNA)单元)组成或包含前者,并且区域GH(H)由(在与互补性RNA分子(如mRNA靶)构成双链体时)能够召集RNA酶的至少五个连续核苷酸(如DNA核苷酸)组成或包含前者,并且区域GZ’(GZ’)(3’区域)由至少一个核苷酸类似物(如至少一个BNA(例如,LNA单元),如1-6个核苷酸类似物,如BNA(例如LNA)单元)组成或包含前者。
在一些实施方案中,区域GX’由1、2、3、4、5或6个核苷酸类似物,如BNA(例如LNA)单元,如2-5个核苷酸类似物,如2-5个LNA单元,如3个或4个核苷酸类似物,如3个或4个LNA单元组成;和/或区域GZ’由1、2、3、4、5或6个核苷酸类似物,如BNA(例如LNA)单元,如2-5个核苷酸类似物,如2-5个BNA(例如LNA单元),如3个或4个核苷酸类似物,如3个或4个BNA(例如LNA)单元组成。
在一些实施方案中,GH由5、6、7、8、9、10、11或12个能够召集RNA酶的连续核苷酸或6-10个或7-9个,如8个能够召集RNA酶的连续核苷酸组成或包含前者。在一些实施方案中,区域GH由至少一个DNA核苷酸单位,如1-12个DNA单位,优选地4-12个DNA单位,更优选地6-10个DNA单位,如7-10个DNA个单位,最优选地8、9或10个DNA单位组成或包含前者。
在一些实施方案中,区域GX’由3个或4个核苷酸类似物如BNA(例如LNA)组成,区域X’由7、8、9或10个DNA单元组成,并且区域Z’由3个或4个核苷酸类似物如BNA(例如LNA)组成。这类设计包括(GX’-GH-GZ’)3-10-3、3-10-4、4-10-3、3-9-3、3-9-4、4-9-3、3-8-3、3-8-4、4-8-3、3-7-3、3-7-4、4-7-3。
在一些实施方案中,寡聚物,例如区域GX’,由总计10、11、12、13或14个核苷酸单元的连续核苷酸序列组成,其中连续核苷酸序列包含或具有(5’–3’)式GX’-GH-GZ’,其中;GX’由1、2或3个核苷酸类似物单元,如BNA(例如LNA)单元组成;在与互补性RNA分子(如mRNA靶)构成双链体时,GH由7、8或9个能够召集RNA酶的连续核苷酸单元组成;并且GZ’由1、2或3个核苷酸类似物单元,如BNA(例如LNA)单元组成。
在一些实施方案中,GX’由1个BNA(例如LNA)单元组成。在一些实施方案中,GX’由2个BNA(例如LNA)单元组成。在一些实施方案中,GX’由3个BNA(例如LNA)单元组成。在一些实施方案中,GZ’由1个BNA(例如LNA)单元组成。在一些实施方案中,GZ’由2个BNA(例如LNA)单元组成。在一些实施方案中,GZ’由3个BNA(例如LNA)单元组成。在一些实施方案中,GH由7个核苷酸单元组成。在一些实施方案中,GH由8个核苷酸单元组成。在一些实施方案中,GH由9个核苷酸单元组成。在某些实施方案中,区域GH由10个核苷单元组成。在某些实施方案中,区域GH由1–10个DNA单元组成或包含前者。在一些实施方案中,GH包含1–9个DNA单元如2、3、4、5、6、7、8或9个DNA单元。在一些实施方案中,GH由DNA单元组成。在一些实施方案中,GH包含至少一个处于α-L构型的BNA单元如2、3、4、5,6、7、8或9个处于α-L构型的LNA单元。在一些实施方案中,GH包含至少一个α-L-氧代BNA/LNA单元组成或其中处于α-L-构型的全部LNA单元均是α-L-氧代LNA单元。在一些实施方案中,GX’-GH-GZ’中存在的核苷酸数目选自(核苷酸类似物单元–区域GH–核苷酸类似物单元):1-8-1、1-8-2、2-8-1、2-8-2、3-8-3、2-8-3、3-8-2、4-8-1、4-8-2、1-8-4、2-8-4;或1-9-1、1-9-2、2-9-1、2-9-2、2-9-3、3-9-2、1-9-3、3-9-1、4-9-1、1-9-4;或1-10-1、1-10-2、2-10-1、2-10-2、1-10-3、3-10-1。在一些实施方案中,GX’-GH-GZ’中的核苷酸数目选自:2-7-1、1-7-2、2-7-2、3-7-3、2-7-3、3-7-2、3-7-4和4-7-3。在某些实施方案中,区域GX’和GH各自由三个BNA(例如LNA)单元组成,并且区域GH由8个或9个或10个核苷单元、优选地DNA单元组成。在一些实施方案中,GX’和GZ’各自均由两个BNA(例如LNA)单元组成,并且GH由8个或9个核苷酸单元、优选地DNA单元组成。在多种实施方案中,其他缺口聚物设计包含这些设计,其中区域GX’和/或GZ’由3、4、5或6个核苷类似物如含有2’-O-甲氧乙基-核糖(2’-MOE)的单元或含有2'-氟-脱氧核糖的单元组成,并且区域H由8、9、10,11或12个核苷如DNA单元组成,其中区域GX’-GH-GZ’具有3-9-3、3-10-3、5-10-5或4-12-4单元。
BNA和LNA缺口聚物:术语BNA和LNA互换使用。BNA缺口聚物是包含至少一个BNA核苷酸的缺口聚物寡聚物(区域GA)。LNA缺口聚物是包含至少一个LNA核苷酸的缺口聚物寡聚物(区域GA)。
核苷酸间键
本文所述的寡聚物和寡聚物缀合物的单元借助连接基团偶接在一起。适当地,每个单元借助连接基团与3’相邻单元连接。
本领域普通技术人员将理解,在本发明的上下文中,在寡聚物末端的5’单元不包括5’连接基团,虽然它可以或可以不包括5’末端基团。
本发明寡聚物或其连续核苷酸序列的核苷酸借助连接基团连接在一起。适当地,每个核苷酸借助连接基团与3’毗邻核苷酸连接。
任选地,本发明的寡核苷酸或本发明的寡核苷酸缀合物可以包含一个或多个接头基团和/或一个或多个分支区域。在多种实施方案中,接头基团是核苷间键或核苷酸间键。
合适的核苷酸间键包括在WO 2007/031091内部列出的那些,例如在(因而通过引用的方式并入的)WO 2007/031091第34页第一段上列出的核苷酸间键。
对于一些实施方案,优选将核苷酸间键从其正常磷酸二酯修饰成更抵抗核酸酶攻击的一种核苷酸间键,如硫代磷酸酯或硼烷磷酸酯–这两者(均可由RNA酶H切割)还允许减少靶基因表达的反义抑制途径。
可以优选如本文中提供的合适的含硫(S)核苷酸间键。还优选硫代磷酸酯核苷酸间键,特别地对于缺口聚物的缺口区域(X)。硫代磷酸酯键也可以用于侧翼区(W和Y,并用于连接W或Y至V或Z,和用于区域V或区域Z内部,如果适宜)。
然而,区域W、X和Y可以包含除硫代磷酸酯之外的核苷酸间键,如磷酸二酯键,特别地,例如当使用核苷酸类似物保护区域W和Y内部的核苷酸间键免遭核酸内切酶降解时–如当区域W和Y包含LNA核苷酸时。
寡聚体中的核苷酸间键可以是磷酸二酯、硫代磷酸酯或硼烷磷酸酯,从而允许RNA酶H切割靶向的RNA。出于改善核酸酶抗性和其他原因如易于制造,优选硫代磷酸酯。
在本发明寡聚物的一个方面,核苷酸和/或核苷酸类似物通过硫代磷酸酯基团彼此连接。
认识到,另外向硫代磷酸酯寡聚物中、特别地在核苷酸类似物单元之间或与之毗邻(一般在区域W和或Y中)纳入磷酸二酯键,如一个或两个键、可以调节寡聚物的生物可利用性和/或生物分布–参见WO 2008/113832,所述文献因而通过引用的方式并入。
在一些实施方案中,如上文所提及的实施方案,其中合适并且未特别指出的情况下,全部剩余的连接基团是磷酸二酯或硫代磷酸酯或其混合物。
在一些实施方案中,全部核苷酸间连接基团均是硫代磷酸酯。
当提到特定的缺口聚物寡核苷酸序列,如本文中提供的那些特定序列的任一个时,应当理解,在多种实施方案中,当键是硫代磷酸酯键时,可以例如使用备选键,如本文公开的那些,例如可以使用磷酸酯(磷酸二酯)键,尤其对于核苷酸类似物(如LNA单元)之间的键。同样地,当提到特定缺口聚物寡核苷酸序列,如如本文中提供的那些特定序列的任一个时,在多种实施方案中,当C残基注释作为5’甲基修饰的胞嘧啶时,寡聚物中存在的一个或多个C可以是未修饰的C残基。
WO 09124238涉及具有通过中性核苷间键与3'或5'末端连接的至少一个双环核苷的寡聚化合物。本发明的寡聚物因此可以具有通过中性核苷间键如一个或多个磷酸三酯、甲基磷酸酯、MMI、酰胺-3、甲缩醛(formacetal)或硫代甲缩醛与3'或5'末端连接的至少一个双环核苷。剩余键可以是硫代磷酸酯。
载体
在一些实施方案中,本发明的寡聚物连接至一个或多个可以相同或不同的载体组分。
在一些实施方案中,寡聚物缀合物具有或包含以下结构:
载体组分–L-第一寡聚物区域
其中L是任选的接头或分支区域或系索分子或桥接部分。优选地,L选自生理不稳定接头(区域PL)或备选性接头(区E)或二者的组合。
如下所示,第一寡聚物区域可以经由5'末端与接头或载体连接:
载体组分–L1-第一寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分;或
备选地,如下所示,第一寡聚物区域可以经由3'末端与接头或载体连接:第一寡聚物区域–L2-载体组分。
其中L2是任选的接头或分支区域或系索分子或桥接部分。
对于某些实施方案,寡聚物缀合物优选地具有或包含结构:
载体组分–L1-第一寡聚物区域
其中L1是任选的接头。
对于某些实施方案,接头1优选地存在。
对于某些实施方案,所述载体组分优选地连接、优选地缀合至所述第一寡聚物区域。
对于某些实施方案,所述载体组分优选地连接、优选地缀合至所述寡聚物的5'末端。
对于某些实施方案,所述载体组分借助接头基团或分支区域或系索分子或桥接部分优选地连接、优选地缀合至所述寡聚物的5'末端。
对于某些实施方案,接头基团或分支区域优选地是生理不稳定接头基团或生理不稳定分支区域或生理不稳定系索分子或生理不稳定桥接部分。
对于某些实施方案,生理不稳定接头基团优选地是核酸酶敏感接头、优选地磷酸二酯接头。
对于某些实施方案,优选的L1接头由生理不稳定接头和C2–C36氨基烷基(例如包括C6至C12氨基烷基)组成。在一个优选实施方案中,L1接头由PO接头和C6氨基接头组成。
在一些实施方案中,载体组分选自糖缀合物或亲脂缀合物,或载体组分包含糖和亲脂缀合物二者。
糖缀合物部分可以例如选自半乳糖、半乳糖胺、N-甲酰半乳糖胺、N-乙酰半乳糖胺、N-丙酰半乳糖胺、N-正丁酰半乳糖胺和N-异丁酰半乳糖胺。优选地,糖缀合物部分是靶向脱唾液酸糖蛋白受体的缀合物部分。亲脂缀合物可以是疏水基团,如C16-20疏水基团、固醇、胆固醇。可以使用的其他糖和亲脂基团例如在本文公开。
对于一些实施方案,寡聚物可以包含额外的CA二核苷酸基序。优选地,在寡聚物缀合物的上下文中,CA基序位于载体组分和寡聚物之间。CA基序优选地包含磷酸二酯键并充当寡聚物和载体组分之间的PO接头。
乙型肝炎病毒(HBV)
如本文所述的全部寡聚物和寡聚物缀合物意在能够用来治疗病毒性疾病、尤其与HBV相关的疾病。这类用途形成本发明的的一部分。
如本文所述的全部寡聚物和寡聚物缀合物意在能够用于制造用于治疗病毒性疾病、尤其与HBV相关的疾病的药物。这类用途形成本发明的一部分。
如本文所述的全部寡聚物和寡聚物缀合物意在能够施用至受试者作为缓解、治愈或治疗病毒性疾病、尤其与HBV相关的疾病的方法的一部分。这类方法形成本发明的的一部分。
如本文所述的全部寡聚物和寡聚物缀合物意在能够构成治疗病毒性疾病、尤其与HBV相关的疾病的药物组合物的一部分。这类药物组合物形成本发明的的一部分。
乙型肝炎病毒(HBV))是作为嗜肝DNA病毒科(Hepadnaviridae)的一部分的正肝病毒属种类。该病毒造成乙型肝炎疾病。除造成肝炎之外,HBV感染还可以导致肝硬化和肝细胞癌。也已经提出它可能增加胰腺癌风险。
本病毒基于其包膜蛋白上存在的抗原表位分成四个主要血清型(adr、adw、ayr、ayw),并且根据基因组的总体核苷酸序列变异分成8个基因型(A–H)。各基因型具有不同的地理分布并且基因型之间的差异影响病情严重性、病程和并发症可能性以及对治疗和可能免疫接种的反应。各基因型相差至少8%。与其他基因组趋异14%的F型是已知趋异最大的类型。A型流行于欧洲、非洲和东南亚,包括菲律宾。B型和C型在亚洲为优势;D型常见于地中海地区、中东和印度;E型局限于撒哈拉以南非洲;F型或H型局限于中美洲和南美洲。已经在法国和德国发现G型。基因型A、D和F在巴西占优势并且全部基因型均在美国出现,频率取决于族裔。
HBV具有环状DNA基因组,然而,DNA不是完全双链的,原因是全长链的一个末端连接至病毒DNA聚合酶。基因组长3020–3320个核苷酸(全长链)及长1700–2800个核苷酸(短长度链)。
存在四个由HBV基因组编码的已知基因(C、P、S和X)。核心蛋白由基因C(HBcAg)编码,并且其起始密码子之前有符合可读框的上游AUG起始密码子,从中产生前核心蛋白。通过蛋白酶解加工前核心蛋白产生HBeAg。DNA聚合酶由基因P编码。
HBx
HBx多肽是一个154残基蛋白质,其干扰宿主中的转录、信号转导、细胞周期进展、蛋白质降解、凋亡和染色体稳定性。它与其细胞靶蛋白(HBX相互作用蛋白:HBXIP)形成异二聚体复合物,并且这种相互作用使中心体动力学和有丝分裂纺锤体形成过程去调控。它与DDB1(受损型DNA结合蛋白1)相互作用,使CUL4-DDB1E3复合物的遍在蛋白连接酶活性重定向,所述CUL4-DDB1E3复合物密切涉及DNA复制和修复、转录和信号转导的胞内调节。
虽然它与任何已知的脊椎动物蛋白质缺少显著的序列同一性,它可能从DNA糖苷酶演化而来。在肝脏中表达X蛋白的转基因小鼠是比野生型更可能形成肝细胞癌。这是因为X蛋白促进细胞周期进展,同时结合于并抑制肿瘤阻抑子蛋白质p53履行自身功能。实验观察还表明,HBx蛋白增加TERT和端粒酶活性,延长肝细胞寿命并促成恶性转化。
在纯化遭HBV感染的癌性肝脏细胞的研究中,发现蛋白质精氨酸甲基转移酶1(PRMT1)的表达水平因PRMT1的甲基转移酶功能而与转录的变化相关。过量表达造成转录的HBV基因数目减少,同时反过来,降低的表达造成增加。还发现PRMT1在复制过程由HBV DNA召集以调节转录过程。增加的HBx表达转而导致抑制PRMT1介导的蛋白质甲基化,从而有益于病毒复制。
HBx靶序列包含始于位置1196处第一个报告的转录起始位点至位置1941处多聚腺苷化位点的序列。从U95551序列的位置1196至1941的序列作为SEQ ID No:1示出。U95551序列作为SEQ ID No:3示出。
HBsAg
HBsAg(也称作主表面抗原、HBV主表面抗原、HBV表面抗原和‘S’)是HBV表面抗原。
基因S是编码表面抗原(HBsAg)的基因。HBsAg基因是一个长开放阅读框,但是含有三个符合可读框的“起始”(ATG)密码子,这些密码子将该基因分成三个部分前S1、前S2和S。因为存在多个起始密码子,所以生成三个不同大小的多肽,称作大、中和小(前S1+前S2+S、前S2+S、或S)。
HBsAg由同一个基因编码的三种糖蛋白构成。各蛋白质在相同阅读框中翻译,但是始于不同的AUG起始密码子;因此,均具有相同的C末端。最大的蛋白质是L蛋白(42kd)并且M糖蛋白含于其内部。S糖蛋白(27kD)含于M蛋白内部。HBsAg蛋白质还分泌入患者的血清,在那里,它可以作为球状粒子(大多是自我缔合的S蛋白)或丝状粒子(大多也是S蛋白,但含有一些L和M)见到。前者小于真实病毒,但是丝状物可以相当大(几百纳米)。
S-HBsAg为226个氨基酸残基长。它是通过残基4和24之间的氨基端跨膜结构域(TMD-i)锚定在ER脂质双层中的整合型膜糖蛋白。它在残基24和80之间包含下游胞质环(CYL-I)、在残基80和100之间包含第二跨膜结构域(TMD-II)并且包含涵盖残基101至164的抗原性环(AGL),面向ER管腔(或胞外粒子表面)。羧基端(残基165至226)据预测含有两个TMD(TMD-III和-IV),分别位于位置173至193和位置202至222,由本文称作胞质环II(CYL-II)的短序列(残基194至201)分隔,原因是预测所述短序列位于ER膜的胞质侧处。M-HBsAg蛋白质序列在其氨基端比S-HBsAg长55个残基(前S2结构域);它与后者在病毒包膜中共装配,但是就形态发生和体外感染性而言是非必需的。L-HBsAg包含整个M多肽,取决于HBV基因型,具有108至119个残基的额外氨基端延长(前S1)。已经用拓扑结构描述它,氨基端前S结构域(前S1外加前S2)是在ER膜处胞质(在分泌的病毒粒上内部)或处于管腔(暴露在病毒粒表面)。内部构象参与召集核衣壳用于病毒粒组合,而外部位置对应于病毒进入时的受体结合功能。
全部三个包膜蛋白均在内质网(ER)膜合成,在那里,它们通过蛋白质-蛋白质相互作用聚集,主要导致分泌空S-HBsAg包覆的亚病毒粒子(SVPs)。仅当L-HBsAg在ER膜处的包膜蛋白聚集物中,HBV核衣壳才可以在出芽复合体中召集并且作为成熟病毒粒释放。由于S-HBsAg用于自装配的主导活性,与L-HBsAg相比,仅在罕见情况下才出现HBV病毒粒形成。
HBx靶序列包含环化U95551序列从位置3158至3182处的转录起始位点和从位置1开始至位置1941处多聚腺苷化位点的序列。因此,HBsAg靶序列包含从环化U95551序列的位置3158至3182和位置1至1944的合并序列的序列。这个靶序列作为SEQ ID No:2示出。U95551序列作为SEQID No:3示出。
靶
在优选的方面,本发明的寡聚物或寡聚物缀合物适当地能够调节在乙型肝炎病毒(HBV)的HBx或HBsAg中的靶序列。在这个方面,本发明的寡聚物可以一般在哺乳动物细胞(如人细胞,如肝脏细胞)中影响对靶序列的抑制。
在一些实施方案中,本发明的寡聚物或寡聚物缀合物与靶核酸结合并与正常表达水平相比,调节表达至少10%或20%,更优选地与正常表达水平相比(如寡聚物或寡聚物缀合物不存在的情况下的表达水平),调节表达至少30%、40%、50%、60%、70%、80%、90%或95%。
在一个实施方案中,本发明的寡聚物或寡聚物缀合物能够下调(例如抑制、减少或移除)HBx或HBsAg基因表达。在这个方面,本发明的寡聚物可以影响对HBx或HBsAg的抑制。这种抑制作用一般可以在哺乳动物细胞(如人细胞,如肝脏细胞)中出现。在一些实施方案中,本发明的寡聚物与靶核酸结合并与正常表达水平相比,影响抑制表达至少10%或20%,更优选地与正常表达水平相比(如不存在寡聚物或寡聚物缀合物情况下的表达水平),影响抑制表达至少30%、40%、50%、60%、70%、80%、90%或95%。
在一些实施方案中,当使用0.04nM和25nM,如从0.8nM和20nM浓度的本发明化合物时,观察到这种调节作用。在相同或不同的实施方案中,表达调节作用小于100%,如小于98%、小于95%、小于90%、小于80%,如小于70%。可以通过测量蛋白质水平,例如通过多种方法如SDS-PAGE,接着通过使用针对靶蛋白产生的合适抗体的蛋白质印迹法测量蛋白质水平,确定表达水平的调节作用。备选地,可以通过测量mRNA水平,例如通过RNA印迹法或定量RT-PCR测量mRNA水平,确定表达水平的调节作用。在一些实施方案中,通过mRNA水平测量时,下调水平在使用适宜剂量如从0.04nM和25nM(如从0.8nM和20nM浓度)时一般是到在本发明化合物、缀合物或组合物不存在的情况下正常水平的10-20%。
如本文中所示,细胞可以是体外转染的细胞。在一些实施方案中,所用的寡聚物或寡聚物缀合物的浓度可以是5nM。在一些实施方案中,所用的寡聚物浓度可以是25nM。在一些实施方案中,所用的寡聚物或寡聚物缀合物的浓度可以是1nM。应当指出,用来处理细胞的寡聚物的浓度一般在体外细胞测定法中使用转染(Lipofecton)执行,如实施例中所示。在不存在转染剂的情况下,为获得靶下调所要求的寡聚物或寡聚物缀合物浓度一般在1和25μM之间,如5μM。
本发明因此提供下调或抑制HBx或HBsAg蛋白质和/或mRNA在正在表达HBx或HBsAg蛋白质和/或mRNA的细胞中表达的方法,所述方法包括向所述细胞施用本发明的寡聚物或缀合物以下调或抑制HBx或HBsAg蛋白质和/或mRNA在所述细胞中的表达。适当地,细胞是哺乳动物细胞如人细胞。在一些实施方案中,施用可以在体外进行。在一些实施方案中,施用可以在体内进行。
对于某些实施方案,靶向HBx的寡聚物或寡聚物缀合物的寡聚物组分还与HBsAg结合。
靶序列
寡聚物或寡聚物缀合物包含与靶序列中存在的核苷酸序列的反向互补序列对应的连续核苷酸序列或由其组成。
靶序列可以是基因或mRNA,如基因或mRNA的编码区或非编码区。例如,靶序列可以是编码性或非编码性外显子。靶序列可以至少包含外显子的一部分。靶序列可以是外显子的一部分,如在外显子内部。
在本发明的实施中,靶序列可以是单链或双链DNA或RNA;然而,单链DNA或RNA靶是优选的。可以理解,本发明的反义寡核苷酸所指向的靶序列包括所靶向基因的等位形式和相应的mRNA,包括剪接变体。在文献中存在给定知道靶多核苷酸的序列而针对反义寡核苷酸选择特定序列的大量指南,例如,Cook S.T.Antisense Drug Technology,Principles,Strategies,and Applications,Marcel Dekker,Inc,2001;Peyman和Ulmann,Chemical Reviews,90:543-584,1990;和Crooke,Ann.Rev.Pharmacol.Toxicol.,32:329-376(1992)。mRNA靶可以包括5'帽位点、tRNA引物结合位点、起始密码子位点、mRNA供体剪接位点、和mRNA受体剪接位点。
在靶多核苷酸序列包含mRNA转录物的情况下,序列互补性寡核苷酸可以与转录物的任何所需部分杂交。原则上,这类寡核苷酸有效抑制翻译,并且能够诱导本文所述的效果。假设通过在起始密码子处或其附近的某个位点阻断mRNA,最有效地抑制翻译。因此,寡核苷酸可以与mRNA转录物的5'-区域互补。寡核苷酸可以互补于mRNA,包括起始密码子(在转录物的已翻译部分的5'末端处的第一密码子)或与起始密码子毗邻的密码子。
在一个实施方案中,靶序列可以在HBV基因型A-H之间具有同一性(下文详细描述)。
在一个实施方案中,靶序列可以与HBV基因型A-H的任一者或多者具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型A具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型B具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型C具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型D具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型E具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型F具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型G具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。例如,靶序列可以与HBV基因型H具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。
在一个实施方案中,靶序列可以在HBV基因型A-H的两者或更多者之间具有至少80%、至少85%、至少90%、至少95%、至少98%同一性。
在一个实施方案中,靶序列可以在HBV基因型A、B、C和D的两者或更多者之间具有同一性。靶序列可以在HBV基因型A和B之间具有至少80%、至少85%、至少90%、至少95%、至少98%同一性。
在一个实施方案中,靶序列可以在HBV基因型A、B、C和D的两者或更多者之间具有同一性。靶序列可以在HBV基因型A和C之间具有至少80%、至少85%、至少90%、至少95%、至少98%同一性。
在一个实施方案中,靶序列可以在HBV基因型A、B、C和D的三者或更多者之间具有同一性。靶序列可以在HBV基因型A、B、C和D之间具有至少80%、至少85%、至少90%、至少95%、至少98%同一性。
在一个实施方案中,靶序列可以在HBV基因型A、B、C和D的三者或更多者之间具有同一性。靶序列可以在HBV基因型A、B和C之间具有至少80%、至少85%、至少90%、至少95%、至少98%同一性。
在一个实施方案中,靶序列可以在HBV基因型A、B、C和D的三者或更多者之间具有同一性。靶序列可以在HBV基因型A、B和D之间具有至少80%、至少85%、至少90%、至少95%、至少98%同一性。
在一个实施方案中,靶序列可以在全部的HBV基因型A、B、C和D之间具有同一性。靶序列可以在HBV基因型A、B、C和D之间具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。
在多种实施方案中,靶序列在显示为SEQ ID No.3的序列内部。
在一个实施方案中,靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分。
在多种实施方案中,靶序列是HBx或HBsAg或其天然存在的变体。
在多种实施方案中,靶序列在显示为SEQ ID No.1的序列内部。
在多种实施方案中,靶序列在显示为SEQ ID No.2的序列内部。
在多种实施方案中,靶序列选自SEQ ID NO:3中以下一个或多个位置的序列:位置1至1944、位置157至1840、位置1196至1941、位置1376至1840和位置3158-3182。优选地,靶序列选自SEQ ID NO:3的位置1530至1598、更优选SEQ ID NO:3的位置1577至1598和最优选地SEQ ID NO:3的位置1530至1543。
在多种实施方案中,靶序列可以选自SEQ ID No.3的任何一个或多个以下位置:
1264-1278;
1265-1277;
1530-1543;
1530-1544;
1531-1543;
1551-1565;
1551-1566;
1577-1589;
1577-1591;
1577-1592;
1577至1598;
1578-1590;
1578-1592;
1583-1598;
1584-1598;
1585-1598;
670-706
670-684
691-705;
691-706;
692-706;
693-706;
694-706。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID No.3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的8-30、8-20、8-18、8-16、8-14、8-12或8-10个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID No.3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28或29个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少8个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少9个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少10个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少11个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少12个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少13个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少14个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少15个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个方面,本发明的寡聚物或寡聚物缀合物能够靶向作为SEQ ID NO:3的位置1200至1900、优选地位置1530至1598、更优选地位置1577至1598、最优选地位置1530至1543显示的序列内部的至少16个连续核苷酸;优选地其中所述寡聚物或寡聚物缀合物与所述连续核苷酸互补。
在一个实施方案中,靶序列包含在SEQ ID NO:1或SEQ ID NO:2或SEQ ID NO:3中所述的序列内部的序列或与之具有至少80%同一性的序列。因此,寡聚物或寡聚物缀合物可以包含选自本文所提供群组中的核心基序或由其组成,其中所述寡聚物或寡聚物缀合物(或其连续核苷酸部分)可以任选地相对于所述选择的基序序列具有一个、两个或三个错配:
GCGTAAAGAGAGG(SEQ ID NO:13);
AGCGAAGTGCACACG(SEQ ID NO:20);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834)
在一个实施方案中,靶序列包含下文所述的序列或与其中任一者具有至少80%同一性的序列。因此,寡聚物或寡聚物缀合物可以包含与选自下文所提供群组中的靶序列杂交的序列或由其组成,其中所述寡聚物或寡聚物缀合物(或其连续核苷酸部分)可以任选地相对于所述选择的靶序列具有一个、两个或三个错配。
在一些实施方案中,与靶序列杂交时,寡聚物或寡聚物缀合物可以忍受1、2、3、或4(或更多个)错配,并且仍然充分地与靶结合以显示所需的效果,即下调靶。错配可以例如通过增加寡聚物核苷酸序列的长度和/或增加核苷酸序列内部存在的核苷酸类似物(如LNA)数目补偿。
在一些实施方案中,杂交至靶序列,如杂交至编码HBx或HBsAg的核酸的相应区域时,连续核苷酸序列包含不多于不多于3个,如不多于2个错配。
在一些实施方案中,杂交至靶序列,如编码HBx或HBsAg的核酸的相应区域时,连续核苷酸序列包含不多于一个单一错配。
如果靶是HBx,本发明寡聚物或寡聚物缀合物的核苷酸序列或连续核苷酸序列优选地与选自本文展示的核苷酸序列中的相应序列具有至少80%同一性(有时称作同源性或同源),如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%同源、至少97%同源、至少98%同源、至少99%同源,如100%同源(相同)。
如果靶是HBx,本发明寡聚物或寡聚物缀合物的核苷酸序列或连续核苷酸序列优选地与作为SEQ ID No:1展示的序列内部的相应序列的反相互补序列具有至少80%同一性(有时称作同源性或同源),如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%同源、至少97%同源、至少98%同源、至少99%同源,如100%同源(相同)。
如果靶是HBx,本发明寡聚物或寡聚物缀合物的核苷酸序列或连续核苷酸序列优选地与作为SEQ ID No:1展示的序列内部存在的子序列至少80%互补,如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%互补、至少97%互补、至少98%互补、至少99%互补,如100%互补(完美互补)。
在一些实施方案中,如果靶是HBx,则寡聚物或寡聚物缀合物(或连续核苷酸其部分)选自或包含本文中展示的序列之一或其至少10个连续核苷酸的子序列,其中与序列相比时,所述寡聚物或寡聚物缀合物(或其连续核苷酸部分)可以任选地包含一个、两个、或三个错配。
如果靶是HBsAg,本发明寡聚物或寡聚物缀合物的核苷酸序列或连续核苷酸序列优选地与选自本文展示的群组中的相应序列具有至少80%同一性(有时称作同源性或同源),如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%同源、至少97%同源、至少98%同源、至少99%同源,如100%同源(相同)。
如果靶是HBsAg,本发明寡聚物或寡聚物缀合物的核苷酸序列或连续核苷酸序列优选地与作为SEQ ID No:2展示的序列内部存在的相应序列的反相互补序列具有至少80%同一性(有时称作同源性或同源),如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%同源、至少97%同源、至少98%同源、至少99%同源,如100%同源(相同)。
如果靶是HBsAg,本发明寡聚物或寡聚物缀合物的核苷酸序列或连续核苷酸序列优选地与作为SEQ ID No:2展示的序列内部存在的子序列至少80%互补,如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%互补、至少97%互补、至少98%互补、至少99%互补,如100%互补(完美互补)。
在一些实施方案中,如果靶是HBsAg,则寡聚物或寡聚物缀合物(或其连续核苷酸部分)选自或包含本文中展示的群组之一或其至少10个连续核苷酸的子序列,其中与序列相比时,所述寡聚物或寡聚物缀合物(或其连续核苷酸部分)可以任选地包含一个、两个、或三个错配。
在一些实施方案中,子序列可以由11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、或29个连续核苷酸,如12-22个,如12-18个如12-16个核苷酸组成。适当地,在一些实施方案中,子序列与本发明寡聚物的连续核苷酸序列具有相同长度。
但是,认识到,在一些实施方案中,寡聚物或寡聚物缀合物的核苷酸序列可以包含额外的5’或3’核苷酸,如,独立地,包含1、2、3、4或5个与靶序列非互补的额外5’和/或3’核苷酸。在这个方面,本发明的寡聚物可以在一些实施方案中包含5’和或3’旁侧分布有额外核苷酸的连续核苷酸序列。在一些实施方案中,额外的5’或3’核苷酸是天然存在的核苷酸,如DNA或RNA。在一些实施方案中,额外的5’或3’核苷酸可以代表如本文的缺口聚物寡聚物或寡聚物缀合物背景下提到的区域D。
RNA酶召集
认识到,寡聚物分子可以通过非RNA酶介导的靶mRNA降解,如通过空间阻断翻译或其他方法发挥作用。
对于一些实施方案,本发明的寡聚物或寡聚物缀合物能够召集核糖核酸内切酶(RNA酶),如RNA酶H。
优选本发明的寡聚物或寡聚物缀合物包含具有至少6个、如至少7个连续核苷酸单位如至少8个或至少9个连续核苷酸单位(残基)(包括7、8、9、10、11、12、13、14、15或16个连续核苷酸)的区域,所述区域与互补性靶RNA构成双链体时能够召集RNA酶。能够召集RNA酶的连续序列可以是如本文所述的缺口聚物背景下提到的区域X。在一些实施方案中,能够召集RNA酶的连续序列如区域X的尺寸可以更大,如具有10、11、12、13、14、15、16、17、18、19或20个核苷酸单元。
EP1 222 309提供用于确定RNA酶H活性的体外方法,所述方法可以用来确定召集RNA酶H的能力。使用EP 1 222 309的实施例91-95提供的方法学,如果在给予互补性RNA靶时,如以pmol/l/分钟计量的RNA酶H初始速率是使用仅DNA寡核苷酸所确定的初始速率的至少1%、如至少5%、如至少10%或超过20%,其中所述仅DNA寡核苷酸具有相同的碱基序列,但仅含有DNA单元,没有2’取代,在寡核苷酸的全部单元之间具有硫代磷酸酯键基团,则认定该寡聚体能够召集RNA酶H。
在一些实施方案中,使用EP 1 222 309的实施例91-95提供的方法学,如果在给予互补性RNA靶和RNA酶H时,如以pmol/l/分钟计量的RNA酶H初始速率小于使用等同的仅DNA寡核苷酸所确定的初始速率的1%、如小于5%、如小于10%或小于20%,其中所述等同性单纯DNA寡核苷酸没有2’取代,在寡核苷酸的全部单体之间具有硫代磷酸酯键基团,则认定某寡聚体基本上不能够召集RNA酶H。
在其他实施方案中,使用EP 1 222 309的实施例91-95提供的方法学,如果在给予互补性RNA靶和RNA酶H时,如以pmol/l/分钟计量的RNA酶H初始速率是使用等同的仅DNA寡核苷酸所确定的初始速率的至少20%,如至少40%,如至少60%,如至少80%,其中所述等同性单纯DNA寡核苷酸没有2’取代,在寡核苷酸的全部单体之间具有硫代磷酸酯键基团,则认定某寡聚体能够召集RNA酶H。
一般,本发明的寡聚物或寡聚物缀合物的区域,由与RNA靶形成DNA/RNA样双链体的核苷酸单元组成,所述区域形成与互补性靶RNA构成双链体时能够召集RNA酶的连续核苷酸单元–并且包括处于α-L构型的DNA单元和LNA单元,特别优选是α-L-氧代LNA。
本发明的寡聚物或寡聚物缀合物可以包含一个核苷酸序列,所述核苷酸序列包含核苷酸和核苷酸类似物并且可以例如处于缺口聚物、头聚物或混聚物形式。
在一些实施方案中,除增强寡聚物对靶区域的亲和力之外、一些核苷类似物还介导RNA酶(例如,RNA酶H)结合和切割作用。由于α-L-LNA单元某种程度地召集RNA酶H活性,在一些实施方案中,含有α-L-LNA单元的寡聚体的缺口区(例如,如本文提到的区域X)由RNA酶可识别和可切割的更少单元组成,并且在混合聚物结构中引入更多的灵活性。
合成
本发明提供一种制造寡聚物缀合物的方法,所述方法包括使至少一种寡聚物缀合至载体组分,其中所述寡聚物缀合物适于治疗病毒性疾病。
本发明还提供一种制造本文所述的多元寡聚物(polyoligomer)缀合物的方法,所述方法包括将一种或多种寡聚物附着至接头基团(E或L)或对称分支区域F,后者随后与如本文所述的载体组分连接,其中所述寡聚物缀合物适于治疗病毒性疾病。
在一些实施方案中,对称的分支区域是或者1,3-戊基酰胺丙基(来自1,3-双-[5-(4,4'-二甲氧基三苯甲氧基)戊基酰氨基]丙基-2-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺)、三-2,2,2-(丙氧甲基)乙基(来自三-2,2,2-[3-(4,4'-二甲氧基三苯甲氧基)丙氧甲基]乙基-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺)或三-2,2,2-(丙氧甲基)亚甲氧基丙基(来自三-2,2,2-[3-(4,4'-二甲氧基三苯甲氧基)丙氧甲基]亚甲氧基丙基-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺)。在一些实施方案中,非对称分支区域是1,3-戊基酰胺丙基(来自1-[5-(4,4'-二甲氧基三苯甲氧基)戊基酰氨基]-3-[5-芴甲氧基羰基氧戊基酰氨基]-丙基-2-[(2-氰基乙基)-(N,N-二异丙基)]-磷酰亚胺),美国Glen Reseach提供这类合适的分支物(例如目录号0-1920、10-1922和10-1925)。
如本文所述的接头基团和分支区域可以是可切割的或不可切割的。
在又一个方面,提供一种制造本发明组合物的方法,所述方法包括将本发明的寡聚物缀合物与可药用的稀释剂、溶剂、载体、盐和/或佐剂混合。
活化的寡聚物
如本文所用,术语“活化的寡聚物”指共价连接(即,官能化)到至少一种功能部分的本发明寡聚物,所述功能部分允许将寡聚物共价至一种或多种缀合的部分(即,本身不是核酸或单元的部分)以形成本文中所述的缀合物。一般,官能部分将包含能够通过例如腺嘌呤碱基的3’-羟基或环外NH2基团、优选亲水的间隔团和能够与缀合的部分结合的末端基团(例如,氨基、硫氢基或羟基)与寡聚物共价键合的化学基团。在一些实施方案中,这个末端基团未保护,例如,是NH2基。在其他实施方案中,末端基团受到保护,例如,由任何合适的保护基如Theodora W Greene和Peter G M Wuts的“Protective Groups in Organic Synthesis",第3版(John Wiley&Sons,1999)中描述的那些保护基保护。合适的羟基保护基的例子包括酯如乙酸酯、芳烷基如苄基、二苯甲基、或三苯甲基和四氢吡喃基。合适的氨基保护基的例子包括苄基、α-甲基苄基、二苯甲基、三苯甲基、苯甲氧基羰基、叔丁氧羰基、和酰基如三氯乙酰基或三氟乙酰基。在一些实施方案中,官能部分是自我切割的。在其他实施方案中,官能部分是生物可降解的。参见,例如,通过引用方式完整并入本文的美国专利号7,087,229。
在一些实施方案中,本发明的寡聚物在5'末端官能化以允许缀合的部分共价接合至寡聚物的5'末端。在其他实施方案中,本发明的寡聚物可以在3'末端官能化。在另外的实施方案中,本发明的寡聚物可以沿骨架或在杂环碱基部分上官能化。在另外的其他实施方案中,本发明的寡聚物可以在独立选自5'末端、3’末端、骨架和碱基的多于一个位置官能化。
在一些实施方案中,通过在合成期间掺入与官能部分共价连接的一个或多个单元,合成本发明的活化的寡聚物。在其他实施方案中,本发明的活化的寡聚物用尚未官能化的单元合成,并且寡聚物在完成合成时官能化。在一些实施方案中,寡聚物用含有氨烷基接头的位阻型酯官能化,其中烷基部分具有式(CH2)w,其中w是范围从1至10的整数,优选地是约6,其中烷基氨基的烷基部分可以是直链或支链,并且,其中官能团借助酯基(-O-C(O)-(CH2)wNH)与寡聚物连接。
在一些实施方案中,寡聚物用含有(CH2)w-硫氢基(SH)接头官能化,其中w是范围从1至10的整数,优选地是约6,其中烷基氨基的烷基部分可以是直链或支链,并且,其中官能团借助酯基(-O-C(O)-(CH2)wSH)与寡聚物连接。在一些实施方案中,硫氢基活化的寡核苷酸与聚合物部分如聚乙二醇或肽缀合(通过形成二硫键)。
如上文所述的含有位阻酯的活化的寡聚物可以通过本领域已知的任何方法并尤其通过PCT公开号WO 2008/034122及其中实施例中公开的方法合成,所述文献通过引用的方式完整并入本文。
在另外的实施方案中,本发明的寡聚物通过借助基本上如美国专利号4,962,029和4,914,210中所述的官能化试剂即基本上线型的试剂,将硫氢基、氨基或羟基引入寡聚物而官能化,所述基本上线型的试剂在一个末端具有通过亲水性间隔链与包含受保护或未保护的硫氢基、氨基或羟基的相反末端连接的磷酰亚胺。这类试剂主要与寡聚物的羟基反应。在一些实施方案中,这类活化的寡聚物具有与寡聚物的5’-羟基偶联的官能化试剂。在其他实施方案中,活化的寡聚物具有与3’-羟基偶联的官能化试剂。在另外的实施方案中,本发明的活化寡聚物具有与寡聚物骨架上羟基偶联的官能化试剂。在进一步的其他实施例中,本发明的寡聚物用多于一个如美国专利号4,962,029和4,914,210中所述的官能化试剂官能化,所述文献通过引用的方式完整并入本文。合成这类官能化试剂并将其掺入单元或寡聚物的方法在美国专利号4,962,029和4,914,210中公开。
在一些实施方案中,固相结合的寡聚物的5’-末端用二烯基磷酰亚胺衍生物官能化,随后,例如用氨基酸或肽通过Diels-Alder环加成反应缀合去保护的寡聚物。
在多种实施方案中,向寡聚物中掺入含有2’-糖修饰的单元如2’-氨基甲酸酯取代的糖或2'-(O-戊基-N-苯二甲酰亚氨基)-脱氧核糖促进缀合的部分共价接合至寡聚物的糖。在其他实施方案中,使用试剂例如5'-二甲氧基三苯甲基-2'-O-(e-邻苯二甲酰亚胺基氨基戊基)-2'-脱氧腺苷-3'-N,N-二异丙基-氰乙氧基磷酰亚胺,制备在一个或多个单元的2'-位置处具有含氨基的接头的寡聚物(参见,例如,Manoharan等人,Tetrahedron Letters,1991,34,7171)。
在仍然其他的实施方案中,本发明的寡聚物可以在核碱基上,包括在N6嘌呤氨基上、在鸟嘌呤的环外N2上、或在胞嘧啶的N4或5位置上具有含胺的官能部分。在多种实施方案中,这类官能化可以通过使用已经在寡聚物合成中官能化的商业试剂实现。
一些官能部分是可商业获得的,例如,异双官能和同双官能连接部分从Pierce Co.(Rockford,Ill.)可获得。其他市售连接基是5'-氨基-调节物C6试剂和3'-氨基-调节物试剂,二者均从Glen Research Corporation(Sterling,Va.)可获得。5'-氨基-调节物C6还从ABI(Applied Biosystems Inc.,Foster City,Calif.)作为Aminolink-2可获得,并且3'-氨基-调节物还可从Clontech Laboratories Inc.(Palo Alto,Calif.)获得。
多元寡聚物
如上文所示,本发明的一些实施方案中,寡聚物或寡聚物缀合物的寡聚物组分可以包含或是具有两种靶向序列的分子的一部分。在一些情况下,这些分子称作多元寡聚物。
在一些实施方案中,寡聚物缀合物具有或包含以下结构:
载体组分–L1-第一寡聚物区域–L2–第二寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L2–第二寡聚物区域-L3–载体组分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L2和L3可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
载体组分1–L1-第一寡聚物区域–L2–第二寡聚物区域-L3–载体组分2
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L1、L2和L3可以是相同或不同的
其中载体组分1和载体组分2可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L1-载体组分1–L2–第二寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2和L3可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L1-载体组分1–L2–第二寡聚物区域-L3–载体组分2
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2可以是相同或不同的
其中载体组分1和载体组分2可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
载体组分1–L1-第一寡聚物区域–L2-载体组分2–L3–第二寡聚物区域-L4–载体组分3
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L1、L2和L3可以是相同或不同的
其中载体组分1、载体组分2和载体组分3可以是相同或不同的。
在一些实施方案中,优选地寡聚物缀合物根据本发明使用,其中所述寡聚物缀合物具有或包含以下结构:
载体组分–L1-第一寡聚物区域–L2–第二寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2可以是相同或不同的。
在一些实施方案中,接头1存在。
在一些实施方案中,接头2存在。
在一些实施方案中,接头3存在。
在一些实施方案中,载体组分连接、优选地缀合至所述第一寡聚物区域。
在一些实施方案中,载体组分连接、优选地缀合至所述寡聚物的5'末端。
在一些实施方案中,第一寡聚物区域和第二寡聚物区域各自借助接头或分支区域连接、优选地缀合。
在一些实施方案中,第一寡聚物区域和第二寡聚物区域各自借助生理不稳定接头基团或生理不稳定分支区域连接、优选地缀合。
在一些实施方案中,本发明提供一种可以包含第一区域(区域PA)、第二区域(区域PB))和第三区域(区域PC)的多元寡聚物化合物,其中第一区域与至少一个其他寡聚体化合物(区域PA’)共价连接,其中第一区域(区域P)和区域PA’借助生物可切割接头(区域PB’)共价连接,以举例方式,所述生物可切割接头可以如根据本文公开的第二区域例如是具有磷酸二酯连接的至少一个DNA或RNA(如DNA)、如磷酸二酯连接的两个、三个、四个或五个DNA核苷或RNA核苷(如DNA核苷)的区域。在一些实施方案中,区域PB和PB’可以具有相同结构,例如相同数目的DNA/RNA核苷和磷酸二酯键和/或相同的核碱基序列。在其他实施方案中,区域PB和PB’可以不同。以举例方式,这类多聚寡聚物化合物可以具有结构如:(5’–3’或3’–5’)缀合物/载体化合物-PO-ON-PO’-ON’,其中缀合物/载体化合物是区域PC,PO是区域PB,PO’是区域PB’,并且ON是区域PA、并且ON’是区域PA’。
应当理解在一些实施方案中,区域PA’可以包含借助生物可切割接头串联(或并联)连接的多个其他寡聚物化合物(如其他2个或3个寡聚物化合物),例如:缀合物/载体化合物-PO-ON-PO-ON’-PO”-ON”或缀合物/载体化合物-PO-ON-[PO-ON’]n,其中n可以例如是1、2或3,并且每个ON’可以相同或不同,并且如果不同,则可以具有相同或不同的靶。
在一个方面,本发明利用多元寡聚物化合物(本文中也称作寡聚物化合物)调节,如抑制细胞中靶核酸,例如HBV HBx或HBsAg。寡聚物化合物包含至少两个寡聚物区域,例如(PA和PA’)和可以包含进一步寡聚物区域(例如PA”)。至少一个寡聚物区域是能够调节HBV的HBx或HBsAg中靶序列的寡聚物,例如如本发明提供的寡聚物。在某些实施方案中,PA、PA’各自(和PA”,如果存在)可以是能够调节HBV的HBx或HBsAg中靶序列的寡聚物,例如如本发明提供的寡聚物。PA和PA’可以互补于靶序列中的不同位置。
在一些实施方案中,PA可以是能够调节HBx中靶序列的寡聚物并且PA’(和/或PA”,如果存在)可以是能够调节不同靶序列的寡聚物。在某些实施方案中,PA’(和/或PA”,如果存在)可以有能力调节HBV的HBsAg中的靶序列。例如PA’(和/或PA”,如果存在)可以是能够调节HBV的HBsAg中靶序列的寡聚物,如本文所述。
在一些实施方案中,PA’可以是能够调节HBx中靶序列的寡聚物并且PA(和/或PA”,如果存在)可以是能够调节来自HBV的不同靶序列的寡聚物。在某些实施方案中,PA(和/或PA”,如果存在)可以有能力调节HBV的HBsAg中的靶序列。例如,PA(和/或PA”,如果存在)可以是能够调节HBV的HBsAg中靶序列的寡聚物,如本文所述。
每种寡聚物区域可以旁侧分布有生物可切割区域(区域PB)、所述生物可切割区域可以例如是1–10个连续核苷酸的其他区域(区域PB),其包含至少一个磷酸二酯键。可以使用其他生理不稳定核苷区域。
在一些实施方案中,本发明的寡聚物化合物共价连接至缀合物基团、靶向基团、反应性基团、活化基团或封闭基团,任选地借助包含磷酸二酯连接的(例如1–10个)DNA核苷或RNA核苷的短区域。这类基团的例子是本文中提到的载体组分和缀合组分。
在一些实施方案中,本发明的化合物不包含RNA(单元)。在一些实施方案中,本发明的化合物形成单条连续序列,其任选地连接至官能基团,如缀合物基团,并且是这种线型分子或作为线型分子合成。寡聚物化合物因此可以是单链分子。在一些实施方案中,寡聚物不包含例如至少3、4或5个连续核苷酸的短区域,所述短区域互补于相同的寡聚物化合物内部的等同区域(即双链体)。在一些实施方案中,寡聚物可以(基本上)不是双链的。在一些实施方案中,寡聚物基本上不是双链的,如不是siRNA。
寡聚物区域PA、PA’和(如果存在)PA”是硫代磷酸酯寡聚物,即在每种寡聚物区域PA、PA’和(如果存在)PA”内部至少70%的核苷间键是硫代磷酸酯键,如如果存在寡聚物区域PA、PA’和PA”(如果存在)的至少80%或至少90%或全部核苷间键是硫代磷酸酯。
在一些实施方案中,寡聚物区域PA、PA’和(如果存在)PA”可以形成单条连续寡核苷酸序列。区域PA、PA’和PA”由区域PB(例如磷酸二酯连接的1、2、3、4或5个DNA核苷的区域)间隔。
当区域PB仅包含1个核苷时,在区域PB核苷(例如DNA核苷)之间的至少一个或两个核苷间键可以是磷酸二酯键。当区域PB仅包含2个或更多个核苷时,在区域PB核苷(例如DNA核苷)之间的核苷间键可以是磷酸二酯键和/或可以是另一种核苷间键,如硫代磷酸酯键。
本发明的寡聚物,如PA、PA’和(如果存在)PA”,不形成siRNA复合物的一部分。本发明的寡聚物,如PA、PA’和(如果存在)PA”,是非互补的,例如,它们彼此不杂交以形成超过8个连续碱基对或在一些实施方案中超过6个连续碱基对的区域。在一些实施方案中,区域PA和PA”不彼此杂交以形成超过4个连续碱基对的区域。示例性碱基对可以在A-T、G-C或A-U之间。在存在三个寡聚物区域PA、PA’和PA”的情况下,非互补性处于PA和PA’、和PA’和PA”、以及PA和PA”之间。
寡聚物区域PA、PA’和(如果存在)PA”不处于具有(基本上)互补寡核苷酸的双链体形式–例如不是siRNA。
在一些实施方案中,寡聚物区域PA、PA’和PA”共有相同的连续核苷酸序列。在一些实施方案中,寡聚物区域PA和PA’共有相同的连续核苷酸序列。在这个方面本发明提供单个化合物,其可以用来递送多个拷贝的寡聚物(即,具有相同的连续核碱基序列和任选地相同化学修饰)至靶组织。
寡聚物区域(PA、PA’和(如果存在)PA”)借助本文中称作区域PB(和,其中存在多于一个区域PB、区域PB’和区域PB”)的至少一个生物可切割区域连接。在一些实施方案中,区域PB包含在寡聚物区域之间或在一个(或每个)寡聚物区域和连接基之间形成生理不稳定区域的1–10个核苷。可以使用DNA磷酸二酯核苷区域,但是可以使用其他核苷酸区域如果它们适当地是生理不稳定的。
在一些实施方案中,在寡聚物区域(PA、PA’或(如果存在)PA”)和(每个)第二区域PB之间的核苷间键是与第一(或仅)DNA核苷连接的磷酸二酯,或者区域PB的RNA核苷包含磷酸二酯连接的至少一个DNA核苷或RNA核苷。
在一些实施方案中,区域PB可以包含可以经磷酸二酯连接的其他DNA核苷或RNA核苷。
如本文解释,区域PB也可以用来将官能团接合至寡聚物区域、任选地借助其他连接基团(PY)。PCT/EP 2013/073858中详述了区域PB作为将官能团接合至寡聚物的可切割接头的用途,所述文献因而通过引用的方式并入。
在一些实施方案中,区域PB进一步共价连接至可以例如是缀合物、靶向基团、反应性基团和/或封闭基团(PC)的第三区域。基团(PC)可以是如本文所述的载体组分。
在一些方面,本发明基于提供生理不稳定区域、第二区域、连接第一区域,例如反义寡核苷酸、和缀合物或官能团,例如载体组分。生理不稳定区域可以包含磷酸二酯连接的至少一个核苷,如DNA核苷或RNA核苷,如磷酸二酯连接的1、2、3、4、5、6、7、8、9或10个核苷,如DNA或RNA。在一些实施方案中,寡聚物化合物包含可切割(生理不稳定)接头。在这个方面,可切割接头优选地存在于区域PB中(或在一些实施方案中,存在于区域PA和PB之间)。
在一些实施方案中,一个(或多个或全部)区域PB可以包含借助磷酸二酯键与第一区域连接的至少一个DNA核苷或RNA核苷或由其组成。在一些方面,将寡聚物区域和第二区域之间的核苷间键视为区域PB的一部分。
在一些实施方案中,一个(或多个或每个)区域PB包含至少1个至10个连接的核苷,如1、2、3、4、5、6、7、8、9或10个连接的DNA核苷酸或RNA核苷酸,或由其组成。尽管认为DNA/RNA磷酸二酯的区域在提供可切割接头方面重要,但区域PB还可能包含糖修饰的核苷类似物,如在上文第一区域下提到的那些。然而在一些实施方案中,区域PB的核苷(任选独立地)选自DNA和RNA。在一些实施方案中,区域PB的核苷是(任选地独立是)DNA。将认识到,区域PB的核苷可以包括天然存在的或非天然存在的核碱基。一般,区域PB包含磷酸二酯连接的至少一个DNA核苷或RNA核苷(在一些实施方案中,它可以是与寡聚物毗邻的第一个核苷)。如果区域PB包含其他核苷,区域PB还可以包含除磷酸二酯之外的其他核苷键如(任选独立地)硫代磷酸酯、二硫代磷酸酯,硼烷磷酸酯或甲基膦酸酯组成。然而,在其他例举的实施方案中,区域PB中的全部核苷间键均是硫代磷酸酯。在一些实施方案中,区域PB的全部核苷(任选独立地)包含2’-OH核糖(RNA)或2’-H糖,即RNA或DNA。已经显示磷酸酯(磷酸二酯)连接的1–5或1-4个之间如2、3、4个DNA核苷特别地可用于本发明的化合物中。
在一些实施方案中,第二区域包含至少1个至10个(例如磷酸二酯)连接的DNA核苷或RNA核苷,如1、2、3、4、5、6、7、8、9或10个(例如磷酸二酯)连接的DNA核苷酸或RNA核苷酸,或由其组成。
在一些实施方案中,区域PB包含不多于3个或不多于4个连续DNA核苷或RNA核苷(如DNA核苷)。因而,B区可以如此之短,从而它不召集RNA酶,一个在区域PB不形成与靶互补的单条连续核碱基序列的一部分时的实施方案中可能重要的方面。在一些实施方案中也可以优选较短(例如1–4个核苷酸长度)的区域PB,因为它们不大可能是序列特异性限制性酶的靶。因而,可以改变区域PB对核酸内切酶切割的敏感性,并且因而在体内或甚至细胞间微调活性寡聚体的活化速率。适当地,如果需要极迅速活化,可以使用较长的区域PB和/或包含(例如细胞或组织特异性或差异性表达的)限制性酶的识别位点的区域B。
在一些实施方案中,区域PB可以缀合至官能团(PC),如缀合物、靶向反应性基团、活化基团、或封闭基团,任选地借助接头基团(PY,如本文中提供的那些)缀合。官能团也可以借助其他手段,例如借助磷酸酯核苷键(例如磷酸二酯、硫代磷酸酯、二硫代磷酸酯、硼烷磷酸酯或甲基磷酸酯)或三唑基团连接至寡聚物区域或本发明的化合物。在一些方面,连接基团与在至少两个寡聚物区域之间的区域PB相同,并且本身可以是磷酸二酯键。
在一些实施方案中,一个(或多个或每个)区域PB的DNA核苷酸或RNA核苷酸独立选自DNA核苷酸和RNA核苷酸。在一些实施方案中,一个(或多个或每个)区域PB的DNA核苷酸或RNA核苷酸是DNA核苷酸。在一些实施方案中,一个(或多个或每个)区域PB的DNA核苷酸或RNA核苷酸是RNA核苷酸。
在第二区域的背景下,术语DNA核苷和RNA核苷可以包括天然存在的或非天然存在的碱基(也称作碱基类似物或修饰的碱基)。
将认识到,在一些实施方案中,一个(或多个或每个)区域PB还可以包含其他核苷酸或核苷酸类似物。在一些实施方案中,一个(或多个或每个)区域PB仅包含DNA核苷或RNA核苷。在一些实施方案中,一个(或多个或每个)区域PB包含多于一种核苷,并且一个或每个区域PB中的核苷间键包括磷酸二酯键。在一些实施方案中,当一个(或多个或每个)区域PB包含多于一种核苷时,第二区域中的全部核苷间键均包含磷酸二酯键。
在一些实施方案中,一个(或多个或每个)区域PB的至少两个连续核苷是DNA核苷(如至少3或4或5个连续DNA核苷酸)。在一些实施方案中,一个(或多个或每个)区域PB的至少两个连续核苷是RNA核苷(如至少3或4或5个连续RNA核苷酸)。在一些实施方案中,一个(或多个或每个)区域PB的至少两个连续核苷是至少一个DNA核苷和至少一个RNA核苷。在区域PA和区域PB之间的核苷间键可以是磷酸二酯键。在一些实施方案中,当区域PB包含多于一种核苷时,至少一个其他核苷间键是磷酸二酯–如与区域PA毗邻的2个(或3个或4个或5个)核苷之间的连接基团。
分别经由另外的寡聚物区域(PA’)或缀合物部分或相似基团(例如封闭性部分/基团、靶向部分/基团或治疗性小分子部分)、任选地经由接头基团(即第二区域和缀合物/封闭性基团等部分之间),区域PB可以在至少一侧(5’或3’侧)旁侧分布有第一区域,例如反义寡核苷酸,并且在另一侧(分别是3’或5’侧)旁侧分布。
在一些实施方案中,当寡聚物区域(例如PA、PA’和/或PA”)和PB与互补性靶序列对齐时,区域PB不形成互补序列。
在一些实施方案中,当寡聚物区域(例如PA、PA’和/或PA”)和PB与互补性靶序列对齐时,区域PB形成互补序列。在这个方面,区域PA和PB在一起可以形成与靶序列互补的单条连续序列。
在一些实施方案中,基于靶组织或细胞或亚细胞区室中存在的优势核酸内切酶、切割酶,选择区域PB中的碱基序列以提供最佳核酸内切酶切割位点。在这个方面,通过从靶组织和非靶组织分离细胞提取物,与非靶细胞(例如肾)相比,可以基于所需靶细胞(例如肝脏/肝细胞)中的偏好性切割活性,选择用于区域PB中的核酸内切酶切割序列。在这个方面,化合物用于目标下调的效力可以针对所需的组织/细胞进行优化。
在一些实施方案中,区域PB包含序列AA、AT、AC、AG、TA、TT、TC、TG、CA、CT、CC、CG、GA、GT、GC或GG的二核苷酸,其中C可以是5-甲基胞嘧啶,和/或T可以替换为U。
在一些实施方案中,区域PB包含序列AAA、AAT、AAC、AAG、ATA、ATT、ATC、ATG、ACA、ACT、ACC、ACG、AGA、AGT、AGC、AGG、TAA、TAT、TAC、TAG、TTA、TTT、TTC、TAG、TCA、TCT、TCC、TCG、TGA、TGT、TGC、TGG、CAA、CAT、CAC、CAG、CTA、CTG、CTC、CTT、CCA、CCT、CCC、CCG、CGA、CGT、CGC、CGG、GAA、GAT、GAC、CAG、GTA、GTT、GTC、GTG、GCA、GCT、GCC、GCG、GGA、GGT、GGC和GGG的三核苷酸,其中C可以是5-甲基胞嘧啶和/或T可以替换为U。
在一些实施方案中,区域PB包含序列AAAX、AATX、AACX、AAGX、ATAX、ATTX、ATCX、ATGX、ACAX、ACTX、ACCX、ACGX、AGAX、AGTX、AGCX、AGGX、TAAX、TATX、TACX、TAGX、TTAX、TTTX、TTCX、TAGX、TCAX、TCTX、TCCX、TCGX、TGAX、TGTX、TGCX、TGGX、CAAX、CATX、CACX、CAGX、CTAX、CTGX、CTCX、CTTX、CCAX、CCTX、CCCX、CCGX、CGAX、CGTX、CGCX、CGGX、GAAX、GATX、GACX、CAGX、GTAX、GTTX、GTCX、GTGX、GCAX、GCTX、GCCX、GCGX、GGAX、GGTX、GGCX和GGGX的四核苷酸,其中X可以选自A、T、U、G、C及它们的类似物,其中C可以是5-甲基胞嘧啶和/或T可以替换为U。将认识到,当提到(天然存在的)核碱基A、T、U、G、C时,这些核碱基可以用作为等同的天然核碱基发挥作用(例如与互补核苷碱基配对)的核碱基类似物置换。
在一些实施方案中,本发明的化合物可以包含多于一种缀合物基团(或多于一种官能团PX–如缀合物基团、靶向基团、封闭基团或活化的基团或反应性或活化基团)如2个或3个这类基团。在一些实施方案中,区域PB与至少一个官能团如两个或三个官能团共价连接,任选地借助(例如非核苷酸)接头基团共价连接。在一些实施方案中,第一区域(PA)可以共价连接(例如借助核苷间键,如磷酸二酯键)至两个区域PB,例如,一个在第一区域PA的5’和一个在第一区域PA的3’,其中每个区域PB可以是(任选独立地)选自本文所述的区域PB。
组合物
本发明的寡聚物和本发明的寡聚物缀合物可以用于药物制剂和组合物中。适当地,这类组合物包含可药用稀释剂、载体、盐或辅剂。WO2007/03109提供适用和优选的可药用稀释剂、载体和辅剂,所述文献因而通过引用的方式并入。在WO 2007/03109中还提供合适的剂量、制剂、施用途径、组合物、剂型、与其他治疗药组合、前药制剂,所述文献还因而通过引用的方式并入。
本发明的药物组合物可以包括可药用载体,所述可药用载体可以含有提供多种功能的多种组分,所述功能包括调节药物浓度、调节溶解度、化学稳定作用、调节粘度、吸收增强、调节pH等。
药用载体可以包括合适的液体溶媒或赋形剂和任选的辅助添加物或添加物。液体溶媒和赋形剂是常规和市售的。示意性药用载体是蒸馏水、生理盐水、右旋糖水溶液等。对于水溶性制剂,药物组合物优选地包含缓冲液如磷酸盐缓冲液或其他有机酸盐,优选地处于pH 6.5至8范围内。对于含有微溶性反义化合物的制剂,可以使用微乳液,例如通过按0.04-0.05%(w/v)的量使用非离子表面活性剂如聚山梨醇酯-80,以增加溶解度。其他组分可以包括抗氧化剂(如抗坏血酸)、亲水聚合物,如,单糖、二糖和其他糖类(包括纤维素或其衍生物、糊精)、螯合剂,如EDTA及药物科学技术人员熟知的类似组分,例如,Remington's Pharmaceutical Science,最新版(Mack Publishing Company,Easton,Pa.)。
本发明的寡核苷酸包括其可药用盐,包括碱土金属(例如,钠或镁)、铵或NX4+(其中X是C1-C4烷基)的那些盐。其他可药用盐包括有机羧酸盐如甲酸盐、乙酸盐、乳酸盐、酒石酸盐、苹果酸盐、羟乙基磺酸盐、乳糖酸盐和琥珀酸;有机磺酸盐如甲磺酸盐、乙磺酸盐、甲苯磺酸盐和苯磺酸盐;和无机酸盐如氢氯酸盐、硫酸盐、磷酸盐和氨基磺酸盐。具有羟基的化合物的可药用盐包括这类化合物的阴离子,连同合适的阳离子如Na+、NH4+等。
患者应当接受足够每日剂量的寡核苷酸以实现有效而安全胞间浓度的组合寡核苷酸。本领域技术人员应当轻易地能够导出适宜的施用剂量和方案以适合患者的特定情况和需求。
可以通过用于确定缓解是否已经出现的例行方法评估治疗的有效性。这类方法通常取决于形态分析、细胞化学分析、细胞遗传分析、免疫学分析和分子分析。此外,缓解可以通过探测一个或多个相关基因的表达水平按遗传方式评定。逆转录酶聚合酶链反应(RT-PCR)方法学可以用来检测甚至很低数目的mRNA转录物。
寡核苷酸递送技术
本发明的寡核苷酸和缀合物可以以优选地经口或局部施用至受试者,但是也可以通过注射静脉内施用。因此设计载体。备选地,寡核苷酸可以借助控释剂型或常规静脉内注射制剂皮下施用。施用寡核苷酸的优选方法包括局部、全身性或区域灌注法,如适宜。根据区域灌注方法,将供给含有损害的肢体的流入和流出血管分离并连接至低流量灌注泵,后者与氧合器和换热器连接。髂血管可以用于灌注下肢。对于上肢损害,在腋窝高处对腋窝血管进行插管。将寡核苷酸添加至灌注回路,并将灌注持续适宜的时间段,例如,1小时。约100至约150ml/分钟的灌注速率可以用于下肢损害,而该速率的一半应当用于上肢损害。全身性肝素化可以在整个灌注期间使用并且在灌注结束后逆转。这种隔离灌注技术允许施用在输注入动脉或静脉全身循环时否则将忍受的更高剂量化疗药。
在一个具体实施方案中,将本发明的寡聚物和缀合物全身施用或配制用于全身性施用。
对于全身性输注,寡核苷酸优选地借助中央静脉导管递送,所述导管连接至适宜的连续输注装置。留置导管提供用于延长时间频繁施用药物的长期静脉内循环通路。它们通常在全身麻醉或局部麻醉下以手术方式插入头外静脉或颈内静脉。锁骨下静脉是另一个常见的插管术部位。输注泵可以是外置的,或可以形成完全植入式中央静脉系统如从Infusaid Corp.,Norwood,Mass可获得的INFUSAPORT系统和从Pharmacia Laboratories,Piscataway,N.J可获得的PORT-A-CATH系统的一部分。将这些装置在局部麻醉下植入皮下袋。与泵注射端口连接的导管经锁骨下静脉传功抵达上腔静脉。植入物在储器中含有寡核苷酸补给,所述寡核苷酸补给可以根据需要从皮下注射针经储器中的自密封隔膜通过注射额外的药物而补充。完全植入式输注器是优选的,因为患者通常因这类装置的便利性、易于维护性和美容优点而良好接受它们。
本发明的寡核苷酸和缀合物可以通过美国专利4,740,463中描述的任何方法引入,所述文献通过引用方式并入本文。一项技术是体外转染,它可以通过几种不同方法做到。一种转染方法涉及添加DEAE-葡聚糖以增加受体细胞摄取裸DNA分子。参见McCutchin,J.H.和Pagano,J.S.,J.Natl.Cancer Inst.41,351-7(1968)。另一种转染方法是磷酸钙沉淀技术,其依赖于添加Ca2+至含磷酸盐的DNA溶液。所产生的沉淀物表面上包括与磷酸钙晶体缔合的DNA。这些晶体停留到细胞单层上;所致的晶体和细胞表面接合似乎导致DNA的摄取。小比例的摄取的DNA在转染子以及其克隆性后代中表达。参见Graham,F.L.与van der Eb,A.J.,Virology 52,456-467(1973)和Virology 54,536-539(1973)。
转染也可以通过阳离子磷脂介导的递送实施。特别地,聚阳离子脂质体可以从N-[1-(2,3-二油基氧基)丙基]-N,N,N-三甲基氯化铵(DOT-MA)形成。参见Felgner等人,Proc.Natl.Acad.Sci.,84,7413-7417(1987)(DNA转染);Malone等人,Proc.Natl.Acad.Sci.,86,6077-6081(1989)(RNA转染)。
对于全身或局部体内施用,寡核苷酸的量可以根据疾病的性质和程度、所用的特定寡核苷酸和其他因素变动。施用的实际剂量可以考虑患者体格大小和体重、治疗的性质是否在本质上为预防或治疗、患者年龄、健康和性别、施用途径、治疗是否为局部或全身性和其他因素。
除随常规药用载体施用之外,反义寡核苷酸还可以通过多种专业化寡核苷酸递送技术施用。适合随本发明药物组合物一起使用的缓释系统包括薄膜、微胶囊等形式的半透性聚合物基质,所述基质可以包含聚乳酸;L-谷氨酸和γ-L-谷氨酸乙酯的共聚物、聚(2-甲基丙烯酸羟乙酯)和类似材料,例如,Rosenberg等人,国际申请PCT/US92/05305。
寡核苷酸和缀合物可以封囊于治疗性递送用脂质体中,如例如Liposome Technology,第II卷,Incorporation of Drugs,Proteins,and Genetic Material,CRC Press中所述。寡核苷酸,取决于其溶解度,可以同时存在水层和脂质层中,或存在于通常提到的脂质体悬液中。疏水性层,通常但非排他地,包含磷脂如卵磷脂和鞘磷脂、类固醇如胆固醇、离子型表面活性剂如二乙酰基磷酸酯、硬脂胺或磷脂酸、和/或具有疏水性质的其他材料。还包含在(DeLong等人,Nucl.Acid.Res.,1999,27(16),3334-3341)中描述的新的阳离子两亲分子,称作“分子伞”。
本发明的实施方案可以借助颗粒物系统和/或聚合物递送。用于体外和体内递送多核苷酸的颗粒物系统和聚合物已经由Felgner在Advanced Drug Delivery Reviews 5,163-187(1990)中充分综述。还在CookS.T.Antisense Drug Technology,Principles,Strategies,and Applications,Marcel Dekker,Inc,2001.中描述了用于直接递送的技术。
前药
寡核苷酸可以作为携带亲脂基团例如甲基-SATE(S-乙酰硫代乙基)或t-Bu-SATE(S-新戊酰硫代乙基)保护基的前药合成,所述亲脂基团向寡聚物赋予核酸酶抗性、改善细胞摄取并在进入细胞后选择性去保护,如Vives等人,Nucl.Acids Res.1999,Vol.27,4071-4076中所述。
环状分子
寡核苷酸可以作为环状分子合成,其中寡核苷酸的5′和3′末端共价连接或由亲和力对结合在一起,所述亲和力对的一个成员共价连接至5′末端并且另一个共价连接至3′末端。这种环化作用保护寡核苷酸免于核酸外切酶降解并且还可以改善细胞摄取和分布。在本发明的一个方面,当进入任何类型的人或脊椎动物细胞时,连接环状核苷酸的5′末端和3′末端的部分自动遭切割,因而使寡核苷酸线性化并使得它与其靶序列高效杂交成为可能。在另一个方面,连接环状核苷酸的5′末端和3′末端的部分如此设计,从而切割优选地仅出现在特定类型的细胞中,所述细胞表达作为反义寡核苷酸的靶的mRNA。例如,针对涉及病毒性疾病的基因的环状反义寡核苷酸可以通过仅在表达所讨论基因(例如HBV HBx或HBsAg)的细胞亚群中的线性化发挥作用。
额外的药物实体
本发明的寡聚物和寡聚物缀合物可以用作主要治疗药用于治疗疾病状态、或可以与非寡核苷酸药物组合使用。
因此,本发明提供一种包含如本文所述的药物组合物和额外药物实体的药物系统。额外的药物实体可以是本领域已知的任何治疗药。例如,额外的药物实体可以是抗体、小分子治疗药、多核苷酸或基因治疗载体(例如,能够表达治疗性多肽或RNAi剂的载体)。
因此,本发明的寡聚物或寡聚物缀合物可以与其他有活性物质如其他抗病毒活性物质组合使用。
以举例方式,本发明的寡聚物或寡聚物缀合物可以与通过反义(包括其他LNA寡聚物)、siRNA(如ARC520)、适配体、吗啉代物或任何其他抗病毒药、核苷酸序列依赖性作用模式发挥作用的其他活性物质如基于寡核苷酸的抗病毒药–如基于序列特异性寡核苷酸的抗病毒药组合使用。
通过其他例子,本发明的寡聚物或寡聚物缀合物可以与其他活性物质如免疫刺激性抗病毒化合物,如干扰素(例如PEG化干扰素α)、TLR7激动剂(例如GS-9620)或治疗性疫苗组合使用。
通过其他例子,本发明的寡聚物或寡聚物缀合物可以与其他活性物质如具有抗病毒活性的小分子组合使用。这些其他活性物可以例如是核苷/核苷酸抑制剂(例如,恩替卡韦或富马酸替诺福韦二吡呋酯)、衣壳化抑制剂、进入抑制剂(例如,Myrcludex B)。
在某些实施方案中,额外的治疗药可以是HBV药、丙型肝炎病毒(HCV)药、化疗药、抗生素、镇痛药、非甾体抗炎(NSAID)药、抗真菌药、抗寄生虫药、抗恶心药、抗腹泻药或免疫抑制药。
在具体的相关实施方案中,额外的HBV药可以是干扰素α-2b、干扰素α-2a和干扰素alphacon-1(聚乙二醇化和非聚乙二醇化)、利巴韦林;HBVRNA复制抑制剂;第二反义寡聚体;HBV治疗性疫苗;HBV预防性疫苗;拉米夫定(3TC);恩替卡韦(ETV);富马酸替诺福韦二吡呋酯(TDF);替比夫定(LdT);阿德福韦;或HBV(单克隆或多克隆)抗体疗法。
在其他具体的相关实施方案中,额外的HCV药可以是干扰素α-2b、干扰素α-2a、和干扰素alphacon-1(聚乙二醇化和非聚乙二醇化);利巴韦林;HCV RNA复制抑制剂(例如,ViroPharma's VP50406系列);HCV反义剂;HCV治疗性疫苗;HCV蛋白酶抑制剂;HCV解旋酶抑制剂;或HCV单克隆或多克隆抗体疗法。
额外的药物实体可以是如本文定义的寡聚物或寡聚物缀合物。
在某些实施方案中,药物系统可以包含本发明提供的至少一种、至少两种、至少三种、直至多种寡聚物或寡聚物缀合物。
在某些实施方案中,额外的药物实体可以是能够调节HBV中靶序列的寡聚物或寡聚物缀合物。寡聚物或缀合物可以各自能够调节HBV HBx或HBsAg中的靶序列。寡聚物或缀合物可以有能力调节HBV中不在HBx或HBsAg内部的靶序列。例如,至少一种寡聚物或缀合物可以有能力调节在HBV基因或HBcAg、HBeAg或DNA聚合酶的mRNA内部的靶序列。
在某些实施方案中,寡聚物或额外的寡聚物、或缀合物、或额外的缀合物、可以有能力调节HBV基因或HBsAg的mRNA中的靶序列。
当使用靶向不同靶序列的寡核苷酸的组合时,不同类型的寡核苷酸的量的比率可以在大范围内变动。根据本发明的一个优选的实施方案,全部类型的寡核苷酸依据体积摩尔浓度以大约等量存在。
施用和剂量
本发明还涉及含有治疗有效量的本发明缀合物的药物组合物。可以配制该组合物用于多种药物递送系统中。一种或多种生理可接受的赋形剂或载体也可以在组合物中包含以便正确配制。用于本发明中的合适制剂存在于Remington's Pharmaceutical Sciences,Mack Publishing Company,Philadelphia,Pa.,第17版,1985中。关于药物递送方法的简要回顾,参见例如Langer(Science 249:1527-1533,1990)。
本发明的药物组合物意在肠胃外、鼻内、局部、口服或局部施用,如通过透皮装置,用于预防性和/或治疗性治疗。可以将药物组合物肠胃外(例如,通过静脉内、肌内或皮下注射)、或通过口服摄入,或通过局部施加或关节内注射。额外的施用途径包括血管内、动脉内、肿瘤内、腹膜内、心室内、硬膜内、以及经鼻、经眼、巩膜内、眶内、直肠、局部或气溶胶吸入施用。在本发明中还特别地包持续释放施用,通过这类手段如储库注射或可蚀植入物或组件。因此,本发明提供用于肠胃外施用的组合物,所述组合物包含溶解或悬浮于可接受载体、优选地含水载体,例如,水、缓冲水、盐水、PBS等中的上述活性剂。组合物可以根据需要含有可药用辅助物质以逼近生理条件,如pH调节剂和缓冲剂、渗透压调节剂、润湿剂、去垢剂等。本发明也提供口服递送的组合物,所述组合物可以含有用于配制片剂、胶囊剂等的惰性成分,如粘合剂或填料。另外,本发明提供局部施用的组合物所述组合物可以含有用于配制乳膏剂、油膏剂等的惰性成分,如溶剂或乳化剂。
在一个具体实施方案中,将本发明的寡聚物和缀合物皮下施用或配制用于皮下施用。
这些组合物可以通过常规消毒技术消毒,或可以进行无菌过滤。可以将所产生的水溶液包装使用或冻干,冻干的制备物在施用之前与无菌含水载体组合。制备物的pH一般将在3和11之间,更优选地在5和9之间或在6和8之间,并且最优选地在7和8之间,如7至7.5。所得到的固体形式的组合物可以按多个单剂量单位包装,每个单剂量单位含有在片剂或胶囊剂的密封包装物中固定量的上文提到的药物或多种药物。固体形式的组合物也可以包装在可变量的容器中,如包装在设计用于局部可施加乳膏剂或油膏剂的可挤压管中。
可以施用含有有效量的组合物用于预防的或治疗性疗法。在预防性应用中,组合物可以施用至受试者,所述受试者具以下临床上确定的素质或增加的易感性:形成肿瘤或癌症、神经变性病或溶酶体疾病。本发明的组合物可以按足够延迟、减少或优选地阻止临床疾病或肿瘤形成发作的量施用至患者(例如,人)。在治疗性应用中,将组合物以足够治愈或至少部分阻滞病症和其并发症症状的量施用至已经患有疾病(例如,癌症、神经变性病或溶酶体贮积病症)的受试者(例如,人)。将足够实现这个目的的量定义为“治疗有效剂量”,一个足以大幅度改善与疾病或医学病状相关的某种症状的化合物量。例如,在治疗癌症、神经变性病、或溶酶体贮积病中,减少、阻止、延迟、抑制或阻滞疾病或病状的任何症状的药物或化合物将是治疗有效的。治疗有效量的药物或化合物不要求治愈疾病或病状,但是将提供对疾病或病状的治疗,从而疾病或病状的发作延迟、受阻或被阻止、或疾病或病状症状改善、或疾病或病状的期限改变,例如,较不严重,或者个体中的恢复加速。有效用于这个目的的量可以取决于疾病或病状的严重程度和患者的体重和总体状态,但是通常是每剂量每位患者约0.5mg至约3000mg药物或多种药物。初始施用和强化施用的合适方案以如下为典型:初始施用,随后按一个或多个小时、日、周或月间隔通过后续施用重复给予。总有效量的在本发明组合物中存在的药物可以作为单次剂量或作为大丸剂或在相对短的时间段内通过输注法施用至哺乳动物,或可以使用分割治疗方案使用,在所述分割治疗方案中将多个剂量经一个更为延长的时间段(例如,每4-6、8-12、14-16或18-24小时或每2-4天、1-2周、每月1次给药)施用。备选地,构思足以在血液中维持治疗有效浓度的连续静脉内输注。
在本发明组合物内存在并且在应用于哺乳动物(例如,人)的本发明方法中所用的一种或多种药物的治疗有效量可以由普通技术人员在考虑哺乳动物年龄、体重和状况的个体差异情况下确定。将本发明的药物以有效量施用至受试者(例如哺乳动物,如人),所述有销量是在治疗的受试者中产生所需结果(例如,减慢或缓解癌症或神经变性病)的量。治疗有效量可以由本领域技术人员经验地确定。
该患者还可以按每次给药约0.1至3,000mg每周一次或多次接受药物(例如,每周2、3、4、5、6或7次或更多次),每周剂量0.1至2,500(例如,2,000、1,500、1,000、500、100、10、1、0.5、或0.1)mg。患者还可以接受每两周或三周一次每次给药0.1至3,000mg的组合物药物。可以实施包含有效量的本发明组合物的单次或多次施用,剂量水平和样式由治疗医生选择。可以基于患者中疾病或病状的严重程度确定并调节剂量和施用方案,其中可以根据临床医生常见实施的方法或本文描述的那些方法在整个治疗过程中监测所述严重程度。
本发明的载体和缀合物可以与常规治疗方法或疗法组合使用或者可以独立于常规治疗方法或疗法使用。
当本发明的缀合物在组合疗法中与其他药物一起施用时,它们可以施用依次或同时至个体。备选地,本发明的药物组合物可以由本发明的载体-药物缀合物结合如本文所述的可药用赋形剂和本领域已知的另一个治疗药或预防药的组合组成。
其他应用
本发明的寡聚物可以作为研究试剂用于例如诊断学、治疗药和预防。
在研究中,这类寡聚物可以用来特异性抑制细胞和实验动物中靶序列的表达产物合成(一般通过降解或抑制mRNA并因而防止蛋白质形成),因而促进靶的功能分析或评价其作为治疗性干预的靶的有用性。
在诊断学中,寡聚物可以用来通过RNA印迹、原位杂交或相似的技术,检测和定量细胞和组织中靶序列的表达产物表达。
对于治疗药,通过施用根据本发明的寡聚物化合物治疗疑似患有可以通过调节靶序列的表达加以治疗的疾病或病症的动物或人。还提供通过施用治疗有效量或预防有效量的一种或多种本发明的寡聚物或组合物治疗动物,如用于治疗人的方法,其中所述动物疑似患有或倾向患有与靶序列表达相关的疾病或病症。本发明的寡聚物、缀合物或药物组合物一般以有效量施用。
本发明也提供如所述的本发明化合物或缀合物的用途,用于制造用于治疗如本文提到的疾病的药物,或提供一种治疗如本文提到的病症的方法。
本发明也提供一种治疗如本文提到的病症的方法,所述方法包括施用如本文所述的本发明化合物和/或本发明缀合物和/或本发明的药物组合物至有需要的患者。
病毒性疾病
本发明的寡聚物、寡聚物缀合物和其他组合物可以用于治疗与靶序列相关的病状,如靶序列的突变形式的过量表达或表达。
本发明还提供本发明化合物在制造用于治疗如本文提到的疾病、病症或病状的药物中的用途。
在本发明的背景下,所述疾病、病症或病状可以是病毒性疾病。
在一个实施方案中,病毒性疾病与HBx或HBsAg表达或过量表达相关。病毒性疾病可以是与HBV相关的疾病。这类病毒性疾病的例子包括但不限于乙型肝炎、肝硬化、肝癌(例如肝细胞癌)、胆管癌。
在一个实施方案中,病毒性疾病是乙型肝炎。如普通技术人员将认识到,术语“乙型肝炎”在本发明的背景下指由HBV引起的肝脏传染病。乙型肝炎可以是急性或慢性的。急性疾病造成肝炎症、呕吐、黄疸和偶尔死亡。慢性乙型肝炎可以引起肝硬化和肝癌。
在一个实施方案中,病毒性疾病是肝硬化。如普通技术人员将认识到,术语“肝硬化”在本发明的背景下指特征在于肝脏中存在纤维化和再生结节的晚期肝病。这些变化可以导致肝功能损失。
在一个实施方案中,病毒性疾病是肝癌。如普通技术人员将认识到,“肝癌”在本发明的背景下指源于肝脏中的恶性肿瘤。
在一个实施方案中,病毒性疾病是肝细胞癌(HCC)。如普通技术人员将认识到,“HCC”在本发明的背景下至一个类型的肝癌,其通常继发于病毒性肝炎感染(例如乙型肝炎)出现。眼观上,HCC显示为结节状或浸润性肿瘤。结节型可以是单个的(大团块)或多个(作为肝硬化的并发症形成时)。肿瘤结节呈圆形或卵圆形、灰色或绿色(如果肿瘤产生胆汁)、良好局限但未包封。弥散型呈不良局限并且浸润门静脉或肝静脉(罕见)。显微镜下,存在4个构造和细胞学类型(样式)的HCC:纤维板层样、假腺样(腺样)、多形性(巨细胞)和透明细胞。在充分分化的形式中,肿瘤细胞类似于肝细胞,形成小梁、索状物和巢状物、并且可以在细胞质中含有胆色素。在不良分化形式中,恶性上皮细胞为松散、多形性、间变性、巨大。肿瘤具有稀少的基质和中央坏死,原因是不良血管化。
在一个实施方案中,病毒性疾病是胆管癌。如普通技术人员将认识到,“胆管癌”在本发明背景下指一种形式的癌,所述癌由源于胆管的突变的上皮细胞(或显示上皮分化特征的细胞)组成,所述胆管将胆汁从肝脏引流入肠。
尽管本文公开的多种实施方案与HBV感染相关的病毒性疾病相关,但本发明不受这些示例性实施方案限制。反而,本发明适用于病毒性感染相关的任何病症。
总体而言,本发明一个方面涉及一种治疗哺乳动物的方法,所述哺乳动物患有或疑似患与靶序列的表达产物的异常水平相关的疾病,所述方法包括向哺乳动物施用治疗有效量的靶向至靶序列的寡聚物。本发明的寡聚物可以包含一个或多个LNA单元。本发明的寡聚物、缀合物或药物组合物一般以有效量施用。
本发明的一个有意义方面涉及如本文定义的寡聚物(化合物)或如本文定义的寡聚物缀合物用于制备治疗如本文提到的疾病、病症或病状的药物的用途。
本发明的方法优选地用于治疗或预防HBx或HBsAg异常水平引起的疾病。
换而言之,在一些实施方案中,本发明进一步涉及一种用于治疗HBx或HBsAg异常水平的方法,所述方法包括向有需要的患者施用本发明的寡聚物、或本发明的缀合物或本发明的药物组合物。
本发明还涉及用作药物的如本文定义的寡聚物、组合物或寡聚物缀合物。
本发明还涉及如本文定义的化合物、组合物、或缀合物用于制造药物的用途,所述药物用于治疗HBx或HBsAg的异常水平或HBx或HBsAg的突变体形式(如等位变体,如与本文提及的疾病之一相关的那些)表达。
另外,本发明涉及一种治疗患有疾病或病状(如本文提及的那些)的受试者的方法。
需要治疗的患者是患有或可能患有该疾病或病症的患者。
实施例寡聚物
下表中展示用于本发明中的寡聚物的例子。
表1用来设计LNA修饰的寡聚物的寡核苷酸序列基序。
该表显示了基因型A、B、C和D的全部公开的全长基因型序列内部的保守部分(GenBank),意指给出的寡聚物基序将100%与某基因型内部给定的靶序列部分互补。如此选择全部寡聚物基序,从而它们将基本上靶向基因型A、B、C和D内部的几乎全部序列,因而允许治疗遭这四种基因型中任一者感染的个体。
表2A来自表1的寡聚物基序的子集
表3LNA寡聚物
大写字母指β-D-氧代LNA,C LNA是5-甲基CLNA,小写字母指DNA,mc指a5-甲基胞嘧啶DNA,全部核苷间键均是硫代磷酸酯核苷间键。
表4LNA寡聚物,其中GalNAc2缀合物部分借助C6氨基接头和可切割性ca磷酸二酯键连接至寡聚物。GalNAc2缀合物部分也可以置换为其他GalNac缀合物部分或固醇部分。作为这些寡聚物基础的寡聚物序列基序是来自表2和表3的子集。
大写字母指β-D-氧代LNA,小写字母指DNA,mc/mC指5-甲基胞嘧啶DNA/LNA、s指硫代磷酸酯核苷间键。其中未说明的情况下,键是磷酸二酯核苷间键
与GalNAc缀合之前,表4的LNA寡聚物表述为AM-C6ca–寡聚物,其中AM-C6代表准备用于缀合的氨基接头并且ca是可切割的磷酸二酯键。这些寡聚物通过引用的方式从优先权申请GB1408623.5的表4的并入。
实施方案
作为编号段落展示的本发明以下实施方案可以与本文所述的其他实施方案组合使用:
1.用于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)用于递送所述第一寡聚物至肝脏的载体组分。
2.根据段1用途的寡聚物缀合物,其中所述载体组分能够通过施用所述寡聚物缀合物,递送所述寡聚物至待治疗的受试者的肝脏。
3.根据1或段2用途的寡聚物缀合物,其中所述载体组分能够通过施用所述寡聚物缀合物,递送所述寡聚物至待治疗的受试者的肝细胞。
4.根据段1至3中任一段的用途的寡聚物缀合物,其中所述载体组分是糖缀合物部分。
5.根据段1至4中任一段的用途的寡聚物缀合物,其中所述载体组分是脱唾液酸糖蛋白受体(ASGP-R)靶向部分。
6.根据段4或5的用途的寡聚物缀合物,其中所述糖缀合物部分或ASGP-R靶向部分选自半乳糖、半乳糖胺、N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇。
7.根据段1至6中任一段的用途的寡聚物缀合物,其中所述载体组分是包含2至4个末端半乳糖衍生物、将每个半乳糖衍生物与分支点基团连接的亲水间隔团的GalNAc簇。
8.根据段7的用途的寡聚物缀合物,其中半乳糖衍生物是GalNAc,间隔团是PEG间隔团并且分支点基团是肽,具有两个或更多个氨基,如双赖氨酸或三赖氨酸。
9.根据段1至8中任一段的用途的寡聚物缀合物,其中所述载体组分是GalNAc2。
10.根据段1至9中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域与靶序列具有至少80%互补性。
11.根据段1至10中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域包含一个或多个LNA单元。
12.根据段1至11中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域是缺口聚物。
13.根据段1至12中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,其中每个翼独立地包含一个或多个LNA单元。
14.根据段1至13中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域包含以下任一个基序:2-8-2、3-8-3、2-8-3、3-8-2、2-9-2、3-9-3、2-9-3、3-9-2、2-10-2、3-10-3、3-10-2、2-10-3,其中第一数字是5’LNA翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是3’LNA翼区中LNA单元的数目。
15.根据段1至14中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域是8-30个核苷酸长度。
16.根据段1至15中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域是10-20个核苷酸长度。
17.根据段1至16中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域是10至16个核苷酸长度。
18.根据段1至17中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域是10至14个核苷酸长度。
19.根据段1至18中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域与靶序列结合。
20.根据段1至19中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域能够抑制靶序列的表达、复制或翻译中的任何一个或多个。
21.根据段1至20中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域能够抑制靶序列的表达。
22.根据段1至21中任一段的用途的寡聚物缀合物,其中所述靶序列是基因或mRNA。
23.根据段1至22中任一段的用途的寡聚物缀合物,其中所述靶序列至少包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的部分。
24.根据段1至23中任一段的用途的寡聚物缀合物,其中所述靶序列是编码HBx或HBsAg的基因或mRNA或其天然存在的变体。
25.根据段1至24中任一段的用途的寡聚物缀合物,其中所述靶序列处于作为SEQ ID No:1和/或SEQ ID No:2显示的序列或与其具有至少80%同一性、优选地与其具有至少85%同一性、优选地与其具有至少90%同一性、优选地与其具有至少95%同一性的序列内部。
26.根据段1至24中任一段的用途的寡聚物缀合物,其中所述靶序列处于作为SEQ ID No:1和SEQ ID No:2显示的序列内部。
27.根据段1至26中任一段的用途的寡聚物缀合物,其中所述靶序列与HBV基因型A-H的任一者或多者具有至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性。
28.根据段1至27中任一段的用途的寡聚物缀合物,其中所述靶序列选自任何一个或多个以下位置:
SEQ ID NO:3的
1264-1278;
1530-1544;
1551-1566;
1577至1598;
691-706;
670-684。
29.根据段1至28中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834)。
30.根据段1至29中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域基于选自以下任一者或多者的序列:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
AGCgaagtgcacACG(SEQ ID NO:310)
AGgtgaagcgaAGTG(SEQ ID NO:668);
AGCgaagtgcacaCGG(SEQ ID NO:308);
CGAaccactgaACA(SEQ ID NO:297);
CGCagtatggaTC(SEQ ID NO:300);
AGGtgaagcgaagTGC(SEQ ID NO:315);
AGGtgaagcgaaGTG(SEQ ID NO:316);
GAAccactgaacAAA(SEQ ID NO:294);
CGAaccactgaacAAA(SEQ ID NO:295);
CGAaccactgaaCAA(SEQ ID NO:296);
CGAaccactgaAC(SEQ ID NO:298);
CCGcagtatggaTCG(SEQ ID NO:299);
CGCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagaCGG(SEQ ID NO:304);
GAGaaggcacagaCGG(SEQ ID NO:305);
GAAgtgcacacGG(SEQ ID NO:306);
GCGaagtgcacaCGG(SEQ ID NO:307);
CGAagtgcacaCG(SEQ ID NO:309);
GAAccactgaaCAAA(SEQ ID NO:585);
CGAAccactgaacAAA(SEQ ID NO:588);
GAAgtgcacaCGG(SEQ ID NO:628);
TAGtaaactgagCCA(SEQ ID NO:678);
CGAaccactgAAC(SEQ ID NO:600);
AGGtgaagcgaAGT(SEQ ID NO:317);和
CGAaccactgAACA(SEQ ID NO:597)。
其中大写字母指LNA单元并且小写字母指DNA单元。
31.根据段1至30中任一段的用途的寡聚物缀合物,其中所述寡聚物缀合物选自以下任一者或多者:
其中大写字母指β-D-氧代-LNA单元;小写字母指DNA单元;下标“s”指硫代磷酸酯键;上标m指含有5-甲基胞嘧啶碱基的DNA或β-D-氧代-LNA单元;GN2-C6指带有C6接头的GalNAc2载体组分。
32.根据段1至29中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13)
GCGTAAAGAGAGGT(SEQ ID NO:11)和
CGCGTAAAGAGAGGT(SEQ ID NO:12)。
33.根据段1至29中任一段的用途的寡聚物缀合物,其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19)和
AGGTGAAGCGAAGT(SEQ ID NO:27)。
34.根据段1至33中任一段的用途的寡聚物缀合物,其中所述寡聚物缀合物具有或包含以下结构:
载体组分–L1-第一寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L2-载体组分
其中L2是任选的接头或分支区域或系索分子或桥接部分。
35.根据段1至34中任一段的用途的寡聚物缀合物,其中所述寡聚物缀合物具有或包含以下结构:
载体组分–L1-第一寡聚物区域
其中L1是任选的接头。
36.根据段34或段35的用途的寡聚物缀合物,其中所述接头1存在。
37.根据段1至36中任一段的用途的寡聚物缀合物,其中所述载体组分连接、优选地缀合至所述寡聚物的5'末端。
38.根据段34至37的用途的寡聚物缀合物,其中接头基团或分支区域是生理不稳定接头基团或生理不稳定分支区域或生理不稳定系索分子或生理不稳定桥接部分。
39.根据段38的用途的寡聚物缀合物,其中生理不稳定接头基团是核酸酶敏感接头。
40.根据段38或39的用途的寡聚物缀合物,其中生理不稳定接头还与C6至C12氨基烷基缀合。
41.根据段1至40中任一段的用途的寡聚物缀合物,还包含能够调节靶序列的第二寡聚物区域。
42.根据段41的用途的寡聚物缀合物,其中第一寡聚物区域和第二寡聚物区域各自能够调节HBV的HBx或HBsAg中的靶序列。
43.根据段31或42中任一段的用途的寡聚物缀合物,其中第一寡聚物区域和第二寡聚物区域各自能够调节HBV的HBx或HBsAg中的靶序列;其中所述靶区域是不同的。
44.根据段41至43中任一段的用途的寡聚物缀合物,其中所述寡聚物缀合物具有或包含以下结构:
载体组分–L1-第一寡聚物区域–L2–第二寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L2–第二寡聚物区域-L3–载体组分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L2和L3可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
载体组分1–L1-第一寡聚物区域–L2–第二寡聚物区域-L3–载体组分2
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L1、L2和L3可以是相同或不同的
其中载体组分1和载体组分2可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L1-载体组分1–L2–第二寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2和L3可以是相同或不同的;或
其中所述寡聚物缀合物具有或包含以下结构:
第一寡聚物区域–L1-载体组分1–L2–第二寡聚物区域-L3–载体组分2
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2可以是相同或不同的
其中载体组分1和载体组分2可以是相同或不同的;或。
其中所述寡聚物缀合物具有或包含以下结构:
载体组分1–L1-第一寡聚物区域–L2-载体组分2–L3–第二寡聚物区域-L4–载体组分3
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L3是任选的接头或分支区域或系索分子或桥接部分
其中L1、L2和L3可以是相同或不同的
其中载体组分1、载体组分2和载体组分3可以是相同或不同的。
45.根据段39至43中任一段的用途的寡聚物缀合物,其中所述寡聚物缀合物具有或包含以下结构:
载体组分–L1-第一寡聚物区域–L2–第二寡聚物区域
其中L1是任选的接头或分支区域或系索分子或桥接部分
其中L2是任选的接头或分支区域或系索分子或桥接部分
其中L1和L2可以是相同或不同的。
46.根据段45的用途的寡聚物缀合物,其中所述接头1存在。
47.根据段45或段46的用途的寡聚物缀合物,其中所述接头2存在。
48.根据段41至46中任一段的用途的寡聚物缀合物,其中所述载体组分连接、优选地缀合至所述寡聚物的5'末端。
49.根据段41至48中任一段的用途的寡聚物缀合物,其中第一寡聚物区域和第二寡聚物区域各自借助接头或分支区域连接、优选地缀合。
50.根据段41至49中任一段的用途的寡聚物缀合物,其中第一寡聚物区域和第二寡聚物区域各自借助生理不稳定接头基团或生理不稳定分支区域连接、优选地缀合。
51.根据段1至50中任一段的用途的寡聚物缀合物,其中所述病毒性疾病是乙型肝炎或与HBV相关的疾病。
52.根据段1至51中任一段的用途的寡聚物缀合物,其中所述病毒性疾病与HBx或HBsAg的表达或过量表达相关。
53.根据段1至52中任一段的用途的寡聚物缀合物,其中所述寡聚物缀合物皮下施用。
54.用于治疗病毒性疾病的组合物,其中所述组合物包含如段1至53中任一段所限定的寡聚物缀合物和至少一个额外的不同寡核苷酸。
55.根据段54的用途的组合物,其中至少一个所述额外的不同寡核苷酸是寡聚物缀合物。
56.根据段54或段55的用途的组合物,其中每个所述额外的不同寡核苷酸是寡聚物缀合物。
57.根据段54至56中任一段的用途的组合物,其中每个所述额外的不同寡核苷酸能够调节HBV中的靶序列。
58.根据段54至57中任一段的用途的组合物,其中至少一个所述额外的不同寡核苷酸能够调节HBV的HBx或HBsAg中的靶序列。
59.根据段54至58中任一段的用途的组合物,其中至少一个所述额外的不同寡核苷酸能够调节HBV的HBx或HBsAg中的靶序列;并且其中所述至少一个所述额外的不同寡核苷酸能够调节HBV的HBx或HBsAg中的靶序列,所述靶序列不同于如段1至53中任一段所限定的寡聚物缀合物靶向的靶序列。
60.根据段54至59中任一段的用途的组合物,其中每个所述额外的不同寡核苷酸能够调节HBV的HBx或HBsAg中的靶序列。
61.根据段54至60中任一段的用途的组合物,其中每个所述额外的不同寡核苷酸能够调节HBV的HBx或HBsAg中的靶序列;并且其中每个所述额外的不同寡核苷酸能够调节HBV的HBx或HBsAg中的靶序列,所述靶序列不同于如段1至53中任一段所限定的寡聚物缀合物靶向的靶序列。
62.适于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)用于递送所述第一寡聚物至肝脏的载体组分。
63.根据段62的寡聚物缀合物,其中所述寡聚物如段1至53中任一段限定。
64.适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物缀合物和至少一种额外的不同寡核苷酸;其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)用于递送所述第一寡聚物至肝脏的载体组分。
65.根据段64的组合物,其中所述寡聚物缀合物是如段1-53中任一段或段62至63中任一段所限定的寡聚物缀合物。
66.根据段的组合物64或段65,其中所述额外的不同寡核苷酸是如段62至63中任一段所限定的额外的不同寡核苷酸。
67.寡聚物,基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834)
所述寡聚物能够调节HBV的HBx或HBsAg中的靶序列以治疗病毒性疾病。
68.段67的寡聚物,其中所述寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13)
GCGTAAAGAGAGGT(SEQ ID NO:11)和
CGCGTAAAGAGAGGT(SEQ ID NO:12)。
69.段67的寡聚物,其中所述寡聚物区域基于选自以下任一者或多者的核心基序:
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19)和
AGGTGAAGCGAAGT(SEQ ID NO:27)。
70.根据段67至69中任一段的寡聚物,其中所述寡聚物包含一个或多个LNA单元。
71.根据段67至70中任一段的寡聚物,其中所述寡聚物是缺口聚物。
72.根据段67至71中任一段的寡聚物,其中所述寡聚物包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,其中每个翼独立地包含一个或多个LNA单元。
73.根据67至72段中任一段的寡聚物,其中所述寡聚物区域包含以下任一个基序:2-8-2、3-8-3、2-8-3、3-8-2、2-9-2、3-9-3、2-9-3、3-9-2、2-10-2、3-10-3、3-10-2、2-10-3,其中第一数字是LNA翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是LNA翼区中LNA单元的数目。
74.根据段67至73中任一段的寡聚物,其中所述第一寡聚物区域是10-18个核苷酸长度。
75.根据段67至74中任一段的寡聚物,其中所述第一寡聚物区域是10至16个核苷酸长度。
76.根据段67至75中任一段的寡聚物,其中所述第一寡聚物区域是10至14个核苷酸长度。
77.根据段67至76中任一段的寡聚物,其基于选自以下任一者或多者的序列:
GCGtaaagagaGG(SEQ ID NO:303);
GCGtaaagagaGGT(SEQ ID NO:301);
GCGtaaagagAGG(SEQ ID NO:618);
AGCgaagtgcacACG(SEQ ID NO:310)
AGgtgaagcgaAGTG(SEQ ID NO:668);
AGCgaagtgcacaCGG(SEQ ID NO:308);
CGAaccactgaACA(SEQ ID NO:297);
CGCagtatggaTC(SEQ ID NO:300);
AGGtgaagcgaagTGC(SEQ ID NO:315);
AGGtgaagcgaaGTG(SEQ ID NO:316);
GAAccactgaacAAA(SEQ ID NO:294);
CGAaccactgaacAAA(SEQ ID NO:295);
CGAaccactgaaCAA(SEQ ID NO:296);
CGAaccactgaAC(SEQ ID NO:298);
CCGcagtatggaTCG(SEQ ID NO:299);
CGCgtaaagagaGGT(SEQ ID NO:302);
AGAaggcacagaCGG(SEQ ID NO:304);
GAGaaggcacagaCGG(SEQ ID NO:305);
GAAgtgcacacGG(SEQ ID NO:306);
GCGaagtgcacaCGG(SEQ ID NO:307);
CGAagtgcacaCG(SEQ ID NO:309);
GAAccactgaaCAAA(SEQ ID NO:585);
CGAAccactgaacAAA(SEQ ID NO:588);
GAAgtgcacaCGG(SEQ ID NO:628);
TAGtaaactgagCCA(SEQ ID NO:678);
CGAaccactgAAC(SEQ ID NO:600);
AGGtgaagcgaAGT(SEQ ID NO:317);和
CGAaccactgAACA(SEQ ID NO:597),
其中大写字母指增强亲和力的核苷酸类似物并且小写字母指DNA单元。
78.根据段67至77中任一段的寡聚物,其基于选自以下任一者或多者的序列:
其中大写字母指β-D-氧代-LNA单元;小写字母指DNA单元;下标“s”指硫代磷酸酯键;上标m指含有5-甲基胞嘧啶碱基的DNA或β-D-氧代-LNA单元;AM-C6是氨基-C6接头;其中5’末端基团“AM-C6 c a”是任选的。
79.如段67至78中任一段所限定的寡聚物,用于医学治疗。
80.如段67至79中任一段所限定的寡聚物,用于治疗病毒性疾病。
81.如段79或段80所限定的寡聚物,其中所述寡聚物如段1至53中任一段限定。
82.如段79或段81所限定的寡聚物,其中所述疾病如段1至53中任一段限定。
83.适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物和至少一种额外的不同寡核苷酸;其中所述寡聚物包含能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域。
84.根据段83的组合物,其中所述寡聚物是如段67至82中任一段所限定的寡聚物。
85.根据段83或段84的组合物,其中所述至少一个额外的不同寡核苷酸是如段54至61中任一段所限定的额外的不同寡核苷酸。
86.用于治疗病毒性疾病的方法,所述方法包括向需要治疗的受试者施用有效量的根据段62或段63的寡聚物缀合物或如段1至52中任一段所限定的寡聚物缀合物。
87.用于治疗病毒性疾病的方法,所述方法包括向需要治疗的受试者施用有效量的根据段64至66中任一段的组合物或如段54至61中任一段所限定的组合物或如段83至85中任一段所限定的组合物。
88.用于治疗病毒性疾病的方法,所述方法包括向需要治疗的受试者施用有效量的根据段67至82中任一段的寡聚物。
89.药物组合物,包含根据段62或段63的寡聚物缀合物或如段1至53中任一段所限定的寡聚物缀合物;和一种或多种可药用的稀释剂、载体、盐或佐剂。
90.药物组合物,包含根据段64至66中任一段的组合物或如段54至61中任一段所限定的组合物或如段83至85中任一段所限定的组合物;和一种或多种可药用的稀释剂、载体、盐或佐剂。
91.药物组合物,包含根据段67至82中任一段的寡聚物;和一种或多种可药用的稀释剂、载体、盐或佐剂。
药物系统,包含根据段89至91中任一段的药物组合物和额外的药物实体。
92.制造低根据段1至52中任一段的寡聚物缀合物方法,包括使如段1至53中任一段所限定的一种或多种寡聚物与如段1至53中任一段所限定的载体组分缀合。
93.制造根据段64至66中任一段的组合物的方法,包括将如段1至53中任一段所限定的寡聚物缀合物与可药用的稀释剂、载体、盐或佐剂混合。
94.制造根据段91的组合物方法,包括将如段67至82中任一段所限定的寡聚物与可药用的稀释剂、载体、盐或佐剂混合。
95.根据前述任一个段落的发明,其中寡聚物或寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中修饰的核苷酸的数目,优选地至少一个是LNA单元、优选地全部是LNA单元;第二数字是缺口区中修饰的核苷酸的数目;并且第三数字是翼区中修饰的核苷酸的数目,优选地至少一个是LNA单元、优选地全部是LNA单元。
96.基本上如本文所述并参考实施例的寡聚物缀合物。
97.基本上如本文所述并参考实施例的组合物。
98.基本上如本文所述并参考实施例的寡聚物。
99.基本上如本文所述并参考实施例的方法。
特别的实施方案
本发明涉及用于治疗病毒性疾病的寡聚物缀合物。寡聚物缀合物包含:a)能够调节乙型肝炎病毒(HBV)的HBx和/或HBsAg中的靶序列以治疗所述病毒性疾病的寡聚物;和b)与所述寡聚物缀合的载体组分。优选地,载体组分用于递送所述第一寡聚物至肝脏。
现在提供本发明某些实施方案的优选方面。
在一个方面,本发明提供用于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是8-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分。
在一个方面,本发明提供适于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是8-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分。
在一个方面,本发明提供一种适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物缀合物和至少一种额外的不同寡核苷酸;其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是8-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分。
在一个方面,本发明提供用于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是8-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834)。
在一个方面,本发明提供适于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是8-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
AGCGAAGTGCACACG(SEQ ID NO:20);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834)。
在一个方面,本发明提供一种适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物缀合物和至少一种额外的不同寡核苷酸;其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是8-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834)。
在一个方面,本发明提供用于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供适于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供一种适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物缀合物和至少一种额外的不同寡核苷酸;其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供用于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834);
其中寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供适于治疗病毒性疾病的寡聚物缀合物,其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分
其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834);
其中寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供一种适于治疗病毒性疾病的组合物,其中所述组合物包含寡聚物缀合物和至少一种额外的不同寡核苷酸;其中所述寡聚物缀合物包含:
a)能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;和
b)载体组分,
其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述载体组分是糖缀合物部分,优选地所述载体组分选自半乳糖、半乳糖胺,N-甲酰半乳糖胺、N-乙酰半乳糖胺(GalNAc)、N-丙酰半乳糖胺、N-正丁酰半乳糖胺、N-异丁酰半乳糖胺或其任一种或多种的簇;优选地所述载体组分包含GalNAc或GalNAc簇;优选地所述载体组分是GalNAc2;
其中所述靶序列包含编码HBx或HBsAg的基因或mRNA或其天然存在的变体的至少一部分;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834);
其中寡聚物缀合物的寡聚物组分包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供治疗病毒性疾病的寡聚物,其中所述寡聚物包含能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;并且,其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834);
其中寡聚物包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
在一个方面,本发明提供适于治疗病毒性疾病的寡聚物,其中所述寡聚物包含能够调节乙型肝炎病毒(HBV)的靶序列、优选地HBV的HBx或HBsAg以治疗所述病毒性疾病的至少一个第一寡聚物区域;并且,其中所述第一寡聚物区域是12-16个核苷酸长度;
其中所述第一寡聚物区域是缺口聚物,优选地其中所述第一寡聚物区域包含在每侧上旁侧有翼的2'-脱氧核糖核苷酸缺口区,优选地其中每个翼独立地包含一个或多个LNA单元;
其中所述第一寡聚物区域基于选自以下任一者或多者的核心基序:
GCGTAAAGAGAGG(SEQ ID NO:13);
GCGTAAAGAGAGGT(SEQ ID NO:11);
AGCGAAGTGCACACG(SEQ ID NO:20);
AGGTGAAGCGAAGTG(SEQ ID NO:26);
AGCGAAGTGCACACGG(SEQ ID NO:18);
CGAACCACTGAACA(SEQ ID NO:7);
GAACCACTGAACAAA(SEQ ID NO:4);
CGAACCACTGAACAAA(SEQ ID NO:5);
CGAACCACTGAACAA(SEQ ID NO:6);
CGAACCACTGAAC(SEQ ID NO:8)
CCGCAGTATGGATCG(SEQ ID NO:9)
CGCAGTATGGATC(SEQ ID NO:10);
CGCGTAAAGAGAGGT(SEQ ID NO:12);
AGAAGGCACAGACGG(SEQ ID NO:14);
GAGAAGGCACAGACGG(SEQ ID NO:15)
GAAGTGCACACGG(SEQ ID NO:16);
GCGAAGTGCACACGG(SEQ ID NO:17);
CGAAGTGCACACG(SEQ ID NO:19);
AGGTGAAGCGAAGT(SEQ ID NO:27);和
TAGTAAACTGAGCCA(SEQ ID NO:834);
其中寡聚物包含以下任一个基序:3-10-3、3-10-2、3-9-3、3-9-2、3-8-3、3-8-2,其中第一数字是翼区中LNA单元的数目,第二数字是缺口区中核苷酸的数目,并且第三数字是翼区中LNA单元的数目。
实施例
材料和方法
HBsAg和HBeAg检测
根据制造商的操作方案,使用HBsAg化学发光免疫测定法(CLIA)和HBeAg CLIA试剂盒(Autobio diagnostics Co.Ltd.,郑州,中国,目录号分别是CL0310-2和CL0312-2)测定感染的AAV-HBV小鼠的血清中的血清HBsAg水平和HBeAg水平。简而言之,将50μl血清转移至各自的抗体包被的微量滴定板斌给添加50μl酶缀合物试剂。将平板在室温在摇床上温育60分钟,之后使用自动清洗机,将全部孔用洗涤缓冲液洗涤6次。将25μl底物A及随后25μl底物B添加至每个孔。将平板在室温温育10分钟,之后使用Envision发光读数仪测量发光。HBsAg按单位IU/ml给出;其中1ng HBsAg=1.14IU。HBeAg按单位NCU/ml血清给出。
HBVDNA提取和qPCR
最初,将小鼠血清按倍数10(1:10)用磷酸盐缓冲盐水(PBS)稀释。使用MagNA Pure 96(Roche)机器人提取DNA。将50μl稀释的血清在加工筒中与200μl MagNA Pure 96外部裂解缓冲液(Roche,目录号06374913001)混合并温育10分钟。随后使用“MagNA Pure 96DNA和病毒核酸小体积试剂盒”(Roche,目录号06543588001)和“病毒NA血浆SV外部裂解2.0”方案提取DNA。DNA洗脱体积是50μl。
使用Taqman qPCR仪(ViiA7,life technologies),对提取的HBV DNA进行定量。在PCR中一式两份测试每份DNA样品。将5μl DNA样品添加至384孔平板中15μl含有10μl TaqMan基因表达主混合物(Applied Biosystems,目录号4369016)、0.5μl Prime Time XL qPCR引物/探针(IDT)和4.5μl蒸馏水的PCR主混合物并且使用以下设定进行PCR:UDG温育(2分钟,50℃)、酶活化(10分钟,95℃)和PCR(40个循环,15秒95°变性和1分钟60℃复性及延长)。基于HBV质粒DNA标准曲线,通过ViiA7软件从Ct值计算DNA拷贝数。
TaqMan引物和探针(IDT)的序列:
核心蛋白正向引物(F3_core):CTG TGC CTT GGG TGG CTT T
反向引物(R3_core):AAG GAA AGA AGT CAG AAG GCA AAA
TaqMan探针(P3_core)56-FAM/AGC TCC AAA/ZEN/TTC TTT ATA AGG GTC GAT GTC CAT G/3IABkFQ
组织特异性体外接头切割测定法
使用有关组织(例如肝或肾)的匀浆和血清,FAM标记的具有待测试的生理不稳定接头(例如DNA磷酸二酯接头(PO接头))的寡聚物接受体外切割。
组织和血清样品采集自合适的动物(例如小鼠、猴、猪或大鼠)并且在匀化缓冲液(0.5%Igepal CA-630、25mM Tris pH8.0,100mM NaCl,pH8.0(用1N NaOH调节)中匀浆化。组织匀浆和血清掺入寡聚物至浓度200μg/g组织。将样品在37o温育24小时并且此后将样品用酚-氯仿提取。随后使用Dionex DNApac p-100柱和范围从pH 7.5 10mM–1M高氯酸钠的梯度,将溶液在Dionex Ultimate 3000上进行AIE HPLC分析。使用荧光检测器在615nm和紫外检测器在260nm,相对于标准物,测定切割的和未切割的寡聚物的含量。
S1核酸酶裂解测定法
FAM标记的具有S1核酸酶易感接头(例如DNA磷酸二酯接头(PO接头))的寡聚物在S1核酸酶提取物或血清中接受体外切割。
100μM寡聚物在核酸酶缓冲液(60U pr.100μL)中接受S1核酸酶体外切割20分钟和120分钟。通过向缓冲溶液添加EDTA终止酶活性。随后使用Dionex DNApac p-100柱和范围从pH 7.5 10mM–1M高氯酸钠的梯度,将溶液在Dionex Ultimate 3000上进行AIE HPLC分析。使用荧光检测器在615nm和紫外检测器在260nm,相对于标准物,测定切割的和未切割的寡聚物的含量。
实施例1缀合物的构建
使用磷酰亚胺法在MerMade 12或OligoMaker DNA/RNA合成仪上以4μmol规模在来自Kinovate的尿苷通用支持物或UnyLinker支持物上合成寡核苷酸。在合成结束时,在室温使用氨水1-2小时,从固相支持物切下寡核苷酸并且进一步在65℃去保护16小时。寡核苷酸通过反相HPLC(RP-HPLC)纯化并以UPLC表征,并且通过ESI-MS证实进一步分子质量。见下文更多细节。
寡核苷酸的延长
通过使用5’-O-DMT-保护的磷酰亚胺在乙腈中的0.1M溶液和DCI(4,5–二氰基咪唑)在乙腈(0.25M)中的0.1M作为激活物,进行β-氰基乙基-磷酰亚胺的偶联(DNA-A(Bz)、DNA-G(ibu)、DNA-C(Bz)、DNA-T、LNA-5-甲基-C(Bz)、LNA-A(Bz)、LNA-G(dmf)、LNA-T或氨基-C6接头)。使用氢化黄原素(乙腈/吡啶9:1中0.01M),实施硫化以引入硫代磷酸酯键。使用THF/吡啶/水7:2:1中的0.02M碘,引入磷酸二酯键。其余试剂是一般用于寡核苷酸合成的那些试剂。对于固相合成后缀合,将一种市售C6氨基接头磷酰亚胺用于固相合成的最后循环,并且在脱保护和从固相支持物切下后,分离氨基连接的去保护的寡核苷酸。使用标准合成方法,通过活化羧酸和后续与寡核苷酸5'末端上的胺反应,引入缀合物。
RP-HPLC纯化:
通过制备性RP-HPLC在Phenomenex Jupiter C18 10μ150x10mm柱上纯化粗制的化合物。按流速5mL/分钟使用0.1M乙酸铵pH 8和乙腈作为缓冲液。将收集的级分冻干以产生纯化的化合物,一般作为白色固体。
缩略语:
DCI:4,5-二氰基咪唑
DCM:二氯甲烷
DMF二甲基甲酰胺
DMT:4,4’-二甲氧基三苯甲基
THF:四氢呋喃
Bz:苯甲酰基
Ibu:异丁酰基
RP-HPLC:反相高效液相色谱
实施例2测试体外效力
引言
以下研究中所用的HBsAg测定法是标准方法。它测量产生的病毒的量。它因此测量由于靶向HBx或HBsAg的寡聚物或寡聚物缀合物的病毒减少。此外,靶向HBx转录物的寡聚物或寡聚物缀合物也将靶向HBsAg转录物(还参见结果表中的第3和第4列)。
细胞系
将HepG2.2.15细胞在补充有10%胎牛血清(Invitrogen)和终浓度200mg/L的G418(Invitrogen的DMEM+Glutamax-I培养基(Invitrogen,Carlsbad,CA,美国)中培养并在5%CO2中在37℃维持。
HBsAg测定法
将HepG2.2.15细胞(组成型表达HBV的细胞系)一式两份按1.5x104个细胞/孔接种入白色96孔板。将细胞用单一浓度的寡聚物或用DMSO中化合物的三倍连续稀释物系列处理。全部孔中的DMSO终浓度是1%并且使用DMSO作为对照。
HBsAg化学发光免疫测定法(CLIA)试剂盒(Autobio Diagnostics Co.,郑州,中国)用来半定量测量分泌的HBV抗原的水平。为了检测,使用50μL/孔培养上清液并且如制造商的说明书所指示那样进行流程。使用CellTiter-Glo(Promega,Madison,WI,USA,目录号G7571)测量细胞毒性。使用E-WorkBook套装(ID Business Solutions Ltd.,Guildford,UK),生成剂量-反应曲线并外推出IC50值和CC50值。IC50和CC50定义为与对照相比HBsAg分泌(IC50)和细胞毒性(CC50)分别减少50%的化合物浓度(或条件培养基对数稀释度)。在一系列浓度测试时,数据可以展示为寡聚物的EC50值,或在单一浓度测试时,展示为上清液中HBsAg的绝对水平,作为不含药物的对照样品中HBsAg水平的百分数。
来自单一浓度处理的结果
使用单次剂量的25μM寡聚物在体外效力测定法中筛选了总计290种无缀合物的寡聚物。13天后测量HBV抗原(HBsAg)分泌。下表5显示筛选结果。SEQ ID NO:294至SEQ ID NO:318的寡聚物均降低HBsAg活性到小于对照的40%。SEQ ID NO:584的寡聚物对应于US8,598,334中作为SEQ ID NO:16公开的寡聚物。
使用单次剂量的25μM寡聚物在体外效力测定法中筛选了额外的213种寡聚物。图5a中显示结果。
表5:作为对照%的25μM寡聚物的HBsAg活性
表5a:作为对照%的25μM寡聚物的HBsAg活性
来自多个浓度处理的结果
使用三倍连续稀释物(25.000、8.3333、2.7778、0.9259、0.0343、0.0114、0.0038、0.0013μM寡聚物)在体外效力测定法中测试来自表5的寡聚物选项以评估寡聚物的IC50值和CC50值。13天后测量HBV抗原(HBsAg)分泌。下表6显示分析结果。SEQ ID NO:585的寡聚物对应于US8,598,334中作为SEQ ID NO:16公开的寡聚物。
表6
实施例3体内AAV/HBV小鼠模型:
可以在AAV/HBV小鼠模型中评价抗HBV LNA。在这个模型中,遭携带HBV基因组的重组腺联病毒(AAV)(AAV/HBV)感染的小鼠维持稳定的病毒血症及抗原血症超过30周(Dan Yang等人,2014Cellular&Molecular Immunology 11,71–78)。
无特定病原体的雄性C57BL/6小鼠(4-6周龄)购自SLAC(中国科学院上海实验动物中心)并且在动物护理机构圈养于单通风的笼中。遵循如WuXi IACUC所示的动物护理和使用指南(研究机构动物护理和使用委员会,WUXI IACUC研究方案编号R20131126-小鼠)。允许小鼠适应新环境3天并将其根据实验设计分组。
将重组AAV-HBV稀释于PBS中,每次注射200μL。这种重组病毒携带1.3拷贝的HBV基因组(基因型D,血清型ayw)。
在第0天,通过尾静脉用200μL AAV-HBV注射全部小鼠。在AAV注射后第6、13和20天,对全部小鼠做下颌下放血(0.1ml血液/小鼠)以采集血清。在注射后第22天,用溶媒或按5mg/kg静脉内给予的抗HBV LNA处理具有稳定病毒血症的小鼠。LNA寡聚物可以是未缀合的或GalNAc缀合的。
小鼠一周双次给药2周。第一次LNA给药后第3,7,10和14天天,对全部小鼠做下颌下放血(0.1ml血液/小鼠)以采集血清,旨在监测血清中的HBV表面抗原(HBsAg)、HBV e抗原(HBeAg)和HBV基因组DNA。
实施例4以单次剂量一周双次注射的体内研究
这项研究中使用如实施例3中制备的AAV/HBV小鼠模型。在具有稳定病毒血症的C57BL/6小鼠中测试了10种GalNAc缀合的抗HBV LNA寡聚物,以盐水作为对照。一些寡聚物与如处方那样每公斤0.03mg作为每日口服剂量施用的标准护理核苷类似物(恩替卡韦(ETV))比较。
小鼠每周二次在第0、3、7和10天或第0、3、6和9天用剂量每次注射2mg/kg皮下给药2周。在所示的日期使用“材料和方法”节中描述的方法测量血清中的HBV表面抗原(HBsAg)、HBV e抗原(HBeAg)和HBV基因组DNA。跟踪小鼠23–24天。
下表中显示结果。
表7A-C–在每周2次2mg/kg剂量后的血清HBsAg水平(log10(IU/ml))数据来自三次独立研究。
从这些数据可以得出结论:在体内,全部GalNAc缀合的抗HBV反义寡聚体均能够降低HBV s抗原(HBsAg)的血清水平至低于盐水和护理标准的水平。尤其,能够表明SEQ ID NO:807、SEQ ID NO:808、SEQ ID NO:814、SEQ ID NO:815、SEQ ID NO:825、SEQ ID NO:826大幅度降低血清HBsAg水平。
表8A-C–在每周2次2mg/kg剂量后的血清HBeAg水平(log10(NCU/ml))
从这些数据可以得出结论:在体内,全部GalNAc缀合的抗HBV反义寡聚体均能够降低血清HBeAg水平至低于盐水和护理标准的水平。尤其,能够表明SEQ ID NO:807、SEQ ID NO:808、SEQ ID NO:814、SEQ ID NO:815、SEQ ID NO:825、SEQ ID NO:826大幅度降低血清HBeAg水平。
表9A-C–在一周双次2mg/kg剂量后的血清HBV DNA水平(依据log10拷贝数)
LLOQ=小于定量下限
LLOQ=小于定量下限
LLOQ=小于定量下限
从这些数据可以得出结论:全部GalNAc缀合的抗HBV反义寡聚体均能够降低血清HBV基因组DNA水平至低于盐水和或等于ETV(临床护理标准)的水平。尤其,能够表明SEQ ID NO:807、SEQ ID NO:808、SEQ ID NO:814、SEQ ID NO:815、SEQ ID NO:825、SEQ ID NO:826大幅度降低血清HBV基因组DNA水平。
来自这些数据总体结论是:在体内,GalNAc缀合的、靶向HBV的LNA可以比ETV(临床护理标准)更好地靶向并减少HBsAg和HBeAg表达和HBV血清DNA(与ETV相比效力相等或更好)。鉴于比核苷类似物ETV更宽地影响病毒转录程序,这些数据表明在临床使用GalNAc缀合的靶向HBV的LNA可能导致改善得多的结局,包括显著增加慢性感染HBV患者的治愈率。尤其,减少免疫阻抑蛋白HBsAg将导致恢复针对HBV的宿主免疫应答。
实施例5以数种剂量一周双次注射的体内研究
这项研究中使用如实施例3中制备的AAV/HBV小鼠模型。在具有稳定病毒血症的C57BL/6小鼠中按不同剂量测试了7种GalNAc缀合的抗HBV LNA寡聚物,以盐水作为对照。
小鼠每周二次在第0、3、7和10天或第0、3、6和9天用每次注射下表中所示的以mg/kg(mpk)计的剂量皮下给药2周。在所示的日期使用“材料和方法”节中描述的方法测量血清中的HBV表面抗原(HBsAg)、HBV e抗原(HBeAg)和HBV基因组DNA。跟踪小鼠23–24天。
下表中显示结果。
表10A-G–按所示浓度一周双次剂量后的血清HBsAg水平(log10(IU/ml)
图11中还展示上述数据。
表11A-G按所示浓度一周双次剂量后的血清HBeAg水平(log10(NCU/ml))。
图12中还展示上述数据。
表12A-G按所示浓度一周双次剂量后的log10(HBV DNA)(以拷贝数计)血清水平。
LLOQ=小于定量下限
LLOQ=小于定量下限
图13中还展示上述数据。
从这些数据可以得出结论:全部GalNAc缀合的抗HBV反义寡聚体均能够降低HBsAg、HBeAG和HBV基因组DNA的血清水平至低于盐水的水平。尤其,SEQ ID NO:807、814、815和825显示非常高效的HBsAg减少,甚至在中间剂量也是如此。在最高剂量,对于SEQ ID NO:807和815,抗原减少在处理结束后维持至少11天。SEQ ID NO:814、815和825展示最有效地敲低病毒血清DNA,对表达病毒聚合酶的转录物显示特别强力的效应。
实施例6比较不同施用途径的抗病毒效力
这项研究中使用如实施例3中制备的AAV/HBV小鼠模型。在具有稳定病毒血症的C57BL/6小鼠中,使用皮下(SC)或静脉内(IV)施用途径按不同剂量测试了GalNAc缀合的抗HBVLNA寡聚物,以盐水作为对照。
小鼠每周二次在第0、3、6和9天用每次注射下表中所示的以mg/kg(mpk)计的剂量皮下或静脉内给药2周。在所示的日期使用“材料和方法”节中描述的方法测量血清中的HBV表面抗原(HBsAg)、HBV e抗原(HBeAg)和HBV基因组DNA。在首次给药后跟踪小鼠23天。
下表中显示结果。
表13A–按所示浓度一周两次SC剂量后的血清HBsAg水平(log10(IU/ml)
表13B–按所示浓度一周两次IV剂量后的血清HBsAg水平(log10(IU/ml)
表14A–按所示浓度一周两次SC剂量后的血清HBeAg水平(log10(IU/ml)
LLOQ=小于定量下限
表14B–按所示浓度一周两次IV剂量后的血清HBeAg水平(log10(IU/ml)
表15A–按所示浓度一周两次SC剂量后的血清HBV DNA水平(依据log10(拷贝数))
LLOQ=小于定量下限
表15B–按所示浓度一周两次IV剂量后的血清HBV DNA水平(依据log10(拷贝数))
LLOQ=小于定量下限
图14中还展示上述数据。
从这些数据可以得出结论:如与静脉内施用相比,通过皮下施用给药时,施用GalNAc缀合的抗HBV反义寡聚体更高效降低HBsAg、HBeAG和HBV基因组DNA的血清水平至低于盐水的水平。
实施例7:比较缀合的和未缀合的寡核苷酸
这项研究中使用如实施例3中制备的AAV/HBV小鼠模型。在具有稳定病毒血症的C57BL/6小鼠中以等摩尔寡聚物剂量测试了未缀合的(SEQ ID NO:308和303)和GalNAc缀合的(SEQ ID NO:807和815)抗HBV LNA寡聚物,以盐水作为对照。
小鼠每周二次在第0、3、6和9天用每次注射下表中所示的以mg/kg(mpk)计的剂量皮下给药持2周。在所示的日期使用“材料和方法”节中描述的方法测量血清中的HBV表面抗原(HBsAg)、HBV e抗原(HBeAg)和HBV基因组DNA。跟踪小鼠23天。
下表中显示结果。
表16A-B–按等摩尔浓度一周两次剂量后的血清HBsAg水平(log10(IU/ml)
表17A-B–按等摩尔浓度一周两次剂量后的血清HBeAg水平(log10(IU/ml)
表18A-B–按等摩尔浓度一周两次剂量后的血清HBV DNA水平(依据log10拷贝数)
LLOQ=小于定量下限
LLOQ=小于定量下限
图15中还展示上述数据。
从这些数据可以得出结论:如与静脉内施用相比,通过皮下施用给药时,施用GalNAc缀合的抗HBV反义寡聚体更高效降低HBsAg和HBeAG的血清水平至低于盐水的水平。通过两种递送方法以相等效力降低血清HBV DNA,尽管测定法的局限性使得在高剂量无法区分。
本文中援引的全部参考文献,包含出版物、专利申请和专利,因而通过引用的方式完整并入并且至与如同单独和专门地指出通过引用的方式并入并且在本文中完整阐述每篇参考文献(至法律允许的最大程度)相同程度。全部标题和副标题在本文中仅为便利而使用并且不应当以任何方式解释为限制本发明。本文中提供的任何和全部实施例或示例性表述(例如,“如”)的用途仅意在更好地说明本发明而不是对本发明的范围加以限制,除非另外声明。本说明书中的语言均不应解释为表示任何未要求保护的要素是对实施本发明为必需的。本文中援引和并入专利文献仅处于便利性而进行并且不反映对这类专利文献的有效性、可专利性和/或可实施性的任何观点。本发明包括适用法律所允许的在本文所附权利要求书中所述主题的全部修改和等同物。
- 还没有人留言评论。精彩留言会获得点赞!