包含辣木叶提取物的放射线联合处理用组合物及利用其的治疗方法与流程
本发明涉及包含辣木(Moringa oleifera)叶提取物的用于治疗、改善或预防癌症的放射线联合处理用组合物及利用其的联合处理方法,具体涉及以下内容,即通过辣木叶提取物和少量放射线的联合处理使放射线的副作用最小化,同时能够获得提高的治疗、改善或预防癌症的效果。
背景技术:
辣木是原产地为印度的乔木,但是在全世界很多地方种植,并且在广泛利用辣木树的很多地区进行引种而自然生长。属于辣木科的辣木树有13种,其中最广为人知的是印度传统辣木(Moringa oleifera)。印度传统辣木是以伞状展开的4~8米高的灌木。其特征为,长度为30~70cm的叶子为落叶性,花为白色且香气浓郁,果实为绿色且为长达30~40cm的革质及悬垂的长三角形形状的长荚,并且原生于印度西北部喜马拉雅山脚,在热带全部地区种植的多用途树种中的一种。辣木是原生于东南亚等的植物,其含有大量的营养成分,因此被称为奇迹植物,并且已知为具有抗糖尿病、抗癌、抗过敏等多种功效。
另外,目前癌症患者的治疗方法是依赖于外科手术、放射治疗、施用显示40余种强细胞毒性的抗癌物质的化学疗法,但是这些疗法大部分也只局限于早期癌症患者或特定癌症,因此因癌症引起的死亡呈持续增长的趋势。尤其是在放射治疗的情况下,因放射线自身的副作用而诱发免疫力下降及患者的生活质量降低等继发性问题,因此成为癌症患者拒绝放射治疗的主要原因。就这种放射治疗而言,对患者照射高剂量的放射线,从而诱发多种副作用,这种副作用则依赖于放射剂量。因此,目前迫切需要开发出降低放射线照射量的同时也能够显示出得到提高的抗癌效果的技术。
技术实现要素:
要解决的技术问题
为了解决上述问题,本发明欲提供包含源自天然物的辣木叶提取物的组合物,其特征在于,通过同时施用所述组合物与少量放射线能够获得与单独照射放射线的情况相比更加提高的抗癌效果。
技术方案
本发明涉及用于治疗、改善或预防癌症的放射线联合处理用组合物,其特征在于,其包含辣木(Moringa oleifera)叶提取物。
此外,本发明涉及辣木叶提取物的制备方法,其特征在于,其包括以下步骤:a)将辣木叶浸渍于水溶性溶剂中;b)获取辣木叶的浸出液,并去除不溶性物质;c)对所述已去除不溶性物质的浸出液进行过滤。
作为另一种实施方式,本发明涉及用于治疗、改善或预防癌症的治疗方法,其特征在于,其包括对癌细胞或患者施用包含辣木(Moringa oleifera)叶提取物的组合物的同时照射放射线的步骤。
作为另一种实施方式,本发明涉及用于治疗、改善或预防癌症的放射线联合处理用组合物的应用,其特征在于,所述组合物包含辣木(Moringa oleifera)叶提取物。
发明效果
通过本发明可以确认以下内容,即在放射线的照射前后同时施用本发明的辣木叶提取物,从而通过少量的放射线照射也能够获得与仅施用放射线或仅施用提取物的情况相比更加提高的抗癌效果,通过上述内容可期待能够实现将天然提取物作为放射线辅助剂使用而进行联合治疗的商用化。
附图说明
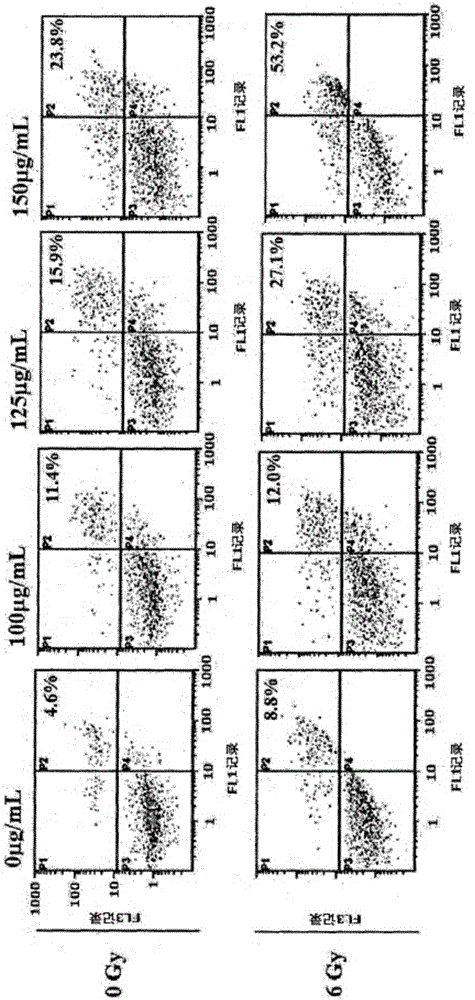
图1是放射线与辣木叶提取物联合处理A549细胞后实施流式细胞仪(FACScan)测定的结果。
图2是将放射线与辣木叶提取物联合处理A549细胞后实施FACScan测定的结果以与图1不同的方式显示的结果。
图3是将放射线与辣木叶提取物联合处理A549细胞的结果通过表达蛋白质分析来显示的结果。
图4是辣木叶提取物与放射线联合处理时的癌细胞的细胞周期变化及细胞凋亡效果与辣木叶提取物或放射线单独处理时的情况进行比较的结果。
图5是对小鼠活体内(in vivo)的辣木叶提取物与放射线的联合处理结果。
具体实施方式
本发明涉及用于治疗、改善或预防癌症的放射线联合处理用组合物,其特征在于,其包含辣木(Moringa oleifera)叶提取物。
本发明中的所述癌症可以为选自大肠癌、肝癌、胃癌、结肠癌、乳腺癌、肺癌、鳞状细胞癌、纤维瘤、非小细胞肺癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼球内黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门周围癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、何杰金氏病(Hodgkin's disease)、食管癌、小肠癌、内分泌腺癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾脏或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(Central nervous system,CNS)肿瘤、原发性CNS淋巴瘤、脊髓肿瘤、脑干神经胶质瘤或脑垂体腺瘤中的一种以上,优选为选自肺癌、大肠癌、肝癌、乳腺癌、鳞状细胞癌及纤维瘤中的一种以上,更优选为选自肺癌、肝癌或大肠癌,但并不限定于此。
本发明中的所述提取物不受限制,其可以通过使用作为提取溶剂的水、甲醇、乙醇或所述提取溶剂的混合物来获得。
本发明中的所述水的温度不受限制,该温度可以为0~60℃,优选为0~40℃,更优选为0~5℃。在上述温度范围内提取的辣木叶提取物显示出更高的抗癌活性。当作为提取溶剂的水的温度为60℃以上时,即使提高提取物的浓度进行处理,提取物对癌细胞生存的影响也甚微,并且温度越低,提取物对癌细胞的毒性越高。
本发明中的所述提取物不受限制,其可以通过将辣木叶浸渍于水中1~60分钟来获得,优选可以浸渍1~30分钟。在上述时间范围内提取的辣木叶提取物显示出更高的抗癌活性。
根据上述条件获得本发明一实施例的辣木叶提取物,并将其命名为JCT-4并使用。
本发明中的所述放射线不受限制,其可以为γ射线、电子束、质子束、中子束或X射线,优选可以利用60Co或l37Cs来照射所述γ射线。
本发明中的所述γ射线不受限制,其可以以0.1~50Gy的剂量来照射,优选可以以0.1~10Gy的剂量来照射。当以上述范围的剂量来照射时,能够大幅度减少放射线副作用所带来的免疫力下降及患者的生活质量降低等继发性问题,从而能够使联合施用效果极大化。
本发明的一实施例中,所述辣木叶提取物的制备方法不受限制,其可以包括以下步骤:将辣木叶浸渍于以辣木叶质量计为5~10倍的0~20℃的水中;获取辣木叶的浸出液,并去除不溶性物质;对所述已去除不溶性物质的浸出液进行过滤。在所述将辣木叶浸渍于水中的步骤中,优选将辣木叶浸渍于水中1~60分钟来进行提取。
此外,本发明涉及辣木叶提取物的制备方法,其特征在于,其包括以下步骤:将辣木叶浸渍于水溶性溶剂中;获取辣木叶的浸出液,并去除不溶性物质;对所述已去除不溶性物质的浸出液进行过滤。
本发明中的所述提取物不受限制,其可以通过使用作为提取溶剂的水、甲醇、乙醇或所述提取溶剂的混合物来获得。
本发明中的所述水的温度不受限制,该温度可以为0~60℃,优选为0~40℃,更优选为0~5℃。在上述温度范围内提取的辣木提取物显示出更高的抗癌活性。当作为提取溶剂的水的温度为60℃以上时,即使提高提取物的浓度进行处理,提取物对癌细胞生存的影响也甚微,并且温度越低,提取物对癌细胞的毒性越高。
本发明中的所述提取物不受限制,其可以通过将辣木叶浸渍于水中1~60分钟来获得,优选可以浸渍1~30分钟。在上述时间范围内提取的辣木叶提取物显示出更高的抗癌活性。
作为另一实施方式,本发明涉及用于治疗、改善或预防癌症的治疗方法,其特征在于,其包括对癌细胞或患者施用包含辣木(Moringa oleifera)叶提取物的组合物的同时照射放射线的步骤。
本发明中的所述癌症可以为选自大肠癌、肝癌、胃癌、结肠癌、乳腺癌、肺癌、鳞状细胞癌、纤维瘤、非小细胞肺癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼球内黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门周围癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、何杰金氏病(Hodgkin's disease)、食管癌、小肠癌、内分泌腺癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾脏或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(Central nervous system,CNS)肿瘤、原发性CNS淋巴瘤、脊髓肿瘤、脑干神经胶质瘤或脑垂体腺瘤中的一种以上,优选为选自肺癌、大肠癌、肝癌、乳腺癌、鳞状细胞癌及纤维瘤中的一种以上,更优选为选自肺癌、肝癌或大肠癌,但并不限定于此。
本发明中的所述放射线不受限制,其可以为γ射线、电子束、质子束、中子束或X射线,优选可以利用60Co或l37Cs来照射所述γ射线。
本发明中的所述γ射线不受限制,其可以以0.1~50Gy的剂量来照射,优选可以以0.1~10Gy的剂量来照射。当以上述范围的剂量来照射时,能够大幅度减少放射线副作用所带来的免疫力下降及患者的生活质量降低等继发性问题,从而能够使联合施用效果极大化。
作为另一实施方式,本发明涉及用于治疗、改善或预防癌症的放射线联合处理用组合物的应用,其特征在于,所述组合物包含辣木(Moringa oleifera)叶提取物。
本发明中的所述癌症可以为选自大肠癌、肝癌、胃癌、结肠癌、乳腺癌、肺癌、鳞状细胞癌、纤维瘤、非小细胞肺癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼球内黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门周围癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、何杰金氏病(Hodgkin's disease)、食管癌、小肠癌、内分泌腺癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾脏或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(Central nervous system,CNS)肿瘤、原发性CNS淋巴瘤、脊髓肿瘤、脑干神经胶质瘤或脑垂体腺瘤中的一种以上,优选为选自肺癌、大肠癌、肝癌、乳腺癌、鳞状细胞癌及纤维瘤中的一种以上,更优选为选自肺癌、肝癌或大肠癌,但并不限定于此。
以下,参照附图对本发明的组合物进行详细说明。就这时所使用的技术术语及科学术语而言,在没有其它定义的情况下,其具有本发明所属技术领域中的技术人员通常所理解的意思,并且在下述说明及附图中会省略可能使本发明的要点模糊的公知功能及组成的说明。
〈制备例〉辣木叶提取物的制备
干燥的辣木叶(M.oleifera leaves)是从GL网络有限公司(GL Network Co.,Ltd.)购买的(清迈,泰国)。将150mg的干燥的辣木叶浸渍于1ml的4℃水中5分钟,并实施涡流(vortexing)30秒钟,然后在冷藏室中进行搅拌(stirring)并存放。之后,通过3次的离心分离(12000rpm,10分钟)去除漂浮物的不溶性部分,然后对上清液(supernatant)进行过滤(0.2μm膜过滤(membrane filtration)),从而获得最终的辣木叶提取物。对最终的辣木叶提取物进行冷冻干燥,然后在-20℃下进行储藏。
〈实验方法〉
1.准备不同的辣木叶提取物浓度的试料
利用蒸馏水(DW)从100g的辣木叶干燥粉末进行提取的情况下,对提取物进行冷冻干燥时,获得总17.5g的具有活性的水溶性干燥粉末。从初期原材料中获得水溶性干燥粉末的收获率约为17.5%。
另外,取出1g的通过上述方法获得的冷冻干燥粉末并溶解于10mL的DW中,然后进行蛋白质定量时,所述试料中含有的蛋白质量为322mg,因此干燥试料中的蛋白质含量约为32%。对此进行计算时,由于在初期用100g的作为原材料的辣木叶进行了提取,因此最终蛋白质收获率为322mg*17.5=5.6%。
即,用DW从1g的原材料进行提取时,能够获得0.175g的水溶性干燥粉末,并能够获得0.056g的蛋白质,具有活性的水溶性干燥粉末中含有的蛋白质达到32%。
将上述提取结果进行代入计算时,每g的干燥重量中含有32%的蛋白质,因此将具有20mg/mL的蛋白质的试料换算成干燥重量时,其结果与约60mg/mL的干燥重量相同。即,若要将在试验中所使用的活性提取物的所有蛋白质浓度换算成试料干燥重量,则乘以3即可。即,当以蛋白质浓度为基准使用100μg/mL、200μg/mL、300μg/mL时,提取物的干燥重量则相当于300μg/mL、600μg/mL、900μg/mL。但是,在小鼠活体内试验的情况下,不是以蛋白质浓度作为基准,而是以总干燥重量作为基准进行处理。
2.细胞培养(cell culture)
为了确认本发明的效果,实验中所使用的人肺癌细胞株(Lung cancer cell line)A549是购自美国标准菌种收藏所(American type culture collection,ATCC,美国)及韩国细胞株库(Korean Cell Line Bank,KCLB)。在添加有10%的胎牛血清(fetal bovine serum,FBS)(海克隆实验室(Hyclone lab),美国)及1%的青霉素-链霉素的RPMI-1640(A549)培养基中培养细胞。将培养的细胞以1×105细胞(cell)分别分配到6孔-平板上,然后保持37℃、95%的空气/5%的CO2条件。
3.放射线照射后的流式细胞分析(Flow cytometric detection)
将人肺癌细胞株(A549)以1×105细胞/ml接种(seeding)于T-25培养瓶(culture flask,Nunc产品,丹麦)中后培养4小时,然后用不同浓度的辣木叶提取物(JCT-4)进行处理。用辣木叶提取物进行处理后进一步培养20小时。对如此培养的人肺癌细胞株,利用60Co以0.2Gy/min的强度来照射5Gy剂量的γ射线。放射线照射后进一步培养两天,然后回收细胞,并用磷酸盐缓冲液(PBS)洗涤,然后在暗处用70%乙醇在4℃下反应2小时而进行固定。对固定的细胞,用PBS进行两次洗涤,然后在室温用50μg/ml的碘化丙啶(propidium iodide,PI)进行染色30分钟。用FACScan(EPICS XL流式细胞仪,贝克曼库尔特计数器(Beckman Coulter Counter))测定DNA量。各个细胞周期中显示的效果是通过细胞周期的各个时期中显示的细胞排列的%(百分比)变化来进行测定,并通过菲尼克斯多循环软件(Phoenix Multicycler)程序(菲尼克斯流式系统,Phoenix Flow System)来决定。
[实施例1]利用FACS分析来确认辣木叶提取物与放射线联合处理所带来的癌细胞的细胞周期变化及细胞凋亡效果
为了确认辣木叶提取物对癌细胞带来的细胞周期变化及细胞凋亡效果,用不同浓度的辣木叶提取物处理A549细胞株,然后在照射放射线48小时后实施FACS分析。
分析结果可以确认随着辣木叶提取物浓度的变化(100μg/mL、125μg/mL、150μg/mL)会使亚Gl群体(sub-G1population)增加(图1及图2)。尤其是可以确认随着辣木叶提取物的浓度增加,在同时照射放射线的情况下,抗癌活性会极具增加,从而可以确认辣木叶提取物与放射线的联合处理效果卓越。这个结果也可以在图3的蛋白质分析结果中确认,即可以确认放射线与辣木叶提取物联合处理的情况下,已知为癌细胞凋亡时释放的半胱天冬酶-3(Caspase-3)蛋白质的释放量会大幅度增加,通过此能够再次确认放射线与辣木叶提取物联合处理时对癌细胞的治疗效果卓越。
[实施例2]利用FACS分析来确认辣木叶提取物与放射线联合处理所带来的癌细胞的细胞周期变化及细胞凋亡效果
类似于所述实施例1,为了确认辣木叶提取物对癌细胞带来的细胞周期变化及细胞凋亡效果,施用150μg/mL的辣木叶提取物的同时用1Gy、2Gy、3Gy、4Gy、5Gy及6Gy剂量的放射线对A549细胞株进行处理,然后在放射线照射48小时后实施FACS分析。
[比较例1]确认辣木叶提取物单独处理所带来的癌细胞的细胞周期变化及细胞凋亡效果
除了没有同时用放射线进行处理以外,采用与所述实施例2相同的过程,然后实施FACS分析。
[比较例2]确认放射线单独处理所带来的癌细胞的细胞周期变化及细胞凋亡效果
除了没有同时用辣木叶提取物进行处理以外,采用与所述实施例2相同的过程,然后实施FACS分析。
将所述实施例2及所述比较例1~2的结果显示在图4中。根据此结果可以确认,在没有实施辣木叶提取物与放射线联合处理的对照组即比较例1、2的情况下,对癌细胞的处理效果甚微,尤其是对照射6Gy剂量时的情况与1Gy+150μg/mL联合处理时的情况进行比较时,可以确认与照射6Gy的放射线的情况相比,实施1/6倍左右的低剂量联合处理时能够显示出同等以上的抗癌效果。
[实施例3]对小鼠活体内的联合处理结果
将在实验室中通常使用的健康小鼠以每组10个个体分为4组,并分别移植肺癌细胞株LLC。之后,将冷冻干燥的辣木叶提取物试料JCT-4(用20mg/mL的PBS原液制备,然后在使用时将其溶化并使用。此时,所使用的浓度是以总干燥重量为基准,而并非是以蛋白质浓度作为基准)以小鼠个体重量计为200mg/kg(以总干燥重量为基准)的量每天口服给药,一周给药7次。在移植后的第8天及第20天以每次2Gy的剂量总共照射2次(总4Gy)。此时,放射线的照射是在用JCT-4处理后实施。
作为对照组的比较例3~5是在未处理及实施放射线单独处理或辣木叶提取物单独处理后同样摘除肿瘤并测定其大小。其结果图示在图5及表1中。
其结果,通过动物实验能够确认联合处理时与未处理对照组相比会减少约93%的肿瘤。
表1
如上所述,本发明人确认了在放射线的照射前后同时施用本发明的辣木叶提取物,从而通过少量的放射线照射也能够获得与仅施用放射线的情况相比显著提高的抗癌效果,并完成了本发明。
- 还没有人留言评论。精彩留言会获得点赞!