基于酵母的免疫疗法和I型干扰素敏感性的制作方法
本申请根据美国法典35§119(e)要求2014年4月11日提交的美国临时申请号61/978,634的权益。将美国临时申请号61/978,634的完整公开通过提述并入本文。
发明领域
本发明一般地涉及基于个体对1型干扰素(T1IFN)的敏感性,选择个体以用基于酵母的免疫治疗组合物治疗的方法和用于增强或改善个体对基于酵母的免疫疗法的响应的方法。
发明背景
免疫疗法的主要目标是产生细胞免疫,并且具体的是激活和扩增抗原特异性CD8+效应T细胞。存在有这可以发生的两种良好建立的途径。第一种是通过由CD4+Th1细胞提供的“T细胞辅助”的递送。第二种更间接的途径是通过诱导CD4+Th17细胞,在某些情况下,其可以转化为Th1细胞,尽管它们的主要作用是产生IL-17以促进巨噬细胞和嗜中性粒细胞的募集以破坏细胞外细菌和真菌。Th17细胞还与调节性T细胞(Treg)竞争相同的空间,并且它们的诱导可能与Treg活性的降低相关,从而解释了过度活性的Th17应答和自身免疫之间的相关性。这两种途径是拮抗的。
尽管T1IFN最初被描述为抗病毒介质,但最近的证据指向它们的免疫调节作用(Heim,2012,Swiss Med Wkly.142:w13586;Gonzalez-Navajas等人,2012,Nat Rev Immunol.12(2):125-35.)。例如,T1IFN已经与Th17活性的降低相关(Moschen等人,2008,Immunobiology 213(9-10):779-87),因此提供了为什么Treg被报道由T1IFN增强的似乎合理的解释(Vandenbark等人,2009,J Neuroimmunol.215(1-2):125-8;Lee等人,2012,Gastroenterology143(1):145-54)。认为T1IFN通过靶向IL-1产生(Schindler等人,1990,J Immunol.144(6):2216-22;Reznikov等人,1998,J Interferon Cytokine Res.18(10):897-903)和炎症小体(inflammasome)(Guarda等人,2011,Immunity34(2):213-23)来抑制Th17途径,所述炎症小体是驱动Th17途径所必需的。T1IFN还诱导驱动Th1途径的IL-12(由Ludigs等人,2012,Cell Mol Life Sci.69(20):3395-418综述),并且在这样做时,减少与Th17维持相关的IL-23产生。还已知T1IFN通常抑制细胞介导的免疫,并因此已经用于治疗自身免疫疾病如多发性硬化(MS),以靶向触犯性(offending)CD4+Th1和Th17T细胞。
更具体地,一些形式的自身免疫,包括MS,类风湿性关节炎(RA),系统性红斑狼疮(SLE)和Sjogrens综合征,已经与“1型干扰素信号”相关,通常定义为T1IFN活性或响应水平和疾病之间的关联,和一些人更具体地定义为血液或其它组织中异常高水平的T1IFN活性,与当暴露于T1IFN时,1型干扰素刺激的基因(ISG)的降低的(或相对不变的)响应性水平相关(Hooks等人,1979,N Engl J Med.301(1):5-8;Baechler等人,2003,Proc Natl Acad Sci U S A.100(5):2610-5;由Crow,2010,Arthritis Res Ther.12Suppl 1:S5综述)。T1IFN信号用于自身免疫背景中作为潜在的诊断测定以确定MS患者是否会对T1IFN治疗有响应,即下述疾病,其中大约一半的治疗的个体似乎对治疗有响应,而其他个体可能具有恶化的自身免疫作为治疗的结果。例如,MS领域的研究者已经使用PCR方法测量T1IFN响应基因产物,在这种情况下是T1IFN敏感性MX1基因(Hundeshagen等人,2012,J.Neuroinflamm.9:140)。在该研究中,在用T1IFN,干扰素-β(IFN-β)治疗之前,将受试者分类为具有MX1RNA的高或低基线表达。作者鉴定了具有在T1IFN治疗后上调MX1信号的基线时低水平表达的MX1RNA的受试者亚组,和具有通过进一步的T1IFN治疗未移动的较高基线MX1RNA水平的受试者亚组,表明个体可以基于“T1IFN签名”分组。尽管这些作者不能证实升高的内源性I型IFN签名(对于进一步的T1IFN暴露没有响应的那些)和恶化的整体疾病病程之间的相关性,但是在分开分析每个IFN-β药物制剂的数据时观察到两组的复发率的差异。Axtell等人(2012,Immunol.Rev.248(1):23-35)综述了在MS中,高内源性T1IFN水平与通过血液中更高水平的IL-17定义的Th17信号相关的证据,提出强IL-17信号是对T1IFN的免疫抑制作用有抗性的侵袭性Th17驱动的自身免疫的标志物,并且高水平的内源性T1IFN活性可能反映了宿主免疫系统尝试使用内源性T1IFN作为抑制特别侵袭性自身免疫的方式。
T1IFN(例如聚乙二醇化的干扰素-α或pegIFN-α)目前用于治疗丙型肝炎病毒(HCV)感染的个体(通常与抗病毒药物如利巴韦林(ribavirin)组合施用)。对于HCV,T1IFN治疗的响应者和非响应者通过在干扰素IL28B基因基因座上游连接的基因型来区分,其中IL28B基因型“C/C”个体对pegIFN-α/利巴韦林治疗高度响应,而IL28B基因型“T/T”个体对pegIFN-α/利巴韦林治疗无响应。在HCV感染个体的研究中,在治疗开始之前通过PCR测试来自未治疗的,HCV感染的受试者的肝活检组织的四种ISG的表达水平(Dill等人,2011,Gastroenterology 140(3):1021-31),以确定这些T1IFN响应基因的上调是否与IL28B基因型和结果相关。作者得出结论尽管IL28B基因型和肝ISG表达都与对pegIFN-α/利巴韦林治疗的响应相关,但它们没有因果关系,并且与ISG的关联是结果的主要预测因子。在Sultanik等人的出版物(2014,J.Viral Hepat.)中,作者使用phosphor-STAT1水平作为T1IFN生物标志物探索了来自健康供体和HCV感染患者的外周血单核细胞(PBMC)中的IFN-α敏感性,并且表明了对IFN-α的基线敏感性与阳性临床结果相关,不论患者的IL28B基因型为何。
已经描述了重组酵母作为独特的免疫疗法的用途(也称为基于酵母的免疫疗法)(参见,例如,Stubbs等人,2001,Nat Med.7(5):625-9;Lu等人,2004,Cancer Res.64(15):5084-8;Haller等人,2007,Vaccine 25(8):1452-63.;Tamburini等人,2012,J Immunother.35(1):14-22)。酵母被专门抗原呈递细胞(APC),例如嗜中性粒细胞,巨噬细胞和树突细胞激烈地吞噬,并且多种抗原可以被工程化改造用于在单个酵母中表达,以在体外和体外引发多重,相互作用的CD4+T细胞介导的免疫应答(Stubbs等人,2001,同上;Lu等人,2004,同上;Haller等人,2007,同上;Bernstein等人,2008,Vaccine26(4):509-21;Remondo等人,2009,Vaccine 27(7):987-94;Cereda等人,2011,Vaccine 29(31):4992-9.;Riemann等人,2007,Exp Dermatol.16(10):814-22;Wansley等人,2008,Clin Cancer Res.14(13):4316-25;Tamburini等人,2012,同上)。这些CD4+T细胞亚群包括与Treg竞争并中和Treg的Th17T细胞,以及有助于引起CD8+效应T细胞生成的Th1T细胞。CD8+T细胞的生成与Treg中和的组合效应提供了现在已经转化为临床的高度重要的免疫治疗机会。
例如,在患有慢性HCV感染的受试者的2期临床试验将护理标准(“SOC”=pegIFN-α加利巴韦林)与“三联疗法”(SOC与基于酵母的免疫疗法产品GI-5005(表达HCV NS3和核心抗原的重组酵母,GlobeImmune,Inc.,Louisville,Colorado)组合)比较。与仅基于T1IFN的护理标准(SOC)相比,包括GI-5005的三联疗法显著改善了治疗结束的病毒清除和ALT正常化(Jacobson等人,2010,European Association for the Study of the Liver(EASL)),并改善了持续的病毒学应答(SVR),总体为12%,未免疫者为10%,NR受试者为12%(Pockros et al.,2010,American Association for the Study of Liver Diseases(AASLD))。令人惊讶的是,具有IL28B T/T基因型的GI-5005三联疗法受试者在持续病毒学应答(SVR)以及IFN-γELISpot测定中具有最大优势,而相比IL28B C/C和C/T SOC受试者,接受仅SOC的IL28BT/T受试者具有显著更差的病毒学和IFN-γELISpot应答(Vierling等人,2010,American Association for the Study of Liver Diseases(AASLD))。
在使用基于酵母的免疫疗法产品GI-4000(表达突变型Ras蛋白的重组酵母,GlobeImmune,Inc.,Louisville,Colorado)与吉西他滨(gemcitabine)组合的胰腺癌患者的2期临床试验中,使用潜在蛋白质组学伴随诊断测试(BDX-001;Biodesix,Inc.,Boulder,Colorado)的回顾式蛋白质组学分析似乎预测在该试验中使用GI-4000和吉西他滨治疗的受试者的亚组与用安慰剂加吉西他滨治疗的受试者相比是否将具有改善的无复发存活(RFS)和总体存活(OS)。大约50%的用GI-4000和吉西他滨治疗的研究受试者样品被分类为BDX-001阳性。在用GI-4000和吉西他滨治疗的BDX-001阳性受试者中,与用安慰剂和吉西他滨治疗的BDX-001阳性受试者样品相比,中值RFS改善11.7个月,中值OS改善16.6个月。BDX-001不预测安慰剂/吉西他滨治疗的受试者的响应(Richards等人,2012,European Society for Medical Oncology(ESMO);Richards et al.,2014,American Association for Cancer Research(AACR))。
因此,在这些临床研究中,似乎存在与其他患者相比,更受益于免疫疗法的患者的亚群。然而,基于来自研究的可用数据,在这些非常不同的疾病类型中的响应者之间的连接(如果有的话)不清楚,也没有确定是否存在可普遍用于选择最可能响应基于酵母的免疫疗法的受试者的其他生物标志物。因此,仍然需要理解如何鉴定通常对基于酵母的免疫疗法最有响应的受试者,以及该表型的基础机制,并开发方法以选择和然后治疗在各种疾病中最可能对基于酵母的免疫疗法具有有益的响应的受试者。实际上,能够鉴定人是否会响应以避免使他们接受没有明显益处的疗法是非常有用的。
发明概述
本发明的一个实施方案涉及使用基于酵母的免疫疗法来治疗受试者的方法,包括向已经预选择为对1型干扰素(T1IFN)敏感的受试者施用基于酵母的免疫治疗组合物。在一个方面,来自受试者的T1IFN-未处理外周血单核细胞(PBMC)由于与T1IFN接触而上调或下调T1IFN调节的生物标志物。在一个方面,先前对T1IFN暴露响应的来自受试者的PBMC对进一步暴露于T1IFN不反应(refractory)。
本发明的另一个实施方案涉及使用基于酵母的免疫疗法治疗受试者的方法。该方法包括以下步骤:(a)预选择对T1IFN敏感的受试者;和(b)向所述受试者施用基于酵母的免疫疗法。在一个方面,预选择步骤(a)包括预选择受试者,所述受试者的一个或多个T1IFN调节的生物标志物的水平由于使来自受试者的生物样品与T1IFN离体或体外接触而改变至少三倍。在一个方面,预选择步骤(a)包括预选择受试者,所述受试者的一个或多个T1IFN调节的生物标志物的水平由于使来自受试者的生物样品与T1IFN离体或体外接触而改变至少五倍。
在本发明的任意这些实施方案或方法中的一个方面,预选步骤(a)包括以下步骤:(i)在从受试者分离的生物样品中离体或体外测量一种或多种T1IFN-调节的生物标志物的基线水平;(ii)使所述生物样品与T1IFN接触;(iii)在接触步骤(ii)之后测量所述一种或多种经T1IFN调节的生物标志物的水平;和(iv)预选择T1IFN敏感的受试者用于基于酵母的免疫疗法的治疗,所述受试者的一种或多种T1IFN调节的生物标志物的水平由于使所述生物样品与T1IFN接触而上调或下调。在一个方面,测量步骤(i)和/或(iii)包括使用测定,其可以包括但不限于:酶联免疫吸附测定(ELISA),实时聚合酶链式反应(PCR),流式细胞术,基于珠的多重免疫测定(multiplex bead-based immunoassay),或基于定量选择反应监测(SRM)的质谱术。在一个方面,预选择受试者,所述受试者的一个或多个T1IFN调节的生物标志物的水平由于使来自受试者的生物样品与T1IFN接触而从基线上调或者下调至少三倍。在一个方面,预选择受试者,所述受试者的一个或多个T1IFN调节的生物标志物的水平由于使来自受试者的生物样品与T1IFN接触而从基线上调或者下调至少五倍。
在本文所述的方法的一个方面,预选步骤(a)包括以下步骤:(i)在从受试者分离的生物样品中离体或体外测量一种或多种T1IFN-调节的生物标志物的基线水平;(ii)使所述生物样品与T1IFN接触;(iii)在接触步骤(ii)之后测量所述一种或多种T1IFN调节的生物标志物的水平;(iv)在步骤(iii)之后使所述生物样品与T1IFN接触;(v)在接触步骤(iv)之后测量所述一种或多种T1IFN调节的生物标志物的水平;和(vi)预选择T1IFN敏感的受试者用于基于酵母的免疫疗法的治疗,所述受试者的一个或多个T1IFN调节的生物标志物的水平由于步骤(ii)中使所述生物样品与T1IFN接触而上调或下调,且所述受试者的一种或多种T1IFN调节的生物标志物的水平不由于步骤(iv)中使所述生物样品与T1IFN接触而实质上调或下调。在一个方面,测量步骤(i)和/或(iii)和/或(v)包括使用选自但不限于以下的测定:酶联免疫吸附测定(ELISA),实时聚合酶链式反应(PCR),流式细胞术,基于珠的多重免疫测定,或基于定量选择反应监测(SRM)的质谱术。
本发明的另一个实施方案涉及用基于酵母的免疫疗法治疗癌症或由病原体引起的疾病的方法。该方法包括向患有癌症或由病原体引起的疾病的受试者施用基于酵母的免疫治疗组合物的步骤,所述受试者的一种或多种T1IFN调节的生物标志物的水平由于使来自受试者的T1IFN-未处理生物样品与T1IFN离体或体外接触而改变至少三倍。
在本发明的任意上述实施方案和方法中,在一个方面,在预选择受试者之前所述生物样品尚未暴露于外源T1IFN。在另一方面,在步骤(a)之前所述受试者尚未接受T1IFN的外源来源。在另一方面,所述生物样品是外周血单核细胞(PBMCs)。在另一方面,所述生物样品是来自受试者的组织活检。
在本发明的任意上述实施方案中,在一个方面,所述生物样品中的细胞由于与T1IFN离体或体外接触而上调一种或多种1型干扰素刺激的基因(ISG)。在一个方面,所述生物样品中的T1IFN调节的生物标志物由于与T1IFN离体或体外接触而具有增加的磷酸化。在一个方面,所述生物样品中的细胞由于与T1IFN离体或体外接触而产生更高水平的T1IFN调节的蛋白。
在本发明的任意上述实施方案和方法中,在一个方面,T1IFN是干扰素-α。在一个方面,T1IFN是干扰素-β。
在本发明的任意上述实施方案和方法中,在一个方面,受试者患有癌症。在一个方面,受试者患有传染病。
在本发明的任意上述实施方案和方法中,在一个方面,基于酵母的免疫疗法包括施用具有重组表达一种或多种抗原的完整酵母。
本发明的另一个实施方案涉及预选择受试者以用基于酵母的免疫疗法治疗的方法。该方法包括以下步骤:(a)在从受试者分离的生物样品中离体或体外测量一种或多种T1IFN调节的生物标志物的基线水平,所述受试者是基于酵母的免疫疗法的候选者;(b)使所述生物样品与T1IFN离体或体外接触;(c)在接触步骤(b)之后测量所述一种或多种T1IFN调节的生物标志物的水平;和(d)预选择用于使用基于酵母的免疫疗法来治疗的T1IFN敏感的受试者,所述受试者的一种或多种T1IFN调节的生物标志物的水平由于使所述生物样品与T1IFN接触而上调或下调。在一个方面,预选择受试者,与在与T1IFN接触之前测量的T1IFN调节的生物标志物的水平相比,所述受试者的与T1IFN接触之后测量的T1IFN-调节的生物标志物的水平在背景上可检测。在一个方面,预选择受试者,所述受试者的与T1IFN接触后测量的T1IFN调节的生物标志物的水平相比于与T1IFN接触前测量的T1IFN调节的生物标志物的水平在统计学上显著不同。在一个方面,预选择受试者,所述受试者的与T1IFN接触后测量的T1IFN调节的生物标志物的水平和与T1IFN接触前测量的T1IFN调节的生物标志物的水平之间的比率为至少三。在一个方面,预选择受试者,所述受试者的与T1IFN接触后测量的T1IFN调节的生物标志物的水平和与T1IFN接触前测量的T1IFN调节的生物标志物的水平之间的比率为至少五。在一个方面,测量步骤(a)和/或(c)包括使用选自但不限于以下的测定:酶联免疫吸附测定(ELISA),实时聚合酶链式反应(PCR),流式细胞术,基于珠的多重免疫测定,或基于定量选择反应监测(SRM)的质谱术。在一个方面,所述生物样品是从受试者分离的外周血单核细胞(PBMC)。在一个方面,所述生物样品是来自受试者的组织活检。
附图简述
图1是Western印迹的数字图像,其显示来自接受基于酵母的免疫疗法的6个不同患者的外周血单核细胞(PBMC)样品,T1IFN添加前的定量MxA蛋白(表示为“0”的泳道)相对定量添加T1IFN后的MxA蛋白(表示为“160U/mL”的泳道)的比率。
图2的图显示了在接受称为GI-4000的基于酵母的免疫治疗组合物的13名癌症患者的分组中,T1IFN响应性以统计学显著的方式与总体存活(OS)相关。
图3的图显示了在接受称为GI-4000的基于酵母的免疫疗法组合物的13名癌症患者的分组中,T1IFN响应性以统计学显著的方式与无复发存活(RFS)相关。
图4A的图显示了在使用GI-4000和吉西他滨治疗的胰腺癌患者中,T1IFN敏感性以统计学显著的方式与无复发存活(RFS)相关。
图4B的图显示了在使用GI-4000和吉西他滨治疗的胰腺癌患者中,T1IFN敏感性以统计学显著的方式与总体存活(OS)相关。
图5A的图显示了在使用安慰剂和吉西他滨治疗的胰腺癌患者中,T1IFN敏感性与RFS不相关。
图5B的图显示了在使用安慰剂和吉西他滨治疗的胰腺癌患者中,T1IFN敏感性与OS不相关。
图6A的图显示T1IFN敏感性以与GI-4000治疗(GI-4000+吉西他滨)的胰腺癌患者的改善的存活(RFS和OS)相关的方式趋向,所述患者具有大于3的T1IFN生物标志物比率。
图6B的图显示了T1IFN-敏感性以与GI-4000治疗(GI-4000+吉西他滨)的胰腺癌患者的改善的存活(RFS和OS)相关的方式趋向,所述患者具有大于5的T1IFN生物标志物比率。
图7A的图显示了T1IFN敏感性不以与安慰剂治疗(安慰剂+吉西他滨)治疗的胰腺癌患者(T1IFN生物标志物比率截留设定为3)的改善的存活(RFS和OS)相关的方式趋向。
图7B的图显示了T1IFN敏感性不以与安慰剂治疗(安慰剂+吉西他滨)治疗的胰腺癌患者(T1IFN生物标志物比率截留设定为5)的存活(RFS和OS)相关的方式趋向。
发明详述
本发明一般涉及使用基于酵母的免疫疗法治疗预选择为最有可能对此类疗法响应的个体的方法,并且还涉及选择这些个体的方法,以及用于增强或改善选择的个体对基于酵母的免疫疗法的响应或响应能力的方法。本发明包括基于酵母的免疫治疗组合物(也称为“基于酵母的免疫疗法”)的用途,以及此类组合物用于预防和/或治疗各种疾病,状况及其相关症状的用途,所述基于酵母的免疫治疗组合物包含酵母媒介物和一种或多种抗原,其已经设计为引发针对个体中的靶标的预防性和/或治疗性免疫应答。根据本发明,选择为最有可能响应基于酵母的免疫疗法(即产生对免疫疗法的免疫应答,其有利于改善或治疗疾病或状况)的个体是基于“1型干扰素(T1IFN)签名”选择的。更具体地,本发明涉及向个体施用基于酵母的免疫疗法,所述个体基于他们对1型干扰素的敏感性预选择,即选择为“干扰素敏感的”或“干扰素响应的”或具有“T1IFN敏感签名”的个体(下文详细描述)。如下文更详细讨论的,此类个体也可以对T1IFN敏感,使得在初始基线暴露后重复暴露于T1IFN可导致个体的细胞对T1IFN脱敏(即,至少一段时间进一步重复暴露于T1IFN不诱导对T1IFN的进一步响应)。
在临床前和临床研究中使用基于酵母的免疫疗法治疗的受试者的免疫应答的各个方面先前已经联系基因型(IL28B)和表型(CD4+Th1/Th17T细胞,CD8+T细胞,Treg和细胞因子)标示物(identifiers)两者,其与在临床中取得的结果相关。然而,在本发明之前,个体对T1IFN的敏感性或不敏感性与基于酵母的免疫疗法对个体的效果之间的关系仍不清楚。可以由基于酵母的免疫疗法起始的免疫应答的范围是复杂的,并且可以包括干扰素不依赖性能力;然而,现在清楚的是,T1IFN在个体对基于酵母的免疫疗法响应的能力中发挥重要作用,其在本发明之前是未知的或未被理解的。事实上,基于酵母的免疫疗法已经在存在和不存在外源性T1IFN的情况下用于临床前或临床研究中,以及在致病剂可以主动诱导内性T1IFN活性的疾病(例如病毒性疾病,例如HCV)和其中T1IFN和免疫应答之间的关系仍不清楚的疾病中(例如,癌症)。进一步使分析复杂化的是酵母本身诱导T1IFN产生的知识(Biondo等人,2011;Bougeois等人,2011;Kasperkovitz等人,2011;Majer等人,2012;Smeekens等人,2013)。因此,可以认为,例如,对基于酵母的免疫疗法的响应者是对T1IFN最敏感的那些。已经描述了T1IFN信号转导直接作用于T细胞,因为其可以诱导IFN-γ的产生,因此有利于Th1T细胞的诱导和维持(Brinkman等人,1993;Krug等人,2003)。在这种情况下,由基于酵母的免疫疗法诱导的Th17途径可能实际上是对响应的阻碍,并且用T1IFN治疗可以在一定程度上减轻这种干扰。因此,对T1IFN的敏感性将增强Th1途径,驱动CD8+T细胞介导的免疫应答,并导致使基于酵母的免疫疗法治疗的患者的更好的结果。或者,可以认为,对基于酵母的免疫疗法的响应者是对T1IFN最具抗性或可产生抗性的那些(T1IFN不敏感个体)。这将驱动Th17途径并降解调节性T细胞,从而允许发生更有效的效应免疫应答。在本发明之前,正确答案是未知的。
本发明人首次将T1IFN签名的概念(其可以识别个体为对T1IFN敏感或对T1IFN不敏感(或较不敏感))应用于基于酵母的免疫疗法,以在至少两种人群(在此表示为T1IFN敏感的(其也可以称为T1IFN响应的)和T1IFN不敏感的(其也可以称为T1IFN抗性,T1IFN不响应或T1IFN较少响应))之间,中发现哪种亚群对基于酵母的免疫疗法(其诱导T1IFN,Th1T细胞和Th17T细胞)最响应。不受理论的限制,本发明人相信在存在诱导竞争性Th1和Th17途径的酵母的情况下,由酵母诱导的T1IFN作用于调节Th17途径,从而确保更平衡的平行产生一些Th1驱动的CD8+T细胞应答。此外,由酵母驱动的调节的Th17T细胞应答进一步下调Treg活性或存活,增强Th1和CD8+效应应答发生的能力。由本文中呈现的数据提供的证据表明,在施用基于酵母的免疫疗法时观察到的临床结果与对T1IFN更敏感的个体(T1IFN敏感的个体)相关,即临床响应者具有在基于酵母的免疫疗法的存在下倾向于Th1应答的免疫系统,而减少或缺失的临床反应与对T1IFN较不敏感的个体(T1IFN不敏感个体)相关,即其免疫系统在基于酵母的免疫疗法存在下偏向Th17免疫应答的个体。
更具体地,并且不受理论的束缚,本发明人提出了支持本文所述发现的以下作用机制。基于酵母的免疫疗法首先接合(engage)抗原呈递细胞(APC)的表面上的Toll样受体(TLRs)例如TLR 2和TLR 4。这导致对通过APC的细胞因子产生的诱导,其包括白细胞介素-6(IL-6),IL-23和IL-1β。IL-1β,IL-6和IL-23均驱动Th17途径。因此,Th17T细胞可能准备被基于酵母的免疫疗法激活。然而,因为IL-23和IL-12共享相同的重链,APCs例如树突状细胞(DC)也能够产生IL-12,当基于酵母的免疫治疗组合物被内化时其最有效地发生,在此时间期间酵母DNA诱导TLR 7和9,导致T1IFN的产生。T1IFN对于IL-12的诱导是必需的或至关重要的,部分是因为T1IFN也抑制活性IL-1β的产生。这削弱IL-23的生成和因此Th17扩增。酵母诱导的T1IFN和IL-12的组合效果(至IL-1β和IL-23的损害)驱动Th1途径。在这个时刻,基于酵母的免疫疗法实质上诱导Th17和Th1T细胞二者的伴随发育。
然而,Th1和Th17途径之间的平衡是不稳定的,并且酵母诱导的T1IFN/IL-12介导的Th1T细胞的扩增减少了Th17T细胞诱导,由Th1T细胞和CD8+T产生的IFN-γ亦然。在这一点上,能力的平衡因此从Th17途径转移到Th1途径。然而,T1IFN依赖性Th17T细胞减少也导致缺乏对Treg生成的控制,因为Th17T细胞否则限制Treg生成。然后Treg自由地抑制Th1应答,导致CD8+T细胞效应物生成的中止。
因此,如果根据本发明,个体是T1IFN敏感的,该个体可以使用T1IFN来推动Th1途径和随后的CD8+效应细胞的生成。然而,如果个体对T1IFN较不敏感或有抗性,则Th17途径可以不受T1IFN的抑制作用的阻碍。因此,该个体驱动Th17途径至Th1和CD8+T细胞,以及Treg的损害。在阳性结果与Th1T细胞和CD8+T细胞应答相关的疾病或状况中,例如癌症,病毒感染和各种其它细胞外或细胞内病原体的感染,T1IFN敏感性是重要的。
在本文中首次提出,用于鉴定最有可能以临床有意义的方式响应基于酵母的免疫疗法的个体,以及最不可能以临床有意义的方式响应于基于酵母的免疫疗法的个体的先前未知的因素,是T1IFN敏感性(最可能响应),或相反,T1IFN不敏感性(最不可能响应)。开发了测定以测试T1IFN敏感性并分析了使用基于酵母的免疫疗法治疗的受试者的测试分组(见实施例)。数据显示,对于总体存活(OS)和无复发存活(RFS)两者,如本文进一步定义的那些T1IFN敏感的个体更可能是对用于胰腺癌的基于酵母的免疫疗法的响应者。即使是使用该小亚群,存在统计学显著性。重要的是,作为本发明主题的与T1IFN敏感性的关联与基于酵母的免疫疗法的结果特异性相关,而不与在癌症背景下基于其它疗法(例如单独的化疗)的使用的结果相关。
因而,本发明描述了这样的发现,即诱导T1IFN和保护性T细胞介导的免疫力二者的基于酵母的免疫疗法在遗传上易于对T1IFN敏感或可以对T1IFN产生敏感性的受试者中将是最有益的。本发明涉及优先选择那些被定义为或随时间可以形成对T1IFN的这种适当反应的受试者用于治疗的能力。在治疗方法之前或早期鉴定可能的响应者的能力将产生对使用基于酵母的免疫疗法的治疗的响应更好的预测,为正在治疗的个体提供显著的益处。
用于基于酵母的免疫疗法治疗的鉴定或预选择方法
因而,本发明集中于基于酵母的免疫疗法用于治疗或预防疾病,包括传染病(或由病原体引起的疾病)和癌症的用途,通过公开预选择可能具有最好的结果的受试者,具体来说,通过预选择对T1IFN敏感的受试者进行。因而,本发明的一个实施方案涉及使用基于酵母的免疫疗法治疗受试者的方法,其包括对预选择为对T1IFN敏感的受试者施用基于酵母的免疫治疗组合物。“预选择”受试者的步骤通过对来自受试者的生物样品进行预选择方法(即测定,分析,测试)来进行(其可以在体内或离体或体外进行,但是最典型地离体或体外进行)以检测受试者,特别是受试者的免疫系统是否对T1IFN敏感或不敏感(或较不敏感)。对体外或离体进行测定的引用是指在实验室中对已经从身体取出的生物样品(例如细胞,组织,体液等)进行测定。一些本领域技术人员可以认为这是“离体”,而一些本领域技术人员可以认为这是“体外”,但是在本上下文中为了清楚起见,这些术语可以互换使用。
本发明的一个实施方案包括预选择受试者用于使用基于酵母的免疫疗法治疗的方法。该方法包括以下步骤:(a)在从受试者分离的生物样品(例如,细胞)中离体或体外测量一种或多种T1IFN调节的生物标志物的基线水平;(b)离体或体外使所述生物样品与T1IFN接触;(c)在接触的步骤(b)之后测量所述一种或多种T1IFN调节的生物标志物的水平;和(d)预选择用于使用基于酵母的免疫疗法治疗的T1IFN敏感受试者,所述受试者的所述一种或多种T1IFN调节的生物标志物的水平由于使所述生物样品与T1IFN接触而上调或下调。在本发明的一个方面,计算步骤(c)中测量的生物标志物的水平与步骤(a)中测量的生物标志物的水平的比率,然后将其用于预选择受试者作为候选者,或拒绝受试者作为候选者,用于使用基于酵母的免疫疗法治疗。在一些实施方案中,预定的截留或标准(如下所述)用于预选择受试者(或拒绝或否则去选择(deselect)受试者)。
在本发明的一个方面,上述方法在步骤(c)之后另外包括以下步骤:(d)在步骤(c)之后,离体或体外使所述生物样品与T1IFN接触;(e)在接触的步骤(d)之后测量所述一种或多种T1IFN调节的生物标志物的水平;和(f)预选择用于使用基于酵母的免疫疗法治疗的T1IFN敏感的受试者,所述受试者的所述一个或多个T1IFN调节的生物标志物的水平由于步骤(b)中使所述生物样品与T1IFN接触而上调或下调,且所述受试者的所述一种或多种T1IFN调节的生物标志物的水平不由于步骤(d)中使所述生物样品与T1IFN接触而实质上调或下调。在该方法中,选择的受试者不仅在测定的第一部分(步骤(a)-(c))中表现出T1IFN敏感性,而且还表现出在第一次暴露于T1IFN后,细胞变得对进一步或重复暴露于T1IFN脱敏,其可用于筛选对T1IFN最敏感的那些受试者。下文详细描述本发明的这个方面。
本发明的另一个实施方案涉及分析个体对T1IFN的响应以确定受试者对基于酵母的免疫疗法的响应性的方法。在本发明的该实施方案中,在生物样品暴露于T1IFN之前和之后,在来自受试者的生物样品中测量T1IFN响应性生物标志物的水平,并且确定生物样品(或生物样品中的组分,例如细胞)与暴露于T1IFN之前相比,对暴露于T1IFN响应的能力。
在本发明的预选择或分析的方法的一个方面,在预选择受试者之前受试者的生物样品(例如细胞)尚未暴露于外源I型干扰素。在该方面,目标是最大化比较T1IFN敏感性的相对内在水平与T1IFN暴露后敏感性的能力,以确定受试者中基线免疫应答的状态。因而,在本发明的这些方法的另一个方面,可以优选的是,在步骤(a)之前受试者尚未接受I型干扰素的外源来源,尽管此类受试者也可以根据本发明进行测试和预选择。
在本发明的预选或分析方法的一个任选方面,描述了另外的测试。在该另外的测试中,测试含有T细胞的受试者细胞的样品以检测T细胞是否响应于与已经暴露于基于酵母的免疫治疗组合物或与基于酵母的治疗组合物孵育的APC接触而增殖,或不增殖(或表现出低增殖)。预期对T1IFN敏感的受试者也将具有在该二级测定中增殖的T细胞,并且比来自对T1IFN较不敏感或不敏感的受试者的T细胞以更大程度增殖。测量T细胞增殖的方法是本领域公知的。例如,通常通过获得来自受试者的T细胞并将其暴露于已经与基于酵母的免疫治疗组合物接触的抗原呈递细胞,并测量T细胞的增殖,例如通过使用放射性同位素或比色检测方法来测量T细胞增殖。
根据本发明,术语“干扰素”一般是指响应于双链RNA或其它T1IFN诱导的刺激的存在,通常由免疫系统的细胞和多种其它细胞产生的细胞因子。“1型干扰素”或“T1IFN”可以包括本领域已知的干扰素蛋白亚组的任何成员,并且可以通过例如它们结合特定细胞表面受体复合物的能力来鉴定,所述细胞表面受体复合物称为干扰素-α受体(IFNAR),其由IFNAR1和IFNAR2链组成(De Weerd等人,2007,J Biol Chem 282(28):20053–20057)。IFNAR与激酶TYK2和JAK1结合。一旦激活,IFNAR复合物磷酸化信号转导物和转录活化子(STAT)家族成员STAT1和STAT2,其与干扰素调节因子9(IRF9)异源三聚化以形成干扰素刺激的基因因子3(ISGF3)复合物(Janus激酶(JAK)/STAT途径)。ISGF3移位至细胞核并结合干扰素刺激的响应元件(ISRE),其是可在许多干扰素刺激的基因(ISG)的调节区中发现的DNA基序(在Hundeshagen,2012中综述,见上文)。在T1IFN相关途径中还存在几种正和负反馈回路。
在哺乳动物系统中发现的T1IFN包括但不限于IFN-α,IFN-β,IFN-κ,IFN-δ,IFN-ε,IFN-τ,IFN-ω,和IFN-ζ(也称为limitin)。在人类中发现的T1IFN包括IFN-α,IFN-β,IFN-κ(也称为IFNK)和IFN-ω。IFN-α蛋白(其存在各种亚型(包括IFN-α-2a和IFN-α-2b)),IFN-β蛋白(其存在各种亚型(包括IFN-β-1a和IFN-β-1b))由许多细胞类型产生,包括淋巴细胞,巨噬细胞,浆细胞样树突状细胞,成纤维细胞,内皮细胞等,并且通常参与先天免疫应答。IFN-α也在商业上生产用于施用至人类以治疗各种疾病,包括HCV,某些其它病毒感染和一些癌症,并且最经常以PEG化形式(例如pegIFN-α)商业提供。商业上也生产IFN-β以治疗各种疾病,包括MS。
根据本发明,如本领域通常使用的术语“T1IFN签名”或“IFN签名”是指干扰素可诱导的(在T1IFN的情况下,T1IFN可诱导的)基因的差异表达,其在本领域中已经用于区分例如患有疾病如自身免疫性疾病的患者与没有疾病(正常或健康)的个体。可以对给定的细胞类型和/或给定的组织类型,和/或给定的疾病状态(例如,自身免疫性疾病或病毒感染)建立干扰素签名,且由细胞、组织或个体响应暴露于T1IFN的T1IFN可诱导基因的数量和身份基于这些参数可以不同。为了本发明的目的,对于给定的细胞类型,组织类型,其他样品类型或待测试个体不需要知道精确的T1IFN签名,或测试给定的细胞,组织,其他样品类型或个体中响应T1IFN的所有基因或其他生物标志物的表达。本发明涉及个体以指示对T1IFN的响应性的方式调节响应于T1IFN的一种或多种T1IFN反应性生物标志物的水平的能力的差异,以确定受试者是否对T1IFN敏感或不敏感。
如上所述,“T1IFN签名”的评估,连同其他科学研究,已导致对多种生物标志物的鉴定,其包括基因,mRNA,蛋白质和甚至磷酸化模式,其通过诱导内源性T1IFN途径或通过暴露于T1IFN被调节(例如通过调节表达或生产)对T1IFN响应。此类生物标志物在本文中一般称为“T1IFN调节的生物标志物”并且也可以称为或包括1型“T1IFN调节的生物标志物”,“T1IFN刺激的生物标志物”,“干扰素刺激的基因”(或“ISG”)或具有“干扰素刺激的响应元件”(或ISRE)的基因,ISG产物(例如由ISG编码的蛋白产物),或“干扰素响应性”元件或基因或蛋白(或这些术语的任何派生)。可用于本发明的T1IFN生物标志物包括本领域已知的任何T1IFN生物标志物,例如在以下文献中描述的那些:Blasius等人,2010,Immunity 32:305–315;Bonjardim等人,2009,Immunol Lett 122:1–11;Boo等人,2010,Yonsei Med J51:9–17;Borden等人,2007,Nat Rev Drug Discov 6:975–990;Fensterl等人,2009,Biofactors 35:14–20;Hall等人,2010,Nat Rev Rheumatol 6:40–49;Haller等人,2007,Cytokine Growth Factor Rev 18:425–433;Koyama等人,2008,Cytokine 43:336–341;Sadler等人,2008,Nat Rev Immunol 8:559–568;Takaoka等人,2006,Cell Microbiol 8:907–922;Zhang等人,2007,Immunol Rev220:225–236;Hundeshagen等人,2012,supra;Kyogoku等人,2013,PLoS ONE8(12):e83776;Schneider等人,2014,Annual Review of Immunology,32:513-545;和Waddell等人,2010,PLos One 5(3)e9753。
可用于本发明的T1IFN生物标志物包括但不限于称为以下的基因:MX1(编码蛋白粘液病毒(流感病毒)抗性1,也称为MxA),STAT1(编码信号转导子和转录激活物家族1),IFNAR1(编码干扰素α/β受体α链),IFNAR2(编码干扰素α/β受体β链),IFI44L(编码干扰素诱导的蛋白44样)),RSAD2(编码含有S腺苷甲硫氨酸结构域2(S-adenosyl methionine domain containing 2)),ISG15(编码干扰素刺激的基因15),IFI27(编码干扰素可诱导蛋白27),LAMP3(编码溶酶体相关的膜蛋白3),OAS1/2和OAS3(编码2'-5'-寡腺苷酸合成酶1,2或3),CXCL10(编码C-X-C基序趋化因子10),SEB2(编码Sec61pER转位复合物的β亚基),CEACAM1(编码癌胚抗原相关细胞粘附分子1),SOC3(编码细胞因子信号传导抑制物3),TRAF2(编码TNF受体相关因子2),MAP2K6(编码促分裂原活化蛋白激酶6),THBS1(编码血小板反应素1),HBEGF(编码肝素结合性EGF样生长因子),ID1(编码立即剂量干扰素(immediate dose interferon)),NR4A1(编码核受体亚家族4,组A,成员1),DEFB1(编码防御素,β1),FOSL1(编码FOS样抗原1),EREG(编码上皮调节蛋白),FOSL2(编码FOS样抗原2),ABRN(编码活性断裂簇区域(BCR)相关蛋白),CCL7(编码趋化因子(C-C基序)配体7),CD9(编码互补决定蛋白9),ETNK1(编码乙醇胺激酶1),C5AR1(编码补体组分5a受体1),SUV420h1(编码杂色抑制物4-20同源物1(variegation 4-20homolog 1)),MYB(编码v-myb禽成髓细胞瘤病毒癌基因同源物),SOS1(编码son of sevenless同源物1),CD38(编码互补决定蛋白38),CD69(编码互补决定蛋白69),VEGFA(编码血管内皮生长因子A),LGALS3BP(编码凝集素,半乳糖苷结合,可溶性,3结合蛋白(lectin,galactoside-binding,soluble,3binding protein)),GZMB(编码粒酶B(粒酶2,细胞毒性T淋巴细胞相关的丝氨酸酯酶1)),SPHK1(编码鞘氨醇激酶1),PRF1(编码穿孔素1),PGAP1(编码GPI后附着于蛋白质1(post-GPI attachment to proteins 1)),EGR3(编码早期生长反应3(early growth response 3)),TNIK(编码TRAF2和NCK相互作用激酶),GZMA(编码粒酶A(粒酶1,细胞毒性T淋巴细胞相关的丝氨酸酯酶3)),CXXC5(编码CXXC指蛋白5),S100A12(编码S100钙结合蛋白A12),BLNK(编码B细胞接头),GOS2(编码G0/G1开关2),PDLIM7(编码PDZ和LIM结构域7),SLC2A3(编码溶质载体家族2(促进葡萄糖转运蛋白),成员3),MXD1(编码MAX二聚化蛋白1),FAIM2(编码Fas凋亡抑制分子2),E1F2AK2(编码真核翻译起始因子2α激酶3),PRKRA(编码蛋白激酶,干扰素可诱导的双链RNA依赖性激活剂),PALM2(编码paralemmin 2),EIF2B1(编码真核翻译起始因子2亚基),FAS(编码Fas细胞表面死亡受体),FASLG(编码Fas配体),FAF1(编码Fas(TNFRSF6)相关因子1),GADD45B(编码生长停滞和DNA-损伤可诱导的,β(growth arrest and DNA-damage-inducible,beta))和/或IL15RA(编码白细胞介素-15受体α),并且可以包括作为基因的那些生物标志物或其它生物标志物的蛋白产物(例如,粘液病毒(流感病毒)抗性1(MX1或MxA),蛋白激酶R(PKR),2'-5'-寡腺苷酸合成酶(OAS),(干扰素诱导的跨膜蛋白(IFITM),载脂蛋白B mRNA编辑酶1(apolipoprotein B mRNA-editing enzyme 1)(APOBEC1),含有三部分基序的蛋白(tripartite motif-containing proteins)(TRIM)),以及此类蛋白产物的磷酸化水平(例如,STAT1的磷酸化)。
本发明包括至少一种T1IFN生物标志物的测量。在一个实施方案中,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25或更多个T1IFN生物标志物用于相同的测定中(或对相同的生物样品或此类样品的等分试样依次进行测定),以测量个体的T1IFN敏感性。
根据本发明,“T1IFN敏感的”,其也可以称为“T1IFN响应的”,在本文中最通常定义为暴露于T1IFN时,个体展示可检测的和/或生物学上有意义的生理响应的能力,如通与暴露于T1IFN之前相比,一种或多种生物标志物的可检测的改变所测量的,所述一种或多种生物标志物被T1IFN调节,活化,诱导,或调控,其中所述改变可以在体内或离体或体外检测。在本发明的上下文中,“生物学上有意义”的生理响应是下述响应,其足以合理地将受试者分类为更可能响应基于酵母的免疫疗法,至少达到对所述受试者推荐或开处方的可接受的程度。在一个实施方案中,生物学上有意义的响应可以是统计学显著的,和/或通过特定测定验证指定的水平。验证通常指进行所有程序,其证明用于生物样品中参数的定量测量的特定方法对于预期用途是可靠的和可重复的。“可检测的”改变将在下面更详细地描述,但是最通常意味着使用公认或验证的用于测量所选择的T1IFN生物标志物的技术可以检测该改变,在优选的实施方案中,可用于鉴定T1IFN敏感的个体的“可检测”变化是显著地或足以推断受试者合理地可能响应于基于酵母的免疫疗法的变化水平,或者相比于具有较小的变化水平的个体,该受试者更可能对响应基于酵母的免疫疗法。根据本发明,在一些实施方案中,T1IFN敏感的个体还可以通过一种或多种以下属性来表征:(1)与Th17免疫应答相比,表现出Th1优势免疫应答;(2)具有低或相对低的血清IL-17水平;(3)具有低或相对低的血清T1IFN水平;(4)具有响应于与已经吞噬了基于酵母的免疫治疗组合物的APC接触而扩增的CD4+T细胞;(5)具有对PD-1阻断响应的免疫细胞(例如,响应PD-1抑制,例如通过抗PD1抗体);和/或(6)作为T1IFN产生的结果和下游效应,具有由免疫系统产生的吲哚胺-吡咯2,3-双加氧酶(IDO)的增加的水平。在一个实施方案中,T1IFN敏感的个体也可以通过其对T1IFN的重复的体外/离体暴露(即,至少两次连续暴露)的响应来鉴定,其中在连续暴露于T1IFN后,T1IFN敏感个体更可能对T1IFN变得脱敏而不是致敏。
根据本发明,“T1IFN不敏感的”,也可以称为“T1IFN抗性”,“T1IFN较少响应”或“T1IFN不响应”,最通常定义为个体对暴露于T1IFN显示可检测和/或生物学上有意义的生理响应的不能或低能力(或与T1IFN敏感的个体相比降低的能力),如通过一个或多个由T1IFN调节,活化,诱导或调控的生物标志物的可检测变化测量的(例如,与暴露于T1IFN之前相比),其中该变化可以在体内或离体或体外检测。根据本发明,在一些实施方案中,T1IFN不敏感个体还可以通过一种或多种以下属性来表征:(1)与Th1免疫应答相比显示出Th17优势免疫应答;(2)具有高或相对高的血清IL-17水平;(3)具有高或相对高的血清T1IFN水平;(4)具有响应于与吞噬了基于酵母的免疫治疗组合物的APC接触而不扩增或几乎没有增殖至没有增殖的CD4+T细胞;(5)具有对CTLA4阻断响应的免疫细胞(例如,响应CTLA4抑制,例如通过抗CTLA4抗体);和/或(6)对IDO抑制剂更响应,即,IDO的阻断应该改善损害Th17功能的T1IFN相关的IDO活性的抑制作用。
应当理解,当观察群体、分组或个体组时,对T1IFN的敏感性将最可能揭示响应的连续谱(continuum),即每个个体将比另一个个体对T1IFN更敏感或较不敏感,如将群体、分组或组作为整体看待产生敏感性的连续谱。根据本发明,个体对T1IFN越敏感,他或她将更可能对基于酵母的免疫疗法具有有意义的响应。因此,本发明的方法以其最一般的意义用于预选择那些最可能对基于酵母的免疫疗法响应的受试者,这必然意味着一些受试者将被预选择为较不可能对基于酵母的免疫疗法响应。在一些实施方案中,所述方法具有用于将个体定义为T1IFN敏感或T1IFN不敏感的预先确定的截留(例如,临床或生物学上有意义的T1IFN敏感性的定性或定量测量,通常是经验证的测定)。因此,预选为较不可能对基于酵母的免疫疗法响应的一些受试者当测试时仍可以显示对T1IFN的一些敏感性,尽管不是足够归类为“T1IFN敏感的”的响应。这些受试者将被分类为“T1IFN不敏感的”(或T1IFN不响应或T1IFN较少响应),即使他们对T1IFN有轻微或低响应。虽然基于T1IFN测定对基于酵母的免疫疗法“不太可能”响应的此类个体仍然可以使用该免疫疗法获得一些益处或甚至很大的益处,因为预期益处的可能性低于其他具有更高T1IFN敏感性的个体,可以在个体的基础上作出是否进行基于酵母的免疫疗法的决定,或者替代地尝试针对疾病或状况的不同类型的治疗性处理,其可以产生更好的结果。或者,可以使用基于酵母的免疫疗法与一种或多种另外的试剂或疗法组合治疗此类个体,所述试剂或疗法选择为:(1)基于个体现在已知的T1IFN概貌(profile),改善个体对基于酵母的免疫疗法响应的能力,和/或(2)考虑治疗的疾病或状况,通常改善个体的有益治疗的可能性。
关于受试者为T1IFN敏感还是T1IFN不敏感的实际决定因此首先基于个体(或个体的免疫系统)如何对T1IFN响应,其通过在暴露于T1IFN之前和之后评估来自受试者的生物样品(即,通过将生物标志物的基线,暴露前水平与生物标志物的暴露后水平进行比较)。以这种方式,不论被测量的具体生物标志物的绝对水平,该测试将测量个体的T1IFN暴露之前和之后的生物标志物的相对水平,其产生比率,指数,倍数变化或百分比变化(或其它“Delta”Δ),然后可以将其与标准进行比较。如本文所使用的,参考任何此类比率,指数,倍数变化或百分比变化(或其它“Delta”Δ)是参照变化的绝对值来陈述的。例如,如果生物标记被下调,使得T1IFN暴露后生物标记的水平是暴露前水平的三分之一,则该差异在本文中称为比率为3或3倍变化。作为另一个实例,如果生物标记被上调使得T1IFN暴露后生物标记的水平是暴露前水平的三倍,则该差异在本文中被称为比率为3或3倍变化。此类测量可能比通过简单比较不同个体之间的生物标志物的绝对水平提供更多信息,因为在个体之间基线可能不同。第二,确定响应是否被认为指示对T1IFN的敏感性或不敏感性最典型地基于对受试者组的预确定的“截留”或“标准”,其考虑给定样品类型和筛查的生物标志物类型(并且在一些情况下,个体经历的疾病类型)。换句话说,然后相对于标准或截留评估个体的比率,指数,倍数变化或百分比变化(或其他“Delta”Δ),以将个体分类为T1IFN敏感的或T1IFN不敏感的。可以根据所测试的生物样品的类型或所使用的生物标志物的类型不同地评估T1IFN响应性的测量(例如,指示T1IFN敏感性的蛋白质的产生水平的差异的量级可以不同于指示敏感性的mRNA的差异表达的量级)。
另外,当使用多于一种T1IFN生物标志物时,它们不需要在相同方向上被调节。例如,与基线水平相比,单一测定中使用的一种或多种T1IFN生物标志物可以通过与基线水平相比被上调而对T1IFN暴露响应,并且与基线水平相比,一种或多种其它T1IFN生物标记可被下调。另外,当使用两种或更多种T1IFN生物标志物时,对于确定受试者的响应状态,所述两种或更多种生物标志物不需要以相同程度或以完全相同的方式被调节而显著或有意义。在单个测定中使用两个,三个,四个,五个,六个,七个,八个,九个,十个或更多个T1IFN生物标志物可以增加测定的能力,使得更可能响应于基于酵母的免疫疗法的个体更容易从不太可能响应于基于酵母的免疫疗法的个体鉴定或区分。
通常通过在来自个体的生物样品中体内或离体或体外测量给定T1IFN生物标志物的水平在暴露于T1IFN之后与暴露于T1IFN之前测量的T1IFN生物标志物的基线水平相比是否改变(上调或下调,增加或减少,修饰,改变等)来确定T1IFN敏感性(或不敏感性)。如果T1IFN生物标志物的水平在暴露于T1IFN和/或根据测定的截留或标准设置显著,实质,可检测或可测量改变,则该个体对T1IFN敏感。如果T1IFN生物标志物的水平在暴露于T1IFN和/或根据测定的截留或标准设置没有改变或没有显著,实质,可检测或可测量改变,则个体对T1IFN不敏感。
T1IFN生物标志物的“水平”可以是,例如,在生物标志物是基因或mRNA时为表达水平(通常通过检测mRNA表达来测量),或者在所述生物标志物是蛋白时,为蛋白产生或表达或定位的水平,或者在生物标志物是磷酸化的测量时为蛋白的磷酸化的水平。此类术语将被本领域技术人员容易地理解,并且基于生物标志物的类型和用于测量该生物标志物的测定的类型来定量或定性地定义。
在缺乏所测试的生物样品暴露于T1IFN外源来源的情况下,在体内或离体或体外测量T1IFN生物标志物的“基线”水平。基线水平优选是内在的基线水平,例如来自受个体中病原体的存在,或微环境中疾病因子的影响,或甚至向受试者在先施用T1IFN最小影响的水平。例如,在HCV感染的个体中,可以优选使用外周血单核细胞(PBMC)作为样品,而不是肝细胞,因为肝细胞可以仍然携带病毒并且在基线处具有预活化的T1IFN表型。这不是说此类样品不合适,而是当可以建立内在基线时,与T1IFN敏感性相关的结果的解释和基于酵母的免疫疗法的影响可能更具信息性或不同。在一些疾病,如癌症或一些感染性疾病的情况下,从活检获得的样品在一些实施方案中也是有用的,因为此类样品可以提供与个体经历的疾病特异性相关的信息。由于本发明的目的是预选择最可能响应于基于酵母的免疫疗法的患者,因此必须集中于T1IFN对个体的免疫应答的影响,优选使用生物样品确定合适的基线水平,所述生物样品包含免疫细胞和/或与受试者的内在免疫反应性最相关。通常也将调整给定测定中的基线水平以减去任意“背景”或非特异性活性或“噪声”,以便提高检测方法的准确性。
如上文所述,在一些实施方案中,本发明的方法具有用于将个体定义为T1IFN敏感性或T1IFN不敏感性的预确定的截留或标准(例如,有意义的T1IFN敏感性的定性或定量测量)。可以使用预确定的标准评价T1IFN响应的变化(基线相对于T1IFN暴露后),个体可以表征为T1IFN敏感的或T1IFN不敏感的,然后将该表型用于预选择受试者用于基于酵母的免疫疗法治疗(或在T1IFN不敏感的受试者的情况下,对受试者选择或提供替代的治疗方案)。测定(预选择方法)的预确定的标准通常在验证测定的过程中确定,但也可以基于统计分析,和/或受试者组的回顾性或前瞻性分析,以及T1IFN敏感性和基于酵母的免疫疗法相关的临床结果的相关性在验证之前确定。
在本发明的一个实施方案中,预选受试者为T1IFN敏感的标准定义为与暴露前(基线)相比,在暴露于T1IFN后,T1IFN生物标志物的水平变化至少3倍,或至少4倍,或至少5倍,或至少6倍,或至少7倍,或至少8倍,或至少9倍,或至少10倍或至少11倍,或至少12倍,或至少13倍,或至少14倍,或至少15倍,或至少16倍,或至少17倍,或至少18倍,或至少19倍,或至少20倍,或至少25倍,或至少30倍,或至少40倍,或至少50倍。
在本发明的一个实施方案中,确定相比于T1IFN暴露前,暴露后响应水平的比率,并将预选择受试者为T1IFN敏感的标准定义为比率为至少3,至少4,至少5,至少6,至少7,至少8,至少9,至少10,至少11,至少12,至少13,至少14,至少15,至少至少16,至少17,至少18,至少19,至少20,至少25,至少30,至少40或至少50。
在本发明的一个实施方案中,预选择受试者为T1IFN敏感的标准定义为与暴露前(基线)相比,在暴露于T1IFN后T1IFN生物标志物的水平变化为至少50%,至少75%,至少100%,至少125%,至少150%,至少175%,至少200%,至少225%,至少250%,至少275%,300%,至少400%,至少500%,至少600%,至少700%。
在本发明的一个实施方案中,预选择受试者为T1IFN敏感的标准定义为与暴露前(基线)相比,在暴露于T1IFN后T1IFN生物标志物的水平的变化,其是统计学显著的,如通过高于中值的至少2个标准误差,高于中值的至少3个标准误差,高于中值的至少4个标准误差,或高于中值的至少5个标准误差所定义的。
在本发明的一个实施方案中,预选择受试者为T1IFN敏感的标准定义为与暴露前(基线)相比,在暴露于T1IFN后T1IFN生物标志物的水平的变化,起始统计学显著的,如通过p<0.05,p<0.02,p<0.01,p<0.005,p<0.002,或p<0.001的p值所定义的。
本发明的预选择受试者用于使用基于酵母的免疫疗法治疗的方法包括测试来自受试者的生物样品中的一种或多种T1IFN生物标志物。如本文所使用的,生物样品可以包括来自受试者的任何体液或组织,其包含可以测试一种或多种T1IFN生物标志物的响应性的细胞。生物样品可以包括分离的或部分分离的细胞样品,组织样品,体液样品,或例如从分离自患者的细胞样品获得的核酸样品(例如,从外周血单核细胞(PBMCs)分离的核酸)。可以通过活检获得组织样品,例如,包括通过切割,切片,擦拭,刮擦或冲孔。可以通过静脉切开术,擦拭或其它简单方法获得的体液样品,包括但不限于血液(全血或血浆),粘液和唾液。优选的细胞样品包括包含免疫系统细胞例如T细胞和抗原呈递细胞的细胞。在本发明中特别有用的一种类型的细胞样品是PBMCs。在本发明中特别有用的另一类型的样品是活检样品。
确定T1IFN敏感性的方法不仅包括免疫治疗之前和之后的直接测量T1IFN和T1IFN响应基因产物,而且包括在体外和体内确定的CD4+T细胞扩增/增殖的测量。T1IFN敏感性和T1IFN不敏感性(T1IFN-抗性)可以通过本领域已知的任何合适的方法测量,包括本文描述和例示的那些。此类方法包括但不限于作为由T1IFN诱导或暴露于T1IFN的结果的T1IFN响应性基因/蛋白的测量。用于检测基因和蛋白的表达和/或水平的合适的方法包括但不限于聚合酶链式反应(PCR),逆转录酶-PCR(RT-PCR),原位杂交,Northern印迹,序列分析,基因微阵列分析,报告基因的检测,Western印迹,免疫印迹,酶联免疫吸附测定(ELISA),放射免疫测定(RIA),免疫沉淀,表面等离振子共振,化学发光,荧光偏振,磷光(phosphorescence),免疫组织化学分析,基质辅助激光解吸/电离飞行时间(matrix-assisted laser desorption/ionization time-of-flight)(MALDI-TOF)质谱术,显微细胞计数,微阵列,显微术,荧光激活细胞分选(FACS)和流式细胞术。
在一个方面,生物样品是PBMCs,并且可以使用选自以下的方法测量T1IFN敏感性:ELISA,多重PCR反应中的实时PCR,流式细胞术(细胞内细胞因子染色),(基于珠的多重免疫测定平台,其通过用激光激发样品,和随后分析发射光的波长同时测量多种分析物,Luminex Corporation,Austin,TX)或基于定量选择反应监测(SRM)的质谱法,尽管本发明不限于使用这些具体方法。在一个方面,生物样品是活检样品,并且可以使用选自以下的方法测量T1IFN敏感性:Western印迹,ELISA,实时PCR或基于定量SRM的质谱法,尽管本发明不限于使用这些具体的方法。
适合于检测T1IFN敏感性的一种示例性测定法是检测T1IFN诱导的蛋白的表达水平。在该测定中,从待测试的受试者收集细胞样品,例如PBMCs样品,并且新鲜使用或可以冷冻和以后解冻用于测试。细胞在体外(或离体)暴露于T1IFN之前以及在暴露于T1IFN之后,测试T1IFN诱导的蛋白的表达水平,并且使用对T1IFN诱导的蛋白特异性的抗体通过蛋白质印迹定量所述蛋白的表达。计算暴露后水平与暴露前水平的比率。用于T1IFN诱导的蛋白MxA的此类测定描述于例如Feng等人,2012,J Neurol Sci.313(1-2):48-53或此类测定的修改版本描述于本实施例中(参见实施例1)。可以使用此类测定类似地测量其它T1IFN诱导的蛋白。
用于检测T1IFN敏感性的另一种示例性测定是检测T1IFN诱导的基因的表达水平,例如通过测量mRNA水平。例如,用于T1IFN诱导的基因的mRNA表达的此类测定描述于Hundeshagen等人,2012,同上,Sultanik等人,2014,同上,Dill等人,2011,同上,和Kyogoku等人,2013,同上。在这些出版物的一些中,不评估在体外或体外暴露于T1IFN之前和之后的差异,但是此类方法可以容易地适于进行该分析。
用于检测T1IFN敏感性的另一种示例性测定是检测由于被T1IFN活化而磷酸化的蛋白的磷酸化水平。用于T1IFN诱导的转录因子,STAT1的磷酸化的此类测定描述于例如Sultanik等人,2014,同上。
确定T1IFN敏感性的潜在的精确方法是通过当使用T1IFN呈递T细胞,然后不久之后重新呈递时发生脱敏的快速性。较敏感的个体是在较低剂量下对T1IFN脱敏的那些个体。在本发明的一个实施方案中,使用本领域已知的或本文所述的任何测定法,首次测试来自受试者的样品的T1IFN敏感性,然后将样品第二次暴露于T1IFN并再次评估敏感性的测量。对T1IFN高度敏感的个体,对于一些T1IFN和细胞类型,在第一次暴露后对T1IFN脱敏,导致对随后暴露的响应钝化。此类测定描述于例如Sultanik等人.,2014,同上。
可用于本发明的组合物
基于酵母的抗原特异性免疫治疗组合物在各种类型的免疫疗法中是独特的,因为这些组合物诱导先天免疫应答,以及特异性靶向各种疾病相关抗原的适应性免疫应答,包括CD4+依赖的TH17和TH1T细胞应答和抗原特异性CD8+T细胞应答。基于酵母的免疫治疗组合物作为生物制剂或药学上可接受的组合物施用。因而,不是使用酵母作为抗原生产系统,随后从酵母中纯化所述抗原,本文所述的整个酵母媒介必须适于,并配制用于施用至患者。本发明的基于酵母的免疫治疗组合物包含容易可检测的酵母DNA且实质上包含超过5%的酵母蛋白;一般地,并且取决于酵母的抗原表达水平,本发明的基于酵母的免疫治疗剂含有超过70%,超过80%或超过90%的酵母蛋白。
将基于酵母的免疫治疗组合物施用于患者以便为了治疗和/或预防目的而免疫患者。在本发明的一个实施方案中,将基于酵母的组合物配制用于在药学上可接受的赋形剂或制剂中施用。在一个方面,组合物应当被配制成适于向人类受试者施用(例如,制造条件应当适合用于人类用途,以及用于完成组合物和/或制备用于施用的免疫治疗剂的剂量的任何赋形剂或制剂应当适合用于人类用途)。在本发明的一个方面,基于酵母的免疫治疗组合物被配制用于通过患者或受试者的注射,例如通过胃肠外途径(例如通过皮下,腹膜内,肌肉内或皮内注射或另一种合适的肠胃外途径)施用。
与酵母媒介物相结合,抗原最典型地由所述酵母媒介物表达为重组蛋白(例如通过完整酵母或酵母原生质球,其可任选地进一步加工成酵母胞质体,酵母空胞(ghost)或酵母膜提取物或其级分),尽管本发明的一个实施方案是将一种或多种抗原加载到酵母媒介物中或与本文所述的酵母媒介物复合,附接,混合或施用,以形成本发明的组合物。根据本发明,提及与本发明的酵母媒介物相关的“异源”蛋白或“异源”抗原(包括异源融合蛋白)是指蛋白或抗原不是由酵母天然表达的,尽管包括异源抗原或异源蛋白的融合蛋白也可以包括也是由酵母天然表达的序列或蛋白或其部分(例如,如本文所述的α因子前原序列(prepro sequence))。
根据本发明,本文一般使用的术语“抗原”是指:蛋白(肽,部分蛋白,全长蛋白)的任何部分,其中所述蛋白质天然存在的或合成得到的,细胞组合物(全细胞,细胞裂解物或破碎细胞),生物体(完整生物体,裂解物或破碎细胞)或碳水化合物,或其它分子或其部分。抗原可以引发抗原在特异性免疫应答(例如,体液和/或细胞介导的免疫应答),其针对免疫系统元件(例如,T细胞,抗体)遇到的相同或相似的抗原。
抗原可以小至单个表位,单个免疫原性结构域或更大,并且可以包括多个表位或免疫原性结构域。因此,抗原的大小可以小至约8-12个氨基酸(即,肽)并且大至:全长蛋白,多聚体,融合蛋白,嵌合蛋白,全细胞,完整微生物,或其任何部分(例如,全细胞的裂解物或微生物的提取物)。此外,抗原可以包括碳水化合物,其可以装载到酵母媒介物或本发明的组合物中。应当理解,在一些实施方案中(例如,当抗原由酵母媒介物从重组核酸分子表达时),所述抗原是蛋白,融合蛋白,嵌合蛋白或其片段,而不是整个细胞或微生物。
当抗原在酵母中表达时,抗原具有能够在酵母中重组表达的最小尺寸,并且通常具有至少或大于25个氨基酸的长度,或至少或大于26个氨基酸,至少或大于27,至少或大于28,至少或大于29,至少或大于30,至少或大于31,至少或大于32,至少或大于33的至少或大于34,至少或大于35,至少或大于36,至少或大于37,至少或大于38,至少或大于39,至少或大于40,至少或大于41,至少或大于42,至少或大于43,至少或大于44,至少或大于45,至少或大于46,至少或大于47,至少或大于48,至少或大于49,或至少或大于50个氨基酸的长度,或长度为至少25-50个氨基酸,长度为至少30-50个氨基酸,或至少35个氨基酸,50个氨基酸长度,或至少40-50个氨基酸长度,或至少45-50个氨基酸长度。可以表达更小的蛋白,并且可以表达显著更大的蛋白(例如,长度为几百个氨基酸或甚至几千个氨基酸)。在一个方面,可以表达缺少来自N-和/或C端的一个或多个氨基酸(例如,缺乏从N-和/或C-末端约1至约20个氨基酸)的全长蛋白或其结构或功能结构域或其免疫原性结构域。融合蛋白和嵌合蛋白也是可以在本发明中表达的抗原。“靶抗原”是由本发明的免疫治疗组合物特异性靶向的抗原(即,期望针对其引发免疫应答的抗原)。
当提及免疫应答的刺激时,术语“免疫原”是术语“抗原”的子集,并因此在一些情况下,可与术语“抗原”互换使用。如本文所使用的免疫原描述了引发体液和/或细胞介导的免疫应答的抗原(即,是免疫原性的),使得向个体施用免疫原产生针对与个体的免疫系统遇到的抗原相同或相似的抗原的特异性免疫应答。在一个实施方案中,免疫原引起细胞介导的免疫应答,包括CD4+T细胞应答(例如TH1,TH2和/或TH17)和/或CD8+T细胞应答(例如CTL应答)。
给定抗原的“免疫原性结构域”可以是抗原的任何部分,片段或表位(例如肽片段或亚基或抗体表位或其他构象表位),其含有至少一个当施用至动物时作为免疫原的表位。因此,免疫原性结构域大于单个氨基酸,并且至少为至少足以含有一个可以作为免疫原的表位的大小。例如,单个蛋白可以包含多个不同的免疫原性结构域。免疫原性结构域不需要是蛋白内的线性序列,例如在体液免疫应答的情况下,其中考虑构象结构域。
给定蛋白质的“功能结构域”是所述蛋白的一部分或功能单元,其包括直接或间接负责至少一种生物或化学功能的序列或结构,所述生物或化学功能与所述蛋白相关,归因于所述蛋白,或由所述蛋白执行。例如,功能结构域可以包括用酶促活性的活性位点,配体结合位点,受体结合位点,分子或部分的结合位点(例如钙),磷酸化位点或反式激活结构域。
给定蛋白质的“结构域”是蛋白质的一部分或蛋白质整体结构中的元件,其具有可识别的结构(例如,其可以是属于并指示蛋白类型或家族中的几种蛋白质的一级或三级结构),是自稳定的和/或可以独立于蛋白质的其余部分折叠。结构域通常与其所属的蛋白的生物学功能相关或特征显著。
表位在本文中定义为在给定抗原内的单个免疫原性位点,当在适当的共刺激信号和/或免疫系统的活化细胞的背景下向免疫系统提供时,足以引起免疫应答。换句话说,表位是实际上被免疫系统的组分识别的抗原的部分,并且也可以称为抗原决定簇。本领域技术人员将认识到T细胞表位在大小和组成上不同于B细胞或抗体表位,并且通过I类MHC途径呈递的表位在大小和结构属性上不同于通过II类MHC途径呈递的表位。例如,由I类MHC分子呈递的T细胞表位通常长度为8至11个氨基酸,而由II类MHC分子呈递的表位在长度上受较少限制,并且可以为8个氨基酸至多25个氨基酸或更长。此外,T细胞表位具有预测的结构特征,这取决于由表位结合的特定MHC分子。大多数抗体识别构象表位。
在本文所述的基于酵母的免疫治疗组合物中使用的任何抗原,包括任何融合蛋白,可以应用以下另外的实施方案。首先,N末端表达序列和/或C末端标记是任选的,并且如果使用的话,可以选自下述几种不同的序列,以改善表达,稳定性和/或允许鉴定和/或纯化蛋白。在一个方面,N末端或C末端序列中的一个或两个一同省略。此外,适合用于酵母中的许多不同的启动子是本领域已知的,并且包括用于表达根据本发明的抗原。此外,由于多种原因,可以在融合蛋白的部分之间引入短的间插接头序列(例如,1,2,3,4或5个或更大的氨基酸肽),包括引入限制酶位点以促进构建体的克隆和未来的操作。
如上所述,任选地,用作本发明的基于酵母的免疫治疗组合物的组分的蛋白(包括融合蛋白)可使用特别有用于改善或增强酵母中的重组抗原的表达,或表达的稳定性的构建体产生。通常,所需的抗原性蛋白或肽在其氨基末端(N-末端)与以下融合:(a)特定合成肽,其稳定酵母媒介中融合蛋白的表达或阻止表达的融合蛋白的翻译后修饰(例如,在2004年8月12日公开的美国专利公开号2004-0156858A1中详细描述了此类肽,其全部内容通过引用并入本文);(b)内源性酵母蛋白的至少一部分,包括但不限于α因子,其中融合配偶体提供蛋白在酵母中的表达的改善的稳定性和/或防止通过酵母细胞的蛋白的翻译后修饰(此类蛋白也详细描述于例如美国专利公开号2004-0156858A1,同上);和/或(c)酵母蛋白的至少一部分,其导致融合蛋白在酵母表面上表达(例如,本文更详细描述的Aga蛋白)。另外,本发明任选地包括使用融合到编码抗原的构建体的C末端的肽,特别是用于蛋白的选择和鉴定。此类肽包括但不限于任何合成或天然肽,例如肽标签(例如六组氨酸)或任何其它短表位标签。连接到根据本发明的抗原的C末端的肽可以在添加或不添加本文所讨论的N-末端肽的情况下使用。
在一个实施方案中,有用于融合蛋白的合成肽连接到抗原的N-末端,所述肽由对抗原异源的至少两个氨基酸残基组成,其中所述肽稳定酵母载体中的融合蛋白的表达或防止表达的融合蛋白的翻译后修饰。所述合成肽和抗原的N-末端部分一起形成具有以下要求的融合蛋白:(1)融合蛋白的位置1处的氨基酸残基是甲硫氨酸(即,合成肽中的第一个氨基酸是甲硫氨酸);(2)融合蛋白第2位的氨基酸残基不是甘氨酸或脯氨酸(即,合成肽中的第2个氨基酸不是甘氨酸或脯氨酸);(3)融合蛋白的2-6位的氨基酸残基都不是甲硫氨酸(即,位置2-6处的氨基酸,无论是合成肽或蛋白质的部分,如果合成肽短于6个氨基酸,不包括甲硫氨酸);和(4)融合蛋白的2-6位的氨基酸都不是赖氨酸或精氨酸(即,位置2-6处的氨基酸,无论合成肽或蛋白质的部分,如果合成肽短于5个氨基酸,不包括赖氨酸或精氨酸)。合成肽可以短至两个氨基酸,但在一个方面,为2-6个氨基酸(包括3,4,5个氨基酸),并且可以长于6个氨基酸,为整数,高达约200个氨基酸,300个氨基酸,400个氨基酸,500个氨基酸或更多。
在一个实施方案中,融合蛋白包含M-X2-X3-X4-X5-X6的氨基酸序列,其中M是甲硫氨酸;其中X 2是除甘氨酸,脯氨酸,赖氨酸或精氨酸之外的任意氨基酸;其中X3是除甲硫氨酸,赖氨酸或精氨酸之外的任意氨基酸;其中X4是除甲硫氨酸,赖氨酸或精氨酸之外的任意氨基酸;其中X5是除甲硫氨酸,赖氨酸或精氨酸之外的任意氨基酸;并且其中X6是除甲硫氨酸,赖氨酸或精氨酸之外的任意氨基酸。在一个实施方案中,X6残基是脯氨酸。增强酵母细胞中抗原表达的稳定性和/或防止酵母中蛋白质的翻译后修饰的示例性合成序列包括序列M-A-D-E-A-P(SEQ ID NO:1)。除了表达产物的增强的稳定性,这些融合配偶体似乎不负面地影响针对构建体中的免疫抗原的免疫应答。此外,合成融合肽可以被设计为提供可以被选择试剂例如抗体识别的表位。
在一个实施方案中,抗原在N-末端与酵母蛋白连接,例如α因子前原序列(也称为α因子信号前导序列)。酵母α因子前原序列的序列是本领域中已知的并包括在本发明中使用。
根据本发明的任意实施方案,提及“全长”蛋白(或全长功能结构域,全长结构域或全长免疫结构域)包括蛋白或功能结构域,结构域或免疫结构域的全长氨基酸序列,如本文所述或已知的,或公共可得的序列中描述的。“接近全长”的蛋白或结构域,其也是蛋白的同源物的类型,与全长蛋白或结构域不同,其通过从此类全长蛋白或全长结构域的N-和/或C-末端开始至少添加或缺失或省略1,2,3,4,5,6,7,8,9或10个氨基酸。对蛋白或结构域的一般提及可以包括全长和接近全长的蛋白,以及其它同源物。
在一个方面,可用于基于酵母的免疫治疗组合物中的抗原包含全长蛋白,或其功能,结构或免疫原性结构域的线性序列的至少80%,85%,90%,91%,92%,93%,94%,95%,96%,97%98%或99%。在一个方面,抗原与全长蛋白,或其功能,结构或免疫原性结构域至少80%,85%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%相同。
在本发明的一些方面,可对野生型或参考蛋白的一个,两个,三个,四个,五个,六个,七个,八个,九个,十个或更多个氨基酸进行氨基酸插入,缺失和/或取代,条件是所得蛋白在用作本发明的基于酵母的免疫治疗组合物中的抗原时,引发针对靶或野生型或参考蛋白的免疫应答,其可以包括增强的免疫应答,减弱的免疫应答或基本上相似的免疫应答。此类抗原在本文中也可以称为“改变的肽配体”(APL),其是可以包括一个或多个T细胞表位,特别是细胞毒性T淋巴细胞(CTL)表位的抗原,其已经通过一个或更多个氨基酸残基取代为不同的氨基酸残基而突变。突变的目的是引发针对激动剂表位(agonist epitope)的T细胞应答,其与针对天然抗原的应答相比被增强/放大/改善,这可以通过改善表位对MHC分子或对在MHC呈递的环境下识别所述抗原的T细胞受体的亲合力(avidity)或亲和力(affinity)来实现。因此,抗原激动剂可以改善针对感染宿主或由宿主表达的天然蛋白的T细胞应答的效力或效率。
本发明还包括任何上述融合蛋白的同源物,以及个体蛋白或其部分(包括任何功能和/或免疫原性结构域)的同源物,变体或突变体的用途,其是此类融合蛋白的部分或本文另有描述。一方面,本发明包括融合蛋白或个体(单个)蛋白或抗原的用途,分别具有与任意融合蛋白或个体蛋白或抗原至少85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%相同的氨基酸序列,在融合蛋白的整个长度上,或相对于融合蛋白中的确定的区段,或确定的蛋白或其结构域(免疫原性结构域或功能结构域(即,具有至少一种生物学活性的结构域)),其形成融合蛋白的一部分。
抗原的类型。考虑用于本发明的抗原包括期望引起免疫应答的任意抗原,并且具体的,包括针对此类抗原的治疗性免疫应答将对个体有益的任何抗原。例如,所述抗原可以包括但不限于与病原体相关的任意抗原,包括病毒抗原,真菌抗原,细菌抗原,蠕虫抗原,寄生虫抗原,外寄生物抗原,原生动物抗原或来自任何其他传染原的抗原。抗原还可包括与特定疾病或病症相关的任何抗原,来自病原或细胞来源,包括但不限于癌抗原,与自身免疫疾病相关的抗原(例如,糖尿病抗原),过敏抗原(过敏原),具有一个或多个突变的氨基酸的哺乳动物细胞分子,通常由哺乳动物细胞出生前或新生表达的蛋白,其表达通过插入流行病学试剂(例如病毒)诱导的蛋白,其表达通过基因转位诱导的蛋白,以及其表达由调节序列的突变诱导的蛋白。这些抗原可以是天然抗原,或已经以某种方式修饰的遗传工程化的抗原(例如,序列变化或融合蛋白的产生)。应当理解,在一些实施方案中(即,当抗原由酵母媒介物从重组核酸分子表达时),所述抗原可以是蛋白或其任何表位或免疫原性结构域,融合蛋白,或嵌合蛋白,而不是整个细胞或微生物。
在本发明的一个方面,有用于本发明的一种或多种免疫治疗组合物的抗原包括任何癌症或肿瘤相关抗原。在一个方面,抗原包括与肿瘤(发生)前或增生性状态相关的抗原。所述抗原还可以与癌症相关或导致癌症。此类抗原可以是肿瘤特异性抗原,肿瘤相关抗原(TAA)或组织特异性抗原,其表位,和其表位激动剂。癌抗原包括但不限于来自任何肿瘤或癌症的抗原,包括但不限于黑素瘤,鳞状细胞癌,乳腺癌,头颈癌,甲状腺癌,软组织肉瘤,骨肉瘤,脊索瘤,睾丸癌,前列腺癌,卵巢癌,膀胱癌,皮肤癌,脑癌,血管肉瘤,血管内皮瘤,肥大细胞瘤,白血病,淋巴瘤,原发性肝癌,肺癌,胰腺癌,胃肠癌(包括结直肠癌),肾细胞癌,造血新生物(hematopoietic neoplasias)及其转移癌。
合适的癌症抗原包括但不限于癌胚抗原(CEA)及其表位,例如CAP-1,CAP-1-6D(GenBank登录号M29540),MART-1(Kawakami等人,J.Exp.Med.180:347-352,1994),MAGE-1(美国专利号5,750,395),MAGE-3,GAGE(美国专利号5,648,226),GP-100(Kawakami等人,Proc.Nat'l Acad.Sci.USA91:6458-6462,1992),MUC-1,MUC-2,点突变的Ras癌蛋白,正常和点突变的p53癌蛋白(Hollstein等人,Nucleic Acids Res.22:3551-3555,1994)PSMA(Israeli等人,Cancer Res.53:227-230,1993),酪氨酸酶(Kwon等人,PNAS 84:7473-7477,1987),TRP-1(gp75)(Cohen等人,Nucleic Acid Res.18:2807-2808,1990;美国专利号5,840,839):NY-ESO-1(Chen等人,PAS 94:1914-1918,1997),TRP-2(Jackson等人,EMBOJ,11:527-535,1992),TAG72,KSA,CA-125,PSA,HER-2neu/c-erb/B2(美国专利号5,550,214),EGFR,hTERT,p73,B-RAF,adenomatous polyposis coli(APC),Myc,von Hippel-Lindau蛋白(VHL),Rb-1,Rb-2,雄激素受体(AR),Smad4,MDR1,Flt-3,BRCA-1,BRCA-2,Bcr-Abl,pax3-fkhr,ews-fli-1,Brachyury,HERV-H,HERV-K,TWIST,间皮素,NGEP,此类抗原和组织特异性抗原的修饰,此类抗原的剪接变体,和/或这样的抗原的表位激动剂。其他癌症抗原是本领域已知的。其它癌抗原也可以通过本领域已知的方法鉴定,分离和克隆,例如在美国专利号4,514,506中公开的那些。癌症抗原还可以包括一种或多种生长因子和每种的剪接变体。
在本发明的一个方面,有用于本发明的一种或多种免疫治疗组合物中的抗原包括与病原体相关,或与由病原体引起或与病原体相关的疾病或病症相关的任何抗原,包括但不限于感染性疾病。这样的抗原包括但不限于与病原体相关的任何抗原,包括病毒抗原,真菌抗原,细菌抗原,蠕虫抗原,寄生虫抗原,外寄生物抗原,原生动物抗原或来自任何其它传染原的抗原。
在一个方面,抗原来自病毒,包括但不限于腺病毒,沙粒病毒,布尼亚病毒(bunyaviruses),冠状病毒,柯萨奇病毒(coxsackie viruses),巨细胞病毒,埃巴病毒(Epstein-Barr viruses),黄病毒,嗜肝性DNA病毒(hepadnaviruses),肝炎病毒(例如HBV,HCV,HDV),疱疹病毒,流感病毒,慢病毒(例如HIV),麻疹病毒,腮腺炎病毒,粘液病毒,正粘病毒,乳头瘤病毒,乳多空病毒,副流感病毒,副粘病毒,细小病毒,小核糖核酸病毒,痘病毒,狂犬病病毒,呼吸道合胞病毒病毒,呼肠孤病毒,弹状病毒,风疹病毒,披膜病毒和水痘病毒。
在另一方面,抗原来自选自以下属的传染原:曲霉属,Bordatella,Brugia,假丝酵母属,衣原体属,球虫属,隐球菌属,恶丝虫属,埃希氏菌属,弗朗西斯氏菌属,淋球菌属,组织胞浆菌属,利什曼原虫属,分枝杆菌属,支原体属,草履虫属,百日咳,疟原虫属,肺炎球菌属,肺囊虫属,立克次体属(Rickettsia),沙门氏菌属,志贺氏菌属,葡萄球菌,链球菌属,弓形虫,霍乱弧菌(Vibriocholerae),和耶尔森菌属。
在一个方面,抗原来自选自以下科的细菌:肠杆菌科,微球菌科,弧菌科,巴斯德氏菌科,支原体科和立克次氏体科。在一个方面,细菌选自以下属:假单胞菌属,Bordatella,分枝杆菌属,弧菌属,芽孢杆菌属,沙门氏菌属,弗朗西斯氏菌属,葡萄球菌属,链球菌属,埃希氏菌属,肠球菌属,巴斯德氏菌属和耶尔森菌属。在一个方面,细菌来自选自以下的物种:铜绿假单胞菌,鼻疽假单胞菌,假鼻疽假单胞菌(Pseudomonas pseudomallei),百日咳博德特氏菌(Bordetella pertussis),结核分枝杆菌,麻风分枝杆菌,土拉弗朗西斯氏菌,霍乱弧菌,炭疽芽孢杆菌,肠道沙门氏菌,鼠疫耶尔森菌,大肠杆菌和支气管炎博德特氏菌(Bordetella bronchiseptica)。
一方面,抗原来自真菌,此类真菌包括但不限于来自酵母属(Saccharomyces spp.),曲霉属(Aspergillus spp.),隐球酵母属(Cryptococcus spp.),球孢子菌属(Coccidioides spp.),脉孢菌属(Neurospora spp.),组织胞浆菌属(Histoplasma spp.),或芽酵母属(Blastomyces spp.)。在一个方面,所述真菌来自选自以下的物种:烟曲霉,黄曲霉,黑曲霉,土曲霉,构巢曲霉(A.nidulans),粗球孢子菌(Coccidioides immitis),Coccidioides posadasii或新型隐球菌。
基于酵母的免疫治疗组合物。在本发明的各个实施方案中,本发明包括使用至少一种“基于酵母的免疫治疗组合物”(该短语可与“基于酵母的免疫治疗产品”,“基于酵母的免疫治疗组合物”,“基于酵母的组合物”,“基于酵母的免疫治疗剂”,“基于酵母的疫苗“或这些短语的衍生词替换使用)。“免疫治疗组合物”是在受试者中引起足以实现至少一种治疗益处的免疫应答的组合物。如本文所使用的,基于酵母的免疫治疗组合物是指包含酵母媒介物组分并在受试者中引发足以实现至少一种治疗益处的免疫应答的组合物。更具体地,基于酵母的免疫治疗组合物是包含酵母媒介物组分并且可以引发或诱导免疫应答,例如细胞免疫应答,包括但不限于T细胞介导的细胞免疫应答的组合物。在一个方面,在本发明中有用的基于酵母的免疫治疗组合物能够诱导CD8+和/或CD4+T细胞介导的免疫应答,且在一个方面,CD8+和CD4+T细胞介导的免疫应答。任选地,基于酵母的免疫治疗组合物能够引发体液免疫应答。
本发明的基于酵母的免疫治疗组合物可以是“预防性”或“治疗性”的。当预防性提供时,本发明的组合物在感染或疾病的任何症状之前提供。此类组合物可以在出生时,在儿童早期,或对成年人,特别是疾病或病症更高风险的成年人施用,所述疾病或病症适合使用免疫疗法。免疫治疗组合物的预防性施用用于防止随后的感染或疾病,如果感染或疾病随后发生则更快地或更完全地解决感染或疾病,和/或如果感染或疾病随后发生则改善感染或疾病的症状。当在治疗性提供时,在感染或疾病发作时或之后提供免疫治疗组合物,目的是改善感染或疾病的至少一种症状,并优选目的是消除感染或疾病,提供感染或疾病持久的缓解,和/或提供针对随后的感染或疾病的长期免疫。
通常,基于酵母的免疫治疗组合物包括酵母媒介物和由酵母媒介物表达,附着或与酵母媒介物混合的至少一种抗原或其免疫原性结构域,其中所述抗原对所述酵母是异源的,并且其中所述抗原包含一种或多种抗原或其免疫原性结构域。在一些实施方案中,抗原或其免疫原性结构域作为融合蛋白提供。在本发明的一个方面,融合蛋白可以包括两种或更多种抗原。在一个方面,融合蛋白可以包括一种或多种抗原的两个或多个免疫原性结构域,或一种或多种抗原的两个或多个表位。
在本发明中使用的任何基于酵母的免疫治疗组合物中,与酵母媒介相关的以下方面包括在本发明中。根据本发明,酵母媒介物是任意酵母细胞(例如,整个或完整细胞)或其衍生物(见下文),其可以与一种或多种抗原,其免疫原性结构域或其表位一起用于本发明的免疫治疗组合物中国,或在一个方面,酵母媒介物可以单独施用或作为佐剂。因此酵母媒介物可以包括,但不限于活的完整(整个)酵母微生物(即具有包括细胞壁在内的所有成分的酵母细胞)、被杀死(死的)或者灭活的完整酵母微生物,或者完整酵母的衍生物,包括:原生质球(即缺少细胞壁的酵母细胞)、酵母胞质体(即缺少细胞壁和细胞核的酵母细胞)、酵母空胞(即缺少细胞壁、细胞核和细胞质的酵母细胞)、亚细胞酵母膜提取物或其组分(又被称为酵母膜颗粒,以前被称为亚细胞酵母颗粒)、任何其他酵母颗粒或者酵母细胞壁制备物。
酵母原生质球通常是通过对酵母细胞壁进行酶解产生的。这类方法在例如Franzusoff等人,1991,Meth.Enzymol.194,662-674中有描述,该文献通过引用全部并入本文。
酵母胞质体通常是通过酵母细胞去核仁产生的。这类方法在例如Coon,1978,Natl.Cancer Inst.Monogr.48,45-55中有描述,该文献通过引用全部并入本文。
酵母空胞(ghosts)通常是通过将发生通透化或者裂解的细胞重新密封产生的,可以但不必须含有该细胞的至少部分细胞器。这类方法在例如Franzusoff等人,1983,J.Biol.Chem.258,3608-3614和Bussey等人,1979,Biochim.Biophys.Acta 553,185-196中有描述,每个文献都通过引用全部并入本文。
酵母膜颗粒(亚细胞酵母膜提取物或其组分)是指缺少天然细胞核或细胞质的酵母膜。颗粒可以是任何大小,大小的范围包括从天然酵母膜到通过超声处理或其他本领域技术人员已知的膜破碎方法产生的微颗粒,然后重新密封。产生亚细胞酵母膜提取物的方法在例如Franzusoff et al.,1991,Meth.Enzymol.194,662-674中有描述。还可以使用含有酵母膜部分的酵母膜颗粒组分,以及如果抗原或其他蛋白是在制备酵母膜颗粒之前由酵母重组表达的,可以使用抗原或其他目标蛋白。抗原或其他目标蛋白可以被运送到膜内,或者膜表面或者它们的组合(即,蛋白可以是膜内或者膜外的,和/或跨酵母膜颗粒的膜)。在一个实施方案中,酵母膜颗粒是重组酵母膜颗粒,所述重组酵母膜颗粒可以是完整的、破碎的或者破碎并重新密封的酵母膜,所述酵母膜包含位于膜表面或者至少部分镶嵌在膜内的至少一个所需抗原或其他感兴趣的蛋白。
酵母细胞壁制备物的一个例子是带有抗原的分离酵母细胞壁制品,所述抗原在细胞壁表面或者至少部分嵌在细胞壁内,这样将所述酵母细胞壁制备物给予动物时,会刺激抗疾病目标的所需免疫反应。
可以使用任何酵母株来产生用于本发明的酵母媒介物。酵母是单细胞微生物,属于以下三类之一:子囊菌纲、担子菌纲或半知菌纲。选择作为免疫调节剂的酵母的类型时一个考虑是酵母的病原性。在一个实施方案中,酵母是诸如酿酒酵母的非致病菌株。选择非致病酵母菌株最小化了带给被给予酵母媒介物的个体的任何不良效应。但是,如果酵母的致病性可以通过本领域技术人员已知的任何手段(例如突变菌株)抵消,则可以使用致病酵母。根据本发明的一个方面,使用的是非致病性酵母株。
可以用于本发明的酵母菌株的属包括,但不限于糖酵母属、假丝酵母属、隐球菌属、汉逊酵母属、克鲁维酵母属、毕赤酵母属、红酵母属、裂殖酵母属和耶氏酵母属。在一个方面中,酵母的属选自糖酵母属、假丝酵母属、汉逊酵母属、毕赤酵母属或裂殖酵母属;并且在一个方面中,使用了糖酵母属。可以用于本发明的酵母株的种包括,但不限于酿酒酵母、卡尔斯伯酵母(Saccharomyces carlsbergensis)、白色假丝酵母、克菲假丝酵母(Candida kefyr)、热带假丝酵母、罗伦特隐球菌(Cryptococcus laurentii)、新型隐球菌、异常汉逊酵母、多形汉逊酵母、脆壁克鲁维酵母、乳酸克鲁维酵母、马克思克鲁维酵母乳酸变种(kluyveromyces marxianus var.lactis)、巴斯德毕赤酵母、深红酵母(Rhodotorula rubra)、粟酒裂殖酵母和解脂耶氏酵母。应当理解,这些种中有许多包括多种亚种、型、亚型等,它们都是意图包括在以上提到的种中的。在一个方面中,用于发明的酵母种包括酿酒酵母、白色假丝酵母、多形汉逊酵母、巴斯德毕赤酵母和粟酒裂殖酵母。酿酒酵母很有用因为它相对容易操作,并且对于作为食品添加剂被“通常认为是安全的”或"GRAS"(GRAS,FDA proposed Rule 62FR18938,April 17,1997)。本发明的一个实施方案是能够将质粒复制到特别高拷贝数的酵母株,比如酿酒酵母cir°株。该酿酒酵母株是这样的菌株,所述菌株能够支持高水平表达一或多个目标抗原和/或抗原融合蛋白和/或其他蛋白的表达载体。可以用于本发明的另一个酵母株是酿酒酵母W303α。此外,本发明中可以使用任何突变酵母株,包括那些表现出对所表达的目标抗原或其他蛋白的翻译后修饰减少(例如延伸N端连接糖基化的酶发生突变)的菌株。
在本发明的大多数实施方案中,基于酵母的免疫治疗组合物包括至少一种抗原,其免疫原性结构域或其表位。考虑用于本发明的抗原包括以下抗原,针对其期望引起免疫应答,用于针对感染或疾病预防性或治疗性免疫宿主的目的。
在本发明的一个方面,操纵酵母媒介物,使得通过部分或全部地在酵母媒介物的表面上递送或转位表达的蛋白质产物(细胞外表达)来表达或提供抗原。实现本发明这一方面的一种方法是使用间隔臂(spacer arm)将一种或多种蛋白定位在酵母媒介物的表面上。例如,可以使用间隔臂来创建抗原或其它感兴趣的蛋白质与将所述抗原或其它蛋白靶向至酵母细胞壁的蛋白的融合蛋白。例如,可用于靶向其他蛋白的一种此类蛋白是能够使抗原或其它蛋白靶向至酵母细胞壁的酵母蛋白(例如,细胞壁蛋白2(cwp2),Aga2,Pir4或Flo1蛋白),使得所述抗原或其它蛋白质位于酵母的表面上。除酵母蛋白之外的蛋白可以用于间隔臂;然而,对于任何间隔臂蛋白,最希望使免疫原性应答针对靶抗原而不是所述间隔臂蛋白。因此,如果其它蛋白用于间隔臂,则所使用的间隔臂蛋白不应产生对所述间隔臂蛋白本身的大的免疫应答,使得对靶抗原的免疫应答被压倒。本领域技术人员应该以相对于靶抗原的免疫应答,对间隔臂蛋白的小的免疫应答为目标。可以构建间隔臂以具有切割位点(例如蛋白酶切割位点),如果需要,允许抗原容易地从酵母中除去或加工。可以使用测定免疫应答的量级的任何已知的方法(例如,抗体产生,裂解测定等),并且是本领域技术人员容易知道的。
用于将待暴露的靶抗原或其它蛋白定位于酵母表面上的另一种方法是使用信号序列,例如糖基磷脂酰肌醇(GPI)将靶标锚定到酵母细胞壁。或者,可通过附加信号序列来实现定位,所述信号系列将抗原或感兴趣的蛋白靶向到分泌途径中,经由转位进入内质网(ER)中使得所述抗原结合到与细胞壁结合的蛋白质(例如,cwp)。
在一个方面,间隔臂蛋白是酵母蛋白。酵母蛋白可以由酵母蛋白的约2至约800个氨基酸组成。在一个实施方案中,酵母蛋白为约10至700个氨基酸。在另一个实施方案中,酵母蛋白为约40至600个氨基酸。本发明的其它实施方案包括酵母蛋白质,其为至少250个氨基酸,至少300个氨基酸,至少350个氨基酸,至少400个氨基酸,至少450个氨基酸,至少500个氨基酸,至少550个氨基酸酸,至少600个氨基酸或至少650个氨基酸。在一个实施方案中,酵母蛋白的长度为至少450个氨基酸。如果需要,优化抗原的表面表达的另一个考虑是抗原和间隔臂的组合是否应当表达为单体或二聚体或三聚体,或甚至连接在一起更多单位。单体,二聚体,三聚体等的该使用允许抗原的适当间隔或折叠,使得一些部分(如果不是全部)抗原以使其更具免疫原性的方式展示在酵母媒介物的表面上。
酵母蛋白的使用可以稳定酵母媒介物中融合蛋白的表达,防止表达的融合蛋白的翻译后修饰,和/或将融合蛋白靶向酵母中的特定区室(例如,在酵母中表达酵母细胞表面)。为了递送到酵母分泌途径中,使用的示例性酵母蛋白包括但不限于:Aga(包括但不限于Aga1和/或Aga2);SUC2(酵母转化酶);α因子信号前导序列;CPY;Cwp2p用于其在细胞壁中的定位和保留;BUD基因用于在子细胞形成的初始阶段期间在酵母细胞芽处定位;Flo1p;Pir2p;和Pir4p。
其它序列可用于将蛋白靶向,保留和/或稳定于酵母媒介物的其它部分,例如在细胞质基质或线粒体或内质网或细胞核中。可以用于上述任何实施方案的合适的酵母蛋白的实例包括但不限于TK,AF,SEC7;磷酸烯醇丙酮酸羧激酶PCK1,磷酸甘油激酶PGK和磷酸丙糖异构酶TPI基因产物,用于它们在葡萄糖和胞质定位中的抑制表达;热休克蛋白SSA1,SSA3,SSA4,SSC1,在细胞暴露于热处理时其表达被诱导并且其蛋白更加热稳定;线粒体蛋白CYC1用于输入线粒体中;ACT1。
发明考虑了制备酵母媒介物和表达、组合和/或结合酵母媒介物与感兴趣的抗原和/或其他蛋白和/或试剂,从而产生基于酵母的免疫治疗组合物的方法。
根据本发明,术语“酵母媒介物-抗原复合体”或“酵母-抗原复合体”用于一般性描述酵母媒介物与抗原的任何结合,并且可以与“基于酵母的免疫治疗组合物”在所述组合物被用于如上所述引发免疫反应的情况下交换使用。这种结合包括由酵母(重组酵母)表达抗原、将抗原引入酵母、抗原与酵母的物理附着,和酵母与抗原在比如缓冲液或其他溶液或制剂中的混合。以下详细描述了这些类型的复合体。
在一个实施方案中,用于制备酵母媒介物的酵母细胞与编码蛋白(例如抗原)的异源核酸分子一起转染,从而由酵母细胞表达蛋白。这样的酵母在本文又被称为重组酵母或重组酵母媒介物。然后可以将酵母细胞与药学可接受的赋形剂成剂并直接给予患者、保持用于以后给药,或者装载到树突细胞中作为完整细胞。还可以将酵母细胞杀死,或者通过形成酵母原生质球、胞质、空胞或亚细胞颗粒进行衍生化,之后将上述衍生物中的任何一种保存、给药或者装载到树突细胞中。为了产生能够表达抗原或其他蛋白的重组原生质球,还可以直接用重组核酸分子转染酵母原生质球(例如,由整个酵母产生原生质球,然后转染)。能够重组表达抗原的酵母细胞或酵母原生质球可以用于制备包含酵母胞质、酵母空胞或酵母膜颗粒或酵母细胞壁颗粒或者它们的部分的酵母媒介物。
一般来说,酵母媒介物或抗原和/或其他药剂可以通过本文描述的任何技术进行结合。在一个方面中,用抗原和/或药剂胞内装载酵母媒介物。在另一个方面中,抗原和/或试剂共价地或者非共价地附着酵母媒介物。在再一个方面中,酵母媒介物和抗原和/或试剂通过混合来结合。另一个方面中,在一个实施方案中,抗原和/或试剂是由酵母媒介物或酵母细胞或者衍生酵母媒介物的酵母原生质球重组表达。
由本发明的酵母媒介物产生的抗原和/或其他蛋白的数量是可以通过酵母媒介物合理产生的任何抗原和/或其他蛋白数量,通常在至少一个到至少大约6个或更多个,包括大约2个到大约6个异源抗原和/或其他蛋白。
抗原或其他蛋白在本发明的酵母媒介物中的表达是利用本领域技术人员已知的技术实现的。简单来说,将编码至少一个所需抗原或其他蛋白的核酸分子插入表达载体,其方式使得核酸分子与转录调控序列可操纵地连接,从而在转化到宿主酵母细胞中时,能够影响核酸分子的组成性表达或调控表达。编码一或多个抗原和/或其他蛋白的核酸分子可以在一或多个表达载体上与一或多个表达调控序列可操纵地连接。特别重要的表达调控序列是那些控制转录起始的序列,比如启动子和上游激活序列。任何合适的酵母启动子都可以用于本发明,许多这样的启动子是本领域技术人员已知的。
用于酿酒酵母中表达的启动子包括,但不限于编码以下酵母蛋白的基因的启动子:乙醇脱氢酶I(ADH1)或II(ADH2)、CUP1、磷酸甘油酸激酶(PGK)、磷酸丙酮异构酶(TPI)、翻译延伸因子EF-1α(TEF2)、甘油醛-3-磷酸脱氢酶(GAPDH;又被称为TDH3,代表磷酸丙酮脱氢酶)、半乳糖激酶(GAL1)、半乳糖-1-磷酸尿苷酰转移酶(GAL7),UDP-半乳糖表异构酶(GAL10)、细胞色素c1(CYC1)、Sec7蛋白(SEC7)和酸性磷酸酶(PHO5),包括诸如ADH2/GAPDH和CYC1/GAL10启动子的杂合启动子,包括细胞内的葡萄糖浓度低(例如,大约百分之0.1到大约百分之0.2)时被诱导的ADH2/GAPDH启动子,以及CUP1启动子和TEF2启动子。同样的,多个上游激活序列(UASs),又被称为增强子是已知的。用于酿酒酵母表达的上游激活序列包括,但不限于编码以下蛋白的基因的UASs:PCK1、TPI、TDH3、CYC1、ADH1、ADH2、SUC2、GAL1、GAL7和GAL10,以及被GAL4基因产物活化的其他UASs,一个方面中使用的是ADH2 UAS。因为ADH2 UAS被ADR1基因产物所激活,当异源基因与ADH21 UAS可操纵地连接时,优选用ADH2 UAS来过表达ADR1基因。用于酿酒酵母表达的转录终止序列包括α因子、GAPDH或CYC1基因的终止序列。
用于在甲基营养型酵母中表达基因的转录调控序列包括编码乙醇氧化酶和甲酸脱氢酶的基因的转录调控区。
根据本发明,核酸分子转染酵母细胞可以通过任何核酸分子导入细胞的方法来实现,包括但不限于扩散、主动运输、浴超声处理、电穿孔、微量注射、脂质转染、吸附和原生质体融合。被转染的核酸分子可以利用本领域技术人员已知的技术整合到酵母染色体中或者维持在染色体外的载体中。带有这样的核酸分子的酵母媒介物的例子在文中有详细公开。正如以上讨论的,还可以通过用所需核酸分子转染完整的酵母微生物或酵母原生质球从而重组产生酵母胞质体、酵母空胞和酵母膜颗粒或者细胞壁制品,在其中产生抗原,然后利用本领域技术人员已知的技术进一步操纵微生物或原生质球,产生含有所需抗原或其他蛋白的胞质、空胞或亚细胞酵母膜提取物或其部分。
产生重组酵母媒介物并由酵母媒介物表达抗原和/或其他蛋白的有效条件包括可以培养酵母菌株的有效培养基。有效培养基通常是包含可同化的碳水化合物、氮和磷源,以及合适的盐、矿物质、金属和其他营养(比如维生素和生长因子)的水样培养基。培养基可以包含复杂营养或者是限定的基础培养基。本发明的酵母株可以培养在多种容器内,包括但不限于生物反应器、锥形瓶、试管、微量滴定板和培养皿。培养在适合酵母菌株的温度、pH和氧气含量下进行。这些培养条件是本领域技术人员的专业知识范围内的(参见例如,Guthrie et al.(eds.),1991,Methods in Enzymology,vol.194,Academic Press,San Diego)。
在本发明的一些实施方案中,酵母在中性pH条件下生长。如本文所使用的,术语“中性pH”的一般用法是指pH范围在约pH 5.5和约pH 8之间,且在一个方面,在约pH 6和约8之间(在PCT公开号WO 2008/097863中详细描述)。
在一个实施方案中,控制酵母糖基化的量用于控制酵母的抗原表达,特别是在表面上。酵母糖基化的量可影响表面上表达的抗原的免疫原性和抗原性,因为糖部分倾向于体积大。因此,在根据本发明的酵母的调控中应考虑酵母表面上糖部分的存在及其对靶抗原周围的三维空间的影响。可以使用任何方法来减少酵母糖基化的量(或如果需要,增加它)。例如,可以使用已经选择具有低糖基化的酵母突变株(例如mnn1,och1和mnn9突变体),或者可以通过突变靶抗原上的糖基化受体序列来消除。或者,可以使用具有缩短的糖基化模式的酵母,例如毕赤酵母。还可以使用减少或改变糖基化的方法处理酵母。
在本发明的一个实施方案中,作为在酵母媒介物中重组表达抗原或其它蛋白的替代方案,酵母媒介物在细胞内加载蛋白或肽,或碳水化合物或其他分子,其作为抗原和/或可用作根据本发明的免疫调节剂或生物反应调节剂。随后,可以将细胞内含有抗原和/或其他蛋白的酵母媒介施用于个体或转载至载体如树突状细胞中。可以通过本领域技术人员已知的技术,例如通过扩散,主动转运,脂质体融合,电穿孔,吞噬作用,冻融循环和浴超声处理,将肽和蛋白直接插入本发明的酵母媒介物中。可以直接加载肽,蛋白,碳水化合物或其他分子的酵母载体包括完整酵母,以及原生质球,空胞或胞质体,其可以在产生后加载抗原和其他试剂。或者,完整酵母可以加载抗原和/或试剂,然后可由其制备原生质球,空胞,胞质体或亚细胞颗粒。在该实施方案中,可以将任何数量的抗原和/或其它试剂装载到酵母媒介物中,从至少1,2,3,4或直到数百或数千的任何整数的抗原和/或其它试剂,例如,通过例如加载微生物或其部分来提供。
在本发明的另一个实施方案中,抗原和/或其他试剂物理附着于酵母媒介物。抗原和/或其他试剂与酵母媒介物的物理附着可以通过本领域的任何合适方法来实现,包括共价和非共价结合方法,包括但不限于将抗原和/或其他试剂化学交联到酵母媒介物的外表面;或者比如通过利用抗体或其他结合伙伴,将抗原和/或其他试剂生物连接到酵母媒介物的外表面。化学交联的实现可以通过例如包括戊二醛连接、光亲和标记的方法、用二亚胺碳进行处理、用能够连接二硫键的化学物质进行处理,以及用其他本领域标准的交联化学剂进行处理。替代地,可以将化学剂与酵母媒介物进行接触,所述化学剂会改变酵母细胞膜脂双层的电荷或细胞壁的成分,从而使酵母外表面更可能与具有特定电荷特性的抗原和/或其他试剂发生融合或结合。还可以将诸如抗体、结合肽、可溶性受体和其他配体的靶向试剂并入抗原作为融合蛋白,或者以其他方式与抗原关联从而使抗原结合酵母媒介物。
在再一个实施方案中,酵母媒介物和抗原或其他蛋白通过更被动、非特异性的或者非共价的结合机制相互结合,比如通过将酵母媒介物与抗原或其他蛋白在缓冲液或其他合适的制剂(例如混合液)中轻轻混合。
在本发明的一个实施方案中,酵母媒介物和抗原或其它蛋白都在细胞内加载到载体如树突状细胞或巨噬细胞中以形成本发明的治疗组合物或疫苗。或者,可以在不存在酵母媒介物的情况下将抗原或其他蛋白质装载到树突状细胞中。
在一个实施方案中,可以将(有或没有异源抗原或其他蛋白表达的)完整酵母以能够产生酵母细胞壁制品、酵母膜颗粒或酵母片段(即不是完整的)的方式磨碎或加工,在一些实施方案中,可以将酵母片段与包含抗原的其他组合物(例如DNA疫苗、蛋白亚基疫苗、杀死或灭活的病原体、病毒载体疫苗)一起提供或给予从而加强免疫反应。例如,可以利用酶处理、化学处理或物理力(例如,机械剪切或超声处理)将酵母破碎成可以作为佐剂的部分。
在发明的一个实施方案中,可用于发明的酵母媒介物包括已经被杀死或灭活的酵母媒介物。杀死或灭活酵母可以通过本领域已知的多种合适方法中的任何一种来完成。例如,酵母热灭活是灭活酵母的一种标准途径,如果需要,本领域技术人员可以通过本领域已知的常规方法来监测目标抗原的结构变化。替代地,可以使用其他酵母灭活方法,比如化学、电学、放射性或UV方法。参见例如标准酵母培养参考书,比如Methods of Enzymology,Vol.194,Cold Spring Harbor Publishing(1990)中公开的方法。任何使用的灭活策略都应当考虑到目标抗原的二级、三级或四级结构,并且保存这些结构以便优化抗原的免疫原性
可以使用本领域技术人员已知的多种技术将酵母媒介物配制成本发明的基于酵母的免疫治疗组合物或产品,包括直接向受试者施用得到制剂,或或首先装载到载体如树突细胞中。例如,可以通过冻干对酵母媒介物进行干燥。包含酵母媒介物的制剂还可以通过将酵母制成饼或片剂,比如象用于烘培或酿造工艺中的酵母。此外,可以将酵母媒介物与药学上可接受的赋形剂混合,比如宿主或宿主细胞能够耐受的等渗缓冲液。这类赋形剂的例子包括水、盐水、林格溶液、葡萄糖溶液、Hank's溶液,和其他水性生理平衡盐溶液。还可以使用非水性的媒介物,比如固定油类、芝麻油、油酸乙酯或甘油三酯。其他有用的制剂包括含有增稠剂(比如羧甲基纤维素钠、山梨醇、甘油或葡聚糖)的悬浮液。赋形剂还可以含有微量的添加剂,比如能增强等渗性和化学稳定性的物质。缓冲液的例子包括磷酸缓冲液、碳酸氢盐缓冲液和Tris缓冲液,防腐剂的例子包括噻汞撒(thimerosal)、m-或o-甲苯酚、福尔马林和苯甲醇。标准的制剂可以是液态注射剂,或者能够加入合适液体成为用于注射的悬浮液或溶液的固体。因此,在非液体制剂中,赋形剂可以包含例如葡萄糖、人血清白蛋白和/或防腐剂,然后在施用前可以加入无菌水或盐水。
在本发明的一个实施方案中,组合物可以包含其他试剂,这些试剂也可以被称为生物反应调节剂化合物,或者产生这些试剂/改造剂的能力。例如,可以用至少一种抗原和至少一种抗原/生物反应调节剂化合物转染或装载酵母媒介物,或者可以将本发明的组合物与至少一种试剂/生物反应调节剂一起给予。生物反应调节剂包括能调节免疫应答的佐剂和其他化合物,它们可以被称为免疫调节性化合物;还包括能改造另一种化合物或试剂的生物活性的化合物,比如基于酵母的免疫治疗剂,所述生物活性不限于免疫系统的效应。某些免疫调节化合物能刺激保护性免疫反应,而其它的能抑制有害的免疫反应,免疫调节与给定基于酵母的免疫治疗剂的组合是否有用可能至少部分取决于要治疗或防止的疾病状态或状况,和/或待治疗的个体。某些生物反应调节剂优先增强细胞介导型免疫反应,而其它的优先增强体液免疫反应(即,刺激的免疫反应中,与体液免疫相比,细胞介导的免疫反应水平提高,或者反过来)。某些生物反应调节剂与基于酵母的免疫治疗剂有一或多个共同的特性,或者对基于酵母的免疫治疗剂的生物特性能够增强或互补。本领域技术人员知道多种测量免疫反应的激发或抑制的方法,以及区分细胞介导的免疫反应和体液介导的免疫反应的方法,和区分一类细胞介导的反应与另一类反应(例如,TH17反应相对TH1反应)。
可用于发明的试剂/生物反应调节剂可以包括,但不限于细胞因子、趋化因子、激素、脂类衍生物、肽、蛋白、多糖、小分子药物、抗体及其抗原结合片段(包括,但不限于抗细胞因子抗体、抗细胞因子受体抗体、抗趋化因子抗体)、维生素、多核苷酸、核酸结合部分、适配体和生长调节剂。本发明涵盖此类试剂的任何组合,并且与基于酵母的免疫治疗剂组合或在方案中与基于酵母的免疫治疗剂一起施用(例如同时,序贯或以其它形式)的任何此类试剂是本发明涵盖的组合物。这类试剂是本领域公知的。这些试剂可以单独使用或者与文中描述的其他试剂组合使用。
试剂可以包括给定蛋白或肽或其结构域的激动剂和拮抗剂。用于本文,“激动剂”是能够与受体或配体结合并产生或引发反应的任何化合物或试剂,包括但不限于小分子、蛋白、肽、抗体、核酸结合剂等,其中可能包括那些模拟天然物质结合受体或配体的作用的试剂。“拮抗剂”是能够阻断或抑制或减少激动剂的作用的任何化合物或试剂,包括但不限于小分子、蛋白、肽、抗体、核酸结合剂等。
本发明的组合物还可以包括以下项,或可以与以下项一同施用(同时,顺序地或间歇地):有用于预防或治疗感染,疾病或病症的任何其它化合物或组合物,或治疗或改善感染,疾病或病症的任何症状的任意化合物。
本发明还包括试剂盒,其包含本文所述的任何组合物或本文所述组合物的任何单独组分。
本发明组合物的施用或使用方法
本发明的一个实施方案涉及使用基于酵母的免疫疗法治疗受试者的方法,其包括对预选择为对T1IFN敏感的受试者施用基于酵母的免疫治疗组合物。本发明的另一个实施方案涉及使用基于酵母的免疫疗法治疗受试者的方法,包括以下步骤:(a)预选择对T1IFN敏感的受试者;和(b)向受试者施用基于酵母的免疫疗法。本发明的另一个实施方案涉及使用基于酵母的免疫疗法治疗癌症或由病原体引起的疾病(其可以包括传染性疾病)的方法。所述方法包括向患有癌症或由病原体引起的疾病的受试者施用基于酵母的免疫治疗组合物,所述受试者的一种或多种T1IFN调节的生物标记物的水平由于使来自所述受试者的T1IFN-未处理外周血单核细胞(PBMC)与T1IFN离体或体外接触而显著地,实质上,可检测地或可测量地改变。
在一个方面,与暴露前(基线)相比,暴露于T1IFN后一种或多种T1IFN调节的生物标志物的水平改变至少3倍,或至少4倍,或至少5倍,或至少6倍,或至少7倍,或至少8倍,或至少9倍,或至少10倍,或至少11倍,或至少12倍,或至少13倍,或至少14倍,或至少15倍,或至少16倍,或至少17倍,或至少18倍,或至少19倍,或至少20倍,或至少25倍,或至少30倍,或至少40倍,或至少50倍。在一个方面,暴露后与暴露于T1IFN之前相比的响应水平的比率为至少3,至少4,至少5,至少6,至少7,至少8,至少9,至少10,至少11,至少12,至少13,至少14,至少15,至少16,至少17,至少18,至少19,至少20,至少25,至少30,至少40,或至少50。在一个方面,与暴露前(基线)相比,在暴露于T1IFN后一种或多种T1IFN调节的生物标志物的水平改变至少50%,至少75%,至少100%,至少125%,至少150%,至少175%,至少200%,至少225%,至少250%,至少275%,至少300%,至少400%,至少500%,至少600%,至少700%。在一个方面,与暴露前(基线)相比,在暴露于T1IFN后,T1IFN生物标志物水平的变化是统计学显著的,如通过高于中值的至少2个标准误差,高于中值的至少3个标准误差,至少4个标准误差高于中值,或高于中值的至少5个标准误差所确定的。在另一方面,与暴露前(基线)相比,在暴露于T1IFN后,一种或多种T1IFN调节的生物标志物的水平变化是统计学显著的,如通过p值为p=0.05,p=0.02,p=0.01,p=0.005,p=0.002或p=0.001所确定的。
在涉及使用基于酵母的免疫疗法治疗受试者的方法的本发明的实施方案中,预选择或分析受试者(个体)对T1IFN敏感的方法可以根据以下任何方法进行:测量本文所述的T1IFN敏感性(或T1IFN不敏感性)。此类方法在上文中详细描述,并且也在实施例中举例说明。
有用于本发明的组合物,其可以包括本文所述的任何一种或多种(例如,两种,三种,四种,五种或更多种)基于酵母的免疫治疗组合物,可用于多种体内和体外方法,包括但不限于治疗和/或预防感染,疾病或病症和/或其后遗症。
如本文所使用的,短语“治疗”感染,疾病或病症或其任何排列(例如,“感染治疗(treated for infection)”等)通常是指一旦感染,疾病或病症(急性或慢性)发生,应用或施用本发明的组合物,目的是减少或消除个体中的感染,疾病或病症所引起的至少一种症状,延迟或预防症状的发作和/或严重性和/或由感染,疾病或病症引起的下游后遗症,由感染,疾病或病症引起的器官或生理系统损伤的减轻,针对感染,疾病或病症的免疫应答的改善,针对感染,疾病或病症的长期记忆免疫应答的改善,和/或个体或个体群体的改善的一般健康。
为了“预防”感染,疾病或病症或其任何排列(例如,“感染的预防”等),通常是指在感染,疾病或病症发生之前,应用或施用本发明的组合物,目的是预防感染,疾病或病症,或,如果感染,疾病或病症后来发生,至少降低感染,疾病或病症的严重性和/或长度和/或由感染,疾病或病症引起的生理损伤,包括预防或降低个体中由感染,疾病或病症引起的至少一种症状的严重性或发生率,和/或延迟或预防个体或个体群体中由感染,疾病或病症引起的症状和/或下游后遗症的发作和/或严重性。
本发明包括向受试者递送(施用,免疫)本发明的一种或多种免疫治疗组合物,包括基于酵母的免疫治疗组合物。施用过程可以在离体或体内进行,但通常在体内进行。离体施用是指在患者外部进行部分调节步骤,例如将本发明的组合物施用于在如下条件从患者中移除的细胞群体(树突状细胞),使得酵母媒介物,抗原,和任何其它试剂或组合物装载到细胞中,并将细胞返回患者。本发明的治疗组合物可以通过任何合适的施用方式返回给患者或施用至患者。
组合物的施用可以是系统性的、粘膜的和/或靶位点位置附近的(例如,感染部位附近)。合适的施用途径对本领域技术人员而言是显而易见的,取决于待预防或治疗的病症的类型,施用的抗原,和/或靶细胞群体或组织。各种可接受的施用方法包括,但不限于静脉内施用、腹膜内施用、肌肉内施用、结内施用、冠状动脉内施用、动脉内施用(例如到颈动脉中)、皮下施用、经皮递送、气管内施用、关节内施用、脑室内(intraventricular)施用、吸入(例如气溶胶)、颅内、脊柱内、眼内、耳、鼻内、口服、肺施用、导管浸渍(impregnation)及直接注射入组织。在一个方面中,施用途径包括:静脉内、腹膜内、皮下、皮内、结内、肌肉内、经皮、吸入、鼻内、口服、眼内、关节内、颅内和脊柱内。胃肠外递送可包括皮内、肌肉内、腹膜内、胸膜内、肺内、静脉内、皮下、心房导管和静脉导管途径。耳递送可包括滴耳剂,鼻内递送可包括滴鼻剂或鼻内注射,眼内递送可包括滴眼剂。也可以利用本领域的标准方法进行气溶胶(吸入)递送(参见例如Stribling等人,Proc.Natl.Acad.Sci.USA189:11277-11281,1992)进行。调节粘膜免疫的其它施用途径在病毒感染的治疗中可以是有用的。此类途径包括,支气管,皮内,肌内,鼻内,其它吸入,直肠,皮下,局部,经皮,阴道和尿道途径。在一个方面中,皮下施用本发明的基于酵母的免疫治疗性组合物。
关于本发明的基于酵母的免疫治疗组合物,一般来说,合适的单剂量是在合适的时间段内施用一次或多次时,能够有效地向给定的细胞类型,组织,或患者身体的区域提供有效量的酵母媒介物和抗原(如果包括的话),以引发针对一种或多种靶抗原或表位的免疫应答。例如,在一个实施方案中,本发明的酵母媒介物的单剂量是施用组合物的生物体的每千克体重的约1x105至约5x107个酵母细胞等同物。在一个方面中,本发明的酵母媒介物的单剂量是每剂量(即每个生物体)约0.1Y.U.至约100Y.U.,包括任何中间剂量,增量为0.1x106个细胞(即1.1x106,1.2x106,1.3x106...)。在一个实施方案中,剂量包括1Y.U-40Y.U.的剂量、1Y.U.-50Y.U.的剂量、1Y.U.-60Y.U.的剂量、1Y.U.-70Y.U.的剂量、或1Y.U.-80Y.U.的剂量,并且在一个方面中,10Y.U.-40Y.U.、50Y.U.、60Y.U.、70Y.U.或80Y.U.的剂量。在一个实施方案中,在个体上的不同部位但是在相同给药期期间施用剂量。例如,可以通过在一个给药期期间对个体上的四个不同部位注射10Y.U.剂量来施用40Y.U.剂量,或者可以在相同给药期期间通过对个体上的四个不同部位注射5Y.U.剂量,或者通过在个体上的两个不同部位注射10Y.U.剂量来施用20Y.U.剂量。本发明包括在个体上的1,2,3,4,5,6,7,8,9,10或更多个部位施用一定量的基于酵母的免疫疗法组合物(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20Y.U.或更多)以形成单剂量。
例如当针对抗原的免疫应答已经减弱或根据需要提供免疫应答或诱导针对特定抗原或抗原的记忆应答时,施用治疗组合物的“增强剂(booster)”或“增强剂(boost)”。可以在最初施用后每月,每两个月,每季,每年,至几年施用增强剂。在一个实施方案中,施用方案是其中在从数周,数月,或数年的时间段中,施用每kg生物体重约1x105至约5x107酵母细胞等同物的组合物至少1,2,3,4,5,6,7,8,9,10或更多次。在一个实施方案中,每周施用剂量,持续1,2,3,4,5,6,7,8,9,10或更多剂量,然后根据需要每月剂量以实现期望的治疗或预防效果。在一个实施方案中,以4周一次的方案(每4周,或在第1天,第4周,第8周,第12周等,持续2至10个剂量或更长时间,由临床医师确定)施用剂量。
关于本文所述的基于酵母的免疫治疗组合物施用,可将单一组合物或此类组合物的组施用于个体或个体群体或此类组合物的组合。因而,可以在“香料架(spice rack)”方法中选择两种或更多种组合物以最有效地预防或治疗给定个体或个体群体中的感染,疾病或病症。
在本发明的一个方面,一种或多种另外的治疗剂与基于酵母的免疫治疗组合物贯序施用。在另一个实施方案中,在施用基于酵母的免疫治疗组合物之前施用一种或多种另外的治疗剂。在另一个实施方案中,在施用基于酵母的免疫治疗组合物之后施用一种或多种另外的治疗剂。在一个实施方案中,一种或多种另外的治疗剂以与基于酵母的免疫治疗组合物交替剂量施用,或在方案中,其中基于酵母的组合物以规定的间隔施用,在一种或多种另外的试剂的连续剂量之间,或随着一种或多种另外的试剂的连续剂量,或反之亦然。在一个实施方案中,在开始施用另外的试剂之前,在一段时间内以一个或多个剂量施用基于酵母的免疫治疗组合物。换句话说,将基于酵母的免疫治疗组合物作为单一疗法施用一段时间,然后添加药剂施用,其与基于酵母的免疫疗法的新剂量同时,或以与基于酵母的免疫疗法交替的方式。或者,可以在开始施用基于酵母的免疫治疗组合物之前施用试剂一段时间。在一个方面,酵母被工程化以表达或携带试剂,或不同的酵母被工程化或产生以表达或携带试剂。
与根据本发明的基于酵母的免疫治疗组合物组合特别有用的试剂/生物反应调节剂包括但不限于:STING激动剂,STING拮抗剂,抗T1IFN抗体,抗CD40抗体,CD40L,淋巴细胞活化基因3(LAG3)蛋白和/或IMP321(来自LAG3的可溶形式的T细胞免疫刺激因子);T细胞共刺激剂(例如,抗CD137,抗CD28,抗CD40抗体);阿仑珠单抗(alemtuzumab)(例如),地尼白介素(例如);抗CD4抗体;抗CD25抗体;免疫检查点抑制剂(例如,“免疫检查点(immune checkpoints)”的抑制剂,其是维持自身耐受并调节生理性免疫应答的持续时间和幅度的免疫系统的抑制途径,此类免疫检查点抑制剂包括但不限于:抗CTLA-4抗体例如ipilimumab(Bristol-Myers Squibb,Princeton,NJ)或tremelimumab(MedImmune/AstraZeneca,Wilmington,DE),程序性细胞死亡蛋白1(PD-1),程序性细胞死亡蛋白1配体(PD-L1),程序性细胞死亡蛋白2配体(PD-L2,例如称为AMP-224(Amplimmune,Gaithersburg,MD/GlaxoSmithKline,Philadelphia,PA)的PD-L2融合蛋白),抗PD-1抗体(例如nivolumab(Bristol-Myers Squibb),pembrolizumanb(Merck,Whitehouse Station,NJ)或pidilizumab(CureTech,Yavne,Israel)),抗PD-L1抗体(例如MPDL3280A(Genentech,South San Francisco,CA),MEDI4736(MedImmune/AstraZeneca),BMS-936559(Bristol-Myers Squibb),MSB0010718C(EMD Serono,Rockland,MD)),或者抗PD-L2抗体);吲哚胺2,3-双加氧酶(IDO)抑制剂(例如INCB24360);阻断FOXP3的试剂(例如,消除活性/杀死CD4+/CD25+Treg细胞);Flt3配体,咪喹莫特(AldaraTM),TLR激动剂,包括但不限于TLR-2激动剂,TLR-4激动剂,TLR-7激动剂和TLR-9激动剂;TLR拮抗剂,包括但不限于TLR-2拮抗剂,TLR-4拮抗剂,TLR-7拮抗剂和TLR-9拮抗剂;抗炎剂和免疫调节剂,包括但不限于COX-2抑制剂(例如塞来昔布,NSAIDS),糖皮质激素,他汀类药物,和沙利度胺(thalidomide)及其类似物,包括(其是沙利度胺的结构和功能类似物(例如(lenalidomide),(Pomalidomide))和调节抗原呈递细胞或Th17,Th1和/或Treg细胞的数量,调节其活化状态和/或调节其存活的任意试剂。本发明考虑此类试剂的组合,和与基于酵母的苗裔治疗剂组合,或在方案中预期一同施用(例如,同时地,贯序地或以其它形式)的任何这些试剂是本发明所涵盖的组合物。此类试剂是本领域中熟知的。这些试剂可以单独或与本文所述的其它试剂组合使用。另外,一种或多种疗法可以在基于酵母的免疫治疗组合物的第一剂量之前或在第一剂施用之后施用或进行。
在本发明的方面中,免疫治疗组合物和其它试剂可以一起(同时)施用。如本文所使用的,同时使用不一定意味着所有化合物的所有剂量在同一天同一时间施用。而是,同时使用是指每个治疗组分(例如免疫疗法和抗病毒疗法)在大约相同的时期开始(彼此在数小时内,或长达1-7天之内),并且在相同的一般时间段施用,注意每种组分可以具有不同的给药方案(例如,每月的免疫疗法,每天的抗病毒)。此外,在同时施用时期之前或之后,可以在没有其它试剂的情况下施用任一种试剂或免疫治疗组合物。
在本发明的方法中,可以对任何动物施用组合物和治疗性组合物,包括任何脊椎动物,特别是脊椎动物纲、哺乳纲的任何成员,包括但不限于灵长类、啮齿动物、家畜和家庭宠物。家畜包括被食用或能产生有用产品的哺乳动物(例如,用于生产羊毛的绵羊)。治疗或保护的哺乳动物包括人、犬、猫、小鼠、大鼠、山羊、绵羊、牛、马和猪。
“个体”是脊椎动物,例如哺乳动物,包括但不限于人。哺乳动物包括,但不限于农场动物、体育运动动物、宠物、灵长类、小鼠和大鼠。术语“个体”可以与术语“动物”,“受试者”或“患者”互换使用。
本发明中有用的一般技术
本发明的实施会应用,除非另有说明,到本领域技术人员熟知的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学、核酸化学和免疫学的常规技术。这类技术在文献中有充分解释,比如Methods of Enzymology,Vol.194,Guthrie等人,eds.,Cold Spring Harbor Laboratory Press(1990);Biology and activities of yeasts,Skinner等人,eds.,Academic Press(1980);Methods in yeast genetics:a laboratory course manual,Rose等人,Cold Spring Harbor Laboratory Press(1990);The Yeast Saccharomyces:Cell Cycle and Cell Biology,Pringle等人,eds.,Cold Spring Harbor Laboratory Press(1997);The Yeast Saccharomyces:Gene Expression,Jones等人,eds.,Cold Spring Harbor Laboratory Press(1993);The Yeast Saccharomyces:Genome Dynamics,Protein Synthesis,and Energetics,Broach等人,eds.,Cold Spring Harbor Laboratory Press(1992);Molecular Cloning:A Laboratory Manual,second edition(Sambrook等人,1989)和Molecular Cloning:A Laboratory Manual,third edition(Sambrook and Russel,2001)(文中统称为“Sambrook”);Current Protocols in Molecular Biology(F.M.Ausubel等人,eds.,1987,包括至2001年的补充材料);PCR:The Polymerase Chain Reaction,(Mullis等人,eds.,1994);Harlow and Lane(1988),Antibodies,A Laboratory Manual,Cold Spring Harbor Publications,New York;Harlow and Lane(1999)Using Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY(文中统称为“Harlow and Lane”);Beaucage等人,eds.,Current Protocols in Nucleic Acid Chemistry,John Wiley&Sons,Inc.,New York,2000);Casarett and Doull’s Toxicology The Basic Science of Poisons,C.Klaassen,ed.,6th edition(2001)以及Vaccines,S.Plotkin and W.Orenstein,eds.,3rd edition(1999)。
一般定义
(GlobeImmune,Inc.,Louisville,Colorado)通常是指胞外(在其表面上)、胞内(内部或者胞质)或者既有胞外也有胞内地表达一种或多种异源抗原的酵母媒介物。产品已有概括描述(参见例如美国专利号5,830,463)。某些基于酵母的免疫治疗组合物以及它们的制备方法和一般使用方法也有详细描述,例如美国专利号5,830,463、美国专利号7,083,787、美国专利号7,736,642、Stubbs等人,Nat.Med.7:625-629(2001)、Lu等人,Cancer Research 64:5084-5088(2004)和Bernstein等人,Vaccine 2008Jan 24;26(4):509-21,其每一个通过提述以其整体并入本文。
本文所使用的术语“类似物”是指在结构上类似于另一种化合物但在组成上略有不同的化合物(如一个原子被不同元素的原子替换,或在特定官能团存在下,或一个官能团被另一个官能团替换)。因此,类似物是在功能和外观上相似或相当,但相对于参考化合物具有不同结构或来源的化合物。
当用于描述化合物时,术语“取代的”,“取代的衍生物”和“衍生物”是指与未取代的化合物结合的至少一个氢被不同的原子或化学部分取代。
尽管衍生物具有与亲本化合物相似的物理结构,所述衍生物可具有与亲本化合物不同的化学和/或生物学特性。此类特性可以包括但不限于亲本化合物的增加的或降低的活性,与亲本化合物相比的新活性,增强或降低的生物利用度,增强或降低的效力,增强或降低的体外和/或体内稳定性,和/或增强或降低的吸收特性。
一般来说,术语“生物活性的”表明化合物(包括蛋白或肽)具有至少一种对细胞或生物体的代谢或其他过程有影响的可检测活性,如在体内(即在天然生理环境中)或体外(即在实验室条件下)测量或观察的。
根据本发明,术语“调控(modulate)”可以与调节(regulate)胶体使用,通常是指对特定活性的上调或下调。如本文所使用的,术语“上调”可以一般性地描述以下任意项:相对于特定活性来说的引发、启动、增加、增多、加强、改进、增强、放大、促进或提供。类似地,术语“下调”可以一般性地描述以下任意项:相对于特定活性来说的减少、降低、抑制、减轻、消除、减小(lessening)、阻断或防止。
在本发明的一个实施方案中,本文描述的任意氨基酸序列可以产生为在特定的氨基酸序列的C和/或N端各自侧接了至少一个到。且多至约20个额外的异源氨基酸。所得的蛋白或多肽可以被称为“基本上由(所述特定氨基酸序列)组成”。根据本发明,异源氨基酸是氨基酸序列,其不是天然(即自然界、体内不存在)侧接特定的氨基酸序列,或者不与特定的氨基酸序列的功能相关;或者如果使用给定氨基酸序列所来源的生物的标准密码子对天然序列中的核苷酸进行翻译,其不由编码所述特定氨基酸序列的基因中的天然核酸序列的侧接核苷酸编码。类似地,短语“基本由…构成”在关于本文的核酸序列使用时是指编码特定氨基酸序列的核酸序列,在编码所述特定氨基酸序列的核酸序列的5’和/或3’端可以各自侧接从至少一个到最多大约60个另外的异源核苷酸。异源核苷酸不象在天然基因中那样天然地侧接编码特定氨基酸序列的核酸序列(即自然界、体内不存在),或者不编码能够给具有特定氨基酸序列的蛋白带来任何另外的功能或者改变所述蛋白功能的蛋白。
根据本发明,短语“选择性结合”是指本发明的抗体、抗原结合片段或结合伴侣优先结合特定蛋白的能力。更具体地说,短语“选择性结合”是指一个蛋白与另一个的特异性结合(例如,对抗原的抗体、其片段或结合伴侣),其中通过任何标准测定(例如免疫学测定)测量到它们的结合水平比测定中的背景对照在统计学上显著更高。例如,在进行免疫学分析时,对照一般包括只含有抗体或抗原结合片段的反应孔/管(即没有抗原),其中在没有抗原情况下,抗体或其抗原结合片段产生的反应量(例如,与孔的非特异性结合)被认为是背景。结合可以利用本领域的多种标准方法,包括酶免疫分析(例如ELISA、免疫印迹分析等)来测量。
对本发明中使用的蛋白或多肽的提及包括全长蛋白、融合蛋白,或此类蛋白的任何片段、结构域(结构的、功能的或者免疫原性的)、构象表位,或同源物,包括蛋白的功能结构域和免疫结构域。更具体的,根据本发明,分离的蛋白,是是已经被从其自然环境移出(即已经经过人的操作)的蛋白(包括多肽或肽),并且可以包括例如纯化蛋白、部分纯化的蛋白、重组产生的蛋白和合成产生的蛋白。因此“分离的”不反映蛋白的纯化程度。优选地,本发明的分离的蛋白是重组产生的。根据本发明,术语“修饰”和“突变”可以替换使用,特别是就对本文描述的蛋白或其部分的氨基酸序列(或核酸序列)进行的修饰/突变来说。
如本文所使用的,术语“同源物”用来指蛋白或肽,其由于对天然发生的蛋白或肽的次要修饰而不同于天然发生的蛋白或肽(即“原型”或“野生型”蛋白),但维持了天然发生形式的基本蛋白和侧链结构。此类变化包括,但不限于,一个或数个氨基酸侧链的变化;一个或数个氨基酸的变化,包括缺失(例如,蛋白或肽的截短版本)、插入和/或取代;一个或数个原子的立体化学的变化;和/或次要的衍生化,包括但不限于甲基化、糖基化、磷酸化、乙酰化、肉豆蔻酰化、异戊二烯化、棕榈酰化、酰胺化和/或糖基磷脂酰肌醇的添加。同源物与参照蛋白或肽相比可具有加强的、降低的,或基本相似的性能。同源物可以包括蛋白质的激动剂或蛋白质的拮抗剂。同源物可以用本领域已知的制备蛋白的方法来制备,包括,但不限于直接对分离的,天然发生的蛋白进行修饰、直接蛋白蛋白,或者使用例如经典或重组DNA技术对编码该蛋白的核酸序列进行修饰以产生随机或定向突变。
给定蛋白的同源物可以包含以下氨基酸序列、基本由其组成,或者由其组成,所述氨基酸序列与参照蛋白的氨基酸序列至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%相同、或至少约92%相同、或至少约93%相同、或至少约94%相同、或至少约95%相同、或至少约96%相同、或至少约97%相同、或至少约98%相同、或至少约99%相同(或者45%和99%之间的按整数增加的任何百分比同一性)。在一个实施方案中,同源物包含以下氨基酸序列、基本由其组成,或者由其组成,所述氨基酸序列与参照蛋白的天然发生的氨基酸序列小于100%相同、小于约99%相同、小于约98%相同、小于约97%相同、小于约96%相同、小于约95%相同等等,按1%递减,至小于约70%相同。
同源物可以包括“接近全长”的蛋白质或蛋白的结构域,这意味着此类同源物不同于全长蛋白质,功能结构域或免疫结构域(如此类蛋白,功能结构域或免疫结构域在本文中描述或否则已知或在公众可获得的序列中描述),其通过从此类全长蛋白或全长功能结构域或全长免疫结构域的N和/或C末端添加或缺失1,2,3,4,5,6,7,8,9或10个氨基酸。
如本文所使用,除非另有说明,提及百分比(%)同一性是指利用下述程序进行的同源性评估:(1)BLAST 2.0 Basic Local Alignment Search Tool(BLAST)基本同源性检索,以标准缺省参数,使用blastp进行氨基酸检索,使用blastn进行核酸检索,其中缺省将查询序列进行低复杂度区域的过滤(比如在Altschul,S.F.,Madden,T.L.,A.A.,Zhang,J.,Zhang,Z.,Miller,W.&Lipman,D.J.(1997)"Gapped BLAST and PSI-BLAST:a new generation of protein database search programs."Nucleic Acids Res.25:3389-3402中有描述,该文献通过引用并入全部本文);(2)BLAST 2比对(使用以下描述的参数);(3)和/或PSI-BLAST,使用标准缺省参数(Position-Specific Iterated BLAST)。应当注意,由于BLAST 2.0 Basic BLAST和BLAST 2之间标准参数中的一些差异,两个特定序列在使用BLAST 2程序时可能被识别为有显著的同源性,而在BLAST 2.0 Basic BLAST中使用序列之一作为查询序列进行的检索可能最佳匹配中没有鉴定到第二个序列。此外,PSI-BLAST提供了“profile”检索的自动化的,使用简便版本,是一种寻找同源序列的灵敏方式。该程序首先进行空位BLAST数据库检索。PSI-BLAST程序利用来自返回的任何明显比对的信息构建位点特异性打分矩阵,以此在下一轮数据库检索中替代查询序列。因此,可以理解通过使用这些程序中的任意一种能够确定百分比同一性。
可以使用BLAST 2序列,如Tatusova and Madden,(1999),"Blast 2sequences-a new tool for comparing protein and nucleotide sequences",FEMS Microbiol Lett.174:247-250中所描述的比对两个特定序列,该文献通过提述以其整体并入本文。BLAST 2序列比对在blastp或blastn中进行,使用BLAST2.0算法在两个序列间进行空位BLAST检索(BLAST 2.0),以便在最后得到的比对中引入空位(缺失和插入)。为了清楚起见,利用如下标准缺省参数进行BLAST 2序列比对。
对于blastn,使用0 BLOSUM62矩阵:
匹配得分=1
错配罚分=-2
开放空位(5)和延伸空位(2)罚分
gap x_dropoff(50)期望值(10)字长(11)滤器(开)
对于blastp,使用0BLOSUM62矩阵:
开放空位(11)和延伸空位(1)罚分
gap x_dropoff(50)期望值(10)字长(3)滤器(开).
分离的核酸分子是已经被从其自然环境移出(即,已经经过人的操作)的核酸分子,其自然环境是自然界中发现该核酸分子的基因组或染色体。因此,“分离的”并不一定反映该核酸分子的纯化程度,而是表明所述分子未包含自然界中发现该核酸分子所处的整个基因组或整个染色体。分离的核酸分子可包括基因。包含基因的分离的核酸分子并不是包含该基因的染色体片段,而是包含与该基因相关的编码区和调控区,但没有天然存在于同一染色体上的其它基因。分离的核酸分子还可包含基因的一部分。分离的核酸分子还可包含(在序列的5’和/或3’端)侧接有其他核酸的特定的核酸序列,所述其他核酸在自然界中通常不位于该特定的核酸序列的侧翼(即异源序列)。分离的核酸分子包括DNA、RNA(例如mRNA)、或者DNA或RNA的衍生物(例如cDNA)。尽管短语“核酸分子”主要指物理的核酸分子,短语“核酸序列”主要指核酸分子上的核苷酸序列,这两个短语可以互换使用,尤其是对于能编码蛋白或蛋白结构域的核酸分子或核酸序列而言。
重组核酸分子是这样的分子,其可以包括的编码本文描述的任何一种或多种蛋白的至少一个任意核酸序列,可操纵地连接至少一个任意转录调控序列,其中所述转录调控序列能有效地调控该核酸分子在待转染的细胞中的表达。虽然短语“核酸分子”主要指物理的核酸分子,短语“核酸序列”主要指核酸分子上的核苷酸序列,这两个短语可以互换使用,尤其是对于能编码蛋白的核酸分子或核酸序列而言。此外,短语“重组核酸”主要指可操纵地连接转录控制序列的核酸分子,但可以与向动物施用的短语“核酸分子”互换使用。
重组核酸分子包括重组载体,所述重组载体是与编码本发明融合蛋白的分离的核酸分子可操纵地连接的任何核酸序列,一般是异源序列,其能使所述融合蛋白得以重组产生,并能将所述核酸分子递送到本发明的宿主细胞中。此类载体可以含有天然状态下与待插入该载体的分离的核酸分子不相邻的核酸序列。载体可以是RNA或DNA,原核的或真核的,而且在本发明中优选是可用于转染酵母的质粒。重组载体可用在克隆、测序和/或其它对核酸分子的操作中,并可以用于递送这样的分子(例如,如在DNA组合物或基于病毒载体的组合物中)。重组载体优选用于核酸分子的表达,还可称为表达载体。优选的重组载体能在所转染的宿主细胞中表达。
在本发明的重组分子中,核酸分子可操纵地与表达载体连接,其中所述表达载体含有调控序列,比如转录控制序列、翻译控制序列、复制起点,以及其它与宿主细胞相容并控制本发明的核酸分子的表达的调控序列。特别地,本发明的重组分子包括与一或多个表达控制序列可操纵地连接的核酸分子。短语“可操纵地连接”是指核酸分子与表达控制序列的连接方式使得该分子在转染(即,转化、转导或转染)到宿主细胞中后被表达。
根据本发明,术语“转染”用来指可以将外源核酸分子(即重组核酸分子)插入细胞中的任何方法。当用来指将核酸分子导入微生物细胞,例如藻类、细菌和酵母时,术语“转化”可与术语“转染”互换使用。在微生物系统中,术语“转化”用于描述由于微生物获取了外源核酸而继承的变化,并且基本上与术语“转染”同义。因此,转染技术包括但不限于,转化、细胞的化学处理、粒子轰击、电穿孔、显微注射、脂质转染、吸附、感染和原生质体融合。
以下实验结果是为说明目的而提供的,并不意在限制发明的范围。
实施例
实施例1
以下实施例显示,使用表达突变Ras的酵母免疫疗法治疗的胰腺癌临床研究中的响应者对1型干扰素(T1IFN)敏感或耐受,其与结果相关。
使用人类受试者临床样品测量T1IFN敏感性:从T1IFN配体发出的信号传导启动转录因子的活化,所述转录因子活化或抑制编码效应蛋白的T1IFN调节的基因。本发明人采用Feng等人,2012,如上文所开发的方法来测量T1IFN诱导的MxA蛋白。更具体地,本发明人首先使用来自健康志愿者的PBMC开发了测定,以确认当样品冷冻和解冻时MxA蛋白信号不削弱,因为Feng等人从新鲜分离的PBMC进行分析。通过测定每个个体而不是合并血液样品,观察到受试者对T1IFN具有不同的敏感性,其沿着连续统(continuum)下降。询问的问题是T1IFN敏感性是否可用于区分在2期胰腺癌免疫治疗试验中具有良好和不良结果的那些。
在用于具有切除的胰腺癌的患者的2期临床研究中,在全球27个中心的两个臂(arm)中登记患者(n=176)。研究药物是称为GI-4000的基于酵母的免疫治疗剂(产品,GlobeImmune,Inc.,Louisville,Colorado)。GI-4000是由GlobeImmune,Inc开发的一系列基于酵母的免疫治疗产品,其靶向突变的Ras。GI-4000目前由一起表达人类癌症中的七种常见Ras突变的四种不同的热灭活的酿酒酵母(分别称为“GI-4014”,“GI-4015”,“GI-4016”和“GI-4020”)组成。酵母中表达的每种蛋白产物含有:(A)在密码子61处的两种突变(谷氨酰胺突变为精氨酸[Q61R](GI-4014,GI-4015,GI-4016)或谷氨酰胺突变为组氨酸[Q61H](GI-4020),和谷氨酰胺突变为亮氨酸[Q61L](GI-4014,GI-4015,GI-4016,GI-4020);加上(B)密码子12处的四种不同突变之一(甘氨酸突变为缬氨酸[G12V](GI-4014),甘氨酸突变为半胱氨酸[G12C](GI-4015),甘氨酸突变为天冬氨酸[G12D](GI-4016),或甘氨酸突变为精氨酸[G12R](GI-4020))。对患者肿瘤进行测序以鉴定他们肿瘤中的特定的Ras突变,并且仅向患者施用具有匹配突变的特定酵母免疫治疗剂。
使用在切除后21至35天开始的三次每周剂量(研究访问第1,8,15天)向患者施用40Y.U.与其Ras突变相匹配的GlobeImmune的GI-4000产品,或安慰剂,且所有受试者在研究访问第24天开始通过静脉内注射接受吉西他滨(GEM)1000mg/m2。GEM的施用进行直到完成6个月周期,GEM不耐受,研究撤回,疾病进展或死亡发生。研究药物(GI-4000)的施用进行直到研究撤回,疾病复发或死亡,并且可以进行得超过GEM停止。在选择的研究访问:第1天(基线),第15天,第24天,第44天,第52天,第100天,第108天,第184天从受试者收集免疫样品,然后在治疗期间和研究后药物随访期期间每季度进行。
如本文先前所讨论的,使用潜在蛋白质组伴随诊断测试(BDX-001;Biodesix,Inc.,Boulder,Colorado)的回顾性蛋白质组分析似乎预测了在该试验中用GI-4000和吉西他滨治疗的受试者的亚组与使用安慰剂加吉西他滨治疗的受试者相比,将具有改善的无复发存活(RFS)和总存活(OS)。(Richards等人,2012,European Society for Medical Oncology(ESMO);Richards等人,2014,American Association for Cancer Research(AACR))。
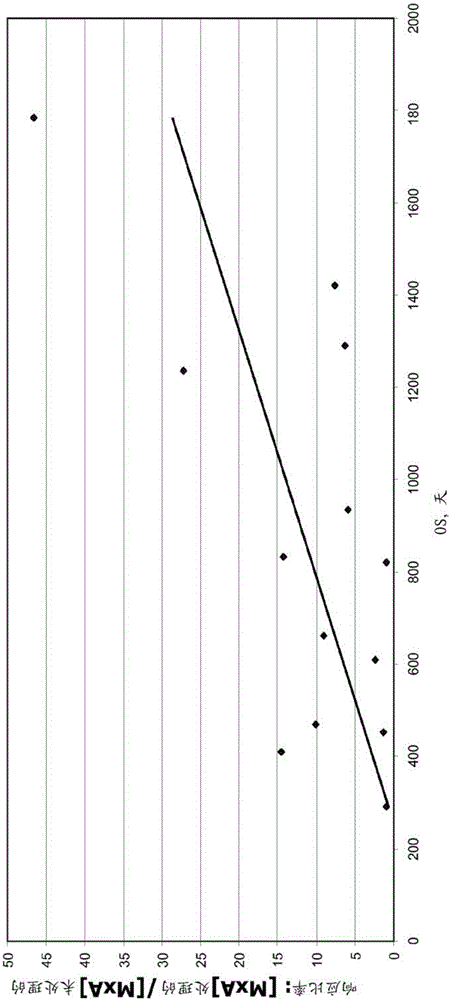
在本发明进行的试验性实验中,测试了来自GI-4000临床研究的14个受试者样品:来自具有较有利的临床结果的受试者的七个样品,其根据更长的总存活(OS)和/或更长的无复存活(RFS)测量),以及来自具有不太有利的临床结果的受试者的七个样品,其根据较短的总存活(OS)和/或较短的无复发存活(RFS)测量。前七个样品先前也被表征为“BDX-001阳性”,而后七个样品先前被表征为“BDX-001阴性”,尽管本实验的目的是确定T1IFN灵敏度和临床结果之间是否有相关性,而不考虑BDX-001状态。基于这些受试者在治疗之前在时间0可获得的最丰富的冷冻样品的实情,选择这些受试者用于来自其库存样品的分析。图1是来自13个患者PBMC样品中的6个的Western印迹(一个样品未提供信号)。每个受试者通过比率(T1IFN添加后相对于添加T1IFN之前的MxA蛋白的扫描定量)定义。每个样品在没有(0)和有(160U/mL)IFN-β(在先前研究中优化了IFN-β的该浓度,以实现最高水平的MxA产生,数据未显示)下一式两份地运行。命名为0132CLB的第一个受试者的MxA比率为0.87,意味着在添加T1IFN之前相比之后未改变的MxA蛋白。为了该分析的目的,将此人分类为T1IFN抗性,因为MxA蛋白不受添加T1IFN的影响。
更具体地,图1显示T1IFN敏感性与基于整个酵母的免疫疗法治疗后的阳性结果相关。对在治疗开始前收集的来自使用基于酵母的免疫疗法治疗的6名受试者的样品测定T1IFN敏感性/不敏感性,其通过在体外添加T1IFN之前和之后测量PBMCs中的T1IFN响应基因产物MxA限定。图1显示了被鉴定为0132,0508,0539,0532,0526和0125的6名受试者。将PBMC置于添加或没有添加160U/mL IFN-β的培养物中。每个样品重复运行。通过比较扫描的凝胶信号和产生在T1IFN治疗之前对之后的信号比率,数据显示对于表示为0132,0508和0125的受试者,该比率为0.87,1.3和2.4,对于受试者0539,0532和0526,比率是6.3,5.9和7.6。
Western印迹数据将受试者539,532和526分类为对T1IFN敏感,其通过T1IFN诱导后MxA蛋白水平的实质增加来定义,而受试者132,508和126可以被认为是对T1IFN不敏感的或至少敏感性较低(例如,受试者0508和0125确实对T1IFN具有一些响应性,尽管这足够低以在该测定中被认为是T1IFN不敏感的)。通过Western印迹分类为对T1IFN敏感的那些受试者在治疗开始>500天(分别为695,642,562天)后具有RFS。具有“T1IFN不敏感”的Western印迹信号的那些具有RFS<500天(分别为354,275,290天)。
在总共13名受试者分组中,根据总存活(OS)和无复发存活(RFS)被认为是长期存活者的所有七名受试者通过MxA测定认为是T1IFN敏感的。所有这些受试者具有大于5的MxA蛋白比率(实际比例为:46.6,27.2,14.2,10.1,7.6,6.3和5.9)。在根据OS和RFS为短期存活者的六名受试者中,四名受试者中的三个具有明显不变的比率(1.3,0.9,0.9),而第四名受试者具有2.4的比率。然而,两个受试者具有14.6和9.0的比率。在最初对健康志愿者进行的T1IFN分析中,四名受试者是T1IFN敏感的,而六名受试者是T1IFN不敏感的。总之,该初步数据子集表明,至少,PBMC T1IFN敏感性测定可以通过T1IFN敏感性预测那些最可能响应基于酵母的免疫疗法的受试者,而那些具有T1IFN不敏感性信号的受试者趋向于不良的结果。
在另外的分析中,结果示于图2和3中,将来自用使用GI-4000处理的患者的PBMCs解冻,洗涤并计数,并将细胞在RPMI中调整至0.5×107细胞/mL的密度。使用160U/mL IFN-β诱导T1IFN应答24小时(对照=无诱导)。收获细胞,通过在含有蛋白酶抑制剂和原钒酸钠以防止磷酸酶活性的标准哺乳动物细胞裂解缓冲液中超声处理来制备裂解物。通过在95℃加热样品5分钟和加载用于蛋白质印迹分析的SDS-PAGE凝胶(相等的总蛋白加载/泳道)进行总蛋白质分析。使用抗MxA抗体探测Western印迹,并使用增强的化学发光数字成像定量MxA蛋白。数据分析为TIIFN诱导的/未诱导的条带强度的比率。相关性和相关的p值由外部供应商(Dr.Stan Deming,Statistical Designs,Houston,TX)进行。
如图2和3中所示,对于GI-4000治疗的胰腺癌患者,存活和T1IFN响应相关,其中与接收GI-4000并且鉴定为T1IFN抗性的患者相比,接受GI-4000并被鉴定为T1IFN敏感的患者具有改善的总体存活(OS;图2;相关系数0.6585;p=0.0144;置信度98.6%)和无复发存活(RFS;图3;相关系数0.7905;p=0.0013;置信度99.87%)。结果是统计学显著的。
因此,基于酵母的免疫疗法的响应性与对1型干扰素的敏感性正相关,其现在可用于以临床上有意义/有益的方式预选择最有可能响应基于酵母的免疫疗法的个体。
实施例2
以下实施例提供了在使用基于酵母的免疫疗法治疗的受试者中,T1IFN敏感性以统计学显著的方式与总体存活和无复发存活相关的另外的证据。
在该实施例中,为了在更大的受试者分组中检查T1IFN敏感性和临床结果之间的关系,使用上述实施例1中所述的那些受试者样品,以及来自相同临床研究的其它GI-4000治疗的受试者(即接受称为GI-4000的基于酵母的免疫疗法加吉西他滨的受试者)的额外样品,在治疗前(基线)PBMCs样品中再次测定GI-4000胰腺癌受试者的T1IFN响应。此外,测试来自相同临床研究中使用安慰剂(即安慰剂加吉西他滨)治疗的受试者分组的样品,以确定这些患者中T1IFN敏感性与临床结果是否相关(即,以确定该效果是否与基于酵母的免疫疗法相关)。
更具体地,将PBMC解冻并在含有10%胎牛血清(cRPMI-10)的完全RPMI培养基中洗涤。将500万个活细胞重悬于2mL cRPMI中,并将悬浮液分至24孔板的2个孔中(每孔1mL)。向其中一个孔中加入IFN-β至终浓度为160U/mL,将仅培养基(模拟处理)加入到另一个孔中。在37℃孵育24小时后,以300×g收获细胞6分钟,将细胞沉淀物在含有1mM原钒酸钠和蛋白酶抑制剂混合物加1X SDS-PAGE凝胶上样缓冲液的冰冷RIPA缓冲液中裂解。将样品超声处理15秒(1秒脉冲,间隔1秒)。然后将样品加热至95℃持续5分钟,使用染料结合方法(Schaffner等,1973,Anal Biochem 56:502-514)测定总蛋白浓度。根据建立的增强化学发光方法进行MxA表达的Western印迹分析。使用分带强度的数字成像来定量MxA表达水平。
计算每个受试者的T1IFN诱导/未诱导的MxA比率,并测定MxA对无复发存活(RFS)(图4A对于GI-4000治疗的受试者,和图5A对于安慰剂治疗的受试者)或MxA对总存活(OS)(图4B对于GI-4000治疗的受试者,和图5B对于安慰剂治疗的受试者)的相关系数和p值。作为分析的另一个水平,将受试者另外分类为各种亚组,具有MxA比率(即,IFN-β暴露后的MxA水平与IFN-β暴露前的MxA水平的比率)<3或≥3(图6A对于GI-4000治疗的受试者,和图7A对于安慰剂治疗的受试者)的那些和具有MxA比率为<5或≥5的那些(图6B对于GI-4000治疗的受试者,和图7B对于安慰剂治疗的受试者),并将每组的存活时间作为散点图绘制。
图4A和4B中示出的结果表明,GI-4000治疗的受试者的存活时间(图4ARFS和图4B OS)与基线PBMC样品中体外T1IFN响应的幅度相关。对于这些受试者,RFS相对于基线MxA响应的相关系数为+0.4179(p=0.0155),而OS相对于基线MxA反应的相关系数为+0.3925(p=0.0239)。如图5A(安慰剂治疗的受试者RFS)和图5B(安慰剂治疗的受试者OS)中所示,在这些样品中没有观察到统计学显著的相关性(对于RFS,图5A,相关系数为-0.2474,p=0.1957,和对于图5B,相关系数为-0.0942,p=0.63)。因此,在使用基于酵母的免疫疗法治疗的受试者中,T1IFN敏感性以统计学显著的方式与存活(RFS和OS)相关,而在接受安慰剂的受试者中该生物标志物与存活不相关(即,T1IFN生物标志物是基于酵母的免疫疗法的结果的预测器)。
分类响应测量的结果(MxA截留为3或5)也表明在T1IFN敏感性和存活之间存在正相关关系,其中对于具有MxA比率≥3的GI-4000治疗的受试者,平均存活时间(RFS和OS)比MxA比率<3的受试者更长(图6A)。当使用MxA比值截留为5时,得到了相似的结论(图6B)。对于安慰剂组没有观察到这些关系(图7A和7B),事实上,对于MxA比≥3或≥5的受试者,存活时间实际上有所减少(图7A)。因此,这些结果还指示了在通过分类响应(categorical response)分组的使用基于酵母的免疫疗法治疗的受试者中,观察到了T1IFN敏感性和临床结果之间的正相关关系,但在使用安慰剂治疗的受试者中未观察到。
虽然已经详细描述了本发明的各种实施方案,但是显然,对于本领域技术人员将发生这些实施方案的修改和改编。然而,应当清楚地理解,此类修改和改编在如所附权利要求书中阐述的本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!