源于多能干细胞的功能性少突胶质细胞及其制备和使用方法与流程
本申请要求2014年5月22日提交的美国临时专利申请号62/002,048的优先权权益,所述美国临时专利申请的内容据此以引用的方式并入本文。
本专利文件的一部分公开内容含有受版权保护的材料。版权所有者不反对由任何人以专利文件或专利公开出现在专利与商标局专利文档或记录中的形式复制所述专利文件或专利公开,但另外无论如何都保留所有版权权利。
序列表的并入
随附序列表中的材料据此以引用的方式并入本申请。名为NYSC1250_1WO_Sequence_Listing_ST25的随附序列表文本文件于2015年5月22日创建,并且是2kb。所述文件可在使用Windows OS的计算机上利用Microsoft Word进行评估。
发明背景
少突胶质细胞是存在于脊椎动物中的中枢神经系统细胞。它们产生富含脂质的层状髓鞘,其覆盖神经元轴突并产生限定的电绝缘区段以使动作电位传导速度最大化。髓磷脂对于轴突完整性和存活也是重要的,并且已显示即使影响少突胶质细胞代谢的小变化也可导致神经退化。Kassmann,C.M.等,Nature Genet.39:969-976(2007)。髓鞘化过程在人类中特别重要,因为人脑具有较高含量的有髓鞘神经元(白质),并且髓鞘化在出生之后持续并贯穿一生。Bartzokis,G.,Adolescent Psychiat.29:55-96(2005)。这表明少突胶质细胞不只提供惰性绝缘,而且髓鞘化是动态过程,从而影响认知功能乃至行为。
多发性硬化症(MS)、肾上腺脑白质营养不良、白质消融性疾病、佩利措伊斯-梅茨巴赫病(Pelizaeus-Merzbacher disease)和脑白质营养不良是脱髓鞘或髓鞘形成障碍病症的实例。此外,少突胶质细胞的关键作用正显现在许多其它神经病症和神经退化性病状,包括肌萎缩性侧索硬化、亨廷顿氏病(Huntington’s disease)、阿尔茨海默氏病(Alzheimer's disease)和精神分裂症中。Bernstein,H.G.等,Schizophr.Res.161:4-18(2015);Behrendt,G.等,Glia 61:273-286(2013);Kang,J.等,Ann.Vasc.Surg.27:487-496(2013);Fennema-Notestine,C.等,Neurology 63:989-995(2004)。人少突胶质细胞祖细胞(OPC)可用于开发体外髓鞘化测定以筛选髓鞘形成性化合物,并且最终可变为自体细胞补充疗法的来源。特定来说,从诱导的多能干细胞(iPSC)产生用于自体细胞疗法的患者特异性细胞近来已作为一种有前途的构思而出现。Wang,S.等,Cell Stem Cell 12:252-264(2013);Goldman,S.A.等,Science 338:491-495(2012)。
对人少突胶质细胞生物学和人髓鞘化的研究已受阻于由活检或尸检获取原代细胞受到限制。在最近20年内,多能干细胞(PSC)已被用作一种可从其产生任何所需细胞类型的替代性适用来源。这已通过在体外重演胚胎发育的基本步骤来实现。Irion,S.等,Cold Spring Harb.Sym.73:101-110(2008)。值得注意的是,在小鼠与人之间,谱系定型的大多数关键路径是高度保守的,并且因此,由小鼠发育生物学获得的见地已成功应用于从人PSC(hPSC)产生众多细胞类型,包括少突胶质细胞。Murry,C.E.等,Cell 132:661-680(2008)。
在小鼠中,少突胶质细胞前体产生于运动神经元祖细胞(pMN)域内。在小鼠胚胎发育期间,视黄酸(RA)和音猬因子(sonic hedgehog,SHH)路径在确定pMN域方面是关键的。这个研究结果已在体外培养中用于使神经上皮细胞转化成pMN域的祖细胞,从而表达转录因子OLIG2。Wichterle,H.等,Cell 110:385-397(2002)。在10μM的浓度下的RA已在大多数方法中用于使人胚胎干细胞(hESC)分化成少突胶质细胞。Izrael,M.等,Mol.Cell.Neurosci.34:310-323(2007);Nistor,G.I.等,Glia 49:385-396(2005)。Zhang实验室证明SHH为诱导OLIG2+NKX2.2+祖细胞以及它们转变成表达SOX10、PDGFRα和最终O4的少突胶质细胞祖细胞(OPC)所必需。Hu,B.Y.等,Development 136:1443-1452(2009a)。相较于小鼠模型,OPC在人模型中的出现被显著延迟;在人模型中,在OLIG2+祖细胞的峰值与OPC的峰值之间存在10周延长时期。Hu,B.Y.等,Nat.Protoc.4:1614-1622(2009b)。
若干小组已设计用以使PSC分化成OPC的方案。Numasawa-Kuroiwa,Y.等;Stem Cell Rep.2:648-661(2014);Stacpoole,S.R.等,Stem Cell Rep.1:437-450(2013);Wang等,(2013);Liu,Y.等,Nat.Protoc.6:640-655(2011);Sim,F.J.等,Nat.Biotechnol.29:934-941(2011)。然而,这些分化方案是冗长的和低效的;它们的实际应用受限于获得表达O4抗原的OPC需要超过120天的培养时间。此外,所得O4+细胞的报道效率在4%至47%的范围内。此外,许多分化方案已仅使用一种或两种hESC株系加以优化,并且它们在iPSC株系的情况下的可再现性是有争论的。Alsanie,W.等,Stem Cells Devel.22:2459-2476(2013)。
因此,在相对较短时间内产生大量纯化OPC的改进少突胶质细胞分化方案是高度合乎需要的。此外,这个方案在不同PSC株系之间应是可再现的,并且应是高度高效的。
发明概述
以下概述本发明的一些主要方面。额外方面描述于本公开的发明详述、实施例、附图和权利要求章节中。本公开的各章节中的描述意图与其它章节联合加以阅读。此外,本公开的各章节中所述的各个实施方案可以各种不同方式加以组合,并且所有所述组合都意图属于本发明的范围。
本发明提供一种在75天内产生40%至70%O4+OPC的强力分化方案。Douvaras,P.等,Stem Cell Rep.3:250-259(2014)(以引用的方式整体并入本文)。也提供一种用于在仅55天分化之后获得约30%O4+OPC,从而导致成本实质性降低的策略。Douvaras,P.等,Nat.Protoc.(2015)(以引用的方式整体并入本文)。当纯化时,O4+细胞能够进行移入,并且在短期(16周)移植研究中移入颤抖(shi/shi)小鼠模型中,显示与人胎儿OPC类似的髓鞘化潜力。在OPC表达O4而非PDGFRα所处的阶段,通过荧光激活的细胞分选(FACS)纯化它们,此举消除污染细胞,并且使致肿瘤潜力最小。我们的方案在使用超过9种hPSC株系的情况下加以验证,其中对于各株系观察到极其一致结果。因此,本发明提供一种用以从包括胚胎干细胞(ESC)和iPSC的PSC高效获得OPC和成熟少突胶质细胞的高度可再现方案。
在一个方面,本发明提供一种产生OLIG2+OPC的方法,所述方法包括:(a)通过以下方式来制备PSC集落:(i)在低密度下在表面上接种PSC;以及(ii)在贴壁培养中培养所述PSC 1-2天,由此制备PSC集落;(b)在包含低浓度的RA、至少一种转化生长因子β(TGFβ)信号传导抑制剂和至少一种骨形态发生蛋白(BMP)信号传导抑制剂的培养基中培养所述PSC集落至汇合,其中所述培养的首日是第0天;(c)在包含Smoothened激动剂(SAG;3-氯-N-[(1r,4r)-4-(甲氨基)环己基]-N-[3-(吡啶-4-基)苯甲基]苯并[b]噻吩-2-甲酰胺)和低浓度的RA的培养基中培养汇合细胞直至细胞过度汇合,其中所述细胞表达OLIG2;由此产生OLIG2+OPC。
在另一方面,本发明提供一种产生O4+OPC的方法,所述方法包括:(a)在包含Smoothened激动剂和低浓度的RA的培养基中悬浮培养OLIG2+OPC的三维细胞聚集物约8天;(b)在包含血小板源性生长因子(PDGF)、肝细胞生长因子(HGF)、胰岛素样生长因子1(IGF-1)和神经营养素(neurotrophin)3(NT3)的培养基中悬浮培养所述细胞聚集物约10天;(c)在2个球体/cm2的密度下再涂铺所述细胞聚集物;以及(d)在贴壁培养中在包含(i)抗坏血酸(AA)或(ii)PDGF、HGF、IGF-1和NT3的培养基中培养所述细胞聚集物直至细胞为O4+;由此产生O4+OPC。可通过以下方式来产生成熟少突胶质细胞:在不存在PDGF、HGF、IGF-1和NT3下培养O4+OPC约3周;由此产生少突胶质细胞,其中所述少突胶质细胞表达髓磷脂碱性蛋白(MBP+)。
在另一方面,本发明提供一种产生少突胶质细胞的方法,所述方法包括:(a)通过以下方式来制备PSC集落:(i)在低密度下在表面上接种PSC;以及(ii)在贴壁培养中培养所述PSC 1-2天,由此制备PSC集落;(b)在包含低浓度的RA、至少一种TGFβ信号传导抑制剂和至少一种BMP信号传导抑制剂的培养基中培养所述PSC集落至汇合,其中所述培养的首日是第0天;(c)在包含Smoothened激动剂和低浓度的RA的培养基中培养汇合细胞直至细胞过度汇合,其中所述细胞是OLIG2+OPC;(d)从所述表面提升所述细胞,由此允许形成三维细胞聚集物;(e)在包含Smoothened激动剂和低浓度的RA的培养基中悬浮培养所述细胞聚集物约8天;(f)在包含PDGF、HGF、IGF-1和NT3的培养基中悬浮培养所述细胞聚集物约10天;(g)在2个球体/cm2的密度下再涂铺所述细胞聚集物;(h)在贴壁培养中在包含(i)AA或(ii)PDGF、HGF、IGF-1和NT3的培养基中培养所述细胞聚集物直至细胞为O4+;由此产生O4+OPC;以及(i)在包含AA并且缺乏PDGF、HGF、IGF-1和NT3的培养基中培养所述O4+OPC直至细胞为MBP+;由此产生少突胶质细胞。
本发明的另一方面是一种产生少突胶质细胞的方法,所述方法包括:(a)在贴壁培养中在包含低浓度的RA的培养基中以单层形式培养PSC,(i)第0天至第8天进行双重SMAD抑制,以及(ii)第8天至第12天使用SHH或Smoothened激动剂,以产生OLIG2+细胞;(b)通过(i)第12天至第20天在包含SHH或Smoothened激动剂和低浓度的RA的培养基中,以及(ii)第20天至第30天在包含PDGF、HGF、IGF-1和NT3的培养基中悬浮培养步骤(a)的细胞来富集OLIG2+细胞;(c)第30天至第75天在贴壁培养中在包含PDGF、HGF、IGF-1和NT3的培养基中培养步骤(b)的细胞以产生O4+OPC;以及(d)第75天至第95天在贴壁培养中在包含AA并且缺乏PDGF、HGF、IGF-1和NT3的培养基中培养所述O4+OPC;由此产生少突胶质细胞。
本发明的另一方面是一种产生少突胶质细胞的方法,所述方法包括:(a)在贴壁培养中在包含低浓度的RA的培养基中以单层形式培养PSC,(i)第0天至第8天进行双重SMAD抑制,以及(ii)第8天至第12天使用SHH或Smoothened激动剂,以产生OLIG2+细胞;(b)通过(i)第12天至第20天在包含SHH或Smoothened激动剂和低浓度的RA的培养基中,以及(ii)第20天至第30天在包含PDGF、HGF、IGF-1和NT3的培养基中悬浮培养步骤(a)的细胞来富集OLIG2+细胞;以及(c)第30天至第60天在贴壁培养中在包含AA并且缺乏PDGF、HGF、IGF-1和NT3的培养基中培养步骤(b)的细胞;由此产生少突胶质细胞。
也提供一种鉴定促进髓鞘化的化合物的方法,所述方法包括:(a)通过本发明方法来产生少突胶质细胞;(b)使所述少突胶质细胞与候选化合物接触;以及(c)确定所述候选化合物是否促进神经元髓鞘化。
另一实施方案是一种治疗受试者的神经疾病或病症的方法,所述方法包括:(a)通过本发明方法来产生少突胶质细胞;以及(b)向所述受试者施用有效量的所述少突胶质细胞,其中所述少突胶质细胞促进所述受试者的神经系统中的髓鞘形成;由此治疗所述受试者的所述神经疾病。
本发明也涵盖通过本发明方法产生的少突胶质细胞祖细胞和少突胶质细胞以及包含它们的非人哺乳动物。
附图简述
图1显示遵循选项A(图1A)和选项B(图1B)的少突胶质细胞分化的时间轴。三角形表示用以通过免疫荧光评估阶段特异性标志物的表达的推荐时间点。SB:SB431542;LDN:LDN193189;SAG:Smoothened激动剂;T3:三碘甲状腺原氨酸;RA:全反式视黄酸;PDGF:血小板源性生长因子;HGF:肝细胞生长因子;IGF-I:胰岛素样生长因子-1;NT3:神经营养素3;AA:抗坏血酸。
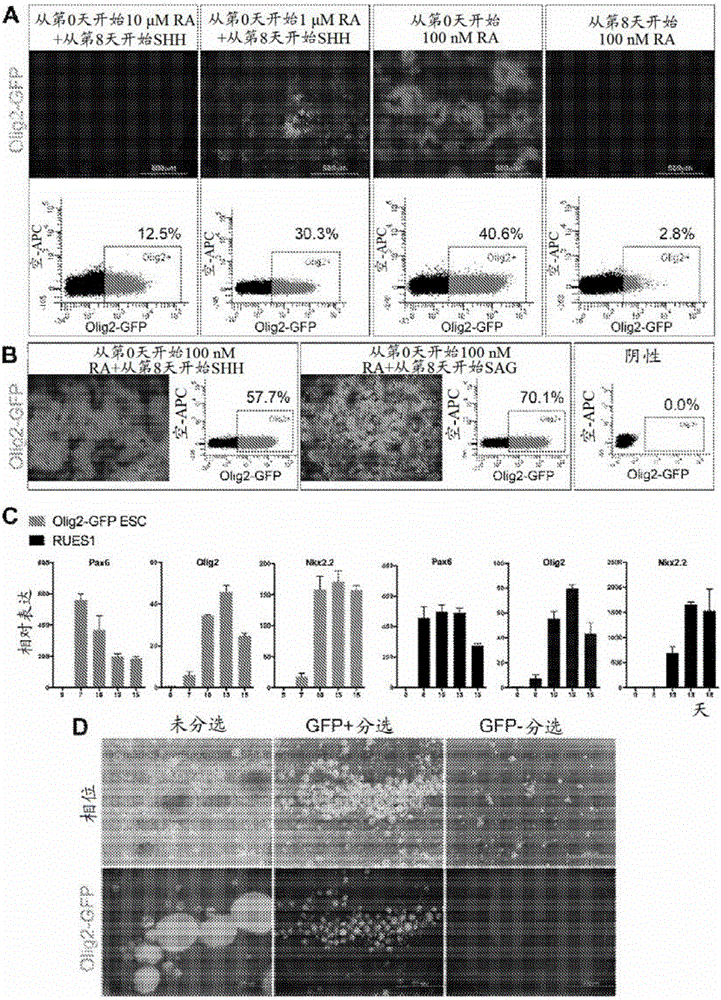
图2显示获得OLIG2+祖细胞需要RA和SHH。图2A显示在不同RA和SHH条件下分化的第14天对OLIG2-GFP细胞的活体成像和流式细胞计量定量。从第0天开始在100nM的浓度下使用RA导致最高GFP+细胞产率。图2B显示在第8天向最佳RA条件添加SHH或SAG之间通过活体成像和FACS分析进行的比较。阴性:hESC株系RUES1。图2C显示在最优RA和SHH条件下PAX6、OLIG2和NKX2.2的时序基因表达概况。误差棒是SEM(N=3)。使用RUES1细胞和OLIG2-GFP报道体株系获得类似的结果。图2D显示对未分选细胞、分选GFP+细胞或GFP-细胞的球体形成的评估。仅GFP+细胞形成球体,从而提供GFP+群体富集。
图3显示获得OLIG2+祖细胞需要SHH和双重SMAD抑制。图3A显示相较于仅从第0天开始暴露于RA的细胞,从第0天开始使用RA以及从第8天开始使用SHH/SAG的培养物之间在分化的第14天OLIG2、PTCH1和SHH的mRNA水平。未暴露于SHH/SAG的样品中的内源性SHH水平较高。误差棒是SEM(N=3)。图3B显示在分化的前12天中仅暴露于RA或暴露于RA和SAG的细胞之间在分化的第75天对O4+细胞的FACS分析。观察到在初始分化步骤中未提供以SAG的细胞中,O4+群体降低56%。阴性对照:仅APC缀合二级抗体。图3C显示在不同SMAD抑制剂下分化的第14天的活体成像和FACS分析。一大群GFP+细胞仅在双重抑制SMAD蛋白下存在,从而指示RA与双重抑制SMAD之间具有协同作用。DSi:双重SMAD抑制;SB:SB431542;LDN:LDN189193。
图4显示从人多能干细胞产生少突胶质细胞。图4A显示从hPSC至成熟少突胶质细胞的分化方案的图解。图4B-4M是RUES1细胞的体外少突胶质细胞分化的依序步骤,其显示:在第8天的PAX6+神经干细胞(B),在第12天的多层结构的相差(C),在第18天的OLIG2+NKX2.2+前OPC(D),SOX10+OLIG2+早期OPC(E),对O4+晚期OPC的活体成像(F),O4+细胞的用以突显分枝突起的剪修图像(G),共同表达OLIG2的O4+OPC(H),共同表达SOX10的O4+OPC(I),共同表达SOX10和NG2的分选O4+OPC(J),在低(K)和较高(x64)放大倍数(L)下的终末分化的MBP+少突胶质细胞,少突胶质细胞培养物中的MAP2+和GFAP+细胞(M)。PSC:多能干细胞;NSC:神经干细胞;OPC:少突胶质细胞祖细胞;OL:少突胶质细胞;pO/L:聚L-鸟氨酸/层粘连蛋白。
图5显示增殖性少突胶质细胞和其它神经细胞类型。图5A显示在分化的第50天OLIG2、SOX10和Ki67的代表性免疫荧光染色。在OLIG2与SOX10之间存在几乎完全共同定位。图5B显示对Ki67+细胞的时序定量,其显示在分化的第30天与第50天之间增殖的OLIG2+和SOX10+祖细胞的百分比。误差棒是SEM(N=2)。图5C显示在第73天培养物的免疫荧光图像,其显示O4+细胞的数目较高,但几乎没有细胞共同表达Ki67。图5D显示在移除生长因子之后4周共同表达MBP的O4+细胞的百分比(神经胶质培养基)。误差棒是SEM(N=4)。图5E显示在分化的第78天–第88天3个独立实验中MAP2+神经元和GFAP+星形细胞相对于细胞总数的百分比。误差棒是SEM(N=3)。
图6显示遵循选项B方案,在分化的第53天(图6A、6D)、第63天(图6B、6E)和第73天(图6C、6F)的活体O4成像。图6A-6C显示在低放大倍数下的代表性区域;O4+细胞的数目随时间增加。图6D-6F分别显示图6A-6C的较高放大倍数图像以突显细胞的形态。图6G显示在使用选项B(“快速”)方案(第55天、第63天和第75天)和选项A(“原始”)方案的情况下,在不同时间点通过流式细胞计量术计算的O4+细胞出现率的代表性实例。比例尺:500μm(6A-6C);200μm(6D-6F)。
图7显示hPSC分化成少突胶质细胞的基本步骤。图7A显示在分化的第8天的PAX6+神经干细胞(PAX6,绿色;核用DAPI染色,蓝色)。图7B显示在第12天的培养物的描绘三维结构的典型形态。图7C显示在第12天的OLIG2和NKX2.2表达,如通过免疫荧光分析所示(OLIG2,绿色;NKX2.2,红色;核用DAPI染色,蓝色)。图7D显示球体选择:箭号指示良好球体,其是圆形、金色/棕色,具有暗色核心以及具有在300μm与800μm之间的直径。感叹号指示一对接合球体,其可通过温和吸移来破坏成单一球体。应避开的聚集物是小型和透明的(箭头)或极大和在形状方面不规则的,通常通过机械消化而获得(星形)。图7E显示对第56天共同表达NKX2.2(绿色)、SOX10(红色)和OLIG2(蓝色)的祖细胞的免疫荧光染色。图7F显示O4(绿色)活体染色,其显示细胞的高度分枝形态。图7G显示在分化结束时的MBP+(红色)少突胶质细胞(核用DAPI染色,蓝色)。图7H在较高放大倍数(64x)下显示MBP+(红色)少突胶质细胞的形态。MAP2+(绿色)和GFAP+(蓝色)细胞也存在于培养物中。图7I显示在分选之后24小时纯化O4+细胞仍然保留典型分枝形态。比例尺:500μm(图7A、7B、7G);200μm(图7C、7E、7F、7I);1mm(图7D)。
图8显示PPMS iPSC株系的产生和表征。图8A显示对PPMS株系的mRNA/miRNA重新编程,其显示在第7天的代表性皮肤纤维母细胞、在第12天明显的iPSC样集落、和在重新编程的第15天的TRA-1-60+集落。图8B显示PPMS-iPSC 102的多能性标志物的免疫荧光。图8C显示在体外通过类胚体达成自发性分化之后内胚层标志物AFP、中胚层标志物αSMA和外胚层标志物βIII-微管蛋白的免疫荧光。核用DAPI染色。图8D显示在将PPMS iPSC注射至免疫缺陷小鼠中之后体内畸胎瘤形成物的H&E染色切片,其显示来自腺组织(内胚层)、软骨(中胚层)和色素上皮(外胚层)的代表性结构。图8E显示未分化PPMS-iPSC和亲本纤维母细胞相对于hESC株系的多能性基因表达。ANPEP基因为纤维母细胞所特有。图8F显示细胞发生分析;所有PPMS-iPSC株系都显示正常核型。
图9显示对在iPSC株系的情况下畸胎瘤形成物的表征。代表性图片来自在将来自iPSC株系102的细胞移植至免疫缺陷小鼠中之后体内畸胎瘤形成物的内胚层(图9A)、外胚层(图9B)和中胚层(图9C)。
图10显示PPMS-iPSC在体外产生OPC和成熟少突胶质细胞。图10A-10I是PPMS iPSC的体外少突胶质细胞分化的依序步骤,其显示:在第8天的PAX6+细胞(A),在第12天的相差多层结构(B),在第12天的OLIG2+和NKX2.2+细胞(C),SOX10+OLIG2+早期OPC(D),对第73天O4+晚期OPC的活体成像(E),O4+细胞的用以突显分枝突起的剪修图像(F),在低(G)和较高(x64)放大倍数(H)下的终末分化的MBP+少突胶质细胞,少突胶质细胞培养物中的MAP2+细胞(I)。图10J显示在从RUES1和PPMS iPSC分化75天之后通过FACS分析对O4+细胞的定量。门控基于二级Ab-APC仅用于O4染色,并且PE缀合同种型对照用于PDGFRα染色(阴性)。总O4+细胞出现率(O4和++)显示于括号中。
图11显示在移植以进行体内研究之前对细胞的表征。图11A显示FACS图,其显示在生长在MEF上的iPSC株系中存在多能性标志物,并且在分化的第81天在细胞中缺乏相同标志物。图11B是显示在分离和低温保存以进行体内移植之前用于分选O4+细胞的更严格门控的图。图11C显示在48小时的恢复时期期间,在低温保存之后涂铺的O4+分选细胞的明视野图像。图11D显示在分选OPC的情况下的活体O4染色,其显示O4和适当分枝形态得以保留。
图12显示PPMS源性OPC移入并在体内分化成髓鞘形成性少突胶质细胞。图12A显示移植至新生颤抖/rag2小鼠中的人PPMS iPSC源性O4+OPC。在16周时,人细胞展现致密移入胼胝体中(hNA,红色)。许多已分化成MBP表达性少突胶质细胞(绿色),并且遍及胼胝体弥漫性分布。图12B是显示小鼠轴突(神经丝;NF,红色)和MBP+人少突胶质细胞(绿色)共同定位的共焦图像。图12C和图12D显示有髓鞘轴突的电子显微照片,其展现具有交替主致密线(箭头)和周期内线的特征性紧实髓磷脂。图12E显示移植的人细胞保留祖细胞特征,其中约80%的hNA+细胞表达OLIG2(绿色;16周)。图12F显示在16周时,个别NG2细胞已开始向上覆大脑皮质中迁移。图12G显示iPSC源性O4分选OPC在体内显示有限双潜力:发现仅少许GFAP+星形细胞接近于侧脑室。
图13显示已从其获得iPSC株系的MS患者和健康个体的人口统计信息。
图14显示皮肤纤维母细胞向iPSC的重新编程。图14A显示在重新编程的第3天,可见在它们的形态方面具有明显变化的纤维母细胞。图14B显示在第7天的使用nGFP mRNA加以评估的转染效率。图14C显示在第12天的iPSC样集落。图14D显示在无饲养层条件下扩增的iPSC克隆。
图15显示使用nanostring分析对iPSC株系的多能性的表征。图15A显示对源于MS患者或健康对照的3种hESC株系、2种纤维母细胞株系和5种iPSC株系的nanostring分析;iPSC株系不可与hESC株系区分。图15B显示体外自发性类胚体分化从所有胚层产生细胞。自左至右:AFP+内胚层细胞,Tuji1+外胚层细胞,aSMA+中胚层细胞。
图16显示一种用以了解多发性硬化症的方法。
发明详述
我们开发了一种用以使用化学成分确定的富含生长因子的培养基从PSC产生人少突胶质细胞的强力、快速和可再现的分化方案。我们的方案模拟发育期间的少突胶质细胞分化。在8天内,PSC分化成PAX6+神经干细胞,其至第12天产生OLIG2+祖细胞。OLIG2+细胞通过共同表达NKX2.2而大约在第18天变得定型成少突胶质细胞谱系,接着通过上调SOX10和PDGFRα而大约在第40天分化成早期OPC。表达由O4抗体识别的硫酸化糖脂质抗原的晚期OPC(O4+)大约在第50天出现,并且至分化的75天达到细胞群体的40-70%。O4+少突胶质细胞祖细胞可通过细胞分选来分离以进行髓鞘化研究,或可终末分化成成熟MBP+少突胶质细胞。我们的少突胶质细胞分化方案的时间轴显示于图1中。
基于由对啮齿动物脊髓胚胎发育的研究获得的知识选择我们利用来产生少突胶质细胞的信号传导路径。Hu等(2009a)。在体外,RA和SHH信号传导模拟pMN环境,从而诱导PSC分化成OLIG2祖细胞。在我们的培养中,通过Smoothened激动剂而非人重组SHH蛋白来活化SHH信号传导。我们发现使RA和SHH信号传导与活化素/nodal/TGFβ抑制(通过SB431542)和BMP4抑制(通过LDN193189)组合产生最高OLIG2+祖细胞产率。由于SB431542和LDN193189的协同作用,在第12天,超过70%的细胞表达OLIG2。这是我们的方案与Wang等(2013)的方案之间的关键差异。抑制活化素/nodal/TGFβ信号传导与BMP信号传导两者也被称为“双重SMAD抑制”。
在我们的方法与先前公开方案之间存在若干其它重要差异。举例来说,与悬浮培养相对比,我们在贴壁培养中开始在双重SMAD抑制的情况下进行神经诱导。Wang等(2013);Hu等(2009b);Nistor等(2005)。使用这个方法,我们在第0天仅以10,000个细胞/cm2起始,而仍然实现神经祖细胞的极大扩增,并且最终充足产生OPC。此外,发现我们掌握的最优RA浓度是约100nM,其比由其它小组使用的浓度低100倍。Gil,J.E.等,FEBS Letters 583:561–567(2009);Izrael等(2007);Nistor等(2005)。此外,在无外源性SHH的情况下用单独RA诱导惊人地产生庞大OLIG2+细胞群体。我们确认Smoothened激动剂是SHH的高效替代物,并且实际上显示我们掌握的优越功效(Stacpoole等2013)。此外,值得注意的是,我们的发明首次显示在不存在纤维母细胞生长因子(FGF)信号传导下通过RA来诱导OLIG2。已知RA和FGF信号传导的组合在鸡发育期间促进OLIG2表达,并且已用于人ESC与iPSC两者的体外分化。Pouya,A.等,PLoS One6:e27925(2011);Nistor等(2005);Novitch,B.G.等,Neuron 40:81-95(2003)。新近研究表明碱性FGF(bFGF)为腹侧前脑来源的少突胶质细胞的特化所必需,而它在来自脊髓的少突胶质细胞的特化期间抑制神经元分化。Stacpoole等(2013)。然而,我们已在我们的体外分化期间在不存在任何外源性FGF下获得高OPC产率。最后,在第12天细胞球体从贴壁培养转变成悬浮培养被证明是富集OLIG2+细胞群体,并且使我们的培养物的分化限定于少突胶质细胞谱系的关键步骤。
我们也提供首个证据表明可通过使PPMS患者皮肤纤维母细胞重新编程来获得髓鞘形成性少突胶质细胞。关于MS源性iPSC的唯一先前报道显示少突胶质细胞可在体外从来自单一35岁RRMS患者的整合性的逆转录病毒重新编程化iPSC株系分化。Song,B.等,Stem Cell Res.8:259–273(2012)。我们证明由源于来自两种性别而且年龄是50-62岁的PPMS患者的4种无整合iPSC株系的OPC达成的体内髓鞘化。因此,本发明不同于使用iPSC源性OPC的新近研究,其中我们的iPSC株系源于PPMS患者。此外,已使用晚期OPC标志物O4分选用于体内移植的细胞以最大程度限定分化潜力。尽管存在这些差异,但相较于先前报道的未分选iPSC源性OPC,PPMS源性O4+分选OPC展现类似移入效率,类似有丝分裂分数和类似比例的宿主包鞘轴突,同时产生较少GFAP+星形细胞。总之,我们的数据显示PPMS源性OPC在体内至少与健康iPSC源性细胞(Wang等,2013)同等高效,并且确定我们的iPSC获得和OPC诱导方案可从单患者样品产生髓鞘形成性少突胶质细胞,其可用于针对MS的自体细胞补充疗法中。
本发明的一特定实施方案是一种通过首先制备PSC集落来产生OLIG2+OPC的方法。在低密度下接种(涂铺)PSC,并且在贴壁培养中使其生长约1-2天。“低密度”意指约8,000至约11,000个细胞/cm2。优选在约9,500至约10,500个细胞/cm2下,更优选在10,000个细胞/cm2下接种细胞。在1-2天之后,PSC形成集落,其优选是直径约75μm至约300μm,更优选是直径约100μm至约250μm。
术语“PSC”具有它在本领域中的常用含义,即能够发育成内胚层、外胚层和中胚层细胞的自我复制性细胞。优选地,PSC是hPSC。PSC包括ESC和iPSC,优选是hESC和hiPSC。可将PSC接种在包含基质(诸如凝胶或基底膜基质)的表面上。一优选基质是由恩格布里斯-霍尔姆-斯旺(Engelbreth-Holm-Swarm,EHS)小鼠肉瘤细胞分泌的蛋白质混合物,以包括和的商标名销售。其它适合基质包括不限于胶原蛋白(collagen)、纤维结合蛋白(fibronectin)、明胶、层粘连蛋白(laminin)、聚赖氨酸、玻连蛋白(vitronectin)及其组合。
在其中培养PSC的培养基优选包含rho相关蛋白质激酶(ROCK)的抑制剂,例如GSK269962、GSK429286、H-1152、HA-1077、RKI-1447、噻唑威(thiazovivin)、Y-27632或其衍生物。
接着在包含低浓度的RA、至少一种TGFβ信号传导抑制剂和至少一种BMP信号传导抑制剂的培养基中以单层形式培养PSC集落至汇合,其中在这个培养基中培养的首日是第0天。“RA的低浓度”是约10nM至约250nM。RA的浓度优选是约10nM至约100nM、或约25nM至约100nM、或约20nM、30nM、40nM、50nM、60nM、70nM、80nM、90nM、以及优选约100nM或更小。TGFβ信号传导抑制剂包括例如GW788388、LDN193189、LY2109761、LY2157299和LY364947。TGFβ信号传导的一优选抑制剂是小分子SB431542。BMP信号传导的抑制剂包括例如DMH1、多索莫非(dorsomorphin)、K02288和诺金(Noggin)。BMP信号传导的一优选抑制剂是小分子LDN193189。
细胞在约第8天达到汇合并表达PAX6,此时在包含SHH或Smoothened激动剂和低浓度的RA的培养基中培养汇合细胞。Smoothened激动剂包括例如SAG和朴莫伐明(purmorphamine)。SHH可为重组人SHH。优选地,培养基缺乏SHH。从PSC转变成OLIG2+祖细胞伴有大量增殖,在理想情况下至约第12天,这导致培养物变得过度汇合,从而产生细胞形成性三维结构。“过度汇合”意指细胞开始彼此堆积,以致并非所有细胞都与培养表面完全接触,并且一些细胞完全不与培养表面接触,而是仅与其它细胞接触。优选地,至约第12天,至少约50%、60%或70%的过度汇合细胞为OLIG2+。
如果OLIG2+细胞将进一步分化成O4+细胞,那么从培养表面提升过度汇合细胞,此允许形成细胞聚集物或球体。OLIG2-细胞不形成聚集物,因此这个方法富集OLIG2+群体,而OLIG2-细胞在随后培养基更换期间被逐渐消除。出于本发明的目的,术语“聚集物”和“球体”可互换使用,并且是指优选但未必具有至少约100个细胞的多细胞三维结构。
提升可以机械方式用细胞刮削器或其它适合器具进行或以化学方式进行。化学提升可使用蛋白水解酶实现,所述蛋白水解酶例如胶原蛋白酶、胰蛋白酶、胰蛋白酶样蛋白酶、诸如以商标名销售的重组酶、诸如以商标名销售的天然源性酶及其组合。化学提升也可使用诸如EDTA的螯合剂或诸如尿素的化合物进行。机械提升或脱离提供细胞死亡最少的优势,然而,它产生大小可变的聚集物,因此需要通过手动挑选过程来选择适合球体。良好球体被确定为具有圆形、金色/棕色,具有暗色核心以及具有在约300μm与约800μm之间的直径的那些。使用诸如酶消化的化学方法使细胞脱离主要产生适于进一步培养的球体。因此,不需要手动挑选球体,并且可使脱离步骤适合于自动化并用于高通量研究中。然而,酶消化使细胞死亡增加,从而产生较低数目的球体。
我们进一步提供一种从OLIG2+OPC产生O4+OPC的方法。在包含Smoothened激动剂和低浓度的RA的培养基中悬浮培养OLIG2+OPC的三维聚集物约8天。可通过例如如上所述的本发明方法或通过本领域中已知的其它方法产生OLIG2+OPC。在包含Smoothened激动剂和RA的培养基中约8天之后,使培养基更换为包含PDGF、HGF、IGF-1和NT3以及任选胰岛素(优选约10μg/ml至约50μg/ml,更优选约25μg/ml)、T3(优选约20ng/ml至约100ng/ml,更优选约60ng/ml)、生物素(优选约50ng/ml至约150ng/ml,更优选约100ng/ml)和/或cAMP(优选约100nM至约5μM,更优选约1μM)的培养基。培养基优选缺乏bFGF和表皮生长因子(EGF)。如果OLIG2+细胞是通过本发明方法产生,那么悬浮培养优选开始于约第12天,并且在包含PDGF、HGF、IGF-1和NT3的培养基中培养优选开始于约第20天。
在包含PDGF、HGF、IGF-1和NT3的培养基中悬浮约10天之后,在贴壁培养中在约2个球体/cm2的密度下涂铺细胞聚集物。(这优选在约第30天,其中方法开始于在包含RA、至少一种TGFβ信号传导抑制剂和至少一种BMP信号传导抑制剂的培养基中培养PSC的第0天。)在其上涂铺和培养细胞聚集物的表面可包含细胞外基质蛋白质(例如胶原蛋白、纤维结合蛋白、层粘连蛋白)和/或带正电荷的聚氨基酸(例如聚精氨酸、聚赖氨酸、聚鸟氨酸)。优选地,表面包含层粘连蛋白和/或聚鸟氨酸。
在涂铺细胞聚集物后,可继续使用包含PDGF、HGF、IGF-1和NT3的培养基(选项A),或可使用包含AA并且缺乏生长因子(例如PDGF、HGF、IGF-1、NT3、bFGF和/或EGF)的培养基(选项B)。包含AA的培养基可任选包含胰岛素、T3、生物素和/或cAMP。至涂铺之后约45天,在包含PDGF、HGF、IGF-1和NT3的培养基中培养的细胞最优地为O4+。优选地,至涂铺之后约45天(第75天),这些细胞中的至少约35%、40%、45%、50%、55%、60%、65%、70%、75%或80%为O4+。至涂铺之后约25天,在包含AA的培养基中培养的细胞最优地为O4+。优选地,至涂铺之后约25天(第55天),这些细胞中的至少约20%、25%、30%、35%或40%为O4+。优选地,至涂铺之后约33天(第63天),这些细胞中的至少约30%、35%、40%、45%、50%、55%或60%为O4+。优选地,至涂铺之后约45天(第75天),这些细胞中的至少约35%、40%、45%、50%、55%、60%、65%、70%或75%为O4+。
可通过在不存在PDGF、HGF、IGF-1和NT3下培养O4+OPC约3周直至细胞为MBP+来产生表达髓磷脂碱性蛋白的成熟少突胶质细胞。优选地,在缺乏PDGF、HGF、IGF-1和NT3的培养基中培养约20天之后,至少约20%、25%、30%、35%、40%或45%的O4+OPC为MBP+。这对于“选项A”细胞发生在约第95天,而对于“选项B”细胞发生在约第60天。培养“选项B”细胞直至至少约第75天导致MBP+表达性细胞的效率较高。
本发明也涵盖通过本发明方法产生的OPC、少突胶质细胞和髓磷脂产生性细胞以及包含它们的非人哺乳动物,优选是小鼠和/或大鼠。髓磷脂产生性细胞是产生髓磷脂的任何细胞,包括不限于少突胶质细胞。在一些实施方案中,髓磷脂产生性细胞从PSC分化,并且在所述实施方案中,PSC可为iPSC。iPSC可源于受试者的体细胞。在一个方面,受试者患有脱髓鞘或髓鞘形成障碍疾病或病症。
在一个方面,本发明提供一种用于从患有MS,特别是PPMS的患者产生病毒性和无整合iPSC的方法。我们的分化方案可用于使所述iPSC高效分化成OPC和功能性少突胶质细胞,如由颤抖小鼠中的体内髓鞘化所证明。
本发明也提供一种关于神经疾病,优选脱髓鞘或髓鞘形成障碍疾病或病症的模型系统。在一个方面,模型系统包含从源于患有脱髓鞘或髓鞘形成障碍病状的受试者的iPSC分化的髓磷脂产生性细胞。模型系统可进一步包含已向其中移植髓磷脂产生性细胞的非人哺乳动物。在一个实施方案中,非人哺乳动物是小鼠或大鼠。由本发明提供的模型系统可用于研究脱髓鞘或髓鞘形成障碍疾病或病症,包括了解潜在机理以及确定治疗靶标。
本发明也提供用于通过根据本发明方法产生OPC或少突胶质细胞;以及向受试者施用有效量的所述细胞来治疗和/或预防所述受试者的神经疾病或病症的方法。一旦被移植,少突胶质细胞或已在体内分化成少突胶质细胞的OPC即促进受试者的神经系统中的髓鞘形成。因此,本发明提供本发明的OPC或少突胶质细胞治疗和/或预防受试者的神经疾病或病症的用途。神经疾病或病症可为脱髓鞘或髓鞘形成障碍疾病或神经退化性疾病。神经疾病或病症可影响中枢神经系统、外周神经系统或两者。在一些实施方案中,脱髓鞘或髓鞘形成障碍疾病是炎症性脱髓鞘疾病(诸如多发性硬化症、视神经炎、德维克病(Devic disease)、急性散播性脑脊髓炎和横贯性脊髓炎)、病毒性脱髓鞘、由获得性代谢病症引起的脱髓鞘、脑白质营养不良(包括髓鞘形成不足疾病,诸如佩利措伊斯-梅茨巴赫病和遗传性痉孪性截瘫)、X染色体关联的蛋白脂质蛋白产生病症、代谢脱髓鞘和溶酶体贮积病症(诸如异染性脑白质营养不良-MLD、泰-萨克斯病(Tay-Sachs disease)、山多夫氏病(Sandhoff's disease)和克拉伯氏病(Krabbe's disease))、白质消融性疾病和脑室周围白质软化。MS以及特别是PPMS也是可通过本发明方法治疗或预防的病状。在一优选实施方案中,通过本发明方法产生的OPC或少突胶质细胞源于从受试者的体细胞产生的iPSC。
与它用于自体细胞移植的潜力一起,iPSC技术正作为一种用于开发新药以及获得对疾病发病机理的见地的工具而出现。Han,S.S.W.等,Neuron.70:626-644(2011)。本发明的方法和细胞将辅助开发对促进髓鞘化的化合物的高通量体外筛选。Lee,S.等,Nat Protoc.8:771-782(2013)。为此,我们提供一种鉴定促进髓鞘化的化合物的方法,所述方法包括通过本发明方法产生髓磷脂产生性细胞;使所述髓磷脂产生性细胞与候选化合物接触;以及确定所述候选化合物是否促进神经元髓鞘化。在一个实施方案中,化合物是用于治疗神经疾病或病症,诸如脱髓鞘或髓鞘形成障碍病状的候选治疗剂,并且方法包括确定所述候选治疗剂是否对神经元髓鞘化具有有益作用,其中所述有益作用指示候选治疗剂供治疗脱髓鞘或髓鞘形成障碍疾病或病症使用。有益作用可为例如防止神经元脱髓鞘,降低神经元脱髓鞘,增加神经元传导性和/或增强神经元髓鞘化。优选地,以高通量形式执行方法。
本发明的细胞、系统和方法也可适用于研究神经疾病。特定来说,此处所述的PPMS iPSC株系提供一种用以探究神经退化过程,特别是MS中的神经退化过程的新资源(图16)。
除非上下文另外明确规定,否则如本说明书和随附权利要求中所用,单数形式“一”和“所述/该”包括复数个指示物。术语“一”以及术语“一个(种)或多个(种)”和”至少一个(种)”可互换使用。
此外,“和/或”应视为特定公开两个指定特征或组分中的各个,伴有或不伴有另一个。因此,如诸如“A和/或B”的短语中所用的术语“和/或”意图包括A和B、A或B、A(单独)和B(单独)。同样,如诸如“A、B和/或C”的短语中所用的术语“和/或”意图包括A、B和C;A、B或C;A或B;A或C;B或C;A和B;A和C;B和C;A(单独);B(单独);和C(单独)。
除非另外定义,否则本文所用的所有技术和科学术语都具有与由本发明所相关领域中的普通技术人员通常理解相同的含义。举例来说,The Dictionary of Cell and Molecular Biology(第5版J.M.Lackie编,2013)、Oxford Dictionary of Biochemistry and Molecular Biology(第2版R.Cammack等编,2008)以及The Concise Dictionary of Biomedicine and Molecular Biology,P-S.Juo,(第2版2002)可提供技术人员以本文所用的一些术语的一般性定义。
单位、前缀和符号以它们的国际单位制(Système International de Unites;SI)接受形式表示。数值范围包括界定范围的数值。本文提供的标题并非是对本发明的各个方面或实施方案的限制,所述各个方面或实施方案可通过参考说明书整体而得到。因此,通过参考说明书整体,以下紧接着定义的术语得以更充分阐释。
每当以措辞“包含”描述实施方案时,包括以“由…组成”和/或“基本上由…组成”描述的另外类似实施方案。
就“受试者”或“个体”或“患者”来说,其意指需要诊断、预后或疗法的任何受试者,特别是哺乳动物受试者。哺乳动物受试者包括人、家养动物、农场动物、体育动物和动物园动物,包括例如人、非人灵长类动物、狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、猪等。
诸如“治疗”或“用以治疗”或“缓和”或“用以缓和”的术语是指治愈、减缓、减轻诊断的病理性病状或病症的症状和/或使诊断的病理性病状或病症的进展停止的治疗措施。因此,需要治疗者包括已患有病症的那些。在某些实施方案中,如果患者显示与疾病或病症相关的症状例如完全、部分或短暂缓和或消除,那么受试者的神经疾病或病症,特别是脱髓鞘或髓鞘形成障碍疾病或病症根据本文提供的方法得以成功“治疗”。
“预防”是指防止和/或减缓所靶向的病理性病状或病症的发展的防治性或预防性措施。因此,需要预防者包括易患或易感于疾病或病症的那些。在某些实施方案中,如果相比于尚未经受本发明方法的患者,患者短暂或永久显现较少或严重性较小的与疾病或病症相关的症状,或较晚发作与疾病或病症相关的症状,那么神经疾病或病症,特别是脱髓鞘或髓鞘形成障碍疾病或病症根据本文提供的方法得以成功预防。
本发明进一步描述于以下非限制性实施例中。
实施例
实施例1.少突胶质细胞从hESC株系分化
我们使用OLIG2-GFP敲入hESC报道体株系(Liu等,2011)来通过活体荧光成像追踪OLIG2+祖细胞。首先,我们在贴壁培养中使用双重SMAD信号传导抑制来诱导PAX6+细胞。Chambers,S.M.等,Nat Biotechnol.27:275-80(2009)。接着,为模拟胚胎脊髓环境,我们在各种时间施加不同浓度的RA和/或SHH,并且通过流式细胞计量术定量OLIG2-GFP表达(图2A)。从诱导开始施加100nM RA产生40.6%的OLIG2+祖细胞,而从第8天开始在100ng/ml下添加SHH使产率增加至57.7%(图2B)。引起关注的是,在前12天期间无外源性SHH的细胞显示SHH mRNA上调(图3A),并且分化成O4+细胞,但相较于用SHH处理的细胞,效率较低(图3B)。
我们接着用SAG替换重组人SHH蛋白,此使产率进一步增加至70.1%OLIG2+祖细胞(图2B)。在第12天,使细胞脱离并放置至低附着板中以促进它们聚集成球体。为形成球体所需的最小细胞数目是至少100个细胞,并且我们注意到球体中的大多数细胞为GFP+。为对此进行进一步探究,我们关于GFP分选第12天培养物,并且观察到仅GFP+细胞形成聚集物(图2C)。这表明单独聚集步骤提供OLIG2+群体富集。
接着,我们通过使第二hESC株系(RUES1)分化,以及通过qRT-PCR比较PAX6、OLIG2和NKX2.2的转录物水平来验证初始步骤朝向OLIG2+祖细胞的产生。这些转录因子的上调遵循与OLIG2-GFP株系的时序样式类似的时序样式,其中PAX6诱导大约第7天,OLIG2峰值大约第13天,并且NKX2.2的可持续高水平在第10天之后(图2D)。基于这些结果,我们使用非遗传修饰的RUES1株系来开发方案的从OLIG2+祖细胞至MBP+成熟少突胶质细胞的随后步骤(图4A)。PAX6+细胞在第7天产生,并且至第12天,它们排列成多层结构(图4B、4C)。从第12天至第30天,使细胞以球体形式生长,接着涂铺于聚L-鸟氨酸/层粘连蛋白(pO/L)涂布的培养皿上以进行方案的其余部分。
为促进朝向O4+阶段成熟,从第20天开始,添加PDGF-AA、HGF、IGF1和NT3至培养基中。OLIG2+祖细胞上调NKX2.2,接着上调SOX10,并且最终成熟成晚期OPC,通过O4活体染色以及通过它们的高度分枝突起所鉴定(图4D-4G)。表达OLIG2、SOX10和NG2的O4+OPC(图4H-4J)早在第50天即出现,并且它们的数目大约第75天显著增加。在分化期间,40-50%的祖细胞具有增殖性,如通过Ki67染色所指示。然而,高度分枝的O4+细胞在体外不分裂(图5A-5C)。另外,在从培养基撤除生长因子之后,34±4%的O4+OPC持续至少2周分化成MBP+成熟少突胶质细胞(图4K-4L、图5D)。这些培养物也由其它细胞类型,即总细胞的分别15±2%GFAP+星形细胞和20±2%MAP2+神经元组成(图4M、图5E)。
我们也使用替代性策略来在仅培养55天之后产生约30%O4+细胞,从而显著降低分化时长和成本。早在第30天即从培养基撤除有丝分裂原PDGF、NT3、IGF-1和HGF,此时接种所选球体。这导致在第55天出现O4+细胞。继续培养以使O4+细胞的出现率增加至与较长久方案类似的水平(图6)。
如表1中所示,在9种不同PSC株系的情况下,O4效率在28%至80%的范围内,并且在4种株系中的平均值大于60%。用O4抗体染色细胞,并且通过流式细胞计量术来分析。测试1种hESC株系(RUES1)和8种hiPSC株系。使用不同批次的各株系在不同继代下进行技术平行测定。结果也表示为平均百分比±SEM。
表1.在约75天分化之后的O4+OPC百分比
N=技术重复测定的数目
在两种策略中,撤除有丝分裂原均驱动OPC终末分化成表达MBP的少突胶质细胞,但在这些培养条件下MBP+细胞不与轴突纤维对准(图7G、7H)。对于髓鞘化研究,可通过荧光激活的细胞分选(FACS)纯化O4+OPC,并且在体内进行移植。也可在分选之后立刻低温保存O4+细胞,并且在移植之前24-48小时解冻。
如上所述,在方案的各个阶段,通过qRT-PCR或免疫荧光来检查培养物的适当标志物的表达。当在第8天关于PAX6(图7A)以及在第12天关于OLIG2和NKX2.2(图7C)对培养物进行免疫荧光分析时,出现率应大于90%(对于PAX6+细胞)、70%(对于OLIG2+细胞)和30%(对于OLIG2+/NKX2.2+细胞)。至第40-50天,SOX10应被表达,并且应与OLIG2和NKX2.2共同定位(图7E)。第50至75天,可进行活体O4染色以检测O4+细胞的出现和它们的扩增(图6A-6F、图7F)。在人发育中,OPC的特征在于表达PDGFRα和NG2,随后表达O4。Jakovcevski,I.等,Front Neuroanat.3:5(2009)。在我们的培养条件下,至第75天,大多数O4+细胞已丧失PDGFRα,但已保留NG2表达。在这个阶段,我们未在培养中观察到任何残余多能细胞。
最后,O4+细胞可通过FACS分离,或进一步分化成MBP+少突胶质细胞(图7G、7H)。其它细胞类型也存在于第75天培养物中,但百分比较低。我们通常发现占总细胞群体的约15%的GFAP+细胞和约20%βIII-微管蛋白+细胞(图7H)。在最终分化步骤之后,当在神经胶质培养基中培养细胞2周时,约35%的O4+细胞也应表达MBP。
实施例2.少突胶质细胞从PPMS-iPSC株系分化
为显示我们的方案可应用于iPSC株系,我们从4名PPMS患者获得皮肤活检体。从活检体建立纤维母细胞培养物,并且使用以修饰的mRNA的混合物(Warren等,Cell Stem Cell.7:618-30(2010))以及一组用以改进最难应对的株系的重新编程效率的miRNA(Stemgent)进行的每日转染来产生iPSC。从重新编程的第12天至第15天,通过活体染色来鉴定TRA-1-60+集落(图8A),挑选,扩增,并且通过免疫荧光来表征其多能性标志物(图8B)。
对7个多能性基因的表达剖析确认所有4种iPSC株系都展现与参照hESC株系类似的,以及与亲本纤维母细胞相异的概况(图8C)。所有iPSC株系都显示正常核型(图8D),并且能够在体外通过自发性类胚体分化(图8E),以及在体内通过畸胎瘤测定(图8F;图9)分化成具有3个胚层的细胞类型。
接着,我们评估方案是否可用我们的PPMS-iPSC株系再现。发现所有测试iPSC株系的表现都与RUES1株系类似(图10A-10I)。方案是极度可再现的和高度高效的,如由分选的O4+OPC的出现率所计算,其中从RUES1获得多达70%O4+细胞,并且从PPMS iPSC株系获得43.6%-62.1%。另外,我们发现O4+部分含有伴有PDGFRα的双重阳性细胞的子群体(图10J)。O4+细胞可易于通过荧光激活的细胞分选(FACS)纯化,冷冻以及解冻,而不丧失它们的形态(图11D)。
实施例3.由PPMS源性晚期OPC对小鼠脑进行轴突髓鞘化
为验证通过我们的方案获得的OPC具有髓鞘形成功能,我们将第75天FACS纯化O4+细胞(105个细胞/动物)注射至新生免疫损害颤抖小鼠的前脑中(图11A)。注射的细胞中的任何污染iPSC都被清除,如通过对多能性标志物SSEA4和TRA-1-60的流式细胞计量术分析所示(图11B)。然而,我们在体内移植之前纯化我们的培养物以保留用于向临床研究转化的潜力。将细胞冷冻,解冻,并且在移植之前使其恢复24-48小时(图11C)。在12-16周处死动物,此时人hNA+细胞遍及胼胝体和前脑白质加以分布。在12周时,胼胝体中的hNA+细胞密度是34,400±3,090个细胞/mm3,并且至16周,人细胞的数目已从12周以来近似加倍。我们未观察到存在细胞团或明显肿瘤发生,并且在12周时,移入的hNA+细胞的增殖分数是17%,并且在16周时,降低至仅8%Ki67+,此时仅5%的细胞为PCNA+。重要的是,胼胝体中超过80%的hNA+细胞共同表达OLIG2蛋白,从而表明移入的细胞限定于少突胶质细胞谱系(图12E)。此外,发现在12和16周时,人MBP+少突胶质细胞弥漫性遍及移入的胼胝体(图12A)。在16周时,在移入的小鼠胼胝体内,31±3%的宿主小鼠轴突被包鞘(图12B)。
对16周龄胼胝体的透射电子显微术检查揭示存在交替主致密线和周期内线的成熟紧实髓磷脂(图12C、12D);而未注射的颤抖/rag2小鼠具有稀薄和松散覆盖的髓磷脂。同样,如通过g比率测量结果评估的髓磷脂包鞘厚度反映若干胼胝体轴突中正常髓磷脂的恢复。
在12周时,移植的hNA+细胞在胼胝体中保持为NG2+OPC(图12E),并且至16周,它们开始向上覆大脑皮质迁移(图12F)。极少数O4分选细胞经受分化而成为hGFAP+星形细胞,并且大多数hGFAP+细胞定位于SVZ以及在脑室周围(图12G),从而表明局部环境可诱导这些区域中的星形细胞分化。类似地,hNESTIN表达性细胞很少见于胼胝体中,并且同样集中在SVZ中。重要的是,未在任何移入动物中检测到βIII-微管蛋白+神经元。总之,我们的数据证明PPMS源性O4分选细胞能够在体内达成成熟少突胶质细胞分化以及形成类似于脑中正常髓磷脂的致密紧实髓磷脂。
实施例4.实施例1-3的详细实验程序
细胞系
使用3种hESC株系和4种hiPSC株系。RUES1和HUES 45均是NIH核准的hESC株系;OLIG2-GFP报道体株系源于BG01hESC株系(University of Texas Health Science Center at Houston)。4种iPSC株系在我们的实验室中通过mRNA/miRNA方法(Stemgent)而由PPMS患者的皮肤活检体获得。
hPSC培养条件
用HUESM(人胚胎干性培养基(HUman Embryonic Stem Medium))培养基和10ng/ml bFGF(Stemcell Technologies)于小鼠胚胎纤维母细胞(MEF)层上培养和扩增hESC和hiPSC株系。对于少突胶质细胞分化,使细胞适应于在涂布的培养皿和mTeSR1培养基(Stemcell Technologies)上培养。HUESM由全都购自Life Technologies(Grand Island,NY)的Knockout-DMEM、20%Knock-out血清、2mM glutamax、0.1mM NEAA、1X P/S和0.1mMβ-巯基乙醇组成。在所有分化阶段,细胞都在5%CO2孵育器中加以培养。
详细分化方案
将PSC于含有10μM ROCK抑制剂Y-27632(Stemgent;Cambridge,MA)的mTeSR1培养基(Stemcell Technologies;Vancouver,BC,Canada)中在10x103个细胞/cm2的密度下涂铺在(BD Biosciences;San Jose,CA)上24小时。涂铺的hPSC的这个密度是优化的以至第8天产生汇合孔,并且在分化的第12天产生多层结构。这个设置不需要大量PSC扩增,因为6孔板的仅1个孔(80%汇合)含有足以分化和分离至少2x106个少突胶质细胞的细胞。孵育细胞1-2天,直至hPSC集落达到100-250μm的直径。
在分化诱导当天(第0天),将培养基变换为神经诱导培养基,其是含有10μM小分子SB431542(Stemgent)和250nM LDN193189(Stemgent)以及100nM全反式RA(Sigma-Aldrich;St.Louis,MO)的mTeSR定制培养基(Stemcell Technologies)。mTeSR定制培养基与可商购获得的mTeSR-1培养基具有相同组成,但不具有5种维持多能性的因子,即氯化锂、GABA、哌啶酸、bFGF和TGFβ1(Stemcell Technologies)。替代mTeSR定制培养基,我们也可使用添加约25μg/ml胰岛素的DMEM/F12。每日进行培养基更换直至第8天,其中每天添加新鲜RA、SB431542和LDN193189至培养基中。
至第8天,细胞应达到汇合,并且PAX6表达应处于它的峰值(图7A)。在第8天,将培养基变换为含有100nM RA、1μM SAG(EMD Millipore;Billerica,MA)或100ng/ml rhSHH(R&D Systems;Minneapolis,MN)的N2培养基,每日更换,其中每天添加新鲜RA和SAG至培养基中。
至第12天,过度汇合细胞进行堆积,并且3D结构明显可见(图7B);这是继续进行分化之前的重要检查点。细胞表达OLIG2和NKX2.2(图7C)。在第12天,以机械方式或以酶法使粘着细胞脱离以允许形成球体。球体形成使OLIG2+祖细胞富集。仅OLIG2+细胞聚集成球体,而OLIG2-细胞保持为单细胞。使用机械单层分散,我们获得最高数目的球体,并且最终获得最高数目的O4+细胞。使用酶促单层分散,我们以较低数目获得更均一球体。对于机械脱离,使用细胞提升器使细胞脱离,所述提升器将单细胞层破坏成小团块以使营养物可到达聚集物内的所有细胞。在显微镜下检查各孔以确保无细胞保持附着。对于酶消化,添加(1ml/2ml DMEM/F12培养基)至各孔中以使培养物解离成单细胞混悬液。
将聚集物于含有1μM SAG的N2B27培养基中再涂铺至超低附着板中,每隔一天更换培养基。在第20天,将培养基变换为PDGF培养基,并且每隔一天进行2/3培养基更换。在培养基更换期间,使用温和吸移来使彼此粘着的任何聚集物分开。在第30天,将球体在2个球体/cm2的密度(6孔板中每孔约20个球体)下涂铺于用聚L-鸟氨酸氢溴酸盐(50μg/ml;Sigma-Aldrich)和层粘连蛋白(20μg/ml;Life Technologies)涂布的板上。这个密度是优化的以允许细胞从球体向外迁移,增殖并到方案结束时扩散至整个培养皿而无需传代。我们使用p200吸移器来挑选具有300与800μm之间的直径,具有暗色中心的圆形、金色/棕色聚集物(图7D)。我们避开完全透明的球体,因为这些不分化成少突胶质细胞。
在这个阶段,在含有有丝分裂原的培养基中(选项A)或在无任何有丝分裂原的培养基中(选项B)培养涂铺的球体。选项A是优化的以获得最高O4+细胞产率,而选项B被开发来提供方案的较短时和成本较小形式。
选项A
在第30天将球体于PDGF培养基中涂铺在如上所述的pO/L板上,每隔一天更换2/3的PDGF培养基直至分化的第75天。从第55天开始,通过活体O4染色来评估O4+细胞的出现(图6)。在第75天,可通过FACS分离O4+OPC(图7I)。或者,对于终末少突胶质细胞分化(图7G、7H),从第75天开始在神经胶质培养基中培养细胞,每3天更换2/3的培养基,持续2周。
选项B
在第30天将球体于神经胶质培养基中涂铺在如上所述的pO/L板上,每隔一天更换2/3的神经胶质培养基直至分化的第55天。在第55天,O4+细胞通过活体O4染色来显像(图6A-F、图7F)或通过FACS分离(图6G)。在第75天,可通过FACS分离O4+OPC。或者,使培养物保持在神经胶质培养基中直至第75天以增加O4+细胞的效率(图6)。我们在约第60天开始观察到MBP+细胞。
对于选项A方案与选项B方案两者,在第30天的聚集物和在分化结束时的细胞均可以活力>70%加以低温保存。聚集物的活力基于在解冻之后重新附着于pO/L涂布的培养皿上的解冻球体的数目。可在分选之后立刻冷冻分选的O4+细胞。分选的O4+细胞的预期解冻后活力是70–80%。
表2提供用于方案中的培养基组成的清单。
表2.详细培养基组成
从穿孔活检体获得皮肤纤维母细胞
从MS患者和健康个体获得皮肤活检体(图13)。根据标准诊断准则,纽约蒂施多发性硬化症研究中心(Tisch Multiple Sclerosis Research Center of New York)的4名去识别化患者被诊断有PPMS。在机构审查委员会核准(BRANY)和知情同意书后获得他们的活检体。所有患者都是高加索人。患者102和107是男性,分别是56和61岁;患者104和109是女性,分别是62和50岁。
将3mm的皮肤活检体收集在由RPMI 1460(Life Technologies)和1X抗生素-抗霉菌素(Life Technologies)组成的活检体收集培养基中。将活检体切成较小断片(<1mm),并且涂铺于TC处理的35mm培养皿上5分钟以进行干燥,并且最后将它们在由Knockout DMEM、2mM GLUTAMAXTM、0.1mM NEAA、0.1mMβ-巯基乙醇、10%胎牛血清(FBS)、1X青霉素-链霉素(P/S;全都来自Life Technologies)和1%核苷(EMD Millipore)组成的活检体涂铺培养基中孵育5天或直至最早纤维母细胞从活检体长出。或者,在37℃下用1000U/ml胶原蛋白酶1A(Sigma-Aldrich)消化活检体1.5小时,洗涤,收集,并且于活检体涂铺培养基中涂铺于1%明胶涂布的35mm培养皿上5天。接着在由DMEM(Life Technologies)、2mM GLUTAMAXTM、0.1mM NEAA、0.1mMβ-巯基乙醇、10%FBS和1X P/S组成的培养基中扩增纤维母细胞,每隔一天更换培养基。
皮肤纤维母细胞的重新编程
使用Stemgent mRNA/miRNA试剂盒使处于3至5代的皮肤纤维母细胞重新编程,所述试剂盒导致通过OCT4、SOX2、KLF4、cMYC和LIN28的修饰RNA来产生无整合无病毒人iPSC(图14)。已发现添加一组特定miRNA会增加重新编程的效率(Stemgent)。简要来说,将纤维母细胞于培养基中以5.5x103个细胞/cm2密度涂铺于基质胶涂布的6孔或12孔板上。次日,用含有B18R的NuFF条件化Pluriton重新编程培养基替换培养基。使用STEMFECTTM如下连续11天转染细胞:第0天,仅miRNA;第1天至第3天,仅mRNA混合物,第4天,miRNA加mRNA混合物;第5天至第11天,仅mRNA混合物。在第11天之后,挑选活体TRA-1-60染色阳性可见集落,并且在使用HUESM培养基的情况下再涂铺在MEF上。
畸胎瘤测定
根据由哥伦比亚机构动物护理和使用委员会(IACUC)核准的方案进行实验。
使用胶原蛋白酶(Sigma-Aldrich)在37℃下使iPSC集落解离15分钟,洗涤,收集,并且再混悬于200μl HUESM中。接着使细胞与200μl MatrigelTM(BD Biosciences)在冰上混合,并且皮下注射至免疫缺陷小鼠(Jackson Laboratory;Bar Harbor,ME)中。使畸胎瘤生长9–12周,通过解剖加以分离,并且在4℃下于4%PFA中固定过夜。使固定组织包埋在石蜡中,以10μm厚度切片,并且用苏木精和曙红(H&E)染色。
体外自发性分化
用(Life Technologies)在37℃下使iPSC解离5分钟,并且于无bFGF的HUESM中接种至超低附着6孔板中,每隔一天更换培养基。在培养3周之后,将类胚体(EB)涂铺于1%明胶涂布的TC处理培养皿上,再持续2周。在室温下将EB和它们的外生长物于4%PFA中固定8分钟,并且针对适当标志物进行免疫染色。
RNA分离和qRT-PCR
使用含QIAshredder的RNeasy Plus小型试剂盒(Qiagen;Hilden,Germany)进行RNA分离。简要来说,集结细胞,用PBS洗涤,并且再混悬于溶解缓冲液中。接着将样品储存在-80℃下直至根据制造商说明书进一步处理。将RNA洗脱于30μl无RNA酶ddH2O中,并且用NanoDrop 8000分光光度计(Thermo Scientific;Somerset,NJ)定量。
对于qRT-PCR,使用GoScriptTM逆转录系统(Promega;Madison,WI),用0.5μg RNA和随机引物合成cDNA。接着将20ng cDNA连同10μl qPCR主混合物和1μl各引物(10nM)一起以20μl反应形式装载至96孔反应板中,并且在Stratagene Mx300P qPCR系统(Agilent Technologies;Santa Clara,CA)中操作所述板。表3列出引物序列。
表3.用于qRT-PCR的引物的序列
对多能性的Nanostring分析
如先前所述从未分化iPSC和hESC HUES45分离RNA。装载RNA(100ng/样品)以用于根据制造商说明书与特定报道体编码组和捕集探针组(NanoString Technologies;Seattle,WA)杂交。相对于以下持家基因使数据标准化:ACTB、POLR2A、ALAS1。数据表示为相对于hESC株系的表达的倍数变化(HUES45=1)。参见图15。
核型确定
所有iPSC株系都经受由Cell Line Genetics进行的细胞发生分析以确认正常核型。
免疫染色和成像
将细胞于PBS-T(含有0.1%曲通(Triton)-X100的PBS)中洗涤3次,每次10分钟,在阻断血清(含5%山羊或驴血清的PBS-T)中孵育2小时,并且在4℃下施加初级抗体过夜(表4)。次日,将细胞于PBS-T中洗涤3次,每次15分钟,与二级抗体一起在室温(RT)下孵育2小时,于PBS-T中洗涤3次,每次10分钟,用DAPI在室温下复染15分钟,并且于PBS中洗涤2次。InvitrogenTM Alexa Fluor二级抗体山羊或驴抗小鼠、大鼠、兔、山羊和鸡488、555、568和647在1:500稀释度下加以使用(Life Technologies)。
使用配备有针对荧光的Olympus DP30BW黑白数码相机和针对H&E染色的DP72数码彩色相机的Olympus IX71倒置显微镜获得图像。使用Olympus软件DP Manager或用ImageJ以数码方式施加荧光色。对于计数,将至少3个非重叠区域输入ImageJ,设定阈值,并且手动评分。
流式细胞计量术
通过在37℃下进行处理25分钟来以酶法收集细胞以获得单细胞混悬液。接着将细胞再混悬于100μl的它们的含有适量初级抗体或荧光缀合抗体的相应培养基中,并且在冰上避光孵育30分钟。当使用二级抗体时,用PBS洗涤初级抗体,并且在冰上施加二级抗体30分钟。染色的细胞或GFP表达性细胞用PBS洗涤,并且立刻在使用100μm陶瓷喷嘴和20psi的5激光器BD Biosciences ARIA-IIuTM细胞分选仪上分选。DAPI用于排除死细胞。使用BD FACSDivaTM软件分析流式细胞计量术数据。
向颤抖(shi/shi)x Rag2-/-小鼠中移植。
所有使用颤抖/rag2小鼠(University of Rochester;Windrem,M.S.等,Cell Stem Cell.2:553-565(2008))的实验都根据由水牛城大学机构动物护理和使用委员会(IACUC)核准的方案进行。使先前已低温保存的FACS分选O4+OPC解冻,并且在手术之前通过于PDGF培养基中涂铺在pO/L培养皿上来使其恢复1-2天。通过在每μl 1x105个细胞下再混悬细胞来制备注射用细胞。
如先前所述进行注射。Sim,F.J.等(2011)。使用低温使幼仔麻醉,并且在两侧各部位中在1.1mm的深度下将5x 104个细胞注射至出生后2-3天幼仔的胼胝体中。通过牵拉式玻璃吸移器注射细胞,穿过头颅直接插入推定靶标部位中。在12-16周,将动物处死并依次用盐水和4%多聚甲醛灌注。切割小鼠前脑的低温保存冠状切片(16μm),并且每160μm进行取样。Sim,F.J.等(2011)。用小鼠抗人核(hNA)鉴定人细胞,并且用MBP标记髓磷脂碱性蛋白表达性少突胶质细胞。人星形细胞和OPC用分别针对hGFAP和hNG2的人特异性抗体染色。用SMI311和SMI312的1:1混合物染色小鼠神经丝(NF)。InvitrogenTM Alexa Fluor二级抗体山羊抗小鼠488、594和647在1:500稀释度下加以使用(Life Technologies)。对于透射电子显微术,如先前所述处理组织。Sim,F.J.等,Molec.Cell.Neurosci.20:669-682(2002)。表4提供所用初级抗体的清单。
表4.初级抗体
参考文献
除本公开的其它章节中引用的文件之外,以下参考文献也可提供额外背景。本公开中引用的所有参考文献都据此以引用的方式整体并入本文。此外,本文引用或提及的任何产品的任何制造商说明书或目录都以引用的方式并入本文。以引用的方式并入本文本的文件或其中任何教义可用于实施本发明。以引用的方式并入本文本的文件不被承认是先前技术。
Antel,J.等,Acta Neuropathol.123:627–638(2012).
Boulting,G.L.等,Nat.Biotechnol.29:279-286(2011).
Hauser,S.L.等,Ann Neurol.74:317-327(2013).
Hu,Z.等,Differentiation 78:177-184(2009).
Miller,R.H.等,J.Neurosci.Res.76:9-19(2004).
Patani,R.等,Nature Communications 2:214(2011).
Rice,C.M.等,J.Neurol.Neurosurg.Ps.84:1100–1106(2013).
Tomassy,G.S.等,Frontiers Cell.Neurosci.8:201(2014).
Yamada M.等,Nature 510:533-536(2014).
***
对特定实施方案的先前描述将充分揭示本发明的一般特性以致他人可在不脱离本发明的一般概念下,在不进行过度实验下,应用属于本领域中的人士的普通技能的知识来容易地修改和/或改适所述特定实施方案以达成各种应用。因此,基于本文呈现的教义和指导,所述改适和修改意图在公开的实施方案的等效物的含义和范围内。应了解本文的措辞或术语是出于描述而非限制目的,因此本说明书的术语或措辞应由熟练技术人员根据教义和指导加以解释。通过以下权利要求来进一步描述本发明。
序列表
<110> 纽约干细胞基金会有限公司
V•福萨蒂
P•道瓦拉斯
<120> 源于多能干细胞的功能性少突胶质细胞及其制备和使用方法
<130> NYSC1250-1WO
<150> US 62/002,048
<151> 2014-05-22
<160> 10
<170> PatentIn 3.5版
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 1
tttgcccgag aaagactagc 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 2
catttggccc ttcgattaga 20
<210> 3
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 3
tgcgcaagct ttccaagat 19
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 4
cagcgagttg gtgagcatga 20
<210> 5
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 5
gacaactggt ggcagatttc gctt 24
<210> 6
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 6
agccacaaag aaaggagttg gacc 24
<210> 7
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 7
atctgcaccg gcccagctac t 21
<210> 8
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 8
ccaccgcgaa ggccccaaat a 21
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 9
aaacaccgga gcggacaggc 20
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 10
ggtcgcggtc agacgtggtg 20
- 还没有人留言评论。精彩留言会获得点赞!