釉质产品和使用方法与流程
本申请要求于2014年4月27日提交的美国临时申请号61/984,814的申请日的权益。
发明领域
本发明涉及可用于成型为修复性牙科产品和骨骼假体(包括用于修复牙面缺陷(例如腭裂)的假体)的釉质产品。所述釉质产品还可用于替换已经被创伤或疾病损坏的其它骨骼的部分和用于整容手术。用于从釉质产品生产、成型为和植入牙修复物或骨骼假体的组合物和方法,包括在CAD/CAM技术的辅助下成型或用3D打印机组装釉质产品的方法,也在本发明的范围内。
背景
釉质是牙齿中的主要组织之一。它在早期发育期间、在牙齿突出牙龈之前形成,并且其覆盖牙齿的可见部分。在发育期间,釉质器官内的上皮细胞分化为成釉质细胞,成釉质细胞产生硬化的高矿物质含量的釉质。更具体地,釉质器官在体内天然地以发育中牙齿的组织学切片中的细胞聚集体出现,并且其包括存有成釉质细胞的内釉质上皮、外釉质上皮、中间层和星网状层。牙器官由釉质器官和间充质组成。
保护和修复釉质是牙科医生和在牙科领域工作的其他人员的主要关注点。这是具有挑战性的,因为釉质在口中去矿物质化并且不再生。虽然再矿物质化牙齿的机制是已知的,但是平衡状态可以容易地倾向于去矿物质化。例如,牙菌斑内的细菌(例如变形链球菌(Streptococcus mutans))可以产生有机酸,特别是在糖的存在下,降低口中的pH,促进去矿物质化和龋齿。工程化釉质显然是需要的,但这被证明是困难的,因为不仅在长出的牙齿中缺少成釉质细胞,而且是发育的要求;到目前为止,可以分化为成釉质细胞的上皮细胞必须与间充质细胞相互作用以正确发育。以前的生产釉质的努力包括基于细胞的策略和无细胞策略两种。通常,基于细胞的策略依赖于在MatrigelTM(一种胶状且含蛋白质的细胞培养基质)中与间充质细胞组合的稳定细胞系的发育,并且其被移植到动物中并在此体内产生釉质(参见例如DenBesten et al.,Connect Tissue Res.38(1-4):3-8,1998;DenBesten et al.,Eur.J.Oral Sci.,107(4):276-81,1999;Nakata et al.,Biochem.Biophys.Res.Commun.,308(4):834-839,2003;Honda et al.,Cells Tissues Organs 189(1-4):261-267,2009;Shinmura et al.,J.Cell.Physiol.217(3):728-738,2008;Nakagawa et al.,J.Dental Res.88(3):219-223,2009;Takahashi et al.,In Vitro Cell Dev.Biol.Anim.,46(5):457-468,2010;Liu et al.,J.Tissue Eng.Regen.Med.7:934-943,2012;Hu et al.,J.Dent.Res.,85(5):416-421,2006;and Chen,Arch.Oral Biol.37:771-778,1992)。由于釉质含有约97%的羟基磷灰石并且不含细胞,合成方法也是可能的(参见例如Yamagishi et al.,Nature 433:819,2005;and Brunton et al.,Br.Dental J.215:741,2013)。通过无细胞方案制备的釉质产品已经在临床试验中得到测试,并且显示其有效的治疗了早期、轻微的龋齿(Yamagishi et al.,Nature 433:819,2005;and Brunton et al.,Br.Dental J.215:741,2013)。
概述
本发明部分地基于发明人开发的培养系统,其包括体外、3维(3D)、基于细胞的培养系统,为含有产生釉质产品的成釉质细胞样细胞的釉质类器官生长提供环境。在这个意义上,本发明的培养系统复制了釉质器官。与迄今为止所使用的方法不同,本文所述的培养系统可以生产釉质产品,而不使用天然存在的釉质器官或依靠牙间质或间充质细胞。
本发明的方法可以使用各种不同的细胞类型进行,这些细胞类型被置于细胞培养系统中,所述细胞培养系统被配置为允许所培养细胞3D生长为釉质类器官。当置于培养物中的细胞不产生釉质素(例如,其中最初培养的细胞是与成釉质细胞不同的分化细胞)时,所述方法包括使细胞去分化,然后再分化为成釉质细胞样细胞的步骤。当置于培养物中的细胞是干细胞或前体细胞时,可以省略去分化步骤,并且当置于培养物中的细胞是产生釉质素的细胞(例如原代细胞)或由细胞系衍生的的细胞时,可以既省略去分化步骤又省略诱导釉质素产生。
因此,在第一方面,本发明的特征在于通过以下在体外产生釉质产品的方法:(a)在细胞培养物中提供分化的细胞;(b)将分化的细胞暴露于诱导去分化的试剂,从而产生去分化的细胞;(c)将去分化的细胞暴露于5-羟色胺受体激动剂,从而产生表达釉质素的成釉质细胞样细胞(例如通过产生包含釉质素的细胞外基质);和(d)将细胞外基质暴露于诱导矿物质化的组合物,从而产生釉质产品。在第二方面,本发明的特征在于通过以下在体外产生釉质产品的方法:(a)在细胞培养物中提供干细胞或前体细胞;(b)将干细胞或前体细胞暴露于5-羟色胺受体激动剂,从而产生生产细胞外基质的成釉质细胞样细胞;和(c)将细胞外基质暴露于诱导矿物质化的组合物,从而产生釉质产品。在第三方面,本发明的特征在于通过以下在体外产生釉质产品的方法:(a)提供细胞(例如,分离的成釉质细胞,永生化的成釉质细胞或工程化以表达釉质素的细胞);和(b)将成釉质细胞置于培养系统(例如,二维或三维培养系统)中。可以保持培养物以允许细胞生长和分裂,并且可以增加培养物中类器官的密度(例如,通过收获和再铺板或重新培养它们),以促进较大的类器官的形成,这将更容易聚集形成聚集体。为了促进细胞增殖和/或增加在培养中形成的釉质类器官的大小,可以将细胞暴露于如下进一步阐述的含有血清和/或生长因子或生长因子组合的组合物(例如细胞培养基)。一旦细胞增殖并产生包含釉质素的细胞外基质,它们可用作釉质产品,并且我们可以指定这样的产品为未矿物质化的釉质产品。这些未矿物质化的釉质产品可用于通过例如三维打印成型为修复物和假体。可以将未矿物质化的釉质产品暴露于诱导矿物质化的试剂,从而产生矿物质化的釉质产品,其也可用于形成修复物和假体(例如通过3D打印)。矿物质化的釉质产品可以通过暴露于减少釉质类器官中的有机物质的量的试剂来进一步开发。因此,任何方法可以进一步包括一旦已经达到期望的尺寸就从釉质类器官去除有机物质的步骤。矿物质化并缺乏有机物质(例如,不含或基本上不含有机物质)的釉质类器官可尤其适于CAD/CAM技术以产生修复物和假体。
在使用分化细胞的任何实施方案中,细胞可以是上皮细胞(例如,口腔上皮角质形成细胞),但是本发明不限于此;可以使用可以在细胞培养物中去分化和/或重编程以开始表达釉质素(例如在细胞外基质中)的任何分化的细胞。在任何实施方案中,细胞培养物(例如,3D培养物)中的细胞可以是原代细胞。也就是说,无论产生釉质产品的方法是否包括培养分化的细胞、干细胞或前体细胞或成釉质细胞,细胞可以是从动物收获并置于细胞培养物中的细胞。在其他实施方案中,可以从动物收获细胞(分化的细胞、干细胞、前体细胞或成釉质细胞)并随后永生化。因此,本发明的方法可以用原代细胞或细胞系的细胞进行。此外,细胞可以从各种来源获得,包括哺乳动物,如人。可以对所用的任何细胞进行遗传修饰(例如通过重组技术来改变由细胞表达的基因产物)。
当使用时,诱导去分化的药剂可以是转化生长因子(例如TGFβ(例如TGFβ1))。去分化的细胞可以是表达通常与干细胞相关的标记(例如,N-钙粘着蛋白或八聚体结合转录因子4(Oct-4))而不是通常与成熟表型相关的标记(例如,去分化的上皮细胞可能不能表达上皮标志物E-钙粘着蛋白)的细胞。
在使用时,5-羟色胺受体激动剂可以是5-羟色胺,氮杂唑酮(azapirone),曲坦(triptan),LY-334,370,拉西地酸(lasmiditan),麦角酰二乙胺(lysergic acid diethylamide),麦斯卡林(mescaline),2,5-二甲氧基-4-溴苯乙胺,氯卡色林(lorcaserin),西沙必利(cisapride),替加色罗(tegaserod),普卢卡必利(prucalopride)或AS-19;其盐、水合物或类似物(例如N,N-二甲基色胺);或其任何组合。
诱导矿物质化的组合物可包括钙和/或磷酸盐(例如,含有钙或磷酸盐的矿物质)。
为了多方面地支持细胞生长和分化,细胞培养物可以包括表皮生长因子(EGF)家族、胰岛素样生长因子(IGF)家、成纤维细胞生长因子(FGF)家族或其他生长因子(例如,血小板衍生生长因子;PDGF;还参见下文)的一种或多种生长因子。
任何细胞培养物均可以包括(例如在培养基质或培养基中)层粘连蛋白,胶原蛋白IV,硫酸乙酰肝素蛋白聚糖,巢蛋白(entactin/nidogen)或从Engelbreth-Holm-Swarm(EHS)小鼠肉瘤提取的溶解的基膜制备物。在任何实施方案中,细胞培养物可以被配置为允许细胞(例如成釉质细胞或成釉质细胞样细胞)增殖成三维细胞簇,我们可以称之为釉质类器官。成釉质细胞或成釉质细胞样细胞可以在本发明的培养系统中暴露于包括血清和/或一种或多种生长因子(例如,EGF、IGF、FGF、TGF或神经生长因子)的组合物。
在本发明的任何方法中,可以处理釉质类器官以减少或去除其中的有机物质。例如,可以用次氯酸钠和/或肥皂/去污剂(例如,Triton-X100)处理(例如浸渍)釉质类器官。如果需要,处理可包括将釉质类器官浸入超声波浴中和/或将其暴露于热(例如干热)以促进有机物质的破坏和/或去除。因此,本文所述的釉质产品可以不含或基本上不含有机物质。
在另一方面,本发明的特征在于通过本文所述的方法制备的釉质产品。该产品可以被收获和包装以供销售(与使用说明书一起),或者可以被成型为外科修复物,其然后也可以被包装以供销售。为了得到本发明的修复物,可以提供如本文所述的釉质产品,并使产品经受进一步组装或成形的工艺。例如,釉质产品可以进行如计算机辅助设计包所示的印模或成形。在一个实施例中,釉质产品可以经制型而包括凹陷(indentation)和/或突起(protrusion),并且可以在第一釉质产品上形成凹陷以啮合第二釉质产品上的突起。因此,可以由多个较小的产品组装更大的产品,然后可以将这些更大的产品进一步制型为适于修复较大缺陷的修复物(例如,长骨(例如股骨,扁平骨诸如肩胛骨,或不规则骨诸如骨盆或脊柱中的骨)中的缺陷)。
在一个实施方案中,外科修复物是牙修复物(例如,牙冠,镶盖(veneer),相应的支架,镶嵌物,覆盖物,全口拖牙,部分拖牙,桥等)。在另一个实施方案中,外科修复物是矫形假体。
在另一方面,本发明的特征在于细胞培养系统,其包括产生釉质素的细胞。该系统可以配置为允许细胞形成釉质类器官的三维系统。产生釉质素的细胞可以是天然即产生釉质素的细胞(例如原代成釉质细胞或永生化原代细胞)或已经通过例如暴露于5-羟色胺受体激动剂或通过遗传工程操作以表达釉质素的细胞。在各种实施方案中,本文所述的方法可以在3D培养物中进行,所述3D培养物包括包含生物聚合物(例如胶原蛋白,丝蛋白,藻酸盐,壳聚糖,肽,透明质酸,其保留支持细胞三维生长能力的衍生物,或其任何混合或组合)的支架。在其他实施方案中,支架可以包括陶瓷。三维培养系统是本领域已知的。可以咨询例如Sumita等人(Biomaterials 27:3238-3248,2006)和Zhang等人(Japanese Dental Science Rev.49:14-26,2013)。
基于我们迄今为止的研究,我们已经确定了在体内自然发育的釉质器官和我们的体外3D培养系统中的釉质类器官之间的相似性。例如,在两种情况下,形成包含表达釉质素的极化柱状外周边界细胞的球状细胞簇。除了釉质素(或可选地),可以存在其它釉质标记物,包括成釉蛋白(ameloblastin),釉蛋白(enamelin)和釉丛蛋白(tuftelin)。还形成了含有釉质素的细胞外可矿物质化基质,为细胞提供结构和化学支持,包括刚刚提及的边界细胞;这种细胞外基质充当将釉质产品矿物质化的基质。釉质素蛋白由釉质细胞高度表达,并且该蛋白质经历自组装以形成与羟基磷灰石晶体相互作用并在垂直于表面的方向上定向晶体生长的纳米球。本发明的釉质产品可以结晶,并且在各种实施方案中,它们的晶体结构将不同于天然存在的牙釉质。
在体内形成的球形釉质器官和本发明培养物中的釉质类器官二者均通过在三维中扩展而生长。当外周边界细胞增殖时,它们产生包含矿物质化和釉质或釉质产品的基础的细胞外基质。因为预期在我们的培养系统中生产的釉质的物理性质与在天然牙齿中发现的釉质的物理性质相似,我们预计当安装在预制牙齿上时,我们的釉质产品将有效地最小化微渗漏,并因此降低龋齿的风险。此外,使用本发明的材料形成的修复物可以提供更自然的外观,并且更容易被牙医及其患者接受。金属和瓷材料的成本上升也使得如本文所述生产的釉质产品的制造具有成本效益。
虽然用于釉质修复的产品目前由具有与天然存在的釉质不同的物理性质的材料制成,但是它们具有足够相似的性质,以允许它们广泛用于各种外科修复物。我们当前的期望是,本发明的釉质产品的物理性质将类似于天然存在的釉质产品的物理性质,使得使用如本文所述的釉质产品产生的修复物具有明显的优点。结合在外科修复物中的釉质产品的硬度可以通过改变矿物质化程度而变化。为牙齿表面准备的修复物可能需要最高的矿物质含量,而用于骨置换或增强的修复物可以更少程度地矿物质化。在应用修复物来置换软骨或重塑软骨特征(例如,鼻子或耳朵)时,矿物质含量甚至可以更低。因此,在各种实施方案中,釉质产品的硬度可以与牙釉质、骨或软骨的硬度基本相同。
“约”是指加或减10%。例如,约10μg为9-11μg,包括端值。
“成釉质细胞样细胞”是指产生含有釉质素的细胞外基质(ECM)用作本文所述的培养系统中矿物质化的支架的生物细胞。
“分化的细胞”是指可识别为除成釉质细胞之外的特化细胞类型的细胞。例如,分化的细胞可以是上皮细胞(例如,口腔上皮角质形成细胞),肝细胞,肌肉细胞或神经元。如本文所定义的分化细胞不产生天然釉质,但可以在细胞培养物中重新编程以产生釉质产品。“去分化的细胞”是先前可识别为特化细胞类型但不再具有至少一种先前识别的性状(例如,其中将其识别为分化细胞的一种性状)的细胞。例如,去分化的口腔角质形成细胞可能不再表达上皮标志物,如E-钙粘着蛋白,角蛋白,桥粒蛋白(例如桥粒粘蛋白或桥粒胶蛋白)或角质化的包膜蛋白;去分化的肝细胞可能不再表达主要血浆蛋白(例如血清白蛋白或C-反应蛋白),载体蛋白(例如白蛋白,血浆铜蓝蛋白,运皮质激素蛋白,触珠蛋白,血色素结合蛋白,IGF结合蛋白,视黄醇结合蛋白,甲状腺素视黄质运载蛋白,或转铁蛋白),激素(例如IGF-1,血小板生成素或铁调素);或载脂蛋白;去分化的肌细胞可能不再表达肌动蛋白或肌球蛋白;并且去分化的神经元可能不再表达神经递质。用于本发明方法的去分化的细胞包括表达5-羟色胺受体并且在暴露于5-羟色胺受体激动剂后能够表达釉质素的细胞。去分化的细胞也可以,但不必然表达间充质标志物N-钙粘着蛋白或干细胞标志物OCT4。
“釉质器官”是指在体内天然存在的细胞聚集体,而“釉质类器官”是指如本文所述在体外开发(在细胞培养物中,包括配置用于细胞在三维中扩增的细胞培养物)的细胞构建体。
“细胞外基质”是指由细胞分泌的分子的集合,其为细胞和其周围的细胞提供结构和/或生物化学支持。ECM可以包括但不必然包括以下一种或多种:胶原蛋白(例如胶原蛋白IV),硫酸软骨素,弹性蛋白,纤连蛋白,透明质酸,硫酸角蛋白,层粘连蛋白,蛋白聚糖(例如硫酸乙酰肝素蛋白聚糖)和巢蛋白。
除非上下文另有说明,否则我们使用术语“体外”来指细胞培养。
“原代细胞”是取自活生物体的细胞和未曾作为细胞系被永生化的细胞。
“干细胞”或“前体细胞”是指不产生天然釉质或釉质产品但在根据本文所述的方法培养时分化成可产生天然釉质或釉质产品的细胞的多能细胞(pluripotent cell或multipotent cell);干细胞和前体细胞完全分化程度较低。通常,多能干细胞进一步特化成多能祖细胞,然后多能祖细胞产生功能性细胞。可用于本发明方法的干细胞和前体细胞表达5-羟色胺受体。
“外科修复物”是指植入或以其他方式施加到患者身体(例如,通过外科手术操作)以改善物理缺陷(例如,由疾病或创伤引起的牙齿或骨骼缺陷)或以增强物理结构(例如,在整容外科手术中)的组合物。例如,缺陷可以包括由退行性疾病、癌症或损伤产生的裂缝、腔或缝隙。外科修复物可以是牙科修复物(即,在牙科操作中应用的组合物,其是或包括釉质产品)或骨骼假体(即,在外科手术操作中应用的组合物,以(完全或部分)修复牙面结构或长、扁平或不规则骨的一部分)。可以使用CAD/CAM技术从釉质产品成型得到外科修复物。“修复性牙科产品”或“牙科修复物”可以是用于(完全或部分)恢复牙齿的结构或外观的组合物。这些组合物包括牙冠,镶盖,相应的支架,镶嵌物,覆盖物,部分拖牙,全口拖牙和桥(例如固定桥)。牙科修复是一种类型的外科修复,并且我们还可以使用术语“外科修复”来指代将本文所述的包含釉质产品或由釉质产品组成的组合物施用于患者的方法。本文所述的任何治疗方法可包括鉴定需要治疗的患者(例如,人类患者,无论是男人,女人还是儿童)的步骤。因此,所述方法可以包括鉴定具有牙科、面部或牙面缺陷(例如,腭裂)的患者;患有釉质发生不全病症的患者;或具有需要修复的骨骼元件(例如,面部中的骨骼)的患者的步骤。该需要可以仅是患者感觉到的需要,如可能是整容外科的情况。
附图简要说明
图1(a)-1(c)是用苏木精和伊红(a),抗釉质素抗体(b)和茜素红(c)染色的本发明3D釉质类器官的显微照片,其染钙并指示矿物质化的类器官或釉质产品。
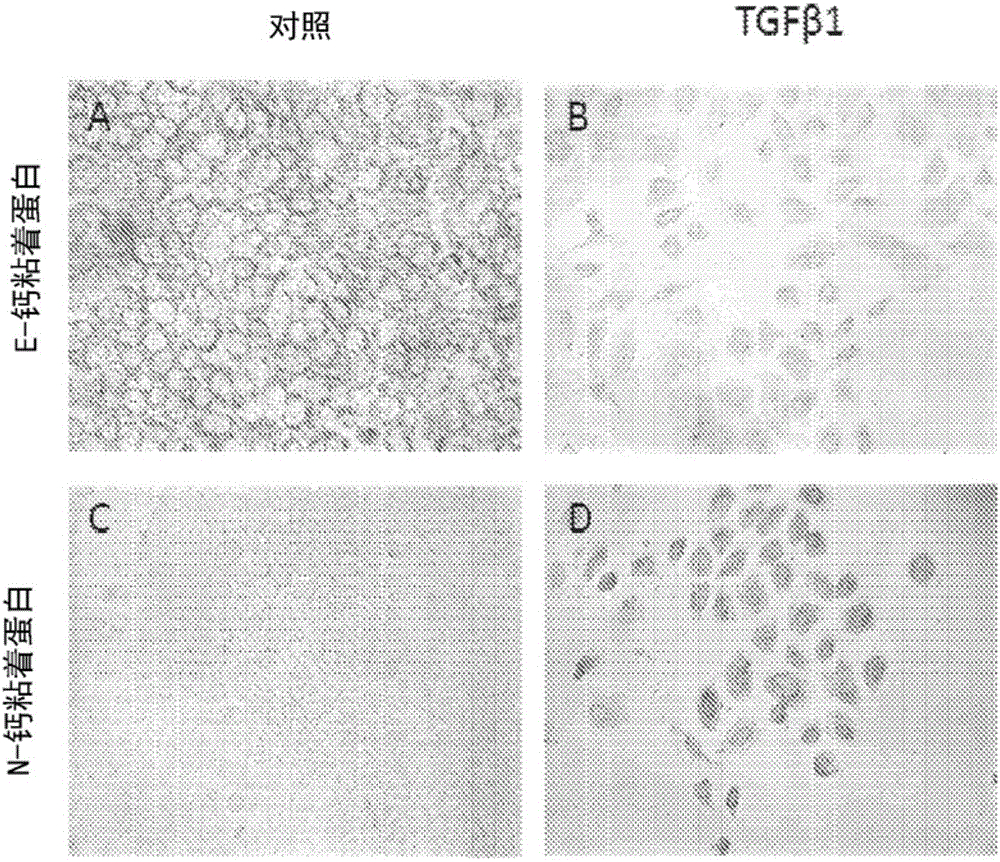
图2(a)-2(d)是证明在培养中用TGFβ1处理的细胞系IMOK的口腔上皮角质形成细胞中,丧失E-钙粘着蛋白表达且获得N-钙粘着蛋白表达的显微照片。
图3(a)-3(f)是用TGFβ1处理前后用抗Oct4、胶原蛋白1和釉质素的抗体染色的细胞系IMOK的口腔上皮角质形成细胞的一系列显微照片。
图4是一对显微照片,其证明了用5-羟色胺处理后细胞系IMOK中的釉质表达的诱导。
图5是显示釉质产品的放射照片,其看起来是不透明的并且被圈表示。
图6是培养物中釉质类器官的一系列照片。标记为“原始”的照片描绘了在用任何生长因子孵育之前的釉质类器官。其余的照片显示了用胎牛血清(FBS)、FBS和EGF或FBS、EGF和PDGF培养接种的类器官的效果。
详述
在下面的段落中,我们描述了用于在体外产生釉质类器官以及用于制备和使用来自这些类器官产生的釉质产品的外科修复物的组合物和方法。本文提供的描述用于示例但不限制本发明。
本文所述的组合物和方法可以不含天然存在的釉质器官、牙间质和间充质细胞,或者可以包括或通过使用这些部分与细胞类型(例如干细胞、前体细胞和分化的细胞(例如原代和永生化细胞))和如下所述的试剂(例如,5-羟色胺受体激动剂、生长因子和矿物质化物质)组合进行。
细胞和细胞类型:可以采用在本文所述的条件下将产生釉质产品(无论是未矿物质化的或矿物质化的或无论是否基本上不含有机物质(例如蛋白质、核酸和其他细胞物质))的任何细胞或细胞类型。这些细胞可以是分化的细胞,其在培养物中被诱导去分化,或者它们可以是干细胞或前体细胞。在任一情况下,细胞可以源自许多不同来源,包括任何数量的真核组织(例如,血液、骨髓、皮肤或粘膜组织)。例如,分化的细胞、干细胞或前体细胞可以从脊椎动物获得,诸如哺乳动物(例如人或其他灵长类动物,狗,猫,马,牛,绵羊,猪,山羊,或啮齿动物)。干细胞或前体/祖细胞可以是例如造血干细胞,间充质干细胞,来自成体生物体的上皮干细胞,上皮干细胞,脂肪来源的干细胞或牙髓干细胞。分化的细胞可以是上皮细胞(例如,上皮角质形成细胞,例如口腔上皮角质形成细胞,或皮肤的上皮细胞)。可以从其所在的口腔的任何区域(例如,腭)采集口腔上皮细胞。在任何实施方案中,细胞可以是永生化的和/或遗传修饰的。
更具体地,釉质类器官可包括釉质器官上皮(EOE)细胞(例如,Chen等人(1992)使用的小鼠EOE细胞,也参见DenBesten et al.,Connect Tissue Res.38(1-4):3-8,1998)或由其产生。如上所述,细胞可以是永生化的,并且在这种情况下它们可以是例如由DenBesten等人产生的永生化的EOE细胞系,PABSo-E(DenBesten et al.,Eur.J.Oral Sci.,107(4):276-81,1999)。这些细胞已经传代超过55次,并保持成釉质细胞的特征,例如阳性表达釉质素、MMP-20和EMSP1mRNA(成釉质细胞的标记物)。细胞还可以自发地永生化(例如,由Nakata等人报道的自发永生化的小鼠成釉质细胞细胞系(Biochem.Biophys.Res.Commun.,308(4):834-839,2003)。另一种有用的细胞类型是Malassez的上皮细胞残留物(ERM细胞;参见Shinmura et al.,J.Cellular Physiol.217:728-738,2008)。ERM细胞可以通过外植体培养从牙周韧带组织获得,用非血清培养基进行亚培养(sub-cultured),并在3T3-J2饲养细胞层上扩增。釉质类器官还可以包括皮肤上皮细胞或从皮肤上皮细胞产生(参见Liu et al.,J.Tissue Eng.Regen.Med.7:934-943,2012)。Hu等人在用牙间质培养这些细胞时证实了这些细胞的重编程(J.Dent.Res.,85(5):416-421,2006)。
遗传修饰的细胞:在它们已经被培养并且产生支持矿物质化的细胞外基质之前或之后,本发明构建体内的细胞可以被遗传修饰以包括异源基因或基因构建体。用于遗传工程改造细胞的方法是本领域公知的,并且包括例如由Chen对小鼠釉质器官上皮细胞(EOE)细胞所使用的电穿孔方法(Chen,Arch.Oral Biol.37:771-778,1992)。如果需要,可以工程改造细胞以表达由成骨细胞或骨细胞表达的一种或多种蛋白质。细胞还可以被遗传修饰以产生釉质素或成釉质细胞的另一种标记物,或者产生或产生更多的ECM成分(包括ECM定义中列出的一种或多种成分)。因此,存在三种用于产生可用于本发明的方法中的细胞的方法:通过提供天然表达ECM和釉质素的细胞(例如通过分离成釉质细胞或永生化成釉质细胞系的细胞);通过遗传工程化细胞以产生ECM和釉质素;或通过重编程培养中的细胞(例如分化的细胞、干细胞或其他前体)以表达ECM和釉质素(例如通过暴露于包括血清和/或生长因子或本文所述的因子的培养基)。
基质和培养条件:对于本文所述的培养系统,可以将细胞最初置于常规的二维培养中,在此它们主要在单层中生长,然后转移至3D培养,或者它们可以直接置于3D培养。例如,当所述方法使用通过基因或重组方法或通过去分化和再分化修饰以产生釉质素的分化细胞时,可以将细胞最初置于二维培养中,所述二维培养物未设计为支持三维生长。当需要3D生长时,本文所述的细胞或细胞类型可以与基质混合,所述基质例如基底膜基质(例如,来自BD Bioscience,San Jose CA的BD Matrigel TM;目录#356234;参见Hughes et al.,Proteomics 10(9):1886-1890,2010),并使用生长培养基(例如,DMEM-高蔗糖)在体外生长。BD MatrigelTM基底膜基质是从Engelbreth-Holm-Swarm(EHS)小鼠肉瘤提取的可溶性制备物,其包含了包括层粘连蛋白、胶原蛋白IV、硫酸乙酰肝素蛋白聚糖和巢蛋白的细胞外基质蛋白。它还含有TGFβ、EGF、胰岛素样生长因子、成纤维细胞生长因子、组织纤溶酶原激活物和在EHS肿瘤中天然存在的其它生长因子。尽管基质的精确组成可以变化,但是其可以包括细胞外基质蛋白和生长因子的混合物,并且其可以源自肿瘤细胞(例如Engelbreth-Holm-Swarm(EHS)小鼠肉瘤细胞)。基质可以是在没有其它因子(例如本文所述的转分化因子)的情况下维持多能细胞在其多能状态(即,其促进自我更新)的基质。还可以将细胞(例如原代或永生化口腔角质形成细胞)最初置于由其它培养基(例如CnT-02生长培养基(CELLNTEC))支持的培养物中。
在三维培养物中,细胞可以变成多层的或聚集的,其中层状和/或聚集的细胞生长由支架引导。例如,3D培养物可以在AggreWell TM 400板(Stemcel Technologies,Grenoble,France)中生长。每个板具有六个孔,并且每个孔含有大约4,700个直径为400μm的微孔。釉质类器官可以从这样的孔转移到ProtoTissueTM生物反应器(MC2Biotek,Horsholm,Denmark),并在37℃下在湿润的培养箱中在5%CO2、95%空气中培养,每2-5天更换培养基。这样的生物反应器可以支持球体生长和细胞外基质的形成。更通常而言,可以使用基于以下或由以下产生的3D培养物:细胞外基质或支架(例如,采用水凝胶),改性表面,旋转生物反应器,微载体,磁悬浮,悬滴板和/或磁性3D生物打印。在无支架技术中,可以使用低粘附力板和微图案化表面。
细胞可以保持在培养中,直到它们达到一定水平的汇合度。例如,可以维持细胞直到它们为约10-90%(例如约30-40%,40-50%,50-60%,60-70%,70-80%或80-90%)汇合。
用去分化因子和再分化因子的处理:本文公开的方法可以包括:(1)分化的细胞(例如,口腔上皮角质形成细胞)通过暴露于TGFβ1(丧失E-钙粘着蛋白;获得N-钙粘着蛋白+Oct4)的去分化;(2)通过暴露于5-羟色胺,将上述去分化(例如干细胞样)的细胞再分化为成釉质细胞样细胞(获得釉质素);(3)3D釉质类器官的形成;和(4)釉质类器官包括其细胞外基质(如通过阳性茜素红染色所证明的)的矿物质化。上皮细胞通常形成片、管或囊泡,其中它们通过专门的接触结构(包括由E-钙粘着蛋白介导的粘附连接)彼此建立紧密的结合。上皮-间质转化(EMT,也称为转分化)是其中细胞丧失上皮特征并获得间质特征的过程。E-钙粘着蛋白的丢失被认为是EMT的标志事件。与该丢失同时,转分化细胞获得间质特征,包括增加的N-钙粘着蛋白的表达。总之,E-钙粘着蛋白的下调和N-钙粘着蛋白的上调作为EMT的标记(Xu et al.,Cell Res.19:156-172,2009)。已经在发育过程中和在癌症进展的背景下研究了EMT。在人类牙齿的发育研究中,Heymann报告说,虽然E-和N-钙粘着蛋白均在胚胎牙组织中表达,但它们的表达模式显著不同(Heymann et al.,Am.J.Pathol.160(6):2123-2133)。E-钙粘着蛋白最初在帽状期在牙上皮中表达,并且当在钟状期开始成釉质细胞分化时下调。N-钙粘着蛋白显示与E-钙粘着蛋白相比的相反的梯度,并且在分化的上皮细胞中上调(Heymann,同上)。根据Heymann,增加的N-钙粘着蛋白的表达和顶端定位在成釉质细胞转化和极化中起重要作用,这是釉质基质分泌的先决条件。在癌症进展的研究中,Araki等人采用了其中用重组TGFβ1诱导EMT的模型系统,并且发现在肝外胆管癌中通过TGFβ1诱导的EMT,从E-至N-钙粘着蛋白的转换促进了癌症的进展(Br.J.Cancer 105:1885-1893,2011)。
在本发明的方法中,可以通过用转化生长因子处理来诱导分化的细胞(例如原代或永生化的口腔上皮角质形成细胞)经历去分化和表达N-钙粘着蛋白。如下所报道,我们观察到在用TGFβ1处理的口腔上皮角质形成细胞中,E-钙粘着蛋白表达减少和N-钙粘着蛋白表达增加。我们还观察到用5-羟色胺处理后釉质素表达的诱导。我们已经证实用10μM的5-羟色胺处理10天后釉质素的诱导,并且可以调整该处理方案(例如,可以测试和观察用约1-100μM(例如约5-80μM)处理约2-20天后的釉质素产生)。
可以测试在形成釉质产品过程中的任何时间,给定培养物中的细胞样品中,上述标记或任何其他标记的表达。例如,培养细胞的样品可以被固定(例如,在醇(例如,100%甲醇)中),并用定制的或可商购的抗体进行免疫组化。
在一些实施方案中(例如,当所培养的第一细胞是去分化的细胞时),生长因子可以从将细胞置于培养中的时间起存在。在其他实施方案中(例如,当最初置于培养物中的细胞是分化的细胞时),生长因子可以在稍后阶段添加,例如在去分化后和/或在暴露于再分化剂(例如,5-羟色胺受体激动剂)后。
可以加入的促进细胞生长和釉质类器官扩张的生长因子和其它试剂包括以下任意组合:双调蛋白(amphiregulin);epigen;EGF;FGF(FGF1,FGF2,FGF3,FGF4,FGF5,FGF6,FGF7,FGF8,FGF9);IGF(IGF1,IGF2);胰岛素;PDGF;肝细胞生长因子;WNT;TGFβ;趋化因子和细胞因子(例如,白细胞介素如IL1或IL6);Notch配体;PGE;PGE2;EP1,EP2,EP3,EP4;头蛋白(Noggin);烟酰胺-用在用于肿瘤的类器官中;A8301(TGFβ1型受体ALK5激酶、I型激活素/淋巴结受体ALK4和1型淋巴结受体ALK7的有效抑制剂);R-Spondin;Flk1;BMP;激活素A;Oct4;SOX-9,SOX17;Runx;LEF1;钙羟基磷灰石;釉丛蛋白;和牙本质涎磷蛋白(sialophosphoprotein)。
例如,釉质类器官的培养物可以包括培养基中0.1-100ng/ml的EGF,培养基中0.1-100ng/ml的可溶性E-钙粘着蛋白,胎牛血清(10%)和/或0.1-10mM的钙。生长因子可以首先添加到生长培养基中(即,在细胞置于培养中时),并且也可以在细胞从二维转移到三维培养系统(例如,包括本文所述的支架材料的系统)之后存在。
细胞和/或从其形成的釉质类器官可以以不同的密度接种,这取决于用于聚集的所需接近度。为了产生更大的类器官(例如,具有大于1毫米直至例如50mm的直径),可以更密集地接种细胞,使得当在培养物中生长时,它们彼此接触(例如,在生长因子如FBS、EGF和PDGF存在下,如图6所示)。
矿物质化:我们还已经观察到在用矿物质化溶液(钙2.5mM,磷酸盐1.5mM)处理时在细胞外基质中钙的沉积。可以使用试剂级CaCl2·2H2O(Sigma,>99.0%纯)和KH2PO4(Sigma,>99.0%纯)制备钙(例如30mM)和磷酸盐(例如3mM)的储液。KH2PO4溶液可以使用小体积的KOH在25℃下调节至pH 7.4,并且可以在使用前过滤溶液。可用于矿物质化的其它溶液包括10%葡萄糖酸钙溶液、1%氟化钠溶液和3%remodent溶液。
有机物质的去除:如上所述,在任何本发明的方法中,可以处理釉质类器官(例如矿物质化釉质产品)以减少或去除其中的一些(例如基本上全部)有机物质(例如,细胞物质,包括蛋白质、脂肪和核酸)。例如,釉质类器官可以用次氯酸钠和/或肥皂/去污剂(例如,Triton-X100)处理(例如浸渍)。如果需要,处理可包括将釉质类器官浸入超声波浴中和/或将其暴露于热(例如干热)以促进有机物质的破坏和/或去除。也可以通过暴露于包括合适的酶(诸如蛋白酶和核酸酶)的溶液中,去除有机物质。因此,本文所述的釉质产品可以不含或基本上不含(例如,大于90%,95%,98%或99%不含)有机物质。
可以在将任何釉质产品制成修复物或假体或并入修复物或假体中之前或之后,将另外的试剂(诸如着色剂)加入到任何釉质产品中。例如,用于改变颜色的着色剂或天然釉质或牙镶盖可以通过本领域已知的方法并入。
釉质类器官和由此产生的釉质的特征:如同天然存在的釉质器官,通过本方法产生的釉质类器官可具有球状外观;釉质类器官是通过三维扩增生长的球体,釉质类器官的外围边界细胞类似地生长。在构建体内,外周边界细胞产生细胞外基质,其提供了矿物质化和釉质的基础。构建体可以包括钙化结节,并且可以通过转化生长因子(例如TGFβ)促进这些结节的外观(大小和/或数量)。生长因子(例如TGFβ)还可以影响分化标记物的表达,包括下面讨论的那些。培养中的类器官通常具有球体形状,并且它们可以被收获并成形为立方体(例如~1cm3的立方体)。在本发明的方法中,立方体然后可以安装在柱上,柱可以将釉质产品固定在铣床上,铣床将基于CAD/CAM方法对产品成形。在一些实施方案中,当釉质产品用于产生较大的外科修复物(例如,用于骨的实质性置换或强化现有骨结构的修复物)时,在培养中形成的类器官可以使用更小的互锁件融合成基本上任何形状。换句话说,如果必要或更方便,可以组装成形(例如,块状)或不成形的类器官,并且这样的组件以及制造和使用它们的方法在本发明的范围内。
分化标记:釉质素,成釉蛋白,釉丛蛋白,釉蛋白,MMP-20(基质金属蛋白酶-20)和EMSP1(釉质基质丝氨酸蛋白酶1)和细胞角蛋白14是体外和体内成釉质细胞分化的合适标记物。
像天然存在的釉质一样,通过本文所述的方法产生的釉质产品可具有高矿物质含量,包括羟磷灰石,其是结晶磷酸钙。以重量计,羟基磷灰石可以构成至少50%(例如至少50%,60%,70%,75%,80%,85%,90%,95%,96%,97%,98%,99%或更多)的釉质产品。换句话说,在各种实施方案中,以重量计,釉质产品包含至少50%(例如至少50%,60%,70%,75%,80%,85%,90%,95%,96%,97%98%,99%或更多)的羟基磷灰石。矿物质含量和其它性质可以通过进一步测试(诸如X射线晶体学)确定。釉质产品还可以含有选自两种独特类型的蛋白质中的至少一种类型的蛋白质,即,认为用作矿物质化框架的釉质素和釉蛋白类型的蛋白质(参见例如Catalano-Sherman et al.,Calcif.Tissue Int.54(1):76-80,1994)和/或其片段或其天然存在的小同种型。
如上所述,本发明的釉质产品可以进一步成形和操作,并且我们期望尺寸为约1cm3的块对于许多应用来说将是方便的尺寸,并且易于适应CAD/CAM技术。为了使釉质类器官生长到适合于预期最终用途的适当尺寸,可以将体外产生的釉质类器官(如本文所述)暴露于用于生长的混合物,包括例如血清和一种或多种生长因子,包括但不限于FGF,EGF,IGF,胰岛素和/或可溶性钙粘着蛋白,例如可溶性E-钙粘着蛋白(由Sabine M.Brouxhon博士;Stony Brook University提供)。
修复物成型的方法:如本文所述产生的釉质产品可用于适于从现有材料形成牙科修复物的任何技术。例如,印模(impression modeling)可用于手动地开发修复物。或者,修复可以通过利用扫描技术的系统来进行,所述扫描技术诸如激光扫描,照相成像(参见美国专利号5,851,115,其内容在此并入本文)和机械感测(参见美国专利号5,652,709,其内容在此并入本文)。在一个实施方案中,该方法包括以下步骤:用单个成像装置对身体区域和置换部分进行成像,所述单个成像装置被布置成在一次曝光期间从不同角度同时拍摄身体区域的图像。图像显影并使用读取装置来扫描图像,该读取装置产生成像的身体区域和要在该区域中应用的置换部分的数字化数据。数字化数据被传送到计算机设备,该计算机设备在屏幕上自动再现身体区域和置换部分。计算机程序计算身体区域和置换部分的表面的空间关系数据,并且该数据在制作和拟合身体(例如,人体)中的置换部分时用作对照数据。
扫描后,技术人员可以创建恢复物,任选使用计算机辅助设计包。已经使用CAD/CAM(计算机辅助设计和计算机辅助制造)技术来提供许多当前可获得的牙科修复物,包括牙冠,镶盖,相应的支架,镶嵌物,覆盖物和桥(例如固定桥)并且其可以类似地用于本发明的釉质产品。在该方法中历史上使用的材料包括与天然牙齿具有显著不同的机械性能的金属、瓷和复合材料。例如,这些材料可以在硬度、弹性和其温度系数方面显著变化。这种差异可允许在修复物和随后的龋齿周围的微渗漏。本发明的优点是通过本发明方法生产的釉质产品更类似于天然釉质,并且还可以接受CAD/CAM研磨和牙科修复应用。因此,所得的牙科修复物表现出与天然牙齿的性质更相似的性质,并且在矿物质化被定制使得釉质产品的硬度更接近软骨或骨的硬度的情况下也是如此。
因此,本发明的特征在于将本文所述的(或通过本文所述的方法制备的)釉质产品成型为修复性牙科产品和骨骼假体的方法。修复物可以是传统的实验室创建的固定修复物,或者可以在CAD/CAM设计和铣削系统(诸如由Sirona Dental Systems以商品名CEREC出售的系统)上生产。可与本发明的釉质一起使用的其它牙科软件产品包括DelcamTM、RenishawTM和WorkNC DentalTM。CAD程序的使用在美国专利号5,338,198中描述,其内容通过引用并入本文。通常,常规牙科印模可以通过计算机控制的激光扫描仪进行数字化,并且此类数字化步骤可以包括在形成釉质产品的本发明方法中。随后,可以通过定制的计算机图形软件来转换数据,从而可以在计算机屏幕上从各种视角和以各种放大倍数观看导出的3D电子模型(例如,牙齿,牙弓或受损骨骼)。
在一个实施方案中,可以使用美国专利号8,612,037中描述的技术制造患者牙列和牙植入物类似物的快速原型,其内容通过引用并入本文。也可以使用仿型铣削(copy milling)方法。
牙科修复领域的普通技术人员熟悉诸如牙冠,镶盖,相应的支架,镶嵌物,覆盖物,假牙和桥的产品。简而言之,牙冠是一种牙齿形的“帽”,当放置在牙齿上时,它改善牙齿的形状和尺寸、强度和外观。牙冠通常被结合到适当位置并完全包住牙齿的可见部分。需要牙冠的患者包括其牙齿变弱(例如,由于蛀牙,破裂或严重磨损)的患者和寻求美容性改善的患者。例如,牙冠可以放置在畸形或严重变色的牙齿上,并且它们也可以放置在牙科植入物上。
在其他实施方案中,修复性牙科产品和骨骼假体可以使用釉质产品的颗粒通过3D打印来制造以打印所需的修复物。换句话说,可以使用由本发明的釉质类器官产生的釉质晶体在3D打印机的帮助下形成更大的结构(即,基本上任何修复性牙科产品或骨骼假体),并且这样的方法在本发明的范围内。或者,可以使用3D打印机打印用作修复的框架的有机基质(例如,细胞外基质材料)。然后将框架置于培养物中,在此细胞如本文所述(例如,成釉质细胞样细胞)将粘附到框架。一旦框架被填充,由细胞产生的支架和细胞外基质可以被矿物质化至所需的程度,并且可以去除有机物质,留下准备用于植入的最终釉质修复物。
关于植入操作,可以使用已知技术植入如本文所述制造的牙科修复物,包括允许最小量的粘合剂延伸超过边缘的技术,如美国专利号8,641,419中所述,其内容通过引用并入本文。简而言之,阻挡件(barrier)定位成与正被恢复的牙齿接触,并且相邻的牙齿覆盖正被恢复的牙齿的一部分,并且产生正被恢复的牙齿和相邻牙齿的分离。粘合剂(cement)施加到固定修复物的第一啮合面和/或牙齿的第二啮合面,并且固定修复物的第一啮合面和牙齿的第二啮合面彼此相邻地定位,以将固定修复物安在牙齿上。该阻挡件覆盖正被恢复的牙齿的一部分,以防止粘合剂粘合到牙齿的该部分。这消除了从牙齿的该部分去除硬化粘合剂的需要。
实施例
在下述研究中,成釉质细胞样细胞起源于口腔上皮角质形成细胞。我们使用细胞系IMOK,一种来自小鼠的永生化口腔角化细胞系(immortalized oral keratinocyte cell line),这是Garrett-Sinha博士赠予的(SUNY-Buffalo;Parikh et al.,Arc.Oral Biol.53:1091-1100,2008)。
为了解冻冷冻的IMOK细胞,我们从液氮储存中取出含有106个冷冻细胞的冷冻小瓶,立即将其置于37℃水浴中,并轻轻旋转小瓶。当细胞解冻时,我们将小瓶转移到层流洁净工作台中,并加入10ml预温热的无血清CnT-02生长培养基(CELLNTEC;FPS 1:1000加入培养基)。我们离心细胞悬浮液(~1000rpm 4分钟),然后目视检查小瓶中是否存在完整的沉淀。无菌倾析上清液而不干扰细胞沉淀,轻轻地将细胞沉淀重悬于7ml CnT-02培养基中。我们将重悬的细胞转移到T25培养瓶中,并用5%CO2的湿润气氛在37℃下培养。每隔一天更换培养基,当细胞达到90%汇合时,我们将它们1:5分开,并如下将它们接种在12孔板中。在从培养瓶中弃去培养基后,我们用PBS洗涤细胞,然后加入2mL预温热的解离试剂(TrypLE;GIBCO),轻轻摇动培养瓶以完全覆盖细胞层。我们将培养瓶转移到培养箱(37℃,5%CO2)中20分钟,每5分钟在显微镜下检查细胞的解离。当≥90%的细胞脱离时,我们加入8ml预温热的CnT-02生长培养基(CELLNTEC),用移液管将其分散在细胞层表面上数次。将细胞悬浮液转移至50ml锥形管中并离心(1000rpm,4分钟)。我们将细胞沉淀重悬在5ml预温热的无血清CnT-02生长培养基(CELLNTEC)中,并以1:5的比例分开细胞。我们稀释细胞悬液板并将合适体积用移液器吸至新的12孔板,将细胞返回培养箱(37℃,5%CO2)。
当所分开的细胞达到30-40%汇合时,开始用5ng/ml TGFβ1(rhTGFβ1;R&D system)处理它们。我们将媒介物(4mM HCl+1mg/mL BSA)添加到对照侧,将TGFβ1(5ng/mL)添加到实验侧,并轻轻混合。我们每隔一天更换培养基,持续10天。为了固定细胞,我们吸出培养基,用PBS洗涤细胞,然后用100%甲醇固定20分钟。固定后,我们用PBS(x3)洗涤固定的细胞,并将其储存在4℃。
免疫细胞化学通用步骤:(1)在0.15M PBS(pH 7.2;4×5分钟)中洗涤样品载玻片;(2)在4%正常山羊血清(NGS)中孵育20分钟(2ml的0.15M PBS+80μL NGS);(3)与一抗溶液孵育(细节如下;90分钟);(4)用0.5M PBS洗涤(3次×10分钟);(5)用在0.15M PBS中的4%NGS封闭(20分钟);(6)与二抗(生物素-SP-缀合的山羊抗兔IgG;60分钟)孵育;(7)用0.15M PBS洗涤(3次×10分钟);(8)制备ABC溶液并在ABC溶液中孵育(以下详述;60分钟(5mL 0.15M PBS+ABC溶液600μL);(9)用0.1M AI缓冲液(175mM乙酸钠和10mM咪唑,pH7.2)洗涤3次×10分钟[在1000mL H2O中14.35g乙酸钠,0.68g咪唑];(10)进行DAB反应5-20分钟,经常检查;和(11)在用含0.04%TritonX-100的0.05M PBS中洗涤15分钟,以终止反应。
一抗溶液含有含0.5%Triton X-100的0.15M PBS;在含0.5%TritonX-100的0.15M PBS中的4%NGS;和1:500稀释的一抗(2mL PBS+0.04%Tx 100+80μL NGS+4μL一抗)。二抗溶液含有含0.5%Triton X-100的0.15M PBS和1:2500稀释的二抗(山羊抗兔IgG)[2ml PBS+0.04%Tx 100+0.8uL GαR]。为了制备ABC(抗生物素蛋白生物素复合物)溶液,在Eppendrof管中向500μL的0.15M PBS中加入1滴A,1滴B。将其在室温下在振荡平台上放置30分钟。DAB溶液含有50mL的125mM乙酸钠缓冲液,pH 9.3,向其中加入10mg DAB(搅拌直到溶解)和16.5μL 30%H2O2。
N-钙粘着蛋白,E-钙粘着蛋白,胶原蛋白-1,釉质素(Amelogenin)和OCT4的免疫细胞化学:为了染色N-钙粘着蛋白,我们使用兔多克隆N-钙粘着蛋白抗体(以1:1000稀释;ab12221)作为一抗,山羊抗兔抗体(1:2500)作为二抗。为了对E-钙粘着蛋白染色,我们使用兔多克隆E-钙粘着蛋白抗体(1:500;H-108[SC-7870])作为一抗,使用山羊抗兔抗体(1:2500)作为二抗。为了染色胶原蛋白-1,我们使用山羊多克隆胶原蛋白抗体(1:500[Col 1A1(D13)][SC-25974])和山羊抗驴二抗(1:2500)。为了对釉质素染色,我们使用兔多克隆釉质素抗体(1:500;Amelx;ab59705)作为一抗和山羊抗兔抗体(1:2500)作为二抗。为了对OCT4染色,我们使用兔多克隆Oct4抗体(1:1000)作为一抗和山羊抗兔抗体(1:2500)作为二抗。
如图1(b)所示,用转分化因子TGFβ1和5-羟色胺处理的釉质类器官的细胞和细胞外基质中的釉质素的表达作为证据证明,细胞承继了成釉质细胞的特征。更具体地,如图3(a)-3(f)所示,在TGFβ1的影响下,口腔上皮角质形成细胞获得Oct4(b)的表达并失去胶原蛋白1(d)的表达。在TGFβ1处理之前(e)或之后(f),细胞不表达釉质素。然而,当进一步用5-羟色胺处理细胞时,它们表达釉质素(图4)。
5-羟色胺,5-羟色胺受体和发育中的牙齿:已经在小鼠釉质器官中在体内鉴定了5-羟色胺受体(Riksen et al.,Eur.J.Oral Sci.118:566-573,2010)。向含有发育中牙芽的器官型小鼠培养物中加入5-羟色胺诱导了下游途径活化并加速了牙齿发育,这被拮抗剂逆转(Moiseiwitsch and Lauder,Arc.Oral Biol.41:161-166,1996;Moiseiwitsch et al.,Arc.Oral Biol.43:789-800,1998)。小鼠中5-羟色胺5TH2B受体的靶向缺失导致小鼠牙齿组织的结构改变(Dimitrova-Nakov et al.,Calcif.Tissue Int.,94(3):293-300,2014)。总的来说,这些数据显示5-羟色胺信号传导在牙齿发育中发挥作用。
用TGFβ1和5-羟色胺处理:如上所述我们用TGFβ1(5ng/ml)处理了解冻和培养的IMOK细胞10天,然后用5-羟色胺(100μM)再处理10天。在最初的研究中,我们使用两个12孔板,细胞在30-40%汇合。我们用TGFβ1(5ng/ml)处理实验侧10天,并且向对照侧添加相同量的媒介物(4mM HCL+1mg/ml ABS)。我们每隔一天更换培养基。在用TGFβ1处理10天后,我们如下处理两个平板。在IMOK板#1上,我们继续TGFβ1处理(5ng/ml),并将5-羟色胺(100μM)加入实验侧。在IMOK板#2上,我们向实验侧添加100μM 5-羟色胺,并将媒介物添加至对照侧。我们每隔一天更换培养基,持续8天。为了固定细胞,我们将它们暴露于100%甲醇20分钟,用PBS(3x)洗涤它们并将其储存在4℃。
我们还测试了不同5-羟色胺浓度对用TGFβ1处理10天的IMOK细胞的影响。细胞以1:8分开,我们每隔一天更换CnT-02无血清培养基。当细胞达到40%汇合时,将它们用TGFβ1(5ng/ml)处理10天,然后以1nM,10nM,100nM,1μM,10μM或100μM的浓度加入5-羟色胺到选择的孔中。我们在平板的其他孔中继续TGFβ1(5ng/ml)处理,作为对照。我们每隔一天更换培养基,持续另外10天,用100%甲醇固定细胞,并将它们储存在4℃。
我们建立了IMOK细胞的2维和3维培养物,以研究矿物质化溶液对用TGFβ1和5-羟色胺处理的细胞的影响。在我们解冻细胞后,将它们置于具有无血清培养基CnT-02(每隔一天更换)的T25培养瓶中。当细胞达到40%汇合时,我们用TGFβ1(5ng/ml)处理它们10天,然后铺板并用10μM 5-羟色胺处理10天(继续每隔一天更换培养基)。2-D培养物用100%甲醇固定,3-D培养物用10%福尔马林固定。我们添加了羟基磷灰石(HA)到未被固定的组,每隔一天更换培养基。
为了产生3-D培养物,我们使用BD MatrigelTM Basement Membrane Matrix(cat#356234)并在4℃下预冷却移液管、吸头和组织培养物过夜。在一个我们称为“厚凝胶法”的方法中,我们在4℃下在冰上解冻凝胶过夜,然后用无血清培养基(CnT-02)1:1(凝胶:培养基)稀释,并充分混合。我们将培养板保持在冰上,并以150-200μl/cm2的生长表面向细胞培养孔(铺板密度1:5分开)加入凝胶。在37℃下孵育细胞30分钟后,我们向每个孔中加入1ml培养基。
我们将如上所述用TGFβ1和5-羟色胺处理的细胞暴露于Wiedemann-Bidlack等人描述的矿物质化溶液中(J.Struct.Biol.173(2):250-260,2011)。使用CaCl2.2H2O(Sigma)和KH2PO4(Sigma)制备钙(30mM)和磷酸盐(30mM)的储液。在室温下将KH2PO4溶液调节至pH 7.4,并且在使用前将两种溶液通过0.22μm过滤器过滤。将终浓度为2.5mM的钙和1.5mM的磷酸盐加入到板中(从而产生矿物质化溶液)。我们用矿物质化溶液培养细胞10天,每隔一天更换培养基。
为了制备冷冻切片,我们用10%福尔马林固定培养物过夜,然后用PBS洗涤1小时。我们在滤纸中收集凝胶,将其包埋在30%蔗糖中1小时,然后包埋在29℃的OCT中。使用标准技术将冷冻组织在低温恒温器(-29℃)上切片至约5μm,将切片置于Fisher SuperfrostTM载玻片上,并在室温下干燥过夜。我们通过将载玻片浸入冷丙酮(-20℃)中2分钟来固定载玻片。它们空气干燥后,我们继续将它们染色。其它合适的固定剂包括醇、甲醇、福尔马林等。
通过标准方法进行H&E(苏木精和伊红)染色。简言之,我们:(1)在50ml锥形管中将经空气干燥的载玻片用过滤的0.1%苏木精染色10分钟;(2)在冷却运行的ddH2O中漂洗5分钟;(3)将它们浸入0.5%伊红(1.5g溶解在300ml的95%EtOH;12x)中,随后用蒸馏水直到伊红停止出条纹,然后是50%EtOH(10x)和70%EtOH(10x);(4)在95%EtOH中平衡载玻片30秒,然后用100%EtOH平衡1分钟;(5)将它们浸入二甲苯几次,用面巾纸擦拭去过量二甲苯;和(6)封片并用Cytoseal XYLTM盖上盖玻片。如图1(a)所示,釉质类器官是球形簇,包括以栅栏布置为特征的外围边界细胞层。如图所示,细胞是极化柱状细胞,一些是立方体形的。细胞具有中等体积的细胞质和单个立方体形或卵形核。
我们用茜素红染色来自2D培养物的福尔马林固定的细胞。我们的工作溶液可以在黑暗中储存长达三个月,并且包括1g Alizarin Res S(Sigma,Cat.#A5533)+100ml蒸馏水。我们使用0.1%氢氧化铵将pH调节至4.1-4.3,然后将溶液用无菌过滤器过滤。用自来水洗涤细胞后,我们用茜素红工作溶液将它们染色5分钟,然后再次用自来水洗涤。
我们还用茜素红染色已暴露于羟基磷灰石(HA)或HA和5-羟色胺的3D细胞培养物的冷冻切片。我们用蒸馏水快速冲洗载玻片,然后是茜素红溶液(2%)30秒至3分钟,显微镜检查橙红色染色的显色。在摇掉染料溶液后,我们将载玻片浸入丙酮(20次)和丙酮-二甲苯(20次)中,用二甲苯清除它们,并将它们在PermountTM中封片。如图1(c)所示,釉质类器官是茜素红染色阳性,识别钙并显示细胞诱导矿物质化(与成釉质细胞一样)。
如图2a-2d所示,口腔上皮角质形成细胞通常在培养物中表达E-钙粘着蛋白(a)。TGFβ1处理诱导E-钙粘着蛋白表达的丧失(b)。相比之下,通常N-钙粘着蛋白不表达(c),而是由TGFβ1(d)诱导。因此,源自口腔上皮的角质形成细胞可以经历与成为成釉质细胞的体内细胞相同的E-钙粘着蛋白至N-钙粘着蛋白转换。在组织学上,这些细胞是圆形的并在汇合控制条件下彼此连接,而在TGFβ1处理后,细胞尺寸增大、分离并扩散。
如图5所示,如本文所述产生的釉质产品样品在射线照片中看起来不透明。
如上所述,支架可用于促进三维釉产品的生产。例如,我们在48孔培养皿中以每个支架接种3x 106个成釉质细胞样细胞(从如上所述,相信由IMOK细胞系制备)接种,并允许细胞在含有10%FCS的DMEM中附着到支架上。将培养物于37℃、5%CO2下培养24小时。然后用冷的(4℃)DMEM替换培养基以除去未附着的细胞并冷却支架。然后将支架结合的细胞转移到含有冷(4℃)液体MatrigelTM的新的细胞培养皿中。我们轻轻地摇动培养皿以促进支架暴露于MatrigelTM,然后将培养皿在37℃下培养30分钟。之后,我们向每个孔中加入1ml培养基,将细胞培养10天,然后在矿物质化培养基存在下再培养10天。
- 还没有人留言评论。精彩留言会获得点赞!