转基因猪胰岛和其用于治疗糖尿病的用途的制作方法
本发明涉及糖尿病治疗领域。本发明尤其涉及通过移植来自猪的朗格汉斯岛来治疗糖尿病,其中PKA和PKC路径被转基因地修饰,优选地被组成性地激活。
背景技术:
I型糖尿病也称为胰岛素依赖性糖尿病(IDDM)或青少年糖尿病,这是一种慢性病。主要症状是高于正常值的血糖过高,这是由于朗格汉斯岛的β细胞无法生产胰岛素引起的。在绝大多数患者中,β细胞被T细胞所介导的自身免疫攻击破坏。
常规治疗是每天注射胰岛素,以便补偿胰腺产量的不足。然而,虽然可以挽救生命,但是用胰岛素治疗通常并不提供对血糖的充分控制,不能预防该疾病的威胁生命的并发症。因此目前开发了其它治疗。一些是基于胰腺或朗格汉斯岛移植以恢复胰岛素的正常生产。同种异体移植(将人来源的器官移植给人)因为人胰岛组织的短缺以及每名接受者需要若干胰腺而受到限制。因此需要产胰岛素细胞的替代来源。
猪胰岛代表人胰岛移植的一个有前景的替代方案,因为其可以大量获得而不会引起伦理问题。猪β细胞所产生的胰岛素与人胰岛素只有一个氨基酸不同,并且已经长期用于治疗糖尿病病人。此外,对猪细胞的基因改造在技术上是可能的并且应当解决与不协调的胰岛异种移植相关的若干问题,例如通过最小化所需胰岛的数目和血栓形成的风险两者(Dufrane&Gianello,Transplantation,2008,86(6),753:60)。此外,在异种移植模型中的免疫抑制可以通过微囊封/巨囊封方法克服(Dufrane等人,2010,Transplantation,90(10):1054-1062;WO2007/144389和WO2010/032242)。
近十年来已经公开了若干临床前猪到非人灵长动物研究,得到关于在接受者内产生胰岛素的有前景的结果(清单请参见Dufrane&Gianello,Transplantation,2008,86(6),753:60)。具体来说,临床研究目前针对人糖尿病患者,例如通过使用由Living Cell Technologies研发的产品其包括用海藻酸盐囊封的猪胰岛。
然而,猪胰岛对葡萄糖刺激显示相对弱的应答。当通过将葡萄糖浓度从静止水平(1-2mM)增加到刺激水平(8-15mM)来刺激分离的猪胰岛时,胰岛素分泌的增加介于1.5倍与3倍之间(Crowther等人1989,Horm.Metabol.Res,21:590-595;Bertuzzi等人1995,FEBES Letters 379:21-25;Dufrane等人2007,Diabetes&Metabolism 33:430-438;Mueller等人2013,Xenotransplantation,20:75-81)。相比之下,当利用葡萄糖浓度的类似增加激发人、灵长动物或啮齿动物胰岛时,胰岛素分泌增加12到16倍(Dufrane等人2007;Mueller等人2013)。当被移植到胰岛素需求更高的生物体(例如非人灵长动物,且可能是人)中时,猪胰岛的这种特性有时会令人对其作为糖尿病治疗的效用产生怀疑。具体来说,与人胰岛相比,猪胰岛对血糖的应答更低,这导致需要移植大量的猪胰岛以充分校正人葡萄糖水平,这也是治疗方法的一个缺点,因为为了移植一名患者目前要使用若干头猪。
因此需要一种通过猪胰岛的异种移植治疗糖尿病患者的改良方法。
在人β细胞中,响应于血糖水平的胰岛素合成和分泌可能涉及两种路径:(i)PKC路径,和(ii)PKA路径。本文的申请人意外地证实,两种路径的组成性激活导致胰岛素分泌的协同增加。这个结果尤其出乎意料,因为之前在现有技术中证实,在小鼠中PKC和PKA对胰岛素分泌的作用甚至不具有累加性(Yang&Gillis,J.Gen.Physiol.,2004,124:641-651;Wan等人,J;Gen.Physiol.,2004,124:653-663)。
本发明因此涉及一种其中PKC和PKA路径被组成性地激活的转基因猪β细胞、转基因猪胰岛和转基因猪,并且涉及其用于在有需要的受试对象中治疗糖尿病的用途。
技术实现要素:
本发明因此涉及一种分离的转基因猪β细胞,其中PKC和PKA路径被组成性地激活。
在一个实施方案中,所述细胞包含组成性活性的乙酰胆碱受体,优选毒蕈碱性受体,更优选III型毒蕈碱性受体。在一个实施方案中,组成性活性的III型毒蕈碱性受体具有氨基酸序列SEQ ID NO:4,或与SEQ ID NO:4具有至少70%序列同一性的序列。
在一个实施方案中,所述细胞表达GLP-1。在一个实施方案中,GLP1具有氨基酸序列SEQ ID NO:6,或与SEQ ID NO:6具有至少70%序列同一性的序列。
本发明还涉及一种分离的转基因猪胰岛,其包含本发明的猪β细胞。
本发明的另一个目标是一种用于获得本发明的分离的转基因猪β细胞或本发明的分离的转基因猪胰岛的离体方法,其中所述方法使用包含编码组成性活性的III型毒蕈碱性受体的核酸序列的表达载体,和包含编码GLP-1的核酸序列的表达载体。
本发明的另一个目标是一种分离的转基因猪β细胞或分离的转基因猪胰岛,其通过用于获得本发明的分离的转基因猪β细胞或本发明的分离的转基因猪胰岛的离体方法而获得。
本发明还涉及一种转基因猪,其包含本发明的分离的转基因猪β细胞或分离的转基因猪胰岛。
本发明还涉及一种装置,其包含本发明的分离的转基因猪β细胞或分离的转基因猪胰岛。在一个实施方案中,所述分离的转基因猪β细胞或所述分离的转基因猪胰岛囊封在海藻酸盐组合物中。
本发明的另一个目标是本发明的分离的转基因猪β细胞或分离的转基因猪胰岛或装置,其用于治疗与内分泌胰腺或β细胞的功能受损相关的疾病、病症或病状。在一个实施方案中,所述与内分泌胰腺或β细胞的功能受损相关的疾病、病症或病状选自包括以下的组:I型糖尿病、II型糖尿病、妊娠糖尿病、隐匿性自身免疫糖尿病、1.5型糖尿病、脂肪萎缩性糖尿病、青年成熟期发病型糖尿病、新生儿糖尿病(例如永久性新生儿糖尿病或暂时性新生儿糖尿病)、前驱糖尿病、类固醇诱导的糖尿病、胰腺癌,尤其是内分泌胰腺癌,例如内分泌胰腺肿瘤和胰腺神经内分泌癌。
本发明的另一个目标是本发明的分离的转基因猪β细胞或分离的转基因猪胰岛或装置,其用于在有需要的受试对象体内调控血糖水平。
本发明的另一个目标是本发明的分离的转基因猪β细胞或分离的转基因猪胰岛或装置,其用于在有需要的受试对象体内恢复正常胰岛素分泌水平。
定义
在本发明中,以下术语具有以下含义:
‐“分离的”是指器官、组织或细胞已经从其天然环境中分离并且至少约75%不含、80%不含、85%不含且优选地约90%、95%、96%、97%、98%、99%不含与其天然地一起存在的其它细胞,但是缺少分离所述细胞所基于的细胞表面标志物。该术语包括从天然环境总体物理分离,例如从供体动物移除,和通过离解改变器官、组织或细胞与其邻近细胞或与其直接接触的细胞的关系。细胞群体的分离方法在所属领域是众所周知的并且包括(但不限于)通过流式细胞术、磁性选择、亲和色谱法、淘选或其组合的细胞分选。
‐“协同作用”定义两种或更多种试剂的相互作用,它们以积极方式一起作用以产生比单独工作的每种试剂的作用的总和更大的作用。
‐数字前的“约”意味着所述数字的值的加或减10%。
‐“治疗”是指治疗性治疗;其中目的是预防或减缓(减轻)靶向的病理情况或病症。需要治疗的对象包括已经患有病症的对象。如果在接受治疗量的本发明的转基因猪胰岛或猪β细胞之后,受试对象显示以下情况中一种或多种的可观察到的和/或可测量到的降低或不存在,那么受试对象的疾病、病症或病状被成功地“治疗”:胰岛素分泌的改善;和/或与特定疾病或病状相关的症状中一种或多种在某种程度上的减轻;发病率和死亡率的下降、血糖控制的改善和生活品质问题的改善。用于评估疾病的成功治疗和改善的以上参数可以通过医生熟悉的常规程序容易地测量。
‐“治疗有效量”意思是在不对靶标造成显著的负面或不利副作用的情况下实现以下目的的转基因猪胰岛或β细胞的水平或量:(1)减缓或停止与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状的一种或多种症状的发展、加剧或恶化;(2)使与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状的症状得到改善;(3)降低与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状的严重性或发病率;或(4)治愈与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状。根据本发明,治疗有效量通常在与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状开始之后施用以获得治疗作用。
‐“植入”或“移植”(可互换使用)是指通过使器官、组织、细胞或组合物定位于期望部位的方法或途径将器官、组织、细胞或组合物放入受试对象例如异种受试对象中。如本文所使用,异种受试对象是指其中引入或将要引入另一物种的细胞的接受者。具体来说,在本发明的上下文中,异种受试对象可指其中引入或将要引入猪细胞的灵长动物,优选人。
‐“与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状”包括存在异常的内分泌胰腺或β细胞功能的病症。此类异常内分泌胰腺功能可以包括正常内分泌胰腺功能受损或不存在,或存在异常内分泌胰腺功能。与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状的实例包括(但不限于)I型糖尿病、II型糖尿病、妊娠糖尿病、隐匿性自身免疫糖尿病、1.5型糖尿病、脂肪萎缩性糖尿病、青年成熟期发病型糖尿病、新生儿糖尿病(例如永久性新生儿糖尿病或暂时性新生儿糖尿病)、前驱糖尿病、类固醇诱导的糖尿病、胰腺癌,优选是内分泌胰腺癌,例如内分泌胰腺肿瘤和胰腺神经内分泌癌。
‐“调控血糖水平”:维持血糖水平处在类似年龄和体重的正常非糖尿病个体的多项参数内。在一个实施方案中,调控血糖水平意味着恢复正常的空腹血糖水平。在一个实施方案中,正常的空腹血糖水平低于110mg/dL(6.1mmol/L),优选低于100mg/dL(5.6mmol/L)。
‐“海藻酸盐”:海藻酸的盐。从海藻分离的海藻酸是由两种糖醛酸D-甘露糖醛酸和L-古罗糖醛酸组成的多糖醛酸。海藻酸基本上不溶于水。它与以下物质形成水溶性盐:碱金属,例如钠、钾和锂;镁;铵;和衍生自例如甲胺、乙醇胺、二乙醇胺和三乙醇胺等低碳数胺的经取代铵阳离子。这些盐在高于pH 4的水性介质中是可溶的,但是当pH被降到约pH 4以下时转化为海藻酸。在存在适当浓度的成胶离子(例如钙、钡、锶、锌、铜(+2)、铝和其混合物)的情况下形成热不可逆的不溶于水的海藻酸盐凝胶。海藻酸盐凝胶可以通过浸泡在可溶阳离子的溶液中或成胶离子的螯合剂(如EDTA、柠檬酸盐等)的溶液中而增溶。
具体实施方式
本发明因此涉及一种猪β细胞,优选分离的猪β细胞,其中PKC和PKA路径被组成性地激活,从而通过所述细胞诱导胰岛素分泌的增加。根据本发明,PKC和PKA路径的组成性激活是由本发明的猪β细胞的转基因改造引起的。
胰岛受副交感神经、交感神经和感觉神经支配。因此,胰岛素分泌受副交感神经系统刺激并被交感神经系统抑制。乙酰胆碱(ACh)是副交感神经通过PKC路径控制β细胞中所涉及的主要神经递质。头期(即在血糖水平的任何增加之前响应于感觉刺激的胰岛素分泌)取决于副交感神经刺激,其随后在整个进餐期间持续。ACh可以结合于β细胞质膜中存在的M3毒蕈碱性受体。这些受体(通过Gq)偶合于磷脂酶C(PLC),PLC在激活后水解膜磷酸肌醇,例磷脂酰肌醇-4,5-二磷酸(PIP2)。在胰岛中,像其它细胞中一样,这种水解导致形成两种主要产物:肌醇-1,4,5-三磷酸(IP3)和二酰甘油(DAG)。DAG可以激活PKC路径,导致胰岛素合成和分泌的增强。平行地,IP3可以结合于内质网上的IP3敏感性Ca2+通道,从而诱导细胞质内Ca2+的排出,这接着导致胰岛素合成和分泌的增强。根据本发明,“PKC路径”包括M3毒蕈碱性受体和下游元件(Gq蛋白、PLC、DAG、PKC…)。
来自回肠和结肠粘膜的L细胞分泌胰高血糖素样肽1(GLP-1),并且来自十二指肠空肠粘膜的K细胞分泌葡萄糖依赖性促胰岛素多肽(GIP)。这两种激素结合于其对应的G蛋白偶合受体(GPCR)并且负责肠促胰岛素作用,所述肠促胰岛素作用在餐间发生并且通过在口服施用而不是静脉内注射给定葡萄糖负载时胰岛素分泌的更大刺激而在实验上得到证明。这两种激素的作用主要由通过蛋白激酶A和Epac2(即PKA路径)作用的cAMP介导。PKA以及与分泌过程相关的蛋白质使葡萄糖转运蛋白-2(Glut2)、K-ATP通道的Kir6.2和SUR1子单元磷酸化。小的GTPase Rap1可以通过尤其在葡萄糖诱导的胰岛素分泌的第一个阶段期间增加可轻易释放的胰岛素颗粒的数量而作为Epac2依赖性路径的效应分子。根据本发明,“PKA路径”包括GLP-1、GPCR和下游元件(腺苷酸环化酶、cAMP、PKA…)。
在一个实施方案中,PKC路径的组成性激活是因为M3毒蕈碱性受体的组成性激活。PKC路径的组成性激活因此可以通过测量从细胞流出的肌醇三磷酸(IP3)证明。实际上,导致PKC激活的磷脂酶C激活引起膜磷酸肌醇分解成IP3和二酰甘油(DAG)。在一个实施方案中,PKC路径的组成性激活可以根据测试A证明,其中测试A包括用肌-[2-3H]肌醇装载细胞2小时来标记肌醇池的第一步骤,以及在细胞中测量流出物3H并定量剩余信号的第二步骤,从而可以证明PKC路径激活(Garcia等人,1988,Biochem J.,254,211-218)。
在一个实施方案中,PKC路径的组成性激活诱导在测试A的条件中测量的总IP3与对照相比增加了至少5倍,优选10、15、20、25或30倍或更高,其中所述对照优选地对应于其中PKC路径没有被组成性地激活的细胞。
在另一个实施方案中,PKC路径的组成性激活可以通过经由测量蛋白质的磷酸化形式(磷酸化PKC是这种酶的活性形式)的量评估PKC的组成性激活而证明。这可以例如通过来自本发明的转基因猪β细胞的蛋白质提取物的蛋白质印迹法实现。特异性地识别磷酸化PKC的抗体可用于确定转基因和野生型猪β细胞中的相比总PKC的被激活PKC的量。此类抗体的实例包括(但不限于)ab59411、ab75837、ab76016和ab32502(Abcam)。在一个实施方案中,可以测量磷酸化PKC/非磷酸化PKC(即活性PKC/非活性PKC)的比率。在一个实施方案中,PKC的组成性激活导致此比率与野生型细胞中所测量的比率相比增加2倍,优选增加3、4、5、6、7、8、9、10倍或更高。
在一个实施方案中,腺苷酸环化酶激活导致从ATP分解形成cAMP,PKA路径的组成性激活可以根据测试B证明,其中测试B通过使用市售的分析试剂盒(Ramos等人,2008,J Gen Physiol,132(3):329-338)测量β细胞中的总cAMP浓度来检测因GLP-1与其膜受体的结合而导致的腺苷酸环化酶激活。
在一个实施方案中,PKA路径的组成性激活对应于在测试B的条件中测量的总cAMP与对照相比增加了至少20、25、30或35倍或更高,其中所述对照优选地对应于其中PKA路径没有被组成性地激活的细胞。
在另一个实施方案中,PKA路径的组成性激活可以通过经由测量蛋白质的磷酸化形式(磷酸化PKA是这种酶的活性形式)评估PKA的组成性激活而证明。这可以例如通过来自本发明的转基因猪β细胞的蛋白质提取物的蛋白质印迹法实现。特异性地识别磷酸化PKA的抗体可用于确定转基因和野生型猪β细胞中的相比总PKA的被激活PKA的量。此类抗体的实例包括(但不限于)ab5815、ab118531和ab39218(Abcam)。在一个实施方案中,可以测量磷酸化PKA/非磷酸化PKA(即活性PKA/非活性PKA)的比率。在一个实施方案中,PKA的组成性激活导致此比率与野生型细胞中所测量的比率相比增加2倍,优选增加3、4、5、6、7、8、9、10倍或更高。
在本发明的一个实施方案中,与天然猪β细胞相比,在测试C的条件中,转基因猪β细胞能够分泌至少约2、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10倍,优选至少15倍,更优选至少20倍,且甚至更优选至少25倍的胰岛素。
用于测定胰岛素的分泌水平的测试C的方法可以例如如下所述:
1)将转基因猪β细胞在37℃、5%CO2/95%O2下,在含有10%热灭活FCS、100IU/ml青霉素、100μg/ml链霉素、5mmol/l葡萄糖的RMPI培养基中培养过夜,
2)将所述转基因猪β细胞在含有1mmol/L或15mmol/L葡萄糖的1mLKrebs-Ringer缓冲液中孵育2小时,
3)通过放射免疫分析法定量回收的培养基中和孵育的转基因猪β细胞中的胰岛素。
在一个实施方案中,PKC路径的组成性激活是由乙酰胆碱受体、优选毒蕈碱性受体、更优选III型毒蕈碱性受体的组成性激活引起的。在一个实施方案中,转基因猪β细胞在其膜上包含被组成性激活的III型毒蕈碱性受体。
可以通过所属领域技术人员已知的体外方法证明转基因猪β细胞的膜上的被组成性激活的III型毒蕈碱性受体的表达。此类方法的实例包括(但不限于)蛋白质印迹法,其使用针对III型毒蕈碱性受体的抗体或针对连接在被组成性激活的III型毒蕈碱性受体序列上的标签的抗体(关于标签的清单请参看下文)。
在一个实施方案中,可以通过所属领域技术人员已知的体外方法证明转基因猪β细胞的基因组中的被组成性激活的III型毒蕈碱性受体序列的整合。此类方法的实例包括(但不限于)RT-PCR,其使用例如以下引物对:正向引物:5’CCCAATTGATGTACCCATAC 3’(SEQ ID NO:17)-反向引物:5’GTGATCTGACTTCTGGTCTC 3’(SEQ ID NO:18)。
来自猪(山猪(Sus scrofa))的III型毒蕈碱性受体是对应于登录号NP_001116570.1(蛋白质序列,SEQ ID NO:1)和NM_001123098.1(cDNA序列,SEQ ID NO:2)的乙酰胆碱受体。III型毒蕈碱性受体的激活可以诱导磷脂酶C的激活,其水解细胞膜磷脂,导致产生二酰甘油(DAG)和/或肌醇三磷酸(IP3)。DAG可以激活PKC路径,导致胰岛素合成和分泌的增强。平行地,IP3可以结合于内质网上的IP3敏感性Ca2+通道,从而诱导细胞质内Ca2+的排出。两者都导致胰岛素合成和分泌的增强。
在一个实施方案中,被组成性激活的III型毒蕈碱性受体具有序列SEQ ID NO:1,其中点突变(Gln490→Leu,位置490位于没有第一个Met氨基酸(对应于起始密码子)的序列中,并且因此涉及SEQ ID NO:1的位置491)引起组成性激活并且其中缺失一个区域以增加表达。在一个实施方案中,所述删除包括SEQ ID NO:1的氨基酸275到470。
在一个实施方案中,被组成性激活的III型毒蕈碱性受体由核酸序列SEQ ID NO:3,或与SEQ ID NO:3具有至少70%、优选75%、80%、85%、90%、95%或更高序列同一性的核酸序列编码。在一个实施方案中,被组成性激活的III型毒蕈碱性受体具有氨基酸序列SEQ ID NO:4,或与SEQ ID NO:4具有至少70%、优选75%、80%、85%、90%、95%或更高序列同一性的序列。
在一个实施方案中,被组成性激活的III型毒蕈碱性受体包含标签,例如HA标签(例如具有序列SEQ ID NO:13,由核苷酸序列SEQ ID NO:12编码)。优选地,经HA标记的被组成性激活的III型毒蕈碱性受体具有序列SEQ ID NO:21。
当用在两种或更多种核酸序列或两种或更多种多肽之间的关系中时,术语“同一性”或“相同”是指核酸序列或多肽之间的序列相关程度,如分别通过两个或更多个核酸或氨基酸残基的链段之间的匹配数所确定。“同一性”衡量两个或更多个序列的较小之间的相同匹配的百分比,其中利用通过特定数学模型或计算机程序(即算法)所解决的空位比对(如果有的话)。可以通过已知方法容易地计算相关核酸序列或多肽的同一性。此类方法包括(但不限于)在Computational Molecular Biology,Lesk,A.M.,ed.,Oxford University Press,New York,1988;Biocomputing:Informatics and Genome Projects,Smith,D.W.编辑,Academic Press,New York,1993;Computer Analysis of Sequence Data,Part 1,Griffin,A.M.和Griffin,H.G.编辑,Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academic Press,1987;Sequence Analysis Primer,Gribskov,M.和Devereux,J.编辑,M.Stockton Press,New York,1991;和Carillo等人,SIAM J.Applied Math.48,1073(1988)中描述的那些。用于测定同一性的优选方法被设计成给出所测试序列之间的最大匹配。在公众可获得的计算机程序中描述了测定同一性的方法。用于测定两个序列之间的同一性的优选计算机程序方法包括GCG程序包,包括GAP(Devereux等人,Nucl.Acid.Res.\2,387(1984);Genetics Computer Group,University of Wisconsin,Madison,Wis.)、BLASTP、BLASTN和FASTA(Altschul等人,J.MoI.Biol.215,403-410(1990))。BLASTX程序从美国国家生物技术信息中心(NCBI)和其它来源(BLAST Manual,Altschul等人NCB/NLM/NIH Bethesda,Md.20894;Altschul等人,上文)是公众可获得的。众所周知的Smith Waterman算法也可用于确定同一性。
在一个实施方案中,PKA路径的组成性激活是由本发明的猪β细胞表达GLP-1引起的。在一个实施方案中,转基因猪β细胞包含整合于其基因组中的GLP-1序列。
可以通过所属领域技术人员已知的体外方法证明转基因猪β细胞的基因组中的GLP-1序列的整合。此类方法的实例包括(但不限于)RT-PCR,其使用例如以下引物对:正向引物:5’CCCGCCCAATTGATGGAGAC 3’(SEQ ID NO:15)-反向引物:5’TCCTCGGCCTTTCACCAGCC 3’(SEQ ID NO:16)。
在一个实施方案中,GLP-1由核酸序列SEQ ID NO:5或与SEQ ID NO:5具有至少70%,优选75%、80%、85%、90%、95%或更高的序列同一性的核酸序列编码。在一个实施方案中,GLP-1具有氨基酸序列SEQ ID NO:6或与SEQ ID NO:6具有至少70%,优选75%、80%、85%、90%、95%或更高的序列同一性的序列。
在一个实施方案中,GLP-1序列经过突变以增强GLP-1的半衰期。在一个实施方案中,用于增强GLP-1的半衰期的所述突变对应于SEQ ID NO:6的位置2中的丙氨酸残基被丝氨酸残基取代(A8S突变)。
在一个实施方案中,GLP-1包含A8S突变并且由核酸序列SEQ ID NO:19或与SEQ ID NO:19具有至少70%,优选75%、80%、85%、90%、95%或更高的序列同一性的核酸序列编码。在一个实施方案中,GLP-1包含A8S突变并且具有氨基酸序列SEQ ID NO:20或与SEQ ID NO:20具有至少70%,优选75%、80%、85%、90%、95%或更高的序列同一性的序列。
在一个实施方案中,GLP1序列进一步包含允许其分泌的另一个序列。在一个实施方案中,所述另一个序列对应于Ig K链信号(核酸序列SEQ ID NO:7,氨基酸序列SEQ ID NO:8)。在一个实施方案中,核酸序列SEQ ID NO:7被插入到编码GLP-1的核酸序列内在第一个ATG之后的位置。
在一个实施方案中,GLP1序列包含A8S突变和Ig K链信号。根据这个实施方案,GLP-1的氨基酸序列可以是SEQ ID NO:10,其由SEQ ID NO:9编码。
在一个实施方案中,GLP-1序列包含弗林蛋白酶(furin)裂解位点,其被插入在Igk链信号与编码GLP-1肽的第一个组氨酸的CAT之间。这个弗林蛋白酶位点的存在确保了合成的肽将在高尔基体中被加工并裂解以产生GLP-1的生物活性形式。这个弗林蛋白酶裂解位点的DNA序列是CGG GGC AGG CGG,其被包含在SEQ ID NO:9中。这个弗林蛋白酶裂解位点的肽序列是Arg Gly Arg Arg,其被包含在SEQ ID NO:10中。
本发明因此涉及一种转基因猪β细胞,优选地涉及一种分离的转基因猪β细胞,其包含:
‐突变乙酰胆碱受体的序列、优选地突变毒蕈碱性受体的序列、更优选地突变III型毒蕈碱性受体的序列,且甚至更优选地序列SEQ ID NO:4,其中所述突变受体被组成性地激活;和
‐编码人GLP-1的序列,其优选地具有序列SEQ ID NO:10。
在一个实施方案中,这两个序列(突变乙酰胆碱受体的序列和编码人GLP-1的序列)处于同一载体(即双顺反子载体)上。
本发明还涉及一种转基因猪胰岛,优选地涉及一种分离的转基因猪胰岛,其包含如上文所述的至少一个转基因β细胞。
在本发明的一个实施方案中,在测试D的条件中,与天然猪胰岛相比,转基因猪胰岛能够分泌至少约2、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10倍,优选至少15倍,更优选20倍,且甚至更优选至少25倍的胰岛素。
用于测定胰岛素的分泌水平的测试D的方法可以例如如下所述:
1)将转基因猪胰岛在37℃、5%CO2/95%O2下,在含有10%热灭活FCS、100IU/ml青霉素、100μg/ml链霉素、5mmol/l葡萄糖的RMPI培养基中培养过夜,
2)将所述转基因猪胰岛在含有1mmol/L或15mmol/L葡萄糖的1mL Krebs-Ringer缓冲液中孵育2小时,
3)通过放射免疫分析法定量回收的培养基中和孵育的胰岛中的胰岛素。
根据本发明,本发明的转基因猪胰岛包含如上文所述的转基因β细胞。
在本发明的一个实施方案中,本发明的转基因猪胰岛展现猪胰岛的正常生理结构,其中α细胞呈环形位于胰岛周边,而β细胞位于胰岛中心。在一个实施方案中,本发明的转基因猪胰岛具有在约50到500μm、优选地约150到250μm范围的大小。在一个实施方案中,本发明的转基因猪胰岛的β/α细胞比例在约5/1到约20/1、优选地约10/1到约12.5/1的范围,更优选地为约11.25/1。
本发明还涉及转基因猪,其在胰腺内包含本发明的至少一个转基因β细胞和/或至少一个转基因猪胰岛。
在本发明的一个实施方案中,转基因猪不含传染性微生物,以便限制异种移植期间疾病的传播风险。作为一个实例,胰岛可以从WO2006/110054中描述的AI猪提取,WO2006/110054以引用的方式并入本文中。这些猪居住在遥远的奥克兰岛(新西兰)上并且不含或准不含(quasi-free)猪内源逆转录病毒(PERV)和其它常见的猪传染性病毒,包括PCMV、PLHV、EMCV、HEV和PCV。另一个实例是在严格的生物安全条件下饲养的不含特异性病原体(SPF)的NZ大白猪。
在本发明的一个实施方案中,转基因改造在体内进行。
在一个实施方案中,转基因改造离体进行,以便产生本发明的转基因猪。使用离体方法产生转基因猪的方法对于所属领域技术人员是众所周知的。在一个实施方案中,以下方法可用于获得转基因猪:
如下所述形成携带猪胰岛素启动子和转基因序列的表达载体。从猪的耳活检产生原代Gal-/-和野生型成纤维细胞并体外培养,优选地在含有10%FCS和10ng/ml的FGF的DMEM/TCM199中在5%CO2和5%O2中培养。
然后转染生长中的培养物。在一个实施方案中,转染通过电穿孔进行。在一个实施方案中,转染通过化学转染进行。在一个优选实施方案中,转染通过灵巧的电穿孔与化学转染的组合进行,例如使用Nucleofector(Amaxa)。
被转染的细胞然后扩增并冷冻以用于核转移。可以扩增一小份所述细胞以进行PCR分析,从而确定转基因的整合。
从在当地屠宰场被屠宰的循环母猪的卵巢回收卵母细胞。使选择的卵母细胞体外成熟,优选地在含有10%FCS的培养基DMEM/F12中在促性腺激素的存在下在5%CO2和38.5℃下成熟42-44小时。在成熟结束时,去除卵丘细胞并选择具有第一极体的卵母细胞用于进一步加工。
在本发明的一个实施方案中,用于核转移的方法是基于无透明带系统:通过短孵育时间的链霉蛋白酶(pronase)消化直到透明带开始溶解来去除透明带。然后用Hoechst对无透明带的卵母细胞染色并在去核之前暴露于细胞松弛素B。使卵母细胞个别地分层为一排微滴并利用钝头微量吸管去核。
在本发明的另一个实施方案中,通过常规的透明带封闭方法制备卵母细胞:用于核转移的细胞生长到融合和/或经历血清饥饿24-48小时以同步其细胞周期。在操纵前,用胰蛋白酶将细胞处理为单细胞悬浮液并保持在室温下直至使用。对于核转移,在临用前以高稀释度将细胞散布在培养皿上(培养基液滴),将去核的卵母细胞首先在含有植物血球凝集素的培养基中洗涤,然后立即滴在细胞上并翻转直到两个单元之间存在强接触(Vajta等人,2003,Biology of reproduction,68:571-8)。
随后使成对体(couplet)(去核的卵母细胞-体细胞)发生细胞融合。将成对体转移到优选地含有0.3M甘露醇、0.01mM Mg、PVA的阴离子培养基中,然后转移到融合室中。通过传递双重DC脉冲(例如1.2Kv/cm,持续30μsec)获得融合。未融合的成对体可以再经受第二轮融合。在一个实施方案中,融合的成对体在通过持续30μsec的1.2KV/cm的双重DC脉冲在含有1mM Ca的融合培养基中融合后的1-2小时内被激活,并在mSOFaa培养基中在5μM细胞松弛素B中孵育3.5-4小时。
在激活后,重构的无透明带的胚胎可以在矿物油下的微滴中的改良的“孔中孔(well of the well)”系统(Vajta等人,2000,Molecular Reproduction and Development,55:256-64)中培养以防止胚胎之间的粘连。
在一个实施方案中,对于体外培养,制备20μl处于油下的mSOFaa微滴(Galli等人,2003,Cloning Stem Cells,5:223-232),然后使用钝头小金属装置制备10到15个小坑。在每个小坑中,在所有培养期间,容纳一个胚胎容纳。在培养的第3天,用新鲜培养基替换一半培养基。在第5天,评估胚胎发育。将致密桑椹胚和早期囊胚转移到同步接受者的子宫中。
可以通过超声波诊断怀孕,例如在孕期第25天。在一个实施方案中,例如通过免疫细胞化学对收集的胎儿或新生动物进行分析以测定胰岛中的转基因表达。在一个实施方案中,在液氮中储存胰腺细胞以用于未来的克隆。基于转基因表达发现,使表达最好的胎儿经历再克隆以产生转基因猪胰岛分离所必需的转基因动物。在这种情况下,使所有的怀孕继续到足月以生下活的动物。
根据一个实施方案,使用病毒载体,优选地使用病毒,更优选地使用选自包括慢病毒(例如具有不同包膜的HIV载体:VSV、γ逆转录病毒(MLV-A、RD114、GALV)、罗斯河病毒、狂犬病病毒、麻疹病毒和腺相关病毒(AAV))的组的病毒进行转基因改造。在一个优选实施方案中,用于转基因改造的载体是慢病毒。
根据一个实施方案,用于猪胰岛细胞的转基因改造的基因处于β细胞特异性猪胰岛素启动子的控制下,所述β细胞特异性猪胰岛素启动子具有或不具有通用启动子例如UCOE启动子(耐沉默)、CAGGS启动子(巨细胞病毒(CMV)早期增强子元件与鸡β肌动蛋白启动子的组合)或CMV(巨细胞病毒)启动子。在一个实施方案中,转基因处于猪胰岛素启动子的控制下,优选地所述胰岛素启动子是β猪胰岛细胞所特有的,导致转基因只在β细胞中表达。胰岛素启动子的核酸序列的一个实例包括(但不限于)SEQ ID NO:11。
在一个实施方案中,转基因蛋白与另一个序列融合。在一个实施方案中,所述另一个序列融合在转基因蛋白的C端。在另一个实施方案中,所述另一个序列融合在转基因蛋白的N端。
在一个实施方案中,所述另一个序列将所述蛋白引导到分泌路径。此类序列的实例包括(但不限于)Ig K链分泌信号(具有氨基酸序列SEQ ID NO:8,由SEQ ID NO:7编码)。
在一个实施方案中,所述另一个序列是标签,其例如允许所述转基因蛋白的鉴别和分离。标签的实例对于所属领域技术人员是众所周知的,并且包括(但不限于)血球凝集素标签(HA标签)、聚精氨酸标签、聚组氨酸标签、Myc标签、Strep标签、S-Tag、HAT标签、3x Flag标签、钙调蛋白结合肽标签、SBP标签、壳聚糖结合结构域标签、GST标签、麦芽糖结合蛋白标签、荧光蛋白标签、T7标签、V5标签和Xpress标签。在一个实施方案中,转基因蛋白包含HA标签,例如具有氨基酸序列YPYDVPDYA(SEQ ID NO:13)并由核酸序列SEQ ID NO:12编码的HA标签。
在一个实施方案中,转基因在其3’端融合于允许转录的有效终止的另一个序列。
在一个实施方案中,转基因与多聚腺苷酸序列融合。在一个实施方案中,转基因与包含多聚腺苷酸序列的兔β球蛋白片段(例如具有序列SEQ ID NO:14)融合。
本发明的另一个目标是一种载体,其包含被组成性激活的乙酰胆碱受体、优选地被组成性激活的毒蕈碱性受体、更优选地被组成性激活的III型毒蕈碱性受体的核苷酸序列,甚至更优选地具有核苷酸序列SEQ ID NO:3。优选地,所述载体选自包括慢病毒的组,例如具有不同包膜的HIV载体:VSV、γ逆转录病毒(MLV-A、RD114、GALV)、罗斯河病毒、狂犬病病毒、麻疹病毒和腺相关病毒(AAV)。优选地,所述被组成性激活的乙酰胆碱受体的核苷酸序列处于β细胞特异性猪胰岛素启动子(例如具有序列SEQ ID NO:11的胰岛素启动子)的控制下。
在一个实施方案中,所述载体包含处于猪胰岛素启动子(在其序列上融合有HA标签和多聚腺苷酸序列)控制下的被组成性激活的III型毒蕈碱性受体的核苷酸序列并且包含序列SEQ ID NO:22。
本发明的另一个目标是一种载体,其包含GLP-1的核苷酸序列,优选地含有A8S突变和/或允许所编码多肽的分泌的另一个序列,甚至更优选地具有核苷酸序列SEQ ID NO:9。优选地,所述载体选自包括慢病毒的组,例如具有不同包膜的HIV载体:VSV、γ逆转录病毒(MLV-A、RD114、GALV)、罗斯河病毒、狂犬病病毒、麻疹病毒和腺相关病毒(AAV)。优选地,所述GLP-1的核苷酸序列处于β细胞特异性猪胰岛素启动子例如胰岛素启动子的控制下。在一个实施方案中,所述胰岛素启动子是β猪胰岛细胞所特有的,导致转基因只在β细胞中表达。胰岛素启动子的核酸序列的一个实例包括(但不限于)SEQ ID NO:11。
在一个实施方案中,所述载体包含GLP1的核苷酸序列并且具有序列SEQ ID NO:23,所述GLP1包含A8S突变和Ig K链分泌信号两者,处于猪胰岛素启动子的控制下并且在其序列上融合有多聚腺苷酸序列。
在一个实施方案中,本发明的转基因猪胰岛或转基因猪β细胞从至少6个月大、优选地8个月大、更优选地18个月大且甚至更优选地2岁大的成年猪分离得到。转基因猪胰岛可以无时间延迟地用于移植患者,但是在有限的时期内发挥功能(例如当囊封在海藻酸盐贴片中时,从成年猪分离的猪胰岛一般可以在约4-6个月、优选地约8个月的时期内在体内发挥功能)。
在另一个实施方案中,本发明的转基因猪胰岛或转基因猪β细胞从约3-4周大的新生猪分离得到。这些猪胰岛必须培养约1周以便成熟,但是与从成年猪分离的猪胰岛相比,在延长的时期内发挥功能。
在一个实施方案中,从新生猪分离的转基因猪胰岛在至少6个月、优选地至少8个月、更优选地至少12个月或更长的时期内在体内发挥功能。
如本文中所使用,成熟猪胰岛对应于这样的猪胰岛,其(i)包含分化细胞,尤其是分化α和β细胞,和(ii)当用葡萄糖刺激时能够分泌胰岛素(这可以在测试D的条件中测量)。
可用于使从新生猪分离的转基因猪胰岛成熟的培养条件对于所属领域技术人员是众所周知的。可使用的培养基的一个非限制性实例是补充有0.25%BSA、10mM IBMX、100U/mL青霉素-链霉素、10mM葡萄糖、2mM谷氨酰胺和10mM烟酰胺的HAM F10培养基。
用于从转基因猪分离猪胰岛的方法对于所属领域技术人员是众所周知的。在一个实施方案中,转基因猪胰岛的分离根据Dufrane等人,Xenotransplantation,2006和Dufrane等人,Transplantation,2006中描述的方案进行,该方案在下文简略地加以总结。
根据一个实施方案,分离方案包括对猪放血以便降低胰腺血含量的步骤。简言之,在脑死亡后,使动物保持心脏跳动直到摘除内脏的时候。通过切开颈动脉和颈静脉进行放血,并吊住后腿将动物悬吊1到10分钟,优选地4到7分钟。
简言之,离体解剖胰腺。根据一个实施方案,用介于5到25分钟之间的热缺血进行胰腺的解剖。于是胰管暴露出来,并插入18号导管。然后借助于灌注液使腺体充满冷储存液。根据一个实施方案,每克组织使用1mL灌注液。将胰腺浸没在保存液中进行储存。根据一个实施方案,保存液是经典的威斯康辛大学液(UW,n=6)或改良UW(UW-M;无羟乙基淀粉和低K+/高NA+)。
然后消化提取的胰腺。根据一个优选实施方案,用优选地由Roche/Boehringer Mannheim提供的释放酶(Liberase)DL研究级(低分散酶(Dispase))酶进行胰腺离解。这种酶在低温下,优选地在约4℃到约12℃范围的温度下,优选地在约8℃下以在约0.1到约1mg/mL范围的浓度,优选地以约0.5mg/mL的浓度溶解于UW-M液中。
根据一个实施方案,使用如Ricordi等人(1986,Diabetes,35:649-653)所述的动态方法消化胰腺。简言之,将充满这种酶的猪胰腺切片,装载到Ricordi室(优选地由具有7个玻璃球的316l不锈钢制成)上,并在37℃下用加热电路消化,并手动摇动该室。当样品中出现大量的分离胰岛时,冷却消化电路,优选地通过添加含10%NCS的冷Ham-F10培养基以便降低酶活性。然后用冷的培养基灌注约25到约40分钟。将胰岛、细胞和碎片收集在250mL管中并在4℃下离心(630g,持续3分钟)。汇集所有的细胞沉淀并将其悬浮在200mL Ham-F10培养基中。
根据另一个实施方案,使用如O’Neil等人,2001所述的静态方法消化胰腺。简言之,用2到4倍体积(mL/g)的释放酶PI灌注胰腺。对胰腺注射以便实现足够的膨胀,将其放在无菌1L Nalgene罐中并通过在37℃下静态孵育45到60分钟来消化。基于目测检查腺体,通过添加Ham-F10+20%NCS终止消化。通过具有1000μm孔径的不锈钢网过滤细胞悬浮液并在Ham-F10+20%NCS中稀释。然后使消化的组织在6mm玻璃珠的床上通过并且穿过不锈钢筛网。利用3到4L的冷Ham-F10+10%NCS将组织流出物收集在250mL圆锥管中并在4℃下以700rpm离心。将胰岛、细胞和碎片收集在250mL管中并在4℃下离心(630g,持续3分钟)。汇集所有的细胞沉淀并将其悬浮在200mL Ham-F10培养基中。
根据一个实施方案,在分离后,纯化转基因猪胰岛。根据一个实施方案,使用如Dufrane等人Xenotransplantation,2006所述的不连续的Ficoll梯度进行转基因猪胰岛的纯化。简言之,使用不连续的Ficoll梯度,优选地Ficoll Euro-Collins梯度在4℃下纯化分离的胰岛。将悬浮于75mL的Ficoll Euro-Collins溶液中的消化后的细胞沉淀(密度=1.1g/cm3)放在平底管中。然后依序添加更低梯度的Ficoll(50mL的1.096g/cm3、50mL的1.060g/cm3和20mL的Ham-F10培养基)。Ham-F10培养基是F-10营养混合培养基并且是市售的,例如由N.V.Invitrogen,Belgium提供。在856g下将梯度管离心17分钟后,从1.1/1.096和1.096/1.060界面收集胰岛。将来自每个界面的胰岛悬浮于含有50mL Ham-F10+10%NCS血清(NCS代表新生牛血清并且是市售的,例如由Biochrom AG,Germany提供)的两个管中。将管在280g下离心3分钟,移除上清液,并用150mL Ham-F10培养基洗涤细胞。这个程序可以重复,例如三次,并且最终将胰岛悬浮于200mL Ham-F10培养基中。
本发明的另一个目标是一种包括本发明的转基因猪胰岛或转基因β细胞的装置。优选地,本发明的装置包括如上文所述的转基因猪胰岛。
根据一个实施方案,本发明的装置是可植入或可移植的装置。根据另一个实施方案,本发明的装置是可注射的装置。
根据一个实施方案,本发明的装置是生物耐久性的,这意味着在植入或注入受试对象时该装置显示提高的生物稳定性。这种提高的生物稳定性能够使装置中存在的细胞与当前情况相比在更长时期内保持在活体内,这将导致提高的治疗功效。
在本发明的一个实施方案中,装置可以是如WO02/32437中所述的血管化的皮下胶原蛋白管,以便允许形成预血管化的自体胶原蛋白贮库,用于放置转基因猪胰岛或转基因猪β细胞。简言之,将具有松动地装配的特氟龙棒的不锈钢网的末端封闭管皮下插入预定移植接受者中。6周后移除特氟龙棒,留下高度血管化的胶原蛋白管。在一个实施方案中,将本发明的转基因猪胰岛或转基因β细胞插入血管状管中,然后用特氟龙塞子密封。
在本发明的另一个实施方案中,装置可以是基质制剂,其包括明胶、胶原蛋白和天然碳水化合物聚合物的制剂。
在本发明的另一个实施方案中,装置可以是血浆凝血酶凝块,即利用异基因凝血酶产生的自体血浆凝块。
在本发明的另一个实施方案中,装置可以是合适的生物相容性材料例如胶囊,用于对移植的转基因猪胰岛或β细胞提供额外的免疫保护。囊封系统在所属领域是众所周知的。有利的是,胶囊由半透膜制成,所述半透膜可透过葡萄糖、营养物和胰岛素,但不能透过体液/细胞免疫组分。
在一个实施方案中,半透膜由选自包括海藻酸盐、硝基纤维素、丙烯腈、琼脂糖和聚四氟乙烯的组的材料制成。在一个优选实施方案中,半透膜由海藻酸盐制成。
在另一个实施方案中,装置可以是用于活细胞的囊封系统,如WO2007/046719所述。根据这个实施方案,囊封系统包括生物耐久性组合物,其包括海藻酸盐,所述海藻酸盐富含甘露糖醛酸,尤其含有约50%到95%的甘露糖醛酸残基,和具有<1.5的多分散指数的聚阳离子,例如聚-L-鸟氨酸。囊封系统可以是使用上文所述的组合物制备的生物相容性微胶囊,其包括:与阳离子交联剂交联的高甘露糖醛酸的海藻酸盐的核心层,具有小于约1.5的多分散指数且形成半透膜的聚阳离子的中间层,和高甘露糖醛酸的海藻酸盐的外层,所述微胶囊在核心层内包括或细胞。
在另一个实施方案中,装置可以是如WO02/032437所述的微胶囊:用于此程序的海藻酸钠是从原材料来源(海藻)提取的并制备成粉末状超纯形式。囊封程序涉及挤压转基因猪胰岛或β细胞与海藻酸钠溶液(1.6%)的混合物使其通过液滴生成针进入胶凝阳离子浴(氯化钙)。被捕获在海藻酸钙凝胶中的胰岛或β细胞然后用正电性的聚-L-鸟氨酸涂布,随后用海藻酸盐外涂层(0.05%)涂布。然后通过添加柠檬酸钠使海藻酸盐的中心核液化。优选地,大多数胶囊含有3个转基因猪胰岛并且具有300到400μm的直径。
在另一个实施方案中,装置可以是如WO2010/032242所述的大胶囊。WO2010/032242公开一种用于通过人工膜移植和免疫分离细胞(例如功能细胞,典型地是朗格汉斯岛)的系统,所述人工膜是通过将细胞巨囊封在水凝胶例如海藻酸盐基质中提供的。形成巨囊封胰岛的水凝胶,以便具有平坦的几何构型,例如厚片、薄片或圆盘。典型地,海藻酸盐结构具有至少一个基本上平坦的表面。海藻酸盐包括超纯级海藻酸盐和交联的指定组成,以便将细胞或组织片段囊封在水凝胶中。典型地,海藻酸盐厚片以2,000-8,000个胰岛/cm2的密度容纳转基因猪胰岛。巨囊封胰岛的海藻酸盐典型地具有小于50%的古罗糖醛酸浓度,使得厚片是足够柔性的,从而符合肾的形状并安装在肾的包膜下空间内,但是具有足够的强度,从而维持厚片的整体物理特征。另外,海藻酸盐包含大于1.5%的干物质含量,使得厚片具有足够的强度和稳定性以便能承受力。典型地,巨囊封的胰岛厚片提供至少1:10(即以体积计的10%胰岛)的胰岛体积与海藻酸盐体积的比率。对于一些应用,用于囊封胰岛的海藻酸盐补充有胶原蛋白。在一些应用中,将胰岛布置在初级海藻酸盐厚片的中心,并且补充性海藻酸盐层围绕囊封在初级海藻酸盐厚片内的胰岛。在此类应用中,医药级的胶原蛋白层可以和补充性海藻酸盐层组合使用。
在本发明的另一个实施方案中,装置可以是如WO2007/144389所述的细胞装置,所述装置包括(a)具有第一侧和第二侧的胶原蛋白基质;(b)被吸收在胶原蛋白基质的第一侧的第一细胞层;和(c)第一胶凝海藻酸盐层和第二胶凝海藻酸盐层;其中第一胶凝海藻酸盐层完全覆盖胶原蛋白基质的第一侧和第一细胞层,并且其中第二胶凝海藻酸盐层完全覆盖胶原蛋白基质的第二侧。
根据一个实施方案,利用Inotech囊封AG装置(Dottikon,Switzerland)将新鲜分离的转基因猪胰岛或β细胞囊封在SLM 100海藻酸盐基质(FMC BioPolymer,Norway)中。
优选地,在植入或注入患者体内之前将本发明的装置灭菌。有利的是,灭菌包括γ照射、电子束、环氧乙烷、高压灭菌或在添加液体组分之前将装置与醇接触,或与NOx气体接触,氢气等离子体灭菌。
优选地,装置具有低含量的内毒素。在一些实施方案中,细胞装置具有小于100内毒素单位(EU)/g、小于90EU/g、小于80EU/g、小于70EU/g、小于60EU/g、小于50EU/g、小于40EU/g、小于30EU/g、小于20EU/g、小于10EU/g、小于5EU/g或小于1EU/g的内毒素水平。
在本发明的另一个实施方案中,装置可以是如WO02/060409所述的囊封室,所述装置包括产生生物活性物质(例如胰岛素)的细胞,例如转基因猪胰岛或β细胞,并且包括至少一个半透膜。所述装置的半透膜可以包括生物相容性多孔聚碳酸酯膜,其中所述多孔聚碳酸酯膜在表面上通过产生极性位点而被修饰,并且其中所述多孔聚碳酸酯膜被至少一种亲水聚合物涂布,例如纤维素、聚丙烯酰胺、聚乙烯吡咯烷酮、乙酸乙烯酯共聚物、聚乙二醇、亲水性聚(甲基)丙烯酸酯、聚糖苷(polyoside)和壳聚糖。
本发明还涉及一种组合物,其包含本发明的转基因猪β细胞、转基因猪胰岛或装置。
本发明还涉及一种医药组合物,其包含本发明的转基因猪β细胞、转基因猪胰岛或装置以及至少一种药学上可接受的赋形剂。如本文中所使用,“药学上可接受的赋形剂”是指当施予动物、优选人时不产生不利的、过敏的或其它不良反应的赋形剂。其包括任何和所有的溶剂、分散介质、涂料、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等等。对于人的施用,制剂应当符合管理部门例如FDA办公室或EMA所要求的无菌性、致热原性、一般安全和纯度标准。
本发明还涉及一种药物,其包含本发明的转基因猪β细胞、转基因猪胰岛或装置。
本发明的另一个目的涉及本发明的转基因猪胰岛、转基因β细胞、装置或组合物、医药组合物或药物的用途,其用于治疗与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状。此类疾病的实例包括(但不限于)I型糖尿病、II型糖尿病、妊娠糖尿病、隐匿性自身免疫糖尿病、1.5型糖尿病、脂肪萎缩性糖尿病、青年成熟期发病型糖尿病、新生儿糖尿病(例如永久性新生儿糖尿病或暂时性新生儿糖尿病)、前驱糖尿病、类固醇诱导的糖尿病、胰腺癌,尤其是内分泌胰腺癌,例如内分泌胰腺肿瘤和胰腺神经内分泌癌。
在一个实施方案中,所述疾病、病症或病状是糖尿病,例如I型糖尿病、II型糖尿病、妊娠糖尿病、隐匿性自身免疫糖尿病、1.5型糖尿病、脂肪萎缩性糖尿病、青年成熟期发病型糖尿病、新生儿糖尿病(例如永久性新生儿糖尿病或暂时性新生儿糖尿病)、前驱糖尿病、类固醇诱导的糖尿病。
本发明的另一个目标是本发明的转基因猪胰岛、转基因β细胞、装置或组合物、医药组合物或药物,其用于在有需要的受试对象体内调控血糖水平。在一个实施方案中,调控血糖水平意味着恢复正常的空腹血糖水平,其中正常的空腹血糖水平优选地对应于在类似年龄和体重的正常(即非糖尿病)个体中测量的空腹血糖水平。在一个实施方案中,正常的空腹血糖水平低于110mg/dL(即6.1mmol/L),优选低于100mg/dL(即5.6mmol/L)。
本发明的另一个目标是本发明的转基因猪胰岛、转基因β细胞、装置或组合物、医药组合物或药物,其用于在有需要的受试对象体内恢复正常胰岛素分泌水平。在一个实施方案中,正常胰岛素分泌水平对应于通过在类似年龄和体重的正常非糖尿病个体中葡萄糖的指定摄取而诱导的胰岛素分泌水平。在一个实施方案中,可以通过葡萄糖耐量测试(例如口服葡萄糖耐量测试(OGTT)或静脉内葡萄糖耐量测试(IVGTT))来测量响应于葡萄糖摄取的胰岛素分泌。在一个实施方案中,在非糖尿病受试对象的IVGTT中,在施用0.3-0.5g/kg的量的葡萄糖之后,胰岛素分泌可以达到100μU/mL的最大值,然后降到基础值(15-20μU/mL)。
本发明还涉及一种用于治疗与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状的方法,其包括将治疗有效量的本发明的转基因猪胰岛、转基因猪β细胞、装置或组合物、医药组合物或药物施予有需要的受试对象,或由所述施予组成。此类疾病的实例包括(但不限于)I型糖尿病、II型糖尿病、妊娠糖尿病、隐匿性自身免疫糖尿病、1.5型糖尿病、脂肪萎缩性糖尿病、青年成熟期发病型糖尿病、新生儿糖尿病(例如永久性新生儿糖尿病或暂时性新生儿糖尿病)、前驱糖尿病、类固醇诱导的糖尿病、胰腺癌,尤其是内分泌胰腺癌,例如内分泌胰腺肿瘤和胰腺神经内分泌癌。
在一个实施方案中,所述疾病、病症或病状是糖尿病,例如I型糖尿病、II型糖尿病、妊娠糖尿病、隐匿性自身免疫糖尿病、1.5型糖尿病、脂肪萎缩性糖尿病、青年成熟期发病型糖尿病、新生儿糖尿病(例如永久性新生儿糖尿病或暂时性新生儿糖尿病)、前驱糖尿病、类固醇诱导的糖尿病。
本发明的另一个目标是一种用于在有需要的受试对象体内调控血糖水平的方法,其包括将治疗有效量的本发明的转基因猪胰岛、转基因β细胞、装置或组合物、医药组合物或药物施予所述受试对象。在一个实施方案中,调控血糖水平意味着恢复正常的空腹血糖水平,其中正常的空腹血糖水平优选地对应于在类似年龄和体重的正常非糖尿病个体中测量的空腹血糖水平。在一个实施方案中,正常的空腹血糖水平低于110mg/dL(即6.1mmol/L),优选低于100mg/dL(即5.6mmol/L)。
本发明的另一个目标是一种用于在有需要的受试对象体内恢复正常胰岛素分泌水平的方法,其包括将治疗有效量的本发明的转基因猪胰岛、转基因β细胞、装置或组合物、医药组合物或药物施予所述受试对象。在一个实施方案中,正常胰岛素分泌水平对应于通过在类似年龄和体重的正常(即非糖尿病)个体中葡萄糖的指定摄取而诱导的胰岛素分泌水平。在一个实施方案中,可以通过葡萄糖耐量测试(例如口服葡萄糖耐量测试(OGTT)或静脉内葡萄糖耐量测试(IVGTT))来测量响应于葡萄糖摄取的胰岛素分泌。在一个实施方案中,在非糖尿病受试对象的IVGTT中,在施用0.3-0.5g/kg的量的葡萄糖之后,胰岛素分泌可以达到100μU/mL的最大值,然后降到基础值(15-20μU/mL)。
本发明的另一个目标是一种用于在有需要的受试对象体内治疗与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状、调控血糖水平或恢复正常胰岛素分泌水平的方法,所述方法包括对所述受试对象施用治疗有效量的转基因猪β细胞或转基因猪胰岛,其中PKA和PKC路径被组成性地激活,从而增加所述受试对象的胰岛素分泌。
在一个实施方案中,所述胰岛素分泌的增加是由以下原因引起的:所述转基因细胞或胰岛表达被组成性激活的M3毒蕈碱性受体,这导致PIP2水解的增加,从而引起IP3和DAG合成的增加,从而激活PKC路径并增加细胞质内Ca2+的排出,从而增强胰岛素合成和分泌。
在一个实施方案中,所述胰岛素分泌的增加是由以下原因引起的:所述转基因细胞或胰岛表达GLP-1,从而激活腺苷酸环化酶,从而增加cAMP生产,从而
(i)激活蛋白激酶A(PKA),从而激活胰岛素分泌过程中涉及的蛋白质(例如PDX-1);和
(ii)诱导构象变化,变成G蛋白Rap1,从而通过扩大可供直接释放使用的颗粒池的大小来增强胰岛素胞吐;
从而增强胰岛素合成和分泌。
在一个实施方案中,本发明的转基因猪胰岛、转基因猪β细胞、装置或组合物、医药组合物或药物通过植入、移植或注射施用。优选地,施用在皮下、腹膜内、肌肉内、肾包膜中或肾包膜下进行。
根据一个实施方案,施用的转基因猪β细胞或猪胰岛的数量(即治疗有效量)在10000到50000IEQ/kg体重,优选地30000到50000IEQ/kg体重的范围。IEQ意思是猪胰岛当量。
根据一个实施方案,当使用装置时,可施用一个或多个装置,例如1、2、3、4、5、6、7、8、9、10个或更多。
在一个实施方案中,有需要的受试对象另外接受免疫抑制治疗。在一个实施方案中,转基因猪胰岛、转基因猪β细胞、装置或组合物、医药组合物或药物和免疫抑制治疗的施用可以是同时的或依序的。有利的是,免疫抑制治疗包括施用选自包括达利珠单抗(daclizumab)、他克莫司(tacrolimus)、雷帕霉素(rapamycin)、吗替麦考酚酯(mycophenolate mofetil)、环孢菌素(cyclosporine)、脱氧精胍菌素(deoxyspergualin)或脱氧精胍菌素类似物、可溶性补体受体1、抗CD154抗体、ATG、甲泼尼龙(methylprednisolone)、抗IL-2R抗体、巴利昔单抗(basiliximab)、FTY720、依维莫司(everolimus)、来氟米特(leflunomide)、西罗莫司(sirolimus)、贝拉西普(belatacept)、CTLA4-Ig、眼镜蛇毒的组的至少一种产品,或由所述施用组成。
优选地,当不用装置施用改造的猪胰岛时,进行免疫抑制治疗。
优选地,受试对象是哺乳动物,优选灵长动物,包括人和非人灵长动物,更优选人。在一个实施方案中,受试对象是雄性。在另一个实施方案中,受试对象是雌性。在另一个实施方案中,受试对象也可指宠物,例如狗、猫、豚鼠、仓鼠、大鼠、小鼠、雪貂、兔子等等。
根据一个实施方案,受试对象患有与内分泌胰腺或β细胞功能的缺陷或不存在相关的疾病、病症或病状。优选地,受试对象患有I型糖尿病或II型糖尿病。
附图说明
图1是显示成年猪和新生猪的分离猪胰岛的胰岛素分泌的柱状图。将200个胰岛的多个批次在仅含有15mM葡萄糖(G15)或含有15mM葡萄糖(G15)与毛喉素(forskolin)(Fsk;1μM)、佛波醇肉豆蔻酸酯乙酸酯(PMA;20nM)或Fsk和PMA两者的组合的1ml krebs培养基中孵育。测量培养基中的胰岛素分泌,并将其表示为每个胰岛批次的总胰岛素含量的百分比。柱体上的数字表示测试组中的胰岛素分泌与仅15mM葡萄糖相比的倍数增加。*p<0.05。值是对于来自8个不同的成年猪制剂的n=5-21和来自11个不同的新生猪制剂的n=11-43的平均值±SEM。
图2是显示用1(G1)或15mM(G15)葡萄糖孵育的转染Min6细胞的葡萄糖诱导的胰岛素分泌的柱状图。成对柱体上的数字表示每组中的刺激比(G15/G1)。*p<0.05指示测试组与对照之间的显著差异。值是对于来自7个不同实验的n=15-21的平均值±SEM。
图3是两个柱状图的组合,其显示暴露于200MOI携带编码GLP-1(GLP-1Ser8)、激活的毒蕈碱性受体(M3R)或两者(GLP-1+M3R)的序列的病毒表达载体48小时期间的新生猪(A)和成年猪(B)的分离猪胰岛的胰岛素分泌。将200个胰岛的多个批次在含有1mM葡萄糖(G1)或15mM葡萄糖(G15)的1ml krebs培养基中孵育。测量培养基中的胰岛素分泌,并将其表示为每个胰岛批次的总胰岛素含量的百分比。*p<0.05。值是来自10个不同制剂的n=38-46的平均值±SEM。
图4是曲线图,其显示暴露于200MOI携带编码GLP-1(GLP-1Ser8)、激活的毒蕈碱性受体(M3R)或两者(GLP-1+M3R)的序列的病毒表达载体48小时期间的分离成年猪胰岛的胰岛素分泌。将600个胰岛的多个批次在先含有1mM葡萄糖(G1)后含有15mM葡萄糖(G15)的krebs培养基中灌流,如图的顶部所指示。然后测量流出物馏分中的胰岛素分泌。值是来自4个不同制剂的n=3-4的平均值±SEM。
实施例
进一步通过以下实施例说明本发明。
实施例1:
将分离的猪胰岛在37℃、5%CO2/95%O2下,在含有10%热灭活FCS、100IU/ml青霉素、100μg/ml链霉素、5mmol/l葡萄糖的RMPI培养基中培养过夜。然后将分离的猪胰岛在含有1mmol/L或15mmol/L葡萄糖的1mL Krebs-Ringer缓冲液中孵育2小时,所述Krebs-Ringer缓冲液任选地补充有20nM佛波醇肉豆蔻酸酯乙酸酯(PMA,PKC路径的直接激活剂)和/或1μM毛喉素(PKA路径的间接激活剂)。最终通过放射免疫分析法定量回收的培养基中和孵育的胰岛中的胰岛素。
如图1所示,PMA对PKC的直接激活使葡萄糖诱导的胰岛素分泌在从成年猪分离的分离猪胰岛中增加至2倍,并在从新生猪分离的猪胰岛中增加至高达8倍,从而提高猪胰岛对葡萄糖的响应性。我们还观察到当用毛喉素升高β细胞cAMP以激活PKA和Epac2时的略微较小的增加。有趣的是,当我们将转基因猪胰岛在15mM葡萄糖的存在下暴露于PMA和毛喉素两者时,我们观察到分泌应答的意外的协同作用,其然后在成年猪胰岛中增加至大约6倍并在新生猪胰岛中增加至25倍。这些结果因此证明PKC激活和PKA激活对胰岛素分泌的意外的协同作用。
实施例2:
为了证实转基因蛋白的表达、被靶向路径的激活以及这种激活对葡萄糖诱导的胰岛素分泌的作用,转染鼠β细胞的一个品系(MIN6)。
通过RT-PCR在mRNA层面证实转基因蛋白的表达。被激活的毒蕈碱性受体的序列与野生型受体在很大程度上不同,并且因此可使用对已添加到受体序列中的标签具有特异性的抗体,通过对被转染MIN6细胞提取物蛋白质印迹验证蛋白质的表达。通过测量转基因细胞和对照细胞中的胞内GLP-1的量以及测量培养基中的GLP-1分泌来证明GLP-1生产。
为了证明转基因蛋白对胰岛素分泌的作用,通过在静态孵育实验期间增加葡萄糖浓度来激发转染的MIN6细胞和对照MIN6细胞。测量胰岛素分泌,并且计算转基因细胞和对照细胞的刺激指数,即高葡萄糖下的胰岛素分泌与低葡萄糖下的胰岛素分泌之间的比率。简言之,将2×105个细胞接种到12孔板中并培育48小时,然后用携带GLP-1(7-37)基因(GLP-1)、突变GLP-1(7-A8S-37)基因(GLP-1Ser8)或被组成性激活的毒蕈碱性受体基因(M3)的质粒中的一种转染这些细胞。对照细胞仅仅暴露于无任何质粒DNA的Lipofectamine。转染后48小时,使细胞饥饿,然后在含有1或15mM葡萄糖的1mL Krebs-Ringer缓冲液中孵育2小时。测量培养基中的胰岛素分泌,并将其表示为细胞的总胰岛素含量的百分比。
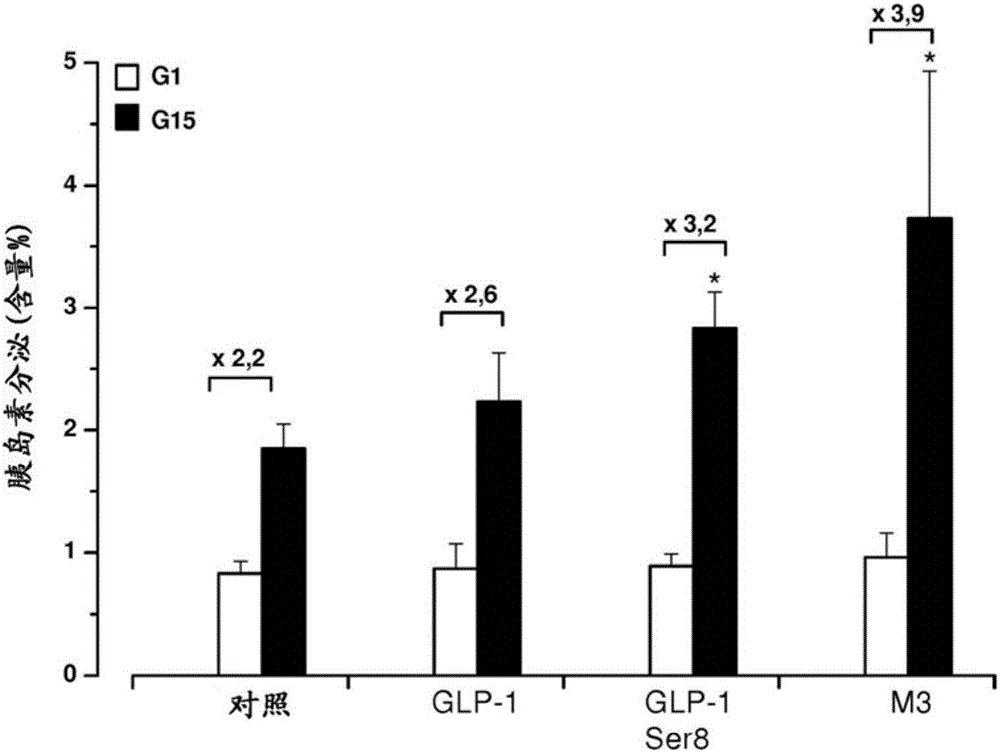
图2显示Min6细胞中GLP-1的转基因表达引起葡萄糖诱导的胰岛素分泌的不显著的轻微增加(刺激指数2.6,对比对照细胞中的2.2)。有趣的是,编码具有更大半衰期的经修饰GLP-1(GLP-1Ser8)的转基因诱导了对于15mM葡萄糖的分泌应答的更显著的增加(刺激指数3.2,对比对照细胞中的2.2)。被组成性激活的3型毒蕈碱性受体(M3)在Min6细胞中的表达显著增加了由15mM葡萄糖诱导的胰岛素分泌(刺激指数3.9,对比对照中的2.2)。
这些结果因此显示,所用的质粒成功地诱导目的分子的表达,并且这种表达增加对葡萄糖的分泌应答。
实施例3:
在分离的猪胰岛中评估PKA和PKC路径的转基因激活的作用。为此目的,将GLP-1Ser8和M3R序列插入pENTCMV腺病毒载体中以允许转基因GLP-1(GLP-1Ser8)和被激活的毒蕈碱性受体(M3R)在原代胰岛细胞中的表达。对于GLP-1和M3R的共同表达,将这两个序列插入同一个双顺反子载体中以研究PKA和PKC的同时激活对于猪胰岛的胰岛素分泌的作用。在葡萄糖激发之前的48小时内,将在HAM F10中培育的新生猪胰岛(小组A)和在RPMI中培育的成年猪胰岛(小组B)以感染复数200(MOI=200)暴露于GLP-1、M3R或GLP-1+M3R病毒表达载体。然后将胰岛在含有1mM或15mM葡萄糖的1mL Krebs-Ringer缓冲液中孵育2小时。然后通过放射免疫分析法定量回收的培养基中和孵育的胰岛中的胰岛素。
如图3所示,对照胰岛中的刺激指数对于新生猪胰岛来说是3.3,并且对于成年猪来说是3。表达GLP-1Ser8的胰岛显示提高的但与对照无显著不同的胰岛素分泌,在新生猪中的刺激指数为4.4,但在成年猪中对分泌不存在作用(分泌指数2.7)。当用M3R表达载体感染胰岛时,胰岛素分泌进一步增加,并且与对照相比的差异是显著的,导致新生猪和成年猪中的刺激指数分别为5.4和4.1。最后,如同从实施例1所示的结果所预期的那样,共同表达GLP-1和M3R的新生猪胰岛显示胰岛素分泌的协同应答,因为其刺激指数为7.3。在成年猪胰岛中也观察到这种作用,但程度较低(刺激指数5.5)。
还在动态胰岛灌流实验中测试了转基因PKA和PKC激活对葡萄糖诱导的胰岛素分泌的作用。将对照和经病毒处理的成年猪胰岛放置在用0.2μm滤器密封的灌流室中。首先在30分钟内用1mM葡萄糖(G1)krebs培养基灌流胰岛以进行平衡,然后在10分钟内每隔2分钟收集一次G1培养基,随后用G15刺激30分钟。如图4所示并且与静态孵育中所观察到的一致,GLP-1表达对急性胰岛素分泌几乎没有作用。M3R表达增加了两个阶段的葡萄糖诱导的胰岛素分泌,但是当成年猪胰岛共同表达GLP-1和M3R时,这种增加更大。
这些结果因此证实了使用药理学激活猪胰岛细胞中的PKA和PKC路径所获得的数据。我们的结论是,猪β细胞中这两种路径的同时激活将是获得功能增强的猪胰岛的最佳策略。
- 还没有人留言评论。精彩留言会获得点赞!