视网膜神经节细胞及其祖细胞的制作方法
相关申请
本申请要求2014年9月5日提交的标题为“retinalganglioncellsandprogenitorsthereof”的美国临时申请系列no.62/046,165的权益,该申请的全部内容以引用方式并入本文。
背景技术:
视网膜疾病通常由于失去了有丝分裂后的神经元细胞而导致失明。视网膜疾病包括青光眼、色素性视网膜炎、视杆细胞或视锥细胞营养不良、视网膜退化、糖尿病视网膜病、黄斑退化、leber先天性黑矇和stargardt病。青光眼尤其涉及视网膜神经节(rg)细胞的损伤或退化。
视网膜神经节(rg)细胞的潜在替代来源为干细胞,例如多能干细胞。早期的研究报告了由小鼠胚胎干细胞体外生成了视网膜前体细胞(ikedaetal.proc.natl.acad.sci.102(32):11331-11336,2005);由出生后第1天小鼠的视网膜生成了视网膜祖细胞(klassenetal.invest.ophthal.vis.sci.45(11):4167-4175,2004);在视网膜退化的rcs大鼠模型中移植骨髓间充质干细胞(inoueetal.exp.eyeres.8(2):234-241,2007);由人类成纤维细胞分化成诱导的多能干细胞(ips),以产生视网膜祖细胞(lambaetal.plosone5(1):e8763.doi:10.1371/journal.pone.0008763);以及由h1人类胚胎干细胞系产生视网膜祖细胞,包括无长突细胞、光感受器、双极细胞和水平细胞(lambaetal.proc.natl.acad.sci.10(34):12769-12774,2006)。
在后面这些研究中,未成熟的和成熟的视网膜细胞均作为不同细胞类型的混合群体生成,并且推定的视网膜神经节细胞代表了群体中的一小部分。此外,用于识别特定细胞类型(包括神经丝,tuj1和huc/d)的标志物对视网膜神经节(rg)细胞和/或其前体不具有特异性。其中的一项研究基于brn3的表达来鉴别细胞,发现很少细胞表达所述标志物。因此,这些方法均不能产生均质的或接近均质的视网膜神经节(rg)细胞或rg祖细胞的群体。这些方法均不能产生例如用于体外方法(例如筛选测试)或体内方法的足够数量的rg细胞或rg祖细胞。
可从中分离rg细胞的供体衍生的组织(例如尸体、胎儿组织和活的动物)的供应是有限的。培养原代rg细胞的尝试已得到了持续至多大约2周的培养物,此后成熟的rg细胞不再有活力。尚未报告原代rg祖细胞的分离。
发明概述
多能干细胞在体外可以无限地增殖和扩充,从而提供潜在的无尽来源的非供体衍生的细胞用于人类治疗。多能干细胞分化成成熟rg细胞(包括均质的或接近均质的成熟rg细胞和/或早期和/或晚期rg祖细胞的群体,包括均质的或接近均质的rg祖细胞的群体)可以提供充足供应的非供体衍生的细胞,用于移植和治疗视网膜疾病或体外用途(例如筛选测试)。之前尚未获得高度纯化的成熟rg细胞的群体,并且之前也未获得足够数量或纯度的rg祖细胞的群体。本发明至少克服了这些现有技术方法和组合物中的这些限制。
本发明尤其提供了包含rg祖细胞和/或成熟rg细胞的组合物或制备物,以及用于制备此类细胞和此类制备物的方法。惊人地发现,本发明的rg祖细胞和成熟rg细胞与原代神经节细胞相比,展现出更好的整合和迁移性质、以及更长的生存时间。
在某些实施方案中,本发明提供了视网膜神经节(rg)祖细胞的基本纯的制备物,其包含多个rg祖细胞以及适于保持rg祖细胞的活力的培养基。此类培养基可以包含葡萄糖、胰岛素、增加camp水平的因子(例如毛喉素)、和神经营养因子(例如睫状神经营养因子(cntf)和脑衍生的神经营养因子(bdnf))。
在某些实施方案中,本发明提供了rg祖细胞的制备物,其包含多个细胞(其中包含至少50%的rg祖细胞),以及适用于保持rg祖细胞的活力的培养基。
在某些实施方案中,本发明提供了rg祖细胞的制备物,其包含多个rg祖细胞,该祖细胞基本上不具有不是rg祖细胞的细胞,例如多能干细胞、眼区祖细胞、光感受器祖细胞、成熟的光感受器和/或无长突细胞。在一些实施方案中,所述制备物中不是rg祖细胞的细胞少于10%,并且甚至更优选地少于5%,2%,1%,0.1%或者甚至少于0.01%。在一些实施方案中,所述制备物可以基本上不具有rg细胞(即,成熟rg细胞)。这些制备物的任意一种可以进一步包含适合于保持rg祖细胞的活力的培养基。
在一些实施方案中,所述制备物可以包含成熟rg细胞和rg祖细胞的混合物,但是可以缺乏其他类型的细胞,例如多能干细胞,眼区祖细胞,光感受器祖细胞,成熟的光感受器和/或无长突细胞。
在某些实施方案中,本发明提供了适合于哺乳动物患者使用的rg祖细胞的药物制备物,其包含多个rg祖细胞;以及适用于保持rg祖细胞被移植到哺乳动物患者中的活力的药物可接受载体。
在某些实施方案中,本发明提供了低温细胞制备物,其包含至少109个rg祖细胞以及与rg祖细胞相容的并且能够保持此类细胞在解冻后的活力的低温保藏系统。
在包含rg祖细胞的制备物的一些实施方案中,制备物中至少70%的细胞在免疫细胞化学上是math5(+),并且甚至更优选地制备物中至少80%,90%,95%或98%的细胞在免疫细胞化学上是math5(+)。在一些实施方案中,制备物中的细胞还是brn3a(+)。在一些实施方案中,制备物中的细胞还是brn3b(+)。在一些实施方案中,制备物中的细胞还是isl1(+)。在一些实施方案中,制备物中的细胞还是brn3a(+)和brn3b(+)。在一些实施方案中,制备物中的细胞还是brn3a(+),brn3b(+)和isl1(+)。
在包含rg祖细胞的一些制备物中,制备物中至少70%的细胞在免疫细胞化学上是math5(+)和brn3a(+)(即,是math5和brn3a阳性的),甚至更优选地制备物中至少80%,90%,95%或98%的细胞在免疫细胞化学上是math5(+)和brn3a(+)。在一些实施方案中,制备物中的细胞还是brn3b(+)。在一些实施方案中,制备物中至少50%,60%,70%,80%,90%,95%或98%的细胞在免疫细胞化学上是math5(+),brn3a(+)和brn3b(+)。在一些实施方案中,制备物中的细胞还是isl1(+)。在一些实施方案中,制备物中至少50%,60%,70%,80%,90%,95%或98%的细胞在免疫细胞化学上是math5(+),brn3a(+),brn3b(+)和isl(+)。在一些实施方案中,少于30%,20%,10%,5%,1%的细胞表达thy1,或者所有细胞均不表达thy1。rg祖细胞还可以表达tuj1。
在包含rg祖细胞的一些制备物中,制备物中至少50%,60%或70%的细胞在免疫细胞化学上是brn3a(+)和/或神经丝(+),甚至更优选地制备物中至少80%,90%,95%或98%的细胞在免疫细胞化学上是brn3a(+)和/或神经丝(+)。在一些实施方案中,制备物中至少50%,60%或70%的细胞在免疫细胞化学上是brn3a(+)和神经丝(+),甚至更优选地制备物中至少80%,90%,95%或98%的细胞在免疫细胞化学上是brn3a(+)和神经丝(+)。在一些实施方案中,制备物中的细胞还是thy1(+)。在一些实施方案中,制备物中至少50%,60%或70%的细胞在免疫细胞化学上是brn3a(+),神经丝(+)和thy1(+)。rg祖细胞还可以表达tuj1。
rg祖细胞是增殖性的。在一些实施方案中,rg祖细胞制备物中的至少70%,80%,90%,95%或98%的细胞是增殖性的。
在某些实施方案中,rg祖细胞是hla基因型一致的,并且优选为基因组一致的。
在某些实施方案中,rg祖细胞的平均末端限制性片段长度(trf)为超过7kb,7.5kb,8kb,8.5kb,9kb,9.5kb,10kb,10.5kb,11kb,11.5kb或者甚至12kb。
在某些实施方案中,rg祖细胞适用于给予人类患者。
在某些实施方案中,rg祖细胞适用于给予非人类的兽医患者。
在上述制备物的优选的实施方案中,rg祖细胞衍生自哺乳动物多能干细胞,特别是人类多能干细胞,优选地选自胚胎干细胞和诱导多能干细胞。
在某些实施方案中,rg祖细胞由共同多能干细胞来源分化得到。
在某些实施方案中,rg祖细胞可以被移植到高眼压性青光眼小鼠或大鼠模型系统或者视神经(on)损伤挤压小鼠模型系统的玻璃体或视网膜下空间中,迁移至神经节细胞层中,并且将改善任何模型系统中的图案erg(视网膜电图描记术)应答和视敏度。在某些实施方案中,rg细胞和rg祖细胞可以再生视神经。
在某些实施方案中,rg祖细胞和rg细胞分泌一种或多种神经保护因子,并由此提供神经保护。可以使用视神经损伤或青光眼的动物模型来测量此类神经保护。
在某些实施方案中,适用于保持rg祖细胞的活力的培养基选自培养物培养基,低温保藏剂和适用于注射人类患者中的生物相容性注射介质。
在某些实施方案中,rg祖细胞制备物不具有热原质和霉菌。
本发明的另一个方面提供了适用于哺乳动物患者的rg细胞药物制备物,其包含多能干细胞衍生的rg细胞,其中制备物中的细胞对于神经丝和/或brn3a的免疫细胞化学是阳性的,因此在一些情况下可以为神经丝(+)brn3a(+)。rg细胞可以是tuj1(+),并且它们还可以任选地是thy1(+)。所述药物组合物可以进一步包含用于保持rg细胞被移植到哺乳动物患者中的活力的药物可接受载体。
本发明的另一个方面提供了适用于哺乳动物患者的rg细胞药物制备物,其包含多能干细胞衍生的rg细胞,其中制备物中的细胞在免疫细胞化学上是神经丝(+)brn3a(+)和tuj1(+),并且可任选地是thy1(+);以及用于保持rg细胞被移植到哺乳动物患者中的活力的药物可接受载体。
本发明的另一个方面提供了适用于哺乳动物患者的rg细胞药物制备物,其包含多能干细胞衍生的rg细胞,其中超过70%,80%,90%,95%或者甚至98%的细胞在免疫细胞化学上是神经丝(+)和brn3a(+);以及用于保持rg细胞被移植到哺乳动物患者中的活力的药物可接受载体。在一些情况下,制备物中超过50%,60%或70%的细胞在免疫细胞化学上是thy1(+)。在一些实施方案中,至少70%,80%,90%,95%或者甚至98%的细胞在免疫细胞化学上是tuj1(+)。
在一些实施方案中,rg细胞药物制备物中的细胞是有丝分裂非活性状态(或者有丝分裂期后的),这意味着它们是非增殖性的。可以使用本领域已知的增殖测试来测定这种情况,例如氚标记的胸腺嘧啶摄入测试法等。在一些实施方案中,制备物中超过50%,60%,70%,80%,90%,95%或98%的细胞是有丝分裂非活性的。
在一些实施方案中,rg细胞制备物中的细胞包含比rg祖细胞种类更大量的树突和/或更复杂的树突。制备物中超过50%,60%,70%,80%,90%,95%或98%的细胞包含大量的树突和/或更复杂的树突(与祖细胞种类相比)。因此,成熟的rg细胞展现出比rg祖细胞数量增多的一级树突和/或在二级、三级和更高级水平下的增多的树突分支和/或增加的总树突长度。例如rg细胞以每个细胞计可以具有比rg祖细胞多2-5倍的树突(例如rg细胞可以每个细胞具有4-5个树突,而rg祖细胞可以每个细胞具有1-2个树突)。
本发明的另一个方面提供了药物组合物,其包含rg祖细胞和/或rg细胞以及视网膜色素上皮细胞、光感受器祖细胞和/或光感受器细胞;以及用于保持rg祖细胞和/或rg细胞被移植到哺乳动物患者中的活力的药物可接受载体。所述制备物还可以包含双极细胞和/或无长突细胞。细胞制备物可以以细胞悬液(预混在一起,或者试剂盒形式,其中具有分开剂量的细胞,它们将被联合传递)、三维结构(例如片或者单层或多层细胞移植物,可任选地设置在生物相容性基质或固体支持物上)的形式提供。在多层细胞移植物的情况下,rpe细胞可以以单层、优选为极化单层的形式提供。因此,在一些实施方案中,rg细胞和/或rg祖细胞与其他的神经视网膜感觉细胞(包括rpe细胞、光感受器细胞或光感受器祖细胞)一起使用。
本发明的另一个方面提供了用于治疗患者中由视网膜神经节细胞损失或功能障碍引起的疾病和紊乱的方法,其包括给予本发明所述这类药物制备物,例如rg祖细胞和/或rg细胞的制备物。所述制备物可以局部注射,例如注射至患者眼睛的视网膜下空间中,注射至患者的玻璃体中;或者系统传递或进入至所述细胞可以存在的其他体腔中。
视网膜神经节细胞损失导致的疾病或紊乱包括青光眼,视神经损伤,缺血性视神经病变,视神经炎,糖尿病视网膜病,遗传性神经节退化和遗传性视网膜营养不良。
由此还提供了本发明所述和/或使用本发明所述方法制备的任何rg祖细胞群体在制造用于治疗受试对象中由视网膜神经节细胞损失或功能障碍引起的疾病或紊乱的药剂中的用途。还提供了本发明所述和/或使用本发明所述方法制备的任何rg祖细胞群体在治疗受试对象中由视网膜神经节细胞损失或功能障碍引起的疾病或紊乱的方法中的应用。
类似地,还提供了本发明所述和/或使用本发明所述方法制备的任何rg细胞群体在制造用于治疗受试对象中由视网膜神经节细胞损失或功能障碍引起的疾病或紊乱的药剂中的用途。还提供了本发明所述和/或使用本发明所述方法制备的任何rg祖细胞群体在治疗受试对象中由视网膜神经节细胞损失或功能障碍引起的疾病或紊乱的方法中的应用。
在某些实施方案中,本发明提供了生产rg细胞的方法,其包括以下步骤:
(a)优选地以细胞簇的形式和优选地在低附着或非附着的条件下,在神经节细胞培养基中培养眼区祖细胞(eyefieldprogenitorcells)足以使得所述细胞簇形成包含rg祖细胞的单个细胞球的时间;以及
(b)在附着条件下,优选地在基质(例如生物材料支架)上在视网膜神经节细胞分化培养基中培养所述细胞球,直至培养物中的大部分细胞为rg细胞,其中所述rg细胞特征为brn3a(+)和/或神经丝(+)(并且优选为brn3a(+)和神经丝(+))和tuj1(+),并且任选地还是thy1(+)。
在某些实施方案中,本发明提供了一种方法,其包括优选地以细胞簇的形式并且优选地在低附着或非附着的条件下,在神经节细胞培养基中培养眼区祖细胞达到足以使得所述细胞簇形成包含rg祖细胞的时间。rg祖细胞还可以任选地在附着条件下,优选地在基质(例如生物材料支架)上,在视网膜神经节细胞分化培养基中进行培养,直至培养物中的大部分细胞为rg细胞,其中所述rg细胞特征为brn3a(+),神经丝(+)和tuj1(+),并且任选地thy1(+)。
在一些实施方案中,眼区祖细胞被表征(例如免疫细胞化学上表征)为pax6(+)且rx1(+)且oct4(-)且nanog(-),并且甚至更优选地还表征为six3(+)、six6(+)、lhx2(+)、tbx3(+)、sox2(+)、otx2(+)和nestin(+),例如可以通过免疫染色和/或流式细胞术或者用于表征细胞中标志物表达的其他标准测试来测定。
在一些实施方案中,rg祖细胞表征为math5(+);或者math5(+)和brn3a(+);或者math5(+),brn3a(+)和brn3b(+);或者math5(+),brn3a(+),brn3b(+)和isl1(+);或者brn3a(+)和神经丝(+);或者brn3a(+),神经丝(+)和thy1(+),例如通过免疫染色和/或流式细胞术或者用于表征细胞中标志物表达的其他标准测试可以测定的。
在某些实施方案中,附着条件包括具有表面的培养系统,其中所述细胞可以附着于所述表面上,所述培养系统包括附着材料,其可以包括(仅是示意性的)聚酯、聚丙烯、聚亚烷基,聚氟氯乙烯,聚氯乙烯,聚氟乙烯树脂,聚苯乙烯,聚砜,聚氨酯,聚对苯二甲酸乙二醇酯,纤维素,玻璃纤维,陶瓷颗粒,生物材料支架,聚-l-乳酸,右旋糖,惰性金属纤维,二氧化硅,泡碱玻璃,硼硅酸盐玻璃,壳聚糖或植物性海绵中的一种或多种。在一些实施方案中,附着材料是带静电荷的。在某些实施方案中,生物材料支架为细胞外基质,例如胶原蛋白(例如iv型或i型胶原蛋白)、804g衍生的基质、纤连蛋白、玻璃粘连蛋白、软骨粘连蛋白、层粘连蛋白或matrigeltm。在其他的实施方案中,生物材料为明胶,藻酸酯,聚乙交酯,纤维蛋白或自组装肽。
在某些实施方案中,rg祖细胞以及随之而来的rg细胞衍生自多能干细胞,例如胚胎干细胞或诱导多能干细胞。
在优选的实施方案中,提供了基本不具有多能干细胞的所得的rg祖细胞制备物,即,制备物中少于10%的细胞是多能干细胞,并且甚至更优选地制备物中少于5%,2%,1%,0.1%或者甚至少于0.01%的细胞是多能干细胞。
在优选的实施方案中,提供基本不具有眼区祖细胞的所得的rg祖细胞制备物,即制备物中少于10%、甚至更优选地少于5%,2%,1%,0.1%或者甚至少于0.01%的细胞是眼区祖细胞。
在优选的实施方案中,所得的rg祖细胞制备物的细胞成分相对于其他细胞类型而言是至少50%纯的(即,制备物中至少50%的细胞是rg祖细胞),并且优选地制备物中至少75%,至少85%,至少95%,至少99%或者大约100%的细胞是rg祖细胞。
在某些实施方案中,所述方法包括低温保存rg祖细胞或rg细胞的另一个步骤。所述细胞优选地在低温保存剂中冷冻,所述低温保存剂与冷冻细胞的解冻(以及解冻细胞本身)相容,并且可任选地洗涤细胞以除去低温保存剂之后,rg祖细胞或rg细胞保持至少25%的细胞活力(例如基于培养效率),更优选地至少50%,60%,70%,80%或者甚至至少90%的细胞活力。
rg祖细胞或rg细胞可以低温保存。在一些实施方案中,rg祖细胞以球体低温保存。
在某些实施方案中,神经节细胞培养基可以包含基础培养基,例如neurobasaltmmedium(lifetechnologies)(或者包含类似构成成分的其他培养基),d-葡萄糖,抗生素(例如青霉素和链霉素),glutamaxtm,n2补充剂(invitrogen),b27补充剂(也得自invitrogen),毛喉素,bdnf和cntf。b27补充剂尤其包含sod,过氧化氢酶和其他抗氧化剂(gsh),以及独特的脂肪酸(例如亚油酸,亚麻酸,硫辛酸)。n2补充剂可以替换为例如以下混合物:转铁蛋白(10g/l),胰岛素(500mg/l),孕酮(0.63mg/l),腐胺(1611mg/l)和亚硒酸盐(0.52mg/l)。
在上述方面和实施方案的某些实施方案中,rg祖细胞由多能干细胞来源分化得到(例如表达oct4,碱性磷酸酶,sox2,ssea-3,ssea-4,tra-1-60和tra-1-80的多能干细胞,例如但不限于胚胎干(es)细胞系或诱导多能干(ips)细胞系)),甚至更优选地由共同多能干细胞来源分化得到。
在上述方面和实施方案的某些实施方案中,rg祖细胞的平均末端限制性片段长度(trf)为超过7kb,7.5kb,8kb,8.5kb,9kb,9.5kb,10kb,10.5kb,11kb,11.5kb或者甚至12kb。
在上述方面和实施方案的某些实施方案中,制备物适用于给予人类患者,并且更优选地为无热原质和/或无非人类的动物产物。
在上述方面和实施方案的某些实施方案中,制备物适用于给予非人类的兽医哺乳动物,例如但不限于狗、猫或马。
在一个方面中,本发明公开提供了生产rg祖细胞的方法,其包括依次在(i)视网膜诱导(ri)培养基中、(ii)神经分化(nd)培养基中、以及(iii)神经节细胞(gc)培养基中培养多能干细胞。
多能干细胞可以是人类的。在一些实施方案中,多能干细胞可以是人类es细胞或人类ips细胞。多能干细胞可以在未分化状态下在无饲养层和/或无异物的条件(可任选地存在基质)下培养。多能干细胞可以在未分化状态下在基质(例如但不限于包含matrigeltm的基质)上以及任选地在mtesr1培养基中培养。
通过在视网膜诱导培养基中培养多能干细胞来开始分化。视网膜诱导培养基可以包含基础培养基(例如dmem/f12,dmem/高葡萄糖或dmem/敲除),或者包含dmem/f12的成分的培养基,或者包含dmem/高葡萄糖的成分的培养基,或者包含dmem/敲除的成分的培养基。
视网膜诱导培养基可以包含d-葡萄糖。
神经分化培养基可以包含d-葡萄糖。d-葡萄糖可以以0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml,或者大约4.5mg/ml的浓度存在。
视网膜诱导培养基可以包含一种或多种抗生素。抗生素可以包含青霉素和/或链霉素,青霉素的浓度可任选地为大约0-100单位/ml或者大约100μg/ml,而链霉素的浓度可任选地为大约0-100μg/ml或者大约100μg/ml。
视网膜诱导培养基可以包含一种或多种血清补充剂。视网膜诱导培养基可以包含n2补充剂。n2补充剂可以以大约0.1至5%、或者0.1至2%、或者大约1%(体积/体积,或v/v)的浓度存在。
视网膜诱导培养基可以包含b-27补充剂。b-27补充剂可以以大约0.05-2.0%、或者大约0.2%(v/v)的浓度存在。
视网膜诱导培养基可以包含非必需氨基酸或最低基础培养基(mem)非必需氨基酸。非必需氨基酸或mem非必需氨基酸可以由原液以1x浓度存在,其中通常认为原液为100x。甘氨酸的最终浓度(在原液的1x浓度下)为大约0.1mm,因此原液为10mm甘氨酸。原液通常还包含l-丙氨酸,l-天冬酰胺,l-天冬氨酸,l-谷氨酸,l-脯氨酸和l-丝氨酸。
视网膜诱导培养基可以包含胰岛素。胰岛素可以为人类的。胰岛素可以以大约5-50μg/ml或者大约20μg/ml的浓度存在。
视网膜诱导培养基可以包含bmp信号传递抑制剂。bmp信号传递抑制剂可以选自noggin多肽、dorsomorphin、ldn-193189和它们的任意的组合。
视网膜诱导培养基可以包含noggin多肽。noggin多肽可以以大约5-100ng/ml、大约10-100ng/ml、大约10-500ng/ml或者大约50ng/ml的浓度存在。在一些实施方案中,noggin多肽以大约10-500ng/ml存在。
每天可以使用新鲜的视网膜诱导培养基全部或部分替换视网膜诱导培养基。在一些情况下,细胞在2x104/cm2至6x104/cm2的密度范围下生长。
在视网膜诱导培养基存在下的培养可以进行大约4-6天、或者大约4天、大约5天或大约6天。
神经分化培养基可以包含基础培养基(例如neurobasaltmmedium(lifetechnologies)),或者包含neurobasaltmmedium的成分的基础培养基。
神经分化培养基可以包含d-葡萄糖。d-葡萄糖可以以0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml,或者大约4.5mg/ml的浓度存在。
神经分化培养基可以包含一种或多种抗生素。抗生素可以包括青霉素和/或链霉素,青霉素的浓度可任选地为大约0-100单位/ml或者大约100单位/ml,而链霉素的浓度可任选地为大约0-100μg/ml或者大约100μg/ml。
神经分化培养基可以包含一种或多种血清补充剂。神经分化培养基可以包含n2补充剂。n2补充剂可以以大约0.1至5%、或者0.1至2%、或者大约1%(v/v)的浓度存在。
神经分化培养基可以包含b-27补充剂(lifetechnologies)。b-27补充剂可以以大约0.05-5.0%、大约0.5-2.0%、或者大约2%(v/v)的浓度存在。
神经分化培养基可以包含非必需氨基酸、mem非必需氨基酸、谷氨酰胺或glutamaxtm。非必需氨基酸或mem非必需氨基酸可以以原液的大约1x浓度存在,其中原液为大约200mm(并且视为100x)。glutamaxtm可以以2mm或原液的1x稀释存在(使用100x原液,该原液为200mm)。
神经分化培养基可以包含bmp信号传递抑制剂。bmp信号传递抑制剂可以选自noggin多肽、dorsomorphin、ldn-193189或它们的任意组合。
神经分化培养物培养基可以包含noggin多肽。noggin多肽可以以大约10-1000ng/ml、大约10-500ng/ml、10-100ng/ml或者大约50ng/ml的浓度存在。
在神经分化培养基存在下的培养可以进行大约8-12天、或者大约9-10天、或大约9天。神经分化培养基可以每天、每2天或每3天全部或部分更换。
神经节细胞培养基可以包含基础培养基(例如neurobasaltmmedium(lifetechnologies))或者包含neurobasaltmmedium的成分的培养基。
神经节细胞培养基可以包含d-葡萄糖。神经分化培养基可以包含d-葡萄糖。d-葡萄糖可以以0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml,或者大约4.5mg/ml的浓度存在。
神经节细胞培养基可以包含一种或多种抗生素。抗生素可以包括青霉素和/或链霉素,青霉素的浓度可任选地为大约0-100单位/ml或者大约100单位/ml,而链霉素的浓度可任选地为大约0-100μg/ml或者大约100μg/ml。
神经节细胞培养基可以包含一种或多种血清补充剂。神经节细胞培养基可以包含n2补充剂。n2补充剂可以以大约0.1至5%、或者0.1至2%、或者大约1%(v/v)的浓度存在。
神经节细胞培养基可以包含b-27补充剂(配方编号080085-sa)(lifetechnologies)。b-27补充剂(配方编号080085-sa)可以以大约0.05-5.0%、大约1.5-2.5%、或者大约2%(v/v)的浓度存在。
神经节细胞培养基可以包含glutamaxtm。glutamaxtm可以以原液的1x稀释存在(使用100x原液,该原液为200mm)。
神经节细胞培养基可以包含毛喉素,bdnf和cntf中的一种、两种或所有三种。毛喉素可以以1-20μm、1-10μm或大约5μm的浓度存在。bdnf可以以1-200ng/ml、5-50ng/ml、5-25ng/ml或大约10ng/ml的浓度存在。cntf可以以1-200ng/ml、5-50ng/ml、5-25ng/ml或大约10ng/ml的浓度存在。bdnf可以为人类bdnf。ctnf可以为人类ctnf。
在神经节细胞培养基存在下的培养可以进行大约40-50天、或者大约45天。神经节细胞培养基可以每天、每2天或每3天或更低的频率全部或部分更换。
通过所述方法生产的rg祖细胞可以占培养物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%,并且可任选地,此类培养物可以增殖1周、2周、或超过2周,包括3周、4周或更长时间。
rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b,isl1,神经丝和thy1,因此可以表征为math5(+),brn3a(+),brn3b(+),isl1(+),神经丝(+)和/或thy1(+)。rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b和isl1,因此可以表征为math5(+),brn3a(+),brn3b(+)和/或isl1(+)。rg祖细胞可以表达以下标志物的一种或多种:brn3a,神经丝和thy1,因此可以表征为brn3a(+),神经丝(+)和/或thy1(+)。rg祖细胞可能不表达pax6和/或rx1,因此可能表征为pax6(-)和/或rx1(-)。某些rg祖细胞可能不表达math5和/或brn3b,因此可能表征为math5(-)和/或brn3b(-)。
rg祖细胞可以表征为math5(+);或者math5(+),brn3a(+);或者math5(+),brn3a(+),brn3b(+);或者math5(+),brn3a(+),brn3b(+),isl1(+);或者brn3a(+);或者神经丝(+);或者brn3a(+),神经丝(+);或者brn3a(+),神经丝(+),thy1(+)。rg祖细胞可能不表达pax6和/或rx1,因此可以表征为pax6(-)和/或rx1(-)。rg祖细胞可以为tuj1(+)。rg祖细胞可以是增殖性的。
rg祖细胞可以低温保存。rg祖细胞可以是人类的。
所述方法可以进一步包括随后的在视网膜神经节细胞(rgc)分化培养基存在下的培养步骤。这可以在未进行中间的低温保存步骤的情况下进行,或者其可以在rg祖细胞低温保存和解冻之后进行。
rgc分化培养基可以包含基础培养基(例如neurobasaltmmedium(lifetechnologies))或包含neurobasaltmmedium的成分的培养基。
rgc分化培养基可以包含d-葡萄糖。神经分化培养基可以包含d-葡萄糖。d-葡萄糖可以以0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml,或者大约4.5mg/ml的浓度存在。
rgc分化培养基可以包含一种或多种抗生素。抗生素可以包含青霉素和/或链霉素,青霉素的浓度可任选地为大约0-100单位/ml或者大约100单位/ml,而链霉素的浓度可任选地为大约0-100μg/ml或者大约100μg/ml。
rgc分化培养基可以包含一种或多种血清补充剂。rgc分化培养基可以包含b-27补充剂(配方编号080085-sa)。b-27补充剂可以以大约0.05至5.0%,大约1.5至2.5%,或者大约2%(v/v)的浓度存在。
rgc分化培养基可以包含glutamaxtm。glutamaxtm可以以原液的1x稀释存在。
rgc分化培养基可以包含视黄酸。视黄酸可以以大约0.5-20μm,大约0.5-10μm,大约1-5μm或者大约2μm的浓度存在。
rgc分化培养基可以包含包括毛喉素,bdnf,cntf,camp和dapt中所有物质的一种或多种。rgc分化培养基可以包含bdnf和/或cntf。rgc分化培养基可以包含包括毛喉素,camp和dapt或者其他notch途径抑制剂或notch抑制剂(例如notch封闭抗体或抗体片段,notch负调控区抗体或抗体片段,α-分泌酶抑制剂,γ-分泌酶抑制剂,订书肽,小分子阻断剂以及sirna,shrna和mirna)中所有物质的一种或多种。毛喉素可以以1-20μm、1-10μm或者大约5μm的浓度存在。bdnf可以以1-200ng/ml、5-50ng/ml、5-25ng/ml或者大约10ng/ml的浓度存在。cntf可以以1-200ng/ml、5-50ng/ml、5-25ng/ml或者大约10ng/ml的浓度存在。bdnf可以为人类bdnf。ctnf可以为人类ctnf。camp可以以1-500ng/ml、10-250ng/ml、5-150ng/ml或者大约100ng/ml的浓度存在。dapt可以以1-100μm、1-50μm、1-20μm或者大约10μm的浓度存在。
rgc分化培养基可以包含胰岛素。胰岛素可以是人类的。胰岛素可以以大约5-50μg/ml或者大约20μg/ml的浓度存在。
在rgc分化培养基存在下的培养可以进行大约1-4周、或者大约2-4周、或者大约2-3周或者大约2周。rgc分化培养基可以每天、每2天或每3天或更低的频率全部或部分更换。
通过所述方法生产的rg细胞可以占培养物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%,并且可任选地,此类培养物可以增殖1周、2周、或超过2周,包括3周、4周或更长时间。
rg细胞可以表达以下标志物的一种或多种:brn3a,神经丝,tuj1和thy1,因此可以表征为brn3a(+),神经丝(+),tuj1(+)和/或thy1(+)。rg细胞可以表征为brn3a(+),神经丝(+);或者brn3a(+),神经丝(+),thy1(+);或者brn3a(+),神经丝(+),thy1(+);或者brn3a(+),神经丝(+),tuj1(+);或者brn3a(+),神经丝(+),tuj1(+),thy1(+)。rg细胞可以为有丝分裂期后的,并且可以比rg祖细胞包含更多数量、更长的和/或更复杂的树突。
rg细胞可以低温储存。rg细胞可以是人类的。
在另一个方面中,本发明公开提供了生产rg祖细胞的方法,其包括在神经节细胞培养基中培养眼区祖细胞。
眼区祖细胞可以以细胞群体的方式提供,该细胞群体的至少50%,至少75%,至少85%,至少95%,至少99%或者大约100%为眼区祖细胞。眼区祖细胞可以为pax6(+)和rx1(+),并且任选地还可以为six3(+),six6(+),lhx2(+)和/或tbx3(+)。眼区祖细胞还可以为sox2(+)。眼区祖细胞可以为nestin(+)。眼区祖细胞还可以为otx2(+)。
眼区祖细胞可以通过多能干细胞的体外分化而获得。在一些实施方案中,多能干细胞可以为es细胞或ips细胞。多能干细胞可以在无饲养层和/或无异物的条件下培养。
在眼区祖细胞的培养可以进行大约5-45天、或者大约5-20天、或者大约35-45天。神经节细胞培养基以及神经节细胞培养基中的培养参数可以如上文所述。
通过所述方法生产的rg祖细胞可以占培养物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%,并且可任选地,此类培养物(包含上述百分率的rg祖细胞)可以增殖1周、2周、或超过2周,包括3周、4周或更长时间。
rg祖细胞表型如上文所述。因此,例如,rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b,isl1,神经丝和thy1,因此可以表征为math5(+),brn3a(+),brn3b(+),isl1(+),神经丝(+)和/或thy1(+)。rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b和isl1,因此可以表征为math5(+),brn3a(+),brn3b(+)和/或isl1(+)。rg祖细胞可以表达以下标志物的一种或多种:brn3a,神经丝和thy1,因此可以表征为brn3a(+),神经丝(+)和/或thy1(+)。rg祖细胞可能不表达pax6或rx1,因此可以表征为pax6(-)和/或rx1(-)。rg祖细胞可以是增殖性的。其他表型如上文所述。
rg祖细胞可以低温保存。rg祖细胞可以是人类的。
在另一个方面中,本发明公开提供了生产rg细胞的方法,其包括在神经节细胞培养基和视网膜神经节细胞(rgc)分化培养基中依次培养眼区祖细胞。
眼区祖细胞可以以细胞群体的方式提供,该细胞群体的至少50%,至少75%,至少85%,至少95%,至少99%或者大约100%为眼区祖细胞。眼区祖细胞可以为pax6(+)和rx1(+),并且任选地还可以为six3(+),six6(+),lhx2(+)和/或tbx3(+)。眼区祖细胞还可以为sox2(+)。眼区祖细胞可以为nestin(+)。眼区祖细胞还可以为otx2(+)。
眼区祖细胞可以通过多能干细胞的体外分化而获得。在一些实施方案中,多能干细胞可以为es细胞或ips细胞。多能干细胞可以在无饲养层和/或无异物的条件下培养。
神经节细胞培养基以及神经节细胞培养基中的培养参数可以如上文所述。rgc分化培养基以及rgc分化培养基中的培养参数可以如上文所述。
通过所述方法生产的rg细胞可以占培养物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%,并且任选地,此类培养物(包含上述百分率的rg细胞)可以增殖1周、2周、或超过2周,包括3周、4周或更长时间。
rg细胞的表型如上文所述。因此,例如,rg细胞可以表达以下标志物的一种或多种:brn3a,神经丝,tuj1和thy1,因此可以表征为brn3a(+),神经丝(+),tuj1(+)和/或thy1(+)。rg细胞可以是有丝分裂期后的。rg细胞可以比rg祖细胞具有更复杂的树突、更长的树突和/或更多的树突。其他表型如上文所述。
rg细胞可以低温保存。rg细胞可以是人类的。
在另一个方面中,本发明公开提供了生产rg细胞的方法,其包括在视网膜神经节细胞(rgc)分化培养基中培养rg祖细胞。
rg祖细胞可以以细胞群体的方式提供,该细胞群体的至少50%,至少75%,至少85%,至少95%,至少99%或者大约100%为rg祖细胞。rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b,isl1,神经丝和thy1,因此可以表征为math5(+),brn3a(+),brn3b(+),isl1(+),神经丝(+)和/或thy1(+)。rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b和isl1,因此可以表征为math5(+),brn3a(+),brn3b(+)和/或isl1(+)。rg祖细胞可以表达以下标志物的一种或多种:brn3a,神经丝和thy1,因此可以表征为brn3a(+),神经丝(+)和/或thy1(+)。rg祖细胞可能不表达pax6或rx1,因此可以表征为pax6(-)和/或rx1(-)。rg祖细胞可以通过多能干细胞的体外分化而获得。在一些实施方案中,多能干细胞可以为es细胞或ips细胞。多能干细胞可以在无饲养层和/或无异物的条件下培养。
rgc分化培养基以及rgc分化培养基中的培养参数可以如上文所述。
通过所述方法生产的rg细胞可以占培养物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%,并且任选地,此类培养物(包含上述百分率的rg细胞)可以增殖1周、2周、或超过2周,包括3周、4周或更长时间。
rg细胞可以表达以下标志物的一种或多种:brn3a,神经丝,tuj1和thy1,并且可以表征为brn3a(+),神经丝(+),tuj1(+)和thy1(+)。
rg细胞可以低温保存。rg细胞可以是人类的。
在另一个方面中,本发明公开提供了组合物,其包含使用本发明所述方法生产的rg祖细胞,例如如上述段落所述。
在另一个方面中,本发明公开提供了包含rg祖细胞的组合物,其中所述rg祖细胞可任选地为人类的。
rg祖细胞可以占组合物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或者大约100%。
rg祖细胞可以表达以下标志物的一种或多种:math5,brn3a,brn3b,isl1,神经丝和thy1,因此可以表征为math5(+),brn3a(+),brn3b(+),isl1(+),神经丝(+)和/或thy1(+)。rg祖细胞可以表达math5,brn3a,brn3b和isl1,因此可以表征为math5(+),brn3a(+),brn3b(+)和isl1(+)。rg祖细胞可以表达brn3a,神经丝和thy1,因此可以表征为brn3a(+),神经丝(+)和thy1(+)。rg祖细胞的其他表型如上文所述。
rg祖细胞可以低温保存。rg祖细胞可以是人类的。
在另一个方面中,本发明公开提供了治疗有需要的个体的方法,其包括向所述个体给予包含rg祖细胞的组合物(例如本发明所述组合物或使用本发明所述方法生产的组合物)。
所述组合物可以给予眼睛、玻璃体、视网膜下空间或静脉内给予。rg祖细胞可以是人类的。
在另一个方面中,本发明公开提供了包含rg细胞的组合物,其中所述rg细胞是根据本发明(例如在上述段落中)所述方法生产的。
通过所述方法生产的rg细胞可以占组合物中细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%,并且可任选地,此类组合物(包含上述百分率的rg细胞)可以在培养物中增殖1周、2周、或超过2周,包括3周、4周或更长时间。
rg细胞可以表达以下标志物的一种或多种:brn3a,神经丝,tuj1和thy1,因此可以表征为brn3a(+),神经丝(+),tuj1(+)和/或thy1(+)。
rg细胞可以低温保存。rg细胞可以是人类的。
在另一个方面中,本发明公开提供了治疗有需要的个体的方法,其包括向所述个体给予包含rg细胞的组合物,例如本发明所述(例如在上述段落中)的组合物;或者通过本发明所述(例如在上述段落中)的方法生产的组合物。
所述组合物可以给予眼睛、玻璃体、视网膜下空间或静脉内给予。
在另一个方面中,本发明涉及人类起源的rg祖细胞或rg细胞的基本纯的制备物,优选为起源于没有在小鼠成纤维细胞饲养层平台上生长的细胞的、非供体衍生的rg祖细胞或rg细胞。例如所述制备物可以是85%-95%纯的。在一个实施方案中,本发明涉及制备人类起源的rg祖细胞或rg细胞的基本纯的制备物的方法,其不需要由小鼠成纤维细胞饲养层平台衍生的细胞。使用本发明的方法替换饲养层系统会生产具有更高均匀性的rg祖细胞或rg细胞,例如75%至100%、或者85%至95%。无饲养层干细胞的分化还可以在未引入外源诱导因子的情况下发生,其比现有技术具有大幅的改进。但是,任选地加入noggin多肽可以加速干细胞的分化,即使其对于分化并非必需的。
在另一个实施方案中,所述分化方法是无饲养层的和无异物的。因此,在一些实施方案中,人类细胞在缺乏衍生自非人类物种的任何培养基成分的情况下培养。
附图简述
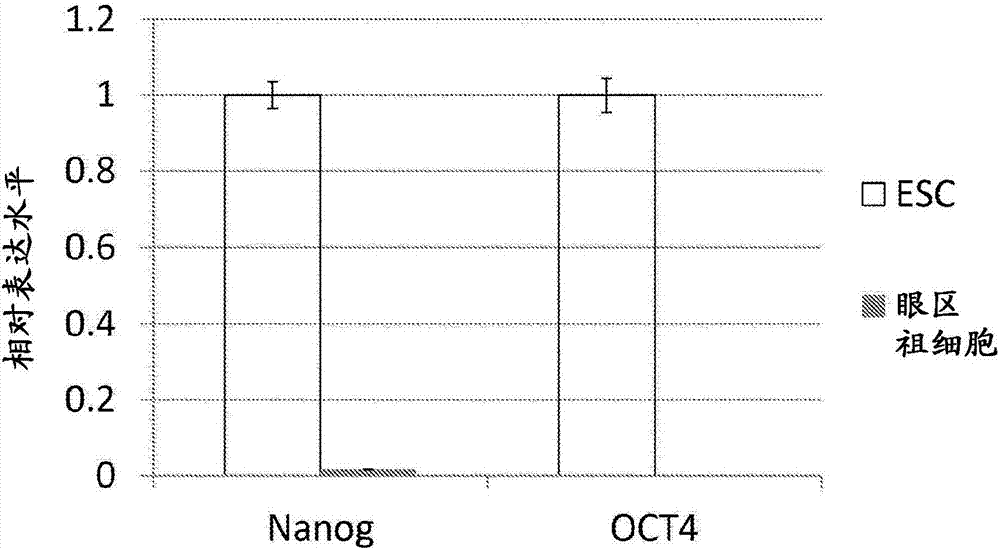
图1a和b.在人类es细胞体外分化过程中的基因表达。图1a.在体外细胞分化的第9天、第11天和第13天眼区祖细胞标志物(pax6和rx1)的流式细胞仪分析。图1b.es细胞(每个柱对的第一个柱)中和眼区祖细胞(每个柱对的第二个柱)中es细胞多能标志物的定量rt-pcr分析。
图2a和b.流式细胞仪分析显示pax6和rx1(图2a)、以及otx2,sox2和nestin(图2b)的表达。
图3a和b.视网膜神经节细胞(rgc)分化所必需的转录因子的表达。图3a.在培养的第35天,es细胞(每个柱对的第一个柱)中和视网膜神经节细胞(rgc)祖细胞(每个柱对的第二个柱)中math5,brn3a,brn3b和isl-1表达的实时rt-pcr分析。图3b.通过免疫染色和流式细胞仪定量math5,pax6和brn3a的表达。
图4.es细胞(各个三元组的第一个柱)中、早期视网膜神经节细胞(rgc)祖细胞(在各个三元组的第二个或者中间的柱)、以及在晚期视网膜神经节细胞(rgc)祖细胞(在各个三元组的第三个或最后的柱)中math5,brn3a和brn3b表达的实时rt-pcr分析。
图5.es细胞衍生的成熟视网膜神经节细胞(rgc)中thy1的表达。左侧小图:thy1的免疫染色;右侧小图:通过流式细胞仪定量thy1的表达。
图6a和b.由分化的人类es细胞衍生的视网膜神经节细胞。图6a.es细胞衍生的视网膜神经节细胞的形态学。图6b.细胞表达brn3a,神经丝和tuj1。
图7.在与激光光凝集有关的青光眼大鼠模型中动物研究的概要。与眼中微珠注射有关的另一个动物青光眼模型如下文所述。
图8.在对照(高iop+pbs)、经细胞处理(高iop+细胞)和正常大鼠中,在眼内压(iop)升高后的5周时,视网膜神经节细胞(rgc)存活的定量。
图9.由多能干细胞分化成视网膜神经节祖细胞和视网膜神经节细胞的时间轴。
图10.在微珠(mb)小鼠青光眼模型中rgc祖细胞对眼内压(iop)的作用。mb处理由一次眼注射组成(2μl15μm微珠,5x106/μl)。对侧眼用作内部对照。细胞处理由玻璃体注射2μlrgcp组成(300000个细胞)。接受玻璃体注射2μl培养基的小鼠用作对照。在第0天注射mb,在第7天进行rgcp或媒介物注射,并且在第28或56天(4周和8周),处死小鼠。评估rgc、rgc与视网膜的功能(pstr和erg,fortuneetal.ivos,2004,45:1854-1862;smithetal.docophthalmol,2014,128:155-168)、以及视觉行为(眼动力学)。在试验组之间未观察到iop的统计学显著性差异,表明移植的rgcp不会影响iop,而是通过另一种机制起作用。
图11.移植的视网膜神经节细胞祖细胞(rgcp)的整合。移植的rgcp表达rgc标志物tuj-1(底部左侧),其整合至经mb处理的小鼠的视网膜中,并且在进一步分化时形成延长的神经突(向着视神经乳头,底部中间)。
图12.移植的视网膜神经节细胞祖细胞(rgcp)整合至宿主视网膜神经节层中。
图13a和b.在经mb处理的小鼠中rgc损失的定量。图13a示出esc-rgcp的移植支持rgcp在注射后4周(左侧)和8周(右侧)时青光眼小鼠中宿主rgc的存活(黑色柱)。白色柱表示接受pbs注射的小鼠。*p<0.05,**p<0.01。图13b示出从中对视网膜神经节层取样的区域。椭圆形表示rgcp移植的区域。重要的是,在远离注射位点的区域中对宿主视网膜神经节层取样,仍然观察到因rgcp注射导致的rgc损失减少。这表明旁泌性机制可能与被移植细胞促进内源的天然视网膜神经节层存活的能力有关。
图14a-d.在青光眼小鼠中,移植rgcp会增强pstr的幅度。pstr为rgc功能的量度。图14a示出针对正常小鼠(无mb)、假处理的小鼠(注射mb和媒介物)、以及esc-rgc处理的小鼠(注射mb和psc-rgcp)的pstr记录的代表性波形。图14b示出在注射后4周时,由正常(正常的)、rgcp移植的(mb+rgcp)或媒介物注射的(mb+媒介物)青光眼小鼠得到的pstr振幅的定量。接受pbs注射的青光眼显示距正常基线显著减小的pstr振幅,而接受rgcp注射的那些青光眼显示pstr振幅与基线相比没有明显减小。图14c显示这3个试验组(正常,mb+媒介物,和mb+rgcp)的相对pstr振幅,表明在假处理的和rgcp处理的小鼠之间相对振幅的差异是显著的。图14d显示使用okr定量视觉对比敏感度,表明在注射后8周时与注射媒介物的眼睛相比,在rgcp移植的眼睛中视觉对比敏感度显著增强。*p<0.05,**p<0.01;ns:无显著性差异。
图15.视神经挤压模型概要。
图16a-j.在视神经损伤的小鼠中rgcp再增殖、分化和突触形成。图16a-c为在视神经损伤后3周时,在由小鼠取得的tuj1免疫标记视网膜铺片中植入rgcp(gfp+)的反射荧光图像。图16a示出gfp染色;图16b示出tuj1染色;而图16c示出gfp和tuj1染色。几乎所有的gfp+细胞都是tuj1免疫标记阳性的,并且许多细胞都带有长的神经突。图16d-e为由3d光片照明显微镜的录像取得的图像,所述显微镜记录了接受hesc衍生的rgcp移植的小鼠的tuj1免疫标记视网膜铺片。gfp+rgcp衍生的细胞与rgc标志物(tuj1)共同定位(图16d,使用dapi复染),并再群集成神经节细胞层(gcl)(图16e)。inl:内核层。图16f-j为由视网膜切片(图16f,h-j)或铺片(图16g)取得的代表性反射荧光共聚焦图像,其中所述切片或铺片针对突触后标志物psd95(图16i)和/或突触前标志物突触结合蛋白(synt)(图16f,针对gfp、synt和dapi染色)进行免疫标记。箭头指向细胞的斑点区域,显示阳性免疫标记。图16j中的覆盖图像表明在gfp+细胞上突触前和突触后标志物的共同定位,表明由植入细胞形成了功能性突触。
表1.dmem/f12培养基,neurobasaltmmedium(lifetechnologies),n2补充剂和b27补充剂的成分。
发明详述
本发明提供了用于生成视网膜神经节(rg)细胞和rg祖细胞的方法。这些方法涉及早期祖细胞(包括多能干细胞和眼区(ef)祖细胞)的体外分化。本发明提供的方法可以使用上述祖细胞(包括干细胞)群体的任意一种作为起始材料。
本发明进一步考虑了由原代眼区(eyefield,ef)祖细胞(即,由受试对象获得的ef祖细胞)在体外生成rg细胞和rg祖细胞。
视网膜神经发育在体内或体外通过多个发育阶段进行,每个阶段可以通过表型(例如通过标志物表达图谱的方式)和/或功能来定义。体外多能干细胞分化成ef祖细胞,其继而分化成rg祖细胞,该祖细胞可以包括早期rg祖细胞和晚期rg祖细胞,其继而分化成成熟的rg细胞(在本发明中称为rg细胞)。在rg祖细胞中,早期rg祖细胞可以分化成晚期rg祖细胞。晚期rg祖细胞可以分化成成熟rg细胞。早期rg祖细胞可以直接分化成成熟rg细胞。本发明提供的方法高效地生成rg细胞和rg祖细胞。
由多能干细胞向rg祖细胞和rg细胞发育的整体发育途径示意性地示于图9中。其中还示出各个发育阶段的标志物表达图谱。
如本文所用,祖细胞是指保持有丝分裂性质并且可以生产更多的祖细胞或者可以分化成终命运细胞系的细胞。术语祖细胞和前体细胞可以交换使用。本发明将更详细地讨论处于这些阶段中的各个阶段的细胞。
本发明提供的rg祖细胞和rg细胞可以用于多种体内和体外方法中。例如rg祖细胞可以在体内用于治疗视网膜病况,包括但不限于青光眼,例如开角型青光眼,闭角型青光眼,正常眼压型青光眼,先天性青光眼,色素性青光眼,继发性青光眼,假表皮脱落性青光眼,外伤性青光眼,新生血管性青光眼和虹膜角膜内皮综合征;以及视神经损伤,任选与自身免疫疾病、外伤、病毒感染、和缺血性再灌注损伤(任选与中风有关的缺血性再灌注损伤)有关的视神经损伤,糖尿病视网膜病,或者损害眼睛供血的其他状况。
本发明进一步提供了通过本发明所述方法获得的rg祖细胞和rg细胞。rg祖细胞和rg细胞可以通过多能干细胞或它们的分化后代(例如眼区祖细胞)的体外分化来获得。眼区祖细胞本身可以得自多能干细胞的体外分化,或者它们可以为得自受试对象的原代眼区祖细胞。
本发明提供了尚未由原代来源获得的或者无法由原代来源获得的rg祖细胞群体和rg细胞群体。这些群体在它们的细胞成份方面是均质的或接近均质的。例如,此类群体中至少50%,至少60%,至少70%,至少80%,至少90%,至少95%,至少99%或者大约100%的细胞可以是rg祖细胞。另一个实例,此类群体中至少50%,至少60%,至少70%,至少80%,至少90%,至少95%,至少99%或者大约100%的细胞可以是rg细胞。这些群体中的这些细胞可以是单一单倍型的。例如它们可以是hla匹配的。这些群体中的这些细胞可以是基因相同的。本发明进一步提供了hla分型的rg祖细胞库。此类细胞可以用于多种人类受试对象中。
此外,本发明提供的方法可以用于生成大量的rg祖细胞和rg细胞,这些细胞不能以其他的方式由原代来源获得。例如所述方法可以由起始的1百万个多能细胞生产108个rg祖细胞或108个rg细胞。
分化的(非干细胞)细胞类型
眼区祖细胞(ef祖细胞)。ef祖细胞最低程度定义为pax6(+)和rx1(+)细胞。它们还可以为six3(+),six6(+),lhx2(+)和tbx3(+)。所有这些标志物为转录因子。ef祖细胞还可以为nestin(+)和/或sox2(+)和/或otx2(+)。ef祖细胞不表达oct4和nanog(即,它们是oct4(-)和nanog(-))。ef祖细胞可以通过多能干细胞的体外分化而形成。此类分化可以在视网膜诱导(ri)培养基存在下发生,并且可以在外源因子(例如noggin多肽或noggin样化合物)的存在或缺乏下发生。
视网膜神经节(rg)祖细胞.本发明的分化方法使得rg发育比之前可能的程度甚至更进一步的剖析,由此揭示了2个rg祖细胞阶段。由ef祖细胞发育的第一个阶段为早期rg祖细胞阶段。这些细胞定义为math5,brn3a,brn3b和isl1中一种、多种或所有的表达(即,math5(+)和/或brn3a(+)和/或brn3b(+)和/或isl1(+)),并且pax6和rx1没有表达或者表达检测不到(即,pax6(-)和rx1(-))。这些rg祖细胞可以是math5(+);或者math5(+),brn3a(+);或者math5(+),brn3a(+),brn3b(+);或者math5(+),brn3a(+),brn3b(+),isl1(+)。这些早期rg祖细胞进一步分化成晚期rg祖细胞。这些细胞定义为brn3a,神经丝和thy1中一种、多种或所有的表达(即,brn3a(+)和/或神经丝(+)和/或thy1(+)),并且math5,brn3b和isl1没有表达或者表达检测不到(即,math5(-),brn3b(-)和isl1(-))。这些rg祖细胞可以是brn3a(+),神经丝(+)和thy1(+)。这些晚期rg祖细胞然后分化成rg细胞。早期rg祖细胞还可以直接分化成rg细胞,例如在rgc分化培养基中培养时。rg祖细胞是增殖性的。
视网膜神经节(rg)细胞.rg细胞最低程度定义为神经丝,tuj1,thy1和brn3a中一种、多种或所有的表达(即,神经丝(+)和/或tuj1(+)和/或thy1(+)和/或brn3a(+))。rg细胞可以为brn3a(+),神经丝(+),tuj1(+),并且可任选地为thy1(+)。rg细胞是有丝分裂期后的。rg细胞可以具有比rg祖细胞更多的树突,更复杂的树突和更长的树突。
培养方法
多能干细胞的维持培养.多能干细胞可以在无饲养层系统上(可任选地在基质上)维持,因此增殖。合适的基质包括但不限于层粘连蛋白,纤连蛋白,玻连蛋白,蛋白聚糖,巢蛋白,胶原蛋白,胶原蛋白i,胶原蛋白iv,胶原蛋白viii,硫酸乙酰肝素,matrigeltm(一种由engelbreth-holm-swarm(ehs)小鼠肉瘤细胞得到的可溶性制备物),cellstart(一种人类基底膜提取物)或它们的任意组合。在一些实施方案中,基质包括matrigeltm、由matrigeltm组成或者基本上由matrigeltm组成。matrigeltm可得自市售来源,例如bdbiosciences。层粘连蛋白(包括重组人类层粘连蛋白)可以用作matrigeltm的备选物。
在一个示例性的方法中,多能干细胞在无饲料层的条件下在它们的未分化状态下维持在matrigeltm或层粘连蛋白上。当汇集达到大约80-90%时,细胞通常被传代或冷冻。可以使用酶(例如分散酶)或非酶(例如基于pbs的解离缓冲剂,invitrogen)手段进行传代。在一些实施方案中,可以在无异物的条件下培养多能干细胞,并且在一些情况下,可以在血清补充剂(例如但不限于n2血清补充剂)存在下培养。
多能干细胞分化培养物.多能干细胞可以直接分化,意指多能干细胞分化成rg细胞或rg祖细胞不涉及分化成非神经节细胞谱系(这种情况例如在拟胚体(eb)中可以发生)。因此,本发明提供的方法无需并且优选地避免了eb的形成。这是优于现有技术方法的改善。
rg祖细胞或rg细胞可以通过悬浮培养(与神经球的形成有关)而生成,或者附着在基质上,例如但不限于matrigeltm或层粘连蛋白。
下文为多能干细胞分化成rg祖细胞和rg细胞的示例性过程。
首先,通过在视网膜诱导(ri)培养基和神经分化(nd)培养基中培养多能干细胞,将其分化成ef祖细胞。
在第0天,将ri培养基加入至汇集达到大约15-20%的多能干细胞中。ri培养基包括基础培养基(例如dmem/f12),或者包含以下的培养基:dmem/f12的成分;d-葡萄糖;抗生素,例如青霉素和链霉素;一种或多种血清补充剂,例如n2补充剂和b27补充剂;非必需氨基酸;胰岛素;以及任选地外源分化因子,例如下文所述noggin多肽或noggin样因子。
表1中提供了dmem/f12、n2补充剂和b27补充剂的成分。
在ri培养基中培养可以进行大约5天。在第1-4天进行全部培养基的更换。
在大约4天后(例如在大约第4、5或6天或者前后时间),将培养基更换成神经分化(nd)培养基。nd培养基包括基础培养基(neurobasaltmmedium(lifetechnologies)),或者包含以下的培养基:neurobasaltmmedium的成分;d-葡萄糖;抗生素,例如青霉素和链霉素;glutamaxtm;一种或多种血清补充剂,例如n2补充剂和b27补充剂;非必需氨基酸;以及任选地外源分化因子,例如下文所述noggin多肽或noggin样因子。
表1中提供了neurobasaltmmedium(lifetechnologies)的成分。
glutamaxtm为l-丙氨酰基-l-谷氨酰胺,其为l-谷氨酰胺的稳定化形式。其在培养物中经历较少的降解,因此减少了在长期培养物中可能发生的氨的构建。
将细胞在nd培养基中再培养大约8天(第6-13天)。规律地更换培养基(例如大约每2天一次)。在这种培养期间,细胞生长成集落,其边缘细胞变得扁平且大,而更加中心定位的细胞则更小并形成紧实的细胞簇。
在大约第10-11天,细胞开始表达pax6,然后在第12天,rx1开始表达(图1a)。rt-pcr分析显示oct4和nanog表达减少(图1b)。在第13天,如定量的流式细胞术所示,超过90%的细胞共同表达pax6和rx1(图2a),并且超过99%的细胞表达nestin,otx2和sox2(图2b)。这些结果表明多能干细胞已经分化成ef祖细胞。
在大约第14天(例如大约在第11,12,13,14或15天或者前后时间),将培养基更换成神经节细胞(gc)培养基。gc培养基包括基础培养基(例如neurobasaltmmedium(lifetechnologies)),或者包含以下的培养基:neurobasaltmmedium的成分;d-葡萄糖;一种或多种抗生素,例如青霉素和链霉素;glutamaxtm;一种或多种血清补充剂,例如n2补充剂和b27补充剂(配方编号080085-sa);以及包括毛喉素、bdnf和cntf的所有物质中的一种或多种。将细胞继续在gc培养基中培养,直至大约第20天。
在大约第20天,使用细胞刮棒将细胞由生长表面刮起,并在gc培养基中以机械方式碎裂成簇。将细胞簇转移至100mm超低附着培养皿中。细胞簇聚拢,并在这种悬浮培养物中形成单个的球。gc培养基每3天更换一次。在大约第35天,实时rt-pcr显示math5,brn3a,brn3b和isl1的表达强烈地上调(图3a)。流式细胞术显示,>99%的细胞表达转录因子math5和brn3a。大约94%math5(+)细胞针对pax6的染色为阴性(图3b)。这些结果表明存在早期rg祖细胞。
在大约第36-60天,将神经球在gc培养基中培养,并且大约每3-4天更换一次培养基。
在大约第60天时,实时rt-pcr显示brn3a持续表达。math5和brn3b的表达水平受到极大的下调(图4)。流式细胞术显示95.3%的细胞共表达brn3a和神经丝(数据未示出)。这些结果表明晚期rg祖细胞的存在。
rg祖细胞分化形成rg细胞.使用
在2周后,大约72%的细胞针对thy1的染色为阳性(图5)。细胞具有树突和轴突(图6a)。免疫染色显示表达brn3a,神经丝和tuj1(图6b)。这些结果表明存在rg细胞。
rg祖细胞和rg细胞的低温保存.可以在不含动物成分的低温保存缓冲剂(例如cryostorcs10)中以神经球的形式冷冻/低温保存早期rg祖细胞、晚期rg祖细胞和rg细胞。
细胞培养基
在本发明的实施方案中,细胞在多种细胞培养基中保存、增殖或分化。这些培养基将在下文中更详细地描述。
视网膜诱导(ri)培养基.视网膜诱导(ri)培养基用于使多能干细胞分化成ef祖细胞。视网膜诱导(ri)培养基包括基础培养基(例如dmem/f12),或者包含以下的培养基:dmem/f12的成分(如表1所示);d-葡萄糖(可任选地为0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml或者大约4.5mg/ml);一种或多种抗生素,例如青霉素(可任选地为0-100单位/ml或大约100单位/ml)和链霉素(可任选地为0-100μg/ml或大约100μg/ml);一种或多种血清补充剂,例如n2补充剂(可任选地为大约0.1至5%、大约0.1至2%或大约1%(v/v))和b27补充剂(可任选地为大约0.05-2.0%或大约0.2%(v/v));mem非必需氨基酸溶液(可任选地为由原液制备的大约1x浓度,大约0.1mm甘氨酸);以及可任选的胰岛素(可任选地为5-50μg/ml或大约20μg/ml)。ri培养基可以包含浓度为大约5-100ng/ml、大约10-100ng/ml、大约10-500ng/ml或大约50ng/ml的noggin多肽。视网膜诱导培养基可以包含bmp信号传递抑制剂,其可任选地选自noggin多肽、dorsomorphin、ldn-193189和它们的任何组合。ri培养基可以包含胰岛素、noggin多肽,或者胰岛素和noggin多肽。
noggin多肽并非必需的,但是当noggin多肽存在时,形成ef祖细胞的分化增多(如ef转录因子的表达增加所示)。可以使用具有相似活性的其他部分(包括但不限于sb431542)构建noggin多肽。
noggin多肽为分泌型bmp抑制剂,据报道其以高的亲和性与bmp2,bmp4和bmp7结合,从而阻断tgfβ家族的活性。sb431542为小分子,据报道其通过阻断actrib,tgfβr1和actric受体的磷酸化而抑制tgfβ/激活素/nodal。认为sb431542通过阻断内源激活素和bmp信号而使激活素-和nanog-介导的多能性网络不稳定,并抑制bmp-诱导的滋养层、中胚层和内胚层细胞的命运。
预计例如当具有一种或多种上述活性的试剂用于本发明公开的方法中时,其可以替代或增强noggin多肽和/或sb431542的功能。例如noggin多肽和/或小分子sb431542可以被一种或多种抑制剂替代或增强,其中所述抑制剂影响以下3个目标领域的任意一个或所有:1)防止配体与受体的结合;2)阻断受体的活化(例如dorsomorphin);以及3)抑制smad细胞内蛋白质/转录因子。示例性的潜在合适的因子包括天然的分泌bmp抑制剂chordin(其阻断bmp4)和follistatin(其阻断激活素),以及它们的类似物或模拟物。可以模拟noggin多肽的作用的其他示例性因子包括使用显性失活受体,或者阻断螯合bmp2,bmp4和/或bmp7的抗体。此外,对于阻断受体的磷酸化,据报道dorsomorphin(或化合物c)对干细胞具有类似的作用。还可以使用可溶性抑制剂例如sis3(6,7-二甲氧基-2-((2e)-3-(1-甲基-2-苯基-1h-吡咯并[2,3-b]吡啶--3-基-丙-2-烯酰基))-1,2,3,4-四氢异喹啉,smad3的特异性抑制剂sis3)、一种或多种抑制剂smad(例如smad6,smad7,smad10)的过表达、或者针对一种受体smad(smad1,smad2,smad3,smad5,smad8/9)的rnai来实现smad蛋白质的抑制。预计适于生成神经祖细胞的因子的另一个组合包括白血病抑制因子(lif),gsk3抑制剂(chir99021),化合物e(γ分泌酶抑制剂xxi)和tgfβ抑制剂sb431542的混合物,其之前已经显示能够有效地生成神经嵴干细胞(lietal.,procnatlacadsciusa.2011may17;108(20):8299-304)。另外的示例性因子可能包括sb431542的衍生物,例如这样的分子,其包含一个或多个加入的或不同的取代基、类似的官能团等,以及对一种或多种smad蛋白质具有类似的抑制作用。例如可以通过将多能细胞与所述因子接触,并监测ef祖细胞表型的采用情况(例如特征基因的表达(包括本发明所述标志物的表达、与ef祖细胞启动子偶联的报告基因的表达等)或者形成本发明所公开的细胞类型的能力,例如视网膜神经祖细胞、rg祖细胞或rg细胞),从而鉴定合适的因子或因子组合。
优选地,使用视网膜诱导培养基处理或者在视网膜诱导培养基中培养细胞,然后使用神经分化培养基培养。
神经分化(nd)培养基。神经分化(nd)培养基用于使多能干细胞分化成眼区(ef)祖细胞。nd培养基包括基础培养基(例如neurobasaltmmedium(lifetechnologies)),或者包含以下的培养基:neurobasaltmmedium的成分,如表1所示;d-葡萄糖(可任选地为0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml或者大约4.5mg/ml);一种或多种抗生素,例如青霉素(可任选地为0-100单位/ml或大约100单位/ml)和链霉素(可任选地为0-100μg/ml或大约100μg/ml);glutamaxtm(可任选的为1x,大约2mm);一种或多种血清补充剂,例如n2补充剂(可任选地为0.1至5%、或者大约0.1至2%,包括1%(v/v))和b27补充剂(可任选地为大约0.05-2%,包括2%(v/v));mem非必需氨基酸溶液(可任选地为原液的大约1x浓度,或大约0.1mm最终浓度);以及可任选的noggin多肽(可任选地为10-500ng/ml,包括50ng/ml)。
神经节细胞(gc)培养基.神经节细胞(gc)培养基用于使多能干细胞分化成视网膜神经节(rg)祖细胞,并且更具体而言,使眼区祖细胞分化成视网膜神经节(rg)祖细胞。gc培养基包括基础培养基(例如neurobasaltmmedium(lifetechnologies)),或者包含以下的培养基:neurobasaltmmedium的成分,如表1所示;d-葡萄糖(可任选地为0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml或者大约4.5mg/ml);一种或多种抗生素,例如青霉素(可任选地为0-100单位/ml或大约100单位/ml)和链霉素(可任选地为0-100μg/ml或大约100μg/ml);glutamaxtm(可任选的为1x,或大约2mm);一种或多种血清补充剂,例如n2补充剂(可任选地为0.1-5%、或者0.1-2%v/v,包括1%(v/v))和b27补充剂(配方编号080085-sa)(可任选地为大约0.05-2%,包括2%(v/v));以及毛喉素(可任选地为1-20μm,包括)5μm、bdnf(可任选地为1-200ng/ml,包括10ng/ml)和cntf(可任选地为1-200ng/ml,包括10ng/ml)中的一种或多种。
视网膜神经节细胞(rgc)分化培养基.rgc分化培养基被用于使多能干细胞分化成视网膜神经节(rg)细胞,并且更具体而言,使rg祖细胞分化成rg细胞。rgc分化培养基包括基础培养基(例如neurobasaltmmedium(lifetechnologies)),或者包含以下的培养基:neurobasaltmmedium的成分,如表1所示;d-葡萄糖(可任选地为0-10mg/ml,2.5-7.5mg/ml,3-6mg/ml,4-5mg/ml或者大约4.5mg/ml);一种或多种抗生素,例如青霉素(可任选地为0-100单位/ml或大约100单位/ml)和链霉素(可任选地为0-100μg/ml或大约100μg/ml);一种或多种血清补充剂,例如b-27补充剂(配方编号080085-sa)(可任选地为大约0.05至5.0%,大约1.5至2.5%或大约2%(v/v));glutamaxtm(可任选地为1x,或大约2mm);以及毛喉素(可任选地为1-20μm,包括5μm)、bdnf(可任选地为1-200ng/ml、5-50ng/ml、5-25ng/ml或大约10ng/ml)、cntf(可任选地为1-200ng/ml、5-50ng/ml、5-25ng/ml或大约10ng/ml)、camp(可任选地为1-500ng/ml、10-250ng/ml、5-150ng/ml或大约100ng/ml)、dapt(可任选地为1-100μm或1-20μm)和可任选地视黄酸(可任选地为0.5-20μm或1-5μm)的所有物质中的一种或多种。bdnf可以为人类bdnf。ctnf可以为人类ctnf。rgc分化培养基可以包含bdnf和/或cntf。rgc分化培养基可以包含包括毛喉素,camp和dapt、或者其他notch抑制剂的所有物质中的一种或多种。rgc分化培养基可以包含胰岛素,包括人类胰岛素(可任选地为大约5-50μg/ml或大约20μg/ml)。
表1中提供了dmem/f12,neurobasaltmmedium(lifetechnologies),n2血清补充剂,b27血清补充剂和b27血清补充剂(配方编号080085-sa)的成分。应该理解的是,本发明涵盖这些特定培养基和/或补充剂(包括所述这些成分、基本上由所述这些成分组成或由所述这些成分组成)的用途。
细胞制备物及其纯度
如本文所用,术语制备物,特别是当其指细胞制备物时,其可以与术语群体和组合物交换使用。为了简洁,可以就制备物来描述多个方面和实施方案,但是应该理解的是此类描述同等地适用于群体和组合物。应该理解的是制备物可以包含其他的非细胞构成成分。
如整篇本发明公开所用,细胞制备物的纯度水平可以定量为制备物中表达所需细胞类型的一种或多种标志物(包括本申请中识别的那些标志物或本领域已知的其他标志物)的细胞相对于制备物中细胞总数的比例。可以通过检测并计数表达所关注的一种或多种标志物的细胞和/或不表达所关注的一种或多种标志物的细胞并且任选地计数细胞总数来测定纯度。可以用于计数细胞的示例性方法包括但不限于荧光激活细胞分选术(facs)、免疫组织化学、原位杂交和本领域已知的其他合适的方法。通常,此类分析排除了制备物中的非存活的细胞。
如本文所用,大部分细胞是指至少50%,并且根据该实施方案,可以包括至少60%,至少70%,至少80%,至少90%,至少95%或大约100%的细胞。
本发明公开基于所公开的方法能够使祖细胞(例如但不限于多能干细胞)直接分化的能力而提供各种细胞群体的基本纯的(或均质的)制备物。如本文所用,直接分化意图是指祖细胞群体分化成或者向着所需的细胞谱系分化,部分是由于提供给此类祖细胞的因子或其他刺激,由此避免分化成其他不需要的并由此潜在污染性的细胞谱系。本发明提供的方法驱动了例如多能干细胞分化成眼区祖细胞,而不会产生拟胚体(eb)。如下文所述,eb是三维细胞簇,其可以在多能干细胞(包括但不限于胚胎干细胞(es))分化过程中形成,并且通常包含中胚层、外胚层和内胚层谱系的细胞,包括祖细胞。eb的三维本性可以创建与本发明所述不基于eb的方法中发生的不同的环境,包括不同的细胞-细胞相互作用,和不同的细胞-细胞信号传递。此外,eb中的细胞可能不是全部都接受相似剂量的外源加入的试剂,例如在周围培养基中存在的分化因子,这样会在eb发育过程中产生不同的分化事件和决策。
相反,本发明培养祖细胞的培养方法无需并且优选避免eb的形成。相反,这些方法在以下条件下培养细胞:提供细胞与周围培养基同等的接触,包括这些培养基中的因子。例如所述细胞可以以附着在培养表面上的单层或接近单层的方式生长。
所有的或大部分的祖细胞与它们周围的培养基、以及由此与此类培养基中的因子以大致相等的程度接触的能力使得这些祖细胞在相似的时间分化达到相似的程度。对于祖细胞群体而言,这种相似的分化时间轴表明此类细胞是同步化的。在一些情况下,所述细胞还可以是细胞周期同化的。这种同步性得到了在其细胞构成中是均质的或接近均质的细胞群体。例如本发明所述方法可以生产细胞群体,其中至少50%,至少60%,至少70%,至少80%,至少90%,至少95%或大约100%的细胞是感兴趣的特定细胞。感兴趣的细胞可以例如通过细胞内或细胞外标志物的表达由表型来定义。感兴趣的细胞可以是眼区祖细胞、rg祖细胞(早期或者晚期)或者rg细胞。
如本文所用,“基本纯的细胞制备物”是指其中细胞为至少60%纯的细胞制备物。因此,制备物中至少60%的细胞表达特定细胞类型的一种或多种标志物(包括本申请中识别的那些标志物或本领域已知的其他标志物)。所述细胞可以是至少65%纯的或至少70%纯的。所述细胞可以为大约超过70%纯的,包括至少75%,80%,85%或90%纯的。
因此,例如“基本纯的rg细胞制备物”是指其中制备物中至少60%的细胞表达rg细胞的一种或多种标志物(包括本申请中识别的那些标志物或本领域已知的其他标志物)的细胞制备物。制备物中至少70%的细胞可以表达rg细胞的一种或多种标志物,在这种情况下,所述制备物是70%纯的。制备物中至少85%的细胞可以表达rg细胞的一种或多种标志物,在这种情况下,所述制备物是85%纯的。制备物中至少95%的细胞可以表达rg细胞的一种或多种标志物,在这种情况下,所述制备物是95%纯的。在一些实施方案中,所述制备物可以为大约85%至95%纯的。
作为另一个实例,“基本纯的rg祖细胞制备物”是指其中制备物中至少60%的细胞表达rg祖细胞的一种或多种标志物(包括本申请中识别的那些标志物或本领域已知的其他标志物)的细胞制备物。制备物中至少70%的细胞可以表达rg祖细胞的一种或多种标志物,在这种情况下,所述制备物是70%纯的。制备物中至少85%的细胞可以表达rg祖细胞的一种或多种标志物,在这种情况下,所述制备物是85%纯的。制备物中至少95%的细胞可以表达rg祖细胞的一种或多种标志物,在这种情况下,所述制备物是95%纯的。在一些实施方案中,所述制备物可以为大约85%至95%纯的。
在本发明公开的某些实施方案中,细胞(包括但不限于rg祖细胞和rg细胞)的平均末端限制性片段长度(trf)为超过7kb,7.5kb,8kb,8.5kb,9kb,9.5kb,10kb,10.5kb,11kb,11.5kb或者甚至12kb。用于测量平均末端限制性片段长度(trf)的方法是本领域已知的。例如参见kimuraetal.nat.protocol,5(9):1596-1607,2010。
作为发育阶段函数的细胞标志物表达
可以在蛋白质和/或mrna水平下评估标志物的表达,例如但不限于pax6,rx1,six3,six6,lhx2,tbx3,sox2,chx10,math5,brn3(包括brn3a和brn3b),isl1,神经丝,tuj1,thy1,nestin,otx2,nanog,oct4(参见fischeraj,rehta,devneurosci.2001:23(4-5):268-76;baumeretal.,development.2003jul;130(13):2903-15;swaroopetal.,natrevneurosci.2010aug;11(8):563-76;agathocleousandharris,annu.rev.celldev.biol.2009.25:45-69;bebyf,lamoneriet,exp.eyeres.2013;111,9-16,每一件申请的内容以引用方式全文并入本文)。
例如除非上下文内容中另有所指,否则所述标志物通常是人类的。可以使用常规的免疫细胞化学方法或常规的pcr方法(这些技术是本领域那些普通技术人员公知的)来识别细胞标志物。
多能干细胞
如本文所用,术语“多能干细胞”为这样的细胞,其:(a)在移植到免疫缺陷型(scid)小鼠中时能够诱导畸胎瘤;(b)能够分化成所有3个胚层的细胞类型(例如外胚层、中胚层和内胚层细胞类型);以及(c)表达多能性的一种或多种标志物(例如oct4,碱性磷酸酶,ssea-3表面抗原,ssea-4表面抗原,nanog,tra-1-60,tra-1-81,sox2,rex1等)。在某些实施方案中,多能干细胞表达选自oct-4,碱性磷酸酶,ssea-3,ssea-4,tra-1-60和tra-1-81中的一种或多种标志物。
多能干细胞包括胚胎干(es)细胞、胚胎衍生的干细胞、胚胎生殖(eg)细胞、胚胎瘤(ec)细胞、诱导多能干(ips)细胞、和刺激引发获得万能性(stap)的细胞。示例性多能干细胞可以使用本领域已知的任意多种方法生成。如本领域所意识的那样,可以由es细胞或eg细胞等形成拟胚体。还如本领域所意识的那样,可以在胚胎未被破坏的情况下生成es细胞。例如可以由非胚胎的孤雌卵(卵细胞)生成es细胞,可以由非存活的胚胎(包括有意改造成非存活的那些,例如不能植入)生成es细胞,并且可以由胚胎(包括非存活的胚胎)的单分裂球生成es细胞。
多能干细胞可以被修饰(包括遗传修饰)从而增加寿命、潜能和/或归巢,和/或预防或减轻同种免疫应答,和/或将所需的因子传递给多能干细胞的已分化后代,和/或在多能干细胞的已分化后代中表达所需的因子。
多能干细胞可以得自任何物种。已经由小鼠、人类和其他来源生成了多种类型的多能干细胞,包括es细胞和ips细胞。因此,在本发明的方法中使用的多能干细胞可以得自任何物种,包括但不限于人类、非人类灵长动物、啮齿动物(小鼠、大鼠)、蹄类动物(牛、绵羊等)、狗(家犬和野狗)、猫(家猫和夜猫,例如狮子、老虎、非洲猎豹)、兔、仓鼠、山羊、大象、熊猫(包括大熊猫)、猪、浣熊、马、斑马、海洋哺乳动物(海豚、鲸鱼等)等。在某些实施方案中,所述物种为濒危物种。在某些实施方案中,所述物种是目前灭绝的物种。
胚胎干(es)细胞.无论它们的来源或用于它们的具体方法如何,胚胎干细胞为这样的细胞:(i)能够分化成所有3个胚层的细胞;(ii)至少表达oct4和碱性磷酸酶;以及(iii)当被移植到免疫缺陷型动物中时能够生产畸胎瘤。该术语包括:由人类囊胚或桑椹胚的内细胞团(icm)衍生的细胞,包括作为细胞系已经过一系列传代的那些;由受精卵、分裂球(例如卵裂期或桑椹期胚胎的分裂球)或囊胚期的哺乳动物胚胎衍生的细胞,精子和卵细胞的人工融合产生的细胞,使用精子使卵细胞受孕得到的细胞,核转移得到的细胞(例如体细胞核移植(scnt)),单性生殖的细胞,雄性单性生殖的细胞,或者通过染色质重编程以及随后将重编程的染色质引入至细胞中。
术语es细胞并非是指、并且不应该是指通过破坏胚胎而生成的细胞。相反,有多种方法是可利用的,可以用于生成es细胞,而不会破坏胚胎,例如人类胚胎。例如可以按照类似于着床前胚胎遗传学诊断(pgd)提取分裂球类似的方式,由胚胎衍生的单一的分裂球生成es细胞。此类细胞系的实例包括ned1,ned2,ned3,ned4,ned5和ned7。可以使用的示例性人类胚胎干细胞系为ma09细胞。ma09细胞的分离和制备之前在klimanskaya,etal.(2006)“humanembryonicstemcelllinesderivedfromsingleblastomeres.”nature444:481-485,andchungetal.(2008)“humanembryonicstemcelllinesgeneratedwithoutembryodestruction,cellstemcell,2(2):113-117中描述。所有这些细胞系均是在未发生胚胎破坏的情况下生成的。
可以使用的其他es细胞包括但不限于人类es细胞,例如ma01,ma09,act-4,ma142,ma143,ma144,ma145,ma146,ma126(ned1),ma127,(ned2),ma128,(ned3),ma129,(ned4),ned7,no.3,h1,h7,h9,h14和act30es细胞。
还可以参照nih人类胚胎干细胞登记。根据本发明公开使用的人类es细胞可以根据本领域已知的gmp标准衍生得到并保持。
如本发明所提及的那样,es细胞衍生自多种物种,包括小鼠,非人类灵长动物的多个物种和人类,并且胚胎衍生的干细胞已经由多种其他的物种生成。
诱导的多能干(ips)细胞.诱导的多能干细胞(ips细胞)为通过体细胞重编程,通过表达因子的组合(在本发明中称为重编程因子)而生成的细胞。
可以使用处于任何发育阶段的几乎任何体细胞作为起始点来生成ips细胞。例如可以由胚胎、胎儿、新生儿、少年或成人供体得到所述细胞。在一些情况下,所述细胞得自新生儿、少年或成人供体,或者得自羊水,因此无需破坏胚胎或胎儿。可以使用的示例性体细胞包括成纤维细胞,例如皮肤样品或活组织检查而获得的皮肤成纤维细胞;得自滑膜组织的滑膜细胞;包皮细胞;面颊细胞;以及肺成纤维细胞。在某些实施方案中,体细胞并非成纤维细胞。
在某些实施方案中,在体细胞中表达至少一种、至少2种、至少3种或者至少4种重编程因子,从而成功地重编程体细胞。重编程因子可以选自oct4(有时称为oct3/4),sox2,c-myc,klf4,nanog和lin28,但是它们不限于此。在一些实施方案中,重编程因子包括oct4(有时称为oct3/4),sox2,c-myc和klf4的组合,或者oct4,sox2,nanog和lin28的组合。
可以使用多种方法中的任意一种将重编程因子引入至体细胞中,包括但不限于整合载体、非整合载体(例如附加体质粒,例如在yuetal.,science.2009may8;324(5928):797-801中所述那些)、化学手段、蛋白质传导、电穿孔、微注射、阳离子两亲性分子、与脂双层融合、去污剂渗透等、或它们的组合。此外,可以通过将体细胞与诱导重编程因子表达的至少一种试剂(例如小的有机分子试剂)接触来诱导重编程因子的表达。
使用整合病毒载体表达oct3/4,sox2,cmyc和klf4已经显示足以重编程小鼠体细胞。使用整合病毒载体表达oct3/4,sox2,nanog和lin28已经显示足以重编程人类体细胞。
ips细胞可以得自细胞库。为了生成组织匹配的rg细胞或rg祖细胞,ips细胞可以使用得自特定患者或匹配供体的材料来特异性的生成。ips细胞可以由在预期受体中基本不是免疫原性的细胞生产得到,例如由自体细胞或者由与预期受体组织相容性的细胞生产得到。
刺激引发获得多能性(stap)的细胞.刺激引发获得多能性(stap)的细胞为通过使用亚致死剂量的刺激(例如暴露于低ph)使得体细胞重编程而生产的多能干细胞。重编程无需使核转移至体细胞中或对体细胞进行基因操作。可以参照obokataetal.,nature,505:676-680,2014。
成人干细胞.“成人干细胞”是指由成人组织分离得到的多能细胞,可以包括骨髓干细胞、脐带血干细胞和脂肪干细胞,并且是人类起源的。
重要的是,本发明的方法不使用eb分化步骤(即,多能干细胞在未形成eb的情况下发生分化而形成视网膜神经节细胞)。如本发明所讨论,这种分化工艺具有意想不到的益处。
“拟胚体”是指包含多能干细胞(例如ipsc或esc)的细胞的团块或簇,其可以通过在未附着的条件下培养多能干细胞而形成,例如在低附着的基材上或者在“悬滴”中。在这些培养物中,多能干细胞可以形成公称为拟胚体的细胞团块或簇。参见itskovitz-eldoretal.,molmed.2000feb;6(2):88-95,该文献以引用方式全文并入本文。通常,拟胚体最初以多能细胞的实体团块或簇的形式形成,经过一段时间后,一些拟胚体开始包含充满流体的腔,所述实体团块或簇在文献中称为“简单”eb,而充满流体的腔称为“囊状”拟胚体。
应用和用途
筛选测试
本发明提供了用于筛选多种试剂的方法,其中所述试剂调控了眼区祖细胞向视网膜神经节细胞谱系的分化。本发明的方法还可以用于发现支持和/或救援rg祖细胞的治疗试剂,其中所述rg祖细胞可以在得自眼区祖细胞的培养物中生成。
本发明提供了筛选多种试剂的方法,其中所述试剂调控了rg祖细胞的分化。所述方法还可以用于发现支持和/或救援成熟rg细胞的治疗试剂,其中所述rg细胞在得自rg祖细胞的培养物中生成。
就本发明的目的而言,“试剂”意图包括但不限于生物或化学化合物,例如简单的或复杂的有机或无机分子;肽;蛋白质(例如抗体);多核苷酸(例如反义的rna干扰(rnai,shrna,microrna));或者核酶。可以合成大量的化合物,例如聚合物,例如多肽和多核苷酸;以及基于多种核心结构的合成有机化合物,它们也包含在术语“试剂”的范围内。此外,多种天然来源可以提供用于筛选的化合物,例如植物或动物提取物等。尽管未必清楚地陈述,但是应该理解的是所述试剂可以单独使用,或者与另一种试剂(具有与本发明的筛选所识别的试剂相同的或不同的生物活性)组合使用。
为了实施体外筛选方法,可以如本发明所述来获得分离的细胞群体。当所述试剂为除了dna或rna以外的组合物时(例如上文所述小分子),所述试剂可以直接加入至细胞中,或者加入至用于添加的培养基中。对于本领域那些技术人员显而易见的是,必须加入“有效”量,该量可以凭经验确定。当所述试剂为多核苷酸时,其可以使用基因枪或电穿孔直接加入。备选地,可以使用基因传递媒介物或上文所述其他方法将多核苷酸插入至细胞中。可以测试阳性和阴性对照以证明药品或其他试剂的预期活性。
药品筛选
本发明的另一个方面涉及用于识别药品的测试的研发和用途,其中所述药品能够保护神经节免于升高的iop的作用、谷氨酸盐的毒性或者可以导致天然视网膜神经节细胞和它们的祖细胞的功能损失或细胞死亡的其他环境或遗传状况。可以通过例如降低神经节对各种这些作用的敏感性来取得保护。在其他的实施方案中,所述测试可以用于识别促进天然视网膜神经节细胞和/或它们的祖细胞增殖的试剂、和/或可以诱导天然视网膜神经节祖细胞分化/成熟成成熟视网膜神经节细胞的试剂。可以在这些测试中进行检验的试剂包括但不限于小分子(例如分子量为低于10000原子质量单位(amu)的有机化合物)、蛋白质和肽、核酸等。例如可以通过细菌、酵母菌或其他有机体(例如天然产物)生产、以化学方式生产(例如小分子,包括拟肽)或者以重组方式生产待检验的试剂。
例如所述测试可以评价化合物保护培养物中视网膜神经节细胞(例如可以使用本发明提供的方法通过多能干细胞、眼区祖细胞或rg祖细胞的分化而衍生得到)免于谷氨酸盐诱导的毒性的能力。有多种测试方式足够使用,并且,根据本发明公开,本领域的技术人员毫无疑问也理解本发明中未明确描述的那些测定法。在检验化合物和天然提取物的文库的许多药品筛选程序中,为了使在给定时间内所调查的化合物的数量最多,高通量的测试是理想的。例如可以通过检测凋亡标志物的相对变化来检测和定量测试试剂的保护活性—保护性的试剂应该会使得在神经毒性状况(例如升高的谷氨酸盐水平)下凋亡的标志物的显著性/表达水平相对于对照未处理细胞而言产生降低。可以通过使用由各种浓度的测试化合物获得的数据生成剂量应答曲线来评估试剂的效力。还可以进行对照测试,从而提供用于比较的基线。在对照测试中,可以在缺乏测试化合物的情况下定量凋亡的程度。应该理解的是,通常而言,其中反应物混合的顺序可以改变,并且可以同时混合。
感觉神经视网膜结构
rg祖细胞以及任选地由其分化的rg细胞可以用于生成包含视网膜色素上皮(rpe)细胞、光感受器细胞以及rg祖细胞或rg细胞本身的感觉神经视网膜结构。例如本发明考虑生成由rg细胞或rg祖细胞、rpe细胞和光感受器细胞(或光感受器祖细胞)构成的多层细胞结构。这些结构可以用于药品筛选,作为用于疾病的模型,或者用于药物制备物中。在药物制备物的情况下,药物制备物可以为rpe-光感受器-rg植入物,其可以设置在生物相容性固体支持物或基质(优选为可生物吸收的基质或支持物,其可以像“贴剂”那样植入)上。
进一步考虑的是rg细胞或rg祖细胞可以与得自视网膜神经祖细胞(例如chx10(+)细胞)的光感受器一起生成,并且这些细胞可以与rpe细胞层(例如单层)一起移植。
为了进一步说明,用于细胞的生物相容性支持物可以是用于视网膜祖细胞的可生物降解的聚酯膜支持物。可生物降解的聚酯可以为适于用作基材或者支架以用于支持视网膜祖细胞的增殖和分化的任何可生物降解的聚酯。聚酯应该能够形成薄膜,优选为微纹理化的膜,并且如果用于组织或细胞移植,则应该是可生物降解的。用于本发明的合适的可生物降解的聚酯包括聚乳酸(pla);聚丙交酯;聚羟基脂肪酸酯(均聚物和共聚物),例如聚羟基丁酸酯(phb),聚羟基丁酸酯共羟基戊酸酯(phbv),羟基丁酸酯共羟基己酸酯(phbhx),聚羟基丁酸酯共羟基辛酸酯(phbo)和聚羟基丁酸酯共羟基十八酸酯(phbod);聚己内酯(pcl);聚酯酰胺(pea);脂肪族共聚酯,例如聚丁二酸丁二醇酯(pbs)和聚丁二酸丁二醇酯/己二酸酯(pbsa);芳香族共聚酯。可以使用高分子量和低分子量的聚酯,取代的和未取代的聚酯,包括嵌段、支化或随机的,以及聚酯的混合物和共混物。优选地,可生物降解的聚酯为聚己内酯(pcl)。
在某些实施方案中,生物相容性支持物为聚(对亚二甲苯基)聚合物,例如聚对二甲苯n,聚对二甲苯d,聚对二甲苯-c,聚对二甲苯af-4,聚对二甲苯sf,聚对二甲苯ht,聚对二甲苯vt-4和聚对二甲苯cf,最优选为聚对二甲苯-c。
通常,可以使用已知的技术将聚合物支持物形成薄膜。膜厚度有利地为大约1微米至大约50微米,并且优选地,厚度为大约5微米。膜的表面可以是光滑的,或者膜的表面可以部分或完全微纹理化的。合适的表面纹理包括例如微沟槽或微柱。可以切割并使膜成型,从而形成用于移植的合适的形状。
rpe、光感受器细胞或光感受器祖细胞、以及rg祖细胞和/或rg细胞可以直接、一起或依次(例如在形成rpe层后对光感受器细胞或光感受器祖细胞铺板)铺于膜上,从而形成生物相容性支架。备选地,可以使用合适的涂敷材料涂敷聚合物膜,例如聚-d-赖氨酸,聚-l-赖氨酸,纤连蛋白,层粘连蛋白,胶原蛋白i,胶原蛋白iv,玻连蛋白和matrigeltm。细胞可以铺成任何所需的密度,但是单层rpe细胞(rpe单层)是优选的。
治疗用途
在一个示例性的实施方案中,可以将所述细胞移植到有此需要的大鼠中,例如高眼压大鼠或疾病的其他动物模型中,并且可以通过视动反应检验、erg(视网膜电图描记术)、亮度阈值记录和/或视觉中心血流量测试来检测所引起的对视功能的作用。
如本文所用,疾病的“迹象”广义而言是指预示疾病的任何异常,这些异常在对患者进行检查时是可发现的;与症状(其为疾病的主观适应症)相反,其是指疾病的客观适应症。
如本文所用,疾病的“症状”广义而言是指患者所经历的任何病态现象或偏离正常结构、功能或感觉,其预示了疾病。
如本文所用,“治疗”、“治疗的”、“治疗性”或“疗法”广义而言是指治疗疾病,阻止或减慢疾病或其临床症状的发展,和/或减轻疾病,从而使得疾病或其临床症状退化。治疗涵盖了预防、防止、治疗、治愈、补救、减少、减轻和/或提供疾病、迹象和/或疾病症状的减缓。在患有正在发生的疾病迹象和/或症状的患者中,治疗涵盖迹象和/或症状的减轻。治疗还涵盖“预防”和“防止”。预防包括防止在患者治疗疾病后发生的疾病,或者减少患者中疾病的发生率或严重性。就治疗目的而言,术语“减少的”广义而言是指迹象和/或症状的临床显著的减少。治疗包括治疗再发或复发的迹象和/或症状。治疗涵盖但不限于在任何时间排除迹象和/或症状的出现,以及减少现有的迹象和/或症状,以及消除现有的迹象和/或症状。治疗包括治疗慢性疾病(“维持”)和急性疾病。例如治疗包括治疗或防止迹象和/或症状的再发或复发。
在一些实施方案中,治疗可以通过稳定的或改善的暗视阈值反应、稳定的或改善的视动反射(okr)、稳定的或改善的视觉诱发电位(vep)和/或稳定的或改善的视敏度(例如通过erg测量)来指示。稳定的或改善的水平是相对于治疗前的水平或相对于未治疗的对照例如对侧眼而言的。应该理解的是,在一些情况下,在缺乏治疗的情况下,这些功能或反应的一种或多种将随着时间的流逝而恶化,并且本发明的移植细胞可以阻止、减少或限制这种恶化。因此,在一些情况下,所述功能或反应相对于对照保持稳定,而在其他的情况下,所述功能或反应有所改善,这两种情况被认为对于受试对象而言都是有利的,因此被认为是治疗。
在这些和其他的实施方案中,受试对象可以经历对其视网膜神经节细胞层的潜在的益处。例如,与对照相比,天然rg细胞层可以经历改善的存活或减少的细胞损失。在其他的实施方案中,受试对象可以经历视神经中轴突的增加形成。
本发明还提供了在需要治疗的患者中替代或修复rg细胞的方法,其包括对患者给予包含本发明的rg祖细胞、或由其衍生的rg细胞或它们的组合的药物制备物。如本发明所述,药物制备物可以为细胞的悬液,其在体外形成可移植的组织。在许多情况下,通过眼内注射给予所述细胞(包括玻璃体注射和视网膜下注射)。因此,所述细胞可以在眼内给予到发病的或退化的视网膜的视网膜下空间中。然而,由于rg祖细胞还具有神经保护作用,所以所述细胞在可以局部给予视网膜外部(例如在玻璃体中),或者通过储库或系统性传递至肌体的其他部分。
本发明的药物制备物可以用于多种会导致视觉系统恶化(包括视网膜退化相关的疾病)的疾病和紊乱中。此类疾病和紊乱可以由衰老导致,使得其看起来似乎缺乏可以鉴定为恶化的实质来源的损伤或疾病。技术人员应该理解的是所建立的诊断此类疾病状态和/或针对此类损伤的已知迹象进行检查的方法。此外,就动物的视觉系统而言,文献有众多关于年龄相关的衰退或恶化的信息。术语“视网膜退化相关疾病”是指由天生的或后天的视网膜退化或异常所导致的任何疾病。视网膜退化相关疾病的实例包括视网膜发育不良、年龄相关的黄斑退化、糖尿病视网膜病、色素性视网膜炎、先天性视网膜营养不良、利伯先天性黑矇、视网膜脱离、青光眼、视神经病变和创伤。
此外或备选地,视觉系统构成部分(例如感觉神经性视网膜)的恶化可以由损伤(例如对视觉系统本身(例如眼睛)的创伤、对头部或脑的创伤或者更一般地对机体的创伤)所导致。已知某些此类的损伤是年龄相关的损伤,即,随着年龄的增长,这些损伤的可能性或频率增加。此类损伤的实例包括视网膜撕裂,黄斑裂孔,视网膜前膜和视网膜脱离,这些损伤可以在任何年龄的动物中发生,但是在老龄化动物(包括其在其它方面健康的老龄化动物)中更可能发生或更频繁地发生。在其他的情况下,视觉系统构成部分的恶化可能由于缺血性和/或再灌注损伤而发生。
视觉系统或其构成部分的恶化还可以由疾病导致。各种影响视觉系统的年龄相关疾病都包括在所述疾病中。与年轻人相比,所述疾病在年老的动物中更可能和/或以更高的频率发生。可以影响视觉系统(包括例如神经感觉性视网膜层)并导致其恶化的疾病的实例为多种形式的视网膜炎,视神经炎,黄斑退化,增殖性或非增殖性糖尿病视网膜病,糖尿病黄斑水肿,进行性视网膜萎缩,进行性视网膜退化,急性获得性视网膜退化,免疫介导性视网膜病变,视网膜发育不良,脉络膜视网膜炎,视网膜缺血,视网膜出血(视网膜前,视网膜内和/或视网膜下),高血压性视网膜病变,视网膜炎症,视网膜水肿,视网膜母细胞瘤或色素性视网膜炎。
上述疾病的一些疾病往往是某些动物特异性的,例如宠物,例如狗和/或猫。所述疾病中的一些疾病是泛泛地列举的,即可能有多种类型的视网膜炎或视网膜出血;因此,所述疾病中的一些疾病并非由一种特异性的病因引起的,而是更加描述性地指明疾病类型或结果。可以导致视觉系统的一个或多个构成部分衰退或恶化的许多疾病可以对动物的视觉系统具有原发性和继发性两种作用、或者更远端的作用。
有利的是,本发明的药物制备物可以用于治疗或减轻多种状况,包括但不限于缺血再灌注损伤,视网膜血管病变,视神经损伤(无论是自身免疫的、创伤的和/或基于病毒的),青光眼(无论类型如何),糖尿病视网膜病(无论是基于缺氧性的还是血管生成性的),遗传性神经节退化和遗传性视神经病(例如leber遗传性视神经病(lhon)或leber视神经萎缩)。
在一个方面中,所述细胞在需要所述治疗的患者中可以治疗或减缓任意一种上述状况的症状。所述细胞对患者而言可以是自体的或异体的。在另一个方面中,本发明的细胞可以与其他的治疗组合给予。
本发明的rg祖细胞在退行性疾病中具有用途。所述细胞以如下方式给予:允许细胞植入或迁移至预期的眼睛位点(例如视网膜的神经节细胞层),并且构建或再生功能性缺陷的区域。
基因改造的rg祖细胞或rg细胞还可以用于使基因产物靶向退行性位点,并且可以例如使用一个或多个基因进行改造,其中所述基因编码分泌型生物活性的蛋白质、肽或核酸(例如rna干扰分子或适体)等。这些基因产物可以包括:促进存活的因子,从而救援天然的退化神经元;可以以自分泌方式起作用的因子,从而促进植入细胞的存活并分化成位点特异性的神经元,或者传递神经递质以允许功能恢复。例如,所述一种或多种生物活性分子可以包括抗血管生成抗体和分子,抗血管生成抗体支架,可溶性受体,靶向并抑制或调控免疫途径分子的试剂,生长因子抑制剂,生长因子,神经营养因子,血管生成因子,神经递质,激素,酶,抗炎因子或其他治疗性蛋白质。在多个实施方案中,此类分子可以包括但不限于c3a抑制剂,c3b抑制剂,靶向并抑制或调控免疫途径分子的其他试剂,脑衍生的神经营养因子(bdnf),nt-4,睫状神经营养因子(cntf),axokine,碱性成纤维细胞生长因子(bfgf),胰岛素样生长因子i(igfi),胰岛素样生长因子ii(igfii),酸性成纤维细胞生长因子(afgf),成纤维细胞生长因子(afgf)表皮生长因子(egf),转化生长因子-α(tgf-α),转化生长因子-β(tgf-β),神经生长因子(ngf),血小板衍生生长因子(pdgf),胶质源性神经营养因子(gdnf),midkine,tryophotin,激活素,促甲状腺素释放激素,白细胞介素,骨形态生成蛋白质,巨噬细胞炎症蛋白,硫酸肝素,双向调节因子,视黄酸,肿瘤坏死因子α,成纤维细胞生长因子受体,表皮生长因子受体(egfr),pedf,ledgf,ntn,神经胚素,神经营养因子,淋巴因子,vegf抑制剂,pdgf抑制剂,胎盘生长因子(pigf)抑制剂,tie2,cd55,c59,同时结合vegf和pdgf的双特异性分子,以及预计对潜在的靶组织具有治疗上有用的效果的其他试剂。在某些优选的实施方案中,重组改造的rg祖细胞或rg细胞经改造而表达一种或多种重组生长因子和神经营养因子,例如fgf2,ngf,睫状神经营养因子(cntf),和脑衍生神经营养因子(bdnf),已经显示这些因子在视网膜退化模型中显著地减慢细胞死亡的过程。使用经改造而合成生长因子或生长因子组合的治疗不仅可以确保神经保护剂的持续传递,而且还可以重建损坏的视网膜。
在某些实施方案中,用于改造rg祖细胞或rg细胞的基因构建体可以包括转录和/或翻译控制元件(例如增强子或启动子),它们对促进神经节细胞死亡和/或青光眼的状况(例如升高的眼内压(iop)、升高的谷氨酸盐水平等)敏感。对升高的iop敏感的示例性启动子为得自基质gla蛋白质(mgp)基因的启动子(例如参见gonzalezetal.,investigativeophthalmology&visualscience,may2004,45(5):1389;该文献以引用方式全文并入本文)。使用几丁质酶-3样1(“ch3l1”)基因的5'启动子区还实现了选择性的靶向,其中表达特异性地导向tm的最外部前区和后区(litonetal.,investophthalmolvissci.2005,46:183;该文献以引用方式全文并入本文)。此外,已经建立了小梁网状结构的大量的基因模式研究,从而为小梁网状结构细胞选择性启动子提供了额外的备选构造(gonzalezetal.,investophthalmolvissci.2000,41:3678-3693;wirtzetal.,investophthalmolvissci.2002,43:3698;tomarevetal.,investophthalmolvissci.2003,44:2588-2596;litonetal.,investophthalmolvissci.2005,46:183;litonetal.,molvis.2006,12:774;fanetal.,investophthalmolvissci.2008,49:1886;fuchshoferetal.,expeyeres.2009,88:1020;paylakhietal.,molvis.2012,18:241;andliuetal.,investophthalmolvissci.2013,54:6382;这些文献的每一份均以引用方式全文并入本文)。
在本发明的方法中,将待移植的细胞在包含等渗赋形剂的任何生理学可接受的赋形剂(在足够无菌的条件下制备用于人类施用)中转移至受体中。就医药配制物的一般原则而言,读者参照celltherapy:stemcelltransplantation,genetherapy,andcellularimmunotherapy,byg.morstyn&w.sheridaneds,cambridgeuniversitypress,1996。根据施用所采用的途径和装置来改变细胞赋形剂和组合物的任何随附要素的选择。通过注射、导管等引入细胞。细胞可以在液氮温度下冷冻,并长期储存,从而能够在解冻时使用。如果冷冻,细胞可以储存在10%dmso,50%fcs,40%rpmi1640培养基中。在一个优选的实施方案中,细胞可以储存在不含动物成分的低温保存缓冲剂(例如cryostorcs10)中。
本发明的药物制备物可任选地包装在合适的容器中,并具有用于所需目的的书面说明。此类配制物可以包含视网膜分化和/或营养因子的混合物,其形式适于与rg祖细胞或rg细胞组合。此类组合物可以进一步包含适于转移至动物中的合适的缓冲剂和/或赋形剂。此类组合物可以进一步包含待植入的细胞。
药物制备物
可以使用药物可接受的载体来配制rg祖细胞或rg细胞。例如rg祖细胞或rg细胞可以单独给予,或者作为药物配制物的成分给予。在医药用途中,可以配制题述化合物用于以医药应用中任何方便的方式施用。适用于给予的药物制备物可以包含rg祖细胞或rg细胞,并组合一种或多种药物可接受的无菌等渗水性或非水性溶液(例如平衡盐溶液(bss))、分散液、悬液、乳液或无菌粉末(其可以在临使用前再构成无菌可注射的溶液或分散液),它们可以包含抗氧化剂、缓冲剂、抑菌剂、溶质或者悬浮或增稠剂。示例性的药物制备物包含rg祖细胞或rg细胞,并结合
在给予时,本发明公开中使用的药物制备物可以为无热原的生理学可接受的形式。
可以在悬液、凝胶、胶体、浆料或混合物中移植包含rg祖细胞或rg细胞的制备物。此外,所述制备物可以理想地以粘性形式囊封或注射于玻璃体液中用于递送至视网膜或脉络膜损害的位点。此外,在注射时,低温保存的rg祖细胞或rg细胞可以再次悬浮于平衡盐溶液中,从而达到用于视网膜下注射施用的所需的渗透压和浓度。所述制备物可以给予至未完全患病的外周黄斑的区域,这可以促进所给予细胞的附着和/或存活。在一些情况下,包括例如青光眼动物模型,通过玻璃体内给予rg祖细胞和/或rg细胞。
如本发明所述,可以冷冻(低温保存)rg祖细胞和/或rg细胞。在解冻时,此类细胞的活力可以为至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%或大约100%(例如解冻后收获的细胞的至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%或大约100%是存活的,或者最初冷冻细胞数量的至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%或大约100%在解冻后以存活状态收获)。
rg祖细胞或rg细胞可以在药物可接受的适用于眼内注射的眼科媒介物或配制物中配制并传递。在一些情况下,设计所述制备物,使得其可以与眼睛表面保持接触足够的时间,从而使细胞渗透至眼睛受影响的区域,例如前房,后房,玻璃体,水状液,玻璃状液,眼角膜,虹膜/睫毛,水晶体,脉络膜,视网膜,巩膜,脉络膜空间,结膜,结膜下空间,巩膜上腔,角膜内空间,角膜周围空间(epicornealspace),平坦部(parsplana),手术导致的缺血区或黄斑。
rg祖细胞或rg细胞可以包含在细胞片中。例如可以通过在基底上培养rg祖细胞或rg细胞来制备包含rg祖细胞或rg细胞的细胞片,由所述基底上可以释放完整的细胞片,所述基材例如为热敏性聚合物,例如热敏性聚(n-异丙基丙烯酰胺)(pnipaam)-接枝的表面,在培养温度下,细胞附着在所述表面上,并增殖,然后在温度改变时,表面特征改变,得以释放培养的细胞片(例如冷却至较低临界溶解温度(lcst)以下,例如参见dasilvaetal.,trendsbiotechnol.2007dec;25(12):577-83;hsiueetal.,transplantation2006feb15;81(3):473-6;ide,t.etal.(2006);biomaterials27,607-614,sumide,t.etal.(2005),fasebj.20,392-394;nishida,k.etal.(2004),transplantation77,379-385;andnishida,k.etal.(2004),n.engl.j.med.351,1187-1196,这些文献的每一份均以引用方式全文并入本文)。细胞片可以附着在适用于移植的基材上,例如在所述细胞片被移植到宿主有机体中时可以在体内溶解的基材,例如通过将细胞在适于移植的基材上培养,或者使细胞由另一个基材(例如热敏性聚合物)上释放至适于移植的基材上而制备的。适于移植的示例性基材可以包括明胶(参加hsiueetal.,如上)。适于移植的备选的基材包括基于血纤维蛋白的基质等。在制造用于预防或治疗视网膜退化疾病的药剂中可以使用细胞片。
可以结合手术或其他侵入性治疗(包括例如小窝下膜切除术,并移植rg祖细胞或rg细胞片)将细胞片引入有需要的眼睛中。因此,细胞片可以结合小窝下膜切除术用于制造用于移植的药剂。
根据本发明所述方法给予的制备物的体积可以取决于多种因素,例如给予的方式,rg祖细胞或rg细胞的数量,患者的年龄和体重,以及待治疗的疾病的类型和严重性。当将配制物局部给予眼睛时,例如通过玻璃体内注射时,配制物应该充分浓缩,这样可以传递最小的体积。例如,如果通过注射给予,则rg祖细胞或rg细胞的药物制备物的体积可以为大约1,1.5,2,2.5,3,4或5ml,或大约1-2ml。例如,如果通过注射给予,则rg祖细胞或rg细胞的药物制备物的体积可以为至少大约1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165,166,167,168,169,170,171,172,173,174,175,176,177,178,179,180,181,182,183,184,185,186,187,188,189,190,191,192,193,194,195,196,197,198,199或200μl(微升)。例如,本发明公开的制备物的体积可以为大约10-50,20-50,25-50,或1-200μl。本发明公开的制备物的体积可以为大约10,20,30,40,50,100,110,120,130,140,150,160,170,180,190,200μl或更高。
根据本发明所述因素,用于注射的浓度可以为有效且无毒的任何水平。用于治疗患者的rg祖细胞或rg细胞的药物制备物可以以至少大约103个细胞/ml的剂量配制,包括至少大约103,104,105,106,107,108,109或1010个rg祖细胞或rg细胞/ml。药物制备物中可以包含至少大约1x103,2x103,3x103,4x103,5x103,6x103,7x103,8x103,9x103,1x104,2x104,3x104,4x104,5x104,6x104,7x104,8x104或9x104个rg祖细胞或rg细胞/μl。所述制备物可以包含2000个rg祖细胞或rg细胞/μl,包括100,000个rg祖细胞或rg细胞/50μl,或者180,000个rg祖细胞或rg细胞/90μl。
rg祖细胞或rg细胞的药物制备物中可以包含至少大约1,000;2,000;3,000;4,000;5,000;6,000;7,000;8,000或9,000个rg祖细胞或rg细胞。rg祖细胞或rg细胞的药物制备物中可以包含至少大约1x104,2x104,3x104,4x104,5x104,6x104,7x104,8x104,9x104,1x105,2x105,3x105,4x105,5x105,6x105,7x105,8x105,9x105,1x106,2x106,3x106,4x106,5x106,6x106,7x106,8x106,9x106,1x107,2x107,3x107,4x107,5x107,6x107,7x107,8x107,9x107,1x108,2x108,3x108,4x108,5x108,6x108,7x108,8x108,9x108,1x109,2x109,3x109,4x109,5x109,6x109,7x109,8x109,9x109,1x1010,2x1010,3x1010,4x1010,5x1010,6x1010,7x1010,8x1010或9x1010个rg祖细胞或rg细胞。rg祖细胞或rg细胞的药物制备物中可以包含至少大约1x102-1x103,1x102-1x104,1x104-1x105,或1x103-1x106个rg祖细胞或rg细胞。rg祖细胞或rg细胞的药物制备物中可以包含至少大约10,000,20,000,25,000,50,000,75,000,100,000,125,000,150,000,175,000,180,000,185,000,190,000,或200,000个rg祖细胞或rg细胞。例如rg祖细胞或rg细胞的药物制备物在体积为至少大约50-200μl中可以包含至少大约20,000-200,000个rg祖细胞或rg细胞。此外,rg祖细胞或rg细胞的药物制备物可以在150μl的体积中包含大约50,000个rg祖细胞或rg细胞,在150μl的体积中包含大约200,000个rg祖细胞或rg细胞,或者在150μl的体积中包含大约180,000个rg祖细胞或rg细胞。
在上文所述药物制备物和组合物中,可以通过计数存活细胞并排除非存活细胞来测定rg祖细胞或rg细胞的数量、或者rg祖细胞或rg细胞的浓度。例如,可以通过失去排除活体染料(例如台盼蓝)的能力或使用功能测试(例如附着在培养基材上的能力等)来检测非存活的rg祖细胞或rg细胞。此外,可以通过计数表达一种或多种rg祖细胞或rg细胞标志物和/或排除表达一种或多种标志物(表明除了rg祖细胞或rg细胞以外的细胞类型)的细胞来测定rg祖细胞或rg细胞的数量、或者rg祖细胞或rg细胞的浓度。
治疗视网膜退化的方法可以进一步包括给予免疫抑制剂。可以使用的免疫抑制剂包括但不限于抗淋巴细胞球蛋白(alg)多克隆抗体,抗胸腺细胞球蛋白(atg)多克隆抗体,咪唑硫嘌呤,
治疗视网膜退化的方法可以包括给予单剂量的rg祖细胞或rg细胞。备选地,本发明所述治疗方法可以包括一段治疗过程,其中经一段时期多次给予rg祖细胞或rg细胞。示例性的治疗过程可以包括每周一次、每2周一次、每个月一次、每个季度一次、每半年一次或每年一次的治疗。备选地,治疗可以进行多个阶段,由此最初给予多个剂量(例如在第一周内每天一剂),随后剂量更少和更低频率。
如果通过注射给予,包括眼内注射,可以在患者的整个生命期间内周期性地一次或多次传递rg祖细胞或rg细胞。例如可以每年一次、每6-12个月一次、每3-6个月一次、每1-3个月一次、或者每1-4周一次地施用rg祖细胞或rg细胞。备选地,对于某些状况或紊乱而言,更频繁地给予是理想的。如果通过移植物或装置给予,可以在患者的整个生命期间内施用一次、或者一次或多次周期性地给予rg祖细胞或rg细胞,这可以根据特定患者和待治疗的紊乱或状况的情况而定。类似地,还涵盖随时间而变化的治疗方案。例如,在开始时可以需要更频繁的治疗(例如每天或每周治疗)。经过一段时间,随着患者状况的改善,可能需要较低频率的治疗或者甚至不需要进一步的治疗。
本发明所述方法可以进一步包括通过测量受试对象的视网膜电图反应、视觉敏度阈值或亮度阈值来监测治疗或预防效力的步骤。所述方法还可以包括通过监测细胞的免疫原性或者眼睛中细胞的迁移、整合或存活来监测治疗或预防的效力。
在制备用于治疗视网膜退化的药剂中可以使用rg祖细胞或rg细胞。本发明公开还涵盖了包含rg祖细胞或rg细胞的制备物在治疗失明中的用途。例如,包含人类rg祖细胞或rg细胞的制备物可以用于治疗与多种视力改变的疾病有关的视网膜退化,其中所述视力改变的疾病导致视网膜损伤和失明,例如缺血再灌注损伤,视网膜血管病变,视神经损伤(无论是自身免疫的、创伤的和/或基于病毒的),青光眼(无论类型如何),糖尿病视网膜病(无论是缺氧性的还是基于血管生成的),和遗传性视神经病(例如leber遗传性视神经病(lhon)或leber视神经萎缩)。在一些实施方案中,包含人类rg祖细胞或rg细胞的制备物可以单独使用,或者与其他疗法(例如其他细胞治疗,例如rpe细胞和/或光感受器细胞群体)一起使用,从而治疗黄斑部退化(包括年龄相关的黄斑退化,例如湿型年龄相关的黄斑退化和干型年龄相关的黄斑退化),色素性视网膜炎,stargardt疾病(眼底黄色斑点症),夜盲症和色盲。所述制备物可以包含至少大约5,000-500,000个rg祖细胞或rg细胞(例如100,000个rg祖细胞或rg细胞)。
可以使用rg祖细胞和/或rg细胞。人类细胞可以用于人类患者中,以及动物模型或动物患者中。例如,可以在视网膜退化的小鼠、大鼠、猫、狗或非人类灵长动物模型中检验人类细胞。此外,人类细胞可以治疗性地用于治疗有此需要的动物,例如兽用医药中。
如本发明所定义,提供单数形式(一种或一个)是为了示意性的目的,其情形也可以适用于多种或多个的情形。
下文列举本发明的多个经编号的实施方案。
1.一种rg祖细胞的基本纯的制备物,其包含:
多个rg祖细胞;以及
适于保持所述rg祖细胞的活力的培养基;
其中在所述制备物中超过90%所述细胞在免疫细胞化学上是math5(+),并且可任选地是math5(+)和brn3a(+)。
2.实施方案1所述rg祖细胞的基本纯的制备物,其中在所述制备物中超过99%的所述细胞在免疫细胞化学上是math5(+),并且任选地是math5(+)和brn3a(+)。
3.实施方案1或2所述rg祖细胞的基本纯的制备物,其中在所述制备物中超过99%的所述细胞在免疫细胞化学上是pax6(-)和rx1(-)。
4.实施方案1、2或3所述rg祖细胞的基本纯的制备物,其中在所述制备物中的细胞在免疫细胞化学上是brn3b(+)和/或isl1(+)。
5.一种rg祖细胞的基本纯的制备物,其包含:
多个rg祖细胞;以及
适于保持所述rg祖细胞的活力的培养基;
其中所述制备物中超过90%的所述细胞在免疫细胞化学上是brn3a(+)和神经丝(+)。
6.实施方案5所述rg祖细胞的基本纯的制备物,其中所述制备物中的细胞是thy1(+)。
7.一种rg祖细胞的制备物,其包含:
多个细胞,其包含至少50%rg祖细胞;以及
适于保持所述rg祖细胞的活力的培养基;
其中所述rg祖细胞在免疫细胞化学上是math5(+),brn3a(+),brn3b(+),并且可任选地是isl1(+)。
8.一种rg祖细胞的制备物,其包含:
多个细胞,其包含至少50%rg祖细胞;以及
适于保持所述rg祖细胞的活力的培养基;
其中所述rg祖细胞在免疫细胞化学上是brn3a(+),神经丝(+),并且可任选地是thy1(+)。
9.一种rg祖细胞的制备物,其包含:
多个rg祖细胞,其基本不含多能干细胞,成熟的光感受器和/或无长突细胞;以及
适于保持所述rg祖细胞的活力的培养基;
其中所述rg祖细胞在免疫细胞化学上是math5(+),brn3a(+),brn3b(+),并且可任选地是isl1(+)。
10.一种rg祖细胞的制备物,其包含:
多个rg祖细胞,其基本不含多能干细胞,成熟的光感受器和/或无长突细胞;以及
适于保持所述rg祖细胞的活力的培养基;
其中所述rg祖细胞在免疫细胞化学上是brn3a(+),神经丝(+),并且可任选地是thy1(+)。
11.一种适用于哺乳动物患者的rg祖细胞的药物制备物,其包含:
(a)多个rg祖细胞,其中所述制备物中超过90%的所述细胞在免疫细胞化学上是math5(+),并且可任选地是math5(+)和brn3a(+);以及
(b)药物可接受的载体,其用于保持rg祖细胞移植到哺乳动物患者中的活力。
12.实施方案11所述药物制备物,其中所述制备物中超过99%的所述细胞在免疫细胞化学上是math5(+),并且可任选地是math5(+)和brn3a(+)。
13.实施方案11或12所述药物制备物,其中所述制备物中超过99%的所述细胞在免疫细胞化学上是pax6(-)和rx1(-)。
14.实施方案11、12或13所述药物制备物,其中所述制备物中的细胞在免疫细胞化学上是brn3b(+)和/或isl1(+)。
15.一种适于哺乳动物患者的rg祖细胞的药物制备物,其包含:
(a)多个rg祖细胞,其中所述制备物中超过90%的所述细胞在免疫细胞化学上是brn3a(+)和神经丝(+);以及
(b)药物可接受的载体,其用于保持所述rg祖细胞移植到哺乳动物患者中的活力。
16.实施方案15所述药物制备物,其中所述制备物中的细胞在免疫细胞化学上是thy1(+)。
17.一种包含至少109个rg祖细胞的低温细胞制备物,其包含:
(a)多个rg祖细胞,其中所述制备物中超过90%的所述细胞在免疫细胞化学上是math5(+),并且可任选地是math5(+)和brn3a(+);以及
(b)低温保存系统,其与解冻时所述rg祖细胞的活力相容。
18.实施方案17所述低温细胞制备物,其中所述制备物中超过99%的所述细胞在免疫细胞化学上是math5(+),并且可任选地是math5(+)和brn3a(+).
19.实施方案17或18所述低温细胞制备物,其中所述制备物中超过99%的所述细胞在免疫细胞化学上是pax6(-)和rx1(-)。
20.实施方案17、18或19所述低温细胞制备物,其中所述制备物中的细胞在免疫细胞化学上是brn3b(+)和/或isl1(+)。
21.一种包含至少109个rg祖细胞的低温细胞制备物,其包含:
(a)多个rg祖细胞,其中所述制备物中超过90%的所述细胞在免疫细胞化学上是brn3a(+)和神经丝(+);以及
(b)低温保存系统,其与解冻时所述rg祖细胞的活力相容。
22.实施方案21所述低温细胞制备物,其中所述制备物中的细胞在免疫细胞化学上是thy1(+)。
23.实施方案1-22的任意一项所述制备物,其中所述rg祖细胞衍生自多能干细胞。
24.实施方案23所述制备物,其中所述多能干细胞选自人类胚胎干细胞和诱导的多能干细胞。
25.上述实施方案的任意一项所述制备物,其中所述rg祖细胞是人类细胞。
26.上述实施方案的任意一项所述制备物,其中所述rg祖细胞是hla-基因型一致的。
27.上述实施方案的任意一项所述制备物,其中所述rg祖细胞是基因组一致的。
28.上述实施方案的任意一项所述制备物,其中所述rg祖细胞的平均末端限制性片段长度(trf)超过8kb。
29.上述实施方案的任意一项所述制备物,其中所述rg祖细胞具有增加的细胞存活和神经保护活性。
30.实施方案11-16的任意一项所述制备物,其适于给予人类患者。
31.实施方案11-16的任意一项所述制备物,其适于给予非人类的兽医患者。
32.实施方案23或24所述制备物,其中所述rg祖细胞衍生自共同的多能干细胞来源。
33.实施方案1-10的任意一项所述制备物,其中适于保持所述rg祖细胞的活力的所述培养基选自培养物培养基、低温保存剂和适于在人类患者中注射的生物相容性注射培养基。
34.上述实施方案的任意一项所述制备物,其中当所述rg祖细胞被移植到视神经挤压模型小鼠的玻璃体空间中时,会迁移至外部有核层,并改善模式erg反应和/或增强小鼠的视神经再生。
35.实施方案11-16的任意一项所述制备物,其中所述制备物不具有热原和霉菌。
36.上述实施方案的任意一项所述制备物,其中所述rg祖细胞分泌一种或多种神经保护因子。
37.一种多能干细胞衍生的rg细胞的基本纯的制备物,其包含:
(a)多能干细胞衍生的rg细胞,其中超过60%的所述细胞在免疫细胞化学上是brn3a(+),神经丝(+)和tuj1(+);以及
(b)适于保持所述干细胞衍生的rg细胞的活力的培养基。
38.实施方案37所述基本纯的制备物,其中所述制备物中的细胞是thy1(+)。
39.实施方案37或38所述基本纯的制备物,其中大约70%的所述细胞在免疫细胞化学上是brn3a(+),神经丝(+)和tuj1(+)。
40.一种适于哺乳动物患者中使用的rg细胞药物制备物,其包含:
(a)多能干细胞衍生的rg细胞,其中所述制备物中超过60%的所述细胞在免疫细胞化学上是brn3a(+),神经丝(+)和tuj1(+);以及
(b)药物可接受的载体,其用于保持所述rg细胞被移植到哺乳动物患者中的活力。
41.实施方案40所述药物制备物,其中所述制备物中的细胞是thy1(+)。
42.实施方案40所述药物制备物,其中大约70%的所述细胞在免疫细胞化学上是brn3a(+),神经丝(+)和tuj1(+)。
43.一种治疗患者中由rg细胞损失而引起的疾病或紊乱的方法,其包括:
向所述患者给予有效量的实施方案11-16中任意一项所述rg祖细胞的药物制备物、或者实施方案40所述rg细胞的药物制备物,或者两者。
44.实施方案43所述方法,其中将所述细胞制备物注射至所述患者的视网膜下空间中。
45.实施方案43所述方法,其中所述细胞制备物通过玻璃体内注射。
46.一种生产rg祖细胞的方法,其包括以下步骤:
优选以细胞簇的形式并且优选在低附着或非附着的条件下,在神经节细胞培养基中,将眼区祖细胞培养足以使所述细胞簇形成单个细胞球的时间,其中所述细胞球包含rg祖细胞,该祖细胞的特征为math5(+)、brn3a(+)、brn3b(+)以及任选地isl1(+),或者brn3a(+)、神经丝(+)以及任选地thy1(+),其中所述眼区祖细胞的特征为pax6(+)和rx1(+)和oct4(-)和nanog(-),并且优选地特征为six3(+),six6(+),lhx2(+),tbx3(+),sox2(+),otx2(+)和nestin(+),如通过免疫染色和/或流式细胞术所测定的。
47.实施方案46所述方法,其中所述眼区祖细胞衍生自多能干细胞。
48.实施方案47所述方法,其中所述多能干细胞为胚胎干细胞或诱导的多能干细胞,任选地为人类胚胎干细胞或人类诱导多能干细胞。
49.实施方案46或47所述方法,其中rg祖细胞以基本不含多能干细胞的形式提供。
50.实施方案46-49中任意一项所述方法,其中所述rg祖细胞相对于其他细胞类型而言是至少50%纯的,至少75%,至少85%,至少95%,至少99%或大约100%纯的。
51.实施方案46-50的任意一项所述方法,其中包括低温保存所述rg祖细胞的另一个步骤。
52.一种用于制备多能干细胞衍生的rg祖细胞的基本纯的培养物的方法,其包括:
(a)在无饲养层的系统中培养多能干细胞,从而产生一个或多个眼区祖细胞;
(b)培养所述一个或多个眼区祖细胞从而产生rg祖细胞,其为math5(+)、brn3a(+)、brn3b(+)以及任选地isl1(+),或者brn3a(+)、神经丝(+)以及任选地thy1(+)。
53.一种生产rg祖细胞的方法,其包括在神经节细胞培养基中培养眼区(ef)祖细胞。
54.实施方案53所述方法,其中所述ef祖细胞为pax6(+)和rx1(+)。
55.实施方案53或54所述方法,其中所述ef祖细胞为six3(+),six6(+),lhx(+),tbs(+)。
56.实施方案53-55的任意一项所述方法,其中所述ef祖细胞为sox2(+)。
57.实施方案53-56的任意一项所述方法,其中所述ef祖细胞以细胞群体的方式提供,其中所述细胞群体中有至少50%,至少60%,至少70%,至少80%,至少90%,至少95%或大约100%ef祖细胞。
58.实施方案53-57的任意一项所述方法,其中所述神经节细胞培养基包括基础培养基,例如neurobasaltmmedium。
59.实施方案53-58的任意一项所述方法,其中所述神经节细胞培养基包括bdnf。
60.实施方案59所述方法,其中bdnf是人类的。
61.实施方案59或60所述方法,其中bdnf以大约1-200ng/ml,5-50ng/ml或大约5-25ng/ml或大约10ng/ml的浓度存在。
62.实施方案53-61的任意一项所述方法,其中所述神经节细胞培养基包含cntf。
63.实施方案62所述方法,其中所述cntf是人类的。
64.实施方案63所述方法,其中所述cntf以大约1-200ng/ml,5-50ng/ml或大约5-25ng/ml或大约10ng/ml的浓度存在。
65.实施方案53-64的任意一项所述方法,其中所述神经节细胞培养基包含毛喉素。
66.实施方案65所述方法,其中所述毛喉素以大约1-20μm或大约1-10μm或大约5μm的浓度存在。
67.实施方案53-66的任意一项所述方法,其中所述神经节细胞培养基包含大约0-10mg/mld-葡萄糖,大约2.5-7.5mg/mld-葡萄糖,大约3-6mg/mld-葡萄糖,大约4-5mg/mld-葡萄糖,或大约4.5mg/mld-葡萄糖。
68.实施方案53-67的任意一项所述方法,其中所述神经节细胞培养基包含一种或多种抗生素。
69.实施方案68所述方法,其中所述一种或多种抗生素选自青霉素和链霉素,任选地浓度为大约0-100单位/ml青霉素和大约0-100μg/ml链霉素。
70.实施方案53-69的任意一项所述方法,其中所述神经节细胞培养基包含n2补充剂。
71.实施方案70所述方法,其中所述n2补充剂以大约0.1至5%、或大约1%的浓度存在。
72.实施方案53-71的任意一项所述方法,其中所述神经节细胞培养基包含b-27补充剂(配方编号080085-sa)。
73.实施方案72所述方法,其中b-27补充剂(配方编号080085-sa)以大约0.05-5.0%或大约1.5-2.5%或大约2.0%的浓度存在。
74.实施方案53-73的任意一项所述方法,其中所述神经节细胞培养基包含谷氨酰胺或glutamaxtm。
75.实施方案53-74的任意一项所述方法,其中所述眼区祖细胞衍生自多能干细胞。
76.实施方案75所述方法,其中所述多能干细胞为人类es细胞或人类ips细胞。
77.实施方案75或76所述方法,其中所述多能干细胞在无饲养层和/或无异物的条件下培养。
78.实施方案53-77的任意一项所述方法,其中所述培养进行大约5-45天。
79.实施方案78所述方法,其中所述培养进行大约5-20天。
80.实施方案78所述方法,其中所述培养进行大约35-45天。
81.实施方案79或80所述方法,其进一步包括低温保存所述细胞。
82.实施方案53-80的任意一项所述方法,其进一步包括通过在视网膜神经节细胞分化培养基中培养所述细胞来生产视网膜神经节(rg)细胞。
83.实施方案82所述方法,其中所述视网膜神经节细胞分化培养基包括neurobasaltmmedium。
84.实施方案82或83所述方法,其中所述视网膜神经节细胞分化培养基包含大约0-10mg/mld-葡萄糖,大约2.5-7.5mg/mld-葡萄糖,大约3-6mg/mld-葡萄糖,大约4-5mg/mld-葡萄糖,或大约4.5mg/mld-葡萄糖。
85.实施方案82-84的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含一种或多种抗生素。
86.实施方案85所述方法,其中所述抗生素选自青霉素和链霉素,任选地浓度为大约0-100单位/ml青霉素和大约0-100μg/ml链霉素。
87.实施方案82-86的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含胰岛素、bdnf和cntf的所有物质中的一种或多种。
88.实施方案87所述方法,其中所述视网膜神经节细胞分化培养基包含胰岛素。
89.实施方案88所述方法,其中所述胰岛素为人类胰岛素。
90.实施方案88或89所述方法,其中所述胰岛素以大约5-50μg/ml或大约20μg/ml的浓度存在。
91.实施方案87-90的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含bdnf。
92.实施方案91所述方法,其中bdnf是人类的。
93.实施方案91或92所述方法,其中bdnf以大约1-200ng/ml,5-50ng/ml或大约5-25ng/ml或大约10ng/ml的浓度存在。
94.实施方案87-93的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含cntf。
95.实施方案94所述方法,其中cntf是人类的。
96.实施方案93或94所述方法,其中cntf以大约1-200ng/ml,5-50ng/ml或大约5-25ng/ml或大约10ng/ml的浓度存在。
97.实施方案82-96的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含毛喉素、camp和dapt中的一种、多种或全部。
98.实施方案97所述方法,其中所述视网膜神经节细胞分化培养基包含毛喉素。
99.实施方案98所述方法,其中所述毛喉素以大约1-20μm或大约1-10μm或大约5μm的浓度存在。
100.实施方案97所述方法,其中所述视网膜神经节细胞分化培养基包含camp。
101.实施方案100所述方法,其中camp以大约5-200ng/ml的浓度存在。
102.实施方案97所述方法,其中所述视网膜神经节细胞分化培养基包含dapt。
103.实施方案102所述方法,其中dapt以大约1-50μm的浓度存在。
104.实施方案82-103的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含b-27补充剂(配方编号080085-sa)。
105.实施方案104所述方法,其中b-27补充剂(配方编号080085-sa)以大约0.05-5.0%,大约0.05-2.5%或大约2%的浓度存在。
106.实施方案82-105的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含谷氨酰胺或glutamaxtm。
107.实施方案82-106的任意一项所述方法,其中所述视网膜神经节细胞分化培养基包含视黄酸。
108.实施方案107所述方法,其中视黄酸以大约1-50mm,大约5-40mm,大约10-30mm或大约20mm的浓度存在。
109.实施方案82-106的任意一项所述方法,其中将所述细胞在所述视网膜神经节细胞分化培养基中培养大约7-60天或大约14-35天或大约24天。
110.实施方案53-80的任意一项所述方法,其中所述视网膜神经节祖细胞在所述培养物中占所述细胞的至少50%,至少75%,至少85%,至少95%,至少99%或大约100%。
111.实施方案110所述方法,其中所述视网膜神经节祖细胞表达标志物math5,brn3a,brn3b和isl1中的一种、多种或所有。
112.实施方案111所述方法,其中至少90%,94%,96%,98%或99%的所述视网膜神经节祖细胞表达math5,并且任选地表达brn3a。
113.实施方案111或112所述方法,其中所述视网膜神经节祖细胞是pax6(-)和rx1(-)。
114.实施方案113所述方法,其中至少90%,92%或94%所述视网膜神经节祖细胞是pax6(-)和rx1(-)。
115.实施方案52-80的任意一项所述方法,其中所述视网膜神经节祖细胞表达brn3a、神经丝和thy1中的一种、多种或全部。
116.实施方案115所述方法,其中至少90%,92%或94%所述视网膜神经节祖细胞表达brn3a和神经丝。
117.实施方案115或116所述方法,其中所述视网膜神经节祖细胞是math5(-)和/或brn3b(-)。
118.实施方案52-80的任意一项所述方法,其进一步包括使所述视网膜神经节祖细胞分化成视网膜神经节细胞。
119.一种组合物,其包含根据实施方案52-118的任意一项所述方法生产的视网膜神经节祖细胞或视网膜神经节细胞。
120.一种包含视网膜神经节祖细胞或视网膜神经节细胞的组合物。
121.实施方案119或120所述组合物,其中所述视网膜神经节祖细胞占所述组合物中细胞的至少50%,至少70%,至少75%,至少85%,至少95%,至少99%或大约100%。
122.实施方案119或120所述组合物,其中所述视网膜神经节细胞占所述组合物中细胞的至少50%,至少60%或至少70%。
123.实施方案119-122的任意一项所述组合物,其中所述视网膜神经节祖细胞表达标志物math5,brn3a,brn3b和isl1中的一种、多种或所有。
124.实施方案123所述组合物,其中至少90%,94%,96%,98%或99%的所述视网膜神经节祖细胞表达math5,以及任选地brn3a。
125.实施方案123或124所述组合物,其中所述视网膜神经节祖细胞是pax6(-)和rx1(-)。
126.实施方案125所述组合物,其中至少90%,92%或94%以所述视网膜神经节祖细胞是pax6(-)和rx1(-)。
127.实施方案119-122的任意一项所述组合物,其中所述视网膜神经节祖细胞表达brn3a、神经丝和thy1中的一种、多种或全部。
128.实施方案127所述组合物,其中至少90%,92%或95%的所述视网膜神经节祖细胞表达brn3a和神经丝。
129.实施方案127或128所述组合物,其中所述视网膜神经节祖细胞是math5(-)和brn3b(-)。
130.实施方案119-122的任意一项所述组合物,其中所述视网膜神经节细胞表达brn3a、神经丝和tuj1中的一种、多种或全部。
131.实施方案119-129中任意一项所述组合物,其中所述视网膜神经节祖细胞被低温保存。
132.实施方案131所述组合物,其中大约80-90%的所述视网膜神经节祖细胞在解冻后得到恢复。
133.一种治疗有此需要的个体的方法,其包括向所述个体施用实施方案119-120的任意一项所述组合物、或者实施方案131或132所述解冻后的组合物。
134.实施方案133所述方法,其中所述组合物被施用于眼睛、视网膜下空间或玻璃体内。
135.实施方案52-80和82-117的任意一项所述方法,其中在所述神经节细胞培养基中培养眼区祖细胞的步骤包括:(i)使眼区祖细胞碎片化,从而获得细胞簇;以及(ii)在低附着的条件下铺板所述细胞簇,从而形成球。
136.实施方案135所述方法,其中步骤(i)包括在低附着的平板上培养所述细胞。
137.实施方案135或136所述方法,其中所述碎片化是通过机械方式或酶促破裂方式实施的。
138.实施方案135-137的任意一项所述方法,其中在所述视网膜神经节细胞分化培养基中培养细胞的步骤包括使所述细胞解离成单个细胞,并将所述球铺板到matrigeltm,层粘连蛋白或胶原蛋白上。
139.实施方案138所述方法,其包括将所述解离的细胞铺板在层粘连蛋白上。
140.实施方案138所述方法,其进一步包括将所述解离的细胞铺板在聚-d-赖氨酸/层粘连蛋白涂敷的平板上。
141.实施方案139或140所述方法,其中以10-40个细胞/cm2的密度铺板所述解离的细胞。
下文为说明本发明的实例,其不应该被视为限定本发明的范围。
实施例
实施例1.由多能干细胞进行rg祖细胞和rg细胞的生产
1.在matrigeltm(bdbiosciences)上在mtesr1培养基(stemcelltechnology)中在不含饲养层的条件下培养人类胚胎干细胞。在80-90%汇合后,细胞需要传代或冷冻。使用酶(例如分散酶)或非酶(例如基于pbs的细胞解离缓冲剂,invitrogen)技术进行干细胞的传代。
2.直接分化方法用于生成视网膜神经元/祖细胞。其中不具有胚胎体的步骤。
3.在第0天:在15-20%汇合下诱导细胞分化。将培养基更换成视网膜诱导(ri)培养基:dmem/f12,其中补充有4.5mg/mld-葡萄糖,100单位/ml青霉素,100μg/ml链霉素,1%n2补充剂(invitrogen)(0.1-2%),0.2%b27补充剂(0.05-2%),1xmem非必需氨基酸溶液,50ng/mlnoggin(10-500ng/ml),和20μg/ml人类胰岛素(5-50μg/ml)。
4.第1天-第4天:每天更换完全培养基。
5.第5天:在第5天,细胞培养物达到80-90%汇合。培养基更换成神经分化(nd)培养基:neurobasaltmmedium(lifetechnologies),其中补充有4.5mg/mld-葡萄糖,100单位/ml青霉素,100μg/ml链霉素,1xglutamaxtm,1%n2补充剂(invitrogen)(0.1-2%),2%b27补充剂(0.5-2%),1xmem非必需氨基酸溶液,和50ng/mlnoggin(10-500μg/ml)。
6.第6天-第13天:将细胞保持在nd培养基中。每2天更换培养基。在nd培养基中细胞集落持续生长。边缘细胞变得扁平且大,而中心细胞更小并形成紧实的细胞簇。在第10天-第11天,细胞开始表达pax6,然后在第12天,开始rx1表达(图1a)。rt-pcr显示丧失oct4和nanog表达(图1b)。在第13天,如流式细胞术定量,超过90%的细胞共表达pax6和rx1(图2a)。超过99%的细胞表达otx2,nestin和sox2(图2b)。这些结果表明它们已成为眼区祖细胞。
7.第14天-第19天:在第15天,将培养基更换成神经节细胞(gc)培养基:神经基础培养基,其中补充有4.5mg/mld-葡萄糖,100单位/ml青霉素,100μg/ml链霉素,1xglutamaxtm,1%n2补充剂(0.1-2%),2%b27补充剂(配方编号080085-sa)(0.5-2%),5μm毛喉素(1-20μm),10ng/mlbdnf(1-200ng/ml),和10ng/mlcntf(1-200ng/ml)。
8.第20天-第35天:在第20天时,将细胞由生长表面刮起,并在gc培养基中以机械方式碎裂成簇。将细胞簇转移至100mm超低附着培养皿中。细胞簇聚拢,并在这种悬浮培养物中形成单个的球。培养基每3天更换一次。在第35天,实时rt-pcr显示math5,brn3a,brn3b和isl1的表达强烈地上调节(图3a)。流式细胞术显示,>99%的细胞表达转录因子math5和brn3a。大约94%的math5(+)阳性细胞针对pax6的染色为阴性(图3b)。
9.第36天-第60天:将神经球培养物保持在gc培养基中,并且每3-4天更换一次培养基。在第60天时,实时rt-pcr显示brn3a持续表达。math5和brn3b的表达水平受到极大的下调节(图4)。流式细胞术显示95.3%的细胞共表达brn3a和神经丝。
10.rg祖细胞分化成rg细胞:
a.使用
b.在2周后,大约72%细胞针对thy1的染色为阳性(图5)。细胞具有树突和轴突(图6a)。免疫染色显示表达brn3a,神经丝和tuj1(图6b)。
实施例2.试验性青光眼模型中的rg祖细胞(使用激光光凝术)
如图7所概括,使用试验性青光眼动物模型来研究rg祖细胞在体内的作用。在该模型系统中,在3个月龄的雄性brownnorway大鼠中通过小梁激光光凝术来诱导慢性眼内压(iop)升高。将悬浮于5μlpbs中的2×105个rg(早期)祖细胞在第二天注射至玻璃体腔中。将pbs注射至对照眼球中。所有大鼠每周2次接受tonolab的暗相和明相iop测量(由治疗前的2周至治疗后的5周)。由治疗前1周至治疗后5周,给予处于水中的环孢菌素a。在治疗后5周时,使用rbpms免疫组织化学对视网膜神经节(rg)细胞进行拓扑形态定量(topographicalquantification)。在对照眼睛中,rg细胞的平均细胞损失为27.3%,而在细胞处理组中,rg细胞死亡显著减少,平均为13.5%(图8)。该结果表明在青光眼大鼠模型中,rg祖细胞处理挽救了rg细胞死亡。
实施例3:人类rg祖细胞和rg细胞的低温保存
早期rg祖细胞(实施例1中的步骤8)和晚期rg祖细胞(实施例2中的步骤9)可以在不含动物成分的低温保存缓冲剂(例如cryostorcs10)或者另一种低温保存缓冲剂(例如90%fbs和10%dmso)中以神经球形式冷冻。rg细胞也可以在这些缓冲剂中低温保存。
实施例4:在试验性青光眼模型中由hesc和/或ipsc衍生的rgcp的移植(微珠(mb)注射)
由hesc和ipsc生成rgcp
如之前所报告来保持hesc细胞系gfp-h1(nih登记为wa01,表达gfp用于体内简单识别)和ipsc细胞系ha1(通过mrna生成,不具有基因组整合31)31。在如本发明所述常规且连续实施的工艺中,这些细胞首先分化成efp,然后通过将efp再次铺于matrigel上并在本发明所述条件下培养而产生不同发育阶段的rgcp。在分化工艺过程中,监测efp基因(pax6,rx1,nestin和sox2)的表达。在体内移植前,收集晚期rgcp(神经丝+brn3a+math5-),并使用accutase使其解离成单细胞悬液。
rgcp移植到青光眼小鼠中
如之前所述,使成年c57bl/6j小鼠接受pbs(作为对照)或微珠的前房注射,从而引起眼高压症(青光眼)29。将具有正常iop的注射pbs的对照加入至受体小鼠的组中,以了解植入的rgcp的存活是否受到青光眼疾病过程的影响。
在pbs或微珠注射后7天,将gfp-hesc-或ha1-ipsc-衍生的rgcp(100,000个细胞/μl)、或者媒介物对照溶液玻璃体内注射至正常iop(注射pbs的)和青光眼(注射微珠的)小鼠中。选择移植的这种时间点以便更好地与显示疾病症状的患者的临床表现一致。按照其他的报告9,在初步研究中,在小鼠的眼睛(其被认为是免疫特免位点)中,在缺乏免疫抑制剂的情况下,观察到植入细胞存活达到移植后8周(图13、14和16)。
在4周和8周的时间点时,测量pstr(其监测视网膜内rgc的电活性),并且首次测量取自在微珠注射前的1-2天,从而得到基线值。在4周和8周时,使用pstr测试来分析对照和青光眼小鼠。
另一种用于评估移植rgcp的治疗效力的测试是视动反射(okr)。okr通过眼睛和头的移动跟踪漂动的条纹图案来测量视敏度和对比敏感度。在okr测试中,在视敏度未受损的情况下,青光眼小鼠展现出急剧降低的视觉对比敏感度。这些观察符合人类患者中所见37,38。在微珠注射之前的1-2天,记录基线okr,并且在pbs或微珠注射后的8周评估okr,以便继续评价视觉功能和视网膜形态改变。
为了检验是否需要免疫抑制来维持植入细胞的存活,对经过免疫抑制剂环孢菌素-a处理的小鼠进行研究。在移植前的1天开始,这组小鼠每天接受环孢菌素-a(处于饮用水中)的处理,直至处死。
另一种用于评估移植的rgcp的治疗效力的检验是视觉诱发电位(vep)。vep测量皮质响应于视觉刺激而生成的总电信号。在vep中,青光眼小鼠展现出延长的n1潜伏和消失的p1-n1振幅。这些观察符合在人类患者中所见37,38。在微珠注射前1-2天记录基线vep。
在所有的试验组中,在pbs或微珠注射后4、8和12周评价vep和sd-oct,以便继续评价视觉功能和视网膜形态改变。通过在pbs或微珠注射后12周来分析pstr和okr。在pbs或微珠注射后12周处死小鼠,然后进行最后的vep,okr,pstr和sd-oct评估。按照之前所述来制备视网膜和视神经切片29。使用针对rgc特异性标志物(例如tuj1或brn3b)的抗体来免疫标记视网膜切片,并通过核标志物dapi进行复染,从而显示宿主rgc的形态学和视网膜层状结构。在活的动物中通过sd-oct监测肿瘤形成,并在视网膜切片中检查。如之前所述29,在视神经切片中进行轴突计数,从而测量在rgcp移植后的轴突退化/保护。
在具有iop升高和不具有iop升高(注射pbs与注射微珠)的小鼠中评价在这些后期时间点时植入细胞的存活,并且还对接受免疫抑制的小鼠组与未接受免疫抑制的小鼠组之间进行比较。
此外,使用临床应用的非侵入性成像技术(光谱域光学相干层析成像(sd-oct))来监测视网膜形态学,其包括测量潜在肿瘤形成,以及神经节细胞层(gcl)与神经纤维层(nfl)厚度。其他文献已经报告了sd-oct在活的青光眼小鼠中定量神经节细胞复合(gcc)层(其包括gcl和nfl)变薄的成功应用30;该发现符合在青光眼患者中所见。
统计分析
数据表示为平均值±标准偏差,并使用用于windows(graphpadsoftwareinc)的graphpadprism5.01进行分析。配对anova和mann-whiney用于统计分析。在p<0.05时,差异被认为有显著性。
结果
如之前的实施例所证明的,已经根据本发明公开研发出了新的过程,其允许人类psb强力分化而生成rgcp的高度均质(>95%)的群体。此外,当此类rgcp被移植到青光眼小鼠中时,观察到显著改善的rgc存活(图13a)和功能(图14a-d),如通过免疫组织化学,pstr和okr所测量的。这些数据表明移植的rgcp能够保护青光眼的视力。
实施例5:rgcp移植后rgc样细胞的表征
实施例5研究以下方面:(1)在移植到青光眼小鼠视网膜中后分化成rgc样细胞的rgcp的百分率;(2)使用免疫组织化学和rna测序(rna-seq)测量人类esc和ipsc衍生的rgc样细胞的形态和分子性质;以及(3)分析这些细胞的基因图谱。
rgcp移植到青光眼小鼠中并定量分化成rgc样细胞的rgcp的百分率
如实施例1和4中所述,由gfp+hesc或ipsc生成rgcp。成年c57bl/6j小鼠接受微珠的前房注射,从而在这种青光眼模型中诱导高眼压症29。在微珠注射后7天,将gfp-hesc-或ha1-ipsc-衍生的rgcp(100,000个细胞/μl)玻璃体内注射至青光眼小鼠(具有或不具有环孢菌素-a的每天处理)中。尽管最初的分析并未检测到在缺乏环孢菌素-a下rgcp存活和分化有任何异常,但是细胞表型和转录物组的比较提供了关于免疫抑制剂对植入的rgcp的作用的进一步信息。为了定量评估rgcp的分化,在移植后的3周收集视网膜铺片,并针对rgc特异性标志物(例如brn3b和tuj1)进行免疫标记。通过gfp表达或人类特异性线粒体抗体来识别植入的rgcp。分别计数植入的细胞(gfp+)和rgc样细胞(gfp+/brn3b+),并计算形成rgc样细胞(gfp+/brn3b+)的植入rgcp的百分率。还如之前所述对其他的视网膜细胞标志物(例如无长突细胞、双极细胞、光感受器和müller细胞)进行免疫检测28,39,以测定植入的rgcp是否发育成其他的视网膜细胞类型。还对突触前和突触后的标志物(例如突触结合蛋白,psd-95,glur2/3)进行免疫标记,并且突触前(例如突触结合蛋白)和突触后(例如psc95)的标志物的共定位表明功能性突触形成40,41。
验证rgc分化的全基因组标志
基于使用facs测量的gfp表达,在移植后3周(允许细胞分化)由小鼠视网膜分离植入的rgcp。由分离的gfp+rgcp、以及由培养的efp(通过pax6+,rx1+,nestin+和sox2+的表达证明)和rgcp(神经丝+/brn3a+/math5-)提取总rna。约40,000个植入的细胞(其可以容易地由4个注射的视网膜分离得到)足以提供所需量的rna用于所述分析。简言之,使用illuminatruseq试剂盒v2生成用于rna-seq的文库,并使用illuminahiseq测序。将所述序列与人类转录物组比对,从而产生比对的bam图谱,并使用cufflinks算法来定量已知的基因和转录子。使用基因注释来测定基因和已知转录子的差异性表达。实施gsea算法的genesetenrichment分析和ingenuitypathway分析。通过qpcr证明所关注的候选转录物。比较由植入的rgcp以及efp和rgcp(直接取自esc-和ipsc-衍生的培养物)得到的数据。当细胞有efp分化成rgcp时监测相应于rgc细胞谱系身份的基因(例如pou,islet1,islet2,thy1.1)42的表达,并且在通过移植的rgcp的分化而在体内生产的rgc样细胞中也监测这些基因表达。此外,在rgcp和rgc样细胞中也监测其他视网膜细胞基因(例如光感受器特异性标志物)的表达。
统计分析
数据表示为平均值±标准偏差,并使用用于windows(graphpadsoftwareinc)的graphpadprism5.01进行分析。配对anova和mann-whiney用于统计分析。在p<0.05时,差异被视为有显著性。
实施例6:rgcp的移植
实施例6研究rgcp的移植是否能够通过移植细胞分化成成熟rgc以及长的轴突延长至连接脑的视神经中而逆转视力丧失或恢复功能。
rgcp移植到视神经挤压损伤模型小鼠中
如实施例1和4所述由gfp+hesc或ipsc生成rgcp。在移植后由于gfp的表达而使得跟踪hesc-rgcp的命运更容易,所以使用gfp+hesc-rgcp。成年c57bl/6j小鼠接受视神经挤压损伤,如之前所述,该损伤导致所有视神经轴突完全损坏22。在损伤后7天时,在这些小鼠中玻璃体内注射gfp+hesc-rgcp(100000个细胞/μl)或媒介物对照溶液。在损伤后8周时处死小鼠。
制备视网膜铺片和纵向视神经切片用于按照如下方式定量rgc的存活、分化和神经生长:(1)为了分析rgc的存活和分化,使用tuj1免疫标记视网膜铺片(flatmount),从而识别内源(宿主)和新的(gfp+)rgc。记录存活的宿主rgc(仅tuj1+)的数量和新生成的rgc(gfp+/tuj1+)的数量;计算表达rgc标志物tuj1的移植(gfp+)细胞的百分率(gfp+/tuj1+细胞除以计数的总gfp+细胞)。还对其他的视网膜细胞标志物进行免疫检测,从而测定植入的rgcp是否发育成其他的细胞类型;以及(2)为了评价轴突的生成和再生长,使用针对神经系蛋白质的一级抗体染色纵向视神经切片,以揭示内源轴突,而通过gfp标记来识别新的轴突。
预计到损伤后4周时,在挤压位点以外,所有的宿主轴突都被破坏并退化,并且会发现仅在挤压位点之后具有再生的轴突。为此,在纵向神经切片中对新gfp+轴突的数量和新gfp+轴突移动的距离进行定量。为了测定新的轴突是否达到脑中的中心靶位,收集小鼠的脑切片;记录在视神经的视束和中心靶位(包括背外侧膝状体核和上丘)发现的gfp+轴突的数量。此外,在脑切片中对突触标志物(例如突触素和psd95)进行免疫标记,以测定gfp+轴突是否发育成突触并表达突触前标志物。
在损伤后的4、8和12周处死其他的小鼠。通过在损伤前和处死前的1-2天记录vep,pstr和okr来评估rgcp移植的潜在功能益处。还实施sd-oct以监测活的小鼠中的视网膜形态学。
统计分析
数据表示为平均值±标准偏差,并使用用于windows(graphpadsoftwareinc)的graphpadprism5.01进行分析。配对anova和mann-whiney用于统计分析。在p<0.05时,差异被视为有显著性。
结果
在视神经损伤后3周时,gfp+细胞使宿主视网膜群体恢复并延长长的神经突。几乎所有的移植细胞(>95%)均分化成tuj1+rgc(图16a-c)。使用共聚焦和光片显微镜,观察到植入的rgcp整合至神经节细胞层中(图16d-e),并发育成功能性突触,这可以通过突触前和突触后标志物的共定位来证明(图16f-j)。这些数据支持hesc-衍生的rgcp可以分化成rgc样细胞,整合至宿主视网膜中,发育成功能性突触,并在移植到视神经损伤的小鼠中后替代丧失的细胞。
结论
为了克服在提供人类视网膜神经节细胞祖细胞(rgcp)的纯的可再生群体用于研究和治疗中的限制,研发了所定义的方法用于使人类多能干细胞(psc)强力地分化成视网膜神经元。已经使用多种hesc和ipsc细胞系(得自囊胚的5个hesc细胞系;通过附加型载体或mrna重编程而获得的6个ipsc细胞系)来实施所述方法,从而生成高度均质(>95%)的rgcp群体。该方法能够在所有这些细胞系中使视网膜分化过程同步发生,从而一致地引起psc逐步分化成眼区祖细胞(efp,图2)16-18、早期rgcp(math5+,图3b和4)19-21和晚期rgcp(math5-/thy1.1+,图3b、4和5),最后导致在体外和体内生成成熟rgc(图13a,14a-b和16a-j)。
在检验这些细胞的治疗潜力的初步研究中,将gfp+hesc-rgcp注射至患有诱导型青光眼的小鼠的玻璃体中。在接受rgcp移植的青光眼小鼠中,观察到明显改善的rgc存活(图13a,下方图),并伴有正暗视阈值反应(pstr)的振幅增加(其为rgc功能的量度)(图14a-c)。
为了进一步确立rgcp在严重的视神经病变中的治疗潜力,分析此类细胞在视神经挤压损伤模型中替换丧失的rgc并形成新的轴突的能力。结果表明,所有移植的细胞均分化成tuj1+rgc,并显示在细胞注射后3周时有新的神经突的大量迁移、整合和形成(图16a-j)。
这些结果一起表明人类psc-rgcp可以用于青光眼的治疗,并且还可以用于治疗视神经病变的其他形式。
表1.
b27培养基补充剂的组成
生物素
l-肉碱
皮质酮
乙醇胺
d(+)-半乳糖
谷胱甘肽(还原形式)
亚油酸
亚麻酸
孕酮
腐胺
视黄醇乙酸酯
硒
t3(三碘-1-甲状腺素原氨酸)
dl-α-生育酚(维生素e)
dl-α-生育酚乙酸酯
蛋白质:
白蛋白,牛
过氧化氢酶
胰岛素
超氧化物歧化酶
铁传递蛋白
dmem/f12培养基的组成
neurobasaltmmedium(lifetechnologies)的组成
n2补充剂的组成
参考文献
[1]quigleyha,bromanat:thenumberofpeoplewithglaucomaworldwidein2010and2020.thebritishjournalofophthalmology2006,90:262-7.
[2]quigleyha:glaucoma.lancet2011,377:1367-77.
[3]lundrd,wangs,klimanskayai,holmest,ramos-kelseyr,lub,girmans,bischoffn,sauvey,lanzar:humanembryonicstemcell-derivedcellsrescuevisualfunctionindystrophicrcsrats.cloningandstemcells2006,8:189-99.
[4]lub,malcuitc,wangs,girmans,francisp,lemieuxl,lanzar,lundr:long-termsafetyandfunctionofrpefromhumanembryonicstemcellsinpreclinicalmodelsofmaculardegeneration.stemcells2009,27:2126-35.
[5]schwartzsd,regillocd,lambl,eliottd,rosenfeldpj,gregorinz,hubschmanjp,davisjl,heilwellg,spirnm,maguirej,gayr,batemanj,ostrickrm,morrisd,vincentm,angladee,delpriorelv,lanzar:humanembryonicstemcell-derivedretinalpigmentepitheliuminpatientswithage-relatedmaculardegenerationandstargardt'smaculardystrophy:follow-upoftwoopen-labelphase1/2studies.lancet2015,385:509-16.
[6]parameswarans,balasubramanians,babain,qiuf,eudyjd,thoresonwb,ahmadi:inducedpluripotentstemcellsgeneratebothretinalganglioncellsandphotoreceptors:therapeuticimplicationsindegenerativechangesinglaucomaandage-relatedmaculardegeneration.stemcells2010,28:695-703.
[7]chenm,chenq,sunx,shenw,liub,zhongx,lengy,lic,zhangw,chaif,huangb,gaoq,xiangap,zhuoy,gej:generationofretinalganglion-likecellsfromreprogrammedmousefibroblasts:iovs2010;51(11):5970-5978.annalsofneurosciences2011,18:64-5.
[8]satarianl,javanm,kianis,hajikaramm,mirnajafi-zadehj,baharvandh:engraftedhumaninducedpluripotentstemcell-derivedanteriorspecifiedneuralprogenitorsprotecttheratcrushedopticnerve.plosone2013,8:e71855.
[9]hambrightd,parkky,brooksm,mckayr,swaroopa,nasonkinio:long-termsurvivalanddifferentiationofretinalneuronsderivedfromhumanembryonicstemcelllinesinun-immunosuppressedmouseretina.molecularvision2012,18:920-36.
[10]jagathab,divyams,sanalkumarr,indulekhacl,vidyanands,divyats,dasav,jamesj:invitrodifferentiationofretinalganglion-likecellsfromembryonicstemcellderivedneuralprogenitors.biochemicalandbiophysicalresearchcommunications2009,380:230-5.
[11]johnsontv,bullnd,huntdp,marinan,tomarevsi,martinkr:neuroprotectiveeffectsofintravitrealmesenchymalstemcelltransplantationinexperimentalglaucoma.investigativeophthalmology&visualscience2010,51:2051-9.
[12]huy,tanhb,wangxm,rongh,cuihp,cuih:bonemarrowmesenchymalstemcellsprotectagainstretinalganglioncelllossinagedratswithglaucoma.clinicalinterventionsinaging2013,8:1467-70.
[13]kassisi,vaknin-dembinskya,karussisd:bonemarrowmesenchymalstemcells:agentsofimmunomodulationandneuroprotection.currentstemcellresearch&therapy2011,6:63-8.
[14]dreixlerjc,postonjn,balyasnikovai,shaikhar,tupperky,conways,boddapativ,marcetmm,lesniakms,roths:delayedadministrationofbonemarrowmesenchymalstemcellconditionedmediumsignificantlyimprovesoutcomeafterretinalischemiainrats.investigativeophthalmology&visualscience2014,55:3785-96.
[15]bullnd,irvineka,franklinrj,martinkr:transplantedoligodendrocyteprecursorcellsreduceneurodegenerationinamodelofglaucoma.investigativeophthalmology&visualscience2009,50:4244-53.
[16]wawersiks,maasrl:vertebrateeyedevelopmentasmodeledindrosophila.humanmoleculargenetics2000,9:917-25.
[17]zaghloulna,yanb,moodysa:step-wisespecificationofretinalstemcellsduringnormalembryogenesis.biologyofthecell/undertheauspicesoftheeuropeancellbiologyorganization2005,97:321-37.
[18]zuberme,gestrig,viczianas,barsacchig,harriswa:specificationofthevertebrateeyebyanetworkofeyefieldtranscriptionfactors.development2003,130:5155-67.
[19]brownnl,kanekars,vetterml,tuckerpk,gemzadl,glasert:math5encodesamurinebasichelix-loop-helixtranscriptionfactorexpressedduringearlystagesofretinalneurogenesis.development1998,125:4821-33.
[20]brownnl,patels,brzezinskij,glasert:math5isrequiredforretinalganglioncellandopticnerveformation.development2001,128:2497-508.
[21]wangsw,kimbs,dingk,wangh,sund,johnsonrl,kleinwh,ganl:requirementformath5inthedevelopmentofretinalganglioncells.genes&development2001,15:24-9.
[22]koprivicav,choks,parkjb,yiug,atwalj,goreb,kimja,line,tessier-lavignem,chendf,hez:egfractivationmediatesinhibitionofaxonregenerationbymyelinandchondroitinsulfateproteoglycans.science2005,310:106-10.
[23]huy,parkkk,yangl,weix,yangq,choks,thielenp,leeah,cartonir,glimcherlh,chendf,hez:differentialeffectsofunfoldedproteinresponsepathwaysonaxoninjury-induceddeathofretinalganglioncells.neuron2012,73:445-52.
[24]zhangxm,liliudt,chiangsw,choykw,pangcp,lamds,yamgh:immunopanningpurificationandlong-termcultureofhumanretinalganglioncells.molvis2010,16:2867-72.
[25]morishitas,okuh,horiet,tonarim,kidat,okuboa,sugiyamat,takais,harah,ikedat:systemicsimvastatinrescuesretinalganglioncellsfromopticnerveinjurypossiblythroughsuppressionofastroglialnf-kappabactivation.plosone2014,9:e84387.
[26]choks,yangl,lub,fengmah,huangx,peknym,chendf:re-establishingtheregenerativepotentialofcentralnervoussystemaxonsinpostnatalmice.journalofcellscience2005,118:863-72.
[27]huangx,wudy,cheng,manjih,chendf:supportofretinalganglioncellsurvivalandaxonregenerationbylithiumthroughabcl-2-dependentmechanism.investigativeophthalmology&visualscience2003,44:347-54.
[28]kinouchir,takedam,yangl,wilhelmssonu,lundkvista,peknym,chendf:robustneuralintegrationfromretinaltransplantsinmicedeficientingfapandvimentin.natureneuroscience2003,6:863-8.
[29]chenh,weix,choks,cheng,sappingtonr,calkinsdj,chendf:opticneuropathyduetomicrobead-inducedelevatedintraocularpressureinthemouse.investophthalmolvissci2011,52:36-44.
[30]yangq,choks,chenh,yud,wangwh,luog,pangih,guow,chendf:microbead-inducedocularhypertensivemousemodelforscreeningandtestingofaqueousproductionsuppressantsforglaucoma.investigativeophthalmology&visualscience2012,53:3733-41.
[31]fengq,shabranin,thonjn,huoh,thiela,machluskr,kimk,brooksj,lif,luoc,kimbrelea,wangj,kimks,italianoj,choj,lusj,lanzar:scalablegenerationofuniversalplateletsfromhumaninducedpluripotentstemcells.stemcellreports2014,3:817-31.
[32]chungy,klimanskayai,beckers,lit,maseratim,lusj,zdravkovict,ilicd,genbacevo,fishers,krtolicaa,lanzar:humanembryonicstemcelllinesgeneratedwithoutembryodestruction.cellstemcell2008,2:113-7.
[33]lusj,fengq,parkjs,vidal,leebs,strausbauchm,wettsteinpj,honiggr,lanzar:biologicpropertiesandenucleationofredbloodcellsfromhumanembryonicstemcells.blood2008,112:4475-84.
[34]lusj,lif,yinh,fengq,kimbrelea,hahme,thonjn,wangw,italianoje,choj,lanzar:plateletsgeneratedfromhumanembryonicstemcellsarefunctionalinvitroandinthemicrocirculationoflivingmice.cellresearch2011,21:530-45.
[35]burroughssl,kajas,koulenp:quantificationofdeficitsinspatialvisualfunctionofmousemodelsforglaucoma.investigativeophthalmology&visualscience2011,52:3654-9.
[36]domenicil,origlian,falsinib,cerrie,barlosciod,fabianic,sansom,giovanninil:rescueofretinalfunctionbybdnfinamousemodelofglaucoma.plosone2014,9:e115579.
[37]atkina,bodis-wollneri,podossm,wolksteinm,mylinl,nitzbergs:flickerthresholdandpatternveplatencyinocularhypertensionandglaucoma.investigativeophthalmology&visualscience1983,24:1524-8.
[38]greensteinvc,seligers,zemonv,ritchr:visualevokedpotentialassessmentoftheeffectsofglaucomaonvisualsubsystems.visionresearch1998,38:1901-11.
[39]takedam,takamiyaa,jiaojw,choks,trevinosg,matsudat,chendf:alpha-aminoadipateinducesprogenitorcellpropertiesofmullergliainadultmice.investigativeophthalmology&visualscience2008,49:1142-50.
[40]millerrf,fagersonmh,staffnp,wolfer,doerrt,gottesmanj,sikorama,schunemanr:structureandfunctionalconnectionsofpresynapticterminalsinthevertebrateretinarevealedbyactivity-dependentdyesandconfocalmicroscopy.thejournalofcomparativeneurology2001,437:129-55.
[41]ullianem,sappersteinsk,christophersonks,barresba:controlofsynapsenumberbyglia.science2001,291:657-61.
[42]mux,kleinwh:ageneregulatoryhierarchyforretinalganglioncellspecificationanddifferentiation.seminarsincell&developmentalbiology2004,15:115-23.
- 还没有人留言评论。精彩留言会获得点赞!