脉冲释放去氧肾上腺素剂型的制作方法
本发明整体涉及由立即释放去氧肾上腺素部分和延迟释放去氧肾上腺素部分组成的剂型,并且更具体地,其中去氧肾上腺素的延迟释放是脉冲式的。
背景技术:
减充血剂常用于缓解鼻充血并且常用的减充血剂为去氧肾上腺素。去氧肾上腺素作为非处方(otc)药物而被消费者广泛获取。
包含去氧肾上腺素的立即释放剂型的一个问题在于为了使其达到最有益效果,必须将其频繁服用。用于包含盐酸去氧肾上腺素的口服剂型的现有美国专论为每四小时十毫克。消费者发现每四小时给药不方便并且常常错过给药,特别是错过中午给药,这可导致症状缓解不良。
此外,给药之间的较短时间段使其难以将去氧肾上腺素与其它药物活性物质,特别是常用于具有更长给药间隔的缓解多种症状的感冒/流感产品的活性物质相缀合。因此,消费者必须在一天内以不同的间隔服用多种剂型和剂量,以对最佳缓解其感冒/流感症状有所体验。
频繁给药的原因之一是因为去氧肾上腺素经受较高的首过代谢效应和较短的半衰期。在口服时,去氧肾上腺素被快速代谢并随后缀合成硫酸盐和葡糖苷酸形式。然而,治疗性减充血剂的活性归因于未被代谢且保持为未缀合的母体活性物质的去氧肾上腺素部分。因此,使口服后未缀合的活性形式在血流中存在的持续时间最大化是有益处的。
已经进行了多种尝试来改变去氧肾上腺素的释放以延长给药间隔。涉及到改变去氧肾上腺素释放的许多方法致力于双释放机制,其包括将立即释放形式与延长的一级延长释放相或零级延长释放相偶联。这些双模态方法的一个问题在于在延长释放相期间,低水平的未缀合的去氧肾上腺素活性物质可能因快速的首过代谢效应而存在于血流中。另选的方法将为如下的脉冲式剂型:在肠中不同区域释放活性物质并且可模拟每4小时给药的立即释放剂型。此类剂型对消费者将是有利的并且允许更有效和方便的给药。
因此,在消费者所选择的otc治疗领域仍然需要改进的选择来治疗与感冒(鼻病毒)、流行性感冒、或环境过敏相关联的症状。具体地,需要一种方便的更长效去氧肾上腺素剂型,其可提供在相对于当前治疗时间的延长时间段内的缓解。
技术实现要素:
一种用于以控制的脉冲剂量递送去氧肾上腺素的多颗粒口服剂型的剂量,所述多颗粒口服剂型包括:(a)立即释放形式,该立即释放形式包括去氧肾上腺素或其盐;和(b)多个延迟释放颗粒,该多个延迟释放颗粒包括包含去氧肾上腺素或其盐的包衣和包含聚合物的ph敏感性包衣;其中auc满足或超过以四个小时间隔服用的两个10mg立即释放去氧肾上腺素剂量的auc。
一种用于以控制的脉冲剂量递送去氧肾上腺素的多颗粒口服剂型,其包括:(a)立即释放形式,该立即释放形式包括去氧肾上腺素或其盐;和(b)多个延迟释放颗粒,该多个延迟释放颗粒包括包含去氧肾上腺素或其盐的包衣和包含聚合物的ph敏感性包衣;其中如由krebs缓冲液方法所测定的,延迟时间为约1小时至约4小时。
附图说明
虽然本说明书通过特别指出并清楚地要求保护本发明主题的权利要求书作出结论,但据信由以下与附图有关的说明可更容易理解本发明,其中:
图1为立即释放颗粒的示意图;
图2为延迟释放颗粒的示意图;
图3示出对于不同的制剂原型,体内未缀合的去氧肾上腺素的平均浓度随时间的变化;
图4示出对于不同的制剂原型,体内总去氧肾上腺素的平均浓度随时间的变化;
图5示出对于不同的制剂原型,在体外用krebs缓冲液溶解法得到的溶解的去氧肾上腺素的平均百分比随时间的变化;
图6示出每四小时服用的市售的去氧肾上腺素产品和八小时延迟释放的原型的计算机模型;
图7示出每四小时服用的市售的去氧肾上腺素产品和基本上生物等价的最佳的八小时延迟释放原型的计算机模型;
图8示出每四小时服用的市售的去氧肾上腺素产品的计算机模型并且其超出生物等效性;
图9a、图9b、图9c和图9d示出在40x的总放大倍数下,延迟释放颗粒的数字照片;
图10a、图10b、图10c和图10d示出在40x的总放大倍数下,延迟释放颗粒的数字照片;并且
图11a和图11b示出用于光滑度测试方法的视场的示例性图像。
具体实施方式
本发明涉及一种多颗粒口服剂型,其被设计用于立即释放盐酸去氧肾上腺素(pe),之后进行一个或多个延迟脉冲。在一个示例中,一个或多个延迟脉冲被配制成使得去氧肾上腺素在胃肠道的不同区域中释放,从而提供延长时间的堵塞缓解。在一个示例中,延迟递送剂量是包肠溶衣的并被设计成在远侧小肠中释放去氧肾上腺素。不受理论的束缚,据信递送至远侧小肠是有效的,因为有效代谢酶的效应减小,最终导致血液中最佳量的未缀合去氧肾上腺素并且给药的持续时间更长。因此,治疗水平的去氧肾上腺素可以以适当的剂量、肠区域和时间间隔递送,以在延长的时间段内提供有效的缓解。
多颗粒固体口服剂型可为可每6小时、8小时或12小时给药的包含去氧肾上腺素的片剂、小袋、或胶囊,以为患者提供延长的堵塞缓解。在一个示例中,所述剂型可满足或超过相比于每四小时时间间隔服用的两个或三个立即释放剂量的去氧肾上腺素的生物利用率和/或生物等效性。
如本文所用,“auc”是指用线性梯形法则计算的从给药时间直到一定时间点的浓度-时间曲线下面积。auc是示出一段时间内累积血药浓度的参数,并且指出了药物总量和利用度。“auc(0-t)”定义为对达到t小时的任意时间值的auc。在一个示例中,t为12小时(本文称之为auc(0-12)),其它示例可包括auc(0-6)和auc(0-8)。“auc(0-无穷)”定义为外推至无穷大时计算的auc。auc(0-无穷)计算为等于auc最后+ct/λz,其中auc最后为直至最后可测量浓度时间点的auc,ct为最后可测量的血浆浓度,并且λz为末相速率常数。末相速率常数λz用线性回归法在曲线末端数据点由药物浓度-时间曲线的斜率得出。
如本文所用,“生物利用率”是指从药品吸收活性药物成分或治疗性部分的速率和程度并且变得可用于治疗作用。在一个示例中,药物成分可为去氧肾上腺素并且其可达到体循环且可在其作用部位处可用。
如本文所用,“生物等价”和“生物等效性”是指当在类似的实验条件下给药时,吸收速率和程度相对于单剂量或多剂量的当前可用产品未示出显著差异的剂型。一些剂型可在其吸收程度方面是等同的但在其吸收速率方面并不等同,然而却可被认为是生物等价的,因为此类吸收速率的不同是预期的并反映于标签中,并且对长期使用时达到有效机体药物浓度并非必须的,或者认为对研究的具体药品而言在医学上是无关重要的。
在一个示例中,在最小暴露处的脉冲式pe剂型可满足或超过可商购获得的每4小时间隔服用的立即释放pe剂量的生物等效性(80-125%auc)。
如本文所用,“缀合的去氧肾上腺素”是指被代谢的去氧肾上腺素。这意指去氧肾上腺素已被酶缀合(即被化学改变)。缀合去氧肾上腺素的酶可包括磺基转移酶或udp-葡萄糖苷酰转移酶。
如本文所用,“延迟释放”是指其中药物活性物质(或活性物质)在除紧随着口服之外的时间释放的颗粒、多个颗粒、或剂型。在一个示例中,延迟释放的颗粒、多个颗粒、或剂型已被有意改变以使得在颗粒、多个颗粒、或剂型内或其上所含的大部分药物活性物质在给药后某时间段释放或吸收到血浆中。延迟释放剂型的一个优点在于其可被配制成在指定的时间段之后或在遇到合适的环境(例如,基于ph,酶活性、或溶解度释放)时释放活性物质。在一个示例中,延迟释放颗粒具有肠溶衣,这是指颗粒包衣是ph敏感的,并且在一个或多个颗粒或剂型达到肠的特定区域之前用户无法体验到益处。在一些示例中,延迟释放的颗粒、多个颗粒、或剂型可以与可包括立即释放颗粒、多个颗粒或其它剂型的立即释放的相缀合。在一个示例中,剂型或一个或多个颗粒并非在延长的持续时间内缓慢递送活性物质,而是颗粒可被设计成在延迟的时间后快速或立即递送活性物质。
如本文所用,“溶解”是指崩解、分散和/或进入溶液中。
如本文所用,“剂量”或“剂量单位”是指根据可靠的医学经验,包含一定量药物活性物质的适于在单个场合给药的剂型。剂型可包括多种口服剂型。剂型的非限制性示例可包括悬浮于液体制剂中的颗粒,明胶或泡沫中的固体,或以片剂、粉末、颗粒剂、球剂、微球、纳米微球、小珠、或独丸以及它们的组合形式的固体剂量。在一个示例中,剂型是片剂或胶囊。在另一个示例中,剂型为包含延迟释放颗粒和任选的立即释放形式以及赋形剂的胶囊。可将剂型口服并通常立即吞咽,缓慢溶解于口中,或咀嚼。
如本文所用,“延长释放”是指相比于由常规剂型例如溶液或立即释放剂型所呈现的,使得给药频率能够降低的颗粒、多个颗粒、或剂量单位。在一个示例中,延长释放剂型可被有意改变,其中颗粒、多个颗粒、或剂型以使得药物活性物质在给药后延长的时间段内可用的方式配制。延长释放的颗粒、多个颗粒或剂型的一个示例为延迟释放剂型。延长释放的颗粒、多个颗粒或剂型的另一个示例可为脉冲式释放剂型或一个或多个颗粒。
如本文所用,“立即释放”是指如下颗粒、多个颗粒、或剂型:其中未有意作出努力来改变释放速率,并且就胶囊、片剂和颗粒而言,引入的崩解剂不被解释为改变。
如本文所用,“pk特征”是指血浆中的药物诸如未缀合去氧肾上腺素的浓度随时间变化的药代动力学特征。
如本文所用,“脉冲式释放”是指去氧肾上腺素在摄取后于两个或更多个不同时间段释放。在一个示例中,所述剂型可具有立即释放形式,其可为多个立即释放颗粒以及多个延迟释放颗粒,这导致将所述剂型给药于用户后立即释放第一脉冲的去氧肾上腺素并且在延迟释放颗粒进入ph较高的小肠环境时立即释放第二脉冲。
如本文所用,术语“基本等同”是指在约60%内,在另一个示例中约70%内,在另一个示例中约75%内,在另一个示例中约80%内,在另一个示例中约85%内,在另一个示例中约90%内,在另一个示例中约93%内,在另一个示例中约95%内,在另一个示例中约98%内,在另一个示例中约102%内,在另一个示例中约105%内,在另一个示例中约107%内,在另一个示例中约110%内,在另一个示例中约115%内,在另一个示例中约120%内,在另一个示例中约125%内,在另一个示例中约130%内,并且在另一个示例中约140%内。基本等同可指但不限于pk特征、c最大和auc。
如本文所用,术语“总去氧肾上腺素”是指缀合的去氧肾上腺素和未缀合的去氧肾上腺素的量。
如本文所用,术语“处理”(treat,treating)包括预防、缓解、改善、抑制、或减轻哺乳动物的一种或多种身体病症。健康状况的非限制性示例可包括呼吸状况。
如本文所用,“未缀合的去氧肾上腺素”是指未代谢的去氧肾上腺素并且为治疗学上活性形式的去氧肾上腺素。未代谢的去氧肾上腺素为已进入使用者身体且在吸收到血浆中时或稍后未发生化学变化的去氧肾上腺素。
如本文所用,冠词“一个”和“一种”被理解意旨受权利要求书保护的或描述的一种或多种材料,例如,“丙烯酸酯共聚物”或“多颗粒剂型”。
除非另外指明,本文所用所有百分比、份数和比率均按剂型的重量计。除非另外指明,所有这些涉及所列成分的重量均基于活性物质含量计,并因此不包括可包含于可商购获得的材料中的溶剂或副产物。
本发明的剂型、工艺和方法可包含、由或基本上由以下物质组成:基本成分和本文所述的本发明的限制,以及本文所述或以其他方式可用于旨在由人类使用或消费的剂型中的任何附加的或任选的成分、组分或限制。
图1示出立即释放颗粒1的示意图。立即释放颗粒1可包括芯2、去氧肾上腺素包衣3、和任选地分隔包衣4。在一个示例中,去氧肾上腺素包衣3可在其到达胃之后溶解或开始溶解。
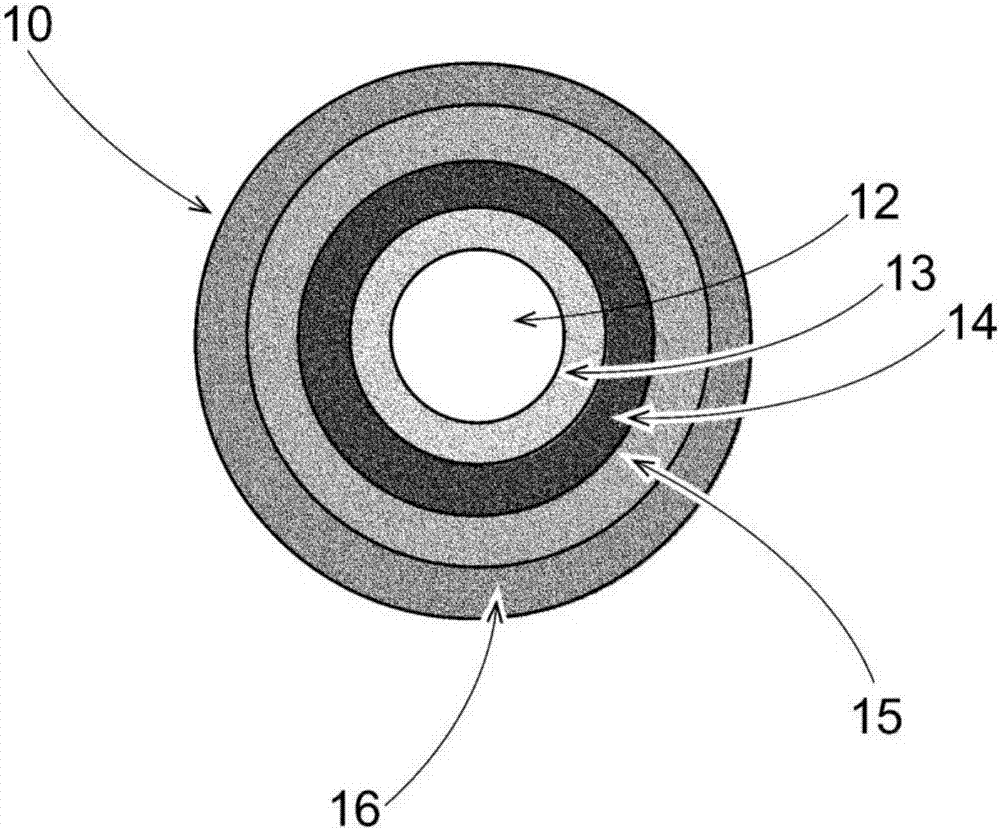
图2示出延迟释放颗粒10的示意图。延迟释放颗粒10包括芯12、去氧肾上腺素包衣13、任选地分隔包衣14、ph敏感性包衣15、和任选地抗结块包衣16。
在一个示例中,立即释放颗粒和/或延迟释放颗粒可具有分隔包衣。对于立即释放颗粒,分隔包衣可有助于在处理颗粒时限制脆碎度。另外,对于延迟释放颗粒,分隔包衣可分隔开高度可溶的去氧肾上腺素层与ph敏感性包衣。如果去氧肾上腺素渗入或迁移到ph敏感性包衣中,则这可导致药物过早溶解。分隔包衣的非限制性示例可包括滑石、聚乙烯醇-聚乙二醇接枝共聚物(可作为
在一个示例中,可将抗结块包衣喷涂到延迟释放颗粒上以防止颗粒在储存期间粘结在一起。在另一个示例中,立即释放颗粒可具有抗结块包衣。如果颗粒粘结在一起,这可导致不均匀溶解,其改变去氧肾上腺素的精确定时释放。抗结块包衣可为防止颗粒粘结在一起的任何材料。在一个示例中,抗结块包衣可为透明的,并且在另一个示例中,抗结块包衣可为半透明的。在另一个示例中,抗结块包衣可为不透明的。在另一个示例中,抗结块包衣可为白色粉末。在另一个示例中,抗结块包衣可包含颜色。在一个示例中,抗结块包衣可包含具有较高的相对高表面积且不溶于水的细小颗粒。在一个示例中,表面积大于约100m2/g,在另一个示例中大于约150m2/g,在另一个示例中大于约175m2/g,并且在另一个示例中大于约200m2/g。在一个示例中,在添加抗结块包衣之后,颗粒增加的重量百分比(重量%)可为约0.1%至约5%,在另一个示例中约0.15%至约3%,并且在另一个示例中约0.2%至约2%。
抗结块包衣的非限制性示例可包括滑石、铁氰化钠、铁氰化钾、碳酸钙、碳酸镁、二氧化硅、亲水性热解二氧化硅(可作为
因为胃肠道内不同的ph环境和可变性,可能难以预测影响期望的脉冲释放特性所需的聚合物的含量和类型。在脉冲释放去氧肾上腺素剂型的一个示例中,基于溶解和药代动力学参数仔细选择和定制聚合物类型、包衣水平、粒群比率、以及单独的剂量水平,以实现pk特征满足或超过相对于连续给药的以规则的时间间隔(通常四小时)服用的立即释放形式的去氧肾上腺素的生物利用率和/或生物等效性的剂型。
一个示例可包括立即释放形式和延迟释放颗粒的混合物,其剂量并不生物等价于连续给药的立即释放形式,但是仍可通过适当设计的临床药代动力学、安全和/或效力试验或附加支持性数据在美国及其它地域注册。另一个示例可包括剂量基本上生物等价于两次或三次连续给药的立即释放剂型的立即释放颗粒和延迟释放颗粒的混合物。
pk特征检查在给药去氧肾上腺素之后体内的时程并且包括c最大、auc、t延迟和t最大。c最大为观察的最大血浆浓度。t最大为达到c最大的时间。t延迟为在第一可定量血浆浓度水平之前的延迟时间。
由评估可商购获得的去氧肾上腺素产品的四个延迟释放处理的体内研究得到的未缀合pe和总pe的pk参数示出于表1和表2以及图3和图4中。在表1和表2以及图3和图4中,处理1对应于实施例2,处理2对应于实施例4,处理3对应于实施例3,并且处理4对应于实施例1。下文对所有实施例进行了描述。处理5和处理6使用了可商购获得的去氧肾上腺素产品
以下详述的表1示出了未缀合的pe在体内的关键pk参数c最大、auc最后、t延迟和t最大的汇总。
表1
以下详述的表2示出了总pe在体内的关键pk参数c最大、auc最后、t延迟和t最大的汇总。
表2
图3示出对于不同处理的非缀合去氧肾上腺素的平均浓度随时间的变化。期望的处理的一个示例可为其中第二脉冲具有与处理6基本等同的c最大、auc最后、t延迟和t最大。
图4示出对于不同处理的总去氧肾上腺素的平均浓度随时间的变化。期望的处理的一个示例可为其中第二脉冲具有与处理6基本等同的c最大、auc最后、t延迟和t最大。
图8示出每四小时服用的市售的去氧肾上腺素产品的计算机模型并且其超出生物等效性。虽然该示例超出生物等效性,但其仍可被认为是安全且有效的。
处理展示了采用ph敏感性包衣的处理的未缀合去氧肾上腺素的auc最后与总去氧肾上腺素的auc最后的比率高于不具有ph敏感性包衣的处理5和处理6的该比率。在一个示例中,采用ph敏感性包衣的处理的比率比不具有ph敏感性包衣的处理的比率大于两倍到十倍,在另一个示例中大于四倍到八倍,并且在另一个示例中大于五倍到七倍。在一个示例中,采用ph敏感性包衣的处理的比率比不具有ph敏感性包衣的处理的比率大于六倍。
相比于处理1、处理2和处理3,处理4的去氧肾上腺素的平均浓度最接近于处理6的去氧肾上腺素的平均浓度。因此,处理4被用作开发另一种原型的起点。然而,去氧肾上腺素过早地由处理4释放,因此并不理想。因此,新原型被设计成具有更厚的ph敏感性包衣以进一步延缓延迟时间。估计最期望将延迟时间进一步延缓附加的90-120分钟。在一个示例中,使用较低剂量的去氧肾上腺素来调节c最大和auc值以匹配ir10mg剂量。对第二脉冲而言,其它示例可包括10mg或更高剂量的pe,以相对于ir处理实现更高的全身性暴露。
图5示出对于不同的制剂原型,在体外用如下所示krebs缓冲液溶解法得到的释放的去氧肾上腺素的量随时间的变化。不受理论的束缚,据信与使用磷酸盐缓冲液的其它溶解方法相比,包含碳酸氢盐的krebs缓冲液对于消化道中的条件更好地近似,并且可导致对于延迟释放颗粒更好地近似。图5中所示的原型对应于本文的实施例6-11。
释放的去氧肾上腺素的量使用如下所述的hplc测定进行计算,并且可见于图5。当释放的去氧肾上腺素的量大于酸极限(其为约10%)时,这为延迟时间。
在一个示例中,如由以下krebs缓冲液方法所测定的,延迟时间为约0.5小时至约6小时,在另一个示例中约1小时至约4小时,在另一个示例中约1.25小时至约3小时,并且在另一个示例中约1.5小时至约2.5小时。
表3
在临床研究中测定了10毫克(mg)立即释放剂量的盐酸去氧肾上腺素和每四小时给药的10mg盐酸去氧肾上腺素的pk特征并且将其用于期望pk特征的计算机建模。在一个示例中,通过用计算机建模来测定pk特征以将延迟释放剂型的auc与每四小时给药的两个或三个立即释放去氧肾上腺素剂型的pk特征进行比较。在另一个示例中,可调节t延迟以调节给药频率以及去氧肾上腺素的期望水平。
图6为示出每四小时服用的市售的去氧肾上腺素产品和八小时延迟释放的原型的计算机模型,其中第二峰的t最大值没有与立即释放原型的第二峰重合。在图6中,在第一脉冲中,原型和市售产品两者的c最大相同。然而,原型的第二脉冲过早,导致血浆中未缀合的去氧肾上腺素的浓度高于立即释放处理的所述浓度。
图7为示出每四小时服用的市售的去氧肾上腺素产品和期望的八小时延迟释放原型的计算机模型。在图7中,原型和市售产品两者的第一脉冲相同,并且原型和市售产品两者的第二脉冲的c最大基本上相同。因此,在图7中,原型的pk特征基本上等同于市售产品的pk特征。
在一个示例中,剂型可每六小时,在另一个示例中每七小时,在另一个示例中每八小时,在另一个示例中每九小时,在另一个示例中每十小时,并且在另一个示例中每十二小时给药。
在一个示例中,可每八小时给药的剂型的auc可满足或超过每四小时给药的两个10mg立即释放剂量的auc。在另一个示例中,可每十二小时给药的剂型的auc可满足或超过每四小时给药的三个10mg立即释放剂量的auc。在此类剂型中,新形式的c最大可满足或超过每4小时给药(共两次或三次给药)的立即释放形式。
在另一个示例中,可每八小时给药的剂型的auc可基本上等于或大于每四小时给药的两个10mg立即释放剂量的auc。在另一个示例中,可每十二小时给药的剂型的auc可基本上等于或大于每四小时给药的三个10mg立即释放剂量的auc。在此类剂型中,新形式的c最大还可基本上等于或大于每4小时给药(共两次或三次给药)的立即释放形式。
在另一个示例中,相比于每四小时给药的10mg立即释放剂量的auc和/或c最大,立即释放颗粒和延迟释放颗粒的剂型可具有更高的auc和/或c最大。
为了提供延迟释放去氧肾上腺素剂型,可对剂型进行适当地配制。
剂型可包含多个颗粒。术语颗粒并不意味着限制并且可包括微晶、微颗粒、小珠、微珠、粉末、颗粒剂、球剂、微球、那普瑞尔种子和微胶囊。在一个示例中,颗粒的在其最长尺寸方向上为约200μm至约1500μm,在另一个示例中约300μm至约1000μm,在另一个示例中约400μm至约800μm,并且在另一个示例中约500μm至约725μm。在另一个示例中,颗粒可为球形或基本球形的。
在另一个示例中,延迟释放颗粒可为基本上平滑的。如果延迟释放颗粒不平滑,例如如果其带尖或具有粗糙的表面外观,则可改变溶解。如果颗粒带尖或具有粗糙的表面,去氧肾上腺素可较早释放,原因是去氧肾上腺素可漏出具有最薄包衣水平的颗粒部分。在一个示例中,如在总放大倍数为40x的显微镜下可视觉感知的,颗粒为基本上平滑的。如本文所用,“在显微镜下可视觉感知”意指人类观察者可在总放大倍数为40x的适当聚焦的显微镜下视觉上辨认出颗粒为平滑的并且表面具有基本类似于不具有ph敏感性包衣的颗粒的外观。图9a、图b、图c和图d示出如可在总放大倍数为40x的显微镜下视觉感知的基本上不平滑的颗粒的数字照片。图10a、图b、图c和图d示出如可在总放大倍数为40x的显微镜下视觉感知的基本上平滑的颗粒的数字照片。基本上平滑的颗粒可以为不圆但仍然平滑的。
在另一个示例中,光滑度可由下文所述的光滑度测试方法来测定。在一个示例中,颗粒可具有约0.70至约1,在另一个示例中约0.75至约1,在另一个示例中约0.8至约1,在另一个示例中约0.85至约1,在另一个示例中约0.90至约1,并且在另一个示例中约0.95至约1的平均圆形度。在另一个示例中,颗粒可具有约0.72至约0.95,约0.78至约0.93,以及约0.82至约0.89的平均圆形度。
在一个示例中,剂型可递送治疗血浆浓度的未缀合去氧肾上腺素至少6小时,在另一个示例中至少8小时,在另一个示例中至少10小时,并且在另一个示例中至少12小时。
本发明剂型中颗粒的芯可包含任何配药学上合适的材料。芯材料的非限制性示例可包括微晶纤维素、糖、淀粉、聚合物、以及它们的组合。在一个示例中,芯可为以商品名
延迟释放颗粒可包含ph敏感性包衣,这意指包衣在浸入特定ph(可为碱性或酸性)中时溶解。在一个示例中,ph敏感性包衣为肠溶衣。包衣为适当的厚度或适当的重量百分比可以是重要的。如果包衣过薄或者重量百分比过低,则去氧肾上腺素可相对过早释放并且延迟时间可比所需要的更短。关于过早释放去氧肾上腺素的一个问题在于剂量可能太靠近在一起,并且使用者可能在预期持续时间内不具有持续水平的未缀合的去氧肾上腺素。过早释放去氧肾上腺素的一个示例可见于图6。
如果包衣过厚或者重量百分比过高,则去氧肾上腺素可相对于实现预期的6-12小时给药持续时间次优地释放。如果去氧肾上腺素在小肠中过远处释放,则去氧肾上腺素可能没有足够的时间在进入结肠之前进入血流。不受理论的束缚,结肠可能不具有足够的液体以允许去氧肾上腺素溶解以及不具有减小的表面积以允许全身性吸收。因此,可能有利的是在迁移到结肠之前剂型和活性物质发生显著溶解。
在添加ph敏感性包衣之后,颗粒增加的重量百分比(重量%)可为约15%重量至约65重量%,在另一个示例中约25重量%至约55重量%,并且在另一个示例中约35重量%至约45重量%。
在另一个示例中,在添加ph敏感性包衣后增加的重量%可为约25重量%至约75重量%增加,在另一个示例中约35重量%至约45重量%,并且在另一个示例中约45重量%至约55重量%。
在另一个示例中,在添加ph敏感性包衣后增加的重量%可为约40重量%至约80重量%增加,在另一个示例中约50重量%至约75重量%,并且在另一个示例中约55重量%至约65重量%。
在另一个示例中,在添加ph敏感性包衣后增加的重量%为20重量%至约60重量%,在另一个示例中约30重量%至约55重量%,在另一个示例中约40重量%至约30重量%,在另一个示例中约42重量%至约48重量%,在另一个示例中约44重量%至约46重量%,并且在另一个示例中约45重量%。在添加ph敏感性包衣后增加的重量%为约10重量%至约50重量%,在另一个示例中约20重量%至约45重量%,在另一个示例中约30重量%至约40重量%,在另一个示例中约32重量%至约38重量%,在另一个示例中约34重量%至约36重量%,并在另一个示例中约35重量%。在另一个示例中,在添加ph敏感性包衣后增加的重量%为约30重量%至约50重量%,并且在另一个示例中约35重量%至约45重量%。
在另一个示例中,延迟释放颗粒可任选的包含按所述颗粒重量计约5重量%至约55重量%,在另一个示例中约10重量%至约45重量%,并且在另一个示例中约15重量%至约35重量%的ph敏感性包衣。
ph敏感性包衣可为肠溶衣。在一个示例中,ph敏感性包衣可在ph为至少5.5的小肠中降解,并且在另一个示例中,ph敏感性包衣可在ph为至少7.0时降解。在任何情况下,在一个示例中,ph敏感性包衣可避免去氧肾上腺素过早降解而在胃中较低ph下溶解。
ph敏感性包衣可包含一种或多种聚合物,其是单独的或与水溶性或不溶性聚合物缀合。ph敏感性包衣可包含任何化学稳定的生物相容性聚合物。在一个示例中,ph敏感性包衣具有100,000g/mol至600,000g/mol,在另一个示例中150,000g/mol至500,000g/mol,在另一个示例中200,000g/mol至400,000g/mol,在另一个示例中225,000g/mol至350,000g/mol,并且在另一个示例中250,000g/mol至300,000g/mol的分子量。
聚合物的非限制性示例可包括纤维素酯和衍生物、丙烯酯共聚物、羟丙甲纤维素乙酸琥珀酸酯、聚醋酸乙烯酯和衍生物(可作为
纤维素酯和衍生物的非限制性示例可包括乙酸邻苯二甲酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)、羟丙基甲基纤维素乙酸琥珀酸酯、乙酸四氢邻苯二甲酸纤维素、乙酸六氢邻苯二甲酸酯纤维素、羟丙基纤维素乙酸琥珀酸酯、以及它们的组合。
丙烯酸酯共聚物的非限制性示例可包括与甲基丙烯酸共聚合的甲基-甲基丙烯酸酯、与甲基丙烯酸和酯共聚合的丙烯酸和酯、包含铵基的丙烯酸酯共聚物、以及它们的组合。
在一个示例中,聚合物可为基于丙烯酸甲酯、甲基丙烯酸甲酯和甲基丙烯酸的阴离子共聚物。在一个示例中,所述包衣可包含聚(丙烯酸甲酯-共聚-甲基丙烯酸甲酯-共聚-甲基丙烯酸)7:3:1聚合物,以商品名“
在一个示例中,ph敏感性包衣可包含
在一个示例中,ph敏感性包衣可包含多于一种可以任意比率混合的聚合物以控制去氧肾上腺素释放的位置。
在一个示例中,立即释放颗粒可具有聚合物包衣,其不为肠溶衣且可在击中(hitting)胃时溶解。
在另一个示例中,在剂型和/或立即释放剂型和/或延迟释放颗粒中的去氧肾上腺素%可占约2%至约20%,在另一个示例中约5%至约15%,在另一个示例中约7%至约12%,在另一个示例中约8%至约10%,并且在另一个示例中约7%至约9%。在另一个示例中,剂型和/或立即释放剂型和/或延迟释放颗粒中的去氧肾上腺素%可大于约5%,在另一个示例中大于约6%,在另一个示例中大于约7%,在另一个示例中大于约8%,在另一个示例中大于约9%,在另一个示例中大于约10%,在另一个示例中大于约11%,并且在另一个示例中大于约12%。在另一个示例中,剂型和/或立即释放剂型和/或延迟释放颗粒中的去氧肾上腺素%可少于约25%,在另一个示例中少于约20%,在另一个示例中少于约15%,在另一个示例中少于约12%,并且在另一个示例中少于约10%。在另一个示例中,剂型和/或立即释放剂型和/或延迟释放颗粒中的去氧肾上腺素%可为约8%至约30%,在另一个示例中约10%至约25%,在另一个示例中约12%至约20%,并且在另一个示例中约13%至约18%。
立即释放颗粒或其它立即释放形式对于延迟释放颗粒的比率可变化。在一个示例中,每种立即释放形式可包含与每种延迟释放颗粒量相同量的去氧肾上腺素,并且立即释放形式与延迟释放颗粒的比率可被调节成实现期望的剂量和效应。在另一个示例中,立即释放形式的去氧肾上腺素的量与延迟释放颗粒上所包衣的去氧肾上腺素的量的比率可大于约1:1。在另一个示例中,立即释放形式的去氧肾上腺素的量与延迟释放颗粒上所包衣的去氧肾上腺素的量的比率可小于约1:1。并且在另一个示例中,立即释放形式的去氧肾上腺素的量与延迟释放颗粒上去氧肾上腺素的量的比率可等于约1:1。在一个示例中,立即释放形式的去氧肾上腺素的量与延迟释放颗粒上所包衣的去氧肾上腺素的量的比率可为约1:4至约4:1,在另一个示例中约1:3至约3:1,并且在另一个示例中约1:2至约2:1。在一个示例中,立即释放形式的去氧肾上腺素的量与延迟释放颗粒上所包衣的去氧肾上腺素的量的比率可大于约1:5,在另一个示例中大于约1:4,在另一个示例中大于约1:3,并且在另一个示例中大于约1:2,并且在另一个示例中大于约1:1。如果比率并非最佳的,则产品不可实现期望的给药方案,例如每6-12小时一次。
在另一个示例中,每种立即释放颗粒或其它立即释放形式上去氧肾上腺素的量可不同于每种延迟释放颗粒上去氧肾上腺素的量。在另一个示例中,立即释放颗粒或其它立即释放形式可包含比延迟释放颗粒更多的去氧肾上腺素,并且去氧肾上腺素的量经由每种颗粒上所包衣的量进行调节。在另一个示例中,立即释放颗粒或其它立即释放形式可包含比延迟释放颗粒更少的去氧肾上腺素,并且去氧肾上腺素的量经由每种颗粒上所包衣的量进行调节。在另一个示例中,立即释放颗粒或其它立即释放形式可包含与延迟释放颗粒大约相同量的去氧肾上腺素。
立即释放颗粒或其它立即释放形式与延迟释放颗粒的比率可根据期望的pk特征进行调节。在一个示例中,pk特征可基本上等同于每四小时给药的立即释放剂型。在另一个示例中,pk特征大于每四小时给药的多个立即释放剂型的pk特征,并且认为对于otc鼻充血产品是安全和有效的。在另一个示例中,pk特征基本不等同于每四小时给药的多个立即释放剂型的pk特征,但是认为对于otc鼻充血产品是安全和有效的。
在一个示例中,多颗粒剂型可具有两个脉冲,可每八小时给药,并且可基本上等同于两个四小时剂量的可商购获得的去氧肾上腺素产品的pk特征。在另一个示例中,多颗粒剂型可具有两个脉冲,可每八小时给药,并且可具有的最小pk特征基本上生物等价于两个四小时剂量的可商购获得的去氧肾上腺素产品的pk特征。在另一个示例中,多颗粒剂型可包含立即释放去氧肾上腺素颗粒和延迟释放去氧肾上腺素颗粒两者,并且可每6-8小时给药,并且可具有的pk特征基本超过每4小时给药的可商购获得的去氧肾上腺素产品的去氧肾上腺素pk特征。在一个示例中,立即释放颗粒或其它立即释放形式和延迟释放颗粒可具有相同量的去氧肾上腺素,立即释放颗粒与延迟释放颗粒的重量比可为约1:1至约10:1,在另一个示例中重量比率的范围可为约1:1至约4:1。
在一个示例中,所述剂型可包含立即释放颗粒或其它立即释放形式,该立即释放颗粒或其它立即释放形式可包含约5mg至约40mg,在另一个示例中约7mg至约30mg,并且在另一个示例中约8mg至约15mg的盐酸去氧肾上腺素。在一个示例中所述剂型可包含含有10mg盐酸去氧肾上腺素的立即释放颗粒或其它立即释放形式。在另一个示例中,剂型可包含立即释放颗粒或其它立即释放形式,该立即释放颗粒或其它立即释放形式可包含约10mg至约20mg的盐酸去氧肾上腺素,在另一个示例中约12mg至约18mg的盐酸去氧肾上腺素,并且在另一个示例中约14mg至约16mg的盐酸去氧肾上腺素。剂型可包含含有15mg盐酸去氧肾上腺素的立即释放颗粒或其它立即释放形式。在另一个示例中,剂型可包含立即释放颗粒或其它立即释放形式,该立即释放颗粒或其它立即释放形式可包含约10mg至约75mg,在另一个示例中约15mg至约50mg,在另一个示例中约20mg至约40mg,并且在另一个示例中约25mg至约35mg的盐酸去氧肾上腺素。在一个示例中,立即释放颗粒或其它立即释放形式可包含约10mg去氧肾上腺素,在另一个示例中约15mg去氧肾上腺素,并且在另一个示例中约20m去氧肾上腺素。
在另一个示例中,所述剂型可包含延迟释放颗粒,该延迟释放颗粒可包含比立即释放颗粒或其它立即释放形式更少的去氧肾上腺素。在另一个示例中,延迟释放颗粒可包含少于约20mg的去氧肾上腺素,在另一个示例中少于约15mg的去氧肾上腺素,并且在另一个示例中少于约10mg的去氧肾上腺素。在另一个示例中,延迟释放颗粒可包含约2mg至约9mg的去氧肾上腺素,在另一个示例中约3mg至约7mg的去氧肾上腺素,并且在另一个示例中约4mg至约6mg的去氧肾上腺素。在一个示例中,延迟释放颗粒可包含约1mg至约5mg,在另一个示例中约2mg至约4mg,并且在另一个示例中约3mg的去氧肾上腺素。在一个示例中,延迟释放颗粒可包含约2至约7mg,在另一个示例中约3mg至约6mg,并且在另一个示例中约5mg的去氧肾上腺素。在另一个示例中,延迟释放颗粒可包含约3mg至约9mg,在另一个示例中约5mg至约8mg,并且在另一个示例中约7mg的去氧肾上腺素。所剂型可包含可含有15mg盐酸去氧肾上腺素的立即释放颗粒或其它立即释放形式。在另一个示例中,所述剂型可包含立即释放颗粒或其它立即释放形式,该立即释放颗粒或其它立即释放形式可包含约10mg至约75mg,在另一个示例中约15mg至约50mg,在另一个示例中约20mg至约40mg,并且在另一个示例中约25mg至约35mg的盐酸去氧肾上腺素。在一个示例中,延迟释放颗粒可包含约10mg去氧肾上腺素,在另一个示例中约15mg去氧肾上腺素,并且在另一个示例中约20m去氧肾上腺素。
在一个示例中,延迟释放颗粒和立即释放颗粒或其它立即释放形式可包含大约相同量的去氧肾上腺素。在另一个示例中,延迟释放颗粒可包含比延迟释放颗粒更多的去氧肾上腺素。在另一个示例中,延迟释放颗粒可包含比延迟释放颗粒更少的去氧肾上腺素。
在另一个示例中,相对于可商购获得的每4小时间隔服用的立即释放pe剂量,脉冲式pe剂量可满足或超过生物等效性范围(>125%auc),同时保持安全和有效。在一个示例中,脉冲式pe剂量可超过至少约5%,在另一个示例中至少约10%,在另一个示例中至少约15%,在另一个示例中至少约20%,在另一个示例中至少约25%,在另一个示例中至少约30%,在另一个示例中至少约40%,在另一个示例中至少约45%,并在另一个示例中至少约50%的生物等效性。在一个示例中,脉冲pe剂量可超过少于约75%,在另一个示例中少于约70%,在另一个示例中少于约65%,在另一个示例中少于约60%,在另一个示例中少于约55%,在另一个示例中少于约50%,在另一个示例中少于约40%,在另一个示例中少于约35%,在另一个示例中少于约30%,在另一个示例中少于约25%,在另一个示例中少于约20%,在另一个示例中少于约15%,并且在另一个示例中少于约10%的生物等效性。在另一个示例中,脉冲式pe剂量可超过至少约75%,在另一个示例中至少约100%,在另一个示例中至少约150%,在另一个示例中至少约200%,在另一个示例中至少约250%,在另一个示例中至少约500%,并在另一个示例中至少约750%的生物等效性。
如本文所用,超过的生物等效性可包括一个或多个药代动力学参数(包括未缀合去氧肾上腺素的c最大和/或auc)的显著增大。例如,超过的生物等效性可包括未缀合的去氧肾上腺素的c最大和/或auc增加大于2倍,在另一个示例中增加大于3倍,在另一个示例中增加大于4倍,在另一个示例中增加大于5倍,在另一个示例中增加大于6倍,在另一个示例中增加大于7倍,在另一个示例中增加大于8倍,在另一个示例中增加大于9倍,并且在另一个示例中增加大于10倍。在一个示例中,超过生物等效性的剂型可以是安全和有效的。
该剂型可包含任意形式的立即释放剂量。在一个示例中,立即释放剂量可包衣于立即释放颗粒上。在一个示例中,立即释放剂量不为立即释放颗粒。在另一个示例中,立即释放剂量可为液体。在另一个示例中,立即释放剂量可为液体,并且在另一个示例中,延迟释放颗粒悬浮于液体中。在另一个示例中,立即释放剂量可为组合的形式。
在另一个示例中,立即释放剂量可为独立剂型,例如片剂或液体,并且在一个示例中,立即释放剂型是独立的并且与延迟释放颗粒同时服用。
在另一个示例中,立即释放剂量可为颗粒剂,其包含活性物质和任选的赋形剂(为稳定性和加工起见)。在立即释放颗粒剂中,可将活性物质和赋形剂分散,可以大致均匀地分散在整个颗粒剂中。在一个示例中,颗粒剂不包含包衣。在另一个示例中,颗粒剂不包含活性包衣。
剂型可包含:含有去氧肾上腺素或其盐的立即释放颗粒或其它立即释放形式,以及含有去氧肾上腺素或其盐的延迟释放颗粒。可给药任何药学上可接受的去氧肾上腺素的盐。去氧肾上腺素或其盐的非限制性示例可包括盐酸去氧肾上腺素、酒石酸去氧肾上腺素、鞣酸去氧肾上腺素、以及它们的组合。在一个示例中,剂型可包含盐酸去氧肾上腺素。
除包含去氧肾上腺素之外,剂型可包含除去氧肾上腺素之外的一种或多种药物活性物质。在一个示例中,药物活性物质可为即释型药物活性物质、延释型药物活性物质和/或缓释型药物活性物质。在一个示例中,附加药物活性物质可被配制成颗粒。
在一个示例中,附加药物活性物质为缓解多种症状的(msr)感冒/流感活性物质,其可用于治疗一种或多种感冒/流感症状。msr感冒/流感活性物质可用于治疗多种感冒/流感症状,所述症状包括鼻充血、流涕、打喷嚏、头痛、干咳、喉咙痛、窦压力或疼痛、胸闷、肌肉酸痛/疼痛、湿咳/胸咳、发烧、以及它们的组合。msr感冒/流感活性物质可包括减充血剂、祛痰剂、抗组胺剂、止咳药、镇痛药、以及它们的组合。
祛痰剂的非限制性示例可包括愈创甘油醚、氨溴索、溴己新、以及它们的组合。
组胺剂的非限制性示例可包括氯苯那敏、地氯雷他定、左西替利嗪、苯海拉明、多西拉敏、曲普利啶、氯马斯汀、非尼拉敏、溴苯那敏、右溴苯那敏、氯雷他定、西替利嗪和非索非那丁、氨来呫诺、烷基胺衍生物、可玛林、阿伐斯汀、异丁司特、巴米品、酮替芬、奈多罗米、奥马珠单抗、二甲茚定、奥沙米特、吡嘧司特、吡咯他敏、喷替吉肽、噻苯哌胺、哌香豆司特、托普帕敏、雷马曲班、瑞吡司特、甲磺司特、氨基烷基醚、他扎司特、溴苯海拉明、卡比沙明、曲呫诺、氯苯沙明、二苯拉林、恩布拉敏、对甲基苯海拉明、莫沙斯汀、奥芬那君、苯托沙敏、赛达斯丁、乙二胺衍生物、氯吡拉敏、氯森、美沙吡林、吡拉明、他拉斯丁、西尼二胺、盐酸桑西胺、曲吡那敏、哌嗪、氯环利嗪、氯西尼嗪、高氯环嗪、羟嗪、三环类、吩噻嗪、美喹他嗪、异丙嗪、甲硫噻丙铵、阿扎他定、赛庚啶、地普托品、地氯雷他定、异西喷地、奥洛他定、卢帕他定、安他唑啉、阿司咪唑、氮卓斯汀、贝他斯汀、克立咪唑、依巴斯汀、依美斯汀、依匹斯汀、左卡巴斯汀、美海屈林、咪唑斯汀、苯茚胺、特非那定、曲托喹啉以及它们的组合。
镇咳药的非限制性示例可包括右美沙芬、薄荷醇、可待因、氯苯达诺、左羟丙哌嗪、以及它们的组合。
镇痛药的非限制性示例可包括对乙酰氨基酚、布洛芬、酮洛芬、双氯芬酸、萘普生、阿司匹林、以及它们的组合。
在一个示例中,祛痰剂可为愈创甘油醚,并且在一个示例中,所述剂型可包含200mg的愈创甘油醚。在一个示例中,抗组胺剂可为氯苯那敏,并且在一个示例中,所述剂型可包含125mg的氯苯那敏。在一个示例中,镇咳药可选自右美沙芬、氯苯达诺、以及它们的组合。在一个示例中,所述剂型可包含10mg的右美沙芬,并且在另一个示例中,所述剂型可包含12.5mg的氯苯达诺。在一个示例中,镇痛药可包括对乙酰氨基酚、布洛芬、萘普生或它们的组合。在一个示例中,所述剂型可包含325mg至500mg对乙酰氨基酚,在另一个示例中包含200mg布洛芬,并且在另一个示例中包含200mg萘普生。在一个示例中,感冒/流感剂量单位还可包含兴奋剂诸如咖啡因。
在一个示例中,剂量单位可包含一种或多种msr感冒/流感活性物质,在另一个示例中两种或更多种msr感冒/流感活性物质,在另一个示例中三种或更多种msr感冒/流感活性物质,并且在另一个示例中四种或更多种msr感冒/流感活性物质。在一个示例中,所述剂量单位可包含恰好一种msr感冒/流感活性物质,在另一个示例中恰好两种msr感冒/流感活性物质,在另一个示例中恰好三种msr感冒/流感活性物质,并且在另一个示例中恰好四种msr感冒/流感活性物质。在一个示例中,剂量单位可包含对乙酰氨基酚、右美沙芬、和去氧肾上腺素。
krebs缓冲液溶解法
krebs缓冲液溶解法可被用来使得与在体外消化道中去氧肾上腺素的释放速率近似。测试使用ii型(桨式)溶解装置,如在usp<711>(2013年12月1日)中所述。
装配该装置,然后将500ml的0.1nhcl置于6个容器中的每个容器中。覆盖容器并使得介质平衡至37±0.5℃的温度。向各个容器中放置一个包含延迟释放颗粒的明胶胶囊并开始进行溶解测试。以50转每分钟(rpm)的桨叶速度操作两小时。使用23mm长×8mm宽的不锈钢弹簧式胶囊沉降篮(作为sotaxstylesinker,part#capwst-23从qla,telford,pennsylvania商购获得)来防止胶囊在容器中浮动。
在0.1nhcl中溶解两小时之后,使用与附接有10μm过滤器(购自qla)的不锈钢插管连接的独立的10cc注入器从各个容器中抽出10ml的等分试样样品。将各个经过滤的酸相样品转移到独立的hplc小瓶中进行分析。
然后,立即进行溶解测试的krebs缓冲液阶段。方法的这一部分需要完全的介质交换。将未溶解的颗粒和沉降篮从各个酸相容器小心地转移至包含1000mlph7.4krebs缓冲介质的设备,以进入到六个容器的每个容器中。下表4示出krebs缓冲液的组成。krebs缓冲液在使用时新鲜制得。在开始测试之前,使用连接至二氧化碳气体的供应源的鼓泡管道将每个容器中介质的ph调节至7.40±0.05。将该气体直接曝气到容器中,以使ph降至目标值。还应当在开始测试前将缓冲液平衡至37±0.5℃。贯穿整个测试,在低压下将气体按需曝气到容器中,以将ph维持在7.40±0.05内。通过便携式ph计监测容器内的ph水平。
表4
将装置以50rpm操作多至八小时。采用与附接有10μm过滤器(购自qla)的不锈钢插管连接的独立的10cc注入器,以合适的间隔(即每30分钟)移除10ml的等分试样样品。
然后使用如本文所述的hplc-uv测定,用于测定各个样本等分试样中去氧肾上腺素的溶解百分比值。
hplc溶解测定
该方法适用于对得自krebs缓冲液溶解法的样品等分试样中的去氧肾上腺素进行测定。通过hplc和uv检测对样品进行分析。hplc柱为agilentzorbaxrapidresolution,目录号hp863953-902,sb-c18,3.5μm,4.6×150mm。
首先,制备原液和工作标准溶液。应当在使用时新鲜制备这些溶液。
标准溶液制备
原液(0.2mg/ml)
称取40.00±2mg的去氧肾上腺素参考标准并转移至200ml容量瓶中。添加约20ml的水并且轻轻晃动,或超声波处理(如果必要)以进行溶解。用水稀释至容积并且充分混合。
酸工作标准溶液(0.004mg/ml)
通过将2ml原液添加到100ml容量瓶中,并用0.1nhcl酸性溶解介质定容来以1:50稀释原液。充分混合。
ph7.4工作标准溶液(0.01mg/ml)
通过将5ml原液添加到100ml容量瓶中,并用ph7.4krebs缓冲介质定容来以1:20稀释原液。充分混合。
根据下表5中的色谱条件(chromaticconditions)来设定hplc系统。
表5
当基线稳定时,注入至少一次0.1nhcl空白,之后注入至少一次0.1nhcl工作标准溶液以平衡系统。
在系统平衡之后,注入5次酸工作标准溶液并评估以下系统适用性要求1-3。
接着,注入酸相样品。至少在每第六个酸相样品之后和最后一个酸相样品之后注入标准内插(bracketingstandard)。对于在整个运行中进行的所有酸相标准内插注入,评估以下系统适用性要求4。使用来自于整个运行中进行的所有酸标准注入的总平均峰面积,以计算酸相样品结果。
在完成酸相样品分析之后,继续运行缓冲液相分析。正如酸相分析,必须采用针对相应ph匹配的空白和标准物的离散定量,进行各个缓冲液相分析。首先注入至少一次空白缓冲溶液(ph7.4krebs缓冲液溶解介质)。接着,注入5次相应的ph7.4工作标准溶液,之后进行相应的样品注入。至少在每第六个时和最后一个相应缓冲液样品之后,进行标准内插缓冲液注入。对于在整个运行中进行的所有缓冲液相标准内插注入,评估系统适用性判据4。然后,计算所有缓冲液标准注入的平均峰面积并将其用于以下公式来计算样品结果。
可在运行色谱分离顺序之后计算系统适用性。如果系统适用性结果无法满足对酸工作标准溶液的要求1-3,则必须废弃所有数据(酸和krebs缓冲液)并重复上述顺序。如果标准内插无法满足要求4,则必须废弃利用该标准的对应内插样品,并重复所述分析。
体系适用性要求
1.峰脱尾因子——对于第一可接受的酸标准注入,脱尾因子必须为2.0或更小。
2.峰面积重复性——对于前五次可接受的酸标准注入,峰面积响应的相对标准偏差(rsd)必须为2%或更小。
3.峰保留时间重复性——对于前五次可接受的酸标准注入,峰保留时间的rsd必须为2%或更小。
4.总体标准峰面积重复性——对于在整个运行中进行的所有标准注入(5次初始注入加上标准内插),峰面积的总体rsd%必须为2%或更小。
计算
如果活性物质在酸相期间释放,则必须校正ph7.4缓冲液相的溶解值%,以考虑交换介质期间活性物质的损失。测试的酸相部分(在2小时取样)应当不具有释放的活性物质。溶解值%应当为零。如果不是,则必须将该值加入到所有缓冲液相结果。
光滑度测试方法
光滑度测试方法可用于测定颗粒的圆形度。圆形度通过(4π×([面积])/([周长]2)测定并且范围为0(无限延伸的多边形)至1(完全为圆形)。因此,具有粗糙、粗陋或带尖外观的颗粒相比于具有相同面积的平滑颗粒可具有更大的周长值。因此,可使用所获得的圆形度结果的差异来计算表面拓扑的差异。
用显微镜(nikonoptiphot-2)和设计用于显微镜检查的40x放大倍数(4x放大镜和10x目镜)和数字相机(optixcamsummitocs-10.0)来选择包含待分析的颗粒的视野。在所选择的视野中,颗粒之间应当存在空间。
将图像以可接受的文件格式诸如jpeg存储,并且采用imagej1.49v(在java中图像处理和分析)计算机软件用指向保存文件目录的“文件/打开”菜单打开。
接着,在imagej上调节设置。打开阈值设置面板并选择以下项:方法(默认值),颜色(b&w),以及色彩空间(hsb)。
下一步骤是调整白色背景和黑色颗粒,以确保待研究的图像完全填充在轮廓掩膜内。这在软件程序中采用亮度滑块进行。滑动亮度滑块而在背景中显现出雪(如图10a中)。然后,滑动亮度调整直至背景再次变成白色而无任何雪(如图10b中)。
该图像准备用于测量处理。使用“设定测量”菜单,指定待用于图像的测量。对于该测试,必须检查圆形度和圆度测量的“形状描述符”。然后,使用来自“分析”菜单的“分析颗粒”命令来选择滤器尺寸,以省略将不被包括在测量中的任何小颗粒。这通过选择尺寸(像素^2):500-无穷大来完成。在“分析颗粒”命令中,另外选择显示结果、清除结果(clearresults)、汇总、边缘排除,并且包括孔。边缘排除将不包括图像边缘的任何阈值化颗粒,仅包括全视图内的那些。另外选择显示:“叠层轮廓”来创建具有被加亮的分析颗粒的新图像以便于参考。现在,选择“ok”来分析颗粒。将显示出图像总结报告和初始图像的轮廓叠层。
对每群颗粒重复十次,每次改变视场并计算平均圆形度。
实施例
1,2购自evonikindustries(darmstadt,germany)
实施例1-4可如下制得:首先,用包含溶解于11,115g纯化水的1235.0g盐酸去氧肾上腺素的水性溶液喷涂7000克(g)的
在独立的容器中,使聚山梨酸酯80、柠檬酸三乙酯和单硬脂酸甘油酯在540g的纯化水中混合。通过70℃至80℃的热板来加热聚山梨酸酯80、柠檬酸三乙酯和单硬脂酸甘油酯混合物,并且用螺旋桨式混合器搅拌。在成分溶解之后,将溶液冷却至室温(小于33℃),并且添加纯化水以产生约2000g的溶液。在实施例1中,添加212g的纯化水以使得总溶液的重量为2000g。然后将
在实施例1中,以设定为20-60克/分钟的速度,用附接至流化床柱的校准泵喷涂器将分散体1喷涂到700g的pe-hcl包衣的
对于实施例2、实施例3和实施例4,如上所述,对以上溶解聚山梨酸酯80、柠檬酸三乙酯和单硬脂酸甘油酯的过程进行重复并且然后添加
在实施例2、实施例3和实施例4中,将分散体1和分散体2混合到单个容器中并使用螺旋桨式混合器在室温下搅拌45分钟。用纯化水调节最终体积,以产生约2000g混合的总溶液。然后通过us60目筛网将混合的总溶液过筛到干净的容器中并在室温下储存,并且连续搅拌直至使用。在将其过筛之后,在48小时内使用混合的总溶液。
接着,如上所述,将混合的总溶液喷涂到700g的pe-hcl包衣的
实施例5-15包括立即释放颗粒和延长释放颗粒两者。作为第一步骤,使用批量大小为7000g的
在一分钟干燥步骤之后,然后通过喷涂15%
用5%
使用具有7”wurster的gpcg-5流化床,对其它批的2kg批量大小的密封包衣颗粒进行包肠溶衣,至特定肠聚合物增重(参见前文)。包肠溶衣的分散体如下制备:将水添加至plasacryltmt200中并在具有三叶片式混合器的适当尺寸的混合容器中混合最少10分钟。在混合时,添加
然后用5%
本文所公开的量纲和值不应理解为严格限于所引用的精确数值。相反,除非另外指明,否则每个此类量纲旨在表示所述值以及围绕该值功能上等同的范围。例如,公开为“40mm”的量纲旨在表示“约40mm”。
除非明确排除或限制,将本文引用的每篇文献,包括任何交叉引用或相关专利或专利申请,全文以引用方式并入本文。任何文献的引用不是对其相对于任何本发明所公开的或本文受权利要求书保护的现有技术的认可,或不是对其单独地或以与任何其它参考文献或多个参考文献的组合提出、建议或公开了任何此类发明的认可。因此,所有数值应理解为由术语“约”修饰。此外,如果此文献中术语的任何含义或定义与以引用方式并入本文的文献中相同术语的任何含义或定义相冲突,将以此文献中赋予该术语的含义或定义为准。
虽然已经举例说明和描述了本发明的具体实施方案,但对于本领域的技术人员来讲显而易见的是,在不脱离本发明的实质和范围的情况下可作出各种其它变化和修改。因此,本文旨在于所附权利要求中涵盖属于本发明范围内的所有此类改变和变型。
- 还没有人留言评论。精彩留言会获得点赞!