用于静脉内给药的PI3K/MTOR‑抑制剂的制剂的制作方法
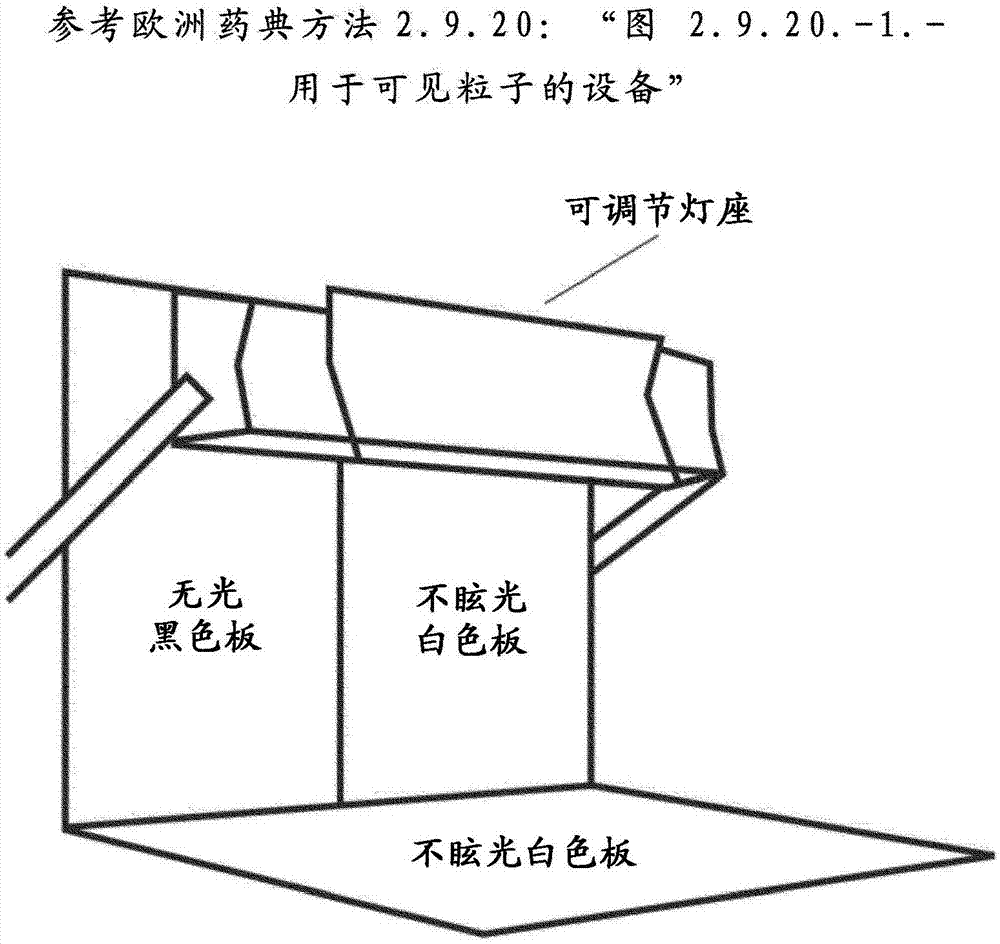
本发明涉及一种药物制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、或其药学上可接受的盐。更特别地,本发明涉及药物水性制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、或其药学上可接受的盐,该药物水性制剂为澄清溶液。这样的制剂特别适于静脉内向患者给药。1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲及其制备公开在wo2009/143313中。该化合物为pi3激酶及mtor的抑制剂,其可用于治疗癌症。1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的结晶形式及其制备方法公开在wo2010/096619中。1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲具有以下化学结构:1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲可制备成结晶形式且在25℃及60%相对湿度(rh)下以此形式化学及物理稳定至多3年。然而,该游离碱的水溶性不足以制备适于静脉内或非经肠给药所需的治疗剂量水平的水溶液制剂。需要开发1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的药学可接受的制剂,其(a)于储存时具有化学稳定性(例如在25℃及60%rh下),和/或(b)将促进该药物有效静脉内(或非经肠)给药至哺乳动物,包括人类。优选地,鉴于1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的特别药物代谢动力学及生物利用度特征,该制剂适于该药物的静脉内给药。重要的是,任何药物的静脉内制剂均为溶液,以促进对患者安全和有效给药。其必须无粒子,且不形成凝胶或悬浮液。优选澄清水溶液。澄清溶液是定义为基本上无任何在目视检查时可观察到的可见微粒的目视澄清溶液。通常,如果观察到任何微粒物质,由于会发生血管阻塞,该制剂不适于静脉内给药且不应使用。因此,鉴于目视测试的定性性质,术语“基本上无任何可见微粒”通常应用于未观察到可见微粒物质时。微粒物质可以定义如下:·斑点-在无放大情况下无法判定其形状的离散粒子·烟或漩涡-看起来像烟或龙卷风的细微粒子,且通常源自样本瓶底部并随该瓶转动而向上盘绕·絮凝材料-松散聚集的粒子或柔软片状物·具有可描述为玻璃状、金属样貌等的确定形状或特征的微粒。该目视检查可根据欧洲药典方法2.9.20标题为“微粒污染:可见粒子(“particulatecontamination:visibleparticles”)”中所定义的方法进行。该方法通过可能存在溶液中的除气泡以外的外来可移动的未溶解粒子来确定注射液及输液的微粒污染。该测试意在提供非经肠溶液关于可见粒子方面的质量的目视评估的简单过程。还可使用其他已验证方法。在欧洲药典方法2.9.20中,设备(见图2中所示的"图2.9.20.-1")包括观察站,其包含:·以垂直位置固持的适当大小的无光黑色板·在该黑色板旁以垂直位置固持的适当大小的不眩光白色板·与合适具阴影的白光源配接且具有合适光漫射器的可调节灯座(包含两个长度各为525mm的13瓦荧光灯管的观看照明器是合适的)。在观察点的照明强度维持在2000勒克斯至3750勒克斯之间,对于彩色玻璃及塑料容器,优选较高值。该方法陈述:“从该容器移除任何粘附标签并洗涤且干燥外部。轻柔转动或倒转该容器,确保不引入气泡,并在白色板前方观察约5秒。在黑色板前方重复该过程。记录任何粒子的存在。”现已意外发现通过以下药物水溶液制剂解决该技术问题,该药物水溶液制剂包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、或其乳酸盐,乳酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以低于6mg/ml的溶液浓度存在,且存在充足乳酸以提供澄清溶液;或1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、或其磷酸盐,正磷酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以低于4mg/ml的溶液浓度存在,且存在充足正磷酸以提供澄清溶液(下文称为“本发明制剂”)。这样的制剂可以静脉内或非经肠方式直接给药至患者(以避免降解发生),优选是添加张力调节剂(tonicitymodifier)。可选地,为了在稍后日子再向患者给药,这种任意地含有填充剂(bulkingagent)和/或张力调节剂的制剂可先冷冻干燥以制备于储存时化学稳定优选至少2年的冻干固体组合物,然后可在通过静脉内(或非经肠)途径向患者给药之前才构成或重构该冻干固体组合物,以提供澄清水溶液,优选视需要添加张力调节剂。已发现使用在2.5至5.5mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的优选浓度下,本发明制剂中所使用的对乳酸或正磷酸的替代酸造成含有微粒物质或胶凝的云雾状制剂,且不会形成供静脉内(或非经肠)向患者给药所需的基本上澄清、无粒子溶液。关于包含乳酸的制剂:·已发现在6mg/ml或更高的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲溶液浓度下,在用于静脉内向患者给药所需的ph下未获得或未一致地获得必要的澄清溶液。·优选是本发明提供药物水溶液制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、乳酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以低于6mg/ml的溶液浓度存在,且存在充足乳酸以提供澄清溶液。·本发明制剂中的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的浓度可为1至5.5mg/ml、2至5.5mg/ml、或3至5.5mg/ml(以所指名的游离碱计算)。·优选地,本发明提供药物水溶液制剂,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以2.5至5.5mg/ml的溶液浓度存在。·优选地,本发明提供药物水溶液制剂,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以约5mg/ml的溶液浓度存在。·优选地,当使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的游离碱时,高于2.5摩尔当量的乳酸存在于本发明制剂中。更优选地,3至10、高于2.5至8.0、或3.5至4.5摩尔当量的乳酸存在于本发明制剂中。最优选地,约4.1摩尔当量的乳酸存在于本发明制剂中。·优选地,当使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的游离碱时,本发明提供药物水溶液制剂,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以5.0至5.5mg/ml的溶液浓度存在,且存在至少2.5摩尔当量的乳酸。·优选地,当使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的游离碱时,本发明提供药物水溶液制剂,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以约5mg/ml的溶液浓度存在,且存在至少2.5摩尔当量的乳酸。·优选地,当使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的游离碱时,本发明提供药物水溶液制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、乳酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以约5mg/ml的溶液浓度存在,且存在至少2.5摩尔当量且足以确保形成澄清溶液的量的乳酸。·应注意的是1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲与乳酸形成1:1(摩尔当量)乳酸盐。本发明制剂可使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲游离碱或使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的乳酸盐制备。当使用乳酸盐时,优选使用高于1.5摩尔当量的乳酸以获得本发明制剂中存在优选下限高于2.5摩尔当量的乳酸。·优选地,本发明提供药物水溶液制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲乳酸盐,乳酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以约5mg/ml的溶液浓度存在,且存在至少1.5摩尔当量且足以确保形成澄清溶液的量的乳酸。·dl-乳酸、d-乳酸或l-乳酸、或其任意组合可用于本发明制剂。优选地,使用dl-乳酸。·优选地,本发明制剂的ph不大于3.7。更优选地,本发明制剂的ph为3.0至3.7、3.3至3.6、或3.4至3.5。·在优选实施方式中,本发明提供药物水溶液制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、乳酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以至多5.5mg/ml的溶液浓度存在,且存在高于2.5摩尔当量且足以确保形成ph不大于3.7的澄清溶液的量的乳酸。·在优选实施方式中,本发明提供药物水溶液制剂,其包含1-(4-([4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、乳酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以约5mg/ml的溶液浓度存在,且存在约4.1摩尔当量且足以确保形成ph不大于3.7的澄清溶液的量的乳酸。·1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式可用用制备本发明制剂。优选地,所使用的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式具有主要峰在约16.2、17.3、18.4、18.9、19.9、20.9及23.1°2θ(+/-0.2°2θ)的pxrd图谱(使用brukerd4衍射仪及铜k-α辐射测量)。该1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式与该盐的其他已知形式的区别在于特征峰在约6.5、15.9、20.9、22.1及23.1°2θ(+/-0.2°2θ)。关于包含正磷酸的制剂:·优选地,本发明提供药物水溶液制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、正磷酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以低于4mg/ml的溶液浓度存在,且存在充足正磷酸以提供澄清溶液。·优选地,本发明提供药物水溶液制剂,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以3.0至3.5mg/ml的溶液浓度存在。·优选地,本发明提供药物水溶液制剂,其中使用至少5摩尔当量的正磷酸。·优选地,本发明提供药物水溶液制剂,其中使用5至7摩尔当量的正磷酸。·在优选实施方式中,本发明提供药物水溶液制剂,其包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、正磷酸及水,其中1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲是以低于4mg/ml的溶液浓度存在,存在5至7摩尔当量且足以确保形成澄清溶液的量的正磷酸。·优选地,所制备的制剂在静脉内给药之前的ph为2至2.5。然后该ph优选调节至3.0至4.5用于静脉内给药。·如果使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的磷酸盐,优选使用正磷酸制备。如果本发明制剂待冷冻干燥以提供冻干固体组合物,优选在冷冻干燥程序开始之前向制剂中添加填充剂。该填充剂的主要功能是提供不溃散的结构完整的冷冻干燥固体,其使得在给药之前构成该水性制剂时能快速重构,且其还应促进有效冻干。通常当在制剂中的溶质总质量少于2g/100ml时使用填充剂。还可添加填充剂以获得与血液的等渗性。该填充剂可以是选自糖类、糖醇、氨基酸或聚合物,或是其任意两种或更多的混合物。优选地,该填充剂为糖或糖醇、或其混合物。优选地,该糖为蔗糖。优选地,该糖醇为甘露醇。冻干固体组合物的重构可通过添加在冻干之前存在的必要量的水而实现,以获得澄清溶液。然后可在使用前添加张力调节剂。冻干固体组合物的构成可通过使用适当量的水和/或合适的张力调节剂的水溶液获得,以确保获得澄清溶液。张力调节剂必须在通过注射将该制剂静脉内或非经肠向患者给药之前存在,以避免红细胞皱缩或溶血,并减缓或避免患者疼痛及不适。这需要待给药至患者的制剂具有与该患者的血液大约相同的有效渗透压。合适的张力调节剂为非离子性张力调节剂,比如甘油、山梨醇、甘露醇、蔗糖、丙二醇或葡萄糖,或其任意两种或更多的混合物。优选该非离子性张力调节剂为葡萄糖、蔗糖或甘露醇,或其任意两种或更多的混合物。适于静脉内给药的水性药学制剂通常具有3至9的ph。待静脉内给药的本发明制剂优选具有3至4.5的ph。本发明制剂可用于哺乳动物,包括人类中癌症的根治疗法、姑息治疗或预防疗法。待治疗的癌症可选自由下列所组成的群组:白血病、皮肤癌、膀胱癌、乳腺癌、子宫癌、卵巢癌、前列腺癌、肺癌、结肠癌、胰腺癌、肾癌、胃癌及脑癌。使用本文所公开的制剂待通过静脉内途径给药用于治疗癌症的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的每周剂量优选在每周100至400mg/ml的范围。以下实施例说明本发明制剂的制备。【实施例】实施例1制备包含5mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲及dl-乳酸的药物水溶液制剂将d,l-乳酸(334mg)溶解于输液用水中以制备总体积为100ml的溶液。将1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(200mg)溶解于37ml的该乳酸溶液中,使用ultraturraxt25(商标)匀浆器混合120分钟,并在超声波浴中超声处理该溶液10分钟。然后使用磁性搅拌器搅拌该混合物过夜以提供澄清溶液。使用容量瓶用乳酸溶液将此补足至40ml体积。在层流(laf)柜中使用0.2μm尼龙过滤器将该溶液过滤至干净的50ml小瓶中。将前5ml的经过滤溶液用于湿润该过滤器,并作为非代表性的经过滤溶液丢弃。使用干净的lyo-塞子及掀起式瓶盖将小瓶压褶并密封。目视检查该溶液并发现其为澄清无色溶液。实施例2制备(a)包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、dl-乳酸及甘露醇的5mg/ml药物水溶液制剂;及(b)制备其冻干固体组合物(a)将36,100g用于注射的水称量入容器。缓慢添加125.82g的dl-乳酸(90.6%纯度,非经肠级)并搅拌该混合物直到乳酸溶解。缓慢添加195.3g的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲并搅拌该混合物直到该材料溶解。逐渐添加1900g的甘露醇粉末(非经肠)并搅拌该混合物直到该材料溶解。添加用于注射的水以将该溶液补足至总重量为38,760g,并再搅拌该溶液10分钟。检查ph并发现为3.4且溶液温度为29.3℃。该溶液是通过在线0.45μm澄清过滤器及0.22μm过滤器组件无菌过滤。然后将该溶液填充至50ml小瓶中,其目标填充体积为每个小瓶20.8ml。将每个小瓶用20mmgraylyod777-1v10-f597wflurotecsiliconised(商标)塞子部分塞住(未密封)。(b)然后将这些小瓶装载入不锈钢托盘中并插入lsl1000(商标)冷冻干燥机。将架温设为5℃。使用下述方法进行冷冻干燥循环。用经无菌过滤的氮反填充该冷冻干燥机至约700毫巴(70,000帕)的设定点,并使用塞子完全封闭这些小瓶。然后使用经无菌过滤的空气将该冷冻干燥机通风至大气压力,并从该冷冻干燥机卸下这些小瓶。每个小瓶含有呈白色固体的冷冻干燥(冻干)制剂。实施例3从冻干固体组合物重构包含1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲、dl-乳酸及甘露醇的5mg/ml药物水溶液制剂将于实施例2(b)中制备的冻干固体组合物样品的小瓶如下重构。将大约25ml用于注射的水置入注射器并将0.2微米的pvdf过滤膜附接至该注射器。经由该膜过滤大约5ml的水并丢弃。然后将留在该注射器中的20ml水过滤至含有如实施例2(b)中制备的冻干固体组合物的50ml小瓶中。在该小瓶中转动该混合物直到获得澄清无色溶液。如下分析该重构的溶液:(a)ph在23.2℃测得该小瓶中溶液的ph为ph=3.52。(b)重构溶液的目视外观使用基于上述欧洲药典方法2.9.20的方法目视检查重构小瓶其中之一。该方法是设计成观察任何可见粒子的存在。通过该方法,在verividedcac60(商标)灯箱中对着无光黑色板及白色板使用3250勒克斯光度计读数,目视检查该小瓶中的溶液。结果显示重构获得澄清无色溶液,其不含微粒物质。(c)亚可见粒子的分析使用hiac设备(商标)通过使用基于美国药典36<788>方法1(“光阻法(lightobscurationparticlecounttest)”)所定义的亚可见微粒测定方法评估小瓶溶液中存在的亚可见粒子。由于usp36<788>方法1对于测试1.b的标准限定了亚可见微粒物质的最广可能接受限度,为了使溶液适于非经肠或静脉内给药,这些结果必须遵从该标准。此测试陈述如下:“测试1.b(用于非经肠输液的溶液或用于注射的溶液供应于名义含量少于100ml的容器中)-如果存在于受试单元中的粒子平均数目为每个容器不超过6000个等于或大于10μm的粒子且每个容器不超过600个等于或大于25μm的粒子,则该制备符合该测试”。通过该方法,首先,合并10个小瓶溶液样本。从该合并溶液移出四个各少于5ml的样本,且就各样本而言,使用hiachrld400(商标)传感器计数等于或大于10μm及25μm的粒子数。略去第一样本所获得的结果。对于剩余三个样本每一个,计算每个容器的粒子平均数并与usp36<788>测试1.b的要求比较。这些样本每个均符合usp36<788>测试1.b对于适于非经肠或静脉内给药的溶液的可接受标准。实施例4制备1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式制备物a:将1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(52mg)称量入2ml小瓶。将22mg/ml的l-乳酸于98:2v/v乙酸乙酯:二甲基甲酰胺(0.5ml)中的溶液添加至该小瓶。该浆液于约23℃搅拌24小时。该浆液然后经过0.2μm尼龙离心过滤器过滤以分离该结晶的标题化合物。使用brukerd4(商标)衍射仪及铜k-α辐射通过pxrd(见下文“研究7”)分析产物,并得到图1所示的图谱。制备物b:将1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(52mg)称量入2ml小瓶。将22mg/ml的l-乳酸于98:2v/v乙酸乙酯:二甲基甲酰胺(0.5ml)中的溶液添加至该小瓶。以5℃/分钟的速率将该浆液加热至60℃,在60℃保持20分钟,然后以0.1℃/分钟冷却至5℃,保持在该温度直到分离(加热步骤开始之后24小时)。该浆液经过0.2μm尼龙离心过滤器过滤以分离该结晶的标题化合物。使用brukerd4衍射仪及铜k-α辐射通过pxrd(见下文“研究7”)分析产物,并得到与图1所示一致的图谱。关于本发明进行以下研究。研究1.关于使用各种酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的3mg/ml水性制剂的研究过程如下制备九个个别酸性缓冲溶液以使得每种酸以约6.8摩尔当量使用(除非其中另有指定):(wfi=输液用水)(*90%w/w于水中的dl-乳酸)针对上述制备的每种酸缓冲液使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的三个约3mg/ml的样本进行稳定性测试。这些样本是如下通过将所需量称量入每一小瓶,使用目标重量为15.45mg的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(因97.1%api活性所致)而制备:缓冲液编号(见上文)n=1n=2n=3115.38mg15.52mg15.35mg215.65mg15.40mg15.28mg315.69mg15.36mg15.47mg415.67mg15.48mg15.41mg515.54mg15.33mg15.58mg615.93mg15.35mg15.50mg715.74mg15.33mg15.33mg815.79mg15.75mg15.33mg915.36mg15.58mg15.42mg1015.33mg15.43mg15.32mg将5ml的各自缓冲液引入小瓶中经称重样本,每个小瓶通过褶皱压紧盖封闭然后用保护膜密封。将小瓶放置于25℃的烘箱中的滚子床上5天。结果在5天期间结束时,测量各样本的ph并使用如欧洲药典方法2.9.20(上述)中所述的灯箱目视观察每一样本,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。在实验过程期间发现有六个小瓶从该滚子掉落,意谓着这些小瓶实际滚动的确切时间未知。这些样本在以下“ph结果”及“目视观察”表中是以星号(*)标记。于25℃下5天之后的ph结果缓冲液编号n=1n=2n=31(柠檬酸)3.023.013.012(琥珀酸)3.143.143.153(乙酸)3.863.873.884(正磷酸)2.012.072.045(甘氨酸)6.456.716.516(酒石酸)2.54*2.37*2.38*7(dl-乳酸)2.91*2.912.918(顺丁烯二酸)1.911.87*1.909(苹果酸)2.712.70*2.7010(dl-乳酸)3.073.213.27于25℃下5天之后样本的目视观察缓冲液编号n=1n=2n=31(柠檬酸)浑浊浑浊浑浊2(琥珀酸)浑浊浑浊浑浊3(乙酸)不呈溶液不呈溶液不呈溶液4(正磷酸)浑浊澄清浑浊5(甘氨酸)不呈溶液不呈溶液不呈溶液6(酒石酸)浑浊*浑浊*浑浊*7(dl-乳酸)澄清*澄清澄清8(顺丁烯二酸)浑浊浑浊*浑浊9(苹果酸)浑浊浑浊*浑浊10(dl-乳酸)澄清澄清澄清结论这些结果显示含有1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲及dl-乳酸的3mg/ml样本在25℃下5天之后获得澄清溶液。所有其他样本除了一个(正磷酸-n=2样本)以外均无法获得澄清溶液。如此,除dl-乳酸及正磷酸以外的酸将不适于制备具有所需api(活性药学成分)浓度的供静脉内向患者给药的药物水溶液制剂。2.关于使用各种酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的3mg/ml及4mg/ml水性制剂的研究过程(a)如下制备四种个别酸性缓冲液溶液用于该3mg/ml制剂,以使用约6.8摩尔当量的个别酸:(wfi=输液用水)针对上述制备的各酸缓冲液使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的三个约3mg/ml的样本进行稳定性测试。这些样本是如下通过将所需量称量入每一小瓶,使用目标重量为15.45mg的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(因97.1%api活性所致)而制备:缓冲液n=1n=2n=3盐酸15.7115.3415.95(d)-乳酸15.5215.4015.50(l)-乳酸15.2215.8015.30正磷酸15.43mg15.50mg15.79mg(b)如下制备个别酸性缓冲液溶液用于该4mg/ml制剂,以使用约5.1摩尔当量的个别酸(除非其中另有指定):(wfi=输液用水)(*90%w/w于水中的dl-乳酸)针对上述制备的各酸缓冲液使用1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的三个约4mg/ml的样本进行稳定性测试。这些样本是如下通过将所需量称量入每一小瓶,使用目标重量为20.60mg的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(因97.1%api活性所致)而制备:缓冲液编号n=1n=2n=3120.5321.0920.71220.7220.5420.87320.5520.7920.43420.9120.9720.81520.0720.7320.59620.9720.2920.14720.9520.6520.45820.9320.2120.81920.2920.2520.481020.3720.6620.501120.9020.1820.521220.5320.4320.751320.7920.6920.441420.5520.8720.55针对上述(a)及(b)二者的制剂,将5ml的个别缓冲液引入小瓶中的经称重样本,且每个小瓶通过褶皱压紧盖封闭并用保护膜密封。将这些小瓶放置于25℃的烘箱中的滚子床上5天。结果在5天期间结束时,测量各样本的ph并使用如欧洲药典方法2.9.20(上述)中所述的灯箱目视观察每一样本,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。于25℃下5天之后的ph3mg/ml缓冲液初始phn=1n=2n=333.3mm盐酸1.511.561.561.5533.3mm(d)-乳酸2.683.143.073.0933.3mm(l)-乳酸2.723.173.133.1433.3mm正磷酸1.872.092.182.184mg/ml缓冲液初始phn=1n=2n=333.3mm柠檬酸2.983.073.093.0833.3mm琥珀酸2.793.193.173.1533.3mm乙酸3.354.074.094.0833.3mm正磷酸1.872.092.062.0533.3mm酒石酸2.282.412.422.4233.3mm盐酸1.511.631.621.6543mm(dl)-乳酸2.533.073.053.043.5mm顺丁烯二酸2.554.704.664.663.5mm苹果酸3.085.145.115.1133.3mm(d)-乳酸2.683.273.313.3433.3mm(l)-乳酸2.723.363.373.3833.3mm(dl)-乳酸2.603.233.233.2833.3mm顺丁烯二酸1.722.032.042.0533.3mm苹果酸2.302.702.742.73于25℃下5天之后样本的目视观察3mg/ml缓冲液n=1n=2n=333.3mm盐酸存在浑浊存在浑浊存在浑浊33.3mm(d)-乳酸澄清澄清澄清33.3mm(l)-乳酸澄清澄清澄清33.3mm正磷酸澄清澄清澄清4mg/ml结论这些结果显示含有1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲及d-乳酸、l-乳酸或dl-乳酸的3mg/ml及4mg/ml样本在25℃5天之后获得澄清溶液。这些结果显示含有1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲及磷酸的3mg/ml样本也在25℃5天之后获得澄清溶液。所有其他样本均无法获得澄清溶液,且除dl-乳酸、d-乳酸、l-乳酸及正磷酸以外的酸将不适于制备具有所需api浓度的供静脉内向患者给药的药物水溶液制剂。3.有关使用dl-乳酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的水性制剂在不同ph及浓度下的研究过程(a)根据下列计算,制备缓冲液溶液,该缓冲液溶液用于制备3mg/ml、5mg/ml、5.5mg/ml、6mg/ml及6.5mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的制剂(wfi=输液用水)(*90%w/w于水中的dl-乳酸)。·3mg/ml:在10ml规模的0.9摩尔当量等于4.39mg的dl-乳酸*于10mlwfi中。(1)·3mg/ml:在10ml规模的2.25摩尔当量等于10.98mg的dl-乳酸*于10mlwfi中。(2)·3mg/ml:在10ml规模的3.7摩尔当量等于17.99mg的dl-乳酸*于10mlwfi中。(3)·5mg/ml:在10ml规模的0.9摩尔当量等于7.32mg的dl-乳酸*于10mlwfi中。(4)·5mg/ml:在10ml规模的2.25摩尔当量等于18.29mg的dl-乳酸*于10mlwfi中。(5)·5mg/ml:在10ml规模的3.7摩尔当量等于30mg的dl-乳酸*于10mlwfi中。(6)·5mg/ml:在10ml规模的7.2摩尔当量等于58.54mg的dl-乳酸*于10mlwfi中。(7)·5mg/ml:在10ml规模的10.8摩尔当量等于87.80mg的dl-乳酸*于10mlwfi中。(8)·5.5mg/ml:在10ml规模的2.25摩尔当量等于20.12mg的dl-乳酸*于10mlwfi中。(9)·5.5mg/ml:在10ml规模的3.7摩尔当量等于33mg的dl-乳酸*于10mlwfi中。(10)·5.5mg/ml:在10ml规模的10.8摩尔当量等于96.58mg的dl-乳酸*于10mlwfi中。(11)·6mg/ml:在10ml规模的3.7摩尔当量等于36mg的dl-乳酸*于10mlwfi中。(12)·6mg/ml:在20ml规模的3.7摩尔当量等于72mg的dl-乳酸*于20mlwfi中。(14)·6.5mg/ml:在10ml规模的3.7摩尔当量等于39mg的dl-乳酸*于10mlwfi中。(13)·6.5mg/ml:在20ml规模的3.7摩尔当量等于78mg的dl-乳酸*于10mlwfi中。(15)在10ml(*于下表中有指明时20ml)的容量瓶中使用wfi,使用以下dl-乳酸重量(**90%w/w于水中的dl-乳酸)制备缓冲液溶液:缓冲液编号重量**(mg)实际摩尔当量ph13.910.83.14212.122.52.86318.163.72.6946.970.92.99519.072.32.68630.803.82.55757.107.02.41887.8210.82.30920.362.32.671033.373.72.5611100.3311.22.271235.933.62.551341.843.92.501470.9*3.62.501578.6*3.72.45(b)将以下量的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的量称量入小瓶(注意1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲具有97.1%的活性,并将针对此活性校正以下目标重量)。将5ml的对应dl-乳酸缓冲液添加至小瓶中的api中,然后将每个小瓶用褶皱压紧盖封闭并用保护膜密封。将样本1至11放置于室温下且为50rpm的滚子床上约21.5小时。将样本12及13放置于室温下且为50rpm的滚子床上约23小时。将样本14及15放置于室温下且为50rpm的滚子床上约25小时。约21.5/23/25小时期间之后的结果在指定滚动期间结束时,测量各样本的ph并使用如欧洲药典方法2.9.20(上述)中所述的灯箱目视观察每一样本,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。ph目视评估进行以下观察:·样本7、8及11显示出在放置于滚子床上2小时内变成溶液·样本6显示出在放置于滚子床上4小时内变成溶液·样本3及10显示出在放置于滚子床上20小时内变成溶液。结论在约24小时期间之后,得出结论:为获得澄清溶液,1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的溶液浓度必须低于6mg/ml且高于2.5摩尔当量的dl-乳酸必须用于该制剂中。然而,上述样本14及15的结果显示,在分别为3.6及3.7摩尔当量的dl-乳酸下,1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的6mg/ml及6.5mg/ml的两种溶液浓度可获得澄清溶液。当与样本12及13的结果比较时,样本14及15的结果反映出如下事实:可能存在其中会形成澄清溶液及非澄清溶液二者的介稳区。72小时期间之后的结果在上述约21.5小时滚动期间之后,将样本1至11贮存在室温下且不再滚动另外的时间,以提供约72小时的总实验期间。观察到一些在起初约21.5小时滚动期间之后不呈溶液的样本在总共72小时期间结束时变成溶液。在上述约25小时滚动期间之后,将样本14至15在室温下滚动贮存另外的时间,以提供约73小时的总实验期间。这些样本是使用如欧洲药典方法2.9.20(上述)中所述的灯箱进行目视评估,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。还测量ph。结果如下:(i)在72小时之后目视评估(ii)比较约24小时及72小时期间之后的ph结果及目视评估结论在总共72小时实验期间之后,可归纳出用5及5.5mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的溶液浓度(其中该制剂中使用至少2.3摩尔当量的dl-乳酸)可获得澄清溶液。使用3mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的溶液浓度(其中该制剂中使用高于2.5摩尔当量的dl-乳酸)也可获得澄清溶液。上述样本14及15的结果显示在分别为3.6及3.7摩尔当量的dl-乳酸下,6mg/ml及6.5mg/ml二个溶液浓度的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲可获得澄清溶液。当与样本12及13的结果比较时,样本14及15的结果反映出如下事实:可能存在其中会形成澄清溶液及非澄清溶液二者的介稳区。4.关于使用6.8摩尔当量的正磷酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的3mg/ml水性制剂的研究过程如下制备约33.3mm的正磷酸水溶液。将0.32569g的正磷酸分配至约80ml的输液用水中。在容量瓶中使用输液用水将其补至100ml体积,且记录ph为1.92。希望3mg/ml浓度的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲而且这必须考虑到97.1%的药效。10ml的规模是据此决定,因此1-(4-([4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的目标重量为30.9mg。使用下列重量于各20ml小瓶中制备三个api样本:n=130.68mgn=231.21mgn=331.04mg使用空气排量移液管(airdisplacementpipette)将上述制备的10ml正磷酸缓冲液分配至各小瓶中。这些小瓶每个都用褶皱压紧盖封闭并用保护膜密封。将这些样本放置于室温下的滚子床上约19小时。这些样本是使用如欧洲药典方法2.9.20(上述)中所述的灯箱进行目视评估,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。还测量ph。结果如下:目视评估最终phn=1澄清2.15n=2澄清2.15n=3澄清2.17稀释虽然通过上述方法已获得澄清、无粒子的溶液,但各样本的ph太低以至于不优选静脉内给药,优选的ph是3至4.5。因此将这3个样本各稀释至0.5mg/ml、0.1mg/ml及0.05mg/ml以鉴别是否ph提高至用于静脉内给药的适当ph。将该经稀释的样本放置于滚子床上过夜以达到平衡状态。还测量ph。这些样本的ph如下:0.5mg/mln=12.64n=22.63n=32.640.1mg/ml0.05mg/mln=13.47n=23.48n=33.49每个样本都是使用欧洲药典方法2.9.20(上述)的灯箱,对着黑色及白色背景检查样本来目视评估。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。观察到各样本为视觉上澄清的溶液。结论该结果显示,可能以6.8摩尔当量的正磷酸配制澄清、无粒子的3mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲水溶液制剂。然而,该制剂或其重构制剂的ph不适于静脉内给药,因此必须随后稀释至低于0.5mg/ml以获得适于静脉内给药的溶液ph。当将这些结果与上述乳酸制剂所获得结果比较时,当使用正磷酸时,可获得的ph及1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲浓度较低。因此,乳酸通常比正磷酸更适于制备根据本发明的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的静脉内给药用水溶液制剂。5.关于使用乙酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的3mg/ml、4mg/ml及5mg/ml水性制剂的研究过程为了制备33.3mm乙酸溶液,将0.2071g的冰醋酸分配至250ml玻璃烧杯中,并添加大约80ml的wfi(输液用水)。添加0.0138g的三水合乙酸钠并溶解成溶液。使用wfi在容量瓶中将该溶液补至100ml体积,且记录ph为3.35。希望三种api浓度(3、4及5mg/ml),其必须考虑api效力为97.1%来校正。根据以下计算确定api重量。·30mg活性为30.9mg1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲·40mg活性为41.2mg1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲·50mg活性为51.49mg1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲将以下重量分配至20ml玻璃小瓶中:3mg/ml4mg/ml5mg/mln=130.86mg41.13mg51.49mgn=230.85mg41.12mg51.55mgn=330.76mg41.21mg51.66mg将上述制备的10ml乙酸缓冲液引入各称重的样本中。将这些小瓶各用褶皱压紧盖封闭并用保护膜密封。将这些样本放置于室温下的滚子床上且使用如欧洲药典方法2.9.20(上述)中所述的灯箱进行目视评估,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。在24小时、48小时、72小时及6天期间进行目视分析。结果在这些24小时、48小时、72小时及6天期间任一时间之后,没有样本获得澄清溶液。样本的ph评估如下:(a)于48小时之后的ph检查缓冲液初始ph=3.35(i)关于3mg/ml样本n=13.88n=23.89n=33.90(ii)关于4mg/ml样本n=13.94n=23.95n=33.95(iii)关于5mg/ml样本n=13.99n=24.00n=34.00(b)于6天之后的ph检查(i)关于3mg/ml样本n=13.99n=23.95n=33.96(ii)关于4mg/ml样本n=14.07n=24.03n=34.04(iii)关于5mg/ml样本n=14.18n=24.18n=34.19结论结果显示,在3、4及5mg/ml浓度下,使用33.3mm乙酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲不会产生澄清溶液。所使用的3mg/ml水性制剂含有约6.8摩尔当量的乙酸。所使用的4mg/ml水性制剂含有约5.1摩尔当量的乙酸。所使用的5mg/ml水性制剂含有约4.1摩尔当量的乙酸。6.关于使用正磷酸的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的3及3.5mg/ml水性制剂的研究如下制备33.3mm的正磷酸水溶液。将0.32767g的正磷酸分配至约75ml的输液用水中。在容量瓶中使用输液用水将其补至100ml体积,且记录ph为1.94。希望1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的3及3.5mg/ml制剂而且此必须考虑到97.1%的药效。所使用的3mg/ml水性制剂含有约6.8摩尔当量的正磷酸。所使用的3.5mg/ml水性制剂含有约5.9摩尔当量的正磷酸。5ml的规模是据此决定,因此制剂的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的目标重量对于3mg/ml为15.5mg,及对于3.5mg/ml制剂为18.0mg。使用下列重量于各20ml小瓶中为每一制剂制备三个样本:3mg/ml3.5mg/mln=115.48mg18.32mgn=216.15mg18.02mgn=315.89mg18.28mg使用空气排量移液管将上述制备的5ml正磷酸缓冲液分配至各小瓶中。将这些小瓶各用褶皱压紧盖封闭并用保护膜密封。将这些样本放置于室温下的滚子床上15小时。这些样本是使用如欧洲药典方法2.9.20(上述)中所述的灯箱进行目视评估,对着黑色及白色背景检查这些样本。该样本还通过使用窄(tyndall)束光源照明测试,然后从与光束垂直的方向目视检查以识别未溶解的固体粒子。观察所有溶液为视觉上澄清的。还测量ph。结果如下(注意,33.3mm正磷酸的进入ph为ph=1.94)3mg/mln=12.02n=22.03n=32.053.5mg/mln=12.09n=22.07n=32.07结论这些结果显示,可能以5.9摩尔当量的正磷酸配制澄清、无粒子的3.0或3.5mg/ml的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲水溶液制剂。然而,ph读数说明会需要稀释以提供容许直接静脉内或非经肠给药这些制剂的适合的ph。当将这些结果与上述乳酸制剂所获得结果比较时,当使用正磷酸时,可获得的ph及1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲浓度较低。因此,乳酸优选用于制备适于静脉内或非经肠给药的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的澄清、无粒子水溶液制剂。7.1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式的特征pxrd分析粉末x射线衍射(pxrd)分析是在brukerd4(商标)衍射仪上使用铜辐射(波长:)进行。管电压及安培数分别设为35kv及40ma。所使用的发散狭缝为v6,且散射狭缝设于0.499mm。使用可变接收狭缝。通过vantec检测器检测衍射的辐射。使用5.4°/min(0.2sec/0.018°步幅)从2.0至55°2θ的θ-2θ连续扫描。分析刚玉标准以检查仪器对准。使用brukeraxs软件收集及分析数据。样本是通过将它们放置于硅片上而制备。使用diffrac.evav3.1软件可视化并评估pxrd光谱。pxrd数据文件(.raw)在峰搜寻之前未经处理。通常,使用阈值1.3及宽度值0.3来进行初步峰指定。目视检查自动化指定的输出以确保有效性并视需要进行人工调节。另外,如果合适,在光谱内人工指定峰。从该列表手动移除关于封固剂的在28.1°2θ的峰。使用bragg-brentano几何形状在用于本发明所报告的测量的bruker仪器上以进行x射线衍射测量,样本通常是放置在平坦硅板上。通过载玻片或等效物加压样本粉末以确保随机表面及适当的样本高度。然后将该样本托座放置入该仪器中。将入射x射线束导引在该样本,相对该托座的平面初始为小角度,然后移动通过在该入射光束与该托座平面之间的角度连续增大的弧。与这些x射线粉末分析相关的测量差异由各种因素造成,包括:(a)样本制备中的误差(例如样本高度),(b)仪器误差(例如平坦样本误差),(c)校正误差,(d)操作者误差(包括确定峰位置时存在的误差),及(e)材料性质(例如优选定向及透明度误差)。校正误差及样本高度误差经常在所有峰沿相同方向移动时产生。使用平坦托座时样本高度小幅差异将会导致pxrd峰位置大幅位移。系统研究显示,在典型bragg-brentano构造使用shimadzuxrd-6000,1mm的样本高度差导致峰偏移至多1°2θ(chen等人;jpharmaceuticalandbiomedicalanalysis,2001;26,63)。这些偏移可从x射线衍射图辨识,且可通过补偿该偏移(将系统校正因子应用至所有峰位置值)或重校正该仪器消除。如上所述,通过应用系统校正因子使峰位置一致,可能矫正来自各种不同机器的测量。通常,该校正因子将使来自bruker测量的峰位置与预期的峰位置一致,及可在0至0.2°2θ的范围。实施例4制备物a的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式的pxrd图谱提供于图1,且其特征在于,在使用铜k-α(cukα)辐射的brukerd4衍射仪上测量的以°2θ(+/-0.2°2θ)及相对强度(≥2.5%)表示的下列峰列表:(*相对强度可能依赖于晶体大小及形态改变)该1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲l-乳酸盐的结晶形式与该盐的其他已知(半结晶)形式的区别在于,具有在约6.5、15.9、20.9、22.1及23.1°2θ(+/-0.2°2θ)的特征峰。7.本发明冻干固体制剂的化学稳定性分析在50ml澄清小瓶中的根据实施例2的方法制备的冻干固体制剂的样本,在25℃/60%相对湿度(rh)及40℃/75%rh下贮存之后在各种不同时间点的化学降解。针对每一条件评估几个样本以承认在所选定时间点的代表性结果。在6个月之后测试这些40℃/75%rh样本。在6个月、12个月、24个月及36个月之后测试这些25℃/60%rh样本。使用高效液相色谱法(hplc)使用以下方法以测量在测试期间的任何降解来测试样本的化学纯度。hplc方法用于hplc方法的溶液、样本及标准是如下制备的:·参考标准:具有已知效力值的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲·稀释剂:乙腈/水(1:1v/v)。·流动相a:10mm水性碳酸氢铵缓冲液溶液,用氢氧化铵水溶液将ph调节至9.8。·流动相b:乙腈·样本溶剂:将3ml的0.1n水性盐酸添加至1000ml容量瓶并用稀释剂(乙腈/水,1:1v/v)稀释至设定体积。充分混合。注意:使用适当组分比可制备较大或较小体积的溶液。标准及检查标准制备物:·精确地制备两个约2mg/ml(+/-10%)的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲参考标准在样本溶剂中的溶液,并精确地记录二者浓度。这些为标准及检查标准溶液。通过使用该稀释剂将这些溶液精确地稀释至约2μg/ml浓度的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲来生产标准及检查标准制备物。灵敏度溶液:·使用该稀释剂将该标准制备物精确地稀释至大约0.06μg/ml浓度的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲。样本制备物:·通过向每个小瓶中添加20ml水,摇晃小瓶以溶解该固体并等待气泡消失来重构1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲的两个冻干固体制剂小瓶(根据实施例2的方法制备)。将该溶液转移至1000ml容量瓶。用稀释剂清洗各小瓶至少两次,并将清洗液转移至该容量瓶。用稀释剂稀释至设定体积。色谱条件:·液相色谱系统–例如,waters2695(商标)或agilent1100(商标)机器·柱:watersxbridgec18(商标),15cmx4.6mm,3.5μm或等效物·柱温:40℃·注射体积:20μl·流速:1.0ml/min·检测:303nm的uv·运行时间:60分钟·流动相a·流动相b·线性梯度表:时间(分钟)%流动相a%流动相b09010375050471090521090539010609010附注通过将流动相b泵送通过柱直到获得稳定基线(此通常费时约30分钟)来准备hplc机器。在运行注射顺序之前,用流动相a再平衡该色谱系统(通常10至15分钟)。在运行样本之前,确保该系统适于使用上述色谱条件的注射空白稀释剂、灵敏度溶液及标准制备物。在初始hplc设定或在该系统有任何重大改变之后必须满足以下标准。建议在测试系统适用性之前注射至少一种调节空白(conditioningblank)。*使用所有系统适用性(重现性)注射的平均值。**参考美国药典(usp)的效率及峰不对称性的计算方程式。注射根据上述色谱条件的检查标准制备物。该检查标准制备物的反应因子(从该标准的面积、标准重量、稀释因子及纯度因子计算)必须在该标准制备物的±5%内。在证明系统适用性之后,根据上述色谱条件,注射该空白溶液、标准制备物及所制备的测试样本,然后注射该标准制备物。建议在标准制备物注射之间注射不超过6个测试样本。对于每一注射(标准及样本),测量各色谱图中的1-(4-{[4-(二甲氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲峰的保留时间和面积。对于每一样本注射,还测量在样本注射中所存在的空白注射中不会出现的任何峰的保留时间和峰面积。如果存在梯度的伪影,则不整合。比较该空白注射色谱图与样本色谱图来确定该样本中的哪个峰与该空白及梯度的伪影峰相关。计算降解物的%并报告在0.05%或高于0.05%的个别降解物峰。未知的降解物应以其相对保留时间个别报告。已知的降解物应以名称个别报告。结果汇总于下表。关键词·nmt=不超过。·nr=未报告。·rrt=相对保留时间·所有%均为w/w降解物1降解物2降解物3、4、5及6这些各自仅以它们的rrt表征。·识别出降解物3、5及6为程序相关杂质,其不改变稳定性,因此在36个月时间点时未报告。结论结果显示,根据实施例2的方法制备的冻干固体制剂在50ml澄清小瓶中的样本在25℃/60%rh下至少36个月及在40℃/75%rh下至少6个月是化学稳定性的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1