促进骨再生的活性支架材料、其制备方法及应用与流程
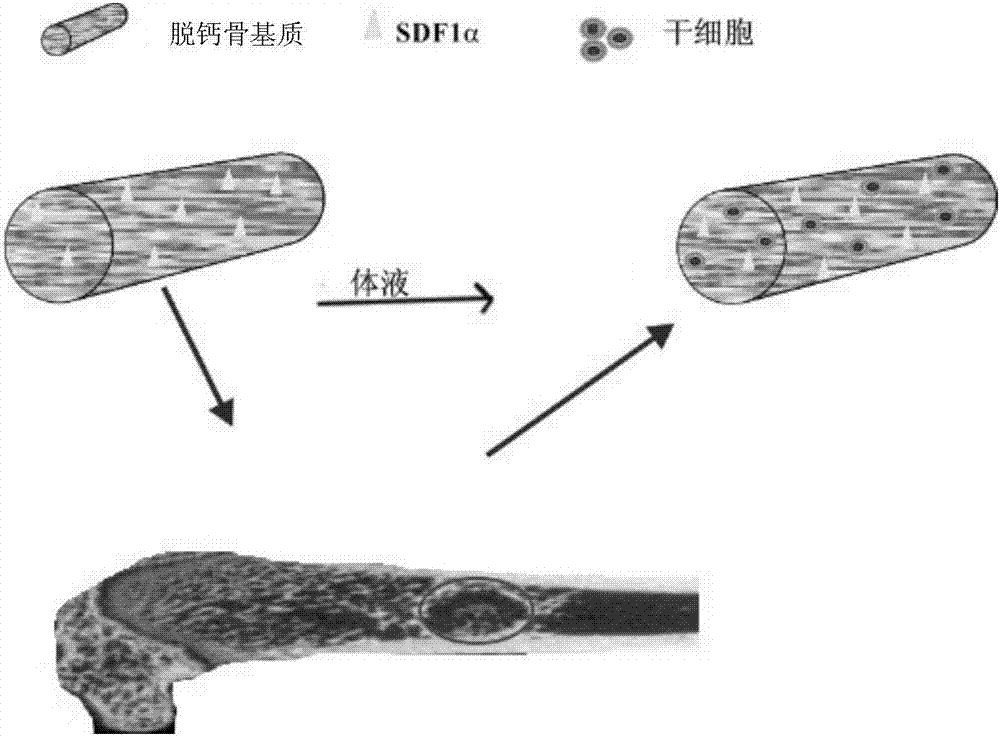
本发明涉及一种生物支架材料,具体涉及一种具有胶原结合区的基质细胞衍生因子修饰的脱钙骨基质支架材料、其制备方法及应用,属于生物医学材料领域。
背景技术:
骨组织是少数几个具有自我再生能力的组织器官之一,这种再生能力不仅伴随着个体的骨骼发育以及骨组织损伤修复过程,甚至在个体成熟后仍然可以有效的工作。然而,当大面积的骨损伤发生时,骨组织就无法利用本身的再生能力进行修复愈合。目前骨组织损伤后的重建主要依赖于移植治疗,但会带来多种并发症以及产生免疫排斥反应。在临床治疗中,自体骨移植是比较理想的方法,但该方法也有许多的缺点,例如并发症患病率高,需要多个手术位点和有限的自体骨组织。为了避免这些缺点,许多种材料如金属、塑料和化学分子聚合物等被用作为骨替代物,但是这些骨替代物材料都无法促进内源性骨再生,甚至可能引起免疫排斥反应,会对患者造成二次伤害。
在骨损伤修复和新骨生成过程中,富含缓慢释放生物活性因子的生物活性支架材料具有至关重要的作用。利用修饰了趋化因子的生物支架材料可以促进新骨的生成和骨组织损伤处的修复。近年来研究发现基质细胞衍化生长因子1α(sdf1α,又称为cxcl12)可以有效的募集间充质干细胞、造血干细胞等到骨损伤处。而研究表明在一定的微环境下,间充质干细胞可以分化为成骨细胞,促进骨损伤的修复。
但是,天然的基质细胞衍生因子在体内维持的浓度较低,并且容易弥散。若利用化学交联等方法将其交联到支架材料上虽然会提高sdf1α的局部浓度,但也会引入有毒或有害的化学交联分子进入体内。
因此,研究具有生物活性因子的生物支架材料作为骨替代物是亟待解决的难题,而如何在体内控制生物活性因子的缓慢释放、降低骨损伤移植的免疫排斥反应是另一个难题。
技术实现要素:
本发明的主要目的在于提供一种促进骨再生的活性支架材料、其制备方法及应用,以克服现有技术的不足。
为了实现上述目的,本发明的技术方案如下:
本发明实施例提供了一种促进骨再生的脱钙骨基质支架材料,其包括:
趋化因子;
负载所述趋化因子的脱钙骨基质,所述脱钙骨基质具有疏松孔状内部结构,并主要由具有空间网状结构的胶原分子组成;
其中,所述趋化因子以共价键或者非共价键方式与所述脱钙骨基质中的胶原分子结合。
进一步的,所述趋化因子包括基质细胞衍生因子(sdf1α)。
尤其优选的,所述趋化因子还包括与所述基质细胞衍生因子连接的胶原结合区。
即,所述趋化因子选自具有胶原结合区(cbd)的基质细胞衍生因子(cbd-sdf1α)
进一步的,所述趋化因子以其胶原结合区与所述脱钙骨基质中的胶原分子结合。
本发明实施例还提供了制备所述的促进骨再生的脱钙骨基质支架材料的方法,其包括:
提供具有疏松孔状内部结构的脱钙骨基质;
使所述脱钙骨基质与趋化因子溶液接触,从而使所述脱钙骨基质负载趋化因子,形成所述脱钙骨基质支架材料。
进一步的,所述的制备方法包括:采用点基因融合表达的方法将胶原结合区结合至基质细胞衍生因子上,从而形成所述趋化因子。
本发明实施例还提供了所述的促进骨再生的脱钙骨基质支架材料的用途。
与现有技术相比,本发明通过将胶原结合区与基质细胞衍生因子融合表达,从而获得的具有胶原结合区的基质细胞衍生因子(cbd-sdf1α),该具有胶原结合区的基质细胞衍生因子不仅可与胶原分子结合,且具有天然(nat-sdf1α)的生物活性,引入的胶原结合区是一个可与胶原分子结合的小分子肽段,具有良好的生物相容性和生物可降解性;进而,采用具有胶原结合区的基质细胞衍生因子修饰脱钙骨基质而形成的生物活性支架材料缓慢释放生物活性因子的稳定性好,极大的提高了损伤处趋化分子的局部浓度,可迅速的动员体内的干细胞到骨损伤处,同时释放持续时间长,而且此生物活性支架材料具有疏松孔状的内部构造可以提供细胞粘附、生长、分化的环境,同时此生物活性支架材料整体又具有一定的硬度,可以在移植早期局部代替骨支撑身体的作用。
附图说明
为了更清楚地说明本发明结构特征和技术要点,下面结合附图和具体实施方式对本发明进行详细说明。
图1为本发明实施例1中一种sdf1α修饰的脱钙骨基质支架材料的制备工艺原理图;
图2a-2b分别为本发明实施例1中一种具有疏松孔状的内部结构的脱钙骨基质的宏观及微观结构示意图;
图3为本发明实施例1中一种sdf1α修饰的脱钙骨基质支架材料缓慢释放sdf1α的统计图;
图4a-4b为本发明实施例1中一种sdf1α修饰的脱钙骨基质支架材料用于大鼠股骨损伤移植的照片;
图5a为本发明实施例1中利用cd34及c-kit免疫荧光染色显示sdf1α修饰的脱钙骨基质支架材料在体内募集干细胞情况的荧光显微照片;
图5b为本发明实施例1中一种sdf1α修饰的脱钙骨基质支架材募集干细胞数量的统计图;
图6a为本发明实施例1中一种sdf1α修饰的脱钙骨基质支架材料移植4周后的骨矿化密度值的统计结果的示意图;
图6b为本发明实施例1中一种sdf1α修饰的脱钙骨基质支架材料移植8周后的骨矿化密度值的统计结果的示意图;
图7a为本发明实施例2中一种cbd-sdf1α修饰的脱钙骨基质支架材料的制备工艺原理图;
图7b为本发明实施例2中一种脱钙骨基质支架材料缓慢释放细胞因子的统计图;
图7c为本发明实施例2中一种脱钙骨基质支架材料可以为细胞的生长提供良好的微环境的sem图,其中*p<0.05,**p<0.01;
图8a为本发明实施例2中脱钙骨基质在矿化液中逐步被矿化的sem图;
图8b为本发明实施例中矿化后的脱钙骨基质材料的元素分析统计图;
图9a为本发明实施例2中反映cbd-sdf1α和nat-sdf1α具有相同的生物活性的结晶紫染色图;
图9b为本发明实施例2中反映cbd-sdf1α和nat-sdf1α具有相同的生物活性的结晶紫染色统计图;
图10a为本发明实施例2中cbd-sdf1α修饰的脱钙骨基质支架材料用于大鼠股骨损伤移植的照片(大鼠股骨缺损模型的建立);
图10b为本发明实施例2中microct的二体积分析法的示意图;
图10c为本发明实施例2中修饰了cbd-sdf-1α的脱钙骨基质在体内短期募集干细胞的情况的荧光显微照片;
图10d为本发明实施例中修饰了cbd-sdf-1α的脱钙骨基质在体内短期募集干细胞的统计结果图,*p<0.05;
图11a为本发明实施例中大鼠股骨样品的ct扫描轴状图;
图11b为本发明实施例中大鼠股骨样品的ct扫描冠状图;
图12a为本发明实施例中h&e染色的样品在50倍放大镜下的观察图;
图12b为本发明实施例中h&e染色样品在200倍放大镜下的观察图;
图12c为本发明实施例中masson染色的样品在50倍放大镜下的观察图;
图12d为本发明实施例中骨组织样品中成骨细胞的统计图;
图12e为本发明实施例中骨组织样品中破骨细胞的统计图,其中黑色的尖箭头指示的是破骨细胞,黑色钝箭头指示的是成骨细胞,*p<0.05,**p<0.01,***p<0.001;
图13a为本发明实施例中移植治疗4周后的骨组织样品的opg染色图;
图13b为本发明实施例中移植治疗4周后骨组织样品的opn染色分析图;
图13c为本发明实施例中移植治疗12周后骨组织样品的ocn染色分析图,其中黑色箭头指示的是褐色的阳性染色区域;
图14a为本发明实施例中移植治疗4周的股骨缺损处活体ct扫描冠状图;
图14b为本发明实施例中移植治疗8周的股骨缺损处活体ct扫描冠状图;
图14c为本发明实施例中移植治疗4周的股骨缺损处(v1及v2)骨矿化密度值统计图;
图14d为本发明实施例中移植治疗8周的股骨缺损处(v1及v2)骨矿化密度值统计图;
图14e为本发明实施例中移植治疗4周的股骨缺损处(v1)新生骨体积值统计图;
图14f为本发明实施例中移植治疗4周的股骨缺损处(v2)新生骨体积值统计图,*p<0.05,**p<0.01,***p<0.001;
图15a为本发明实施例中三点弯曲实验示意图;
图15b为本发明实施例中移植治疗4周的股骨样品三点弯曲测试结果统计图;
图15c为本发明实施例中移植治疗8周的股骨样品三点弯曲测试结统计图;
图15d为本发明实施例中移植治疗12周的股骨样品三点弯曲测试结果统计图,其中*p<0.05,**p<0.01,***p<0.001。
具体实施方式
以下将结合附图及较佳实施例对本发明的技术方案作进一步的说明:
本发明实施例提供的一种促进骨再生的脱钙骨基质支架材料包括:
趋化因子;
负载所述趋化因子的脱钙骨基质,所述脱钙骨基质具有疏松孔状内部结构,并主要由具有空间网状结构的胶原分子组成;
其中,所述趋化因子以共价键或者非共价键方式与所述脱钙骨基质中的胶原分子结合。
进一步的,所述趋化因子包括基质细胞衍生因子。
优选的,所述趋化因子还包括与所述基质细胞衍生因子连接的胶原结合区。
进一步的,所述趋化因子以其胶原结合区与所述脱钙骨基质中的胶原分子结合。
进一步的,所述脱钙骨基质内的至少部分孔洞中修饰有所述趋化因子。
本发明提供的修饰了具有胶原结合能力的基质细胞衍生因子的脱钙骨基质支架材料,即前述的脱钙骨基质支架材料可以通过募集內源间充质干细胞来促进新骨生成,并可用于体内移植治疗。
将修饰具有胶原结合能力的基质细胞衍生因子的脱钙骨基质生物活性支架材料作为骨移植替代物移植到大鼠股骨损伤处可动员内源干细胞到损伤部位。术后检查其恢复情况可发现,这种生物活性的支架材料促进新骨的生成及骨组织功能的恢复。
本发明具有显著优点:本发明提供的复合趋化因子的脱钙骨基质支架材料缓慢释放生物活性因子的稳定性好,极大的提高了损伤处趋化分子的局部浓度,可迅速的动员体内的干细胞到骨损伤处,同时释放持续时间长;另外,此复合的生物活性支架材料具有疏松孔状的内部构造可以提供细胞粘附、生长、分化的环境。而生物活性支架材料整体又具有一定的硬度,可以在移植早期局部代替骨支撑身体的作用。
本发明实施例提供的一种制备所述的促进骨再生的脱钙骨基质支架材料的制备方法包括:
提供具有疏松孔状内部结构的脱钙骨基质;
使所述脱钙骨基质与趋化因子溶液接触,从而使所述脱钙骨基质负载趋化因子,形成所述脱钙骨基质支架材料。
进一步的,所述的制备方法包括:采用点基因融合表达的方法将胶原结合区结合至基质细胞衍生因子上,从而形成所述趋化因子。
进一步的,所述的制备方法包括:将所述趋化因子溶液缓慢施加在所述脱钙骨基质上,从而使所述脱钙骨基质负载趋化因子。
进一步的,所述趋化因子溶液的浓度在10nm以上。
进一步的,所述的制备方法包括:提供异体来源的长骨骨组织,先剪切成合适大小,然后在有机溶剂中充分浸泡,去除骨组织表面的杂质,之后以水充分清洗,再以盐酸溶液处理脱钙,最后以水清洗、冻干、辐射灭菌,获得脱钙骨基质,备用。
进一步的,所述有机溶剂可采用丙酮,但不限于此。
较为优选的,所述盐酸溶液的浓度可以为0.6mol/l。
进一步的,所述的制备方法包括:在无菌条件下,将趋化因子溶于磷酸盐缓冲液中而形成所述趋化因子溶液,之后将所述趋化因子溶液逐滴、多点地滴加到所述脱钙骨基质上,并在37℃孵育30min以上,使趋化因子被修饰到所述脱钙骨基质上,形成所述脱钙骨基质支架材料。
本发明可采用酸碱的方法制备脱钙骨基质,使得获得的脱钙骨基质具有疏松孔状的内部结构、具有一定的硬度同时也极大的降低了免疫原性。同时还可采用点基因融合表达的方法获得具有胶原结合能力的基质细胞衍生因子(cbd-sdf1α),进而实现了趋化因子的生物活性的保存和与脱钙骨基质材料的有效结合。同时,所述cbd-sdf1α不仅可与胶原分子结合并且具有天然(nat-sdf1α)的生物活性,而且引入胶原结合区是可与胶原分子结合的小分子肽段,具有良好的生物相容性和生物可降解性。
相应的,本发明实施例还提供了所述的促进骨再生的脱钙骨基质支架材料于制备活性支架材料中的用途,所述活性支架材料至少能够通过募集内源性干细胞而促进骨再生。
相应的,本发明实施例还提供了所述的促进骨再生的脱钙骨基质支架材料在制备骨缺损移植治疗产品中的用途。
如下结合附图和若干实施例对该技术方案、其实施过程及原理等作进一步的解释说明。
实施例1
(一)修饰趋化因子的脱钙骨基质支架材料的制备方法
1)首先,利用业界已知的基因工程方法构建趋化因子的大肠杆菌表达载体,纯化表达出高纯度的趋化因子,其中趋化因子采用sdf1α;
2)其次,利用酸碱的方法处理脱钙骨基质材料,具体的,提供异体来源的长骨骨组织,先剪切成合适大小,然后在丙酮中处理48小时去除表面的软组织、脂肪等物质,随后用双蒸水清洗数次再用0.6mhci溶液处理脱钙,最后双蒸水清洗后冻干;再辐照灭菌后备用,获得的脱钙骨基质具有疏松孔状的内部结构(如图2a-图2b所示),可以提供细胞粘附、生长、分化的环境,而脱钙骨基质支架材料整体又具有一定的硬度,可以在移植早期局部代替骨支撑身体的作用;
3)最后,在无菌条件下,用20μl的pbs溶解10nm的sdf1α,再逐滴、多点地滴加到剪切好的脱钙骨基质材料上,注意此步操作时要缓慢,从而保证生物活性因子sdf1α充分的负载到脱钙骨基质支架材料上,参阅图1展示了sdf1α修饰到脱钙骨基质支架材料的情况。
(二)修饰趋化因子的脱钙骨基质支架材料缓慢释放趋化因子的检测方法
1)在无菌条件下,选取一个48孔板,在每个孔内均放置一块sdf1α修饰的脱钙骨基质支架材料,并在每个孔内添加500μl的pbs;
2)将48孔板放入水平转速为150转/分钟的小摇床上,再整体放入到温度恒定为37℃的恒温培养箱中,每隔12小时更换一次pbs溶液,并且每次收取更换掉的溶液冻存于-20℃冰箱中,一直延续此动作至84小时;
3)利用sdf的elisa试剂盒检测收集的冻存的溶液中的sdf1α的含量,如图3所示,体现了sdf1α修饰的脱钙骨基质支架材料缓慢释放sdf1α的情况,从图中可以看出,sdf1α从脱钙骨基质支架材料上的释放是一个均匀的、缓慢的过程,一直到测试开始的84小时后,sdf1α在脱钙骨基质支架材料上的浓度仍然维持在一个相对较高的水平上(30%以上)。
(三)sdf1α修饰的脱钙骨基质支架材料在大鼠体内短期募集干细胞的表征
1)首先,构建一个大鼠股骨损伤的模型,如图4a展示了,大鼠股骨滑车处手术处理形成一个3×3mm的缺损;
2)然后,将sdf1α修饰的脱钙骨基质支架材料填充到骨损伤部位(如图4b),移植手术三天后,用4%的戊巴比妥钠腹腔注射麻醉大鼠处死,而后取出移植的sdf1α修饰的脱钙骨基质支架材料。
3)将取出的sdf1α修饰的脱钙骨基质支架材料包埋后进行冰冻切片,选取cd34和c-kit作为干细胞的标记,进行染色处理,利用dapi进行细胞核染色,所有染色处理完成后在激光共聚焦显微镜下观察cd34和c-kit阳性细胞的数量。
4)设计三个实验组:对照组、dbm材料组(脱钙骨基质支架材料组)及sdf1α修饰的dbm支架材料组。在图5a的共聚焦图片中可以看出,sdf1α修饰的dbm支架材料组可以募集到更多的干细胞,而在图5b的统计图中也可以表明sdf1α修饰的dbm支架材料组的募集细胞数量更多,这在骨移植治疗中更有利于新骨的生成。
(四)sdf1α修饰的脱钙骨基质支架材料移植后骨损伤恢复的表征
在移植手术进行之后,依赖microct的技术,可以检测到骨的矿化程度,新骨生成的情况以及直观的看到松质骨愈合情况。在移植手术进行4周、8周后分别进行了microct的检测。图6a、6b展示了移植手术进行4周、8周后各个实验组的骨矿化密度值的统计,其清晰地表明在相同的恢复时间内,sdf1α修饰的dbm支架材料组的骨矿化密度值更高,且相对其他有显著性差异。
实施例2
1.cbd-sdf1α修饰的脱钙骨基质支架材料的制备及宏观、微观结构的表征
首先,利用基因工程的方法构建cbd-sdf1α/nat-sdf1α的大肠杆菌表达载体,纯化表达出高纯度的cbd-sdf1α/nat-sdf1α。其次,是利用酸碱的方法获得脱钙骨基质材料(dmb支架),辐照灭菌后备用(与实施例1相同,形貌可参阅图2a-图2b)。无菌条件下,用20μl的pbs溶解10nm的cbd-sdf1α/nat-sdf1α,逐滴、多点地滴加到剪切好的材料上,注意此步操作时要缓慢,保证生物活性因子充分的负载到脱钙骨基质支架材料上,如图7a展示了cbd-sdf1α/nat-sdf1α负载到脱钙骨基质支架材料的情况。
2.cbd-sdf1α修饰的脱钙骨基质支架材料缓慢释放的表征
制备含有10nm的cbd-sdf1α/nat-sdf1α的脱钙骨基质支架材料,检测在模拟体内条件下,这种具有生物活性因子的支架材料缓慢释放生物活性因子cbd-sdf1α/nat-sdf1α的能力。无菌条件下,选取一个48孔板,在每个孔都放置一块含有cbd-sdf1α/nat-sdf1α的dbm支架材料,然后每个孔都添加500μl的pbs。将48孔板放入水平转速为150转/分钟的小摇床上,再整体放入到温度恒定为37℃的恒温培养箱中。每12小时换一次pbs,收取的液体冻存于-20℃的冰箱中,一直检测到84小时。然后利用sdf1α的elisa试剂盒检测收集的样品中sdf1α的含量。图7b展示了cbd-sdf1α/nat-sdf1α修饰的脱钙骨基质支架材料缓慢释放cbd-sdf1α的情况。在统计的图中可以看到,cbd-sdf1α从脱钙骨基质上的释放是一个均匀的、缓慢的过程。一直到释放实验开始的84小时后,cbd-sdf1α在脱钙骨基质支架材料上的浓度仍然维持在一个相对较高的水平上(30%)。而nat-sdf1α在释放实验12小时后快速被释放,到36小时其浓度仅为初始值的一半左右。
3.脱钙骨基质支架材料培养间充质干细胞的表征
检测人脐带间充质干细胞在脱钙骨基质材料上的生长情况具体是将含有间充质干细胞的细胞悬液逐滴滴加到脱钙骨基质支架材料上,置于37℃恒温的5%co2细胞培养箱中培养。细胞培养2-3天后,将含有间充质干细胞的脱钙骨基质材料浸没于4%的多聚甲醛中于室温条件下固定2小时。对固定后的样品采用梯度浓度酒精进行脱水处理,最后置于真空干燥箱中干燥处理3小时。图7c展示的为场发射扫描电子显微镜观察下的间充质干细胞可以在脱钙骨基质材料上的很好的粘附和生长。
4.脱钙骨基质支架材料矿化活性的分析
本研究采用10倍浓度的模拟体液(10×sbf)作为研究脱钙骨基质材料矿化活性的矿化液。在矿化实验前,利用nahco3调节10×sbf的ph到6.5,然后将脱钙骨基质材料完全浸没在矿化液中,分别于1,2,3小时取出脱钙骨基质材料。将矿化后的材料进行梯度浓度的酒精脱水处理,然后置于真空干燥箱内干燥处理3小时,最后利用场发射扫描电子显微镜观察。如图8a和图8b,脱钙骨基质材料可以很好的被矿化,矿化实验3小时基本可以将材料完全矿化。元素分析的统计结果表明,在矿化实验中,材料中的钙离子浓度逐渐提高,材料表面被逐步的矿化。
5.cbd-sdf1α和nat-sdf1α活性比较
采用boyden小室的方法对cbd-sdf1α和nat-sdf1α活性进行比较。首先,在48孔板的每个孔中分别加入600μl含有500ng的cbd-sdf1α/nat-sdf1α的细胞培养基,然后把小室放入到24孔板中并向小室上部加入200μl细胞浓度为1×106个/ml间充质干细胞的悬液。然后将24孔板放入细胞培养箱中培养12小时,取出小室。将小室的内部用棉签擦拭干净后浸没于4%的多聚甲醛固定1小时,最后对小室进行结晶紫染色。染色的结果可通过光学显微镜观察,如图9a所示。在相同的实验条件下,cbd-sdf1α和nat-sdf1α组诱导迁移的细胞数量相当。随机选取5个视野统计迁移的细胞获得细胞迁移率如图9b,进一步验证了cbd-sdf1α和nat-sdf1α组诱导迁移的细胞能力相似,不存在统计学差异。
6.构建大鼠股骨损伤模型及microct分析方法
建立大鼠股骨缺损模型如图10a-10d所示。首先采用腹腔注射戊巴比妥钠溶液(50mg/kg)的方法对实验大鼠进行麻醉。然后选取大鼠股骨的远端、滑车正对下方作为手术的位点,造成一个3×3的骨缺损模型,最后移植修饰了具有胶原结合区的基质细胞衍生因子的脱钙骨基质材料并将打开的伤口进行缝合处理。在建模一周后,采用ct活性扫描的方法检测建模是否成功。如图11a-图11b所示,在大鼠股骨缺损模型造模一周后,无处理的对照组ct扫描显示并未有新生骨的生成,骨缺损的尺寸基本没变化。
为了全面细致的分析骨缺损的ct扫描数据,本研究采用两体积分析的方法。如图10b所示,将股骨样品的表面以3mm圆面为截面向轴向纵深1.5mm为vi;同样以3mm圆面为截面,沿股骨的轴向移动1.5mm形成v2。通过利用v1、v2可以对骨组织样品的矿化物密度值、新生骨体积值进行统计和分析,从而获得不同方面的骨再生的情况。
7.cbd-sdf1α修饰的脱钙骨基质支架材料在大鼠体内短期募集干细胞的表征
采用对常见干细胞标记物cd34及c-kit染色的方法,研究cbd-sdf1α修饰的脱钙骨基质支架材料在大鼠体内募集内源性干细胞的情况。首先,麻醉处死移植治疗3天的实验大鼠,收获移植的生物样品,用o.c.t.包埋后于-80℃冷冻处理1天。利用冰冻切片机将包埋好的样品制备成6μm厚度的冰冻切片,然后浸没于丙酮中固定30分钟。将冰冻切片分别滴加mouse-anti-rat-anti-cd34和anti-c-kit-biotin并置于4℃过夜处理。取出切片,用pbs溶液清洗3次,然后再对切片分别在孵育rabbitanti-mouseigg-pe以及fitc-streptavidin中室温孵育1小时。最后,采用dapi溶液对所有的切片进行细胞核染色处理。如图10c所示,共聚焦显微镜获得的荧光图表明,各个实验组在大鼠股骨缺损治疗后具有一定数量的干细胞被募集到损伤部位,其中cbd-sdf1α组的干细胞数量更为丰富。图10d为利用image-proplus软件对图10c的荧光染色图进行统计分析进一步表明cbd-sdf1α组比nat-sdf1α组及dbm组募集更多的干细胞。
8.cbd-sdf1α修饰的脱钙骨基质支架材料移植后骨损伤修复的表征
1)组织形态学分析cbd-sdf1α修饰的脱钙骨基质支架材料可以促进骨的再生
采用常规组织化学染色-h&e、masson染色分析方法。首先,过量注射4%的戊巴比妥钠溶液对移植治疗4、8及12周的实验大鼠进行安乐死,收集股骨组织样品。用pbs溶液将骨组织样品清洗3次,以洗净骨样品表面的细胞、血管等软组织;再将骨组织样品浸没于15%的edta(ph7.4左右)溶液中,室温条件下脱钙12周(每3-4天更换一次脱钙液且脱钙液需现用现配)。用针刺法检测骨组织样品是否脱钙完全。对于已经完全脱钙的骨组织样品,用双蒸水清洗后再利用梯度酒精溶液进行脱水处理,然后用石蜡包埋并制备成石蜡切片。最后对各个实验组的石蜡切片进行h&e、masson染色,光学显微镜下观察获得图12a-12e。如图12a-12b所示,移植治疗4周后不同实验组的骨缺损部位均有一定程度的愈合,其中cbd-sdf1α组的愈合效果最好且成骨细胞数量最多(箭头所示)。在针对胶原染色的图12c中可以观察到,cbd-sdf1α组的新生胶原最多。通过对各组中成骨细胞及破骨细胞的统计分析(图12d-12e)可以进一步证明cbd-sdf1α组具有更多数量的成骨细胞并且可以一定程度的抑制破骨细胞的数量。
2)cbd-sdf1α修饰的脱钙骨基质支架材料可以促进具有骨诱导活性蛋白的表达
为了研究cbd-sdf1α修饰的脱钙骨基质材料是否具有骨诱导活性,我们针对骨诱导蛋白:骨保护素opg、骨桥蛋白opn以及骨钙蛋白ocn进行染色。在制备获得骨组织石蜡切片后,将切片分别与anti-osteoprotegerin、anti-osteopontin以及anti-osteocalcin在4℃条件下孵育过夜,隔天利用pbs溶液清洗3次后再分别与二抗溶液室温共孵育1小时后,置于光学显微镜下观察。图13a-13b展示了cbd-sdf1α组在骨缺损治疗4周后表达相对多的骨保护素及骨桥蛋白,并且在骨移植治疗12周后累积表达的骨钙蛋白的量也明显高于其他实验组(图13c)。
3)cbd-sdf1α修饰的脱钙骨基质支架材料可以促进骨矿化密度值和新生骨体积的增加
利用microct进行骨组织样品扫描检测以及活体扫描检测可以获得移植治疗后大鼠骨缺损处恢复的直观图以及缺损处骨矿化密度值和新生骨体积值。如图14a-14b所示,在移植治疗4周后,各个实验的骨缺损部位具有一定程度的愈合,其中以cbd-sdf1α组的愈合效果最好,nat-sdf1α组和dbm组的愈合程度相似;在移植治疗8周后cbd-sdf1α组的骨缺损部位基本完全愈合,而其他实验组均还有一定程度的缺口未愈合。
为了进一步比较各个实验组的治疗效果,我们对microct获得的数据统计分析。图14c-14d分别展示了移植治疗4周及8周的骨缺损样品的矿化物密度值,cbd-sdf1α修饰的脱钙骨基质极大的促进了骨缺损处的矿化物的累积,相对于其他实验组具有明显的优势。图14e-14f则表示移植治疗4周后v1/v2处的新生骨体积的增长情况。cbd-sdf1α修饰的脱钙骨基质材料均可促进v1/v2处的新生骨体积的增长,其对v2处的新生骨体积增长促进效果更为显著。
4)cbd-sdf1α修饰的脱钙骨基质支架材料可以促进骨组织力学性能的恢复
力学性能是评价骨组织功能恢复的重要指标,因此,采用三点弯曲对移植治疗的骨缺损样品进行力学性能的检测。如图15a所示,三点测试的过程是:给待测的样品两端各一个支点且两点之间的距离大于2cm,在两支点的中间正上方给予一个具有恒定速度向下且不断增加的压力,检测样品断裂时的最大负载力。通过对移植治疗4、8以及12周的骨缺损样品进行三点弯曲测试,统计得到图15b-15d。在移植治疗4周后,各个实验组的骨组织样品所能承受的最大负载力差别最大,其中cbd-sdf-1α组显著高于nat-sdf-1α组;在移植治疗8周和12周后,各组间能承受的最大负载力差距缩小,cbd-sdf-1α组虽然还高于nat-sdf-1α组但却没有显著性差异。
应当理解,上述具体实施方式仅为说明本发明的技术构思和结构特征,目的在于让熟悉此项技术的相关人士能够据以实施,但以上所述内容并不限制本发明的保护范围,凡是依据本发明的精神实质所作的任何等效变化或修饰,均应落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!