由肿瘤微环境控制粒径大小及药物释放的多组分脂质复合系统、其制备方法与应用与流程
本发明涉及一种由肿瘤微环境控制粒径大小及药物释放的多组分脂质复合系统、其制备方法与在制药中的应用。
背景技术:
抗肿瘤纳米制剂能够显著降低治疗毒性,近年来逐渐取代传统制剂成为临床首选药物。然而,市售纳米制剂并未能真正意义上提高患者的生存期。主要有两个原因:1.抗肿瘤纳米制剂在肿瘤组织聚集和渗透的效率之间的“天然矛盾”制约着抗肿瘤疗效的发挥;2.包埋的多组分释放次序无法调控,影响组分间协同治疗效率。
一般来说,粒径是决定其能否在肿瘤组织高效聚集和渗透的最关键因素:较大粒径的纳米粒子(100~120nm)易于实现肿瘤的高通透性和滞留效应,即组织聚集;而较小粒径的纳米粒子(20~40nm)则更善于向肿瘤组织深层渗透。显然,目前在研/上市的纳米载体难以同时满足活性成分在肿瘤组织高效聚集和深层渗透,因此,亟需构建一种粒径可调节的给药系统来最大程度上为临床提供真正意义上“增效减毒”的抗肿瘤纳米制剂。利用肿瘤自身微环境特性来调控纳米粒子尺寸,是解决上述问题的有效手段。同时将两种最优的粒径参数“程序化写入”纳米粒子的制备工艺中,设计成“大球包小球”的结构,借助肿瘤组织的微环境特性触发纳米递药系统进行粒径程序化调控,逐级匹配组织靶向和深层渗透所需的最优粒径,对改善活性组分的肿瘤组织聚集效率及深层渗透能力,促进抗肿瘤组分对肿瘤细胞的精准定位和摄取,最终实现多组分纳米制剂抗肿瘤疗效显著提高具有重要意义。
另一方面,一种类型的肿瘤病程发展通常由数个病理机制调控,多组分协同治疗需要从机制层面作出合理次序的药物干预。如何利用同一递药系统错时释放不同药物,作用不同病理节点,提高抗肿瘤效果是亟需解决的问题。譬如,对于耐药型荷瘤裸鼠模型的抗肿瘤治疗,在瘤内预注射一种耐药逆转剂后再给予相关治疗,比简单注射逆转剂+抗肿瘤药物的疗效提高数倍。这种预实验结果提示,如果耐药逆转剂和抗肿瘤药物同时被包埋在同一递药系统中,前者的释放次序和释放速率对抗肿瘤药物的效率至关重要。因此如果设计一种脂质复合系统:以小粒径的抗肿瘤微乳为核心,外表包封一层含有特定药理活性药物的敏感脂质层。这种系统首先依靠实体瘤通透与滞留增强效应(EPR)到达靶部位,接着敏感脂质膜被肿瘤微环境促发响应,提前暴释出特定药理活性药物和小粒径的抗肿瘤微乳。这种靶部位的次序释放设计有三方面的优势:1,首先释放的特定药理活性药物可提前干预某些病理环节,为后续抗肿瘤组分胞内聚集创造条件;2,主要的抗肿瘤/毒性成分被脂质层和微乳体系双重包封,因此药物泄露率将更低,体内安全性将更高;3,脂质体的粒径更适合肿瘤部位聚集,微乳的粒径更适合肿瘤组织的深层渗透,脂质层的脱离的实质是粒径由大到小的转变,更利于脂质复合系统的肿瘤深层递送。这种多组分协同智能递送的纳米脂质复合系统由肿瘤特异病理环境触发优先释放某些药物,提前作用某些节点,极大地优化抗肿瘤药物在肿瘤细胞内的聚集和组织间的渗透效率,从思路上为多组分协同抗肿瘤研究提供一种新的设计理念和解决方案。
以宫颈癌为研究对象,举例说明本发明的一个典型设计方案:拟利用其组织内过表达furin蛋白的微环境特性设计一种对其敏感的粒径可控逐级释药系统。结合课题组之前公开的发明(CN201410149584.9;CN201410149596.1),首先构建以薏苡仁油为油相荷载雷公藤红素的微乳系统,增加了药物的溶解度,降低了辅料用量与雷公藤红素的毒性,该微乳粒径在30nm左右,具有较好的肿瘤渗透性。为同时提高其在肿瘤组织的聚集和深层渗透,本项目设计一种能被宫颈癌furin蛋白触发的“逐级蜕壳”式丹参酮2A/雷公藤红素-脂质微乳复合系统,该系统利用脂质外壳包封小粒径的微乳,组装成较大粒径的丹参酮2A脂质-薏苡仁油微乳复合系统(粒径约为120nm),首先该粒径范围有利于载体在宫颈癌组织高效聚集;其二,该脂质系统外壳用以对宫颈癌furin蛋白敏感的材料修饰,在到达肿瘤组织外周后,通过furin蛋白的环境的刺激,蜕去脂质外壳,释放出丹参酮2A和小粒径薏苡仁油-雷公藤红素微乳,前者用来修复肿瘤血管,为后者肿瘤深层渗透创造条件;最后,小粒径薏苡仁油-雷公藤红素微乳凭借其尺寸优势和表面修饰的肿瘤主动靶向配体(转铁蛋白)完成更精准的肿瘤细胞定位,最终在肿瘤细胞内释放抗肿瘤组分,发挥协同抗肿瘤药效。
本发明的创新点在于:在设计理念上利用肿瘤微环境特性触发粒子逐级程序化调控粒径,智能匹配纳米粒子完成高效肿瘤聚集和组织渗透所需的最佳粒径,更精准地靶向组织深层的肿瘤细胞;并且通过敏感脂质对微环境的相应,错时释放出特定活性药物和抗肿瘤药物,协同发生抗肿瘤效应。同时,还结合荧光共振能量转移(FRET)、激光共聚焦显微镜等先进技术定性定量地表征脂质复合系统在肿瘤部位结构变化及深层渗透行为,具有较强的创新性。
技术实现要素:
本发明的目的是提供一种由肿瘤微环境控制粒径大小及药物释放的复合系统及其制备方法,以及这种纳米递送系统作为药物载体在制备药物中的应用。本发明以抗肿瘤微乳为核心,借助对肿瘤微环境敏感的脂质材料,将微乳和某种特定活性的药物共包封于脂质体中,形成的脂质复合系统可以在病灶部位实现尺寸的变化和药物的逐级释放,将不同类型的药物运送至不同部位,使得核心部分完成更深层次的肿瘤渗透,最终在肿瘤细胞内释放抗肿瘤组分,发挥协同抗肿瘤药效。
本发明的目的之一是提供一种由肿瘤微环境控制粒径大小及药物释放的多组分脂质复合系统,包含一种抗肿瘤微乳、一类能够被肿瘤微环境响应的脂质、一类具有改善肿瘤微环境的特定药物,本脂质复合系统还包含胆固醇和水。
所述的抗肿瘤微乳、脂质、特定药物、胆固醇与水五者之间的重量比是20~100:20:1~4:3~10:1000~5000,最优的质量比为60~100:20:1~2:4~8:1000~2500。
以上方案中,抗肿瘤微乳采用已公开发明(CN201410149584.9;CN201410149596.1)的方案制备、脂质复合系统通过薄膜分散法在水相环境下自组装形成纳米级的乳剂。通过以上方案所制备的系统粒径均在80~160nm之间,多分散系数均在0.250以下,黏度与水溶液相当,放置30天以及血清稳定性均达到实验标准,冻干粉复溶液稳定性均达到市售制剂标准。
本发明的抗肿瘤微乳各组分种类如下,油相选自薏苡仁油、莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种;搭载的难溶性抗肿瘤药物选自雷公藤红素、多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种;乳化剂选自RH40、吐温80、司盘20中的一种;助乳化剂选自PEG-400、乙醇、异丙醇或丙二醇中的一种。
所述脂质是敏感脂质或者是敏感脂质与普通脂质的混合,其中敏感脂质选自:(1)二棕榈酰磷脂酰胆碱(DPPC);(2)二油酰磷脂酰乙醇胺(DOPE);(3)由聚乙二醇-敏感肽-亲脂性基团构成的化学实体,敏感肽包括furin蛋白敏感肽、金属蛋白酶(MMP)敏感肽、尿激酶纤维蛋白溶酶原激活剂(uPA)敏感肽以及组织蛋白酶(CTSs)敏感肽,亲脂性基团为己醇到十八醇、硬脂酸或者辛酸中的一种;普通脂质选自DSPE、二油酰磷脂酸(DOPA),大豆卵磷脂(SPC)中的一种或几种。
所述furin蛋白敏感肽由甘氨酸-精氨酸-缬氨酸-精氨酸-精氨酸-丝氨酸-半胱氨酸序列构成,其中furin蛋白敏感肽序列的第1、6、7位的氨基酸可以被替换,构成的聚乙二醇-敏感肽-亲脂性基团的结构通式如下:
进一步的,上述敏感脂质中(3)的化学系实体优选为聚乙二醇-furin蛋白敏感肽-十八醇、聚乙二醇-furin蛋白敏感肽-辛醇、聚乙二醇-furin蛋白敏感肽-硬脂酸、聚乙二醇-furin蛋白敏感肽-辛酸、聚乙二醇-金属蛋白酶敏感肽-十八醇、聚乙二醇-金属蛋白酶敏感肽-辛醇、聚乙二醇-金属蛋白酶敏感肽-硬脂酸、聚乙二醇-uPA敏感肽-十八醇、聚乙二醇-uPA敏感肽-硬脂酸、PEG-CTSs敏感肽-十八醇、聚乙二醇-CTSs敏感肽-硬脂酸、中的一种或几种。
本发明中的特定活性药物主要是丹参酮2A磺酸钠、丹参酮2A、川芎嗪、人参皂苷Rh2、五味子甲素、汉防己甲碱中的一种。
本发明采用薄膜分散法、乙醇注入法或者溶剂挥发法中的一种,将特定活性的药物和抗肿瘤微乳共载入至由敏感脂质体组装成的脂质体中,所形成的脂质复合系统一方面可以通过肿瘤微环境调控粒径大小、控制药物逐级释放,另一方面又使得大毒性的药物泄露率更低,提高了治疗的安全性。通过粒径控制,可以实现最优的肿瘤部位聚集和组织渗透优势;通过药物逐级释放,可以优化多组分协同抗肿瘤效率;通过多层包封,可以降低系统在体内循环时的毒副作用。
上述涉及到的肿瘤微环境敏感脂质的制备方法采用已公开发明(CN201410149584.9;CN201410149596.1)的方案制备、脂质复合系统通过薄膜分散法在水相环境下自组装形成纳米级的乳剂,其特征步骤如下:
1)取1~1.3eq不同分子量的PEG-COOH、1.1eq的(N,N’-二环己基碳二亚胺)DDC和0.1eq(4’-二甲氨基吡啶)DMAP,共同溶解于二氯甲烷中室温搅拌0.5~1h,再加入1eq敏感肽,磁力搅拌12~24h后,抽滤,滤液经减压蒸除溶剂,得粗品,经二氯甲烷/甲醇(20/1)柱层析得纯品;
2)取1~1.3eq十八醇、1.1eq的DDC和0.1eq DMAP,共同溶解于吡啶中室温搅拌0.5~1h,再加入1eq步骤1纯品,60℃反应12~24h,抽滤,滤液经减压蒸除溶剂,得粗品,经二氯甲烷/甲醇(10/1)柱层析得纯品,
更优选的方案包括(此方案以聚乙二醇-furin蛋白敏感肽-十八醇为例):
1)取1eq不同分子量的PEG-COOH、1.1eq的(N,N’-二环己基碳二亚胺)DDC和0.1eq(4’-二甲氨基吡啶)DMAP,共同溶解于二氯甲烷中室温搅拌0.5h,再加入1eq furin蛋白敏感肽,磁力搅拌18h后,抽滤,滤液经减压蒸除溶剂,得粗品,经二氯甲烷/甲醇(20/1)柱层析得纯品;
2)取1eq十八醇、1.1eq的DDC和0.1eq DMAP,共同溶解于吡啶中室温搅拌0.5h,再加入1eq步骤1纯品,60℃反应12h,抽滤,滤液经减压蒸除溶剂,得粗品,经二氯甲烷/甲醇(10/1)柱层析得纯品。此方法还可应用于聚乙二醇-MMP敏感肽-十八醇、聚乙二醇-uPA敏感肽-十八醇、聚乙二醇-CTSs敏感肽-十八醇、聚乙二醇-furin蛋白敏感肽-硬脂酸、聚乙二醇-furin蛋白敏感肽-庚酸、聚乙二醇-furin蛋白敏感肽-辛酸等。
本发明的目的之二是提供上述由肿瘤微环境控制粒径大小及药物释放的多组分脂质复合系统的制备方法,其特征在于,步骤如下:
1)取油类(包括有活性的和普通油相辅料)、表面活性剂、助表面活性剂以及抗肿瘤药物,室温搅拌2~8h至完全混匀,高速搅拌下缓慢注入水相,制得抗肿瘤微乳;
2)取敏感脂质或敏感脂质+普通脂质、胆固醇,溶解于有机溶剂中,制备成薄膜,减压下抽除残留有机溶剂24h;
3)将含上述制备的微乳和特定活性药物的水相加入至薄膜中,常温下水合0.5~1h,超声粉碎1~5min后,制备得到脂质复合系统。
更优选的制备方法包括(此部分抗肿瘤微乳以薏苡仁油-雷公藤红素为例;敏感脂质以PEG-FsP-octadecanol+DOPA为例,特定活性药物以丹参酮2A磺酸钠为例,涉及其他种类敏感脂质复合系统的制备方法类似):
1)取薏苡仁油、RH40、PEG400以及雷公藤红素,室温搅拌4~6h至完全混匀,高速搅拌下缓慢注入水相,制得薏苡仁油-雷公藤红素微乳;
2)取PEG-FsP-octadecanol+DOPA、胆固醇,溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;
3)将含上述制备的薏苡仁油-雷公藤红素微乳和丹参酮2A磺酸钠的水相加入至薄膜中,常温下水合0.5h,功率10%下超声粉碎1~3min后,制备得到脂质复合系统。
最优选的包埋薏苡仁油-雷公藤红素和丹参酮2A磺酸钠的敏感脂质复合系统(TC-L)制备方法包括:
取薏苡仁油、RH40、PEG400以及雷公藤红素质量比(20/20/5/2),室温搅拌5h至完全混匀,高速搅拌下缓慢注入10倍总当量的水;取PEG-FsP-octadecanol、DOPA、胆固醇(2/20/5),溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;将含上述制备的薏苡仁油-雷公藤红素微乳和丹参酮2A磺酸钠(雷公藤红素/丹参酮2A磺酸钠=1/3)的水相加入至脂质薄膜(雷公藤红素/脂质=1/20)中,常温下水合0.5h,功率10%下超声粉碎5min后,制备得到脂质复合系统。
本申请第三个目的是,上述微环境敏感的多组分脂质复合系统在制备药物制剂中的应用。
以TC-L为例,上述的TC-L相比已报道的各药物的脂质体或微乳剂型,包封率得到极显著的提高;在肿瘤部位的粒径控制行为非常显著;药物逐级释放性质非常突出;细胞摄取、肿瘤部位聚集、肿瘤组织渗透、协同抗肿瘤效率明显提升。
本发明为了验证该设计理念在不同脂质、不同抗肿瘤微粒和不同特定活性药物的相互组合依然适用,发明人还将脂质材料替换成二棕榈酰磷脂酰胆碱(DPPC)、DOPE、PEG-FsP-stearic acid、PEG-MMP-octadecanol、PEG-MMP-stearic acid、DSPE、DOPA、SPC中的一种或多种,抗肿瘤微粒替换成莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种与多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种组合制备的抗肿瘤微粒、特定活性的药物替换成丹参酮2A、川芎嗪、人参皂苷Rh2、五味子甲素中的一种,所制备得到的脂质复合系统依然可以在粒径控制、药物逐级释放、协同抗肿瘤方面有类似的优势。该设计理念的一个突出特点就是其有较强的普适性、易于推广和深入研究。
本发明的脂质复合系统可以将多种上市的中药油类抗肿瘤组分、抗肿瘤化疗药物、抗肿瘤辅助治疗药物巧妙地整合至同一个递药系统中。这种从特定肿瘤类型的病理机制出发,合理设计药物组合,有望开发出针对特定肿瘤的纳米递药系统。因此该类的递药系统优势还在于为各类肿瘤提供一种精准的治疗方案。
本发明以TC-L治疗宫颈癌为例,构建荷载Hela肿瘤裸鼠模型,比较了TC-L和普通脂质体之间的抗肿瘤疗效。
体内抗肿瘤方案如下:建立Hela细胞异位荷瘤裸鼠模型,随机分组。设TC-L和普通脂质体以及物理混合组为制剂组别,生理盐水组为阴性对照组,隔天尾静脉注射给药,给药期间记录肿瘤体积和体重,检查血常规、肝功能、TNF-α和IL-6等指标。14天后将动物断颈处死,剥离肿瘤、脾脏、肝脏、胸腺,仔细观察肿瘤大小、形态。用游标卡尺分别测量瘤体的长径(a)和短径(b),依据公式V=a·b2/2,计算肿瘤体积,称量体重、记录生存状态和生存时间。动物处死后称脾脏及肝脏重量,计算肿瘤抑制率、肝、脾及胸腺指数:抑瘤率=(1-给药组平均肿瘤体积/对照组平均肿瘤体积)×100%;肝指数=肝脏重量(mg)/裸鼠体重(g);脾指数=脾脏重量(mg)/裸鼠体重(g);胸腺指数=胸腺重量(mg)/裸鼠体重(g)。常规石蜡包埋、切片、HE染色,并用TUNEL试剂盒观察肿瘤组织的凋亡状态和形态学改变。
结果表明,TC-L组经过14天治疗后,肿瘤体积生长抑制最为明显、抑瘤率最高、生存时间显著延长、体内的免疫指标均优于其他各组;肿瘤切片的荧光照片结果显示,TC-L可以更深层地渗透到肿瘤组织内部。所得结果均表明,控制粒径和药物逐级释放对于抗肿瘤活性提高的重要性。
本发明以包埋薏苡仁油-雷公藤红素和五味子甲素的敏感脂质复合系统(TS-L)治疗耐药性乳腺癌为例,构建荷载MCF-7/MDR肿瘤裸鼠模型,比较了TS-L和普通脂质体之间的逆转乳腺癌耐药性疗效差异。
体内抗肿瘤方案如下:建立MCF-7/MDR细胞异位荷瘤裸鼠模型,随机分组。设TS-L和普通脂质体以及物理混合组为制剂组别,生理盐水组为阴性对照组,隔天尾静脉注射给药,给药期间记录肿瘤体积和体重,检查血常规、肝功能、TNF-α和IL-6等指标。14天后将动物断颈处死,剥离肿瘤、脾脏、肝脏、胸腺,仔细观察肿瘤大小、形态。用游标卡尺分别测量瘤体的长径(a)和短径(b),依据公式V=a·b2/2,计算肿瘤体积,称量体重、记录生存状态和生存时间。动物处死后称脾脏及肝脏重量,计算肿瘤抑制率、肝、脾及胸腺指数:抑瘤率=(1-给药组平均肿瘤体积/对照组平均肿瘤体积)×100%;肝指数=肝脏重量(mg)/裸鼠体重(g);脾指数=脾脏重量(mg)/裸鼠体重(g);胸腺指数=胸腺重量(mg)/裸鼠体重(g)。常规石蜡包埋、切片、HE染色,并用TUNEL试剂盒观察肿瘤组织的凋亡状态和形态学改变。
结果表明,TS-L组经过14天治疗后,肿瘤体积生长抑制最为明显、抑瘤率最高、生存时间显著延长、体内的免疫指标均优于其他各组;肿瘤切片的荧光照片结果显示,TS-L可以更深层地渗透到肿瘤组织内部。所得结果均表明,不仅控制粒径和药物逐级释放对于抗肿瘤活性提高的至关重要,而且这种设计的理念可以根据肿瘤特定的病理机制,灵活变换药物组合,具有很好的功能拓展性。
本发明内容所涉及的具体制备方法、有效性结果、体内外的抗肿瘤行为均在下列的具体实施例中详细给出。需要指出的是,其他功能辅料与药物的组合还有用于其他疾病的治疗的可能性。
附图说明
图1为各敏感脂质系统外界条件干预下的粒径变化情况(n=3);
图2为各敏感脂质系统外界条件干预下的药物逐级释放考察(n=3);
图3为TC-L抑制体内宫颈癌生长情况考察(**P<0.01vs游离药物,n=8);
图4为TG-L抑制体内耐药型乳腺癌生长情况考察(**P<0.01vs游离药物,n=8);
图5为TC-L体内水平深层渗透肿瘤组织能力考察;
图6为TC-L体内水平血液循环稳定性考察。
具体实施方式
实施例1,包埋薏苡仁油-雷公藤红素微乳和丹参酮2A磺酸钠的敏感脂质复合系统(TC-L)制备方案:
取薏苡仁油、RH40、PEG400以及雷公藤红素质量比(20/20/5/2),室温搅拌5h至完全混匀,高速搅拌下缓慢注入10倍总当量的水;取PEG-FsP-octadecanol、DOPA、胆固醇(2/20/5),溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;将含上述制备的薏苡仁油-雷公藤红素微乳和丹参酮2A磺酸钠(雷公藤红素/丹参酮2A磺酸钠=1/3)的水相加入至脂质薄膜(雷公藤红素/脂质=1/20)中,常温下水合0.5h,功率10%下超声粉碎5min后,制备得到脂质复合系统。
同样地,抗肿瘤微粒替换成莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种与多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种组合制备的抗肿瘤微粒;RH40可替换为吐温80或者司盘20;PEG400可替换成乙醇、异丙醇或丙二醇;丹参酮2A磺酸钠可替换成丹参酮2A。
实施例2,包埋薏苡仁油-雷公藤红素微乳和五味子甲素的敏感脂质复合系统(TS-L)制备方案:
取薏苡仁油、RH40、PEG400以及雷公藤红素质量比(20/20/5/2),室温搅拌5h至完全混匀,高速搅拌下缓慢注入10倍总当量的水;取PEG-FsP-octadecanol、DOPA、胆固醇(2/20/5),溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;将含上述制备的薏苡仁油-雷公藤红素微乳和五味子甲素(雷公藤红素/五味子甲素=1/3)的水相加入至脂质薄膜(雷公藤红素/脂质=1/20)中,常温下水合0.5h,功率10%下超声粉碎5min后,制备得到脂质复合系统。
同样地,抗肿瘤微粒替换成莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种与多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种组合制备的抗肿瘤微粒。
实施例3,包埋薏苡仁油-雷公藤红素微乳和人参皂苷Rh2的敏感脂质复合系统(TG-L)制备方案:
取薏苡仁油、RH40、PEG400以及雷公藤红素质量比(20/20/5/2),室温搅拌5h至完全混匀,高速搅拌下缓慢注入10倍总当量的水;取PEG-FsP-octadecanol、DOPA、胆固醇(2/20/5),溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;将含上述制备的薏苡仁油-雷公藤红素微乳和人参皂苷Rh2(雷公藤红素/人参皂苷Rh2=1/3)的水相加入至脂质薄膜(雷公藤红素/脂质=1/20)中,常温下水合0.5h,功率10%下超声粉碎5min后,制备得到脂质复合系统。
同样地,抗肿瘤微粒替换成莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种与多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种组合制备的抗肿瘤微粒。
实施例4,包埋薏苡仁油-雷公藤红素微乳和川芎嗪的敏感脂质复合系统(TL-L)制备方案:
取薏苡仁油、RH40、PEG400以及雷公藤红素质量比(20/20/5/2),室温搅拌5h至完全混匀,高速搅拌下缓慢注入10倍总当量的水;取PEG-FsP-octadecanol、DOPA、胆固醇(2/20/5),溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;将含上述制备的薏苡仁油-雷公藤红素微乳和川芎嗪(雷公藤红素/川芎嗪=1/3)的水相加入至脂质薄膜(雷公藤红素/脂质=1/20)中,常温下水合0.5h,功率10%下超声粉碎5min后,制备得到脂质复合系统。
同样地,抗肿瘤微粒替换成莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种与多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种组合制备的抗肿瘤微粒。
实施例5,包埋薏苡仁油-雷公藤红素微乳和丹参酮2A磺酸钠的金属蛋白酶/furin蛋白酶/酸/热敏感脂质复合系统制备方案:
取薏苡仁油、RH40、PEG400以及雷公藤红素质量比(20/20/5/2),室温搅拌5h至完全混匀,高速搅拌下缓慢注入10倍总当量的水;取PEG-MMP-octadecanol、DOPA、胆固醇(2/20/5),溶解于有机溶剂中,制备成敏感脂质薄膜,减压下抽除残留有机溶剂24h;将含上述制备的薏苡仁油-雷公藤红素微乳和丹参酮2A磺酸钠(雷公藤红素/丹参酮2A磺酸钠=1/3)的水相加入至脂质薄膜(雷公藤红素/脂质=1/20)中,常温下水合0.5h,功率10%下超声粉碎5min后,制备得到脂质复合系统。
同样地,抗肿瘤微粒替换成莪术油、鸦胆子油、亚麻籽油、荆芥油、白术油或丁香油中的一种与多西紫杉醇、紫杉醇、阿霉素、厄洛替尼、吉非替尼、埃克替尼、藤黄酸、槲皮素、长春碱中的一种组合制备的抗肿瘤微粒;特定活性的药物可以替换成川芎嗪、人参皂苷Rh2、五味子甲素、汉防己甲碱等;敏感脂质可以替换成DPPC、DOPE、PEG-FsP-stearic acid、PEG-MMP-stearic acid、DSPE、DOPA、SPC中的一种或多种。
实施例6,包埋抗肿瘤微乳和特定活性药物的敏感脂质复合系统的制剂学评价方案:
此处以抗肿瘤微乳以薏苡仁油-雷公藤红素微乳为例;特定活性的药物以丹参酮2A磺酸钠、川芎嗪、人参皂苷Rh2、五味子甲素、汉防己甲碱为例;敏感脂质材料以PEG-MMP-octadecanol、PEG-FsP-octadecanol、DPPC、DOPE、PEG-FsP-stearic acid、PEG-MMP-stearic acid为例,实施例1~5方案制备各种不同类型的脂质复合系统。将所制备的各制剂用0.8μm的微孔滤膜。精确移取100μL微乳液体至10mL容量瓶中,甲醇稀释至刻度;照各包埋药物组分的色谱条件测定,记录峰面积并计算药物测得含量。通过计算测得的药物总量与加入药物的比例,得出包封产率(Drug entrapment efficiency,DEE)、载药量(Drug-loading efficiency,DLE),并通过比较脂质复合系统条件下各组分溶解度和水相条件下各组分的溶解度差异,计算出增溶倍数(Sx)。如结果(表1)所示,本发明所设计的复合系统对各种难溶性组分均可以进行较好地增溶。包封率、载药量、增溶倍数等指标明显高于同等条件下的脂质体系统,体现出该脂质复合系统对双重包封的优势。同时,更换其它类型的抗肿瘤微粒,脂质复合系统依然可以表现出对各组分的高荷载能力。
表1各多组分脂质复合系统制剂学行为评价
注:a敏感脂质由括号内标注脂质构成;bSx仅表示难溶性抗肿瘤成分被增溶的倍数。
其它抗肿瘤微乳、特定活性药物以及敏感脂质的组合构成的脂质复合系统在DEE、DLE、Sx方面均与表1列出的各系统相类似,此实施例未尽数列出。
实施例7,微乳的小鼠急性毒性考察:
1.药液的配置:
以TC-L为例,按实施例1的方案制备新鲜的脂质复合系统,以雷公藤红素剂量计,20mg/kg的药液作为本次实验的最高浓度,并以1:0.8的比例依此作递减稀释,配制16,12.5,10,8和6.4mg/kg共6个浓度的药液,给药体积为0.1mL/l0g,单次i.v给药。将对照组雷公藤红素-tween80溶液(20mg/kg)和空白脂质复合系统同上体积和方式给药。
2.受试动物选择
昆明种小白鼠,雌雄各半,38-42g,由扬州大学比较医学中心提供,合格证为苏动(质)284820。动物数为:10只/组,6个剂量组。原料药和空白脂质复合系统各1个对照组。
3.给药方案
(1)TC-L给药对小鼠的急性毒性:小鼠50只,随机分为5组,10只/组,受试前禁食12小时。根据预试,确定本次实验最高剂量为20mg/kg,并以1:0.8的剂距依此递减为16,12.5,10,8和6.4mg/kg共6个剂量组;
(2)空白脂质复合系统对照,1个剂量组;
(3)雷公藤红素对照(20mg/kg),1个剂量组;
结果表明,TC-L尾静脉给药对小鼠的急性毒性在较高剂量给药后即进入挣扎、昏迷窒息,数天后部分小鼠最终因肝肾毒性死亡。中、低剂量给药后出现短暂的呼吸抑制,呼吸急促,血尿等现象,但大部分未出现死亡病例。死亡小鼠剖体检查可见肝肾部出现不规则毒性病变,稍晚死亡小鼠除肝肾部出血性病变外,部分可见肝脏脂肪样变,余未见明显异常。雷公藤红素-tween80溶液20mg/kg给药后数天即出现大部死亡现象。死亡原因可能系主要系肝肾部病变所致。空白微乳组静注后未出现明显异常现象。本品小鼠灌胃给药的死亡情况,LD50及95%可信限见表2,TC-L的小鼠灌胃给药的LD50及95%可信限分别为11.4(9.60~14.13)mg/kg,较雷公藤红素-tween80溶液安全性有明显提高。
表2 LD50软件计算TC-L小鼠静注给药的LD50和95%置信限
其他脂质复合系统在相同剂量和方法给药后,观察期的14天内,小鼠食量、活动、其他行为以及毛色等均好于直接给予游离药物的对照组别。实验结果表明,本发明的脂质复合系统i.v小鼠耐受性明显改善。表明该本发明的脂质复合系统毒性显著降低。
实施例8,各系统在体外干预下的粒径调控:
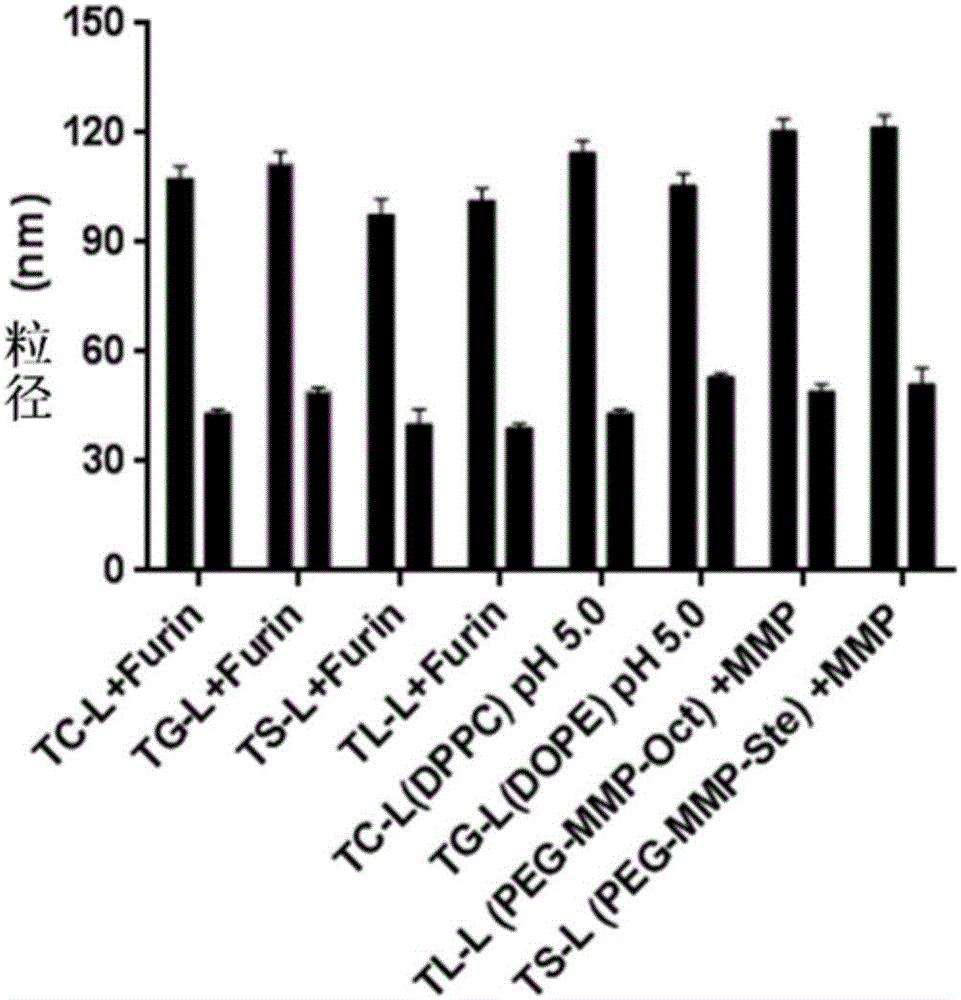
按实施例1~5方案新鲜制备不同类型的敏感脂质复合系统,其中TC-L、TS-L、TG-L、TS-L为furin蛋白敏感;TC-L(DPPC)、TG-L(DOPE)为酸敏感;TS-L(PEG-MMP-Oct)、TS-L(PEG-MMP-Ste)为金属蛋白酶敏感。分别将TC-L、TS-L、TG-L、TS-L加入至含furin蛋白(2.0μg/mL)的水相中,孵育30min后前后的粒径大小变化;将TC-L(DPPC)、TG-L(DOPE)加入至pH 5.0的PBS中,孵育30min后前后的粒径大小变化;TS-L(PEG-MMP-Oct)、TS-L(PEG-MMP-Ste)加入至含金属蛋白酶(5.0μg/mL)的水相中,孵育30min后前后的粒径大小变化。结果见图1,各敏感递药系统均明显发生粒径减小的现象,显示了本发明的敏感脂质复合系统在外界环境干预后所表现出的粒径自调控能力。
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例9,各系统在体外干预下的药物逐级释放:
按实施例1~5方案新鲜制备不同类型的敏感脂质复合系统,其中TC-L、TS-L、TG-L、TS-L为furin蛋白敏感;TC-L(DPPC)、TG-L(DOPE)为酸敏感;TS-L(PEG-MMP-Oct)、TS-L(PEG-MMP-Ste)为金属蛋白酶敏感。分别将TC-L、TS-L、TG-L、TS-L加入至含furin蛋白(2.0μg/mL)的水相中,采用溶出仪在37℃下检测0.2~24h期间各特定活性药物的释放行为;将TC-L(DPPC)、TG-L(DOPE)加入至pH 5.0的PBS中,采用溶出仪在37℃下检测0.2~24h期间各特定活性药物的释放行为;TS-L(PEG-MMP-Oct)、TS-L(PEG-MMP-Ste)加入至含金属蛋白酶(5.0μg/mL)的水相中,采用溶出仪在37℃下检测0.2~24h期间各特定活性药物的释放行为。结果见图2,各敏感递药系统均出现明显的药物错时释放现象,显示了本发明的敏感脂质复合系统在外界环境干预后所表现出的药物逐级释放能力。
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例10,TC-L的体内抗宫颈癌作用考察:
将Hela异位荷瘤鼠模型随机分组后,将TC-L和对照组药物雷公藤红素-Tween80溶液分别尾静脉给药,剂量设定为雷公藤红素5mg/kg;隔天1次,连续14天,将裸鼠断颈处死,称体重,取肿瘤、脾脏、肝脏,仔细观察肿瘤大小、形态。用游标卡尺分别测量瘤体的长径(a)和短径(b),依据公式V=a·b2/2,计算肿瘤体积、体重、生存状态和生存时间;动物死亡后称脾脏及肝脏重量,计算肿瘤抑制率、肝指数及脾指数。结果见图3,TC-L依托粒径调控、药物逐级释放和与其他组分协同抗肿瘤效应,其抑瘤作用显著强于对照组,并且给药14天后,体重与阴性对照相比并未显著降低,各免疫器官指数较阴性对照组比未发现明显下降,表明本发明的微乳具有较高的抗肿瘤活性和较低的毒副作用。
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例11,TG-L的体内抗耐药型乳腺癌作用考察:
将MCF-7/MDR异位荷瘤鼠模型随机分组后,将TC-L和对照组药物雷公藤红素-Tween80溶液分别尾静脉给药,剂量设定为雷公藤红素5mg/kg;隔天1次,连续14天,将裸鼠断颈处死,称体重,取肿瘤、脾脏、肝脏,仔细观察肿瘤大小、形态。用游标卡尺分别测量瘤体的长径(a)和短径(b),依据公式V=a·b2/2,计算肿瘤体积、体重、生存状态和生存时间;动物死亡后称脾脏及肝脏重量,计算肿瘤抑制率、肝指数及脾指数。结果见图4,TC-L依托粒径调控、药物逐级释放和与其他组分协同抗肿瘤效应,其抑瘤作用显著强于对照组,并且给药14天后,体重与阴性对照相比并未显著降低,各免疫器官指数较阴性对照组比未发现明显下降,表明本发明的微乳具有较高的抗肿瘤活性和较低的毒副作用。
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例12,TC-L的在体内宫颈癌组织深层渗透作用考察:
按常规方法构建Hela异位荷瘤鼠模型,将TC-L中的雷公藤红素替换成荧光探针DiO,对照组药物替换成DiO溶液,剂量设定为DiO 50μg/kg,尾静脉给药3次后,将裸鼠断颈处死,取肿瘤组织,冷冻切片。激光共聚焦下观察不同深度的组织中药物分布情况。结果见图5,TC-L的肿瘤组织渗透效率远远高于对照组,表明粒径从100多nm到40nm的转变,更利于抗肿瘤微乳完成深层次的渗透。
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例13,TG-L的在血液和肿瘤组织的稳定性考察:
将TC-L中的雷公藤红素替换成荧光探针DiO和DiI荧光共振能量转移(FRET)荧光对,对照组药物替换成DiO+DiI混合溶液,剂量设定为DiO 50μg/kg,SD大尾静脉给药1次,于不同时间点眼眶取血0.5mL。在全波段扫描酶标仪下检测FRET通道下的荧光强度变化。结果见图6,TC-L在血液循环时的FRET效率基本不发生变化,提示TC-L在体内循环时的可能是以完整的粒子形式,这为下一步的肿瘤部位聚集提供了先决条件。
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例14,各脂质复合系统30天室温放置稳定性:
按实施例1~5方法制备各脂质复合系统,考察不同递药系统在在放置稳定性方面的优势。此实施例以常规的脂质体系统作为对照制剂组。如表3所示,各制剂在30天室温放置稳定性试验中,均未为出现分层现象,表明本发明所涉及到的各敏感脂质复合系统稳定性由于普通脂质体系统。此实施例抗肿瘤微粒以雷公藤红素薏苡仁油微乳为例。
表3各脂质复合系统30天室温放置稳定性考察
相同地,其他抗肿瘤微乳、特定药物和敏感脂质的组合所制备的递药系统在上述类似的实验方法中也得出相类似的结果。
实施例15,聚乙二醇-furin蛋白敏感肽-十八醇的制备方法:
1)取1eq不同分子量的PEG-COOH、1.1eq的(N,N’-二环己基碳二亚胺)DDC和0.1eq(4’-二甲氨基吡啶)DMAP,共同溶解于二氯甲烷中室温搅拌0.5h,再加入1eq furin蛋白敏感肽,磁力搅拌18h后,抽滤,滤液经减压蒸除溶剂,得粗品,经二氯甲烷/甲醇(20/1)柱层析得纯品;
2)取1eq十八醇、1.1eq的DDC和0.1eq DMAP,共同溶解于吡啶中室温搅拌0.5h,再加入1eq步骤1纯品,60℃反应12h,抽滤,滤液经减压蒸除溶剂,得粗品,经二氯甲烷/甲醇(10/1)柱层析得纯品。
将furin蛋白敏感肽替换成MMP敏感肽、uPA敏感肽、CTSs敏感肽中的一种,将十八醇替换成辛醇、硬脂酸、辛酸等中的一种,此方法还可应用于PEG-furin蛋白敏感肽-辛醇、PEG-furin蛋白敏感肽-硬脂酸、PEG-MMP敏感肽-十八醇、PEG-MMP敏感肽-辛醇、PEG-MMP敏感肽-硬脂酸、PEG-uPA敏感肽-十八醇、PEG-CTSs敏感肽-十八醇、PEG-uPA敏感肽-硬脂酸、PEG-CTSs敏感肽-硬脂酸、PEG-furin蛋白敏感肽-辛醇、PEG-furin蛋白敏感肽-辛酸等。
- 还没有人留言评论。精彩留言会获得点赞!