一氧化碳释放分子在制备抗牛病毒性腹泻病毒药物上的应用的制作方法
本发明属于抗病毒研究技术领域,具体地涉及一氧化碳释放分子在制备抗牛病毒性腹泻病毒药物上的应用。
背景技术:
牛病毒性腹泻病毒(Bovine viral diarrhea virus, BVDV)是黄病毒科瘟病毒属的代表种,主要感染牛并引发疾病,由牛病毒性腹泻病毒引起的牛病毒性腹泻病以出现多症状、持续性感染和免疫抑制为主要特征,是对全球养牛业造成极大危害的牛的重要病毒性疫病。
目前对BVDV的防制主要采用疫苗和抗生素。现在主要的BVDV疫苗有常规疫苗和新型疫苗。常规疫苗主要是利用细胞培养物得到BVDV毒株,进而得到这些毒株的弱毒或灭活苗,这些疫苗对抗原相同或差异较小的毒株的保护是有效的,对抗原差异较大或不同抗原的BVDV毒株所感染的动物并不能起到有效的保护作用。随着基因工程技术的发展和应用,BVDV新型疫苗诞生,包括亚单位疫苗、DNA疫苗和重组活载体疫苗等,但由于BVDV在自然条件下变异性高,对BVDV的防治造成很大的困难,从疫苗的使用来看,不论是灭活苗、弱毒菌还是新型疫苗,在安全性、治疗效果等方面都不能对最终控制BVDV起到决定性的作用。另外基于对健康安全食品的关注和需求,动物抗生素的使用已经引起越来越多的消费者的反对。因此,急需寻找一种新的抗病毒药物或制定新型抗病毒策略以有效防控病毒感染。
CORM-2(Carbon Monoxide-Releasing Molecules-2),中文名称是一氧化碳释放分子。其化学名称Dichlorotricarbonylruthenium (II) dimer,中文是三羰基二氯代钌(II)二聚物。目前,主要用于研发,还没有作为药品或其它用途的报道。其结构式如下所示:
技术实现要素:
针对目前采用疫苗或抗生素治疗牛病毒性腹泻病不能有效且可持续保护和控制的现状,本发明的目的在于研究一氧化碳释放分子在制备抗牛病毒性腹泻病毒药物上的应用,为治疗和预防由牛病毒性腹泻病毒引起的疾病提供新的思路和途径。
本发明涉及一氧化碳释放分子在制备抗牛病毒性腹泻病毒药物上的应用,其特征在于:一氧化碳释放分子浓度梯度依赖性抑制牛病毒性腹泻病毒mRNA的表达,尤其是非结构蛋白NS5B的表达。
本发明涉及一种抗牛病毒性腹泻病毒的药物制剂,所述药物制剂以一氧化碳释放分子作为有效成分,并结合辅料配制而成。
作为进一步的优选,所述抗牛病毒性腹泻病毒药物制剂为注射剂或口服剂。
作为进一步的优选,所述注射剂是将一氧化碳释放分子溶于DMSO或生理盐水中配制而成。
作为进一步的优选,所述注射剂为冻干粉针剂。
作为进一步的优选,所述口服剂是将一氧化碳释放分子与淀粉、蔗糖或糊精中的任意一种混合均匀,得混合物;加无菌水使混合物的质量分数为50-70%,搅拌均匀,捏合、粉碎、过筛制备而成。
作为进一步的优选,所述口服剂为散片剂,胶囊剂或颗粒剂。
本发明亦涉及一氧化碳释放分子作为一种牛病毒性腹泻病毒抑制剂,其特征在于:所述抑制剂抑制牛病毒性腹泻病毒感染MDBK细胞。
作为进一步的优选,一氧化碳释放分子的有效浓度为50-300μmol/L。
有益效果:
(1)本发明利用一氧化碳释放分子为有效成分,结合相关辅料制备抗牛病毒性腹泻病毒药物,用于治疗由牛病毒性腹泻病毒引起的疾病,该药物不同于抗生素类药物,不会对机体的免疫系统造成危害;亦不同于疫苗类药物,本发明所述药物可制备成注射制剂或口服剂,不拘泥于使用类型,可满足不同层次的需要;另外一氧化碳释放分子的生产工艺成熟,可以为抗牛病毒性腹泻病毒药物的制备提供充足的原材料,可大大节约生产成本。
(2)本发明通过对细胞内BVDV病毒基因进行相对定量,发现随着一氧化碳释放分子浓度的增加,病毒基因表达量逐渐降低;在接毒量为0.05MOI(感染复数)且24hpi时,150μL的一氧化碳释放分子处理的细胞对BVDV的抑制效果最为显著。一氧化碳释放分子在MDBK细胞中的作用浓度为150μM时,可以导致BVDV表达量下降50%以上、病毒滴度下降1.13lg,具有显著的抗病毒能力,这种抗病毒作用是通过一氧化碳释放分子对BVDV病毒粒子的直接杀伤和抑制病毒在靶细胞中的复制共同完成的,而且主要是通过细胞内的调控作用来抑制病毒感染的。最后,通过检测不同浓度的一氧化碳释放分子处理对MDBK细胞增殖活性的影响,发现25μM~300μM的浓度范围内一氧化碳释放分子不影响MDBK细胞的活性,但经400μM和500μM的一氧化碳释放分子处理后,则MDBK细胞的活力分别降低了51%和87%。
附图说明
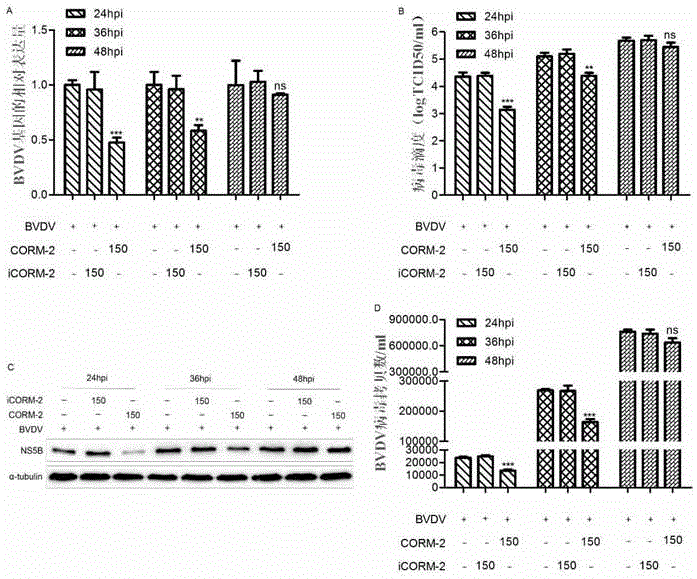
图1是CORM-2呈浓度梯度依赖性抑制BVDV在MDBK细胞中复制的结果图。
图2是CORM-2呈时间梯度依赖性抑制BVDV在MDBK细胞中复制的结果图。
图3是CORM-2抑制不同滴度的BVDV在MDBK细胞中复制的结果图。
图4是不同浓度的CORM--2对MDBK细胞活性影响的结果图。
具体实施方式
下面通过具体的实施例对本发明作进一步的解释说明。
实施例1 CORM-2对BVDV感染MDBK细胞的影响
步骤一、CORM-2处理BVDV感染的MDBK细胞
S1. 不同浓度CORM-2对BVDV复制的影响
用含10%胎牛血清的DMEM培养基稀释对数生长期的MDBK细胞后接种于6孔板,每孔2mL。培养至70%~80%汇合度时,接种用DMEM稀释好的BVDV毒株,吸附1h;弃病毒液,加1mL PBS洗涤1次,加入用3%胎牛血清的DMEM维持液配制好的不同浓度(50μM、100μM和150μM)的CORM-2;同时用3%胎牛血清的DMEM维持液配制灭活的CORM-2(150μM)作为对照,每孔2mL,置于37℃、5% CO2培养箱继续培养,24hpi收集细胞及上清。
S2. CORM-2对不同滴度的BVDV复制的影响
用含10%胎牛血清的DMEM培养基稀释对数生长期的MDBK细胞后接种于6孔板,每孔2mL。培养至70%~80%汇合度时,接种用DMEM稀释好的不同滴度的BVDV毒株,吸附1h;弃病毒液,加1mL PBS洗涤1次,加入用3%胎牛血清的DMEM维持液配制好的150μM的CORM-2;同时用3%胎牛血清的DMEM维持液配制灭活的CORM-2(150μM)作为对照,每孔2mL,置于37℃、5%CO2培养箱继续培养,于24hpi、36hpi和48hpi收集细胞及上清。
步骤二、qPCR检测细胞内BVDV基因的相对表达量
分别提取步骤一S1和S2中制备收集到的细胞总RNA。提取步骤为:对于贴壁培养MDBK细胞,移除培养液,用PBS洗涤后加入适量的RNAiso Plus裂解细胞,参考说明书提取细胞总RNA,提取完成后保存于-80℃备用。以提取的细胞总RNA为模板,以表1中根据GeneBank 中 BVDV Oregon C24V 毒株基因序列(序列号: AF091605.1)设计的BVDV-q F和BVDV-q R为引物,利用反转录试剂盒进行反转录,将提取的细胞总RNA转录成cDNA,反应体系与反应条件参考反转录试剂盒说明书。对反转录产物(即cDNA)进行1:10稀释,以稀释的cDNA为模板,以表1中根据选定的牛B2M内参基因序列设计的bB2M-q F和bB2M-q R为引物,使用SYBR GREEN荧光定量试剂盒进行基因表达量的检测,反应条件为95℃,10 min;95℃,15 s;60℃,60s;95℃,15 s;反应共40个循环,在每个循环中60℃延伸结束时采集一次荧光信号。其中,引物说明如下表1所示。
试验结果表明:通过检测MDBK细胞内BVDV基因的相对表达量,如图1A所示,随着CORM-2浓度的增加,病毒基因表达逐渐降低,说明CORM-2呈浓度梯度依赖性抑制BVDV在MDBK细胞中的复制;如图2A和3A所示,在接毒量为0.05MOI且24hpi时,150μL的CORM-2处理的细胞对BVDV的抑制效果最为显著。
其中,所述RNAiso Plus试剂购自Takara,型号为D9108A ;
反转录试剂盒购自Takara,型号为RR037A;
PCR仪与荧光定量PCR仪购自赛默飞世尔;
SYBR GREEN荧光定量试剂盒购自瑞士的Roche公司。
步骤三、qPCR检测细胞上清中病毒的拷贝数
分别提取步骤一中S1和S2制备收集到的上清细胞总RNA。提取步骤为:收集400μL上清液于灭菌的1.5mL EP管中,加400μL RNAiso Plus振荡混匀,参考说明书提取细胞总RNA,提取完成后保存于-80℃备用。以提取的细胞总RNA为模板,以表1中根据GeneBank 中 BVDV Oregon C24V 毒株基因序列(序列号:AF091605.1)设计的BVDV-q F和BVDV-q R为引物,利用反转录试剂盒进行反转录,将提取的细胞总RNA转录成cDNA,反应体系与反应条件参考反转录试剂盒说明书。对反转录产物(即cDNA)进行1:10稀释,以稀释的cDNA为模板,以表1中根据选定的牛B2M内参基因序列设计的bB2M-q F和bB2M-q R为引物,使用SYBR GREEN荧光定量试剂盒进行基因表达量的检测,反应条件为95℃,10 min;95℃,15 s;60℃,60s;95℃,15 s;反应共40个循环,在每个循环中60℃延伸结束时采集一次荧光信号。
从图1D、图2D和图3D上清中BVDV病毒拷贝数的结果可以看出,上清中BVD病毒拷贝数的下降趋势,与对应的细胞内BVDV病毒基因表达量一致。
步骤四、药物处理后细胞上清的病毒滴度测定(即TCID50)
将步骤一中S1和S2制备得到的细胞上清用DMEM培养基作10倍系列稀释10-1至10-8,接种在长满MDBK细胞单层的96孔细胞培养板上,每稀释度接种8孔,100μL/孔,37℃吸附1h后,弃上清液,每孔加入100μL含3%胎牛血清的DMEM培养基维持液,37℃、5% CO2培养箱中静置培养4~7d,每天观察细胞病变,根据记录结果使用Karber方法计算病毒的TCID50。
从图1B、图2B和图3B可以看出,上清中BVD病毒滴度的下降趋势,与对应的细胞内BVDV病毒基因表达量一致。
步骤五、Western Blot 检测CORM-2处理对病毒NS5B蛋白表达的影响
通过Western Blot检测步骤一S1和S2中制备得到的细胞中病毒蛋白NS5B的表达量变化,其中,病毒NS5B蛋白提取步骤为:将步骤S1和S2制备得到的细胞样品分别收集于1.5 mL的离心管内,4℃、500g离心10min,弃上清液,加入1mL PBS重悬,同样500g离心10min,弃去PBS,以1×106加入100μL NP40裂解液的比例,加入适量的NP40于冰上裂解30min;12000g离心10 min,除去细胞碎片,取上清,5 μL裂解样品+45 μL PBS,Pierce BCA protein Assay Kit测定总蛋白浓度,每个泳道50 μg总蛋白,进行Western blot检测。
制备浓度为12%的SDS-PAGE分离胶及5%的浓缩胶;按稳压200V进行浓缩胶和分离胶的电泳;半干转膜法恒压15V转膜1h;取出膜后,用1×PBS’T洗膜5min后加入封闭液,室温缓慢摇动2h(或4℃过夜);弃去封闭液,用PBS’T洗膜3次,5min/次;加入合适比例稀释的一抗溶液,室温缓慢摇动2h或者4℃过夜孵育;弃去一抗溶液,用PBS’T洗膜3次,5min/次,之后加入合适比例稀释的二抗溶液,室温缓慢摇动1h;弃去二抗溶液,用PBS’T洗膜3次,5min/次;ECL显色,并在发光成像仪上曝光。
从图1C、图2C和图3C可以看出,随着CORM-2浓度的增加,病毒NS5B蛋白表达逐渐降低;150μL的CORM-2呈时间依赖性抑制MDBK细胞中BVD病毒NS5B蛋白的表达;最后,CORM-2呈滴度依赖性抑制不同滴度的BVDV在MDBK细胞中的蛋白表达。
实施例2 CORM-2对MDBK细胞增殖活性的影响
用含10%胎牛血清的DMEM培养基稀释对数生长期的MDBK细胞后接种于96孔板,100μL/孔,为防止蒸发,96孔细胞培养板四周边缘孔填充相同体积的无菌PBS,置于37℃、5%CO2培养箱中培养24h,加入试验药物CORM-2。设置CORM-2不同浓度的处理组(CORM-2稀释成0μM、25μM、50μM、100μM、150μM、200μM、300μM、400μM、500μM 9种不同浓度)。参考CCK-8试剂盒说明书进行MDBK细胞活性检测。用100μL移液器依次吸弃旧培养基,加PBS洗涤1次后,加入事先准备好的浓度梯度的CORM-2溶液,每孔100μL,每个浓度梯度实验孔设有6个重复孔,对照孔设有4个重复孔。然后将96孔细胞培养板置于37℃、5%CO2培养箱内培养48h。在超净工作台内、避光条件下,用10μL移液枪向每孔加入10μL CCK-8溶液,切记不要刮掉、戳掉细胞或打出气泡,在37℃、5% CO2培养箱内继续培养至设定的测定OD450的时间点,并在酶标仪上读取450nm吸光度值,最后根据吸光度值统计分析。
其中,CCK-8试剂盒来源碧云天生物技术研究所,货号为C0038。
从图4可以看出,25μM~300μM的CORM-2处理对MDBK细胞的活性均无显著影响;与正常细胞相比,400μM和500μM的CORM-2处理后,则MDBK细胞的活力分别降低了51%和87%,说明25μM~300μM的浓度范围内CORM-2对MDBK细胞活性的影响不明显。
综合实施例1和实施例2的结果,CORM-2在有效量范围内可通过抑制牛病毒性腹泻病毒mRNA的表达,尤其是抑制非结构蛋白NS5B的表达来降低牛病毒性腹泻病毒的病毒滴度和子代病毒的拷贝数,从而影响对MDBK细胞的感染,为CORM-2用于开发抗牛病毒性腹泻病毒药物奠定了基础和提供了理论条件。在尽量不影响MDBK细胞活性的前提下又能够抑制BVDV复制的一氧化碳释放分子的最佳浓度为50-300μM。
以上内容应理解为说明性的,阐述了本发明的基本原理和本发明的优点,而非限制本发明的保护范围。本发明的保护范围以权利要求书的内容为准,对本领域技术人员而言,在不背离本发明实质和范围的前提下,对本发明作出的一些非本质的改进和调整仍属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!