治疗缺血性脑中风的药物及其制备方法与用途与流程
本发明属于药物领域,具体涉及治疗缺血性脑中风的药物及其制备方法与用途。
背景技术:
NAD,化学名为烟酰胺腺嘌呤二核甘酸或二磷酸烟苷,在哺乳动物体内存在氧化型(NAD+)和还原型(NADH)两种状态,是人体氧化还原反应中重要的辅酶,属于辅酶I;同时,它是NAD+依赖型ADP核糖基转移酶的唯一底物,这类酶在体内主要有三种:(1)ADP核糖基转移酶或聚核糖基聚合酶(PARP);(2)环ADP核糖合成酶(cADPR synthases);(3)III蛋白型赖氨酸去乙酰化酶Sirtuins。这类酶将辅酶I(NAD+)作为底物分解成ADP核糖和烟酰胺(Nam),在不同细胞中发挥不同生理功能。NAD+是细胞能量产生的重要辅助因子,在线粒体有传递氢离子的作用,是能量合成中重要的辅酶。
NADPH是一种辅酶,叫还原型辅酶Ⅱ,学名还原型烟酰胺腺嘌呤二核苷酸磷酸,曾经被称为三磷酸吡啶核苷酸。NADPH作为递氢体为细胞氧化还原反应提供动力,它是谷胱甘肽还原酶的辅酶,可以将氧化型谷胱甘肽(GSSG)还原成GSH,GSH可以用于清除ROS。NADPH通常作为生物合成的还原剂,并不能直接进入呼吸链接受氧化,只是在特殊的酶的作用下,NADPH上的H被转移到NAD+上,然后以NADH的形式进入呼吸链。此外,NADPH还参与了体内众多生物的合成反应,如脂肪酸合成。
磷酸戊糖旁路(pentose phosphate pathway)是葡萄糖氧化分解的另一条途径,它的功能不是产生ATP,而是产生细胞所需的具有重要生理作用的特殊物质,包括NADPH和5-磷酸核糖。细胞内70%左右的NADPH是由戊糖旁路提供的。NADPH对维持体内的GSH水平有非常重要的作用,因为NADPH可以降低细胞内的ROS水平,降低活性氧相关联的凋亡信号,阻止活性氧诱导的细胞凋亡,保护细胞。因此,戊糖旁路在神经元的抗氧化应激中扮演着重要角色。磷酸戊糖途径的另一产物核糖,是体内合成DNA/RNA的原料。因此,细胞内磷酸戊糖途径活性增强时,可以促进DNA修复。
脑卒中(Stroke),又称脑中风或脑血管意外,是一种突然起病的脑血液循环障碍性疾病,是威胁人类健康的三大疾病之一,具有发病率高、死亡率高、致残率高、复发率高的特点。脑卒中是指在脑血管疾病的病人,因各种诱发因素引起脑内动脉狭窄,闭塞或破裂,而造成急性脑血液循环障碍,临床上表现为一过性或永久性脑功能障碍的症状和体征。脑卒中分为缺血性脑卒中和出血性脑卒中。近年来,我国的脑血管疾病患者逐年上升,以缺血性脑血管病最多见,约占70-80%,其中新发脑中风患者为300-350万人。此外,脑中风不仅死亡率高,而且预后较差,存活者中约75%致残,5年复发率高达41%。
研究脑中风尤其是缺血性脑中风的病理机制及治疗防护一直是医药界的重要任务。理论上,针对急性缺血或缺血再灌后细胞损伤的药物(神经保护剂)可保护脑细胞,提高对缺血缺氧损伤的耐受性,但从目前的研究结果看,大多数在动物实验中具有疗效的药物,在临床试验中往往以失败告终。
有文献报道,外源NADPH对小鼠脑缺血再灌注损伤具有保护作用;也有研究发现,在暂时性局部脑缺血的大鼠模型中,通过鼻腔给予NAD+能显著减少缺血性脑损伤:在缺血开始2h后给予NAD+能够减小梗死面积的85%。然而,未见NADPH和NAD+联合应用治疗脑缺血性中风的报道。
因此,研究新型的治疗脑缺血性疾病的药物具有重要意义。
技术实现要素:
为此,本发明提出一种治疗缺血性脑中风的药物组合物。
为解决上述技术问题,本发明是通过以下技术方案来实现的:
本发明提供一种治疗脑中风的药物组合物,其原料药包括:
NADPH0.05~20重量份,NAD+10~100重量份。
优选地,本发明上述治疗脑中风的药物组合物,其原料药包括:
NADPH1~20重量份,NAD+40~65重量份。
进一步优选地,本发明上述治疗脑中风的药物组合物,其原料药包括:
NADPH2~10重量份,NAD+45~60重量份。
进一步优选地,本发明上述治疗脑中风的药物组合物,其原料药包括:
NADPH2.5重量份,NAD+50重量份;或者
NADPH7.5重量份,NAD+50重量份;或者
NADPH1重量份,NAD+55重量份;或者
NADPH9重量份,NAD+45重量份;或者
NADPH7重量份,NAD+41重量份;或者
NADPH5重量份,NAD+53重量份。
本发明还提供一种上述治疗脑中风的药物组合物的制备方法,包括以下步骤:分别取选定重量份的NADPH和NAD+,混合均匀,即得。
本发明还提供包括上述治疗脑中风的药物组合物的制剂、或者包括上述制备方法制备得到的治疗脑中风的药物组合物的制剂,
所述药物组合物加入常规辅料,按照常规工艺,制成临床上可接受的片剂、胶囊剂、散剂、合剂、丸剂、颗粒剂、溶液剂、糖浆剂、煎膏剂、贴膏剂、栓剂、气雾剂、软膏剂或注射剂。
所述药学上可接受的辅料为:填充剂、崩解剂、润滑剂、助悬剂、粘合剂、甜味剂、矫味剂、防腐剂、基质等。填充剂包括:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂包括:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙纤维素、交联羧甲基纤维素纳等;润滑剂包括:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂包括:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂包括,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等;甜味剂包括:糖精钠、阿斯帕坦、蔗糖、甜蜜素、甘草次酸等;矫味剂包括:甜味剂及各种香精;防腐剂包括:尼泊金类、苯甲酸、苯甲酸钠、山梨酸及其盐类、苯扎溴铵、醋酸氯乙定、桉叶油等;基质包括:PEG6000、PEG4000、虫蜡等。
本发明还提供上述药物组合物、上述制备方法制备得到的药物组合物、或上述药物组合物的制剂在制备治疗脑中风的药物中的应用。
优选地,本发明上述应用,所述应用为在制备治疗缺血性脑中风的药物中的应用。
本发明还提供上述药物组合物、上述制备方法制备得到的药物组合物、或上述药物组合物的制剂在制备治疗缺血性心肌损伤的药物中的应用。
本发明还提供上述药物组合物、上述制备方法制备得到的药物组合物、或上述药物组合物的制剂在制备治疗缺血性肾脏损伤的药物中的应用。
本发明还提供上述药物组合物、上述制备方法制备得到的药物组合物、或上述药物组合物的制剂在制备治疗缺血性肝脏损伤的药物中的应用。
本发明的上述技术方案相比现有技术具有以下优点:
(1)本发明通过将NADPH和NAD+联合给药,二者在特定的配比下共同作用,可以显著降低缺血性脑中风小鼠的脑梗死体积,显著改善缺血性脑中风小鼠的行为障碍,显著减轻缺血性脑中风小鼠的脑萎缩,显著提高缺血性脑中风小鼠的长期生存率,显著增强缺血性脑中风小鼠的神经功能恢复,显著抑制缺血性脑中风小鼠大脑皮层缺血区的细胞凋亡和坏死信号通路;这表明,特定的配比下的NADPH和NAD+联合给药对缺血性脑中风有显著的治疗作用;
(2)本发明通过将NADPH和NAD+联合给药,二者在特定的配比下共同作用,对缺血性脑中风的治疗效果显著优于二者单独给药对缺血性脑中风的治疗效果;这表明,特定的配比下的NADPH和NAD+联合给药具有协同增效的作用。
附图说明
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
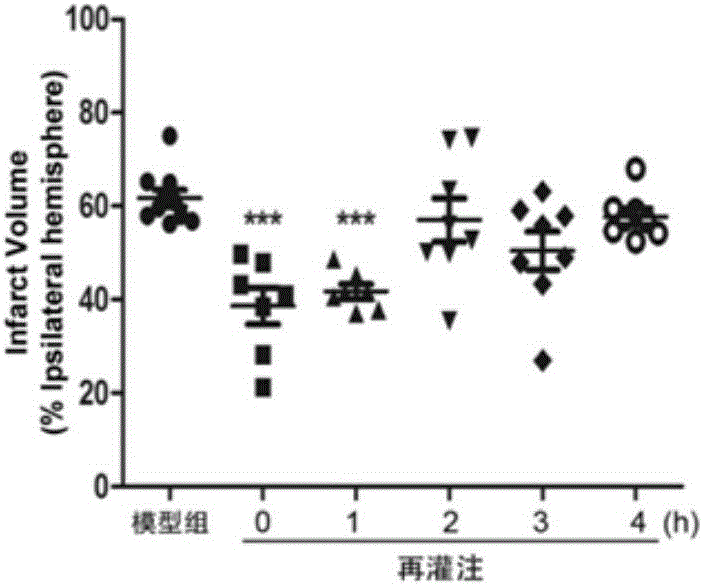
图1(a)、1(b)分别是不同时间给予NAD+对缺血性脑中风小鼠脑梗死体积的影响,其中***表示p<0.001;
图2(a)、2(b)、2(c)分别是7.5mg/kgNADPH+50mg/kgNAD+对缺血性脑中风小鼠脑梗死体积的影响,其中***表示p<0.001,$表示p<0.05;
图3(a)、3(b)、3(c)分别是2.5mg/kgNADPH+50mg/kgNAD+组对缺血性脑中风小鼠脑梗死体积的影响,其中**表示p<0.01,***表示p<0.001,$表示p<0.05;
图4(a)、4(b)、4(c)分别是7.5mg/kgNADPH联合复罐后4h时给予50mg/kgNAD+对缺血性脑中风小鼠脑梗死体积的影响,其中***表示p<0.001,#表示p<0.05;
图5(a)、5(b)、5(c)分别是7.5mg/kgNADPH联合50mg/kgNAD+复罐4h后给予对缺血性脑中风小鼠脑梗死体积的影响,其中***表示p<0.001;
图6(a)、6(b)、6(c)分别是40mg/kgNADPH联合10mg/kgNAD+对缺血性脑中风小鼠脑梗死体积的影响;
图7(a)、7(b)、7(c)分别是0.25mg/kgNADPH+50mg/kgNAD+组对缺血性脑中风小鼠脑梗死体积的影响,其中**表示p<0.01,***表示p<0.001,&表示p<0.05。
图8是7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠脑萎缩的影响,其中***表示p<0.001,#表示p<0.05,###表示p<0.001,&&表示p<0.01,$表示p<0.05;
图9是7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠平衡运动的影响,其中*表示p<0.05,**表示p<0.01;
图10是7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠协调运动的影响,其中*表示p<0.05;
图11是7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠学习记忆能力的影响,其中**表示p<0.01;
图12是7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠长期生存的影响,其中*表示p<0.05;
图13(a)、13(b)、13(c)、13(d)分别是7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血性中风小鼠大脑皮层缺血区细胞凋亡通路的影响,其中***表示p<0.001,##表示p<0.01,###表示p<0.001,&&表示p<0.01;
图14(a)、14(b)、14(c)是7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血性中风小鼠大脑皮层缺血区坏死信号通路的影响,其中***表示p<0.001,##表示p<0.01,###表示p<0.001。
具体实施方式
实施例1
本实施例治疗脑中风的药物组合物,其原料药组成为:NADPH2.5g,NAD+50g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
实施例2
本实施例治疗脑中风的药物组合物,其原料药组成为:NADPH7.5g,NAD+50g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
实施例3
本实施例治疗脑中风的药物组合物,其原料药组成为:NADPH1g,NAD+55g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
实施例4
本实施例治疗脑中风的药物组合物,其原料药组成为:NADPH9g,NAD+45g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
实施例5
本实施例治疗脑中风的药物组合物,其原料药组成为:NADPH7g,NAD+41g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
实施例6
本实施例治疗脑中风的药物组合物,其原料药组成为:NADPH5g,NAD+53g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
对比例1
本对比例治疗脑中风的药物组合物,其原料药组成为:NADPH 40g,NAD+10g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
对比例2
本对比例治疗脑中风的药物组合物,其原料药组成为:NADPH 0.25g,NAD+50g;
其制备方法,包括以下步骤:分别取选定重量的NADPH和NAD+,混合均匀,即得。
实验例
下述各实验例证明本发明所述的技术效果。
实验例1NADPH联合NAD+对小鼠脑缺血再灌注损伤的保护作用
1、实验目的
研究实施例1、实施例2、对比例1和对比例2制备的药物组合物对小鼠脑缺血再灌注损伤的保护作用。
2、实验方法
(1)实验材料
清洁级雄性ICR小鼠,质量23~28g,购自上海史莱克公司,许可证号码:SCXK(沪)2012-0002。
室温22℃,湿度50-60%,通风良好,人工昼夜(12h/12h),自由摄食摄水。实验前,将雄小鼠在饲养环境中适应2d。
外源性NADPH和NAD+药物的来源可以通过人工合成、半合成、生物提取获得。
(2)实验方案
1)小鼠短暂性大脑中动脉阻塞模型建立
采用颈内动脉线栓法,稍加改进制备小鼠MCAO模型,小鼠以4%水合氯醛(400mg/kg)腹腔注射麻醉,我们采用线栓法制备缺血模型,分离颈总、颈外和颈内动脉,结扎劲外和颈总近心端,线栓(6023,DoccolCorporation,Redlands,USA)从颈外插入直到大脑前动脉起始端,阻断大脑中动脉供血。阻断血流2h后,拔出线栓实现再灌注。假手术组小鼠除不插线外,其余步骤均与缺血组和治疗组相同。整个手术过程中室温保持在22~25℃,采用自动控温加热垫将小鼠肛温控制在37±0.5℃。术后将动物置于放有清洁垫料的饲养盒中,自由饮水、进食。
2)脑梗死体积测定
脑缺血再灌注24h后将小鼠断头取脑,置冰箱(-20℃)数分钟,去掉嗅球、小脑和低位脑干,冠状切4刀分为5片(2mm),脑片用红四氮唑(TTC)染色,染色液组成为:1.5mL1%TTC,0.1mL1mol/LK2HPO4,3.4mL生理盐水,37℃避光染色30min,正常组织呈红色,梗死组织为白色。
4%甲醛固定两天后,用滤纸吸干液体再取出脑梗死组织,以梗死脑组织重量占总大脑重量的百分比作为脑梗死体积的指标。用SigmaPro5.0软件计算脑梗塞面积所占百分比。
3)数据统计与分析
数据均以均数±SEM(Mean±SEM)表示,统计分析采用单因素方差分析(one-wayANOVA),p<0.05为统计学差异有显著性。
3、实验结果
不同时间给予NAD+对缺血性脑中风小鼠脑梗死体积的影响分别如图1(a)、1(b)所示。
由图1(a)、1(b)可知,与模型组相比,再灌注后0h和1h时给予NAD+都明显降低了小鼠脑缺血再灌注24h后脑梗死体积(p<0.001;p<0.001),再灌注1h后给予NAD+对小鼠脑缺血再灌注24h后脑梗死体积没有明显影响。这表明,再灌注后1h内给予NAD+可降低脑缺血性中风小鼠脑梗死体积。
7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠脑梗死体积的影响分别如图2(a)、2(b)、2(c)所示。
由图2(a)、2(b)、2(c)可知,与模型组相比,7.5mg/kgNADPH组和50mg/kgNAD+组明显降低了小鼠脑缺血再灌注24h后脑梗死体积(p<0.001;p<0.001);7.5mg/kgNADPH联合50mg/kgNAD+组进一步降低了小鼠脑梗死体积(p<0.001);与单独用7.5mg/kgNADPH组相比,7.5mg/kgNADPH+50mg/kgNAD+组有显著性差异(p<0.05)。这表明,7.5mg/kgNADPH、50mg/kgNAD+以及7.5mg/kgNADPH联合50mg/kgNAD+均可降低脑缺血性中风小鼠脑梗死体积,7.5mg/kgNADPH联合50mg/kgNAD+降低小鼠脑梗死体积的效果优于单独使用7.5mg/kgNADPH或单独使用50mg/kgNAD+的效果。
2.5mg/kgNADPH+50mg/kgNAD+组对缺血性脑中风小鼠脑梗死体积的影响分别如图3(a)、3(b)、3(c)所示。
由图3(a)、3(b)、3(c)可知,与模型组相比,2.5mg/kgNADPH组和50mg/kgNAD+组都明显降低了小鼠脑缺血再灌注24h后脑梗死体积(p<0.001;p<0.001);2.5mg/kgNADPH联合50mg/kgNAD+组进一步降低小鼠脑梗死体积(p<0.001);与单独用2.5mg/kgNADPH组相比,2.5mg/kgNADPH+50mg/kgNAD+组降低小鼠脑梗死体积有显著性差异(p<0.05)。这表明,2.5mg/kgNADPH、50mg/kgNAD+以及2.5mg/kgNADPH联合50mg/kgNAD+均可降低脑缺血性中风小鼠脑梗死体积,2.5mg/kgNADPH联合50mg/kgNAD+的效果优于单独使用2.5mg/kgNADPH或单独使用50mg/kgNAD+的效果。
7.5mg/kgNADPH联合复罐后4h时给予50mg/kgNAD+对缺血性脑中风小鼠脑梗死体积的影响分别如图4(a)、4(b)、4(c)所示。
由图4(a)、4(b)、4(c)可知,与模型组相比,7.5mg/kgNADPH明显降低了小鼠脑缺血再灌注24h后脑梗死体积(p<0.001),50mg/kgNAD+组对小鼠脑梗死体积的降低无明显统计学差异;7.5mg/kgNADPH联合复罐后4h时给予50mg/kgNAD+则进一步降低了小鼠脑梗死体积(p<0.001);与单独用50mg/kgNAD+相比,7.5mg/kgNADPH联合4h后给予50mg/kgNAD+降低小鼠脑梗死体积有显著性差异(p<0.05)。这表明,NADPH、NAD+以及7.5mg/kgNADPH联合复罐后4h时给予50mg/kgNAD+均可降低脑缺血性中风小鼠脑梗死体积,7.5mg/kgNADPH联合复罐后4h时给予50mg/kgNAD+降低小鼠脑梗死体积的效果优于单独使用7.5mg/kgNADPH降低小鼠脑梗死体积或单独使用50mg/kgNAD+降低小鼠脑梗死体积;这进一步证明,联合NADPH可以延长NAD+的治疗时间窗。
7.5mg/kgNADPH联合50mg/kgNAD+复罐4h后给予对缺血性脑中风小鼠脑梗死体积的影响分别如图5(a)、5(b)、5(c)所示。
由图5(a)、5(b)、5(c)可知,与模型组相比,7.5mg/kgNADPH联合50mg/kgNAD+在复罐后4h时和5h时明显降低了小鼠脑缺血再灌注24h后脑梗死体积(p<0.001;p<0.001),而复罐6h时联合用药无明显统计学差异。这表明,联合NADPH可以延长NAD+的治疗时间窗至复罐5h。
40mg/kgNADPH联合10mg/kgNAD+组对缺血性脑中风小鼠脑梗死体积的影响分别如图6(a)、6(b)、6(c)所示。
由图6(a)、6(b)、6(c)可知,与模型组相比,10mg/kg NAD+不能降低小鼠脑缺血再灌注24h后脑梗死体积,40mg/kgNADPH、40mg/kgNADPH联合10mg/kgNAD+均可以降低小鼠脑缺血再灌注24h后脑梗死体积;与单独使用40mg/kgNADPH相比,40mg/kgNADPH联合10mg/kgNAD+降低小鼠脑梗死体积没有显著性差异。这表明,40mg/kgNADPH、40mg/kgNADPH联合10mg/kgNAD+均能降低脑缺血性中风小鼠脑梗死体积,10mg/kg NAD+不能降低脑缺血性中风小鼠脑梗死体积,40mg/kgNADPH联合10mg/kgNAD+降低小鼠脑梗死体积的效果未优于单独使用40mg/kgNADPH或单独使用10mg/kg NAD+的效果,即:没有协同增效的作用。
0.25mg/kgNADPH联合50mg/kgNAD+组对缺血性脑中风小鼠脑梗死体积的影响分别如图7(a)、7(b)、7(c)所示。
由图7(a)、7(b)、7(c)可知,与模型组相比,0.25mg/kgNADPH、没有降低小鼠脑缺血再灌注24h后脑梗死体积,50mg/kgNAD+和0.25mg/kgNADPH联合50mg/kgNAD+组均可以明显降低小鼠脑缺血再灌注24h后脑梗死体积(p<0.001;p<0.001);而与单独用50mg/kg NAD+相比,0.25mg/kgNADPH联合50mg/kgNAD+组降低小鼠脑梗死体积没有显著性差异。这表明,0.25mg/kgNADPH不能降低脑缺血性中风小鼠脑梗死体积,50mg/kgNAD+、0.25mg/kgNADPH联合50mg/kgNAD+均可降低脑缺血性中风小鼠脑梗死体积,0.25mg/kgNADPH+50mg/kgNAD+的效果未优于单独使用0.25mg/kgNADPH或单独使用50mg/kgNAD+的效果,即:没有协同增效的作用。
4、实验结论
实施例1、2制备的药物组合物显著降低缺血性脑中风小鼠脑梗死体积,与二者单独给药相比,具有协同增效的作用;对比例1、2制备的药物组合物均可以降低缺血性脑中风小鼠脑梗死体积,与二者单独给药相比,没有协同增效的作用。
实验例2NADPH联合NAD+对缺血性小鼠神经功能的影响
1、实验目的
研究实施例1、2制备的药物组合物对缺血性小鼠神经功能的影响。
2、实验方法
(1)实验材料
同实验例1
(2)实验方案
1)小鼠短暂性大脑中动脉阻塞模型
同实验例1
2)大脑脑萎缩的测定
脑缺血再灌注28d后将小鼠断头取脑,拍照,用ImageJ软件计算大脑面积。脑萎缩所占百分比=(左脑面积-右脑面积)/左脑面积×100%。
3)神经功能测试
(I)平衡木测试
平衡木行走实验用于评定小鼠的运动整合能力及平衡协调能力。平衡木长91cm,宽35mm,高57cm。
训练:提前一天(小鼠学习后能充分休息),让小鼠自主地完整行走通过平衡木2次。
试验:记录小鼠从平衡木一端到达另一端的时间,只计爬行时间,停留时间不计,若中途摔落,暂停时间,并从摔落处继续出发计时。每次试验每只小鼠测3次,取平均值,测完一次休息1h。
(II)转子杆测试
转子杆测试(Rota-rodtest)在转子杆上保持平衡需要本体觉、位置觉及微调运动能力。该测试要求小鼠在匀速旋转杆上保持平衡,并记录其在转棒上的运动时间及跌落时间得转棒旋转速度。测试中缓慢的加速限制了个体间表现的差异性。
所需道具包括:(1)仪器:滚轮轴心的直径为5cm左右,由坚固的塑料制作而成,外面包裹灰色的橡胶泡沫。管宽约5cm。这个仪器可以在300s内从4转/min加速到40转/min;(2)秒表;(3)50%酒精;(4)纸巾。在测验的时候,把小鼠放在他们自己的笼子里,让它们在测试房间内适应15min(适应环境阶段)。整个测试是由间隔30min的三次试验组成。在测验阶段前没有训练阶段。它可以在同一次试验时直接对下一批小鼠进行操作。仪器设定为在300s内从4转/min加速到40转/min。仪器在开始前以4转/min的恒速运转。
(III)Y迷宫实验(Y-mazetest)
Y型电迷宫3条臂的尽头均有l灯,底部是电网,其中只有1条臂尽头的灯发出亮光,此时该臂底部电网无电流通过,即为安全区。另两臂的灯不亮,底部电网通电(约50V),为非安全区。安全区与非安全区随机改变。实验开始时,将动物放入迷宫中任一臂中适应2~3min。然后将其他任一臂的信号灯打开作为条件刺激,经5s延迟后,灯不亮的两臂通电(非条件刺激)。当动物逃避电击至安全区后,灯亮持续15s,然后熄灯休息45s,即完成1次操作并记录所用时间,然后再开始下一次操作。
4)数据统计与分析
数据均以均数±SEM(Mean±SEM)表示,统计分析采用单因素方差分析(one-wayANOVA),p<0.05为统计学差异有显著性。
3、实验结果
7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠脑萎缩的影响如图8所示。
由图8可知,与Sham组相比,模型组小鼠脑萎缩程度达60%(p<0.001);与模型组相比,7.5mg/kgNADPH、50mg/kgNAD+均明显抑制了脑缺血再灌注诱导的脑萎缩(p<0.05;p<0.05);7.5mg/kgNADPHNADPH联合50mg/kgNAD+则对小鼠的脑萎缩程度的降低更显著(p<0.001)。与单独使用7.5mg/kgNADPH或单独使用50mg/kgNAD+相比,7.5mg/kgNADPH联合50mg/kgNAD+对小鼠的脑萎缩程度的降低有显著性差异(p<0.01;p<0.05)。这表明,7.5mg/kgNADPH、50mg/kgNAD+以及7.5mg/kgNADPH联合50mg/kgNAD+均可改善小鼠脑缺血再灌注28天后的脑萎缩症状,7.5mg/kgNADPH联合50mg/kgNAD+对小鼠的脑萎缩程度的降低的效果优于单独使用7.5mg/kgNADPH或单独使用50mg/kgNAD+对小鼠的脑萎缩程度的降低的效果。
7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠平衡运动的影响如图9所示。
由图9可知,与模型组相比,7.5mg/kgNADPH或50mg/kgNAD+均明显增强脑缺血再灌注后28天存活小鼠的平衡运动能力(p<0.05;p<0.05),7.5mg/kgNADPH联合50mg/kgNAD+组对脑缺血再灌注后28天存活小鼠的平衡运动能力的增强更显著(p<0.01)。这表明,7.5mg/kgNADPH、50mg/kgNAD+以及7.5mg/kgNADPH联合50mg/kgNAD+均可提高小鼠平衡运动能力。
7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠协调运动的影响如图10所示。
由图10可知,与模型组相比,7.5mg/kgNADPH或50mg/kgNAD+能增强脑缺血再灌注后28天存活小鼠的协调运动能力,但无统计学差异;7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血再灌注后28天存活小鼠的协调运动能力的增强更显著(p<0.05)。这表明,NADPH联合NAD+可提高小鼠协调运动能力,7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血再灌注后28天存活小鼠的协调运动能力的增强的效果优于单独使用7.5mg/kgNADPH或单独使用50mg/kgNAD+对脑缺血再灌注后28天存活小鼠的协调运动能力的增强的效果。
7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠学习记忆能力的影响如图11所示。
由图11可知,与模型组相比,7.5mg/kgNADPH或50mg/kgNAD+均明显增强脑缺血再灌注后28天存活小鼠的学习记忆能力,但无统计学差异;7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血再灌注后28天存活小鼠的平衡运动能力的增强更显著(p<0.01)。这表明,7.5mg/kgNADPH联合50mg/kgNAD+可提高小鼠学习记忆能力,7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血再灌注后28天存活小鼠的平衡运动能力的增强的效果优于单独使用7.5mg/kgNADPH或单独使用50mg/kgNAD+对脑缺血再灌注后28天存活小鼠的平衡运动能力的增强的效果。
7.5mg/kgNADPH联合50mg/kgNAD+对缺血性脑中风小鼠长期生存的影响如图12所示。
由图12可知,与模型组相比,7.5mg/kgNADPH以及7.5mg/kgNADPH联合50mg/kgNAD+明显提高了小鼠脑缺血再灌注后28d存活率(p<0.05;p<0.05),50mg/kgNAD+无统计学差异。这表明,7.5mg/kgNADPH以及7.5mg/kgNADPH联合50mg/kgNAD+均可提高小鼠生存率,7.5mg/kgNADPH联合50mg/kgNAD+对小鼠生存率提高的效果优于单独使用7.5mg/kgNADPH或单独使用50mg/kgNAD+对小鼠生存率提高的效果。
4、实验结论
实施例1、2制备的药物组合物显著增强缺血性脑中风小鼠的神经功能恢复,显著改善缺血性脑中风小鼠的行为障碍,显著提高缺血性脑中风小鼠的长期生存率,与二者单独给药相比,具有协同增效的作用。
实验例3 NADPH联合NAD+对缺血性小鼠大脑皮层中细胞凋亡通路和坏死信号通路的影响
1、实验目的
研究实施例1、2制备的药物组合物对缺血性小鼠神经功能的影响。
2、实验方法
(1)实验材料
同实验例1
(2)实验方案
1)小鼠短暂性大脑中动脉阻塞模型
同实验例1
2)Westernblot方法:
a.配制12%SDS-PAGE,上样,电压积层胶90V、分离胶110V,电泳。
b.电泳结束后采用湿转法将样品转移至NC膜,恒流0.3A,2h。
c.转膜结束后,将NC膜放入含有5%脱脂奶粉的TBST中室温下封闭1h。
d.加入含有5%脱脂奶粉和0.1%叠氮钠的TBST配置的一抗,4C摇床过夜。
e.TBST漂洗,10min×3次。
f.加入用含有5%脱脂奶粉TBST配置的荧光二抗,室温2h。
g.TBST漂洗10min×3次。
h.使用LI-COROdyssey仪器捕捉图像。
3)数据统计与分析
数据均以均数±SEM(Mean±SEM)表示,统计分析采用单因素方差分析(one-wayANOVA),p<0.05为统计学差异有显著性。
3、实验结果
7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血性中风小鼠大脑皮层缺血区细胞凋亡通路的影响分别如图13(a)、13(b)、13(c)、13(d)所示。
由图13(a)、13(b)、13(c)、13(d)可知,Sham组凋亡相关蛋白PARP,Bax和Cleavedcaspase3的表达较低,而缺血再灌注后16h,PARP,Bax和Cleavedcaspase3蛋白表达明显升高(p<0.001;p<0.001;p<0.001);与模型组相比,7.5mg/kgNADPH、50mg/kgNAD+以及7.5mg/kgNADPH联合50mg/kgNAD+不同程度地降低了PARP,Bax和Cleavedcaspase3的蛋白水平,并且与7.5mg/kgNADPH相比,7.5mg/kgNADPH联合50mg/kgNAD+明显抑制了PARP蛋白的表达(p<0.01)。
7.5mg/kgNADPH联合50mg/kgNAD+对脑缺血性中风小鼠大脑皮层缺血区坏死信号通路的影响分别如图14(a)、14(b)、14(c)所示。
由图14(a)、14(b)、14(c)可知,Sham组RIP1和RIP3的表达均较低,而缺血再灌注后16h,RIP1和RIP3蛋白表达明显升高(p<0.001;p<0.001);与模型组相比,7.5mg/kgNADPH、50mg/kgNAD+以及7.5mg/kgNADPH联合50mg/kgNAD+均可以不同程度的降低RIP1和RIP3的蛋白水平。
4、实验结论
实施例1、2制备的药物组合物显著抑制缺血性脑中风小鼠大脑皮层缺血区的细胞凋亡和坏死信号通路,与二者单独给药相比,具有协同增效的作用。
综上,(1)本发明通过将NADPH和NAD+联合给药,二者在特定的配比下共同作用,可以显著降低缺血性脑中风小鼠的脑梗死体积,显著改善缺血性脑中风小鼠的行为障碍,显著减轻缺血性脑中风小鼠的脑萎缩,显著提高缺血性脑中风小鼠的长期生存率,显著增强缺血性脑中风小鼠的神经功能恢复,显著抑制缺血性脑中风小鼠大脑皮层缺血区的细胞凋亡和坏死信号通路;这表明,特定配比下的NADPH和NAD+联合给药对缺血性脑中风有显著的治疗作用;(2)特定配比下的NADPH和NAD+联合给药对缺血性脑中风的治疗效果显著优于二者单独给药对缺血性脑中风的治疗效果;这表明,特定配比下的NADPH和NAD+联合给药具有协同增效的作用。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!