包含利匹韦林HCl和富马酸替诺福韦酯的治疗组合物的制作方法
本发明的优先权
本申请要求2010年11月19日提交的申请号为61/415,600的美国临时申请的优先权。由此通过参考将该临时申请的全部内容并入本申请。
发明背景
利匹韦林HCl(RPV),即用于治疗HIV感染的研究新药,具有下式I:
它是第二代非核苷类逆转录酶抑制剂(NNRTI),与其他商业NNRTIs(包括依法韦伦)相比具有更长的半衰期和更好的副作用特征。
恩曲他滨(FTC)是具有下式II的核苷类逆转录酶抑制剂:
恩曲他滨作为(恩曲他滨)胶囊、(恩曲他滨和富马酸替诺福韦酯)片和(依法韦伦、恩曲他滨和富马酸替诺福韦酯)片中的活性成分存在,这些药物被市售用于治疗HIV感染。
富马酸替诺福韦酯(替诺福韦DF或TDF)是具有下式III的逆转录酶抑制剂:
富马酸替诺福韦酯也作为活性成分存在于(富马酸替诺福韦酯)片、(恩曲他滨和富马酸替诺福韦酯)片和(依法韦伦、恩曲他滨和富马酸替诺福韦酯)片中。
利匹韦林HCl、恩曲他滨和富马酸替诺福韦酯的组合目前处于临床研究中,用于治疗HIV(例如TMC278-TiDP6-C209:比较TMC278与依法韦伦联用替诺福韦+恩曲他滨的用于治疗首次HIV-1患者的临床试验,www.clinicaltrials.gov/ct2/show/-NCT00540449?term=TMC278&rank=10。在目前的临床研究中,这种组合以两种片剂的形式给药:一种片剂包含利匹韦林HCl,第二种片剂是商品(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)。
固体口服剂型的包含利匹韦林HCl、恩曲他滨和富马酸替诺福韦酯的固定剂量联用产品是期望的。这样一个固定剂量组合可以给患者提供每日一次给药的给药便利。临床研究已经显示了高水平的依从性和治疗满意度,其中使用简单的每日一次高效抗逆转录病毒治疗(HAART),导致HIV-1 RNA的持久抑制。
国际专利申请公开号WO 2005/021001讨论了用于制备包含利匹韦林HCl、恩曲他滨和富马酸替诺福韦酯的单一片剂的共-湿法制粒。令人遗憾地的是,在利匹韦林HCl的存在下富马酸替诺福韦酯的化学稳定性受影响。因此,WO 2005/021001中讨论的共-湿法制粒方法提供的制剂对人体临床应用而言是不理想的。
目前对包含利匹韦林HCl、恩曲他滨和富马酸替诺福韦酯的固定剂量组合产品存在需求。理想地的是,固定剂量组合产品将提供活性成分的适合的化学稳定性并且将具有作为单位剂型的可接受的大小。另外,对固定剂量形式产生与给予所述单个药剂产生的血浆浓度相等的三种药剂各自的人血浆浓度将是有益的。
发明概述
申请人发现了利匹韦林HCl、恩曲他滨和富马酸替诺福韦酯的单一多层制剂,其提供适合的活性成分的化学稳定性和三种活性剂的血浆浓度,该血浆浓度相当于给予Emtriva(恩曲他滨200毫克)胶囊、Viread(富马酸替诺福韦酯300毫克)片和包含利匹韦林HCl的目前处于临床试验中评价的第三种片剂所产生的血浆浓度。另外,根据曲线下血浆浓度面积(AUC)所测定的,申请人鉴定的这种单一多层制剂在与和不与食物一起给予时,与所述单个成分与食物一起给予时相比,提供了类似的药物暴露。与同食物一起给予所述单个成分相比,不与食物一起给予所述单个成分显示利匹韦林暴露(AUC)下降了21%。限制与食物一起给药仅可能使给药方案复杂化并且损害患者的给药依从性。
因此,在一个实施方案中,本发明提供了片剂,其包含第一层和第二层,其中a)第一层包含利匹韦林HCl;b)第二层包含富马酸替诺福韦酯;以及c)该片剂还包含恩曲他滨。
在一个实施方案中,本发明提供了治疗人HIV感染的方法,其包括对该人给予本发明的片剂,其中摄食时对该人给药后得到的利匹韦林AUC比禁食时对该人给药时得到的利匹韦林AUC大不超过约25%。
在一个实施方案中,本发明提供了治疗人HIV感染的方法,其包括对该人给予本发明的片剂,其中摄食时对该人给药后得到的利匹韦林Cmax比禁食时对该人给药时得到的利匹韦林Cmax大不超过约25%。
在一个实施方案中,本发明提供用于预防或治疗待处理HIV感染的本发明的片剂,其中摄食时对该人给药后得到的利匹韦林AUC比禁食时对该人给药时得到的利匹韦林AUC大不超过约25%。
在一个实施方案中,本发明提供了用于预防或治疗性处理HIV感染的本发明的片剂,其中摄食时对该人给药后得到的利匹韦林Cmax比禁食时对该人给药时得到的利匹韦林Cmax大不超过约25%。
在一个实施方案中,本发明提供了本发明的片剂,其用于预防或治疗性处理HIV感染。
在一个实施方案中,本发明提供了如权利要求1~32任一项中所述的片剂在制备用于治疗人HIV感染的药物中的应用。
本发明还提供了如本文所述的制备本发明片剂的方法和可用于制备本发明片剂的新的中间体混合物。
本发明的片剂代表了开发用于治疗病毒感染例如HIV的多药物疗法中的进步。
附图简述
图1.示例本发明的片剂。
图2.示例本发明的片剂。
图3.示例本发明的片剂。
图4.是示例制备实施例1中所述的本发明有代表性的片剂的流程图。
图5.是示例制备实施例2中所述的本发明有代表性的片剂的流程图。
图6.是示例制备实施例3中所述的本发明有代表性的片剂的流程图。
图7.示例对比例1中测定的随时间变化的总TDF降解百分比。
图8.示例对比例4中测定的随时间变化的总TDF降解百分比。
图9.示例实施例5中测定的溶出的RPV百分比。
详细描述
如本文关于本发明的方法所使用的,在“摄食”时对人给药是指在人消耗约300-600卡标准膳食和约10-约15克脂肪的5分钟内对该人给予本发明的片剂。
如本文关于本发明的方法所使用的,在“禁食”时对人给药是指对在从给予所述片剂前约8小时到给予所述片剂后约4小时的时间期限内没有消耗食物的人给予本发明的片剂。
如本文所使用的,当本发明的片剂包含“基本上不含”指定成分的层时是,它是指在该层中测到的该成分的量少于存在于片剂中的所述指定成分的总重量的5%。在本发明的一个实施方案中,当本发明的片剂包含“基本上不含”指定成分的层时,它意指在该层中测到的该成分的量少于存在于片剂中的所述指定成分的总重量的1%。
如下对范围和术语列出的具体值仅是示例性的;它们不排除其他值。
在一个实施方案中,本发明提供了片剂,其中第二层包含恩曲他滨。
在一个实施方案中,本发明提供了片剂,其包含27.5±1.4毫克的利匹韦林HCl。
在一个实施方案中,本发明提供了片剂,其包含200±10.0毫克的恩曲他滨。
在一个实施方案中,本发明提供了片剂,其包含300±15.0毫克的富马酸替诺福韦酯。
在本发明的一个实施方案中,第一层还包含一种或多种稀释剂、崩解剂、粘合剂或润滑剂。
在本发明的一个实施方案中,本发明片剂中的第一层的总重量为275±75毫克。
在本发明的一个实施方案中,所述片剂中的第一层的总重量大于225毫克。
在本发明的一个实施方案中,本发明片剂中的第一层的总重量为275±50毫克。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含乳糖一水合物、聚维酮、交联羧甲基纤维素钠、聚山梨醇酯20、微晶纤维素和硬脂酸镁。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含碱化剂。在本发明的一个实施方案中,所述碱化剂选自交联羧甲基纤维素钠、碳酸钙、氢氧化钠、氧化铝、碱金属氢氧化物(例如氢氧化钠、氢氧化钾和氢氧化锂)、碱土金属氢氧化物(例如氢氧化钙和氢氧化镁)、氢氧化铝、二氢铝(dihydroaluminum)、碳酸钠、硫酸氢氧化铝镁(aluminum magnesium hydroxide sulfate)、氢氧化铝碳酸镁、氢氧化铵、碳酸镁、硬脂酸镁、哌嗪、乙酸钠、柠檬酸钠、酒石酸钠、马来酸钠和琥珀酸钠及其混合物。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含交联羧甲基纤维素钠和聚山梨醇酯20。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含乳糖一水合物、聚维酮、交联羧甲基纤维素钠、聚山梨醇酯20、微晶纤维素和硬脂酸镁。
在一个实施方案中,本发明提供了本发明的片剂,其中第二层包含微晶纤维素和交联羧甲基纤维素钠。
在一个实施方案中,本发明提供了本发明的片剂,其中第二层包含乳糖一水合物、预胶化淀粉、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层与第二层接触。
在一个实施方案中,本发明提供了本发明的片剂,其还包含位于第一层与第二层之间并且使第一层和第二层分开的第三层。在一个实施方案中,第三层包含乳糖一水合物或微晶纤维素或其混合物。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层是覆盖第二层的薄膜包衣。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层是完全覆盖第二层的聚合物薄膜包衣。
在一个实施方案中,本发明提供了片剂,其还包含薄膜包衣。在一个实施方案中,所述薄膜包衣包含34±12毫克的欧巴代II紫33G100000(Opadry II Purple 33G100000)。
在一个实施方案中,本发明提供了片剂,其中至少约5.4重量百分比的第一层是交联羧甲基纤维素钠且至少约63.3重量百分比的第一层是乳糖一水合物。
在一个实施方案中,本发明提供了片剂,其中少于约12.2重量百分比的第一层是盐酸利匹韦林。
在一个实施方案中,本发明提供了片剂,其中少于约12重量百分比的第一层是盐酸利匹韦林。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约230毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约240毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约250毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约260毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约270毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约280毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约290毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约300毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约230毫克且少于约325毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约300毫克且少于约325毫克。
在一个实施方案中,本发明提供了片剂,其中第一层包含27.5±1.4毫克的盐酸利匹韦林并且其中第一层的总重量至少为约290毫克且少于约310毫克。
在一个实施方案中,本发明提供了如本文所述制备的片剂。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含:
且第二层包含:
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含:
且第二层包含:
在一个实施方案中,本发明提供了片剂,其包含含有如下成分的第一层:
包含如下成分的第二层:
和位于第一层与第二层之间并且使第一层和第二层分开的第三层且第二层包含150±8.0毫克的微晶纤维素或乳糖一水合物或其混合物。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层由如下成分组成:
和由如下成分组成的第二层:
在一个实施方案中,本发明提供了片剂,其包含由如下成分组成的第一层:
由如下成分组成的第二层:
和位于第一层与第二层之间并且使第一层和第二层分开的第三层,且第二层包含150±8.0毫克的微晶纤维素或乳糖一水合物或其混合物。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层是覆盖第二层的薄膜包衣并且其中第一层包含27.5±1.4毫克的利匹韦林HCl;且第二层包含:
在一个实施方案中,本发明提供了本发明的片剂,其中第一层是覆盖第二层的薄膜包衣并且其中第一层包含27.5±1.4毫克的利匹韦林HCl;且第二层由如下成分组成:
在一个实施方案中,本发明提供了本发明的片剂,其中第一层包含:
且第二层包含:
在一个实施方案中,本发明提供了片剂,其包含含有如下成分的第一层:
包含如下成分的第二层:
和位于第一层与第二层之间并且使第一层和第二层分开的第三层且第二层包含150±8.0毫克的微晶纤维素或乳糖一水合物或其混合物。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层由如下成分组成:
且第二层由如下成分组成:
在一个实施方案中,本发明提供了片剂,其包含由如下成分组成的第一层:
由如下成分组成的第二层:
和位于第一层与第二层之间并且使第一层和第二层分开的第三层且第二层包含150±8.0毫克的微晶纤维素或乳糖一水合物或其混合物。
在一个实施方案中,本发明提供了本发明的片剂,其中第一层是覆盖第二层的薄膜包衣并且其中第一层包含27.5±1.4毫克的利匹韦林HCl;且第二层包含:
在一个实施方案中,本发明提供了本发明的片剂,其中第一层是覆盖第二层的薄膜包衣并且其中第一层包含27.5±1.4毫克的利匹韦林HCl;且第二层由如下成分组成:
本发明的片剂可以包括一种或多种可接受的载体。该载体应是“可接受的”,其含义是与制剂的其他成分相容且在生理学上对其接受者无害。本文所用的术语载体包括赋形剂、助流剂、填充剂、粘合剂、润滑剂、稀释剂、防腐剂、表面活性剂、分散剂等。例如,参见Handbook of Pharmaceutical Excipients(APhA出版,华盛顿,DC),将该文献完整地引入本文参考。术语载体还包括试剂,例如甜味剂、矫味剂、着色剂和防腐剂。此外,这些术语包括本文举出的值和与常规实践一致的值。
本发明的片剂还可以包含覆盖部分或全部片剂的薄膜包衣。薄膜包衣衣料是本领域公知的且可以由亲水性聚合物材料组成,但不限于多糖材料,例如羟丙基甲基纤维素(HPMC)、甲基纤维素、羟乙基纤维素(HEC)、羟丙基纤维素(HPC)、聚(乙烯醇-共-乙二醇)和其他水溶性聚合物。尽管本发明薄膜包衣中包括的水溶性材料可以包括单一聚合物材料,但是它也可以使用多种聚合物的混合物形成。在本发明的一个实施方案中,薄膜包衣包含欧巴代II紫33G100000,其可购自Colorcon。
本发明的片剂可以便利地制成单位剂型且可以通过任意制药领域众所周知的方法制备。技术和制剂一般性可以在Remington'sPharmaceutical Sciences(Mack出版公司,Easton,PA)中找到,将该文献完整地引入本文参考。这种方法包括将活性成分与构成一种或多种辅助成分的载体混合的步骤。
可以通过任选地用一种或多种辅助成分压制或模制制备片剂。压制片可以通过在适合的机器中压制自由流动形式的活性成分例如粉末或胶囊制备,所述的活性成分任选地与粘合剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂或分散剂混合。模制片可以通过在适合的机器中模制用惰性液体稀释剂湿润的粉状活性成分的混合物制备。例如,可以任选地用聚合物薄膜包衣给片剂包衣,所述的聚合物薄膜包衣可以任选地包含式I的化合物。
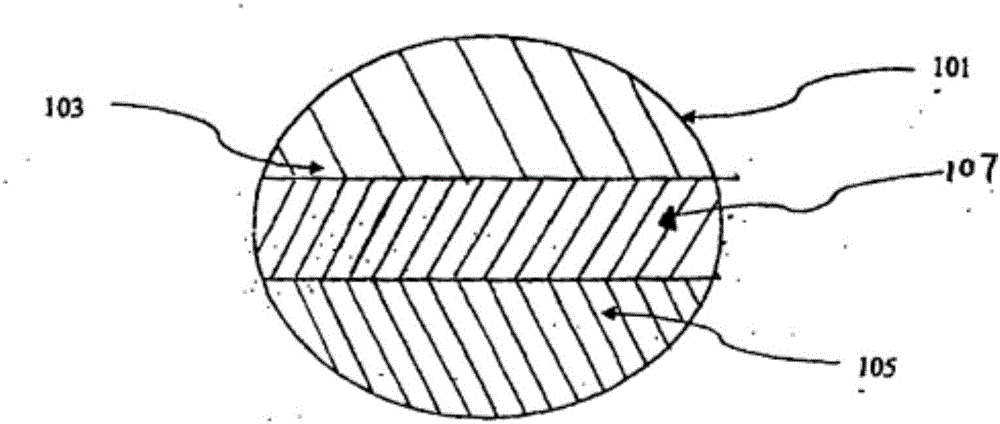
图1显示本发明片剂(101)的横截面。该片剂包括包含利匹韦林HCl的第一层(103)。该片剂还包括包含富马酸替诺福韦酯的第二层(105)。第一层和第二层还可以进一步包含恩曲他滨。
图2显示本发明片剂(101)的横截面。该片剂包括包含利匹韦林HCl的第一层(103)。该片剂还包括包含富马酸替诺福韦酯的第二层(105)和为惰性的第三层(107)。第一层和第二层还可以各自进一步包含恩曲他滨。
图3显示本发明片剂(101)的横截面。该片剂包括包含利匹韦林HCl的第一层(109)和包含富马酸替诺福韦酯和恩曲他滨的第二层(105),其中第一层(109)是覆盖第二层(105)的包衣。
对比例
对比例1.FTC、RPV和TDF的共-湿法制粒制剂的制备和稳定性评价
基于的制剂组成(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)和RPV 3期临床制剂,单一共-湿法制粒法用于配制FTC、RPV和TDF。因为共-湿法制粒法具有易于制备的益处,它通常是研发FDC产品的第一选择方法。低剂量的RPV和使用常用于(富马酸替诺福韦酯)、(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)和(恩曲他滨)的赋形剂使得FTC/RPV/TDF顺应于单层湿法制粒法。一种挑战在于在表面活性剂的存在下维持TDF的稳定性。
将所评价的共-湿法制粒制剂的组成和加工参数分别概述在表CE1.1和CE1.2中。在有和没有非离子型表面活性剂(泊洛沙姆188和聚山梨醇酯20)的存在下进行湿法制粒。
表CE1.1
表CE1.2
用3g硅胶干燥剂包装未包衣的片剂并且贮存在50℃下和40℃/75%RH稳定性隔室中以压制片剂样品并且加速降解速率,得到在环境条件(25℃/60%RH)下的片剂长期稳定性的迹象。制剂前研究已经证实TDF在水溶液中发生水解且在接触湿度和热后在固态中达到较小的程度。降解产物是一-POC PMPA、异丙醇、二氧化碳和甲醛。共-湿法制粒制剂中TDF的降解速率和程度明显高于商品(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)片剂中的降解速率和程度。在50℃下2周后总TDF-相关杂质和降解产物增加至4%以上。通过除去表面活性剂或增加微晶纤维素和预胶化淀粉浓度改善共-湿法制粒制剂中TDF的化学稳定性的各种尝试没有改善制剂稳定性。这些结果显示TDF的降解速率共-湿制粒法对人体临床应用而言并不理想。将在50℃下的稳定性数据概述在图7中。全部制剂显示远高于(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)片剂中的降解速率。
如下实施例6中所示例的,本发明有代表性的片剂克服了存在于上述共-湿法制剂中存在的TDF稳定性降低的问题。
对比例2.制剂1的制备
通过掺合FTC、RPV和TDF与赋形剂,然后使用干制粒法将它们一起干燥制粒,制备了制剂1,所述干制粒法使用滚筒压实器和研磨机。将颗粒与颗粒外赋形剂掺合并且压制成片芯,然后将其进行薄膜包衣。将用于共-干燥制粒制剂(制剂1)的组成参数概述在表CE2.1中。
表CE2.1
a相当于25.0毫克的利匹韦林游离碱
b相当于245毫克的替诺福韦地索普西(tenofovir disoproxil)
对比例3.制剂2的制备
使用两种单独的制粒法制备制剂2,其中通过流化床制粒法湿法制粒利匹韦林HCl,用高剪切湿制粒法共同制粒恩曲他滨和富马酸替诺福韦酯。将该制剂设计成使用颗粒内利匹韦林HCl制剂且流化床制粒法用于制备RPV片剂,其目前处于3期临床试验评价中。使用所述方法和用于制备(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)的颗粒内组合物生产恩曲他滨/富马酸替诺福韦酯粉末掺合物。然后将两种颗粒与润滑剂掺合,压制成单层片剂,然后薄膜包衣。将制剂2的组合物参数概述在表CE3.1中。
表CE3.1
a相当于25.0毫克利匹韦林游离碱
b相当于245毫克的替诺福韦地索普西
对比例4.制剂1和制剂2的稳定性
使用HPLC方法测定APIs和降解产物的同一性和浓度,该方法使用4.6×250-mm C-12柱(4-μm粒径),用于通过使用反相色谱法进行色谱分离,其中使用由乙酸铵缓冲液和乙腈组成的流动相,在约60分钟内梯度洗脱。溶解10片复合样品,用4:3:3pH 3磷酸盐缓冲液:乙腈:甲醇溶液稀释成约0.08毫克/mL RPV、0.64毫克/mL FTC和0.96毫克/mL TDF的终浓度。通过HPLC、使用面积校准和外部参比标准品在262nm波长测定FTC、RPV和TDF的浓度和降解产物含量。将贮存在40℃/75%RH中的在包含3g硅胶干燥剂的诱导密封瓶中的30计数片剂的稳定性数据概述在图8中。
在如下对比例5中,评价来自实施例2和3的制剂1和制剂2的生物利用度。制剂1和2二者都没有显示利匹韦林的生物等效性,曲线下的面积(AUC)和Cmax水平显著高于使用目前处于临床试验评价中的利匹韦林片剂得到的结果。因此,制剂1和制剂2产生的利匹韦林人血浆浓度与目前在临床试验中产生的利匹韦林血浆浓度不相当。本发明有代表性的片剂确实显示了提供利匹韦林血浆浓度的有益特性,该血浆浓度与目前临床试验中产生的血浆水平相当(参见下文实施例5)。
对比例5.制剂1和制剂2的生物利用度
进行临床研究以评价制剂1和2相对于共同给予的单独成分的生物利用度和生物等效性,其中全部处理均在摄食状态下给予。制剂1和2均没有显示利匹韦林的生物等效性,其曲线下的面积(AUC)和Cmax水平明显高于使用目前处于3期临床试验评价中的利匹韦林片剂得到的结果。相反,来自制剂1和2的恩曲他滨和替诺福韦AUC和Cmax水平分别与商品制剂(恩曲他滨)和(富马酸替诺福韦酯)具有生物等效性。在生物等效性研究中从制剂1和2中观察到的利匹韦林显著更高的接触水平可以归因于利匹韦林HCl与恩曲他滨或富马酸替诺福韦酯之间直接的物化相互作用。这些结果启示所述制剂和制备方法需要显著改进以得到期望的利匹韦林暴露。
Cmax:ng/mL,AUC:ng*hr/mL
现在通过下列非限制性实施例示例本发明。
实施例
实施例1.本发明有代表性的双层片的合成
在本发明的一个实施方案中,可以将制备方法分解成多个阶段:流化床制粒和干燥利匹韦林HCl、高剪切湿法制粒恩曲他滨和富马酸替诺福韦酯、研磨和掺合每种颗粒、双层压片、片剂整体薄膜包衣和包装。该逐步操作如下文详细描述。为了适应设备容量,可以对过程中产品进行制粒并且在多个部分中干燥。然后在最终研磨和掺合步骤前合并。如图4中所示,可以如下制备本发明有代表性的片剂。
利匹韦林HCl的流化床制粒
1)称重利匹韦林HCl和赋形剂(乳糖一水合物和交联羧甲基纤维素钠)。基于药物含量因子,校准利匹韦林HCl重量,乳糖一水合物重量同时减少。
2)称重纯水、聚山梨醇酯20和聚维酮。在不锈钢容器中在2个步骤中混合,形成制粒粘合剂流体。首先,加入聚维酮,然后加入聚山梨醇酯20,混合至完全溶解。
3)将利匹韦林HCl、乳糖一水合物和交联羧甲基纤维素钠加入到流化床制粒机/干燥器中,使床流化以预混合所述成分。
4)喷雾整个体积的粘合剂溶液,同时维持粉末床流化。
5)在添加溶液后,在流化床制粒机/干燥器中干燥颗粒以达到如通过干燥失重(LOD)测定的适合的含湿量。
利匹韦林掺合物的研磨和掺合
6)通过用于粒径减小的研磨机转移干燥的颗粒。
7)加入干燥的研磨的颗粒和颗粒外乳糖一水合物、微晶纤维素和交联羧甲基纤维素钠,用掺合机掺合。
8)加入颗粒外硬脂酸镁,掺合。
恩曲他滨/富马酸替诺福韦酯的湿法制粒
9)称重恩曲他滨、富马酸替诺福韦酯和赋形剂(预胶化淀粉、交联羧甲基纤维素钠、乳糖一水合物、微晶纤维素和硬脂酸镁)。基于药物含量因子,校准富马酸替诺福韦酯和恩曲他滨重量,相应地调整乳糖一水合物的重量。
10)将恩曲他滨、富马酸替诺福韦酯和颗粒内赋形剂(预胶化淀粉、交联羧甲基纤维素钠、微晶纤维素和乳糖一水合物)加入到高剪切制粒机/混合器中,用设定在低速的旋转混合器掺合。
11)将水加入到干燥掺合物中,同时用旋转混合器(混合器)和制粒机(料斗)混合,形成湿颗粒。加入水后,湿物料完全形成颗粒。
12)研磨湿法制粒的材料。
流化床干燥
13)将湿颗粒转入流化床干燥器,将该颗粒干燥至如通过干燥失重(LOD)所测定的适合的含湿量。
恩曲他滨/富马酸替诺福韦酯掺合物的研磨和掺合
14)通过用于粒径减小的研磨机转移干燥的颗粒和颗粒外赋形剂(交联羧甲基纤维素钠)。
15)掺合该混合物。
16)向该混合物中加入硬脂酸镁,掺合。
压片
17)用双层片压片机将恩曲他滨/富马酸替诺福韦酯最终粉末掺合物,然后将利匹韦林最终粉末掺合物压制成目标重量和硬度。
薄膜包衣
18)用欧巴代II紫33G100000的含水混悬液给未包衣的片芯进行薄膜包衣,得到目标重量增加。
实施例2.本发明有代表性的三层片的合成
在本发明的一个实施方案中,可以将制备方法分解成多个阶段:流化床制粒和干燥利匹韦林HCl、高剪切湿法制粒恩曲他滨和富马酸替诺福韦酯、研磨和掺合每种颗粒、三层压片、片剂整体薄膜包衣和包装。该逐步操作如下文详细描述。为了适应设备容量,可以对过程中产品进行制粒并且在多个部分中干燥,然后在最终研磨和掺合步骤前将它们合并。如图5中所示,可以如下制备本发明有代表性的片剂。
利匹韦林HCl的流化床制粒
1)称重利匹韦林HCl和赋形剂(乳糖一水合物和交联羧甲基纤维素钠)。基于药物含量因子,校准利匹韦林HCl重量,乳糖一水合物重量同时减少。
2)称重纯水、聚山梨醇酯20和聚维酮。在不锈钢容器中在2个步骤中混合,形成制粒粘合剂流体。首先,加入聚维酮,然后加入聚山梨醇酯20,混合至完全溶解。
3)将利匹韦林HCl、乳糖一水合物和交联羧甲基纤维素钠加入到流化床制粒机/干燥器中,使床流化以预混合所述成分。
4)喷雾整个体积的粘合剂溶液,同时维持粉末床流化以确保均匀颗粒生长。
5)在添加溶液后,在流化床制粒机/干燥器中干燥颗粒以达到如通过干燥失重(LOD)测定的适合的含湿量。
利匹韦林掺合物的研磨和掺合
6)通过用于粒径减小的研磨机转移干燥的颗粒。
7)加入干燥的研磨的颗粒和颗粒外乳糖一水合物、微晶纤维素和交联羧甲基纤维素钠,用掺合机掺合。
8)加入颗粒外硬脂酸镁,掺合。
恩曲他滨/富马酸替诺福韦酯的湿法制粒
9)称重恩曲他滨、富马酸替诺福韦酯和赋形剂(预胶化淀粉、交联羧甲基纤维素钠、乳糖一水合物、微晶纤维素和硬脂酸镁)。基于药物含量因子,校准富马酸替诺福韦酯和恩曲他滨重量,相应地调整乳糖一水合物的重量。
10)将恩曲他滨、富马酸替诺福韦酯和颗粒内赋形剂(预胶化淀粉、交联羧甲基纤维素钠、微晶纤维素和乳糖一水合物)加入到高剪切制粒机/混合器中,用设定在低速的旋转混合器掺合。
11)将水加入到干燥掺合物中,同时用旋转混合器(混合器)和制粒机(料斗)混合,形成湿颗粒。加入水后,湿物料完全形成颗粒。
12)研磨湿法制粒的材料。
流化床干燥
13)将湿颗粒转入流化床干燥器,将该颗粒干燥至如通过干燥失重(LOD)所测定的适合的含湿量。
恩曲他滨/富马酸替诺福韦酯掺合物的研磨和掺合
14)通过用于粒径减小的研磨机转移干燥的颗粒和颗粒外赋形剂(交联羧甲基纤维素钠)。
15)掺合该混合物。
16)向硬脂酸镁中加入该混合物,掺合。
压片
17)用三层片压片机将恩曲他滨/富马酸替诺福韦酯最终粉末掺合物,然后将利匹韦林最终粉末掺合物压制成目标重量和硬度,其中乳糖一水合物或微晶纤维素作为中间层。
薄膜包衣
18)用欧巴代II紫33G100000的含水混悬液给未包衣的片芯进行薄膜包衣,得到目标重量增加。
实施例3.本发明有代表性的双层片的合成
为了适应设备容量,可以对过程中产品进行制粒并且在多个部分中干燥,然后在最终研磨和掺合步骤前将它们合并。如图6中所示,可以如下制备本发明有代表性的片剂。
恩曲他滨/富马酸替诺福韦酯的湿法制粒
1)称重恩曲他滨、富马酸替诺福韦酯和赋形剂(预胶化淀粉、交联羧甲基纤维素钠、乳糖一水合物、微晶纤维素和硬脂酸镁)。基于药物含量因子校准,富马酸替诺福韦酯和恩曲他滨重量,相应地调整乳糖一水合物的重量。
2)将恩曲他滨、富马酸替诺福韦酯和颗粒内赋形剂(预胶化淀粉、交联羧甲基纤维素钠、微晶纤维素和乳糖一水合物)加入到设定在低速的高剪切制粒机/混合器中。
3)将水加入到干燥掺合物中,同时用旋转混合器(混合器)和制粒机(料斗)混合,形成湿颗粒。加入水后,湿物料完全形成颗粒。
4)研磨湿法制粒的材料。
流化床干燥
5)将湿颗粒转入流化床干燥器,将该颗粒干燥至如通过干燥失重(LOD)所测定的适合的含湿量。
恩曲他滨/富马酸替诺福韦酯掺合物的研磨和掺合
6)通过用于粒径减小的研磨机转移干燥的颗粒和颗粒外赋形剂(交联羧甲基纤维素钠)。
7)掺合该混合物。
8)向该混合物中加入硬脂酸镁,掺合。
压片
9)用单层片压片机将恩曲他滨/富马酸替诺福韦酯最终粉末掺合物压制成目标重量和硬度。
RPV薄膜包衣
10)制备RPV在有机溶剂或水性介质中的溶液或混悬液。该溶液或混悬液可以包含另外的赋形剂,例如聚维酮、聚乙二醇、羟丙基甲基纤维素、乳糖一水合物和/或湿润剂,以辅助薄膜包衣粘附在片剂表面上。
11)用聚合物和利匹韦林HCl的溶液/混悬液给未包衣的片芯进行薄膜包衣以达到具有效力的目标重量增加。
实施例4.本发明有代表性的片剂的制备
研究双层制剂,其中一层包含利匹韦林HCl(下文称作利匹韦林层),而另一层包含恩曲他滨和富马酸替诺福韦酯。这种方法用于将利匹韦林HCl与恩曲他滨和富马酸替诺福韦酯之间任何可能的理化相互作用减少至最低限度。这种双层制剂方法涉及两个单独的制粒过程,其中使用流化床制粒法对利匹韦林HCl进行湿法制粒,而使用高剪切湿制粒法对恩曲他滨和富马酸替诺福韦酯进行共制粒。通过将两种掺合物压制成双层片剂使两种颗粒以物理方式分隔开(制剂3和4)。制剂3和4的定量组成分别如表4.1和表4.2中所示。尽管制剂3和4使用相同的制备方法,但是每种制剂中利匹韦林HCl颗粒的制剂组成在所用的赋形剂的相对比例方面不同。
表4.1.制剂3片剂的定量组成
a相当于25.0毫克利匹韦林游离碱.
b相当于245毫克的替诺福韦地索普西
表4.2.制剂4片给的定量组成
a相当于25.0毫克利匹韦林游离碱.
b相当于245毫克的替诺福韦地索普西
通过使用现存的颗粒内RPV制剂和流化床制粒法将制剂3和4设计成将固定剂量的组合片剂与目前处于临床试验中的制剂之间的制剂和制备工艺差异减小到最低限度。此外,使利匹韦林HCl与恩曲他滨和富马酸替诺福韦酯隔离。通过双层压片法生产片剂达到这一目的。通过相同制备方法并且使用(恩曲他滨200毫克/富马酸替诺福韦酯300毫克)的相同颗粒内组成生产恩曲他滨/富马酸替诺福韦酯粉末掺合物。利匹韦林与恩曲他滨/富马酸替诺福韦酯层之间的重量差异要求稀释利匹韦林HCl颗粒以确保稳定的片剂制备工艺。通过调整具有微晶纤维素、乳糖一水合物、交联羧甲基纤维素钠和硬脂酸镁的利匹韦林层中赋形剂的浓度适应制剂3和4中的层重。
实施例5.制剂3和4的生物利用度
本研究评价来自实施例4的制剂3与三种单独剂型(FTC+RPV+TDF,参比)共同给药的生物等效性。
在健康成年人中在摄食条件下进行的随机化、单剂量、标签公开、I期研究。在口服给予每种处理后192小时内得到系列血样,计算PK参数。根据测试治疗与参比治疗之间每种药物的Cmax、AUClast和AUCinf的几何最小二乘法(GMR)之比的90%置信区间(CI)评价制剂的生物等效性。
结果:36位受试者登记并且有34位受试者完成了本研究。总的说来,全部治疗是充分耐受的,所观察到的大部分不良事件的严重程度轻微。PK参数的算术平均值与几何平均值之比(GMR)与90%置信区间如下所示。
Cmax:ng/mL,AUC:ng*hr/mL
Cmax:ng/mL,AUC:ng*hr/mL
发现制剂3产生三种活性剂各自的人血浆浓度相当于给予单独的活性剂产生的血浆浓度。来自实施例4的制剂4产生的三种活性剂各自的人血浆浓度与给予单独的活性剂产生的血浆浓度不相当。
制剂3和制剂4在颗粒外赋形剂和存在的交联羧甲基纤维素钠的量方面不同。生物等效制剂(制剂3)具有的利匹韦林层中颗粒外赋形剂(微晶纤维素和乳糖一水合物)和交联羧甲基纤维素钠的量明显高于(38%)制剂4。实验室数据显示在恩曲他滨和/或富马酸替诺福韦酯的存在下利匹韦林的特性溶出速率增加,从而启示溶解度增加可以促成与恩曲他滨和富马酸替诺福韦酯共同配制时更高的利匹韦林生物利用。可以推定与利匹韦林单一活性剂参比片剂具有生物等效性的制剂3的利匹韦林层中较高量的稀释剂可以用于减少利匹韦林与恩曲他滨和/或富马酸替诺福韦酯之间的接触和相互作用程度并且实现生物等效性。
此外,较高量的交联羧甲基纤维素钠即超级崩解剂导致更为快速的层崩解和利匹韦林层与恩曲他滨/富马酸替诺福韦酯层隔离,从而将利匹韦林与恩曲他滨和/或富马酸替诺福韦酯之间任何可能的相互作用减少至最低限度。利匹韦林层中交联羧甲基纤维素钠即碱化赋形剂的浓度对利匹韦林溶出速率也具有令人意外的效果。较高浓度的这种超级崩解剂令人意外地降低了溶出速率,如图9中所示。这可能归因于这种赋形剂的碱化特性。
实施例6.制剂3成分的稳定性
使用HPLC方法测定APIs和降解产物的同一性和浓度,该方法使用4.6×250-mm C-12柱(4-μm粒径),用于通过使用反相色谱法进行色谱分离,其中使用由乙酸铵缓冲液和乙腈组成的流动相,在约60分钟内梯度洗脱。溶解10片复合样品,用4:3:3pH 3磷酸盐缓冲液:乙腈:甲醇溶液稀释成约0.08毫克/mL RPV、0.64毫克/mL FTC和0.96毫克/mL TDF的终浓度。通过HPLC、使用面积校准和外部参比标准品在262nm波长测定FTC、RPV和TDF的浓度和降解产物含量。将贮存在40℃/75%RH中的在包含3g硅胶干燥剂的诱导密封瓶中的30计数片剂稳定性的数据概述在下表中,显示了在加速贮存条件下可接受的化学稳定性。
实施例7.制剂4成分的稳定性
将贮存在40℃/75%RH中的在包含3g硅胶干燥剂的诱导密封瓶中的30计数片剂稳定性的数据概述在下表中,显示了在加速贮存条件下与制剂3相比可接受的化学稳定性。
实施例8.食物效应
在对比生物利用度研究中评价制剂3,以评估在参比组中给予作为包含恩曲他滨、利匹韦林HCl和富马酸替诺福韦酯的三种单独的片剂时,食物对利匹韦林HCl接触的效应。
“摄食”状态或“摄食条件”是指在完成标准膳食(早餐)的5分钟内给予研究药物。给药后限制受试者食物消耗约4小时。在抽取4-小时剂量后血液后给受试者提供膳食(标准午餐)。全部膳食和/或零食对全部受试者而言都是标准化的且与每天几乎同时摄取的卡和脂肪含量类似。在给药的当天的标准早餐包含约400卡(kcal)和约13g脂肪。
“禁食”状态是指在没有食物的存在下给药研究药物。使受试者禁食过夜,给予研究药物,然后在给药后限制它们食物消耗约4小时。在抽取4-小时剂量后血液后给受试者提供膳食(标准午餐)。
下文中提供了药代动力学参数的平均值与摄食条件下参比组的平均值的对比。禁食状态下制剂3的AUC值与摄食条件下参比组相同。禁食状态下参比组显示与摄食条件下相比AUC值减少26%。
Cmax:ng/mL,AUC:ng*hr/mL
通过参考将全部公开出版物、专利和专利文献并入本文,如同通过参考将它们单独并入一样。已经参照不同的具体和优选实施方案和技术描述了本发明。然而,应理解,可以进行许多改变和变型,同时保持它们属于本发明的精神和范围内。
- 还没有人留言评论。精彩留言会获得点赞!