石杉碱甲骨架微粒、口崩片及其制备方法与流程
本发明涉及药物制剂
技术领域:
,特别是涉及一种石杉碱甲骨架微粒、口崩片及其制备方法。
背景技术:
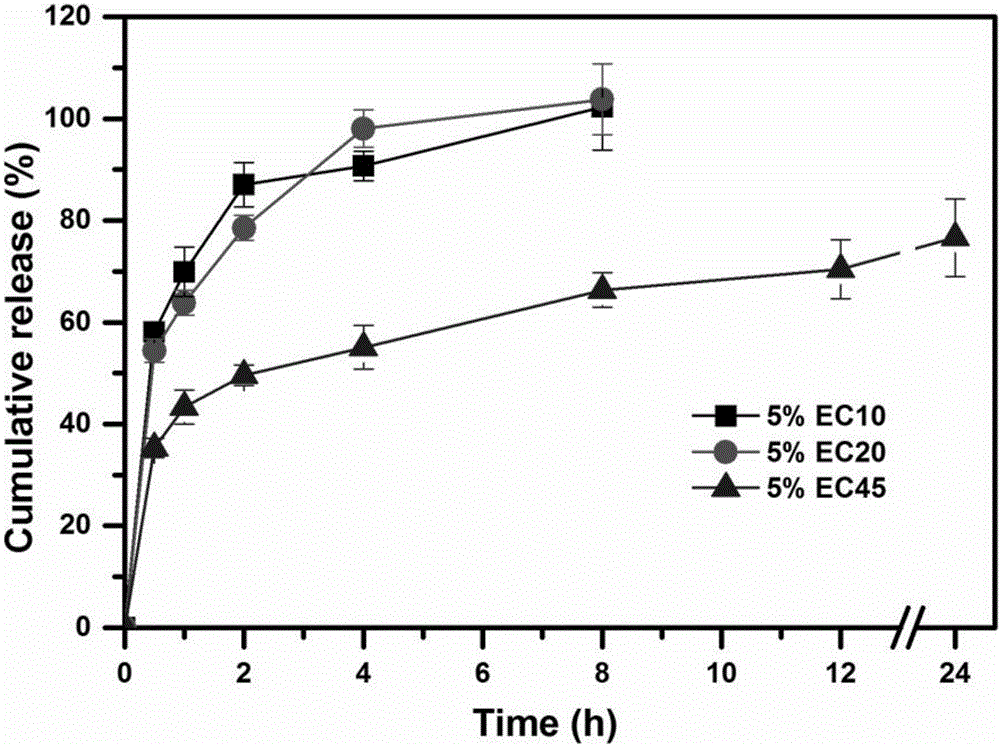
:多单元制剂又称剂量分散型制剂,是指一组结构相近或一致的亚单元构成的一个完整的给药剂量。与单单元制剂相比,多单元制剂有着减少胃肠道刺激,提高生物利用度和临床用药安全性的优势,但其缺点是剂量不可分割,无法灵活调整剂量适应临床需求。为了集合多单元和单单元制剂的优势,目前已报道的方法是将药物和载药基质制成微粒,如微丸、微球和骨架颗粒等,再将微粒和辅料压制成片。理想地,这类制剂不仅储存、运输、服用方便,还能保持微粒的释药行为。其中,微丸片的制剂手段较为复杂,生产时批内和批间产品的质量差异较大,较难实现工业化生产。至今国际市场上仅有ZOK(琥珀酸美托洛尔微丸片,阿斯利康)MUPS(埃索美拉唑微丸片,阿斯利康)和SoluTabTM(兰索拉唑微丸片,阿斯利康)三种产品,而国内市场一片空白。此外,目前国际上制备骨架颗粒的方法主要有挤出-滚圆造粒法、热熔挤出法、熔融高速搅拌法、喷雾干燥法等。挤出-滚圆造粒法、热熔挤出法在制备的过程中螺旋管和挤出筛网的温度很高,不适于热敏感型药物,且制备的微粒粒径较大,难以压制成片;熔融高速搅拌法除制备过程温度较高外,制备的微粒圆整度较差,批次间的重现性差;喷雾干燥法制备的微粒粒径虽小,但结构疏松、孔隙度大、抗压性差,且微粒的突释效应显著,存在临床用药安全隐患。由于阿尔兹海默症(AD)发病机制不是单一性的,故单靶点药物很难取得理想的治疗效果,设计和研制具有多靶点作用的制剂是对AD治疗的有效策略。大量研究证明,石杉碱甲是一种疗效好、安全性高的多靶点天然药物。石杉碱甲能通过与乙酰胆碱酯酶结合为复合物抑制其活性,提高脑内乙酰胆碱水平;还可以通过提高蛋白激酶Cα的水平而缓解Aβ蛋白诱导的SAPPα减少,同时降低Aβ蛋白的含量;并且石杉碱甲能提高NGFmRNA和蛋白表达量,恢复其受体trkA和p75的功能;此外石杉碱甲还具有其他神经保护作用。因此研制具有多靶点作用的石杉碱甲制剂对AD患者的治疗具有重大意义。石杉碱甲属于低剂量的高效药物,市售口服制剂只有普通片和胶囊(50μg/片/粒),这两种制剂均存在一天内需多次服用,吞咽困难和患者依从性差的问题。此外由于药物剂量极低,采用传统方法生产的单单元制剂,如中国专利申请CN200710093156.9、CN200910174864.4、CN201410657374.0、201110454189.8,易出现含量不均匀的问题。因此开发石杉碱甲的多单元给药制剂━石杉碱甲口崩型缓释微粒片意义重大,具有广阔的市场前景。技术实现要素:基于此,本发明提供了一种石杉碱甲骨架微粒的制备方法。该方法具有条件温和,工艺稳定,重现性好的优点,制备得到的石杉碱甲骨架微粒产率高,成型性好,具有明显的粗糙表面结构,粒子间的混合均一性好,微粒可压性好,且具有良好的缓释效果。具体技术方案如下。一种石杉碱甲骨架微粒的制备方法,包括以下步骤:将石杉碱甲和骨架材料溶于乙醇水溶液中,得到含药高分子溶液;将含药高分子溶液通过蠕动泵均速输送至超细微粒制备系统的高速旋转圆碟中形成微滴,微滴在气流场中挥干溶剂并固化,即得所述石杉碱甲骨架微粒;所述石杉碱甲和骨架材料的质量比为0.01-2:100;所述骨架材料为乙基纤维素或质量比为2-40:1的乙基纤维素和添加剂的混合物;所述添加剂选自柠檬酸三乙酯、聚乙二醇、羟丙甲基纤维素和聚维酮中的至少一种;所述含药高分子溶液中骨架材料的浓度为0.03-0.1g/ml。在其中一些实施例中,所述石杉碱甲和骨架材料的质量比为0.1-0.3:100;所述骨架材料为质量比为20-40:1的乙基纤维素和添加剂的混合物。在其中一些实施例中,所述含药高分子溶液中骨架材料的浓度为0.05-0.06g/ml。在其中一些实施例中,所述乙基纤维素选自EC7、EC10、EC20、EC45和EC100中的至少一种。在其中一些实施例中,所述乙基纤维素为EC45。在其中一些实施例中,所述聚乙二醇选自PEG400和PEG6000中的至少一种;所述羟丙甲基纤维素选自HPMCE5、HPMCE4M和HPMCK15M中的至少一种;所述聚维酮选自PVPK12、PVPK30和PVPK90中的至少一种。在其中一些实施例中,所述聚乙二醇为PEG400;所述羟丙甲基纤维素为HPMCE4M和/或HPMCK15M;所述聚维酮选自PVPK12和/或PVPK30。在其中一些实施例中,所述乙基纤维素为EC45,所述添加剂选自柠檬酸三乙酯、PEG400、HPMCE4M和HPMCK15M中的至少一种。在其中一些实施例中,所述乙醇水溶液的体积分数为60%-90%;所述含药高分子溶液的输送速度为3-20ml/min;所述高速旋转圆碟的转速为3000-10000rpm。在其中一些实施例中,所述乙醇水溶液的体积分数为75%-85%;所述含药高分子溶液的输送速度为7-9ml/min;所述高速旋转圆碟的转速为8000-9000rpm。本发明还提供了一种石杉碱甲骨架微粒。具体技术方案如下。根据上述的制备方法制备得到的石杉碱甲骨架微粒。本发明还提供了上述石杉碱甲骨架微粒的应用。具体技术方案如下。上述石杉碱甲骨架微粒在制备石杉碱甲口崩片中的应用。本发明还提供了一种石杉碱甲口崩片。该石杉碱甲口崩片药物含量的均一性好。具体技术方案如下。一种石杉碱甲口崩片,由上述石杉碱甲骨架微粒与适用于口崩片的辅料制备而成。所述用于口崩片的辅料为稀释剂、崩解剂等。所述稀释剂可以为微纤维素(MCCKG802/UF711/PH200/PH302)和直压甘露醇中的至少一种,优选为MCCPH302和所述崩解剂可以为交联聚维酮、交联羧甲基纤维素钠、交联羧甲基淀粉钠和低取代羟丙基纤维素。本发明还提供了上述石杉碱甲口崩片的制备方法。具体技术方案如下。一种上述的石杉碱甲口崩片的制备方法,包括以下步骤:将上述石杉碱甲骨架微粒过筛后与适用于口崩片的辅料混合均匀,压片,即得。所述用于口崩片的辅料为稀释剂、崩解剂等。所述稀释剂可以为微晶纤维素(MCCKG802/UF711/PH200/PH302)和直压甘露醇中的至少一种,优选为MCCPH302和所述崩解剂可以为交联聚维酮、交联羧甲基纤维素钠、交联羧甲基淀粉钠和低取代羟丙基纤维素。本发明首次采用超细微粒制备系统UPPS制备石杉碱甲骨架微粒。发明人从大量骨架材料中筛选得到乙基纤维素,结合UPPS的制备方法,使制备得到的石杉碱甲骨架微粒产率高,药物包封率高,成型性好,结构致密且具有明显的粗糙表面,粒子间的混合均一性好,微粒可压性好,且具有良好的缓释效果,在体内胃肠道环境下具有很低的药物突释率(2h内的释放低于25%)。发明人进一步在乙基纤维素骨架材料中添加特定比例的特定添加剂,可进一步提高石杉碱甲骨架微粒的药物包封率,或者降低药物突释。发明人进一步将制备得到的石杉碱甲骨架微粒制备成石杉碱甲口崩片。由于石杉碱甲骨架微粒的结构致密且具有明显的粗糙表面,粒子间的摩擦力大,粒子重排的时间更短,因此减少了粒子在混合过程中发生分离,改善了粒子间的混合均一性,增加了微粒可压性;其粒径和表面粗糙度上与口崩片中添加的辅料更接近,避免了压片过程中与辅料的分层,因而使制备得到的石杉碱甲口崩片的药物均一性好,并且增加了在压片过程中口崩片辅料对微粒的保护作用,使制备得到的石杉碱甲口崩片的释药行为与石杉碱甲骨架微粒的释药行为相同。因此,本发明的石杉碱甲口崩片具有以下优点:(1)药物均一性好,解决了低剂量石杉碱甲在制剂生产过程中存在的含量不均一的问题;(2)保持了石杉碱甲骨架微粒在压片前的释药特点,可实现持续释药12h以上,满足一天给药一次的需求,避免多次给药带来的药物浓度波动和毒副反应;(3)解决了老年人,尤其是老年痴呆患者吞咽不便的问题:石杉碱甲口崩片在口腔中遇水即崩解成多个可以独立释药的缓释微粒,能够在胃肠道中缓慢而持续地释药,并且微粒的颗粒细小,在口腔中无明显的沙砾感,加水送服后可随水流迅速进入胃肠道,从而发挥药效。本发明的石杉碱甲骨架微粒以及石杉碱甲口崩片的制备方法具有操作简单,省时省力,条件温和,工艺稳定,重现性好的优点。附图说明图1为石杉碱甲口崩片制备过程示意图;图2为实施例2中不同型号EC对石杉碱甲骨架微粒释放的影响图;图3为实施例3中不同添加剂种类和用量对石杉碱甲骨架微粒包封率的影响图;图4为实施例3中不同添加剂种类和用量对石杉碱甲骨架微粒释放的影响图:A.PVP系列聚合物;B.HPMC系列聚合物;C.PEG400聚合物;D.其它(EuragitRSPO/TEC);图5为实施例4中UPPS制备的三批石杉碱甲骨架微粒体外释药曲线(A)和包封率(B)图;图6为实施例4中石杉碱甲骨架微粒的扫描电镜图;图7为实施例4中石杉碱甲骨架微粒和市售辅料的原子力显微镜图:A.MCCKG802,B.MCCUF711,C.MCCPH200,D.MCCPH302,E.F.骨架微粒;图8为石杉碱甲骨架微粒和石杉碱甲骨架微粒口崩片的体外释药曲线图。具体实施方式以下将结合具体实施例和附图对本发明的石杉碱甲骨架微粒、口崩片及其制备方法做进一步详细的说明。UPPS:超细微粒制备系统,装置结构与使用参见中国专利CN101816913B以及文献WenX,PengX,FuH,etal.Preparationandinvitroevaluationofsilkfibroinmicrospheresproducedbyanovelultra-fineparticleprocessingsystem[J].IntJPharm,2011.416:195-201.本发明首次采用UPPS制备石杉碱甲骨架微粒,并将其进一步制备成石杉碱甲口崩片,制备过程如图1所示:将石杉碱甲和骨架材料溶解制备含药高分子溶液,在蠕动泵的作用下将含药高分子溶液泵入UPPS中的高速旋转的圆碟上,在高速旋转圆碟的离心力和剪切力作用下,溶液瞬间被剪切成高度分散的微滴,微滴飞入气流场中挥发溶剂,一步固化成石杉碱甲骨架微粒,随后在气流场和重力的作用下沉降到收集盘;将制备的石杉碱甲骨架微粒按一定比例与稀释剂和崩解剂混合后直接压制成石杉碱甲口崩片。该制备方法具有重现性好,操作简单,省时省力,条件温和,工艺稳定的优势。实施例1固定石杉碱甲骨架微粒理论载药量为0.2%(w/v)。称取适量的石杉碱甲,溶于200ml80%v/v乙醇溶液中,得药物溶液,在磁力搅拌作用下缓慢于药物溶液中加入一定量的骨架材料(乙基纤维素EC(EC7/EC10/EC20/EC45),丙烯酸树脂EudragitRSPO或醋酸乙烯酯-聚维酮共混物KollidonSR),使之形成骨架材料的浓度为5%~20%(w/v)的含药高分子溶液。将含药高分子溶液通过蠕动泵以7.8ml/min均速供入UPPS中,在高速旋转圆碟(转速为9000rpm)的作用下剪切雾化形成微滴,微滴中的溶剂在气流场中挥干,微滴固化即得到石杉碱甲骨架微粒,最后对石杉碱甲骨架微粒进行收集。由不同骨架材料所制得的石杉碱甲骨架微粒的产率和成型性如表1所示。由表1可知,石杉碱甲骨架微粒的成型性与骨架材料的种类和浓度均相关,其中骨架材料的种类对微粒的成型性影响更明显,当骨架材料为EC,浓度低于10%(w/v)时,才能得到成型性好的石杉碱甲骨架微粒,并且产率高。表1不同骨架材料的石杉碱甲骨架微粒产率及成型性实施例2称取石杉碱甲20mg,溶于200ml80%v/v乙醇溶液中,得药物溶液,在磁力搅拌作用下缓慢于药物溶液中分别加入10g骨架材料EC10、EC20和EC45,至EC溶胀完全形成均一的含药高分子溶液。将含药高分子溶液通过蠕动泵以7.8ml/min均速供入UPPS中,在9000rpm高速旋转圆碟的作用下形成微滴,微滴中的溶剂在气流场中挥干,微滴固化即得到石杉碱甲骨架微粒。将制备得到的石杉碱甲骨架微粒至于干燥器中保存以进行后续研究。石杉碱甲骨架微粒中药物含量的测定方法(即药物包封率的测定方法)为:精密称定10~10.5mg石杉碱甲骨架微粒置于5ml容量瓶中,加入80%甲醇超声至微粒骨架溶解完全后定容,再取适量溶液用0.22μm微孔滤膜过滤。药物含量测定的液相色谱条件为:流动相,甲醇/0.02%三乙胺溶液(冰醋酸调节pH为6.90)=60/40(v/v);检测波长311nm;柱温40℃;流速1.0ml/min;进样量20μl。由不同型号的EC制备得到的石杉碱甲骨架微粒的包封率如表2所示。采用EC45为骨架材料得到的石杉碱甲骨架微粒包封率较EC10和EC20高,有利于减少药物的损耗。表2不同型号的EC制备得到的石杉碱甲骨架微粒的包封率(n=3)EC型号包封率(%)EC1062.90±0.60EC2057.98±0.71EC4566.64±2.17将制备的石杉碱甲骨架微粒,照释放度测定法(中国药典2015年版二部附录XD第一法),采用溶出度测定法(附录XC第三法)的装置进行体外溶出试验:以200ml水为溶出介质,温度为37±0.5℃,转速为50r/min,依法操作,在0.5、1、2、4、6、8、12和24h分别取溶液1ml,过滤并及时向溶出杯中补充1ml37℃的新鲜溶出介质。石杉碱甲骨架微粒体外释放药物含量测定的液相色谱条件为:流动相,乙腈/磷酸二氢钾(磷酸调节pH为2.5)=14:86(v/v);检测波长308nm;柱温40℃;流速1.0ml/min;进样量20μl。根据石杉碱甲浓度-峰面积标准曲线计算药物浓度,绘制微粒的累积释放度曲线,如图2所示。从图2可以看出采用这三种型号的EC(EC10、EC20和EC45)制备得到的石杉碱甲骨架微粒,EC45的突释更小,而且可以使药物的释放维持24h,用EC45作为骨架材料制备得到的石杉碱甲骨架微粒具有更好的缓释效果。实施例3称取石杉碱甲21mg,溶于200ml80%v/v乙醇溶液中,得药物溶液,在磁力搅拌作用下缓慢于药物溶液中分别加入10g骨架材料EC45和表3所示种类和用量的添加剂,至骨架材料溶胀完全形成均一的含药高分子溶液。将含药高分子溶液通过蠕动泵以7.8ml/min均速供入UPPS高速旋转圆碟(9000rpm)中形成微滴,随后微滴中的溶剂在气场中挥干,进一步固化成石杉碱甲骨架微粒。石杉碱甲骨架微粒的包封率和释放曲线照实施例2项下进行。各种添加剂及其用量对石杉碱甲骨架微粒的包封率和药物释放的影响结果分别如图3和图4所示。结果显示:加入特定种类以及特定用量的添加剂可明显提高石杉碱甲骨架微粒的药物包封率或者降低药物突释率,其中,PEG、PVP和HPMC系列的聚合物均可显著提高微粒的药物包封率,同时不会增加微粒的突释,使微粒保持良好的缓释能力;而增塑剂柠檬酸三乙酯(TEC)可以进一步降低微粒的药物突释,但对微粒的包封率影响不大。但是当添加剂选择不合理时则会降低微粒的药物包封率以及增加突释,比如EudragitRSPO的加入会降低微粒的药物包封率,且会增加微粒的药物突释率。表3石杉碱甲骨架微粒处方实施例4为验证UPPS系统制备石杉碱甲骨架微粒的重现性,制备含药溶液,并用UPPS重复进行三批试验。含药溶液的制备方法为:称取石杉碱甲21mg,溶于200ml80%v/v乙醇溶液中,得药物溶液,在磁力搅拌作用下缓慢于药物溶液中分别加入10g骨架材料EC45和0.25gHPMCK15M,继续搅拌至药物和骨架材料完全溶解,得含药高分子溶液。将含药高分子溶液通过蠕动泵以7.8ml/min均速供入UPPS的高速旋转圆碟(9000rpm)中形成微滴,随后微滴中的溶剂在气场中挥干,进一步固化成石杉碱甲骨架微粒。三批石杉碱甲骨架微粒的包封率实施例2项下进行。再将三批石杉碱甲骨架微粒的释放按照模拟体内胃肠道环境进行,即进行pH转换条件的释放:首先将微粒在150mlpH1.2HCl的释放介质中进行2h,再加入50ml0.2N的磷酸钠溶液将pH调整为6.8继续释放至24h。其它释放条件与实施例2的保持一致,计算三批微粒释放曲线的相似因子f2值。f2值介于0和100之间,当f2≥50时,认为两种制剂体外释放曲线相似,当f2=100时,则表示两种制剂体外释放曲线完全相同。f2的计算方法见下式。Rt:参比样品t时间累积释药百分率;Tt:试验样品t时间累积释药百分率;n:释放度试验取样点数。三批石杉碱甲骨架微粒的体外释放曲线和包封率如图5所示,三批石杉碱甲骨架微粒的包封率相近,体外释放曲线相似。经计算得批与批之间释放曲线的相似因子f2值均大于50,表明UPPS制备的石杉碱甲骨架微粒的重现性良好。此外,石杉碱甲骨架微粒在体内胃肠道环境下具有很低的药物突释率(2h内的释放低于25%),可持续释药24h以上,表现了良好的缓释能力。实施例5采用扫描电镜对实施例4制备得到的石杉碱甲骨架微粒表面形态进行表征,所得结果如图6所示。采用UPPS制得的石杉碱甲骨架微粒为类球形,表面质地粗糙,有利于与辅料混合均匀。采用原子力显微镜对实施例4制备得到的石杉碱甲骨架微粒表面粗糙度进行表征,并与市售的常用直压辅料进行比较。微粒和辅料的典型表面结构如图7所示(A.MCCKG802,B.MCCUF711,C.MCCPH200,D.MCCPH302,E.),都具有明显的粗糙表面结构。这种结构特征有利于微粒和辅料形成均一的混合物,主要是因为表面粗糙的粒子会影响粒子间的接触角及粒子间相互作用。粗糙表面的粒子,粒子间的摩擦力更大,粒子重排的时间更短,因此可以减少粒子在混合过程中发生分离,改善粒子间的混合均一性,一方面可以增加辅料对微粒在压片过程中的保护作用,另一方面可以增加微粒本身的可压性,若进一步压制成片,更易于制备含量均一的片剂。实施例6将实施例4制备得到的石杉碱甲骨架微粒过100目筛后和不同辅料按表4处方组成进行直接压片,即得石杉碱甲口崩片。所用到的崩解剂为交联聚维酮(PVPP),所用到的稀释剂为微晶纤维素(MCCKG802/UF711/PH200/PH302)和直压甘露醇对制备得到的石杉碱甲口崩片的质量进行如下评价,所得结果如表5和图8所示。表4石杉碱甲口崩片处方(1)重量差异检查:各个处方分别取药片20片,精密称定各片的重量,求平均片重,计算片重差异。(2)硬度检查:各个处方分别取药片3片,使用片剂硬度仪测定各片的硬度,比较各处方片剂的平均硬度大小。(3)含量均匀度检查:口崩片中石杉碱甲的含量照实施例2的含量测定方法,按《中国药典》2015年版二部附录XE项下计算每片以标示量为100的相对含量,求其平均值和标准差S,以及标示量与均值之差的绝对值A,如A+1.80S≤15.0,则片剂的含量均匀度符合规定。(4)崩解时限检查:参照《中国药典》2015年版三部附录口腔崩解片的测定方法进行。(5)体外释放度检查:原始石杉碱甲骨架微粒和石杉碱甲口崩片的体外释放照实施例2的体外释放方法,并计算这两者之间的相似因子f2。f2值越大,表明压片操作对微粒的释药行为改变越小,辅料对微粒的保护能力越强。由表5和图8可知,采用UPPS制备的石杉碱甲骨架微粒适于与多种压片辅料混合直接压片,制得的口崩片可在水中迅速崩解(崩解时间<60s),药物含量均一性高(A+1.80S<15),硬度可通过添加不同的稀释剂来调节,压片后得到的口崩片仍可保留与原始石杉碱甲骨架微粒相似的释药行为。这主要是因为骨架微粒的表面和压片辅料的表面类似,都具有一定的粗糙度,有利于减少微粒和辅料在压片过程中发生分离,提高辅料对微粒的保护作用,因而在压片之后微粒的释药行为未发生改变。表5不同处方制得的石杉碱甲口崩片的质量以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1