用于抑制HIV感染的多肽及其药物用途的制作方法
本发明属于生物医药领域,涉及一种抗HIV感染多肽,具体涉及式I:CP—I(L)—D—I(L),式I所示的多肽、其衍生物、其立体异构体、或其无生理毒性的盐,可以显著提高原C端多肽抑制HIV感染的活性。本发明还涉及含有上述的式I多肽、其衍生物、其立体异构体、或其无生理毒性的盐的药物组合物,以及式I多肽、其衍生物、其立体异构体、或其无生理毒性的盐在治疗或预防HIV感染所导致相关疾病尤其是获得性免疫缺陷综合症(艾滋病)的用途。
背景技术:
现有技术公开了人类获得性免疫缺陷综合症,即艾滋病(AIDS),其是国际医学领域的关注热点。该疾患由人感染人类免疫缺陷病毒(HIV)引起,目前我国的临床病例多是感染的1型HIV。据联合国艾滋病规划署(UNAIDS)提供的资料显示,从上世纪80年代被发现以来,HIV已经造成了累计超过六千万人被感染以及超过两千万人死亡,目前,每年仍有约两百万的新增感染病例出现,因此,艾滋病是人类公共卫生领域的重大威胁。
研究显示,HIV表面糖蛋白gp41在HIV-1与靶细胞发生膜融合并最终进入细胞的过程中起着至关重要的作用,也是新发现的融合抑制的作用靶点。gp41的组成包括融合多肽(Fusion Peptide,FP)、胞外段、跨膜区段等,其上对病毒细胞发生膜融合不可或缺的两个螺旋结构位于胞外段,为N末端重复序列(N-terminal heptad repeat,HR1或NHR,aa:542-592)和C末端重复序列(C-terminal heptad repeat,HR2或CHR,aa:623-665)。1992年,Wild教授团队首先报道发现多肽DP107,该多肽来源于HIV-1表面糖蛋白gp41的N端序列,具有毫摩尔级别的抗HIV-1的活性;1993年,姜世勃教授和其同事报道了多肽SJ-2176,该多肽来源于gp41的C端序列,具有纳摩尔级别的抗病毒活性;这两个多肽的发现引发了学术界对融合抑制剂的探索,开启了一个抗艾滋病药物的全新领域;1997年,有科学家发现了gp41的晶体结构,发现gp41在HIV入侵靶细胞的过程中会发生折叠,其CHR和NHR会形成发夹样的6螺旋束结构,有助于更细致地 了解HIV进入靶细胞的过程:在HIV入侵靶细胞的过程中,其表面糖蛋白gp120先与靶细胞上的CD4受体以及辅助受体CXCR4或者CCR5结合,进而触发gp41构型的变化,发夹样结构拉近了HIV与靶细胞的距离,促进其发生膜融合,所以,融合抑制剂作用在这个阶段;在gp41蛋白N端插入靶细胞细胞膜之后,来源于其N端(或C端)的多肽与gp41C端(或N端)结合,阻止其六螺旋结构(6-HB)的形成,进而阻断其发生膜融合的过程,进而达到治疗艾滋病的效果。
基于融合抑制剂的作用原理,研究着期望能设计出与HIV gp41C端或者N端具有更高亲和性的多肽,那将能使得该多肽药物具有更好的抗病毒活性,进而使其被开发为药物后使用剂量减小,减低用药成本。本申请的发明人拟提供一种显著增强现有HIV-1进入抑制多肽的活性的方法,为进一步优化治疗艾滋病的融合抑制剂提供新的方法。
技术实现要素:
本发明的目的在于提供一种抗HIV感染多肽,具体涉及式I:CP—I(L)—D—I(L),式I所示的多肽、其衍生物、其立体异构体、或其无生理毒性的盐,所述式I所示的多肽能显著提高原C端多肽抑制HIV感染的活性。
本发明还提供含有上述的式I多肽、其衍生物、其立体异构体、或其无生理毒性的盐的药物组合物,以其在制备治疗或预防HIV感染所导致相关疾病尤其是获得性免疫缺陷综合症(艾滋病)的药物中的用途。
本发明的一个方面涉及式I所示的多肽、其衍生物、其立体异构体、或其无生理毒性的盐,
CP—I(L)—D—I(L) 式1
其中,CP为来源于HIV-1gp41的具有抑制HIV-1活性的C端多肽,L为亮氨酸,I为异亮氨酸,D为天冬氨酸。
本发明中,所述式I中,将三个可变的氨基酸(亮氨酸或异亮氨酸-天冬氨酸-亮氨酸或异亮氨酸)加入到传统的具有抑制HIV-1活性的C端多肽的碳端,获得到的更长的多肽,具有显著增强的抗病毒活性;利用所述技术,可以开发出用量更少且成本更低的艾滋病药物。
在本发明的一个实施方案中,所述I(L)—D—I(L)这三组氨基酸在特定的位置接入CP多肽的C末端,使这三组氨基酸所对应的氨基酸残基序号(以HIVHXB2病毒CHR结 构域为准)为:I(L)654—D655—I(L)656,或写作:
654IDI656(SEQ ID NO:1);
654IDL656(SEQ ID NO:2);
654LDI656(SEQ ID NO:3);
654LDL656(SEQ ID NO:4);
本发明中采用的该接入方法,将传统的抑制HIV-1活性的C端多肽从643位的氨基酸(通常情况下是Q643)后面截断,接入I(L)—D—I(L)这三组氨基酸,获得到的多肽具有更强的抑制HIV感染的活性。
在本发明的另实施方案中,根据式1设计得到了5个多肽,JLS1-JLS5:
1)JLS1:N端-WEEWDKKIEEYTKKIEELIKKSQNQQIDI-C端(SEQ ID NO:5);
2)JLS2:N端-WEEWDKKIEEYTKKIEELIKKSQNQQIDL-C端(SEQ ID NO:6)
3)JLS3:N端-WEEWDKKIEEYTKKIEELIKKSQNQQLDI-C端(SEQ ID NO:7);
4)JLS4:N端-WEEWDKKIEEYTKKIEELIKKSQNQQLDL-C端(SEQ ID NO:8);
5)JLS5:N端-MTWEEWDKKIEEYTKKIEELIKKSQNQQIDL-C端(SEQ ID NO:9)。
其中,JLS1-JLS4的特征在于:在WEEWDKKIEEYTKKIEELIKKSQNQQ(名称:SC26EK)序列的羧基端分别加上本发明提出的I(L)—D—I(L)这四组氨基酸,所得到的衍生多肽均具有极强的、广谱的抗病毒活性;JSL5则是在JLS2的基础上在其氨基端添加了MT的增强序列,两端同时存在的增强序列能提高其抗病毒活性。
本发明中,氨基酸缩写具有本领域公知的含义:W为色氨酸、E为谷氨酸、D为天冬氨酸、K为赖氨酸、I为异亮氨酸、Y为酪氨酸、T为苏氨酸、L为亮氨酸、S为丝氨酸、Q为谷氨酰胺、N为天冬酰胺、M为甲硫酰胺。
本发明中,还提供了用于编码上述的式I多肽或其衍生物;以及含有这些核酸分子的表达和重组载体、重组细胞或者重组病毒等生物材料的核酸编码。
本发明中,还提供了化学合成上述任一多肽、其衍生物、其立体异构体、或其无生理毒性的盐的步骤;以及生物表达所述任一多肽、其衍生物、其立体异构体、或其无生理毒性的盐的步骤。
本发明中,经过对JLS1-JLS5的一系列结构与功能的检测之后,结果显示,根据式1设计的多肽序列,在碳端加上654IDI656,654IDL656,654LDI656,654LDL656这样的四组氨基酸形式,使得其与NHR的亲和力更好,进而使得其抗病毒活性显著提高。
经试验表明,所述的JLS1-JLS5具有以下优点:
1)含有29个/31个氨基酸,明显短于现有技术广泛使用的多肽:T20(36个氨基酸)、T1249(39个氨基酸)、C34(34个氨基酸)等,节省合成成本;
2)相比其他多肽,序列上更为精简的同时抗病毒活性却大为提高;
3)目前FDA唯一批准的进入抑制剂是T20,但是在临床上已发现多种T20耐药株,本发明的多肽对耐药株仍然有效;
4)序列中大量引入了极性氨基酸(E、K等),使得其与靶序列结合更牢固的同时,水溶性也明显提高,利于进一步开发出药物。
本发明的另一个方面,提供了式I所示的多肽、其衍生物、其立体异构体、或其无生理毒性的盐形成的多聚物以及药物组合,其特征在于:其含有至少一种下述任一所述的式I多肽、其衍生物、其立体异构体、或其无生理毒性的盐,以及药学上可接受的载体或辅料,
1)上述任一种多肽的氨基端和/或羧基端连接保护基所得到的连接物,氨基端保护基可为乙酰基、氨基、马来酰基、琥珀酰基、叔丁氧羰基、或苄基或其他疏水基团,羧基端保护基可为NH2、羧基、酰胺基、叔丁氧羰基或其他疏水性基团;或,
2)将衍生多肽用构象为D-型的氨基酸,人工修饰的氨基酸以及自然界存在的稀有氨基酸等进行替换得到的产物,能提高多肽的生物利用度、稳定性和/或抗病毒活性;或,
3)上述任一种多肽的氨基端和/或羧基端连接寡肽或亲脂性基团或胆固醇得到的连接物,寡肽可由2-10个氨基酸构成,亲脂性基团可含有3-20个碳原子的脂肪酸链;或
4)上述任一种多肽被蛋白质、聚乙二醇、马来酰亚胺修饰得到的产物。
本发明的另一个方面,提供了式I所示的多肽、其衍生物、其立体异构体、或其无生理毒性的盐在制备治疗或预防HIV感染所导致相关疾病尤其是获得性免疫缺陷综合症(艾滋病)的药物中的用途;其中包括:
1)治疗和/或预防和/或辅助治疗HIV感染所致疾病(如艾滋病);
2)抑制HIV介导的细胞融合;
3)抑制HIV侵入细胞;
4)抑制HIV复制;
5)制备具有体外抑制HIV感染活性的生物制剂。
本发明中,所述的多肽及其衍生物以及药用盐可单独或者作为组合物应用于HIV感染者的治疗。
本发明中,所述的多肽及其衍生物以及药用盐可与各种适宜的载体材料或赋形剂混合,制成多种剂型,可以是普通制剂,控释制剂,缓释制剂以及各种微粒给药系统;或与逆转录酶抑制剂、蛋白酶抑制剂等抗HIV药物联合应用于艾滋病的治疗。
本发明为进一步研发艾滋病治疗和预防药物提供了有实际价值的思路。
为了便于理解,以下将通过具体的附图和实施例对本发明进行详细地描述。需要特别指出的是,具体实例和附图仅是为了说明,显然本领域的普通技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。
附图说明
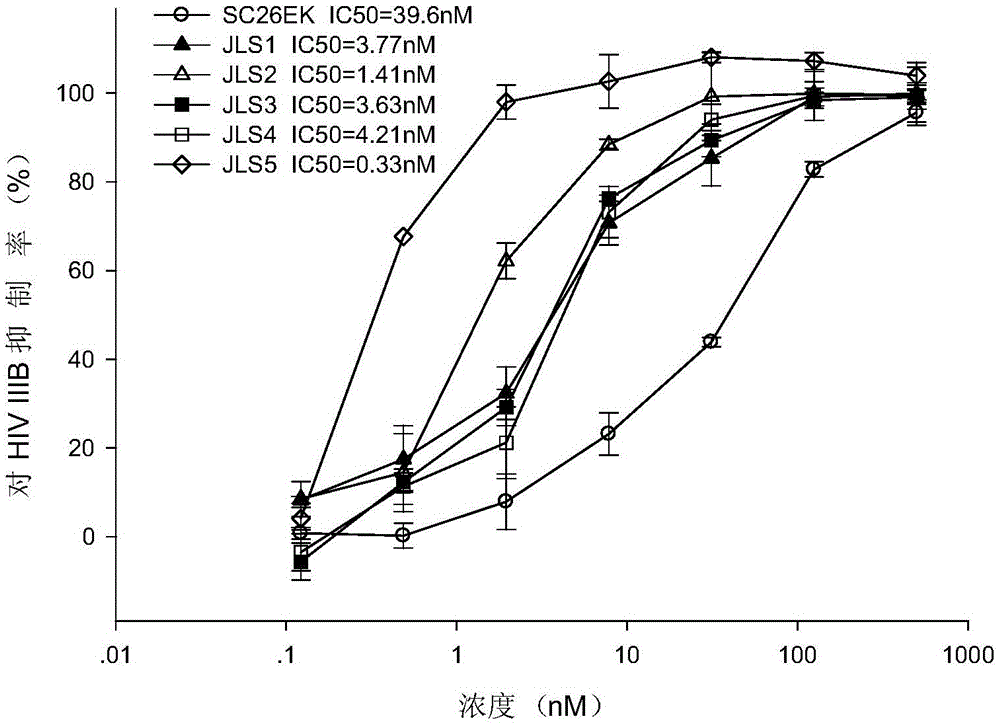
图1为通过P24-based ELISA,用MT-2细胞检测JLS1-JLS5针对X4型病毒株IIIB的抑制能力,结果显示JLS1-JLS5均具有较好的抑制HIV IIIB病毒的活性。
图2为通过P24-based ELISA,用M7细胞检测JLS1-JLS5针对R5型病毒株Bal的抑制能力,结果显示JLS1-JLS5均具有较好的抑制HIV Bal病毒的活性。
图3为JLS1-JLS5与来源于gp41N末端序列的多肽N36相互作用的圆二色谱分析。
具体实施方式
下列实例中未注明具体实验方法的均可按照常规方法进行,如参照《分子克隆实验指南》,所用试剂或仪器未注明生产产商的均为可以市购的常规产品。
实施例1多肽的制备
多肽JLS1-JSL5均由SynPeptide Co Ltd公司合成,用高效液相色谱(HPLC)和质谱(PerSeptive Biosystems,Framingham,MA)对其进行纯化和鉴定,显示序列正确,纯度大于98%;本发明多肽的分子量和纯度如表1所示。
表1.多肽的分子量和纯度
实施例2多肽抑制HIV感染细胞
1)检测C多肽抑制HIV-1X4株IIIB感染MT-2细胞的活性的方法如下:96孔板中每孔加入50μLIIIB病毒(用无血清1640稀释)以及50μL按倍比稀释(4倍)的C多肽(用无血清1640稀释),37℃孵育30分钟,再加入100μL细胞(105个/ml,用加入10%血清的1640培养液稀释),以只加了同等终浓度的MT-2细胞的孔作为阴性对照,以加入了同等终浓度的IIIB病毒和MT-2细胞,未加入药物的孔为阳性对照,第二天早上每孔吸走上清150μL,加入150μL新鲜的含10%血清的1640培养液,第五天早上收取上清50μL,并在上清中加入50μL含5%triton的PBS,混合后4℃放置过夜。用ELISA检测上清中P24的含量来定量HIV-1感染MT-2的情况,检测P24需要在前一天晚上将半区96孔板(Corning)包被上HIV IgG(5μg/ml,PBS稀释),4℃放置12个小时,洗板后加入2%的PBS溶牛奶进行封闭,37℃放置2小时,洗板后加入10μL收取的上清与加入了triton的PBS的混合物,再加入40μL PBS,37℃放置1小时,洗板后加入一抗(1.5μg/ml,实验室自行提取的183抗体)50μL,37℃放置一小时,洗板后加入二抗(稀释3000倍,Dako Denmark兔抗鼠单抗)50μL,37℃放置一小时,洗板后加入显色液,待3-5分钟,加入硫酸终止反应,用酶标仪(TECAN infinite M200pro)检测每孔的OD450,得出数据,计算每一浓度样品抑制率,以及有效抑制剂量(IC50值);
2)检测C多肽抑制HIV-1R5株Bal感染M7细胞的活性:
96孔板中每孔加入50μLBal病毒(用无血清1640稀释)以及50μL按倍比稀释(4倍)的C多肽(用无血清1640稀释),37℃孵育30分钟,再加入100μL细胞(105个/ml,用加入10%血清的1640培养液稀释),以只加了同等终浓度的M7细胞的孔作为阴性对照,以加入了同等终浓度的Bal病毒和M7细胞,未加入药物的孔为阳性对照,第 二天早上每孔吸走上清150μL,加入150μL新鲜的含10%血清的1640培养液,第五天早上收取上清50μL,并在上清中加入50μL含5%triton的PBS,混合后4℃放置过夜,用ELISA检测上清中P24的含量定量HIV-1感染M7的情况,检测P24需要在前一天晚上将半区96孔板(Corning)包被上HIV IgG(5μg/ml,PBS稀释),4℃放置12个小时,洗板后加入2%的PBS溶牛奶进行封闭,37℃放置2小时。洗板后加入10μL收取的上清与加入了triton的PBS的混合物,再加入40μL PBS,37℃放置1小时,洗板后加入一抗(1.5μg/ml,实验室自行提取的183抗体)50μL,37℃放置一小时,洗板后加入二抗(稀释3000倍,Dako Denmark兔抗鼠单抗)50μL,37℃放置一小时,洗板后加入显色液,待3-5分钟,加入硫酸终止反应。用酶标仪(TECAN infinite M200pro)检测每孔的OD450,得出数据,按前述方法,计算每一浓度样品的抑制率和有效抑制浓度;
实验结果显示,无论是针对CXCR4共受体还是CCR5共受体介导的HIV-1感染靶细胞的过程,SC26EK抑制该过程的能力均较弱,本发明中通过计算机模拟发现在C多肽的C末端加上654IDI656,654IDL656,654LDI656,654LDL656这样的四组氨基酸,能形成更稳定的结构,将多肽绑定到gp41N端序列的沟槽里,检测其抗病毒活性均提高16-45倍;再在JLS2的基础上加上N端的MT的增强序列,则抗病毒活性进一步增强,达到0.3nM;表2.显示了JLS1-JLS5的抗病毒感染能力。
表2.
实施例3 JLS2和JLS5的广谱抗HIV作用
鉴于HIV类的逆转录病毒易发生基因组突变,本发明中选择了对实验室适应株有较好效果的JSL2和JSL5,并检测了其对一系列临床株的抗病毒活性;所述临床株可分为多种亚型,包括A-D,F-H,J和K亚型等;本实验以SC26EK为对照,观察其N末端和C末端加上增强序列后的效果;本实验还选择了唯一上市的融合抑制剂T20以及有报道的抗病毒活性最高的融合抑制剂HP23作为阳性对照;
按如下方法:96孔板中每孔加入50μL HIV病毒(用无血清1640稀释)以及50μL按倍比稀释(4倍)的C多肽(用无血清1640稀释),37℃孵育30分钟,再加入100μL细胞(105个/ml,用加入10%血清的1640培养液稀释),以只加了同等终浓度的M7细胞的孔作为阴性对照,以加入了同等终浓度的HIV病毒和M7细胞,未加入药物的孔为阳性对照,第二天早上每孔吸走上清150μL,加入150μL新鲜的含10%血清的1640培养液,第五天早上收取上清50μL,并在上清中加入50μL含5%triton的PBS,混合后4℃放置过夜,用ELISA检测上清中P24的含量定量HIV-1感染M7的情况,检测P24需在前一天晚上将半区96孔板(Corning)包被HIV IgG(5μg/ml,PBS稀释),4℃放置12个小时,洗板后加入2%的PBS溶牛奶进行封闭,37℃放置2小时,洗板后加入10μL收取的上清与加入了triton的PBS的混合物,再加入40μL PBS,37℃放置1小时,洗板后加入一抗(1.5μg/ml,实验室自行提取的183抗体)50μL,37℃放置一小时,洗板后加入二抗(稀释3000倍,Dako Denmark兔抗鼠单抗)50μL,37℃放置一小时,洗板后加入显色液,待3-5分钟,加入硫酸终止反应,用酶标仪(TECAN infinite M200pro)检测每孔的OD450,得出数据,依前述方法,计算每一浓度样品的抑制率和有效抑制浓度;实验结果如表3所示,对于A、D、F、O等各种亚型的临床株和在中国流行占主导地位的重组A/E病毒株,JSL2和JSL5均具有较好的抑制活性,且相对SC22EK活性均大幅度提高,甚至优于HP23,表明本发明所述的两个增强序列的有效性。
表3.JLS2,JLS5对不同临床株的抑制活性。
实施例4.JLS2,JLS5对HIV T-20抗性株的抑制作用
鉴于T20是目前唯一批准用于临床的融合抑制剂,但其很容易诱导耐药突变,导致疗效的降低,本实验拟解决临床上迫切需要的解决的问题,期望提供出能抑制T-20抗性株的新型融合抑制剂;本实验以SC26EK为对照,观察在其N末端和C末端加上增强序列后的效果;还选择了唯一上市的融合抑制剂T20以及有报道的抗病毒活性最高的融合抑制剂HP23作为阳性对照,检测了JLS2和JLS5对T20抗性株的抑制活性,实验方法如前所述,实验结果如表4所示,JLS2,JLS5对T-20抗性株均展现出良好的活性,其中,JLS5对9488和9489株的抑制作用甚至优于HP23。
表4.JLS2,JLS5对HIV T-20抗性株的抑制活性
实施例5.圆二色谱(CD)技术研究JLS1-JLS5的二级结构
1)圆二色谱分析(Circular dichroism analysis):将C多肽与来源于gp41N末端序列的N36等摩尔浓度地混合,终浓度均为10μM(溶于PBS),将其在37℃孵育30分钟,CD检测使用日本分光公司的分光偏振计(model J-815;Jasco,Inc.,Easton,MD),采用1纳米的带宽,在室温下检测其在光波长从195纳米到260纳米变化下其吸光虑的变化,以PBS在同一条件下的吸光系数作为空白矫正,样品与N36的螺旋含量由其222纳米处的摩尔椭偏率可以大概推知,变温实验在温控装置将温度从4℃变化到90℃期间检测样品在222纳米处的摩尔椭偏率的变化,温度变化率为1.2℃/min,数据在1纳米带宽,0.25Hz频率,222纳米波长的光照下得到;变温情况下的曲线平滑,随着温度上升,样品解螺旋,曲线上升的中点温度即为样品在222纳米光照下的最大溶解温度(Tm);
实验结果显示,来源于HIV gp41的CHR区的抗病毒多肽主要是通过与NHR区的靶序列相互作用而阻断6-HB结构的形成,继而达到抑制HIV侵入靶细胞的作用,CD结果如表5所示,SC26EK和JLS1-JLS5在与N36孵育后均能形成典型的螺旋结构,表现为在-208和-222呈现典型的吸收峰(如图3所示),其中,将222nm波长处值除以-33(理论上达到100%螺旋度时的吸收峰值),以此表示该C多肽与N36形成的复合物的螺旋度,越大表示CHR和NHR多肽螺旋复合物的α螺旋含量越高,说明螺旋度越高就意味着CHR与NHR亲和力越好,抑制HIV感染的活性也越好;实验还显示,JLS1-JLS4的螺旋含量相比SC26EK明显提升,JSL5螺旋含量高达94%,Tm值表示C多肽与NHR复合物的温度稳定性,结果表明,JLS1-JLS4的热稳定性比SC26EK明显提升,JSL5的热稳定性尤其较其他5个多肽显著提升,热稳定性较好;以上结果说明,JLS1-JLS5的抑制活性与其形成的异源6螺旋束的螺旋度和热稳定性相关。
表5.JLS1-JLS5的圆二色谱分析
SEQUENCE LISTING
<110> 复旦大学,中国科学院生物物理研究所
<120> 用于抑制HIV感染的多肽及其药物用途
<130> 1
<160> 9
<170> PatentIn version 3.3
<210> 1
<211> 3
<212> PRT
<213> 人工序列
<400> 1
Ile Asp Ile
1
<210> 2
<211> 3
<212> PRT
<213> 人工序列
<400> 2
Ile Asp Leu
1
<210> 3
<211> 3
<212> PRT
<213> 人工序列
<400> 3
Leu Asp Ile
1
<210> 4
<211> 3
<212> PRT
<213> 人工序列
<400> 4
Leu Asp Leu
1
<210> 5
<211> 29
<212> PRT
<213> 人工序列
<400> 5
Trp Glu Glu Trp Asp Lys Lys Ile Glu Glu Tyr Thr Lys Lys Ile Glu
1 5 10 15
Glu Leu Ile Lys Lys Ser Gln Asn Gln Gln Ile Asp Ile
20 25
<210> 6
<211> 29
<212> PRT
<213> 人工序列
<400> 6
Trp Glu Glu Trp Asp Lys Lys Ile Glu Glu Tyr Thr Lys Lys Ile Glu
1 5 10 15
Glu Leu Ile Lys Lys Ser Gln Asn Gln Gln Ile Asp Leu
20 25
<210> 7
<211> 29
<212> PRT
<213> 人工序列
<400> 7
Trp Glu Glu Trp Asp Lys Lys Ile Glu Glu Tyr Thr Lys Lys Ile Glu
1 5 10 15
Glu Leu Ile Lys Lys Ser Gln Asn Gln Gln Leu Asp Ile
20 25
<210> 8
<211> 29
<212> PRT
<213> 人工序列
<400> 8
Trp Glu Glu Trp Asp Lys Lys Ile Glu Glu Tyr Thr Lys Lys Ile Glu
1 5 10 15
Glu Leu Ile Lys Lys Ser Gln Asn Gln Gln Leu Asp Leu
20 25
<210> 9
<211> 31
<212> PRT
<213> 人工序列
<400> 9
Met Thr Trp Glu Glu Trp Asp Lys Lys Ile Glu Glu Tyr Thr Lys Lys
1 5 10 15
Ile Glu Glu Leu Ile Lys Lys Ser Gln Asn Gln Gln Ile Asp Leu
20 25 30
- 还没有人留言评论。精彩留言会获得点赞!