一种O型口蹄疫病毒人工重组抗原及其制备与应用的制作方法
本发明属于生物制剂领域,具体地,涉及一种O型口蹄疫病毒人工重组抗原及其制备与应用。
背景技术:
口蹄疫(Food and Mouth Disease,FMD)是由口蹄疫病毒(Food and Mouth Disease Virus,FMDV)引起的偶蹄动物急性、热性、高度接触性、烈性传染病,其临床表现以口腔粘膜、舌面、鼻镜、蹄部、乳房皮肤发生水泡和溃烂为特征。世界动物卫生组织(OIE)和我国政府均将该病列为A类动物传染病之首。由于该病的爆发影响国际贸易,常造成巨大的经济损失和政治影响,因此,口蹄疫防治工作始终受到世界各国政府的高度重视。
在FMD防治工作中,诊断、监测是至关重要的环节。准确可靠的诊断监测、结果是制定正确防制措施的依据。由于FMDV有7个血清型、65个亚型、型间不能交互免疫保护,不同亚型、不同分离株的抗原性也有不同程度的差异,给FMD的诊断工作带来困难。特别是在注射FMD疫苗的国家和地区,原有的一些检测技术失去了应用价值。因此,正确鉴别FMD灭活疫苗免疫动物和自然感染动物是FMD防治工作中的一项重要内容,也是OIE判断一个国家或地区有无FMD的重要依据之一。
随着分子生物学技术的快速发展,利用基因工程技术为FMD鉴别诊断提供一种特异、稳定、安全、高效的重组抗原,已经成为该项研究的首选。FMDV非结构蛋白(Nonstructural proteins,NSP)是病毒在复制过程中产生的蛋白,在自然感染的情况下,动物会产生抗NSP抗体,而灭活疫苗在纯化过程中除去了大部分非结构蛋白,免疫动物不会产生所有的非结构蛋白抗体,故通过检测血清中抗NSP抗体,可以区分自然感染动物与灭活疫苗免疫的动物,从而确定动物群体中FMDV的感染情况。
在FMDV几种非结构蛋白中,3D和2C非结构蛋白已经被证明不能用于区分感染动物和免疫动物。Mackay等和Bergmann等研究发现,应用3ABC作为鉴别自然感染动物和疫苗免疫动物是最好的选择。利用基因工程表达3ABC或3AB重组蛋白作为抗原研制的ELISA试剂盒,在无口蹄疫国家应用效果较好。原因是在这些国家、所检动物没有接种灭活疫苗,或者即使进行了免疫接种,由于其生产的灭活疫苗质量较高,免疫动物不易产生非结构蛋白抗体。然而这种试剂盒在我国的应用效果不是很理想(口蹄疫鉴别诊断,见江鹏斐等:2000年湖北襄樊第八次家畜口蹄疫学术研讨会论文集)。据分析,主要原因是由于国内所用口蹄疫灭活疫苗所含的成份比较复杂,尤其是培养病毒的细胞成份含较高,加之口蹄疫灭活疫苗在注射时剂量被人为加大,以及多次反复免疫,容易使免疫动物产生非结构蛋白抗体。故,获得敏感、特异性好的非结构蛋白抗原是目前需解决的首要问题。
3ABC是口蹄疫病毒的一种非结构蛋白,参与病毒RNA复制,是高保守区,3ABC蛋白是由3A、3B和3C组成,其中3B多肽是由编码区3个串联重复的非等同基因编码的,因而可以产生3种不同的3B蛋白(VPg),这是RNA病毒基因组中少见的信息重复现象(King A M Q,ET AL.,1980),而且VPg基因的拷贝数与RNA病毒的感染力有关(Falk M M.,ET AL.,1992)。插入或者缺失一个VPg基因并不影响病毒RNA的复制(Falk M M.,ET AL.,1992)。携带有pUpU结构的VPg蛋白可以与3`端的Poly(A)结合作为病毒RNA合成时的引物蛋白,这种特殊的RNA复制方式与宿主细胞mRNA转录不同,因而在宿主RNA合成受到抑制时,并不影响病毒RNA的合成。上述研究表明VPg蛋白的确与病毒感染有关。
田克恭、孙明等人于2007年对3B进行了相关研究,发现,3B抗原用于健康牛群、免疫牛群和未免疫感染牛群的鉴别诊断特异性、敏感性较好,只是仍然存在一定的漏检或者假阳性。
本领域亟需开发一种更可靠、更准确的抗原用于检测O型口蹄疫病毒。
技术实现要素:
根据上述领域现有抗原存在漏检、假阳性等不足,以及亟需开发新抗原的需求,本发明提供一种敏感、特异性好的口蹄疫病毒非结构蛋白重组抗原及其制备方法,本发明重组抗原可用于鉴别口蹄疫病毒自然感染动物和疫苗免疫动物。
本发明的技术方案如下:
一种O型口蹄疫病毒人工重组抗原,其氨基酸序列包含如Seq ID No.4所示的肽段。
所述O型口蹄疫病毒人工重组抗原,其氨基酸序列如Seq ID No.5所示。
编码所述O型口蹄疫病毒人工重组抗原的基因片段。
表达所述O型口蹄疫病毒人工重组抗原的重组表达载体,其特征在于,包含编码Seq ID No.4所示的肽段的核苷酸序列。
一种转化体,其特征在于,包含所述的重组表达载体。
所述O型口蹄疫病毒人工重组抗原的制备方法,其特征在于,包括:
将所述的重组表达载体转化宿主细胞获得工程菌,进行工程菌培养、诱导表达获得重组蛋白。
所述重组表达载体为PGEX-20T-VPg1;
所述宿主细胞为大肠杆菌ER2566菌株;
所述培养指,用添加了100μg/mL AMP的LB培养液在37℃下振荡培养所述转化后的宿主细胞;
所述诱导表达指,在所述培养液OD450=0.6-0.8时,加入终浓度为1mmol/L的IPTG。
所述制备方法还包括对工程菌的诱导表达产物进行如下纯化步骤:
(1)超声破碎
8000g离心所述工程菌10min,弃上清收集沉淀;所述沉淀用粗提缓冲液悬浮,用超声波破碎处理,16000g离心20min,取上清弃沉淀;
所述粗提缓冲液为0.05mol/L pH8.5Tris-HCl缓冲液;
(2)粗提层析
将所述上清以16ml/min流速穿过DEAE-FF柱;上样完毕后用粗提缓冲液冲洗上样峰至基准线;用粗提洗脱液冲洗柱子到出峰,收集洗脱峰;
所述DEAE-FF柱在使用前先用所述粗提缓冲液平衡10个柱床体积;
所述粗提洗脱液为0.02mol/L pH6.8磷酸盐缓冲液;
(3)精提层析
将上一步中收集的样品用精提缓冲液3倍稀释后以16ml/min流速穿过CM-FF柱;上样完毕后用精提缓冲液冲洗上样峰至基准线;用精提洗脱液冲洗柱子到出峰,收集洗脱峰;
所述精提缓冲液为0.05mol/L pH5.5醋酸盐缓冲液;
所述CM-FF柱在使用前先用所述精提缓冲液平衡15个柱床体积;
所述精提洗脱液为0.1mol/L氯化钠溶液;
(4)样品透析
精提层析中收集的样品用样品保存缓冲液以内外体积1:20的比例进行透析,每隔4h换透析液一次,共换透析液3次,然后用0.22μ的微孔滤膜除菌过滤,获得的所述重组抗原-20℃保存;
所述样品保存缓冲液为0.02mol/L pH8.0磷酸盐缓冲液。
用于检测O型口蹄疫病毒和/或鉴别O型口蹄疫病毒自然感染动物和疫苗免疫动物的试剂盒,其特征在于,包括:
所述O型口蹄疫病毒重组抗原;和/或
所述核苷酸序列;和/或
所述重组表达载体;和/或
所述转化体。
所述O型口蹄疫病毒重组抗原的工作浓度为0.5μg/mL-5μg/mL。
本发明提供一种O型口蹄疫病毒人工重组抗原,其氨基酸包括如Seq ID No.4所示的肽段。本发明的口蹄疫病毒非结构蛋白重组抗原可用于鉴别诊断自然感染动物和疫苗接种动物,具有特异性好、敏感性强等优点。Seq ID No.4所示的肽段即VPg1重组蛋白,该蛋白仅由23个氨基酸组成,为仅有少数的抗原决定簇的小片段多肽,以有效区分感染动物的单决定簇抗原或寡决定簇抗原,鉴别口蹄疫病毒疫苗免疫动物和自然感染动物。
在本发明一些具体的实施例中,所述人工重组抗原的氨基酸序列如Seq ID No.5所示。
基于本领域公知的密码子理论,本发明还请求保护所有能够编码上述O型口蹄疫病毒重组抗原的核苷酸序列。
基于分子生物学实验操作理论,连接有编码Seq ID No.4所示肽段的核苷酸序列的重组表达载体,经适当的分子生物学实验操作,例如,转化、培养、诱导表达等,也可以表达上述O型口蹄疫病毒人工重组抗原,因此本发明请求保护包含编码Seq ID No.4所示肽段的核苷酸序列的重组表达载体。在具体的实施例中,所述编码Seq ID No.4所示肽段的核苷酸序列如Seq ID No.1所示。
同样地,基于分子生物学实验操作理论,将上述重组表达载体转化至合适的宿主细胞,可得到一种转化体,该转化体经培养和/或诱导表达亦可获得本发明所述的O型口蹄疫病毒重组抗原,因此本发明还请求保护包含所述的重组表达载体的转化体。在一些具体的实施例中,所述宿主细胞优选大肠杆菌ER2566菌株,所得到的转化体是包含有连接了Seq ID No.1所示的VPg1核苷酸序列的上述重组表达载体的工程菌。
本发明的另一些实施例还提供了所述O型口蹄疫病毒重组抗原的制备方法,包括:将Seq ID No.1所示的核苷酸序列扩增的连接表达载体、转化宿主细胞获得工程菌进行培养、诱导表达获得重组蛋白;和/或,将所述的重组表达载体转化宿主细胞,获得工程菌进行培养,诱导表达获得重组蛋白;和/或,将所述的转化体进行培养,诱导表达获得重组蛋白。
在进一步的实施例中,所述方法还包括纯化所述重组蛋白。纯化这一步的优点在于可提高重组蛋白的纯度、质量及反应活性,使其符合用于检测的使用要求。
上述方法的各个步骤:连接、转化、诱导表达和/或纯化,均为本领域常规操作方法,在基于对上述VPg1蛋白的氨基酸序列或其对应的VPg1核苷酸序列的了解下,本领域技术人员可以按照《分子克隆实验指南》等技术手册获得与本发明所述O型口蹄疫病毒重组抗原作用相同的重组蛋白。
在本发明一个最为具体的实施例中,所述口蹄疫病毒非结构蛋白重组抗原的制备方法是以O型口蹄疫病毒RNA为模板,用Seq ID No.2和Seq ID No.3所示的核苷酸序列为引物扩增得到目的基因扩增产物,将扩增产物插入载体pGEX-20T,得到重组质粒pGEX-20T-VPg1,载将其转到大肠杆菌ER2566菌株,在37℃,含氨苄青霉素(100ug/mL)的LB培养基中培养,用IPTG诱导表达重组蛋白,再将诱导的重组蛋白进行纯化。
为了完善本发明的便捷度,本发明还提供一种用于检测O型口蹄疫病毒和/或鉴别O型口蹄疫病毒自然感染动物和疫苗免疫动物的试剂盒,其包括:所述的O型口蹄疫病毒重组抗原;和/或所述重组抗原对应的核苷酸序列;和/或连接有VPg1核苷酸序列的重组表达载体;和/或包含所述重组表达载体的转化体。根据上面的原理叙述,以VPg1蛋白为核心的所述O型口蹄疫病毒重组抗原、连接有VPg1核苷酸序列的重组表达载体、和/或包含所述重组表达载体的转化体都能实现检测O型口蹄疫病毒的效果,也均可起到鉴别诊断O型口蹄疫病毒自然感染动物和疫苗免疫动物的作用,因此上述几种物质的任意一种或几种都可用于制备检测O型口蹄疫病毒的试剂盒和/或鉴别口蹄疫病毒自然感染动物和疫苗免疫动物的免疫学诊断试剂盒;所述试剂盒可以是酶联诊断试剂,胶体金免疫试纸条等。
在一些优选的实施例中,本发明所述O型口蹄疫病毒重组抗原在所述试剂盒中的工作浓度为0.5μg/mL-5μg/mL。采用该工作浓度的重组抗原进行检测,效果最优。
在一些国家专利法允许的情形下,本发明还请求保护所述O型口蹄疫病毒重组抗原,和/或所述重组抗原对应的核苷酸序列,和/或连接有VPg1核苷酸序列的重组表达载体,和/或包含所述重组表达载体的转化体,和/或所述试剂盒在检测O型口蹄疫病毒,和/或鉴别诊断O型口蹄疫病毒自然感染动物和疫苗免疫动物方面的用途。
经质量鉴定检测证实,本发明所述的O型口蹄疫病毒重组抗原纯度高、反应活性好、特异性好;并且经口蹄疫阴性群体牛血清、口蹄疫灭活疫苗免疫群体牛血清和口蹄疫病毒人工感染牛血清试验,说明本发明利用原核表达系统表达的口蹄疫病毒非结构蛋白VPg1具有良好的反应原性,能够与口蹄疫病毒阳性血清反应,且能很好的鉴别自然感染动物血清和灭活疫苗免疫血清;更为重要的是,本发明还对比了本发明的重组抗原与现有的几种已知抗原在各类阴性群体、阳性群体、免疫群体的血清样本中的检测效果,发现本发明所提供的O型口蹄疫病毒重组抗原在检测中的准确率更高。
采用本发明所述的口蹄疫病毒非结构蛋白VPg1重组抗原对O型口蹄疫病毒进行检测,特异性好、安全、成本低,有较好的反应活性,且抗原制备操作简便,能很好的鉴别自然感染动物和人工免疫动物血清,与现有已知的抗原相比较,漏检率大大降低,检测的特异性和敏感性达到了很高的水平。
附图说明
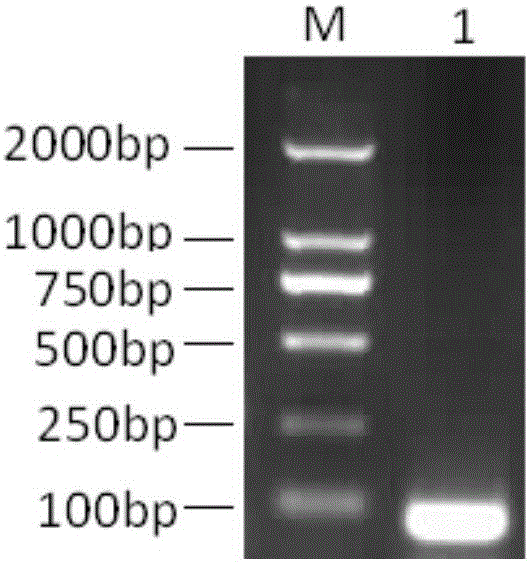
图1为VPg1基因扩增,泳道1:VPg1;M:DL2000Marker。
图2为VPg1重组蛋白诱导表达的SDS-PAGE鉴定,泳道1:未诱导对照;泳道2:诱导菌;泳道3:菌体裂解沉淀;泳道4:菌体裂解上清;M为低分子量蛋白Marker。
图3为蛋白纯化SDS-PAGE鉴定,泳道1:纯化的VPg1;M为低分子量蛋白Marker。
图4为用口蹄疫病毒阴阳性血清对纯化的重组蛋白进行Western-bloting鉴定,泳道1:O型口蹄疫病毒标准阳性血清;泳道2:豚鼠A型口蹄疫病毒标准阳性血清;泳道3:豚鼠Asia I型口蹄疫病毒标准阳性血清;泳道4:豚鼠C型口蹄疫病毒标准阳性血清;泳道5:猪水泡病阳性血清;泳道6:牛病毒性腹泻病毒阳性血清;M:低分子量蛋白Marker。
具体实施方式
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的方法和产品,均落在本发明的保护范围之内。
生物材料来源
1.疫苗和血清:
实施例2中使用的O型口蹄疫活疫苗,购自乾元浩生物股份有限公司。牛O型口蹄疫病毒标准阳性血清、豚鼠A型口蹄疫病毒标准阳性血清、豚鼠C型口蹄疫病毒标准阳性血清、豚鼠Asia I型口蹄疫病毒标准阳性血清由中国农业科学院兰州兽医研究所惠赠。猪水泡病标准阳性血清和牛病毒性腹泻标准阳性血清由农业部兽医诊断中心保存。O型口蹄疫野毒株感染牛阳性血清由农业部兽医诊断中心制备保存,O型口蹄疫疫苗株免疫牛阳性血清和口蹄疫病毒人工感染牛血清由内蒙古生药厂和农业部兽医诊断中心制备保存,口蹄疫阴性群体牛血清由北京进出境检验检疫局提供。
实施例4中使用的10份口蹄疫阴性群体牛血清,由北京进出境检验检疫局提供;口蹄疫灭活疫苗免疫群体牛血清和口蹄疫病毒人工感染牛血清各20份,由内蒙古生药厂和农业部兽医诊断中心共同制备并保存;10份口蹄疫病毒自然感染牛血清,由农业部兽医诊断中心制备并保存;
实施例5中使用的O型口蹄疫自然感染阳性血清(20份)、O型口蹄疫人工感染阳性血清(20份)、口蹄疫灭活疫苗免疫阳性血清、疫苗免疫攻毒组阳性血清(10份)和口蹄疫阴性血清(20份),均由农业部兽医诊断中心保存提供。
2.载体和菌株:
pGEX-T-Easy载体购自Promega公司。Dh5a感受态细胞购自北京全式金生物技术有限公司。pGEX-20T载体和E.coli ER2556菌株由厦门大学肿瘤与细胞工程实验室夏宁邵教授惠赠。
主要试剂
总RNA提取试剂盒为Qiagen公司产品。AMV、Rnasin、DNTPs、Taq DNA聚合酶、T4连接酶、pGEM-T-Easy均购自Promega公司,胶回收试剂盒和质粒提取试剂盒为Omega产品,Bgl II和Sal I为Takara产品。
实施例1、本发明所述重组抗原的获得
本实施例提供一种O型口蹄疫病毒重组抗原,其包括VPg1蛋白;编码所述VPg1蛋白的核苷酸序列由下述引物RT-PCR扩增O型口蹄疫病毒RNA获得。
所述RT-PCR扩增引物如下:
引物1:AGATCTATGGGACCCTACGTCGGG(Seq ID No.2)
引物2:GTCGACTTACTCTTGCTGTGGTAGC(Seq ID No.3)
1.口蹄疫病毒总RNA的提取
用Qiagen公司的RNA提取试剂盒说明书从O型口蹄疫活疫苗中提取总RNA。
2.VPg1片段RT-PCR扩增
用步骤2得到的RNA作模板,用引物1和引物2进行RT-PCR扩增,25ul反应体系如下:纯化水12μL,5XPCR buffer 5μL,dNTP(2.5mmol/L)2.5μL,上下游引物(10pmol)各1μL,Taq DNA聚合酶(5U/μL)1μL,反转录酶0.3μL,RNA酶抑制剂0.2μL,RNA 2μL。扩增程序:42℃反转录45min,95℃热启动3min,95℃30s,50℃30s,72℃30s,35个循环后,72℃延伸10min。扩增产物经1.5%琼脂糖凝胶电泳鉴定。结果显示,得到大小为80bp左右的目的条带,即VPg1蛋白的核苷酸序列,如Seq ID No.1及图1所示。
3.VPg1DNA片段的纯化回收
经凝胶电泳后,切下目的片段,进行胶回收纯化,具体方法步骤详见Omega胶回收试剂盒说明书。纯化回收后的DNA放-20℃备用。
4.T-Easy-VPg1重组质粒的构建
连接体系10μL:pGEM-T-easy载体1μL,回收DNA 4μL,10X连接Buffer 1μL,纯化水4μL,混匀后,16℃反应4h。然后进行转化,具体方法如下:
1)从-70℃冰箱拿出一只DH5a感受态细胞,迅速放入,实现准备好的冰水浴盒中,待感受态细胞融化,将连接产物轻轻加入并混匀。冰浴30min。
2)42℃热击:将上述加入连接产物的感受态细胞放进42℃水浴锅中,热击45s,热击后迅速放入冰浴中3min。
3)在操净台中向热击好的管中加入无菌LB培养基500μL。37℃200转,复苏细胞1小时。
4)取上述复苏好的转化菌200μL,加入LB/AMP琼脂板中,涂匀后,37℃温箱中倒置培养16小时。
5.T-Easy-VPg1重组质粒的鉴定及提取
待步骤4中的菌板第二天长出单菌后,挑取10个单菌,分别接种于LB/AMP培养基中,37℃摇床220r培养12小时,用PCR方法鉴定阳性质粒。
PCR鉴定方法与体系如下:无菌水9.8μL,dNTP(2.5mmol/L)2μL,5X Buffer 4μL,上下游引物(10pmol)各1μL,DNA聚合酶(5U/μL)0.2μL,最后加对应菌液2μL。扩增程序:95℃热启动3min,95℃30s,50℃30s,72℃30s,35个循环后,72℃延伸10min。扩增产物经1.5%琼脂糖凝胶电泳鉴定。将鉴定阳性的菌样送上海英俊生物工程有限公司测序。
测序结果显示获得编码所述VPg1蛋白的核苷酸序列如Seq ID No.1所示。所述VPg1蛋白的氨基酸序列如Seq ID No.4所示。
将测序正确的阳性菌液,提取质粒。质粒提取方法按照Promega质粒提取试剂盒方法进行。最后回收的质粒放-20℃保存备用。
6.所述重组表达载体PGEX-20T-VPg1的构建
用BamH I和Sal I双酶切表达载体PGEX-20T,Bgl II和Sal I双酶切T-Easy-VPg1重组质粒,回收目的基因片段,与表达载体PGEX-20T连接。并转化到DH5a大肠杆菌中(方法步骤见方法5),涂LB/AMP培养板37℃过夜培养。第二天无菌挑取平板上大小均匀的单菌落接种LB/AMP液体培养基中,并编号,37℃震荡培养,12小时。按照步骤5中的菌液PCR方法进行鉴定。
将PCR鉴定为阳性的菌液,进行小量质粒提取,并进行双酶切鉴定。酶切体系如下:Bgl II 0.5μL,Sal I 0.5μL,10X H Bufer 1μL,质粒DNA 4μL,无菌水4μL,37℃酶切3h。酶切反应结束后,取酶切产物进行琼脂糖凝胶电泳分析,将阳性质粒命名为PGEX-20T-VPg1。
7.所述转化体的获得
将上一步获得的所述重组表达载体PGEX-20T-VPg1转化至宿主细胞中,即可获得本发明所述的转化体。
具体地,所述宿主细胞为E.coli ER2556菌株。
转化后获得含有PGEX-20T-VPg1重组表达载体的工程菌,可以通过诱导表达获得本发明所述的重组抗原。
8.VPg1的诱导表达及鉴定
将单菌接种4mL LB/AMP培养基中,37℃过夜震荡培养。按1:100的比例将摇好的菌液接种到新的LB/AMP培养基中,37℃震荡培养,当培养液OD450=0.6~0.8时,加入终浓度为1mmol/L的异丙基硫代半乳糖苷(IPTG),继续培养6小时,收菌。将菌体用粗提缓冲液(pH8.5 50mmol/L Tris-HCL溶液)悬浮,超声破碎处理,16000r/min离心20min,取上清和沉淀,进行SDS-PAGE电泳,结果显示获得了与预期大小相等的蛋白,分子量大小为29KDa左右(图2),重组蛋白存在于裂解上清和裂解沉淀中,即以可溶性形式存在于裂解上清中和以包涵体的形式存在裂解沉淀中,此步所得的重组蛋白即本发明所述的O型口蹄疫病毒重组抗原,其氨基酸序列为如Seq ID No.5所示。
为了保证所述重组抗原的纯度和质量,还可对其进行进一步的纯化。
9.重组蛋白纯化
1)VPg1基因工程菌处理
将诱导的VPg1基因工程菌培养液8000g离心10min,弃上清收集沉淀。沉淀用粗提缓冲液(pH8.5 50mmol/L Tris‐HCl缓冲液)悬浮,用超声波破碎处理,16000g离心20min,取上清弃沉淀。
2)粗提层析
用粗提缓冲液平衡DEAE‐FF柱,流速为16mL/min,平衡10个柱床体积。将上清用粗提缓冲液10倍稀释,然后以16mL/min流速穿过DEAE‐FF柱。上样完毕后用粗提缓冲液冲洗上样峰至基准线。用粗提洗脱液(0.02mol/L pH6.8磷酸盐缓冲液)冲洗柱子到出峰,收集洗脱峰。
3)精提层析
用精提缓冲液(50mmol/L pH5.5醋酸盐缓冲液)平衡CM-FF柱,流速为16mL/min,平衡15个柱床体积后,将粗提层析中收集的样品用精提缓冲液3倍稀释,以16mL/min流速穿过CM-FF柱。上样完毕后用精提缓冲液冲洗上样峰至基准线。用精提洗脱液(100mmol/L氯化钠溶液)冲洗柱子到出峰,收集洗脱峰。
4)样品透析
精提层析中收集的样品用样品保存缓冲液(0.02mol/L pH8.0磷酸盐缓冲液)以内外体积1:20的比例进行透析,每隔4h换透析液一次,共换透析液3次,然后用0.22μm的微孔滤膜除菌过滤,纯化样品进行蛋白含量测定,-70℃保存。
蛋白纯化的这一过程,采用了重组蛋白通过粗提层析(DEAE-FF柱)和精提层析(CM-FF柱)两步法,去掉一些与VPg1等电点比较接近的杂蛋白,使得目的蛋白更为纯净,最后用保存缓冲液进行透析,使得蛋白能更好的保存以保存其活性。
实施例2、本发明所述重组抗原的质量检测
1)SDS-PAGE电泳鉴定
取测定浓度的纯化蛋白20uL,加5×上样缓冲液,煮沸5min,12000r离心10min,备用。按照表1中的配方配制分离胶和积层胶。
表1 SDS-PAGE电泳胶的配方
按照常规方法配制12%胶进行SDS-PAGE鉴定,以检测VPg1纯化率,电泳结果显示,通过粗提,精提和透析,获得了较纯的重组蛋白,纯化率在95%以上(见图3)。
3)蛋白浓度与纯度测定
用紫外光分光光度计测定纯化的VPg1在260nm和280nm波长的光吸收值,按照以下公式计划样品中的蛋白浓度:蛋白质浓度(mg/mL)=(1.45×A280-0.74×A260)×稀释倍数。测定结果显示纯化的VPg1蛋白浓度为2.13mg/mL。蛋白质纯度测定使用SDS-PAGE电泳检查纯化的蛋白样品,并用薄层分析目的蛋白的纯度。结果显示蛋白样品纯度约为95%。符合使用要求。
3)反应活性鉴定
将纯化的VPg1进行Western Blot鉴定:将纯化的VPg1进行SDS-PAGE电泳,并转移到NC膜上,分别用牛O型口蹄疫病毒标准阳性血清、豚鼠A型口蹄疫病毒标准阳性血清、豚鼠C型口蹄疫病毒标准阳性血清、豚鼠Asia I型口蹄疫病毒标准阳性血清、猪水泡病阳性血清和牛病毒性腹泻病毒阳性血清进行Western Blot分析,封闭液为PBS配制的0.2%酪蛋白,10%马血清,2%明胶溶液,其他按常规方法进行。结果显示,牛O型口蹄疫病毒标准阳性血清、豚鼠A型口蹄疫病毒标准阳性血清、豚鼠C型口蹄疫病毒标准阳性血清、豚鼠Asia I型口蹄疫病毒标准阳性血清均与表达的VPg1重组蛋白在29KDa左右位置出现阳性条带。猪水泡病阳性血清和牛病毒性腹泻病毒阳性血清与表达的VPg1蛋白呈阴性反应。结果见图4。
4)抗原特异性检测
包被:用纯化的VPg1抗原样品作为包被抗原,将其用碳酸盐缓冲液(0.05mol/L,PH9.6)稀释成0.5μg/mL、1.0μg/mL及2.0μg/mL.向96孔酶联反应板孔加100μL,在2~8℃下包被18-24h,取出,弃孔中抗原包被液。
封闭:加封闭液(100g Tris,50g酪蛋白,500g蔗糖,加水至30L,PH7.5)至包被的酶联反应板各孔中,330μL/孔,室温下封闭1h,弃去封闭液,洗板5次。
加样:用牛口蹄疫标准阳性血清、牛口蹄疫标准阴性血清、猪水泡病阳性血清和牛病毒性腹泻病阳性血清用样品稀释液(含10%马血清的PBS缓冲液)稀释10倍,加入酶联反应板反应,100μL/孔,37℃孵育60min,弃去反应液,洗板5次。
加酶标记物:每孔加入100μL HRPO标记SPA(1:10000稀释),37℃孵育30min。弃去反应液,洗板5次。
显色:每孔加入100μL TMB底物液,37℃孵育15min。每孔加入终止液100μL,并且轻轻震荡混匀。
OD值测定:在450nm波长下测定各孔OD值。
结果显示,牛口蹄疫标准阳性血清在0.5μg/mL、1.0μg/mL及2.0μg/mL VPg1抗原均呈阳性反应,牛口蹄疫标准阴性血清、猪水泡阳性血清和牛病毒性腹泻病阳性血清均呈阴性反应,OD450值均小于0.2.结果见表2。
表2 VPg1抗原ELISA特异性检测结果
实施例3、本发明所述的试剂盒及重组抗原间接ELISA检测方法建立
本实施例提供一种用于检测O型口蹄疫病毒和/或鉴别O型口蹄疫病毒自然感染动物和疫苗免疫动物的试剂盒,包括:
实施例1所提供的Seq ID No.1所示的核苷酸序列;和/或O型口蹄疫病毒重组抗原;和/或重组表达载体;和/或转化体(具体为所述工程菌)。
进一步地,为了确定所述重组抗原在试剂盒中的工作浓度,以及为检测各类血清样本中FMDV建立ELISA检测方法,进行如下试验:
按照方阵滴定法分别确定VPg1重组抗原的最佳包被浓度、一抗血清的最佳稀释倍数、酶标二抗兔抗牛IgG的最佳稀释浓度及最佳反应时间等。基本方法如下:
包被:将VPg1抗原样品用碳酸盐缓冲液(0.05mol/L,pH9.6)稀释成0.5μg/mL、1μg/mL、2μg/mL和5μg/mL。向96孔酶联反应板各孔中加入l00μL,在2~8℃下包被18~24h,取出,弃去孔中的抗原包被液,洗板5次。
封闭:用封闭液(100g Tris,50g Casein,500g sucrose;加水至30L,pH7.5)加入已包被的酶联反应板各孔内,每孔330μL,在37℃温箱封闭30min,弃去封闭液,洗板5次。
加样:将牛口蹄疫标准阳性血清用样品稀释液(含10%马血清的PBS缓冲液)按l:2、l:5、1:10的比例稀释,加入包被酶联反应板各孔内反应,每孔100μl,37℃孵育60min~120min。弃去反应液,洗板5次。
加酶标记物:每孔加入100μL HRPO标记兔抗牛IgG(1:10000稀释),37℃孵育30min~60min,弃去反应液,洗板5次。
显色:每孔加入100μL TMB底物液。37℃孵育15min。每孔加入100μL终止液,并轻轻振荡混匀。
OD值测定:在450nm波长下测定各孔OD值。
计算临界值:用优化后的ELISA实验体系分别检测FMDV抗体阴性群体,计算阴性样本OD450平均值和标准差,按照公式:阴阳性临界值=样本OD450平均值+3倍的标准差。
结果显示,经方阵滴定法确定重组抗原包被浓度为0.5μg/mL,血清稀释度为10倍稀释、辣根过氧化物酶标记羊抗牛IgG工作浓度为1:10 000,反应时间分别为血清样品反应时间为30min、酶标记物反应30min,显色10min。
阴阳性临界值为0.235。
由此可以确定,本发明所述试剂盒中,所述O型口蹄疫病毒重组抗原的工作浓度范围为:0.5μg/mL-5μg/mL,优选为0.5μg/mL。
实施例4、采用本发明所述的试剂盒检测牛血清
采用实施例1所述的重组抗原VPg1和/或实施例3所述的试剂盒,以及所建立的ELISA检测方法,对背景清楚的实验牛血清和临床上背景清楚的牛血清进行检测,包括10份口蹄疫阴性群体牛血清、口蹄疫灭活疫苗免疫群体牛血清和口蹄疫病毒人工感染牛血清各20份、以及10份口蹄疫病毒自然感染牛血清。以OD450值/阴性对照血清OD450值≥2.0为判定阳性的标准。分析检测结果,计算试剂盒敏感性。
临床样品检测结果显示,用VPg1重组抗原ELISA检测20份口蹄疫阳性血清(10份自然感染病例和10份人工感染病例)均为阳性,敏感性100%,10份阴性血清和10份疫苗免疫血清均为阴性。
实施例5、本发明所述重组抗原与现有抗原的对比试验
采用实施例1所述的重组抗原VPg1和/或实施例3所述的试剂盒,以及所建立的ELISA检测方法(以下简称VPg1-ELISA)与现有技术中的VPg1-2和VPg2-3纯化蛋白建立的间接ELISA(以下分别简称VPg1-2-ELISA和VPg2-3–ELISA)同时对背景清楚的O型口蹄疫自然感染阳性血清(30份)、O型口蹄疫人工感染阳性血清(30份)、口蹄疫灭活疫苗免疫阳性血清(30)、疫苗免疫攻毒组阳性血清(20份)和口蹄疫阴性血清(30份)进行检测。
检测结果见表3。检测结果显示,虽然VPg1-2-ELISA和VPg2-3–ELISA对于健康牛群、灭活疫苗免疫牛群的特异性和敏感性可达到100%,但它们对自然感染牛群、人工活病毒感染牛群和疫苗免疫后攻毒牛群有一定程度的漏检,尤其是对疫苗免疫后攻毒牛群的漏检率高达50%左右,而本发明所述的重组抗原对于健康牛群、自然感染牛群、疫苗免疫后未感染牛群以及人工活病毒感染牛群特异性和敏感性达到100%,不存在漏检;只有疫苗免疫后攻毒牛群有一定的漏检,但漏检率控制在10%以下。
表3 对比试验结果
SEQUENCE LISTING
<110> 北京世纪元亨动物防疫技术有限公司
中国动物疫病预防控制中心
<120> 一种O型口蹄疫病毒重组抗原及其制备与应用
<130> P160207/SJY
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 69
<212> DNA
<213> artificial sequence
<220>
<223> O型口蹄疫病毒(Food and Mouth Disease Virus)VPg1蛋白对应的核苷酸序列
<400> 1
ggaccctacg tcgggccgct cgagcgtcag aaacctctta aagtgagagc agagctacca 60
cagcaagag 69
<210> 2
<211> 24
<212> DNA
<213> artificial sequence
<220>
<223> O型口蹄疫病毒(Food and Mouth Disease Virus)VPg1蛋白RT-PCR扩增引物1
<400> 2
agatctatgg gaccctacgt cggg 24
<210> 3
<211> 25
<212> DNA
<213> artificial sequence
<220>
<223> O型口蹄疫病毒(Food and Mouth Disease Virus)VPg1蛋白RT-PCR扩增引物2
<400> 3
gtcgacttac tcttgctgtg gtagc 25
<210> 4
<211> 23
<212> PRT
<213> artificial sequence
<220>
<223> O型口蹄疫病毒(Food and Mouth Disease Virus)VPg1蛋白
<400> 4
Gly Pro Tyr Val Gly Pro Leu Glu Arg Gln Lys Pro Leu Lys Val Arg
1 5 10 15
Ala Glu Leu Pro Gln Gln Glu
20
<210> 5
<211> 252
<212> PRT
<213> artificial sequence
<220>
<223> O型口蹄疫病毒(Food and Mouth Disease Virus)重组抗原
<400> 5
Met Ser Pro Ile Leu Gly Tyr Trp Lys Ile Lys Gly Leu Val Gln Pro
1 5 10 15
Thr Arg Leu Leu Leu Glu Tyr Leu Glu Glu Lys Tyr Glu Glu His Leu
20 25 30
Tyr Glu Arg Asp Glu Gly Asp Lys Trp Arg Asn Lys Lys Phe Glu Leu
35 40 45
Gly Leu Glu Phe Pro Asn Leu Pro Tyr Tyr Ile Asp Gly Asp Val Lys
50 55 60
Leu Thr Gln Ser Met Ala Ile Ile Arg Tyr Ile Ala Asp Lys His Asn
65 70 75 80
Met Leu Gly Gly Cys Pro Lys Glu Arg Ala Glu Ile Ser Met Leu Glu
85 90 95
Gly Ala Val Leu Asp Ile Arg Tyr Gly Val Ser Arg Ile Ala Tyr Ser
100 105 110
Lys Asp Phe Glu Thr Leu Lys Val Asp Phe Leu Ser Lys Leu Pro Glu
115 120 125
Met Leu Lys Met Phe Glu Asp Arg Leu Cys His Lys Thr Tyr Leu Asn
130 135 140
Gly Asp His Val Thr His Pro Asp Phe Met Leu Tyr Asp Ala Leu Asp
145 150 155 160
Val Val Leu Tyr Met Asp Pro Met Cys Leu Asp Ala Phe Pro Lys Leu
165 170 175
Val Cys Phe Lys Lys Arg Ile Glu Ala Ile Pro Gln Ile Asp Lys Tyr
180 185 190
Leu Lys Ser Ser Lys Tyr Ile Ala Trp Pro Leu Gln Gly Trp Gln Ala
195 200 205
Thr Phe Gly Gly Gly Asp His Pro Pro Lys Ser Asp Leu Val Pro Arg
210 215 220
Gly Ser Arg Ser Met Gly Pro Tyr Val Gly Pro Leu Glu Arg Gln Lys
225 230 235 240
Pro Leu Lys Val Arg Ala Glu Leu Pro Gln Gln Glu
245 250
- 还没有人留言评论。精彩留言会获得点赞!
- 一种O型口蹄疫病毒多肽与SLA-2重链、轻链β2m复性结晶的方法
- 一种口蹄疫病毒微滴数字pcr绝对定量检测试剂盒的制作方法
- 检测口蹄疫病毒和/或猪水泡病病毒的基因芯片以及试剂盒的制作方法
- 口蹄疫病毒(fmdv)共有蛋白、其编码序列以及由其制造的疫苗的制作方法
- 口蹄疫病毒O、A和AsiaⅠ型三重实时荧光定量RT-PCR检测试剂盒的制作方法
- 一种高效表达口蹄疫病毒抗原基因的重组乳酸杆菌及其制备方法和应用
- 口蹄疫病毒结构蛋白抗体酶联免疫检测试剂盒的制作方法
- Rpa-侧流层析检测口蹄疫病毒气溶胶的引物、探针及试剂盒的制作方法
- 一种口蹄疫病毒2c3abc重组蛋白及其制备方法和应用
- 用于检测口蹄疫病毒的基因芯片及其检测方法