一种头孢曲松钠和舒巴坦钠组合物、包含该组合物的药物制剂及其应用的制作方法
技术领域:
本发明涉及一种组合物,特别涉及一种由头孢曲松钠和舒巴坦钠组成的组合物。本发明还涉及包含该组合物的药物制剂及其应用。
背景技术:
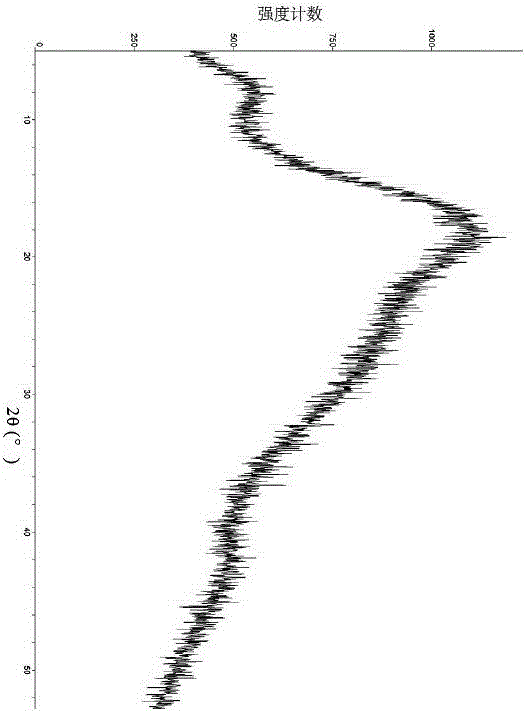
:头孢曲松(ceftriaxone)是第三代头孢菌素类抗生素,临床上常用其钠盐。头孢曲松钠对多种革兰氏阴性菌和部分革兰氏阳性菌(如大肠杆菌、肺炎克雷伯菌、淋病奈瑟菌等)具有良好的抗菌活性,可用于治疗敏感菌所致的感染性疾病,但对耐甲氧西林金葡菌(MRSA)、阴沟肠杆菌等则不敏感,导致其使用受到一定的限制。舒巴坦是一种β-内酰胺酶抑制剂。现有技术中有人将舒巴坦钠和头孢曲松钠制成复方制剂,提高了头孢曲松的抗菌谱和对耐药菌的敏感性。药品质量稳定是保障人们安全用药的关键。要使头孢曲松钠和舒巴坦钠复方制剂相对于单方制剂具有更好药效,必然要求复方制剂药品质量稳定。但是,复方与单方相比,在制剂制备和药效作用等方面均呈现出较大的复杂性。通过研究发现,现有的头孢曲松钠和舒巴坦钠复方制剂,呈现出晶体形态不稳定的情况。CN102462684A报道,在低温、惰性气体条件下,头孢曲松钠、舒巴坦钠和冻干保护剂溶于70%的乙醇形成溶液后,加入pH调节剂,经冻干后可形成一种共晶粉,并能够在36个月内保持有效成分基本不降解。但是,该共晶粉毕竟含有头孢曲松钠、舒巴坦钠、冻干保护剂、pH调节剂等多种组分,可能会对原料药本身产生一定影响。通过研究发现,该共晶粉在含量方面虽然稳定,但是并没有形成一种稳定的晶体。这意味着其在晶体学意义上仍然是不稳定的。发明人期望通过深入的研究,改善头孢曲松钠与舒巴坦钠复方制剂的产品质量,延长药品有效期,提高药品的经济性和安全性。技术实现要素:本发明的目的之一是提供一种由头孢曲松钠和舒巴坦钠组成的稳定组合物,以解决目前头孢曲松钠和舒巴坦钠复方制剂的稳定性差、药效差或者有效期短等问题。本发明的又一目的在于,提供一种包含由头孢曲松钠和舒巴坦钠组成的稳定组合物的药物制剂。本发明的再一目的在于,提供所述药物制剂在制备抗菌药物中的应用。发明人在改进复方制剂的制备工艺时,意外地得到了一种具有特定晶体形态的头孢曲松钠和舒巴坦钠组合物。本发明的一个技术方案是:一种由头孢曲松钠和舒巴坦钠组成的组合物,在其X射线粉末衍射分析图谱中,包含以下衍射角:11.2±0.2°、14.3±0.2°、17.8±0.2°、19.3±0.2°、21.2±0.2°、22.8±0.2°和/或23.8±0.2°。优选地,本发明所述的组合物在其X射线粉末衍射分析图谱中还可以包含以下衍射角:12.6±0.2°、16.7±0.2°、18.4±0.2°、20.0±0.2°、20.4±0.2°和/或28.0±0.2°。本发明的另一技术方案是:一种由头孢曲松钠和舒巴坦钠组成的组合物,在其X射线粉末衍射分析图谱中包含以下晶面间距:7.9±0.2Å、6.2±0.2Å、5.0±0.2Å、4.6±0.2Å、4.2±0.2Å、3.9±0.2Å和/或3.7±0.2Å。优选地,本发明所述的组合物在其X射线粉末衍射分析图谱中还包含以下晶面间距:7.1±0.2Å、5.3±0.2Å、4.8±0.2Å、4.4±0.2Å、4.3±0.2Å和/或3.2±0.2Å。本发明的组合物是一种结晶性物质(晶体)。X射线粉末衍射分析是本领域中鉴别晶体的权威手段,在进行X射线粉末衍射分析所得图谱中,低2θ角处、高晶面间距处、形态清晰完整、强度较大的峰往往更能反映出晶体的特征性。另外,由于样品的择优取向等问题,单独的特征峰峰高、峰面积等参数往往不具有特征性,不能单独用作对晶体的表征。发明人按照晶体学的普遍原则,选取了一系列具有特征性的2θ角和晶面间距,能够科学地表征出本发明的组合物。优选地,本发明的组合物,在进行红外吸收光谱分析时,可以在以下波数±5cm-1处具有吸收峰:3255、1742、1604、1539、1398、1302、1198、1124、1032、897、804、600和479。更优选地,本发明所述的组合物在进行红外吸收光谱分析时,还可以在以下波数±5cm-1处具有吸收峰:3441、3116、2938、1500和1099。优选地,本发明的组合物,在进行差示扫描量热分析时,显示在269.6±0.5℃处具有放热峰。对于晶体的表征而言,红外吸收光谱分析和差示扫描量热分析的准确性可能不如X射线粉末衍射分析,但它们是物质鉴别的两种常用手段,因此,对于本发明的组合物的表征可以起到参考的作用。本发明的组合物,可以通过以下方法制备得到:取头孢曲松钠原料和舒巴坦钠原料,研磨至粒度为25μm~88μm,混合均匀。优选地,所述的粒度可以是25μm~47μm、38μm~62μm或58μm~88μm。优选地,本发明所述的研磨可以是先将头孢曲松钠原料和舒巴坦钠原料分别研磨后,再共同研磨;也可以是直接将头孢曲松钠原料和舒巴坦钠原料共同研磨。优选地,本发明所述的粒度可以是指中位粒径分布D50。优选地,本发明所述的研磨可使用球磨机进行。优选地,本发明所述的混合可以是采用单锥螺带式混合机进行的。更优选地,所述单锥螺带式混合机的转速可以是每分钟25~40转,混合时间可以是10~25分钟。在制备本发明的组合物时,发明人采用研磨方法。在研磨过程中,物理作用力促使头孢曲松钠和舒巴坦钠充分接触,并直接或间接地影响物质的微观空间结构。发明人发现,特定的研磨程度对于产物十分重要,在某些情况下得到的产物其结晶度偏低,而通过规定研磨后产物的粒径则可在一定程度上实现对研磨程度的控制。例如,可以在研磨时选用不同目数的筛网,也可在研磨后用特定目数的筛网对产物进行筛分。产物的粒径可使用本领域通常的方法进行测定。虽然列举了一种本发明组合物的制备方法,但并不排除还有其他方法可以得到本发明的组合物。另外,为了简化制药过程,使后续制备药物制剂时更加方便,还可以预先使本发明组合物中的两种组分保持在一定的比例。优选地,本发明的组合物中,头孢曲松钠(按头孢曲松计)和舒巴坦钠(按舒巴坦计)的比例(质量比),可以为1:1~8:1。在本发明的一些实例中,比例优选为1:1、2:1、3:1、4:1、5:1、6:1、7:1或8:1。更优选地,本发明的组合物中,头孢曲松钠(按头孢曲松计)和舒巴坦钠(按舒巴坦计)的比例为1:1~4:1。虽然例举了组分的一些比例,但并不排除使用其他的比例可以得到本发明的组合物。对于组合物而言,上述各种优选技术方案中的技术特征可以自由组合,均属于本发明的组合物的范畴。本发明的又一技术方案是:一种含有本发明组合物的药物制剂。优选地,本发明的药物制剂中可以是以本发明中的组合物为活性成分。优选地,本发明的药物制剂中还可以含有药学上所接受的辅料。优选地,本发明的药物制剂可以是粉针剂或注射液,其中粉针剂可以是无菌粉针或冻干粉针。优选地,本发明的药物制剂中,头孢曲松钠(按头孢曲松计)和舒巴坦钠(按舒巴坦计)的比例(质量比),可以为1:1~8:1。在本发明的一些实例中,比例优选为1:1、2:1、3:1、4:1、5:1、6:1、7:1或8:1。更优选地,本发明的药物制剂中,头孢曲松钠(按头孢曲松计)和舒巴坦钠(按舒巴坦计)的比例可以是1:1~4:1。对于药物制剂而言,上述各种优选技术方案中的技术特征可以自由组合,均属于本发明的药物制剂的范畴。本发明的再一技术方案是:本发明的组合物或药物制剂在制备预防或治疗细菌感染的药物中的应用。优选地,本发明中的抗菌可以是抗淋病奈瑟菌,其中更优选可以是具有耐药性的淋病奈瑟菌。更优选地,本发明中的耐药可以是指对β-内酰胺类、四环素类、大环内酯类、氨基糖苷类或氟喹诺酮类抗菌药物的耐药。说明:本发明中,“组合物”这一名词是指:一种以上物质所形成的组合。“药物制剂”这一名词是指:按照一定的剂型要求所制成的,符合相关法律法规的规定和相关标准的要求,可以直接提供给使用对象使用的产品。其中,相关法律法规包括但不限于《药品管理法》、《药品注册管理办法》、《药品生产质量管理规范》等;相关标准包括但不限于《中国药典》。“无菌粉针”、“冻干粉针”或“注射液”中可以根据需要添加或不添加辅料,并采用本领域常规方法进行制备。“X射线粉末衍射分析”、“红外吸收光谱分析”、“差示扫描量热分析”均采用本领域常规的分析方法。另外,由于相关分析方法中实验条件(包括但不限于样品粒度、样品颗粒长宽比、仪器型号、仪器精度、操作方式、操作人员等)的差别,以及由于实验误差(仪器误差、偶然误差等)的不可避免性,本发明中的数据不可能完全绝对化。为科学地表征本发明的组合物,发明人根据本领域的通常认识(例如美国药典USP35-NF30中描述X射线粉末衍射分析中衍射角误差可能达到0.2°)和本发明组合物的情况对数据的误差范围进行了制定。但是,应当理解的是,误差范围并不能穷尽所有的情况。本领域技术人员可以理解数值还可以在本领域的通常范围内进行波动,这均属于本发明的技术方案的范围。“特征峰”、“吸收峰”或“放热峰”中的“峰”是指:使用相关分析方法所得到的图谱中,所呈现出的强度大于噪音的峰。“耐药”或“耐药性”是指:微生物对药物产生了耐受,使得药物对该微生物的活性作用明显下降。本发明通过研究得到了一种新型的头孢曲松钠和舒巴坦钠组合物,该组合物及其制成的药物制剂具有更好的抑菌活性和更优异的稳定性(物理稳定性、化学稳定性和生物活性稳定性)。在本发明的某些实例中,组合物及其制剂在贮藏30个月后水溶液澄清度好,各项杂质含量均小于0.5%,结晶度基本保持不变,显示出优异的物理稳定性和化学稳定性。另外,出人意料的是,在本发明的某些实例中,组合物和药物制剂在抗菌活性方面还得到了提高,特别对于各种耐药性淋病奈瑟菌显示出更好的抑菌效果,而且贮藏30个月后活性不变,显示出优异的生物活性稳定性。由于具有优异的稳定性和生物活性,本发明的组合物及其制剂非常适合用于细菌感染的治疗,特别适用于各种难治性的耐药淋病奈瑟菌所引起的泌尿生殖系统感染的治疗。附图说明图1对比例1中的冻干粉针A的X射线粉末衍射分析图谱。图2对比例2中的混粉的X射线粉末衍射分析图谱。图3实施例1中组合物I的X射线粉末衍射分析图谱。图4实施例1中组合物I的红外吸收光谱分析图谱。图5实施例2中组合物II的X射线粉末衍射分析图谱。图6实施例2中组合物II的红外吸收光谱分析图谱。图7实施例3中组合物III的X射线粉末衍射分析图谱。图8实施例3中组合物III的红外吸收光谱分析图谱。具体实施方式晶体是物质的粒子在微观上所呈现出的一种有序排列方式,受科学技术水平制约,目前尚不能有效预测出晶体的存在和存在方式。原料药的晶型(晶体形态)对于药品质量的稳定起着十分重要的作用。在药品质量控制方面,不同晶型(晶体形态)可能具有不同的稳定性进而影响药品质量。若药品晶型(晶体形态)固定,则质量更稳定,更易控制,否则可能造成药品批次之间的质量差异,使其稳定性各不相同。头孢曲松钠可呈现出多种不同的晶体形态。《中国抗生素杂志》(2007,32(11):672-678)报道了使用软件对头孢曲松钠的单晶结构进行模拟,为人们研究头孢曲松钠的晶体提供了有益的参考。《药学学报》(2014,49(7):1034-1038)则报道了头孢曲松钠的三种亚晶型,其在成盐率、结晶度、丁基胶塞相容性等方面均不相同,并可能影响药物的疗效。舒巴坦钠也是一种可呈现不同晶体形态的物质。《Biochemistry》(1981,20(13):3680-3687)报道了舒巴坦钠可从乙酸乙酯-正丁醇混合溶剂中进行结晶,并公开了其单晶结构。《淮海医药》(2005,23(5):423)报道了采用丙酮、乙酸乙酯、甲醇、乙醇等不同溶媒制备舒巴坦钠,得到四种不同的晶体,其形态、密度、流动性方面均有显著的区别。CN103113390A公开了一种舒巴坦晶体,其能够在24个月内保持含量稳定。由于头孢曲松钠和舒巴坦钠均存在多种不同晶体,这就带来了复方药物晶型的复杂性,而且制剂的过程也可能对晶体产生不可预知的影响。以下对比例、实施例、试验例不用来限制本发明的技术方案和技术效果。说明:以下对比例、实施例或试验例中:(1)所述的头孢曲松钠/头孢曲松钠晶体的用量是指按照头孢曲松来进行计量的,所述的舒巴坦钠/舒巴坦钠晶体的用量是指按照舒巴坦来进行计量的。例如,“取头孢曲松钠500g”是指所取的头孢曲松钠中头孢曲松的量是500g。(2)所述的晶体形态测定采用X射线粉末衍射法,采用BRUKERD8ADVANCEX射线粉末衍射仪,测定条件:CuKα辐射,管压40kV,扫描范围5-60°,扫描速度17.7s/步,步长0.02°。(3)所述的红外吸收光谱分析中将样品用KBr压片后测定。(4)所述的差示扫描量热分析法采用德国NETZSCH公司STA409综合热分析仪测定,测定条件:升温速度10K/min,保护气N2流量30mL/min,吹扫气N2流量20mL/min,温度范围35~300℃。(5)所述的结晶度采用美国药典USP35-NF30的方法测定。(6)所述的杂质含量按照欧洲药典EP8.0的方法,采用HPLC法进行测定。(7)所述的溶液澄清度按照中国药典2015版的方法进行测定。对比例1按照CN102462684A中实施例1报道的方法,在无菌、避光和氮气流下,将100g头孢曲松钠、50g舒巴坦钠和25g甘露醇置于预处理好的,已冷却到10℃以下且用非金属容器盛装的90ml70%乙醇溶液中,搅拌使溶解完全,用0.1mol/L的碳酸氢钠水溶液将溶液pH值调节到6.5,无菌过滤,分装,放入到充满惰性气体的冻干机内预冻(-48~-20℃)、减压、升华、干燥,得到一种冻干物,命名为冻干粉针A,取样进行晶体形态测定,X射线粉末衍射图谱见图1。对比例2按照CN102993215A中实施例1描述的下列方法:“将7-ACT与AE-活性酯进行缩合得到头孢曲松钠粗品;取粗品5g,加水40ml使溶解,在13℃下向溶液中加入异辛酸钠4.1g,搅拌至澄清,用10%的稀盐酸调pH值为7.00,继续搅拌30分钟得到母液;在搅拌下向该母液中缓慢加入无水乙醇,至出现浑浊时停止搅拌和加入,静置25分钟,再缓慢加入无水乙醇至形成大量晶体,共使用无水乙醇150ml;将所得晶体过滤,滤饼用无水乙醇:水=4:1的混合溶剂洗涤至中性,再用无水乙醇洗一遍,35℃下常压干燥”,制备头孢曲松钠。按照CN103113390A中实施例1描述的下列方法:“取舒巴坦钠粗品,加入粗品5倍(ml/g)的N,N-二甲基甲酰胺与水的混合溶剂(3:1),升温至70℃,搅拌至全溶,保温,调溶液pH至5.5,将溶液以5m/s的速度流动通过0.5T的直流磁场,磁场方向与溶液流动方向垂直,磁处理完的溶液中加入混合溶剂0.3%倍(g/ml)的活性碳脱色,搅拌30min,过滤,得到澄清溶液,向澄清溶液中加入混合溶剂5倍(ml/ml)的乙醇,过滤,得到滤饼,用蒸馏水洗涤滤饼3次,再减压干燥4h”,制备舒巴坦钠。取按照上述方法制得的头孢曲松钠1000g和舒巴坦钠500g,无菌条件下用槽式混合机混合均匀,得到混粉,取样进行晶体形态测定,X射线粉末衍射图谱见图2。混粉在无菌条件下进行分装后,得到一种无菌粉针剂,命名为无菌粉针A。对比例3取市售头孢曲松钠2000g和舒巴坦钠1000g,无菌条件下用槽式混合机混合均匀,得到一种混粉,取样进行晶体形态测定,X射线粉末衍射图谱与图2类似。混粉在无菌条件下进行分装后,得到一种无菌粉针剂,命名为无菌粉针B。实施例1取按照对比例2方法制得的头孢曲松钠1200g和舒巴坦钠600g,用球墨机一同研磨至粒径D50为25μm~47μm,再置于锥螺带式混合机(HF1600型)中混合均匀,机器转速设定为每分钟30转,混合时间为25分钟。操作完成后,取出物料,得到一种结晶性物质,命名为组合物I。取样测定其晶体形态,X射线粉末衍射图谱见图3,表1列出了图谱中的主要数据。用红外吸收光谱分析测定其红外吸收,图谱见图4,表2列出了主要的红外吸收峰数据。进行差示扫描量热分析,发现在269.51℃处具有放热峰。表1组合物I的X射线粉末衍射图谱主要数据序号2θ角(°)晶面间距(Å)峰高峰面积111.1387.9372150216530212.5217.06344374363314.2896.19341101468918416.6385.3238179812883517.8354.9692156911493618.4324.80968837497719.2764.6008290821910819.9784.4406103412897920.4534.33861342204181021.1714.19301651170801122.7363.90791889258221223.7693.74031299150651327.9853.1856261225393表2组合物I的红外吸收图谱主要数据序号波数(cm-1)序号波数(cm-1)13441101302232541111983311712112442937131099517421410326160515897715391680481501176009139818480实施例2取市售头孢曲松钠500g和舒巴坦钠500g,用球墨机一同研磨至粒径D50为38μm~62μm。再置于单锥螺带式混合机(HF1600型)中混合均匀,机器转速设定为每分钟40转,混合时间为20分钟。操作完成后,取出物料,得到一种结晶性物质,命名为组合物II。取样测定其晶体形态,X射线粉末衍射图谱见图5,表3列出了图谱中的主要数据。用红外吸收光谱分析测定其红外吸收,图谱见图6,表4列出了主要的红外吸收峰数据。进行差示扫描量热分析,发现在269.67℃处具有放热峰。表3组合物II的X射线粉末衍射主要数据序号2θ角(°)晶面间距(Å)峰高峰面积111.1207.9500125015628212.5217.06354133990314.2726.2007840951004416.6565.3181128210862517.8154.9746151410864618.4314.80977336124719.2924.5970247516754819.9234.452853718373920.4534.33861604152081021.1714.19311308136321122.7353.90801626233931223.8253.7317947144601327.9663.1878209021313表4组合物II的红外吸收图谱主要数据序号波数(cm-1)序号波数(cm-1)13441101302232541111983311512112442939131099517421410326160515897715391680481499176009139818478实施例3取市售头孢曲松钠930g,研磨;取舒巴坦钠310g,研磨,然后再将两种原料用球墨机一同研磨至粒径D50为58μm~88μm。置于单锥螺带式混合机(HF1600型)中混合均匀,机器转速设定为每分钟25转,混合时间为10分钟。操作完成后,取出物料,所得结晶性物质命名为组合物III。取样测定其晶体形态,X射线衍射图谱见图7,表5列出了图谱中的主要数据。用红外吸收光谱分析测定其红外吸收,图谱见图8,表6列出了主要的红外吸收峰数据。进行差示扫描量热分析,发现在269.69℃处具有放热峰。表5组合物III的X射线粉末衍射主要数据序号2θ角(°)晶面间距(Å)峰高峰面积111.1597.9227151916847212.5767.03264584586314.2946.19131313270185416.6585.3176178611679517.8514.9647187310087618.4504.80499107192719.3154.5917394024924819.9984.436285911627920.4764.33381901137881021.2084.18581446163281122.7013.91381468219121223.8073.73451261157791327.9733.1870193523623表6组合物III的红外吸收图谱主要数据序号波数(cm-1)序号波数(cm-1)13441101302232561111983311712112442937131099517421410326160315897715391680481499176009139818480实施例4~8分别取市售头孢曲松钠800g和舒巴坦钠200g;头孢曲松钠1150g和舒巴坦钠230g;头孢曲松钠2700g和舒巴坦钠450g;头孢曲松钠1330g和舒巴坦钠190g;头孢曲松钠2200g和舒巴坦钠275g;分别按实施例2的方法操作,分别得到组合物IV~组合物VIII。经X射线衍射分析,这五种组合物的图谱与实施例1~3所得图谱基本一致。实施例9取市售头孢曲松钠500g和舒巴坦钠500g,用球墨机一同研磨至粒径D50为104μm~175μm。其余的物料混合操作与实施例2相同。操作完成后,取出物料,将物料在无菌条件下进行分装,得无菌粉针C。再取市售头孢曲松钠500g和舒巴坦钠500g,用球墨机一同研磨至粒径D50至10μm以下。其余的物料混合操作与实施例2相同。操作完成后,取出物料,将物料在无菌条件下进行分装,得无菌粉针D。实施例10分别取实施例1~8的组合物在无菌条件下进行分装,得无菌粉针I~无菌粉针VIII。分别取实施例1~8的组合物,按冻干剂的常规工艺进行操作,得冻干粉针I~冻干粉针VIII。分别取实施例1~8的组合物,用50倍量(ml/g)的0.9%氯化钠水溶液溶解,分装,得注射液I~注射液VIII。试验例1:稳定性试验对上述对比例或实施例中的组合物I~组合物VIII、无菌粉针I、无菌粉针II、无菌粉针IV、冻干粉针I、冻干粉针II、无菌粉针A、无菌粉针B、无菌粉针C、无菌粉针D、冻干粉针A,进行稳定性试验。试验环境:在温度25℃±2℃、相对湿度60%±10%的环境下放置30个月。试验结果:对溶液澄清度、杂质1、2、3、4的含量(其中杂质1、2、3分别为EP8.0记载的头孢曲松钠的杂质A、B、E,杂质4为EP8.0记载的舒巴坦钠的杂质A)、结晶度等进行了测定,主要试验结果如表7~表10所示。表7:稳定性试验0月各样品情况表8:稳定性试验12月各样品情况表9:稳定性试验24月各样品情况表10:稳定性试验30月各样品情况从稳定性试验的结果可以看出,在12个月后,实施例中的组合物及制剂,与对比例相比,在结晶度、杂质、溶液澄清度等方面均具有区别,在30个月后,区别更显著。对比例中的制剂未呈现出晶态,无结晶度数据;而实施例中的组合物和制剂结晶度高达90%,且在30个月之内能基本保持不变,表明物理稳定性很好。对比例中的制剂在24~30月时出现了轻微浑浊现象,而实施例中的组合物和制剂未出现浑浊现象。对比例中的制剂虽然在0月时四种杂质含量基本与本发明的组合物和制剂相当,但是时间变化后杂质增加非常明显,特别是杂质1(头孢曲松异构体杂质)和杂质4(舒巴坦开环降解杂质),24~30月时含量分别超过了1%和0.5%,已经达不到EP8.0的要求;而实施例中的组合物和制剂的四种杂质增加不明显,且均在限定范围之内,表明化学稳定性很好。该项发现揭示了特定杂质的产生与晶体形态之间可能存在紧密的联系。试验例2:体内抑菌试验在试验例1中,于0月抽取稳定性试验样品进行体内抑菌试验;然后于30月再抽取稳定性试验样品,再进行体内抑菌试验。两次体内抑菌试验均按照以下方法进行。试验材料试验样品:试验例1稳定性试验中0月和30月的组合物I~组合物VIII、无菌粉针I、无菌粉针II、无菌粉针IV、冻干粉针I、冻干粉针II、冻干粉针A、无菌粉针A、无菌粉针B;以及对照药物头孢曲松钠、盐酸左氧氟沙星、阿奇霉素、盐酸多西环素、盐酸大观霉素。其中对照药物在稳定性试验0月时购买一批用于与0月的试验样品配套进行试验,在稳定性试验30月再购买一批用于与30月的试验样品配套进行试验,购买时两批的生产日期均在一个月以内。动物:ICR小鼠,体重18-22g,雌雄各半。菌株:ATCC700603(肺炎克雷伯菌)、ATCC43069(淋病奈瑟菌)、Q-R(耐喹诺酮类淋病奈瑟菌)、T-R(耐四环素类淋病奈瑟菌)、PP-R(耐β-内酰胺类淋病奈瑟菌)、MAC-R(耐大环内酯类淋病奈瑟菌)、SPE-R(耐大观霉素淋病奈瑟菌)、QS-R(耐头孢曲松淋病奈瑟菌)。其中,ATCC700603、ATCC43069购自ATCC,QS-R参照文献《中国热带医学,2010,10(8),946-948》方法制备,其他菌株来自临床分离。保护剂:高活性干酵母。试验方法细菌增毒:将孵育18小时的实验菌用5%高活性干酵母稀释为10-2和10-3,以此菌0.5ml行腹腔注射感染小鼠,造成实验鼠全身感染致败血症模型,不给任何保护措施致小鼠感染死亡并及时对感染致死鼠进行无菌操作开胸术,取心血或内腔积液均匀涂在相应的琼脂平皿上,置37℃孵育18小时后经鉴定与所给感染菌相符。再用此菌感染小鼠,以此法1-2次可增强细菌毒力且毒力比较稳定。确定最小致死菌量(MLD):将实验菌株用5%高活性干酵母稀释为10-1、10-2、10-3、10-4不同浓度的稀释菌液,分别对实验动物进行腹腔注射(0.5ml/鼠)建立感染败血症模型。感染后记录小鼠死亡数,致小鼠100%死亡的最低菌量为1MLD,作为动物保护试验中的用菌量,而低于其一个log菌浓度组感染动物全部存活的菌浓度称0.1MLD。在实验中用1MLD菌浓度作为感染实验的阳性对照;用0.1MLD的菌浓度作为感染阴性对照。无论是阳性还是阴性对照组均只给菌而不给任何抗生素治疗。阳性对照组应具有70%以上的死亡率,阴性对照组应具有30%以下的死亡率。确定试验样品剂量范围的预试验:用5%高活性干酵母配制1MLD菌量感染小鼠,即刻和6小时后,用高、中、低三个不同浓度的试验样品剂量进预试验(每个剂量组4只鼠),记录感染后小鼠存活数,并以此结果为依据来设计动物保护试验的给药剂量。初摸给药剂量时各组药剂量浓度相差倍数可大些,当定了范围后可缩小相差倍数再摸试,直至找到合适药物剂量浓度(即最高浓度剂量组70%以上的感染动物存活;最低剂量组不低于70%的感染动物死亡)。动物保护试验:在预试验中按小鼠感染受试菌,找出100%小鼠死亡与未出现死亡的各药物剂量浓度后,取实验前18h禁食不禁水、体重18-22g的小鼠,雌雄各半,随机分成:(1)ATCC700603组,(2)ATCC43069组,(3)Q-R组,(4)T-R组,(5)PP-R组,(6)MAC-R组,(7)SPE-R组,(8)QS-R组,每组5个试验样品浓度,每组10只动物,并设10只动物作空白对照(给予等体积的灭菌注射用水),每鼠均腹腔注射1MLD菌液0.5ml,造成感染模型,于感染后即刻和6小时分别皮下注射不同浓度的试验样品液0.2ml/鼠,连续观察7天,记录各组动物死亡情况。对死亡小鼠剖检,作肉眼观察。用Bliss法计出各受试药的50%有效剂量(ED50)及95%可信限,并进行t检验,组间比较其差异的显著性。ED50越小表明试验样品对细菌感染动物具有越好的保护作用。试验结果表11和表12列出了动物保护试验主要的结果。其中表11为稳定性试验0月样品的体内抑菌ED50值,表12为稳定性试验30月样品的体内抑菌ED50值。表11:稳定性试验0月试验样品的体内抑菌的ED50值(mg/kg)表12:稳定性试验30月试验样品的体内抑菌ED50值(mg/kg)注:表11和表12中的“/”表示未进行。试验结果显示出实施例中的组合物及制剂在抗菌方面具有更好的活性,特别是对于各种耐药性淋病奈瑟菌显示出明显更强的抑制活性,与对比例中的制剂相比,某些情况下活性可高出2-3倍。另外,实施例中的组合物及制剂具有相当好的生物活性稳定性,特别是对于不耐药和各种耐药淋病奈瑟菌的抑制作用能始终保持稳定,经30月后,生物活性基本不变。对比例中的制剂经过30月后则出现了明显的活性降低。工业实用性本发明提供的由头孢曲松钠和舒巴坦钠组成的组合物、包含该组合物的药物制剂具有的更好的活性和更优异的稳定性(物理稳定性、化学稳定性和生物活性稳定性),适合用于细菌感染的治疗,特别适用于难治性的对多种抗生素耐药的淋病奈瑟菌所引起的泌尿生殖系统感染疾病的治疗。虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明的基础上,本领域技术人员可以对之作合理的修改或改进。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明的内容。上文中
背景技术:
、
发明内容、具体实施方式中所描述的内容,仅用于说明之用途,不作为认定本发明之现有技术的证据。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1