一种普鲁兰多糖‑全反式维甲酸载药系统及其制备方法与流程
本发明涉及药物载体领域,特别是涉及一种负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸载药系统及其制备方法。
背景技术:
近年来,纳米载药系统在恶性肿瘤的治疗方面取得了长足的进步。目前应用于临床的紫杉醇-脂质体(力朴素)、紫杉醇-白蛋白纳米粒子(Abraxane)、阿霉素-脂质体(凯莱)、G-CSF-聚乙二醇纳米粒子(Lonquex)以及氟尿嘧啶-聚乳酸纳米粒子(中人氟安)等纳米载药系统可在一定程度上提高药物疗效,减轻毒副作用。但是,当实施纳米载药系统治疗以后,肿瘤暂时得到抑制,之后往往再次复发和转移。
造成这一现象的主要原因在于现有纳米载药系统治疗肿瘤普遍存在下列问题:1、大多数纳米载药系统稳定性不足,进入体内后造成纳米载药系统团聚或分散,团聚后粒径过大很快被网状内皮系统清除(大于150nm);分散后粒径过小(小于10nm)则通过外渗作用从组织中清除,导致治疗效果不理想。
2、纳米载药系统单一载药进入体内后难以高效杀灭生命力顽强的肿瘤细胞。Yani Cui等人研究了一种具有还原敏感性的聚酰胺胺-聚乙二醇-聚精氨酸纳米载药系统[见“ACS applied materials interfaces”,8卷2193-2203页,(2016年)],该系统粒径较小,具有很好的体内靶向性,但只负载阿霉素一种药物,降低了其疗效。
3、纳米载药系统在治疗过程中存在着肿瘤细胞耐药性,肿瘤细胞能够将药物泵出细胞外,导致肿瘤复发和转移的问题。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种普鲁兰多糖-全反式维甲酸载药系统及其制备方法,用于解决现有技术中用于治疗肿瘤的载药系统稳定性差、疗效欠佳等问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种普鲁兰多糖-全反式维甲酸载药系统的制备方法,包括如下步骤:
1)将普鲁兰多糖-肼冻干材料用水溶解,制得第一溶液;
2)将全反式视黄醛与第一溶液混合,再加入异丙醇或二甲亚砜进行反应,制得第二溶液;
3)将第二溶液除去杂质,冷冻干燥,制得普鲁兰多糖-全反式维甲酸材料;
4)将阿霉素-纳米金刚石复合物用水溶解,制得第三溶液;
5)将步骤3)制得的普鲁兰多糖-全反式维甲酸材料溶于水中,制得第四溶液,将第三溶液与第四溶液混合进行反应,制得第五溶液;
6)将第五溶液超滤,制得所述普鲁兰多糖-全反式维甲酸载药系统。
进一步地,步骤1)中,每10mg普鲁兰多糖-肼冻干材料中加入1-3mL水。
进一步地,步骤2)中,全反式视黄醛与第一溶液中普鲁兰多糖-肼冻干材料的质量之比为(1-3):5。
全反式视黄醛的英文名称:all-trans-Retinal;别名:VitaminAAIdehyde、维他命A醛;CAS:116-31-4;化学式:C20H28O。
进一步地,步骤2)中,每mL第一溶液中加入0.2-0.6mL异丙醇或二甲亚砜。异丙醇或二甲亚砜可增加全反式视黄醛在水溶液中的溶解度。其作用是溶解全反式视黄醛,全反式视黄醛的加入量会直接影响异丙醇的加入量。异丙醇或二甲亚砜的加入量以刚好溶解完全反式视黄醛为宜,如果加入的异丙醇或二甲亚砜过多,阿霉素-金刚石将会从溶液中析出来,如果加入的异丙醇量过少,那么全反式视黄醛部分没有溶解,进而会影响载药量。因此,异丙醇或二甲亚砜的加入量存在一个临界点,多加或少加都会带来负面影响。
进一步地,步骤3)中,第二溶液除去杂质的方式为透析。
进一步地,步骤4)中,所述第三溶液中阿霉素-纳米金刚石复合物的浓度为10-15mg/mL。阿霉素-纳米金刚石复合物是指载有阿霉素的纳米金刚石。
进一步地,步骤5)中,所述第四溶液中普鲁兰多糖-全反式维甲酸材料的浓度为5-10mg/mL。
进一步地,步骤5)中,第三溶液中的阿霉素-纳米金刚石与第四溶液中的普鲁兰多糖-全反式维甲酸的质量比为(1-4):1。
本发明第二方面提供上述方法制得的普鲁兰多糖-全反式维甲酸载药系统。
本发明第三方面提供上述普鲁兰多糖-全反式维甲酸载药系统在制备靶向治疗肿瘤药物中的用途。
如上所述,本发明的一种普鲁兰多糖-全反式维甲酸载药系统的制备方法,具有以下有益效果:1、利用普鲁兰多糖载体赋予纳米载药系统优良的稳定性,提高了靶向性;2、使用全反式维甲酸与阿霉素协同增效,提高阿霉素的抗肿瘤效果;3、引入纳米金刚石物理吸附药物,增加药物在肿瘤细胞内的滞留,克服耐药性。本发明将改性天然普鲁兰多糖和纳米金刚石作为载体,实现对阿霉素和全反式维甲酸的双载药,不仅保证了纳米载药系统在体内稳定、安全地将药物靶向递送到病灶部位,而且克服了肿瘤耐药性,实现了对肿瘤的联合给药和协同治疗。
附图说明
图1显示为本发明实施例的普鲁兰多糖-全反式维甲酸材料的红外图。
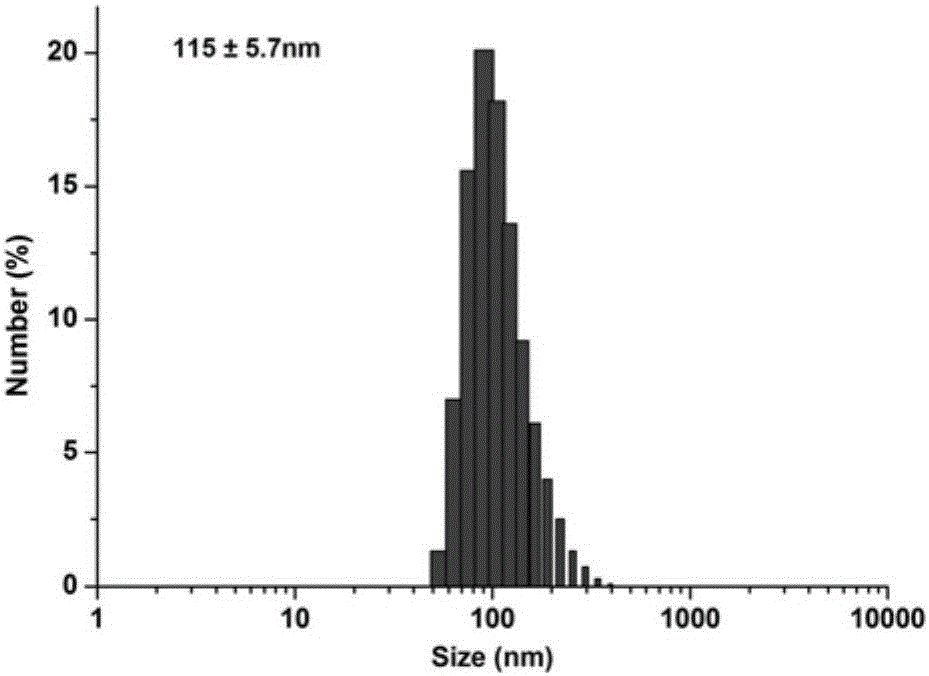
图2显示为本发明实施例的负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸纳米粒子的粒径分布图。
图3显示为本发明实施例的药物在肿瘤细胞内的分布图。
图4显示为本发明实施例的荷瘤鼠的死亡曲线图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
发明人在前期研究工作中,构建的普鲁兰多糖纳米载药系统展现出优异的稳定性,以下实施例中的普鲁兰-肼冻干材料采用申请号为2012100661842的专利文献中的方法制得。载阿霉素-纳米金刚石的制备方法详见“Nanodiamond Therapeutic elivery Agents Mediate Enhanced Chemoresistant Tumor reatment,Edward K.Chow et al.Sci Transl Med 3,73ra21(2011)”。
实施例1
一种普鲁兰多糖-全反式维甲酸载药系统的制备方法,包括如下步骤:1)将100mg普鲁兰多糖-肼冻干材料(酰胺化普鲁兰多糖)用10mL去离子水溶解,常温、磁力搅拌助溶,制得第一溶液;
2)称取20mg全反式视黄醛加入到第一溶液中,得到混合溶液,将2mL异丙醇逐滴滴入该混合溶液中,直至全反式视黄醛彻底溶解,在常温、磁力搅拌下反应12小时,制得第二溶液;
3)将第二溶液用去离子水透析除去小分子杂质,冷冻干燥,制得普鲁兰多糖-全反式维甲酸材料;
4)将20mg载阿霉素-纳米金刚石用2mL去离子水溶解,常温、超声助溶,制得第三溶液;
5)将20mg普鲁兰多糖-全反式维甲酸材料溶于2mL水中,制得第四溶液,将第三溶液与第四溶液混合进行反应,常温、磁力搅拌2h,制得第五溶液;
6)将第五溶液超滤,制得负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸载药系统。
实施例2
一种普鲁兰多糖-全反式维甲酸载药系统的制备方法,包括如下步骤:1)将100mg普鲁兰多糖-肼冻干材料(酰胺化普鲁兰多糖)用20mL去离子水溶解,常温、磁力搅拌助溶,制得第一溶液;
2)称取40mg全反式视黄醛加入到第一溶液中,得到混合溶液,将7.8mL二甲亚砜逐滴滴入该混合溶液中,直至全反式视黄醛彻底溶解,在常温、磁力搅拌下反应12小时,制得第二溶液;
3)将第二溶液用去离子水透析除去小分子杂质,冷冻干燥,制得普鲁兰多糖-全反式维甲酸材料;
4)将30mg载阿霉素-纳米金刚石用2mL去离子水溶解,常温、超声助溶,制得第三溶液;
5)将20mg普鲁兰多糖-全反式维甲酸材料溶于3mL水中,制得第四溶液,将第三溶液与第四溶液混合进行反应,常温、磁力搅拌2h,制得第五溶液;
6)将第五溶液超滤,制得负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸载药系统。
实施例3
一种普鲁兰多糖-全反式维甲酸载药系统的制备方法,包括如下步骤:1)将100mg普鲁兰多糖-肼冻干材料(酰胺化普鲁兰多糖)用30mL去离子水溶解,常温、磁力搅拌助溶,制得第一溶液;
2)称取60mg全反式视黄醛加入到第一溶液中,得到混合溶液,将18mL异丙醇逐滴滴入该混合溶液中,直至全反式视黄醛彻底溶解,在常温、磁力搅拌下反应12小时,制得第二溶液;
3)将第二溶液用去离子水透析除去小分子杂质,冷冻干燥,制得普鲁兰-全反式维甲酸材料;
4)将80mg载阿霉素-纳米金刚石用7mL去离子水溶解,常温、超声助溶,制得第三溶液;
5)将20mg普鲁兰-全反式维甲酸材料溶于4mL水中,制得第四溶液,将第三溶液与第四溶液混合进行反应,常温、磁力搅拌2h,制得第五溶液;
6)将第五溶液超滤,制得负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸载药系统。
对实施例1制得的药品在红外谱图、粒径分布、药物在细胞内的分布情况、治疗效果等方面进行实验观察,实验结果如下:
图1中,Pu-HHA:普鲁兰多糖-水合肼材料;ATR:全反式视黄醛;Pu-ATRA:普鲁兰多糖-全反式维甲酸材料。
关于图1的红外谱图图解如下:通过对比普鲁兰多糖-水合肼材料、全反式视黄醛、普鲁兰多糖-全反式维甲酸材料的红外谱图,能够明显看出在普鲁兰多糖-全反式维甲酸材料的谱图中出现了全反式视黄醛的特征峰,表明成功合成普鲁兰多糖-全反式维甲酸材料。
从图2的粒径分布图可知,负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸纳米粒子的粒径大小在115纳米左右,粒径较小,分布较窄,有利于体内的靶向分布。
图3为激光共聚焦图,即药物在肿瘤细胞内的分布图,从图中可知,负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸纳米粒子在与癌细胞作用4个小时后,药物明显进入细胞核,表示药物在细胞内进行了有效释放。
本发明选择荷瘤鼠进行实验,通过裸鼠尾静脉分别注射DOX·HCl、DOX-NDs、Pu-ATRA/DOX-NDs溶液。治疗结果如图4所示,图4为荷瘤鼠的死亡曲线图,图中,从左到右依次为Control:空白对照组;DOX·HCl:盐酸阿霉素组;DOX-NDs:阿霉素-纳米金刚石组;Pu-ATRA/DOX-NDs:负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸纳米粒子组,各组溶液中阿霉素的注射浓度为5mg/kg体重。通过对比可以看出,负载阿霉素-纳米金刚石的普鲁兰多糖-全反式维甲酸纳米粒子组能够明显延长动物死亡时间,展示出优良的疗效。
实施例2和实施例3的实验结果与实施例1类似。
综上所述,本发明将改性天然普鲁兰多糖和纳米金刚石作为载体,实现对阿霉素和全反式维甲酸的双载药,不仅保证了纳米载药系统在体内稳定、安全地将药物靶向递送到病灶部位,而且克服了肿瘤耐药性,实现了对肿瘤的联合给药和协同治疗。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!