一种红毛五加皮提取物及制备方法和用途与流程
本发明涉及一种红毛五加皮提取物及其制备方法和用途。
背景技术:
五加皮,始载于《神农本草经》,《本经》记载:“一名豺漆”,为五加最早的异名。《名医别录》所载:“一名豺节”。《图经本草》载:“酿酒饮之,治风痹四肢挛急”。《本草纲目》云:“五加治风湿痿痹,壮筋骨,其功良深”。可见,历代本草均将五加皮作为治疗风湿痹痛的良药,兼具滋补强壮之功效。全国五加皮药用基原来自于五加属多种植物的茎皮或根皮。
红毛五加皮为五加科植物五加属红毛五加Acanthopanax giraldii Harms密生刺毛的干燥茎皮。有本草考证认为“豺漆”、“豺节”之名称由来,是其原植物性状的形象比喻,因其茎皮上密被类似豺毛的红棕色刺毛。从现在全国使用的五加皮类药材来看,最符合此性状特征的当属红毛五加。《四川中药志》言红毛五加功效:“性温,味辛,无毒。祛风湿,通关节,坚筋骨;治瘘痹、拘挛疼痛、风寒湿痹,足膝无力、皮肤风湿及阴痿囊湿。”用法为“作煎剂或酒剂”。与历代本草记载的五加功效和用法相符。
红毛五加已报道的化学成分已逾百种,主要属于苷类、萜类、多糖、烷烃及有机酸类化合物,代表性的苷类成分包括紫丁香酚葡萄苷、刺五加苷B、D、E、胡萝卜苷、鸟苷、腺苷、核苷,等。
现代药理学研究认为,红毛五加总苷部位具有明确的抗炎、镇痛作用。
沈映君等对红毛五加皮的药理作用初步研究表明,红毛五加对大鼠蛋清性或琼脂性足跖肿胀及对小鼠因二甲苯或巴豆油所致的耳部炎症抑制作用明显,与红毛五加皮祛风湿的传统功效相符。现代研究表明,红毛五加中的苷类成分为抗炎的主要活性成分。党月兰等研究证实红毛五加总苷(TGA)具有抗急、慢性炎症作用。
红毛五加皮的总苷虽然效果优良,但其提取物中有效成分含量较低,若将其制备成方制剂,辅料用量较大,不利于工业生产成本的节约,且其服药量较大,不便于患者使用。
若能提供一种有效成分含量较高、且药效活性显著的提取物,将会有利于上述药物的推广。
技术实现要素:
本发明的技术方案是提供了一种新的红毛五加皮提取物及其制备方法和用途。
本发明红毛五加皮提取物,它是红毛五加皮的提取物,其HPLC指纹图谱如图2、图3或者图4所示,其中,HPLC指纹图谱的色谱条件如下:色谱柱:以十八烷基硅烷键合硅胶作填充剂;检测波长:207nm;流动相:以0.3%磷酸二氢钠水溶液为流动相A,乙腈为流动相B,按如下程序进行梯度洗脱:从0分钟开始至15分钟,流动相B由2%变为6%,从15分钟开始至25分钟,流动相B由6%变为9%,从25分钟开始至35分钟,流动相B由9%变为13%,从45分钟开始至60分钟,流动相B由17%变为25%,从60分钟开始至75分钟,流动相B为25%。
其中,所述的红毛五加皮为五加科植物五加属红毛五加Acanthopanax giraldii Harms密生刺毛的干燥茎皮。
本发明还提供了前述的红毛五加皮提取物的方法,它包括如下步骤:
a、取红毛五加皮,用6~15倍水煎煮提取2~4次,合并滤液,浓缩,去沉淀,得上清液;
b、取步骤c所得上清液,加于大孔吸附树脂上,水洗,再用1~4倍柱体积20%~60%乙醇溶液洗脱至近无色,回收或挥去乙醇,干燥,即得。
步骤a中,用15倍水煎煮提取3次。
步骤b中,所述大孔吸附树脂是非极性大孔树脂或者中性大孔树脂,优选D101大孔树脂、AB-8大孔树脂。
步骤b中,所述水洗的体积为1~4倍柱体积;所述乙醇溶液的用量为2~3倍柱体积;所述乙醇溶液是浓度为60%的乙醇溶液。
本发明还提供了前述红毛五加皮提取物在制备抗炎和/或镇痛的药物中的用途。
本发明还提供了前述红毛五加皮提取物在制备治疗类风湿性关节炎的药物中的用途。
本发明还提供了一种抗炎镇痛的药物组合物,它是含有有效量前述红毛五加皮提取物为活性成分,加入药学上可接受的辅料或辅助性成分制备而成的药剂。
其中,所述的药剂是口服制剂、注射制剂。
本发明红毛五加皮提取物具有良好的抗炎镇痛功效,且效果优于其他提取部位,进一步明确了红毛五加皮抗炎镇痛的有效部位,为制剂和药品安全监控提供了保障。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1对照品色谱图,1、绿原酸对照品色谱峰;2、刺五加苷B色谱峰;3、刺五加苷E色谱峰
图2本发明实施例1的提取物的色谱图,1、绿原酸对照品色谱峰;2、刺五加苷B色谱峰;3、刺五加苷E色谱峰
图3本发明实施例2的提取物的色谱图,1、绿原酸对照品色谱峰;2、刺五加苷B色谱峰;3、刺五加苷E色谱峰
图4本发明实施例3的提取物的色谱图,1、绿原酸对照品色谱峰;2、刺五加苷B色谱峰;3、刺五加苷E色谱峰
具体实施方式
实施例1本发明红毛五加皮提取物的制备
1、制备方法
称取红毛五加皮药材4kg,水浸置过夜后,分别加入15倍量水煎煮3次(煎煮时间是30min),合并水煎液,加热挥至小体积(浓缩至5000ml),滤去沉淀,上清液过D101大孔树脂柱(大孔树脂用量4kg,内径15cm,柱长70cm),先用2倍柱体积(BV)蒸馏水洗去杂质,然后2BV 60%乙醇溶液洗脱,收集洗脱部位,回收乙醇,浓缩物经60℃喷雾干燥得黄棕色粉末,即为本发明红毛五加皮提取物。
2、指纹图谱分析
2.1分析方法
(1)色谱条件为:色谱柱为Hypersil ODS2C18柱(4.6mm×250mm,5μm,大连伊利特);柱温:35℃;检测波长:207nm。流动相条件:A:0.3%磷酸二氢钠水溶液(加入磷酸调节pH约为3.5)-B:乙腈作为流动相的效果最好,色谱峰数目较多且峰形较好。梯度条件为:
红毛五加HPLC梯度条件
(2)样品制备方法:精密吸取洗脱部位的混悬液100μl,加乙醇900μl溶解,滤过,各精密吸取10μl,注入高效液相色谱仪分析。
(3)对照品:刺五加苷E、刺五加苷B均购自成都曼思特生物科技有限公司(供含量测定用,纯度≥98%);绿原酸(中国药品生物制品检定所,批号110753-200413);齐墩果酸(中国药品生物制品检定所,批号110709-200505)。葡萄糖为分析纯;试剂:甲醇(色谱纯,Fisher),乙腈(色谱纯,Fisher),水为超纯水或蒸馏水,提取药材用纯净水为乐百氏纯净水。
2.2分析结果
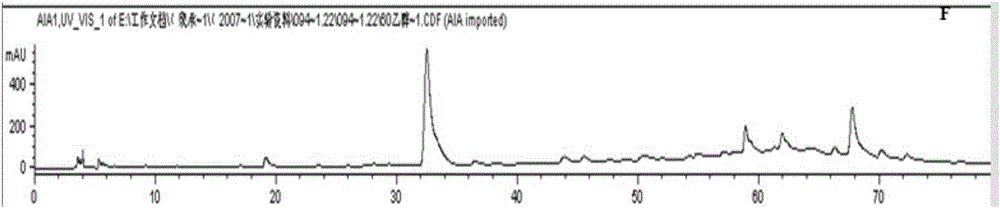
对照品的图谱如图1所示,本发明红毛五加皮提取物的指纹图谱如图2所示。
实施例2本发明红毛五加皮提取物的制备
1、制备方法
称取红毛五加药材4kg,水浸置过夜后,分别加入15倍量水煎煮3次(煎煮时间是30min),合并水煎液,加热挥至小体积(浓缩至5000ml),滤去沉淀,上清液过D101大孔树脂柱(大孔树脂用量4kg,内径15cm,柱长70cm),先用2倍柱体积(BV)蒸馏水洗去杂质,然后3BV 40%乙醇溶液洗脱,收集洗脱部位,回收乙醇,浓缩物经60℃喷雾干燥得黄棕色粉末,即为本发明红毛五加皮提取物。
2、指纹图谱分析
2.1分析方法
同实施例1。
2.2分析结果
对照品的图谱如图1所示,本发明红毛五加皮提取物的指纹图谱如图3所示,可以看出,本发明提取物含有刺五加苷B。
实施例3本发明红毛五加皮提取物的制备
1、制备方法
称取红毛五加药材4kg,水浸置过夜后,分别加入15倍量水煎煮3次(煎煮时间是30min),合并水煎液,加热挥至小体积(浓缩至5000ml),滤去沉淀,上清液过D101大孔树脂柱(大孔树脂用量4kg,内径15cm,柱长70cm),先用2倍柱体积(BV)蒸馏水洗去杂质,然后3BV 20%乙醇溶液洗脱,收集洗脱部位,回收乙醇,浓缩物经60℃喷雾干燥得黄棕色粉末,即为本发明红毛五加皮提取物。
2、指纹图谱分析
2.1分析方法
同实施例1。
2.2分析结果
对照品的图谱如图1所示,本发明红毛五加皮提取物的指纹图谱如图4所示,可以看出,本发明提取物含有刺五加苷B。
实施例4本发明红毛五加皮提取物的制备
1、制备方法
称取红毛五加皮药材4kg,水浸置过夜后,分别加入6倍量水煎煮4次(煎煮时间是30min),合并水煎液,加热挥至小体积(浓缩至5000ml),滤去沉淀,上清液过D101大孔树脂柱(大孔树脂用量4kg,内径15cm,柱长70cm),先用1倍柱体积(BV)蒸馏水洗去杂质,然后4BV 60%乙醇溶液洗脱,收集洗脱部位,回收乙醇,浓缩物经60℃喷雾干燥得黄棕色粉末,即为本发明红毛五加皮提取物。
实施例5本发明红毛五加皮提取物的制备
1、制备方法
称取红毛五加皮药材4kg,水浸置过夜后,分别加入12倍量水煎煮2次(煎煮时间是30min),合并水煎液,加热挥至小体积(浓缩至5000ml),滤去沉淀,上清液过AB-8大孔树脂柱(大孔树脂用量4kg,内径15cm,柱长70cm),先用4倍柱体积(BV)蒸馏水洗去杂质,然后1BV 60%乙醇溶液洗脱,收集洗脱部位,回收乙醇,浓缩物经60℃喷雾干燥得黄棕色粉末,即为本发明红毛五加皮提取物。
实施例6本发明抗炎镇痛药物的制备
红毛五加皮提取物胶囊,取实施例1制备的红毛五加皮提取物,加入可溶性淀粉等口服用药剂辅料改善流动性,填充制成胶囊。
红毛五加皮提取物片剂,取实施例2制备的红毛五加皮提取物,加入可溶性淀粉等口服用药剂辅料改善流动性,压制成片剂。
红毛五加皮提取物软胶囊,取实施例3制备的红毛五加皮提取物,加入聚乙二醇400、助悬剂,混匀,用明胶做囊壳材料,压制成软胶囊。
红毛五加皮提取物注射剂,取实施例1制备的红毛五加皮提取物,溶入注射用水中,采用注射剂制备工艺,制得5mg/ml的注射剂(含输液)。
红毛五加皮提取物粉针剂,取实施例2制备的红毛五加皮提取物,溶入注射用水中,采用现有粉针剂冻干制备工艺,制成粉针剂。
红毛五加皮提取物滴丸剂,取实施例3制备的红毛五加皮提取物,采用滴丸制备工艺,即制得滴丸剂。
红毛五加皮提取物脂肪乳,取实施例1制备的红毛五加皮提取物,加入大豆油、卵磷脂、注射用水等注射用药剂辅料,均质化处理,制成脂肪乳剂。
以下通过实验例的方式来说明本发明的有益效果:
实验例1本发明红毛五加皮提取物的抗炎镇痛功效
(1)受试药物
本发明红毛五加皮提取物水溶液(0.3g生药/ml,提取物按照实施例1的方法制备)及红毛五加皮水提取物(0.3g生药/ml。吲哚美辛肠溶片(山西太原药业有限公司,批号:101001,规格:25mg/片)。
(2)实验动物及实验场地
SPF级KM种小鼠100只,由四川省医学科学院实验动物研究所提供。小鼠购回饲养观察3天,作药前体重记录。全价饲料,自由采食饮水。鼠用全价颗粒料由四川省实验动物专委会养殖场提供,营养成分:符合GB14924.4中的规定。实验场地为成都中医药大学药学院中药药理动物观察室(川实动管015号)。空调保持室温18~24℃,相对湿度60~70%。,光照条件:12h/12h明暗交替,通风情况:全新风。
(3)实验仪器
BP221S型电子天平(SARTORIUS,上海良平仪器仪表有限公司,d=0.1mg);不锈钢电热恒温水箱DHW-600(北京国华医疗器械厂);1ml一次性无菌注射器(江苏康进医疗器材有限公司,批号:20050609D42)。
(4)统计方法
实验数据以均数±标准差表示,组间差异的显著性检验运用spss 18.0软件提供的单因素方差分析方法。
(5)实验方法
给药剂量
本发明红毛五加皮提取物水溶液和红毛五加皮水提取物按红毛五加皮临床剂量分别配制成高剂量:4g/kg、低剂量:1g/kg两个剂量组;吲哚美辛肠溶片按照等效剂量配制:10mg/kg。每天灌胃1次,灌胃溶剂:0.2ml/10g,对照组灌胃等体积溶媒。
镇痛作用研究
KM种小鼠60只,SPF级,雄性,体重20±2g;按体重随机分成10组,分别灌胃蒸馏水,吲哚美辛肠溶片溶液和各组药物。连续灌胃4天,于末次给药前禁食不禁水12h,末次给药后30min,小鼠腹腔注射0.7%醋酸溶液0.2ml/只,分别以小鼠腹部凹陷,双后肢伸展为扭体反应指标,观察小鼠出现扭体反应的潜伏期(min)和15min内扭体反应的次数。
抗炎作用研究
KM种小鼠60只,SPF级,雄性,体重20±2g;按体重随机分成10组,分别灌胃蒸馏水,吲哚美辛肠溶片溶液和各组药物。连续灌胃6天,于末次给药前禁食不禁水12h,末次给药后1h,将20μl二甲苯涂于小鼠右耳廓两面致炎,左耳不涂作为对照,致炎后1h处死小鼠,剪下小鼠双耳廓,用直径5mm的打孔器在两耳对称位置取下左右耳片称重,以左右耳片重量差为耳廓肿胀度表示药物的抗炎效应,同时计算平均抑制率,平均抑制率=(给药组肿胀度-对照组肿胀度)/对照组肿胀度×100%
(6)实验结果
表1红毛五加镇痛及抗炎实验结果
注:*与空白组对照比较,p<0.05。▲本发明提取物组与水提物组比较,p<0.05
实验结果说明,本发明红毛五加皮提取物可以有效镇痛抗炎,并且在相同生药量下,本发明红毛五加皮提取物在低剂量下的抗炎功效显著优于红毛五加皮总的水提取物,镇痛的作用相当。
实验例2本发明红毛五加皮提取物的抗炎镇痛功效
(一)、受试药物
60%乙醇洗脱部位(本发明实施例1的方法制备)、40%乙醇洗脱部位(本发明实施例2的方法制备)、20%乙醇洗脱部位提取物(本发明实施例3的方法制备)、红毛五加水洗液部位(实施例1中直接收集水洗洗脱部位的提取物)、95%乙醇洗脱部位(实施例1中,将60%乙醇溶液替换为95%的乙醇溶液,得到的提取物)。每个提取部位分用5‰CMC溶液作为溶剂配置成800mg/kg、400mg/kg高低两剂量组。蔽光室低温保存。
(二)、实验动物及实验场地
SPF级KM种小鼠130只,由四川省医学科学院实验动物研究所提供。小鼠购回饲养观察3天,作给药前体重记录。全价饲料,自由采食饮水。鼠用全价颗粒料由四川省实验动物专委会养殖场提供,营养成分:符合GB14924.4中的规定。实验场地为成都中医药大学药学院中药药理动物观察室(川实动管015号)。空调保持室温18~24℃,相对湿度60~70%。,光照条件:12h/12h明暗交替,通风情况:全新风。
(三)、实验试剂
地塞米松磷酸钠注射液(天津药业焦作有限公司,批号:08020111,规格1ml:5mg);奇迈特,盐酸曲马多片(石药集团欧意药业有限公司,国药准字:H10960106,批号:040701)。
(四)、实验仪器
BP221S型电子天平(SARTORIUS,上海良平仪器仪表有限公司,d=0.1mg);不锈钢电热恒温水箱DHW-600(北京国华医疗器械厂);1ml一次性无菌注射器(江苏康进医疗器材有限公司,批号:20050609D42)。
(五)、统计方法
实验数据以平均值±标准差表示,组间差异的显著性检验运用spss 15.0for windows软件提供的非参数检验和单因素方差分析方法。
(六)、实验方法
1、给药剂量
五个部位各分高剂量:800mg/kg、低剂量:400mg/kg两个剂量组。按0.2ml/10g于实验之前48h、24h、10min共计灌胃给药3次。
2、红毛五加镇痛作用研究
取SPF级KM种小鼠25±2g者,将小鼠尾末端垂直浸入(50±0.5)℃恒温水浴中,浸入长度为3cm左右,以尾回缩出水面的潜伏期(tail flick latency,TFL)为测痛指标。选择在(50±0.5)℃温水浴中痛阀值为4s左右的小鼠,随机分为12组。10个给药组分别po给予各部位高低剂量药物(给药体积:0.2ml/10g);阳性组po给予5‰CMC盐酸曲马多溶液(给药体积:0.2ml/10g)、空白组po给予等体积5‰CMC溶液。末次给药后10min、30min、1h复测TFL。
3、红毛五加抗炎作用研究
取SPF级KM种小鼠25±2g者80只,随机分为12个组。10个给药组分别po给予各部位高低剂量药物(给药体积:0.2ml/10g);阳性组ip地塞米松(给药体积:0.1ml/10g)、空白组po给予等体积5‰CMC溶液。给药后1h于每鼠右耳壳均匀滴二甲苯0.03ml,左耳壳作对照,2h后剪下耳壳,用直径8mm的打孔器取下耳片称重,左右耳片重量差为肿胀度。
(七)实验结果
1、红毛五加镇痛作用研究结果
各组给药后10min、30min、1h的TFL如表2所示:
表2红毛五加镇痛作用TFL表
注:与空白组对照*p<0.05
结果表明:在给药后10min,除阳性药组外,各剂量组与模型组比较均不能明显延长TFL值(p>0.05)。在给药后30min,水洗液低剂量组、40%乙醇高剂量组、60%乙醇各剂量组、阳性药组均能明显延长TFL值(p<0.05)。在给药后1h,水洗液低剂量组和阳性药组能明显延长TFL值(p<0.05)。
2、红毛五加抗炎作用研究结果
各组耳肿胀度情况如表3所示:
表3红毛五加对抗二甲苯耳肿胀模型研究情况表
注:与模型组对照*p<0.05。
结果表明:20%乙醇高剂量组、60%乙醇各剂量组、阳性药组均能明显抑制二甲苯致小鼠耳肿胀(p<0.05)。
(八)实验结论
红毛五加水洗液部位、95%乙醇洗脱部位、60%乙醇洗脱部位、40%乙醇洗脱部位、20%乙醇洗脱部位提取物分用5‰CMC溶液作为溶剂配置成800mg/kg、400mg/kg高低两剂量组。对各部位高低剂量镇痛作用进行考察发现,在给药后10min时,只有阳性药组的TFL明显延长(p<0.05),说明各受试药物在给药10min时没有产生明显镇痛作用(p>0.05);在给药后30min时,水洗液低剂量组、40%乙醇高剂量组、60%乙醇各剂量组、阳性药组均能明显延长TFL值(p<0.05),说明水洗液低剂量组、40%乙醇高剂量组、60%乙醇各剂量组受试药物在给药30min时产生明显镇痛作用(p<0.05);在给药后1h时,水洗液低剂量组及阳性药组的TFL均明显延长(p<0.05),其余各组的镇痛作用同空白对照组比没有明显差异(p>0.05)。
对红毛五加水洗液部位、95%乙醇洗脱部位、60%乙醇洗脱部位、40%乙醇洗脱部位、20%乙醇洗脱部位提取物高低剂量抗二甲苯致小鼠耳肿胀作用考察发现,20%乙醇高剂量组、60%乙醇各剂量组、阳性药组均能明显抑制二甲苯致小鼠耳肿胀(p<0.05),说明20%乙醇高剂量组、60%乙醇各剂量组均有明显的抗炎作用(p<0.05)。
三、讨论
本发明实施例1制备得到的提取物(60%乙醇洗脱部位)具有明确的抗炎镇痛效果,而实施例2制备得到的提取物(40%乙醇洗脱部位)有明确的镇痛效果,实施例3制备得到的提取物(20%乙醇洗脱部位)有明确的抗炎效果,而乙醇洗脱部位则没有抗炎镇痛的作用。
综上,本发明红毛五加皮提取物(60%乙醇大孔树脂洗脱部位)具有良好的抗炎镇痛功效,且效果优于其他提取部位,其中,尤以实施例1的红毛五加皮提取物的效果最佳,进一步明确了红毛五加皮抗炎镇痛的有效部位,为制剂和药品安全监控提供了保障。
- 还没有人留言评论。精彩留言会获得点赞!