一种流感病毒四价亚单位疫苗及其应用的制作方法
本发明涉及一种流感病毒四价亚单位疫苗及其应用,属于医药技术领域。
背景技术:
流行性感冒病毒(influenzavirus),简称流感病毒,是一种造成人类及动物患流行性感冒的RNA病毒,流感病毒属于正黏液病毒科(Orthomyxoviridae)。流感病毒会造成急性上呼吸道感染,并借由空气迅速的传播,在世界各地常会有周期性的大流行。流行性感冒病毒在免疫力较弱的老人或小孩及一些免疫失调的病人会引起较严重的症状,如肺炎或是心肺衰竭等。
流感病毒主要由囊膜和核衣壳构成,囊膜由纤突、双层类脂膜和基质蛋白(M)构成。纤突分为两类:一类呈棒状,由血凝素(HA)分子的三聚体构成;另一类呈蘑菇状,由神经氨酸酶(NA)分子的四聚体构成。双层类脂膜为病毒粒子出芽时从宿主细胞膜获得的。基质蛋白紧密排列在囊膜内侧,是维持病毒形态的结构蛋白。基质蛋白内部包围着核衣壳,核衣壳由8个呈螺旋形排列的RNA-核蛋白复合物(RNP)构成,每个RNP由一个单股负链RNA外面包被着核蛋白(NP)形成,流感病毒基因组的8个负链RNA就形成了8个RNP。按照核蛋白NP和基质蛋白M抗原性的不同,流感病毒被分为A、B、C三型,也有学者称为甲、乙、丙三型。它们没有共同的抗原,但都能感染人,其中以A型流感病毒的流行规模最大。各型流感病毒又根据其病毒粒子表面的血凝素(HA,简写为H)和神经氨酸酶(NA,简写为N)抗原性的不同而被分为多种亚型,其中A型流感病毒中已经发现的H亚型有18种,N亚型有11种,H和N亚型可以形成不同的组合,如H1N1、H5N1、H3N2、H9N2亚型等。
四次大流感的暴发和每年季节性流感的传播严重威胁着人类健康并造成重大经济损失,不时突现的高致病性禽流感时刻警示人类新一轮大流感暴发的潜在可能。流感病毒的血凝素蛋白(hemagglutinin,HA)是病毒囊膜表面一个主要的抗原蛋白。HA蛋白最基本的功能是识别受体和膜融合,在病毒粒子包装和出芽过程中也起到一定的作用。HA分子与流感病毒的宿主范围、毒力、传播能力,以及人类新流行毒株或大流行毒株的出现有密切的关系,也是药物和疫苗设计主要的靶分子。
流感病毒疫苗接种是当前人类预防流感的首选措施。然而,由于流感病毒血清型众多,一旦流感病毒疫苗株和流行株的抗原性不匹配,就会导致疫苗失效,无法提供相应的保护,无法对所有类型的流感病毒提供交叉保护。目前已经批准上市的疫苗都是病毒裂解疫苗,即灭活疫苗,如GSK公司生产的Quadrivalent和赛诺非巴斯德公司生产的都是多价的流感病毒裂解疫苗。该类疫苗需要先制备流感病毒活病毒,因此生产过程存在安全风险,而且生产成本也大大增加。目前尚无批准上市的流感病毒亚单位疫苗。
技术实现要素:
本发明针对季节性流感病毒H3N2、2009年大流感的H1N1病毒和B型流感病毒B35和B51,我们设计了四价流感病毒亚单位疫苗,分别选取流感病毒株A/California/04/2009(H1N1)、A/HongKong/2014(H3N2)、B/Brisbane/60/2008(B35)和B/Massachusetts/2/2012(B51),分别构建其HA胞外区的杆状病毒表达质粒,通过昆虫细胞表达系统分别获得了可溶性的蛋白H1HA、H3HA、B35HA和B51HA,并利用分子筛和离子柱纯化获得了高纯度的三聚体目的蛋白,通过免疫小鼠实验和细胞中和实验,验证了该四价疫苗的有效性。
本发明的第一个目的是提供一种四价蛋白质疫苗,包括四种蛋白,所述蛋白质分别命名为H1HA、H3HA、B35HA和B51HA,其氨基酸序列份为SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4所示;这四个蛋白分别是在H1N1亚型流感病毒株血凝素、H3N2亚型流感病毒株血凝素、B型流感病毒株B35亚型血凝素、B型流感病毒株B51亚型血凝素的胞外区的前面加上了GP67信号肽序列,后面加上凝血酶酶切位点、fibritin的三聚体标签和6×His标签。
所述蛋白质疫苗还包括佐剂,包括铝佐剂、MF59佐剂。
所述蛋白质疫苗的制备方法,包括以下步骤:
(1)构建重组质粒
扩增编码流感病毒株A/California/04/2009(H1N1)、A/HongKong/2014(H3N2)、B/Brisbane/60/2008(B35)和B/Massachusetts/2/2012(B51)的胞外区的核苷酸序列,加上GP67分泌信号肽,引导目的蛋白有效地分泌到细胞外;并加上一端编码凝血酶(Thrombin)酶切位点、来自于T4噬菌体次要纤维蛋白fibritin的三聚体标签和6×His标签的核苷酸序列,使得目的蛋白的C端带有凝血酶(Thrombin)酶切位点、来自于T4噬菌体次要纤维蛋白fibritin的三聚体标签和6×His标签;将所得片段连入到pFastBacTM1载体上,形成重组质粒(见图1);
(2)转化
将重组质粒转化DH10BACTM E.coli感受态,得到阳性重组菌;
(3)提取Bacmid
从阳性重组菌中提取Bacmid;
(4)转染
将Bacmid转染Sf9或Sf21细胞,获得P1代重组杆状病毒;
(5)扩毒
将P1代重组杆状病毒扩毒得到P3代重组杆状病毒;
(6)蛋白表达纯化
P3代重组杆状病毒感染Sf9或Sf21细胞,从细胞中分离纯化得到目的蛋白;
(7)将4种目的蛋白按照特定比例,与佐剂混合,四价亚单位疫苗。
本发明的第二个目的是提供所述四价疫苗在预防流感病毒方面的应用。
本发明的第三个目的是提供编码所述四种蛋白的基因序列。
本发明的第四个目的是提供表达四种蛋白的质粒和细胞系统。
本发明的有益效果:
本发明获得了一种流感病毒四价亚单位疫苗,该疫苗对小鼠有良好的保护作用,有预防流感病毒的应用价值。本发明采用杆状病毒表达系统来快速制备获得高纯度的三聚体蛋白质疫苗,所得疫苗免疫原性强,生产周期短,并且不存在任何的安全隐患,可以预防多种亚型的流感病毒。
附图说明
图1、表达质粒的构建示意图。
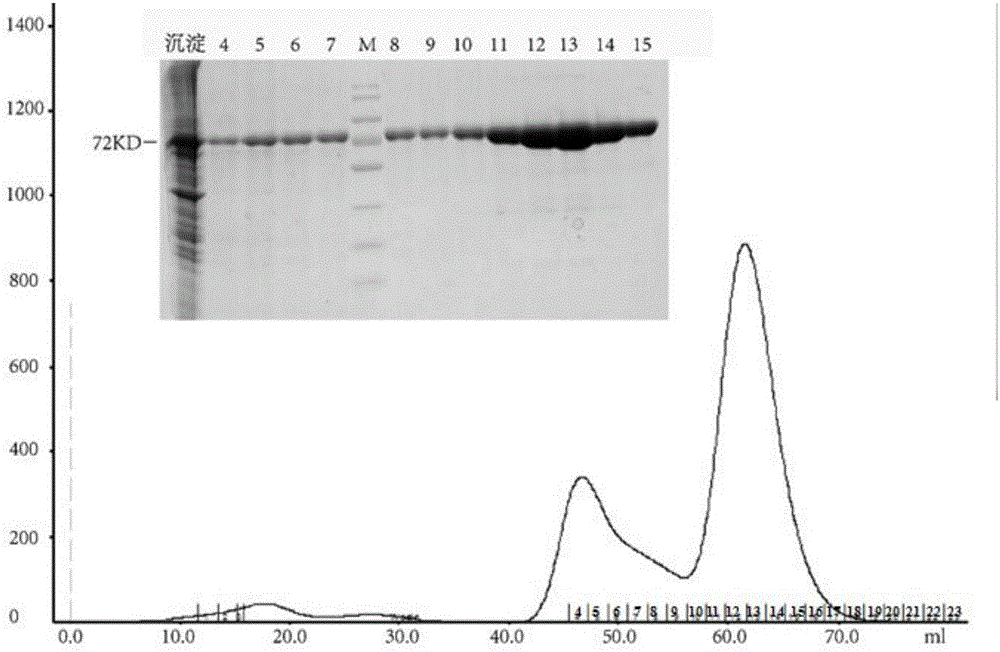
图2、流感病毒H1HA蛋白的分子筛纯化结果;峰图上蛋白编号为从4到23。
图3、流感病毒H3HA蛋白的分子筛纯化结果;图中横坐标上40ml之后,次要刻度线标记的蛋白的编号从左向右是1至20。
图4、流感病毒B35HA蛋白的分子筛纯化结果;图中横坐标上40ml之后,次要刻度线标记的蛋白的编号从左向右是1至40。
图5、流感病毒B51HA蛋白的分子筛纯化结果;图中横坐标上40~70ml之间,次要刻度线标记的蛋白的编号从左向右是1至19。
图2~5中,沉淀表示收集蛋白时离心获得的细胞沉淀;M代表蛋白质分子量标记;数字分别代表峰图上相应位置的蛋白组分。
图6、小鼠免疫血清对H1N1病毒的中和效果;
图7、小鼠免疫血清对H3N2病毒的中和效果;
图8、小鼠免疫血清对B35病毒的中和效果;
图9、小鼠免疫血清对B51病毒的中和效果;
图6~9中,横坐标是不同组别免疫小鼠的血清,Al-5-3表示四种HA胞外区蛋白各5μg与铝佐剂混匀后在第0、14和28天共三次免疫小鼠后分离的血清,Al-PBS-3表示PBS与铝佐剂混匀后在第0、14和28天共三次接种小鼠后分离的血清,MF-10-3表示四种HA胞外区蛋白各10μg与MF59佐剂混匀后在第0、14和28天共三次免疫小鼠后分离的血清,MF-PBS-3表示PBS与MF59佐剂混匀后在第0、14和28天共三次接种小鼠后分离的血清,NC表示阴性对照,是从未经任何免疫处理的小鼠中分离的血清,PC-3表示使用赛诺菲巴斯德公司的流感病毒裂解疫苗三次免疫小鼠后分离的血清。
具体实施方式
实施例1:流感病毒HA蛋白的表达和纯化
1、表达质粒的构建
分别选取流感病毒株A/California/04/2009(H1N1)、A/HongKong/2014(H3N2)、B/Brisbane/60/2008(B35)和B/Massachusetts/2/2012(B51),由公司合成基因序列,构建其HA胞外区的杆状病毒表达质粒。
具体地,A/California/04/2009(H1N1)的HA全长序列由大连宝生物生物工程有限公司合成。在此基础上,扩增出编码H1N1蛋白的胞外区11-505位(按H3排序)氨基酸的核苷酸序列,在其前面加上GP67分泌信号肽,可将目的蛋白有效地分泌到细胞外。为促进HA蛋白的三聚化,提高蛋白的免疫原性,并方便后续的纯化,我们在HA胞外区的C端加上一段修饰序列:这一序列包括凝血酶(Thrombin)酶切位点、来自于T4噬菌体次要纤维蛋白fibritin的三聚体标签和末端的6×His标签,得到序列如SEQ ID NO.1所示的片段,将该片段连入到pFastBacTM1载体上,形成pFastBacTM1-H1HA重组质粒。GP67信号肽的序列如SEQ ID NO.5所示,Thrombin酶切位点的序列如SEQ ID NO.6所示,三聚体标签的序列如SEQ ID NO.7所示,His标签为6个组氨酸。
H3N2的HA胞外区以及前面的GP67信号肽、后面的Thrombin酶切位点、三聚体标签和His标签由上海捷瑞生物工程有限公司直接合成,克隆构建与H1N1的胞外区一致,命名为pFastBacTM1-H3HA。
B35和B51的HA胞外区由苏州金唯智生物科技有限公司合成,克隆构建与H1N1和H3N2的胞外区一致,也连入pFastBacTM1载体上。分别形成pFastBacTM1-B35HA重组质粒和pFastBacTM1-B51HA重组质粒。
2、转化
取100μl的DH10BACTM E.coli感受态细胞置于冰上,加至少1ng pFastBacTM1-H1HA重组质粒至100μl DH10BacTM E.coli感受态细胞中,轻轻混匀,冰上放置30min。42℃热激45s,立即插回冰上,静置2min。在超净台中,每管加入800μl无抗LB培养基,37℃培养4h。4小时培养后,取100μl菌液涂三抗平板(LB平板,含:50μg/ml卡那霉素(kanamycin)、7μg/ml庆大霉素(gentamicin)、10μg/ml四环霉素(tetracycline)、300μg/ml Bluo-gal,40μg/ml IPTG),余下的菌液4℃暂存,平板倒置于37℃烘箱中培养24h。pFastBacTM1-H3HA、pFastBacTM1-B35HA和pFastBacTM1-B51HA重组质粒的转化方法与pFastBacTM1-H1HA完全一致。
3、提取Bacmid
经过PCR菌液鉴定为阳性的白斑菌液转接至4ml含KGT三种抗生素的LB培养基中继续37℃培养16-24h,提取Bacmid(S.N.A.P.TM MidiPrep Kit,Catalog no.K1910-01或者异丙醇沉淀法提取)。测质粒浓度,挑选OD260/OD280在1.8-2.0之间,浓度较高(500ng/μl或以上)的Bacmid做转染比较好。并再次进行PCR鉴定。
4、转染
预先准备好悬浮培养的Sf9或Sf21细胞,细胞处于对数生长期,密度约1.5-2.5×106个细胞/ml。细胞计数板数细胞,确定细胞密度。铺六孔板(孔直径35mm),每孔8×105个细胞,将细胞摇匀。待板底细胞达到合适密度,吸取培养液,每孔加入1ml Grace’s Medium。Cellfectin II 6-8μl(4℃保存,加前混匀)加上Grace’s Medium 100μl,轻轻混匀,标记为管1,静置5min。将PCR鉴定结果为阳性的重组Bacmid 2μg加上Grace’s Medium 100μl,轻轻混匀,标记为管2。管1的溶液转移到管2中(总体积约210μl),轻轻混匀,静置20min。将六孔板中的培养基用移液器吸出,每孔加2ml Grace’s Medium洗涤2次,洗完弃去培养基。加0.8ml Grace’s Medium至步骤4的管1和管2混合液中,总共1ml,轻混后沿六孔板壁缓缓加入。将六孔板放入27℃培养箱中5h。换液:弃去六孔板中的混合液,每孔加2ml Sf-900TM III SFM培养基(含三种抗生素:100单位/ml penicillin,100单位/ml streptomycin和0.25μg/mlAntimycotic,发挥抗细菌和抗真菌作用)。27℃培养箱中孵育。约72h以后,细胞裂解,单层细胞漂浮。收取2ml上清,500g,5min离心后转移至干净的离心管,锡箔纸包裹4℃避光保存,获得P1代重组杆状病毒(加胎牛血清至终浓度2%可防止蛋白酶对病毒的破坏)。若需长期保存,将P1病毒在液氮中冻后保存于-80℃。
5、扩毒
重组杆状病毒扩增P1代病毒的滴度一般约1×106-1×107pfu/ml。pfu:plaque forming units(空斑形成单位)。扩毒的MOI应控制在0.05-0.1。MOI:multiplicity ofinfection(感染复数),接种体积(ml)=MOI(pfu/cell)×细胞个数/病毒滴度(pfu/ml)。P1扩P2实验步骤如下:每个10cm盘铺1×107个Sf9或Sf21细胞。算出所需P1体积,把病毒加入盘中,27℃培养箱孵育。48-72h收毒。一般P2病毒的滴度在107-108pfu/ml。P2病毒可以直接表达蛋白,或者继续扩增P3病毒,用P3代病毒表达蛋白。一般200μl的P2病毒可感染100ml悬浮培养的Sf9(1.5-2.0×106)或Sf21(1.0-1.5×106)细胞,48-72h收P3病毒。一般P3病毒的滴度达到108pfu/ml。
6、蛋白表达纯化
通过Western blot检测目的蛋白的表达,然后P3病毒感染High FiveTM细胞密度约1.5-2.0×106(Sf9密度2.0-3.0×106;Sf21密度1.0-2.0×106),27℃摇床培养48h,镜检细胞约50%死亡率收细胞,将细胞倒入离心桶,7,000g离心45min,收集上清,0.22μm滤膜抽滤。使用HisTrapTMHP 5ml预装柱(GE Healthcare),在buffer3(20mM Tris,150mM NaCl,300mM咪唑,pH 8.0)洗脱目的HA蛋白,经过透析浓缩至约10ml。浓缩后的HA蛋白用SuperdexTM200 10/300 GL column进行分子筛纯化(20mM Tris-HCl,50mM NaCl,pH 8.0的缓冲液),最终获得目的的HA蛋白。并通过SDS-PAGE鉴定蛋白纯度,蛋白纯度达到95%以上。
四种蛋白H1HA、H3HA、B35HA和B51HA均使用同样的方法制备。H1HA、H3HA、B35HA和B51HA的胞外区序列与GP67信号肽、凝血酶(Thrombin)酶切位点、T4噬菌体次要纤维蛋白fibritin的三聚体标签和末端的6×His标签的融合片段分别如SEQ ID NO.2、SEQ ID NO.3、SEQ ID NO.4所示。
实施例2:四价亚单位疫苗的性能检测
将四价亚单位疫苗对小鼠进行了免疫,小鼠接种方案请见表1。分别在第0天、14天和28天进行三次对小鼠腿部进行接种,每组小鼠每次接种的蛋白及佐剂的种类和数量一致。分别在二免和三免后的12天采集小鼠的尾血,分离血清。在第0天采用眼球取血的方法采集分离6只小鼠的样本做阴性对照。
免疫小鼠时采用不同的蛋白剂量、不同的佐剂进行免疫。蛋白剂量分为30μg,10μg,5μg和2.5μg四个梯度,佐剂分为铝和MF59两种。例如免疫方案中第一组是将四种蛋白H1HA、H3HA、B35HA和B51HA各10μg混匀,使得总体积为600μl。然后加入600μl的MF59佐剂,使用1ml注射器反复吹打,充分混匀蛋白和佐剂,然后取150μl该混合液接种小鼠大腿部,共接种6只小鼠。
表1、小鼠免疫方案
随后,我们通过流感病毒中和实验检测小鼠血清对流感病毒的中和效果。分别采用的流感病毒株为:A/California/04/2009(H1N1),A/Texas/50/2012(H3N2),B/Brisbane/60/2008和B/Massachusetts/2/2012。将血清用RDE处理后,进行2倍倍比稀释,与等体积的病毒(200TCID50/100ul)孵育1.5小时。取100μl加在长满MDCK细胞的96孔板中,37℃培养72小时,期间定期观察细胞病变情况。经过血凝法检测中和实验结果。
结果发现,小鼠经过三次铝佐剂免疫后的血清可以显著中和A/California/04/2009(H1N1)病毒(5μg HA蛋白/铝佐剂组,TICD50=10E-1.6)和B/Massachusetts/2/2012(B51)病毒(5μg HA蛋白/铝佐剂组,TICD50=10E-2.58)。小鼠经过三次铝佐剂免疫后的血清对B/Brisbane/60/2008(B35)病毒和A/Beijing Huairou/1178/2014(H3N2)病毒的中和效价较低,但是加上MF59佐剂免疫后的血清可以显著中和B/Brisbane/60/2008(B35)病毒(10μg HA蛋白/MF59佐剂组,TCID50=10E-2.36),并且可以在一定程度上中和H3N2病毒(A/Beijing Huairou/1178/2014)(2.5μg HA蛋白/MF59佐剂组TCID50=10E-1.76)。
我们通过小鼠免疫方案和病毒中和实验,可以初步证明添加佐剂后的四价疫苗可以有效提高动物对甲型H1N1和H3N2病毒和B型流感病毒(B35、B51)免疫能力。
综上,我们发明了一种流感病毒四价亚单位疫苗,该疫苗包括四种HA蛋白,H1HA、H3HA、B35HA和B51HA,加入铝或MF59佐剂后,该四价疫苗可以有效提高小鼠对甲型H1N1病毒和B型流感病毒(B35、B51)免疫能力,对H3N2病毒也有一定的免疫效果。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!