RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷递药系统的制备方法与流程
本发明涉及于生物医药技术领域,具体涉及一种RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷递药系统的制备方法。
背景技术:
三氧化二砷(arsenic trioxide,ATO)是中药砒霜的有效活性成分,临床上主要用于急性早幼粒细胞白血病的治疗。有学者发现,ATO对多种实体瘤细胞也具有抑制生长和诱导凋亡作用,具有广谱抗癌性。但由于ATO在体内分布缺乏特异性,达到有效浓度时对其他正常组织往往会产生严重的不良反应;此外,ATO半衰期短,给药后消除迅速,因此限制了其在实体瘤中的应用。
聚酰胺-胺树枝状大分子(PAMAM)是一类目前得到广泛应用的树枝状聚合物材料,在其作为靶向递药系统载体时体现出独特的优越性。首先,其结构内部的疏水空腔,可以物理包埋疏水性药物;其次,PAMAM表面有许多活性较强的氨基,一方面可以连接抗肿瘤药物,另一方面还可以连接能与机体中某些器官、组织发生特异性识别的靶向配基等。研究表明,低代数的PAMAM往往呈现相对开放的结构,内腔较小,表面官能团有限,不利于载药和修饰;高代数的PAMAM开始呈现三维的球形结构,并且具有足够的官能团而被更多应用。但由于高代数PAMAM会引起一定的细胞毒性和溶血毒性,所以通常在PAMAM表面对其进行PEG化的修饰,一方面可以减少其毒副作用,另一方面可进一步提高该载药系统的亲水性,延长药物在血液中的循环时间,更有助于药物被动靶向于肿瘤组织,从而提高药物治疗效。
为进一步提高抗肿瘤药物的疗效,近年来将配体连接到载药微粒表面,通过配体-受体介导的主动靶向药物传递系统已经成为癌症治疗研究的热点。整合素是一种由α和β两个亚基以非共价键形式结合,能介导细胞内外双向信息传递的异二聚体跨膜糖蛋白。其中整合素v3在多种恶性肿瘤细胞(骨肉瘤、成神经细胞瘤、肺癌、乳腺癌、前列腺癌、膀胱癌、胶质母细胞瘤及浸润性黑色素瘤)表面有高水平的表达,而且在恶性肿瘤组织的新生血管内皮细胞膜高表达,而在成熟血管内皮细胞和绝大多数的正常器官系统则无表达或几乎不能被探及。整合素v3的天然配体包括纤维连接蛋白,玻璃连接蛋白,层粘蛋白等,这些配体的共同特征是在其结构中含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列,而且通过RGD序列与整合素v3结合。研究表明,外源性RGD多肽竞争性与肿瘤细胞表面整和素特异性结合后,不仅表现出抑制肿瘤的作用,且具有靶向性标记肿瘤和输送抗肿瘤药物的潜在价值。线性的RGD多肽体内易被酶解,半衰期短,从而限制了其应用,而环肽具有更强的结构稳定性和受体亲和力,从而表现出更高的临床应用潜力。
技术实现要素:
为了解决ATO脂溶性差,透血脑屏障难,体内分布缺乏特异性,达到有效浓度时对其他正常组织毒性大,治疗窗窄,脑内血药浓度“峰谷”波动亦会引起颅内中枢组织的严重不良反应等问题,本发明提供一种RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷递药系统的制备方法,通过RGD结合PEG共同修饰PAMAM,用来负载ATO,在进一步减少PAMAM本身毒性的同时,赋予其脑胶质瘤靶向的能力,并且具有一定缓释作用,改善ATO药动学特征,增加生物利用度,提高用药安全性。
本发明采用的技术方案是:
一种RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷递药系统的制备方法,所述方法包括以下步骤:
(1)制作RGD-PEG-PAMAM:
以RGD环肽的巯基与双功能聚乙二醇MAL-PEG-NHS的马来酰亚胺基反应,生成RGD多肽修饰的聚乙二醇羟基琥珀酰亚胺活化酯RGD-PEG-NHS,然后与PAMAM的表面氨基反应,生成RGD-PEG修饰的PAMAM,记为RGD-PEG-PAMAM;
(2)制作RGD-PEG-PAMAM-mPEG:
将RGD-PEG-PAMAM与mPEG-NHS反应,使RGD-PEG-PAMAM在步骤(1)未反应完的多余氨基进一步被PEG修饰,制得RGD-PEG-PAMAM-mPEG;
(3)三氧化二砷溶液与RGD-PEG-PAMAM-mPEG反应,制得负载有三氧化二砷的RGD-PEG-PAMAM-mPEG,即RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷递药系统。
所述RGD为RGDyC,RGDyK,RGDfC,RGDfK等含有RGD序列的环状多肽,其结构中含有游离巯基;优选RGDyC。
所述双功能聚乙二醇MAL-PEG-NHS为分子量为1000-10000Da的双功能聚乙二醇,其一端含有马来酰亚胺基,另一端含有羟基琥珀酰亚胺活化酯;优选使用MAL-PEG3500-NHS。
所述PAMAM为整数代的聚酰胺-胺树枝状聚合物。优选PAMAM G5。
所述mPEG-NHS为分子量为1000-10000Da单官能团的甲氧基聚乙二醇,一端为羟基琥珀酰亚胺活化酯。优选mPEG3000-NHS
进一步,所述步骤(1)优选按以下步骤进行:
将RGD溶于pH6.0的醋酸-醋酸钠缓冲液中,作为溶液A,将PAMAM溶于pH9.2的硼砂-氢氧化钠缓冲液中,作为溶液B,向溶液A中加入MAL-PEG-NHS,涡旋30s后,全部反应液加入溶液B中,室温下反应8~20小时;调节反应液pH值为7.0,加入β-巯基乙醇终止未反应完全的马来酰亚胺基团,超滤、离心、冷冻干燥,制得RGD-PEG-PAMAM。
所述PAMAM、RGD、MAL-PEG-NHS的物质的量之比为1:20~50:20~50,优选1:45:45
所述溶液A的质量浓度优选2~5mg/mL;
所述溶液B的浓度优选2~5mg/mL
所述步骤(2)优选按以下步骤进行:
将RGD-PEG-PAMAM复溶于pH值8.0的磷酸盐缓冲液中,得到溶液C,向溶液C加入mPEG-NHS,使PAMAM与mPEG-NHS的物质的量之比为1:60~70,优选1:64,室温反应40~60h(优选48h),超滤、离心,除去未反应的PEG,冷冻干燥,制得RGDyC-PEG-PAMAM-mPEG。
所述步骤(2)在超滤、离心时,需要多次操作直到到离心后上层液中检测无PEG为止,一般可采用薄层色谱法监测至上层液中无PEG。
所述溶液C的浓度优选为1~10mg/mL。
所述步骤(2)中,RGD-PEG-PAMAM的用量是指其中含有的PAMAM与mPEG-NHS的物质的量之比为1:60~70,可按照步骤(1)中制备RGD-PEG-PAMAM时所投料的PAMAM的物质的量来计量。
所述步骤(3)优选按以下步骤进行:
称取RGD-PEG-PAMAM-mPEG溶于超纯水中,得到溶液D,向溶液D中加入三氧化二砷溶液,室温搅拌12~30小时,所得反应液超滤除去未负载的游离的三氧化二砷,冷冻干燥,制得RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷。所得制剂一般在-80℃保存
所述RGD-PEG-PAMAM-mPEG、三氧化二砷的质量用量比10:1~3,优选10:2。
所述溶液D的浓度优选为5~15mg/mL
所述三氧化二砷溶液的浓度优选为0.5~2mg/mL。
所述三氧化二砷溶液优选如下制得:向三氧化二砷逐滴加入浓盐酸,至完全溶解,再加入氢氧化钠浓溶液调节pH中性,制得三氧化二砷溶液。
本发明还提供所述的方法制得的RGD及PEG共修饰的PAMAM树状大分子载三氧化二砷递药系统,载药量可达1.5~3.0%,可以呈现一定缓释作用和肿瘤靶向作用。
本发明的有益效果在于:通过双官能团的PEG(MAL-PEG-NHS)作为偶联臂,将RGD与PAMAM键合。并且在此基础上,用单官能团的mPEG-NHS进一步与PAMAM上多余的氨基反应,继续屏蔽部分氨基以增加PAMAM的体外安全性。
本发明将ATO结合PAMAM本身的优势,如水溶性好,无免疫原性,缓释,具有一定酸敏特性。通过RGD结合PEG共同修饰PAMAM,可以在降低高代数PAMAM毒性的同时,达到肿瘤靶向的作用,并首次将剧毒中药三氧化二砷负载于PAMAM中,载药量可达1.5~3.0%,可以呈现一定缓释作用,即可以一定程度避免其在到达病灶部位之前而被降解或产生毒副作用的风险。且PAMAM作为载体材料本身具有一定酸敏特性,其在酸性环境下表面氨基质子化相互排斥而有利于释药。因此构建RGD-PEG-PAMAM@ATO脑胶质瘤靶向递药系统,以解决ATO脂溶性差,透血脑屏障难,体内分布缺乏特异性等问题,并改善其药动学特征,增加生物利用度,为脑胶质瘤治疗的基础研究提供一种新的思路。
附图说明
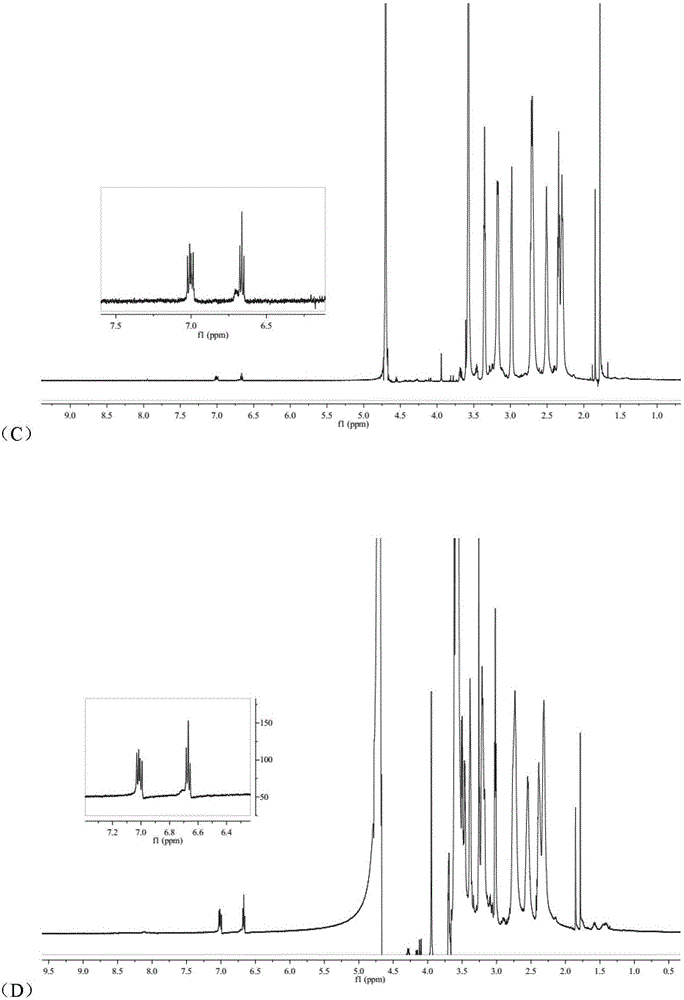
图1 RGDyC,PAMAM,RGDyC-PEG-PAMAM和RGDyC-PEG-PAMAM-mPEG的1H-NMR图谱,其中(A)图为RGDyC,(B)图为PAMAM,(C)图为RGDyC-PEG-PAMAM,(D)图为RGDyC-PEG-PAMAM-mPEG。
图2 RGDyC-PEG-PAMAM-mPEG的粒径分布图和Zeta电位图,其中(A)图为粒径分布图,(B)图为Zeta电位图。
图3不同载体材料的溶血毒性对比图,n=3。
图4不同载体材料对HBMEC细胞的毒性柱状对比图,n=6。
图5 RGDyC-PEG-PAMAM-mPEG负载ATO制剂和原药ATO的体外释药曲线图,n=3。
具体实施方式
下面以具体实施例来对本发明的技术方案做进一步说明,但本发明的保护范围不限于此。
实施例1
(1)砷溶液的制备:
称取一定量的三氧化二砷,向其中逐滴加入浓盐酸,至完全溶解,再通过氢氧化钠浓溶液调节pH至7.4,使成为浓度约为1mg/mL的砷盐母液。
(2)RGDyC-PEG-PAMAM的制备:
称取4.68mg RGDyC,溶于2mL醋酸-醋酸钠缓冲液中(pH 6.0),向其中加入27.32mg MAL-PEG3500-NHS,涡旋30s,迅速加入至2mL含有5.0mg PAMAM G5的硼砂-氢氧化钠缓冲液中(pH 9.2),室温反应过夜。通过缓冲液调节体系pH至7.0,加入5μLβ-巯基乙醇反应1h以终止未反应完全的马来酰亚胺基团。用截流分子量为10000的密理博超滤离心管进行超纯水超滤离心,冷冻干燥,得RGDyC-PEG-PAMAM15.53mg。
(3)RGDyC-PEG-PAMAM-mPEG的合成方法为:在上述基础上,将上述离心浓缩后的产物15.53mg复溶于2mL磷酸盐缓冲液(pH 8.0),向其加入33.30mgmPEG3000-NHS,使PAMAM G5与mPEG3000-NHS最终的反应摩尔比为1:64。室温反应48h,用截流分子量为30000的密理博超滤离心管进行超滤离心,除去未反应的PEG。超滤8-9次,采用薄层色谱法监测至离心后的上层液中无PEG,冷冻干燥。通过核磁图谱确定RGD和PEG的接枝率。核磁结果表明平均每个PAMAM树状大分子上,共键合上约30个PEG,并且成功键合上RGDyC。RGDyC-PEG-PAMAM-mPEG的粒径大部分集中在20多纳米左右。所得制剂粒径相对较小。Zeta电位为5.36±0.22mV。
(4)RGDyC-PEG-PAMAM-mPEG的体外毒性评价:
4.1溶血毒性实验
取新鲜抗凝家兔全血5mL,轻微搅拌去除纤维蛋白凝块。加生理盐水充分混匀后,1500rpm·min-1,离心5min,弃上清。重复洗涤5~6次,至上清液基本无色。沉淀的红细胞用生理盐水配成2%(v/v)的红细胞悬液,现配现用。取未经修饰的PAMAM,PEG-PAMAM,RGDyC-PEG-PAMAM和RGDyC-PEG-PAMAM-mPEG,用1mL生理盐水配置成一系列不同质量浓度的溶液(以PAMAM浓度计,0.001mg·mL-1~2mg·mL-1)置于离心管中,加入等体积的2%(v/v)的红细胞悬液。另取1mL 2%(v/v)的红细胞悬液,分别加入等体积的蒸馏水和生理盐水,作为阳性对照和阴性对照。各管充分混匀,置于37℃恒温水浴中孵育1h,1500rpm·min-1,离心10min,取上清液,酶标仪于414nm下测吸光度值(Abs)。按下式计算溶血率:
其中Abs、Abs0和Abs100分别表示样品、阴性对照和阳性对照的吸光度值。
载体的溶血毒性结果如图3所示。结果表明,PEG的修饰可以显著降低PAMAM的溶血毒性,且在高浓度时减毒作用尤为显著,而RGD的进一步修饰对毒性没有显著性影响。未经修饰的PAMAM,在浓度为2mg·mL-1时,孵育1h后,溶血率达到了99.0%,而经过PEG的修饰,PAMAM的溶血毒性明显降低,当PEG的修饰率为24.2%时,在浓度为2mg·mL-1时,溶血率仅为3.5%,比未经修饰的PAMAM毒性降低了95.5%。在此浓度下,RGDyC-PEG-PAMAM和RGDyC-PEG-PAMAM-mPEG的溶血率分别为:10.6%和2.8%,且PAMAM,RGDyC-PEG-PAMAM和RGDyC-PEG-PAMAM-mPEG三者之间的溶血毒性存在显著性差异。
4.2细胞毒性实验
采用MTT法考察所得载体材料对HBMEC细胞的细胞毒性。HBMEC细胞以5×103个/孔接种于96孔板,37℃培养24h。弃去培养液,分别加入不同浓度的载体材料(0.001μmol·L-1~100μmol·L-1),每组6个复孔,培养48h,弃去培养液,每孔加入100μL MTT无血清培养液(0.5mg·mL-1),继续培养4h。弃去上清液,每孔加入150μL DMSO,微量振荡器上振荡10min,用酶标仪测定其570nm处的吸光度值。计算细胞存活率(Cell Viability):
其中A样品为不同浓度样品组的吸光度,A对照为空白细胞组的吸光度。
结果由图4所示,所有组别在低浓度时(<0.1μmol·L-1),均未表现出明显的细胞毒性,而当浓度高于1μmol·L-1时,PEG-PAMAM和RGDyC-PEG-PAMAM-mPEG的细胞存活率明显高于PAMAM和RGDyC-PEG-PAMAM组,表明PEG的进一步修饰确实可以降低PAMAM的毒性。当浓度为100μmol·L-1时,PAMAM组对应的HBMEC细胞的细胞存活率为45.6%,RGDyC-PEG-PAMAM-mPEG对应HBMEC细胞的细胞存活率分别为87.7%,表现出较好的体外安全性。
(5)RGDyC-PEG-PAMAM-mPEG载三氧化二砷的制备:
称取RGDyC-PEG-PAMAM-mPEG 10mg溶于1mL超纯水于西林瓶中,加入搅拌子,再加入2mL砷盐母液,室温搅拌24小时。置于截流分子量为3000的密理博超滤离心管中,超滤除去游离砷盐,并且每次超滤完后收集下滤液,并补充超纯水至刻度。建立砷标曲,通过等离子体发射光谱仪测下滤液中砷盐浓度,计算载药量。冷冻干燥,-80摄氏度保存制剂。
通过等离子体发射光谱仪测得,超滤离心三次后,几乎所有未被包载的游离砷盐已被除干净。载药量约在1.5~3.0%之间。
(6)体外释放实验:
采用透析法考察ATO和RGDyC-PEG-PAMAM-mPEG/ATO纳米复合物的体外释药特性。原药ATO和ATO纳米复合物(以0.5mg ATO计)分别溶于1mL pH7.4和pH5.5的PBS释放介质中,放入经预处理的透析袋中,扎紧袋口,置于100mL PBS释放介质,37℃恒温水浴振荡(75rpm)。定时从释放介质中准确取样1mL,同时补加等量37℃空白释放介质。建立砷标曲,样品ATO通过等离子体发射光谱仪测定,代入标准曲线方程计算浓度,计算累计释放百分率(%)。所有试验重复三次。
所得RGDyC-PEG-PAMAM-mPEG载三氧化二砷制剂的体外释放实验结果如图5所示:原药ATO释放迅速,在pH 5.5及pH 7.4的环境下,2h的累积释放率已达95%以上,而经过RGDyC-PEG-PAMAM-mPEG的包载后,其释放呈现出明显的缓释特性和一定的酸敏性。此特性对于后续的肿瘤的治疗具有一定的优势。
- 还没有人留言评论。精彩留言会获得点赞!