一种多肽缓释微球制剂及其制备方法与流程
本发明涉及一种多肽缓释微球制剂及其制备方法,属于医药领域。
背景技术:
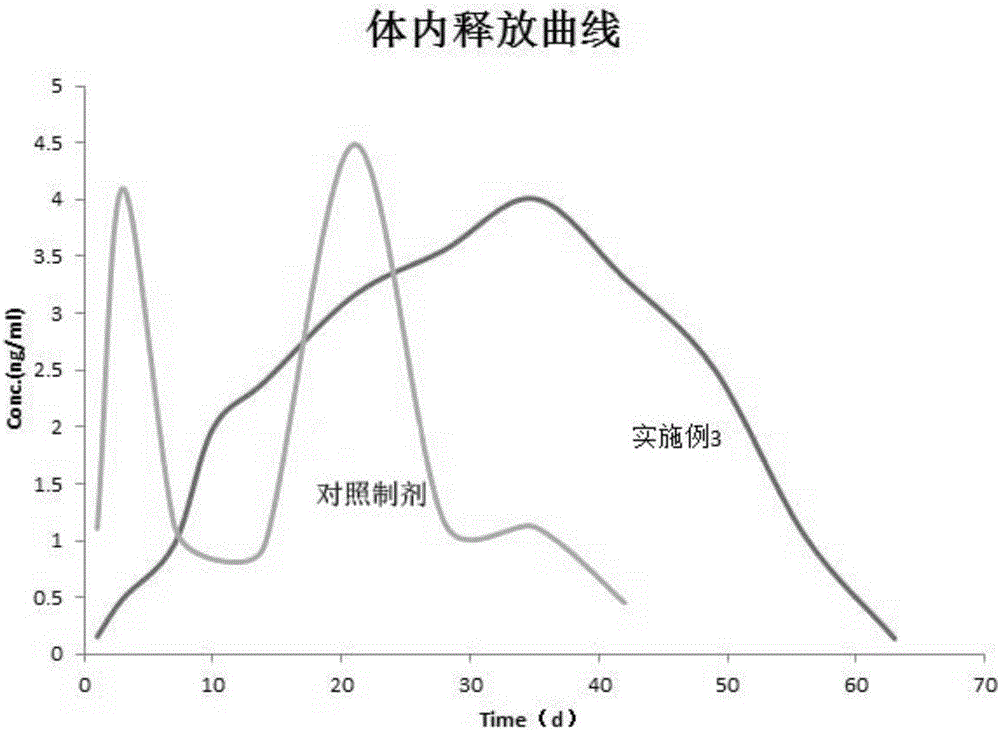
:大多数具有生物活性的蛋白质、多肽类药物由于口服生物利用度低,往往不能通过口服途径给药。通过注射给药时,体内蛋白酶的存在使得药物在体内的半衰期很短,需要频繁注射,增加了患者的痛苦。为减少给药频率、提高患者顺应性,此类药物通常需要被开发成长效缓释制剂。艾塞那肽是人工合成的北美毒晰外泌肽,由39个氨基酸残基组成,相对分子量为4186.57,为胰高血糖素-1(GLP-1)受体激动剂。艾塞那肽已知的药理作用包括:(1)增加葡萄糖依赖性促胰岛素分泌;(2)抑制II型糖尿病患者胰高血糖素的分泌;(3)抑制餐后胃肠动力及分泌功能,延迟胃排空,从而有利于餐后血糖的控制;(4)降低食欲,减少食物的摄入;(5)刺激β细胞凋亡,从而增加β细胞的数量;(6)改善II型糖尿病患者的空腹及餐后血糖水平。与传统的治疗糖尿病药物相比,艾塞那肽具有不可比拟的优点。美国食品药品监督管理局(FDA)于2005年4月批准了艾塞那肽在美国上市。然而由于半衰期短,该产品为每日2次注射剂,频繁的注射使患者顺应性较差。目前,已有文献报道利用生物相容性可降解材料(例如高分子材料)包裹药物活性成分,制成艾塞那肽微球制剂;通过可降解的生物高分子材料在体内逐步降解来控制艾塞那肽的释放,从而维持有效的血药浓度,达到长效缓释的目的。CN102198103A公开了一种能有效延长艾塞那肽在体内作用时间的艾塞那肽缓释微球制剂,该制剂包含艾塞那肽0.1%-12.5%,乙交酯丙交酯共聚物77.5%-99%,0.1%-10%的保护剂,1.01%-10%的助悬剂,保护剂用于稳定和缓释,在体外的缓释周期可达到7-35天。CN102688198A提供了另一种艾塞那肽缓释微球制剂,该制剂采用稳定剂及O/O型乳化-溶剂挥发法制备而成,药物释放时间从一周至一月。然而,为了进一步降低给药频率,亟需开发一种新的制剂和制备工艺,以期得到缓释周期长达数月的多肽缓释制剂。技术实现要素:本发明的目的在于提供一种多肽缓释微球制剂及其制备方法。进一步的,本发明的目的在于提供一种艾塞那肽及其衍生物的缓释微球制剂及其制备方法。本发明的多肽缓释微球制剂不需要使用稳定剂或保护剂,采用O/O相凝聚方法,特别是通过对溶剂-凝聚剂-淬灭溶剂体系的研究,采用简化有效的方法和处方,就可以得到粒径小、释药时间长、有效避免体外突释、体外初始释放率低、能克服平台期的艾塞那肽缓释微球制剂。本发明提供了一种多肽(例如艾塞那肽及其衍生物)的缓释微球制剂,它是由下述重量百分比的原料和辅料组成:多肽3%~10%,高分子聚合物90%~97%,所述的高分子聚合物为聚乳酸羟基乙酸共聚物(PLGA)、聚乳酸(PLA)或聚羟基乙酸(PGA)中的一种或几种,所述缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。优选的,所述多肽缓释微球制剂的体外释放曲线为接近零级的释放曲线。本发明的多肽缓释微球制剂克服了释放平台期,实现接近恒速释放。本发明的缓释微球制剂以艾塞那肽为例说明,也可以是其它的生物活性多肽药物,如GLP-1、LHRH、利拉鲁肽、降钙素、细胞因子、肿瘤坏死因子、生长激素、EGF、NGF、干扰素、生长激素、酶、白细胞介素、促红细胞生长素、免疫球蛋白、抗体、集落刺激因子、胰岛素以及上述蛋白、多肽的类似物、衍生物、修饰物及盐,上述多肽药物可以是通过天然提取、化学合成或者基因工程方法得到。优选的,本发明的多肽缓释微球制剂是由下述重量百分比的原料和辅料组成:多肽(例如艾塞那肽或艾塞那肽盐)3-10%,聚乳酸(例如1002APLA)90-97%。进一步优选的,上述缓释微球制剂是由下述重量百分比的原料和辅料组成:艾塞那肽或艾塞那肽盐6%,聚乳酸(例如1002APLA)94%。本发明的上述缓释微球制剂不包含保护剂或稳定剂,例如糖类,实例如蔗糖。进一步的,本发明所述的缓释微球制剂,通过将多肽(例如艾塞那肽或艾塞那肽盐)和高分子聚合物溶于溶剂中,再加入凝聚剂,转移至淬灭溶剂中硬化得到。其中,上述溶剂为可以使多肽和高分子聚合物溶解的任何溶剂,例如有机溶剂,优选为冰醋酸。优选的,凝聚剂为硅油、液体石蜡、矿物油中的至少一种与C6-C8的饱和脂肪烃中的至少一种形成的混合物,所述饱和脂肪烃的体积百分比为50%-80%,其余为硅油、液体石蜡、矿物油中的至少一种。更进一步的,所述的C6-C8的饱和脂肪烃包括,例如正己烷、正庚烷、正辛烷、环己烷、环庚烷、环辛烷等。优选的,所述凝聚剂为正庚烷和硅油的混合物。更优选的,所述凝聚剂为50%-80%(V/V%)的正庚烷和20%-50%(V/V%)的硅油,例如在具体实施例中,所述凝聚剂为50%(V/V%)的正庚烷和50%(V/V%)的硅油、48%正庚烷和52%硅油、55%正庚烷和45%硅油。进一步的,所述的淬灭溶剂为正庚烷或正庚烷与乙醇的混合物进一步的,所述淬灭溶剂中正庚烷与乙醇的体积比为1:0-5,优选1:0-2.5,更优选1:0-1。进一步优选的,所述淬灭溶剂为体积比为1:1的正庚烷和乙醇的混合物。进一步的,所述淬灭溶剂的加入量为不低于2倍体积的凝聚剂,进一步优选为淬灭溶剂的加入量为不低于8倍体积的凝聚剂。在一个优选的实施例中,所述的艾塞那肽缓释微球制剂,通过将多肽(例如艾塞那肽或艾塞那肽盐)和高分子聚合物溶于冰醋酸中,再加入由正庚烷和硅油的混合物组成的凝聚剂中,再转移至由正庚烷和乙醇的混合物组成的淬灭溶剂中硬化得到。在另一个优选的实施例中,凝聚剂中正庚烷和硅油的体积比为1:1,淬灭溶剂中正庚烷和乙醇的体积比为1:1。本发明以上缓释微球制剂中的上述技术特征可以任意组合。本发明还提供了一种所述多肽缓释微球制剂的制备方法,包含以下步骤:(1)、将多肽(例如艾塞那肽或艾塞那肽盐)与高分子聚合物溶于溶剂;(2)、向步骤(1)制备的混合物中加入凝聚剂,形成初期微球;(3)、将步骤(2)制备的初期微球转移至淬灭溶剂中硬化得到硬化微球;还任选地包括以下步骤中的一个或多个:(4)、清洗步骤(3)制备的硬化微球表面;(5)、收集步骤(3)或步骤(4)的硬化微球、干燥。本发明提供的上述制备方法中,步骤(4)和步骤(5)均为可选或可不选的步骤,并且,步骤(4)和步骤(5)可以同时采用或者择一采用。在一个优选的多肽缓释微球制剂制备方法中,包含以下步骤:(1)、将多肽(例如艾塞那肽或艾塞那肽盐)与高分子聚合物溶于溶剂;(2)、向步骤(1)制备的混合物中加入凝聚剂,形成初期微球;(3)、将步骤(2)制备的初期微球转移至淬灭溶剂中硬化得到微球制剂。在一个优选的多肽缓释微球制剂的制备方法中,包含以下步骤:(1)、将多肽(例如艾塞那肽或艾塞那肽盐)与高分子聚合物溶于溶剂;(2)、向步骤(1)制备的混合物中加入凝聚剂,形成初期微球;(3)、将步骤(2)制备的初期微球转移至淬灭溶剂中硬化得到硬化微球;(4)、清洗步骤(3)制备的硬化微球表面;得到微球制剂。在另一优选的多肽缓释微球制剂制备方法中,包含以下步骤:(1)、将多肽(例如艾塞那肽或艾塞那肽盐)与高分子聚合物溶于溶剂;(2)、向步骤(1)制备的混合物中加入凝聚剂,形成初期微球;(3)、将步骤(2)制备的初期微球转移至淬灭溶剂中硬化得到硬化微球;(4)、清洗步骤(3)制备的硬化微球表面;(5)、收集步骤(4)的硬化微球、干燥,得到微球制剂。进一步的,所述步骤(1)的溶剂为可以使多肽(例如艾塞那肽或艾塞那肽盐)和高分子聚合物溶解的任何溶剂,优选多肽(例如艾塞那肽或艾塞那肽盐)和高分子聚合物溶解性好的溶剂,例如包括冰醋酸、丙酮、乙腈、乙酸乙酯,艾塞那肽或艾塞那肽盐和高分子聚合物在冰醋酸中溶解性好。进一步的,所述的凝聚剂为硅油、液体石蜡、矿物油中的至少一种与C6-C8的饱和脂肪烃中的至少一种形成的混合物,所述饱和脂肪烃的体积百分比为50%-80%,其余为硅油、液体石蜡、矿物油中的至少一种。更进一步的,所述的C6-C8的饱和脂肪烃为包括正己烷、正庚烷、正辛烷、环己烷、环庚烷、环辛烷等。优选的,所述凝聚剂为正庚烷和硅油的混合物。进一步优选的,所述凝聚剂为50%-80%(V/V%)的正庚烷和20%-50%(V/V%)的硅油。,例如在一个具体实施例中,所述凝聚剂为50%(V/V%)的正庚烷和50%(V/V%)的硅油。已发现,本发明提供的凝聚剂可以有效的实现对冰醋酸的萃取,及微球粒径的控制,将微球粒径控制在60微米-120微米,包封率好,有效避免药物突释现象。进一步的,所述的淬灭溶剂为正庚烷或正庚烷与乙醇的混合物。进一步的,所述正庚烷与乙醇的体积比为1:0-1。进一步优选的,所述淬灭溶剂为体积比为1:1的正庚烷和乙醇的混合物。进一步的,所述淬灭溶剂的加入量为不低于2倍体积的凝聚剂,进一步优选淬灭溶剂的加入量为不低于8倍体积的凝聚剂。在一个优选的实施例中,所述的溶剂为冰醋酸;所述的凝聚剂为正庚烷和硅油的混合物。在另一优选的实施例中,所述的溶剂为冰醋酸;所述凝聚剂为体积比为1:1的正庚烷和硅油的混合物。在一个优选的实施例中,所述的溶剂为冰醋酸;所述的淬灭溶剂为正庚烷和乙醇的混合物。在另一优选的实施例中,所述的溶剂为冰醋酸;所述淬灭剂为体积比为1:1的正庚烷和乙醇的混合物。在一个优选的实施例中,所述的凝聚剂为正庚烷和硅油的混合物;所述的淬灭溶剂为正庚烷和乙醇的混合物。在另一优选的实施例中,所述凝聚剂为体积比为1:1的正庚烷和硅油的混合物,所述淬灭溶剂为体积比为1:1的正庚烷和乙醇的混合物。在一个优选的实施例中,所述的溶剂为冰醋酸;所述的凝聚剂为正庚烷和硅油的混合物;所述的淬灭溶剂为正庚烷和乙醇的混合物。在另一优选的实施例中,所述的溶剂为冰醋酸;所述凝聚剂为体积比为1:1的正庚烷和硅油的混合物,所述淬灭剂为体积比为1:1的正庚烷和乙醇的混合物。进一步的,所述的清洗步骤采用通常的微球清洗方法对硬化微球表面进行清洗即可,本发明提供一种优选的清洗步骤,包括:清洗液为乙醇-正庚烷,采用逐步减小其中乙醇的比例的清洗液清洗微球表面,最后采用正庚烷浸泡,以得到良好形态的微球。进一步的,所述的收集硬化微球步骤采用湿法筛分。进一步的,所述的干燥步骤采用真空干燥。本发明以上制备方法中的技术特征都可以任意组合。本发明以上制备方法中不需要加入保护剂或稳定剂(例如包含蔗糖在内的糖类)来控制粒径及其带来的注射顺应性、或解决突释问题等。本发明以上制备方法中通过对溶剂-凝聚剂-淬灭溶剂体系的选择,能很好地解决现有技术存在的艾塞那肽缓释微球制剂的突释问题、粒径问题、以及平台期问题,延长单次给药期可长达3个月。本发明还提供一种通过上述制备方法制备得到的艾塞那肽缓释微球制剂。本发明中“组成”可以理解为不包括如蔗糖等糖类在内的保护剂或稳定剂,或者不包括其它原料或辅料,但是,应该理解,并不排除在制备过程中残留的溶剂等。本发明中的V/V%是指体积/体积%,即体积百分比。本发明中的初始释放率,即体外初始释放率,是指1小时内的体外累计释放率(重量百分比)。本发明中的凝聚剂是将艾塞那肽或艾塞那肽盐与高分子聚合物的溶液不易溶解于其中因此与该溶液形成不同相的试剂。本发明中提供的缓释微球制剂中,采用艾塞那肽作为活性成分,艾塞那肽(exenatide)是人工合成的北美毒蜥外泌肽(exendin-4),由39个氨基酸残基构成,分子式为C184H282N50O60S,相对分子量4186.57,其氨基酸序列如下:His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-SerLys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-NH2。艾塞那肽为人胰高血糖素样肽-1(GLP-1)的类似物,是GLP-1的受体激动剂,与GLP-1具有相同的生理功能,艾塞那肽在体外显示可以结合并活化已知的人类GLP-1受体。这就意味着通过包括cAMP和/或其他细胞内信号传导机制使葡萄糖依赖性胰岛素合成及胰岛β细胞在体内分泌胰岛素增加。在葡萄糖浓度升高的情况下,艾塞那肽可促进胰岛素从β细胞中释放。体内给药后艾塞那肽模拟GLP-1的某种抗高血糖药作用。本发明中所述的高分子聚合物为生物相容性,可为生物降解性聚合物或非生物降解性聚合物或其掺合物或共聚物。本发明所用聚合物的可接受的分子量根据聚合物的降解率、物理特性(例如机械强度)、端基化学和聚合物于溶剂中溶出率等因素来确定。通常可接受分子量范围为约2,000道尔顿到约2,000,000道尔顿。本发明的缓释组合物可形成很多形状,例如薄膜、丸状、圆柱状、盘状或微粒。如本发明所定义,微粒包含直径小于约一毫米且生物活性多肽分散或溶于其间的聚合物组分。微粒可为球形、非球形或不规则形状。本发明提供了一种多肽缓释微球制剂,并通过对制备时溶剂、凝聚剂和淬灭溶剂的选择,不仅微球粒径小、包封率高,还进一步延长了药物释放时间,单次给药可以持续释放半月以上,可长达3个月,显著降低了给药频率,提高患者的顺应性;并且克服了现有的多肽,尤其是艾塞那肽缓释微球制剂在释放中存在的平台期,本发明的多肽缓释微球制剂意外地能够实现近乎零级的释放曲线;同时,有效避免了体外突释,经实验证实,本发明制剂在1小时内的体外初始释放率在重量百分比2%以内。本发明的艾塞那肽缓释微球制剂用于治疗糖尿病,包括I型和II型糖尿病;可以用于通过降低血浆葡萄糖水平的药剂而获益的疾病的治疗中;用于预防高血糖;用于预防高血压;和用于治疗会通过给予延迟和/或延缓胃排空的药剂而获益的疾病的治疗;还可以用于减少食物摄入、抑制食欲并治疗肥胖症;本发明的艾塞那肽缓释微球制剂还可以用于治疗充血性心力衰竭。尽管“肥胖症”通常被定义为体重指数超过30,出于本发明公开的目的,需要或希望减轻体重的任何对象,包括体重指数小于30的那些,都被包括在“肥胖”的范围内。本发明的多肽缓释微球制剂通常可按照本领域通常所知方法给药。可通过注射、植入(例如皮下、肌内、腹膜内、颅内和皮内)、粘膜给药(例如鼻内、阴道内、肺内或借助栓剂)、口服、通过无针注射或原位递送(例如通过灌肠剂或气雾剂)将本发明的缓释微球制剂给予患者(例如需要该制剂的人类)或其它动物。可用在所需时间内达到所需治疗水平的任何给药时间给予该缓释微球制剂。举例而言,可给予缓释微球制剂,监测患者直到所递送的药物水平回到基线。回到基线后,可再次给予缓释微球制剂。或者,可在患者体内达到基线水平前序惯给予缓释微球制剂。本发明的缓释微球制剂还可与皮质类固醇一起给予。本发明的缓释微球制剂与皮质类固醇一起给予可进一步提高缓释微球制剂中生物活性多肽的生物利用度。本发明所定义的皮质类固醇指类固醇类抗炎性剂,也称为糖皮质激素。本发明中所用术语患者是指人类,例如需要该药剂或治疗方法、预防方法或诊断方法的人类。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1本发明艾塞那肽微球制剂体外释放曲线。图2本发明艾塞那肽微球制剂体内释放曲线。具体实施方式本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。本发明中所述的“艾塞那肽盐”可以为任何可以药用的艾塞那肽盐,包括艾塞那肽有机酸盐和艾塞那肽无机酸盐,例如目前已经药用的为艾塞那肽醋酸盐,还包括艾塞那肽盐酸盐、艾塞那肽乳酸盐、艾塞那肽三氟乙酸盐、艾塞那肽枸橼酸盐、艾塞那肽富马酸盐、艾塞那肽丙二酸盐、艾塞那肽马来酸盐、艾塞那肽酒石酸盐、艾塞那肽门冬氨酸盐、艾塞那肽苯甲酸盐、艾塞那肽琥珀酸盐或艾塞那肽扑酸盐,可将艾塞那肽盐作为一种优选的艾塞那肽盐原料用作制备艾塞那肽微球制剂。本发明实施例中的PLGA或PLA或PGA命名组成通常是丙交酯和乙交酯聚合比例+旋光性+比浓对数粘度+高分子末端类型。例如,50:50DLG1APLGA的具体含义,是指PLGA是外消旋物质,由丙交酯、乙交酯的环状二聚合物在亲核引发剂催化作用下的开环聚合物,聚合比例1:1,PLGA比浓对数粘度在1左右,PLGA末端基团是羧基,命名时DLG也可以放在聚合比例之前,如DLG50501A。本发明中,生物活性多肽的缓释是从本发明的缓释制剂释放该多肽,释放发生的时间比直接给予该多肽溶液后存在可利用的生物学显著量的时间长。缓释通常可以为连续释放或不连续释放,释放速率相对恒定或有变化。所用聚合物组成的类型等可能影响释放的连续性和释放水平。实施例1微球制剂及其制备方法(1)将5g纯化50:50DLG2APLGA(聚合比例1:1,PLGA比浓对数粘度在1左右,末端基团是羧基的PLGA),0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(3)制备的初期微球转移至1800ml正庚烷和1800ml乙醇的混合溶液中,20℃下搅拌1-2h;(4)用200ml50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面的残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。4℃干燥24h,25℃真空干燥24h,35℃真空干燥24h。实施例2微球制剂及其制备方法(1)将5g纯化50:50DLG3APLGA,0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至1500ml正庚烷和1500ml乙醇的混合溶液中;(4)用200ml50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面的残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。4℃干燥24h,25℃真空干燥24h,35℃真空干燥24h。实施例3微球制剂及其制备方法(1)将5g纯化1002APLA,0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至2100ml正庚烷和2100ml乙醇的混合溶液中,20℃下搅拌1-2h;(4)用200ml50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。4℃干燥24h,25℃真空干燥24h,35℃真空干燥24h。实施例4微球制剂及其制备方法(1)将5g纯化75:25DLG2APLGA,0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至1800ml正庚烷和1800ml乙醇的混合溶液中,20℃下搅拌1-2h;(4)用200ml50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。4℃干燥24h,25℃真空干燥24h,35℃真空干燥24h。实施例5微球制剂及其制备方法(1)将60g纯化50:50DLG3APLGA,1.9g艾塞那肽溶于冰醋酸中,形成聚合物与药物的溶液;(2)混合4000ml正庚烷与1000ml硅油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至20L正庚烷中,25℃下搅拌5-6h;(4)清洗;(5)收集微球,真空干燥。实施例6微球制剂及其制备方法(1)将9gPGA,1g艾塞那肽溶于200ml冰醋酸,形成聚合物与药物的溶液;(2)混合800ml正庚烷与400ml硅油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至3000ml正庚烷和1800ml乙醇的混合溶液中,搅拌;(4)用500ml50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。0-4℃干燥24h,20-25℃真空干燥24h,35℃真空干燥24h。实施例7微球制剂及其制备方法(1)将9.2g纯化75:25DLG2APLGA,0.8g艾塞那肽溶于溶剂中,形成聚合物与药物的溶液;(2)混合600ml正辛烷与400ml液体石蜡,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至6L正庚烷和4L乙醇的混合溶液中,20℃下搅拌;(4)用50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。真空干燥。实施例8微球制剂及其制备方法(1)将60g纯化60:40DLG2APLGA,2g艾塞那肽溶于溶剂中,形成聚合物与药物的溶液;(2)混合2000ml正辛烷与2000ml液体石蜡,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至8000ml正庚烷和8000ml乙醇的混合溶液中,室温搅拌6h;(4)用50%的正庚烷-乙醇溶液并逐步减小其中乙醇的比例来清洗步骤(3)得到的微球表面;(5)湿法筛分收集步骤(4)得到的微球,真空干燥。实施例9微球制剂及其制备方法(1)将4.88g纯化1002APLA,0.32g艾塞那肽溶于冰醋酸中,形成聚合物与药物的溶液;(2)混合500ml正己烷与500ml矿物油,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至3L正庚烷和3L乙醇的混合溶液中;(4)用50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。4℃干燥20-24h,35℃真空干燥20-24h。实施例10微球制剂及其制备方法(1)将5g纯化1002APLA,0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;向步骤(1)制备的聚合物与药物的溶液中加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至2100ml正庚烷和2100ml乙醇的混合溶液中硬化得到微球制剂。实施例11微球制剂及其制备方法(1)将5g纯化1002APLA,0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;向步骤(1)制备的聚合物与药物的溶液中加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至2100ml正庚烷和2100ml乙醇的混合溶液中硬化得到微球制剂。(4)、清洗步骤(3)制备的硬化微球表面;(5)、收集硬化微球、干燥。实施例12微球制剂及其制备方法(1)将5g纯化50:50PLA2APLGA,0.3g艾塞那肽溶于50ml冰醋酸,形成聚合物与药物的溶液;(2)混合200ml正庚烷与200ml硅油,制备凝聚剂;(3)剪切步骤(1)制备的聚合物与药物的溶液,同时加入步骤(2)制备的凝聚剂,得到初期微球;(4)将步骤(3)制备的初期微球转移至2100ml正庚烷和2100ml乙醇的混合溶液中,20℃下搅拌1-2h;(5)用200ml50%的正庚烷-乙醇溶液冲洗步骤(4)得到的微球表面残留溶剂;(6)使用多层筛收集步骤(5)得到的微球,用50%的正庚烷-乙醇溶液漂洗。4℃干燥24h,25℃真空干燥24h,35℃真空干燥24h。实施例13微球制剂及其制备方法(1)将9.2g纯化75:25DLG2APLGA,0.8g艾塞那肽醋酸盐溶于溶剂中,形成聚合物与药物的溶液;(2)混合600ml正辛烷与400ml液体石蜡,制备凝聚剂;剪切步骤(1)制备的聚合物与药物的溶液,同时加入制备的凝聚剂,得到初期微球;(3)将步骤(2)制备的初期微球转移至6L正庚烷和4L乙醇的混合溶液中,20℃下搅拌;(4)用50%的正庚烷-乙醇溶液冲洗步骤(3)得到的微球表面残留溶剂;(5)使用多层筛收集步骤(4)得到的微球,用50%的正庚烷-乙醇溶液漂洗。真空干燥。实施例14一种艾塞那肽缓释微球制剂,由艾塞那肽和聚乳酸羟基乙酸共聚物(PLGA)组成,其中艾塞那肽的重量百分比为3%,聚乳酸羟基乙酸共聚物(PLGA)的重量百分比为97%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例15一种艾塞那肽缓释微球制剂,由艾塞那肽和聚乳酸(PLA)组成,其中艾塞那肽的重量百分比为10%,聚乳酸(PLA)的重量百分比为90%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例16一种艾塞那肽缓释微球制剂,由艾塞那肽和聚羟基乙酸(PGA)组成,其中艾塞那肽的重量百分比为5%,聚羟基乙酸(PGA)的重量百分比为95%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内,该艾塞那肽缓释微球制剂的体外释放曲线为接近零级的释放曲线。实施例17一种艾塞那肽缓释微球制剂,由艾塞那肽和聚乳酸羟基乙酸共聚物(PLGA)组成,其中艾塞那肽的重量百分比为8%,聚乳酸羟基乙酸共聚物(PLGA)的重量百分比为92%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例18一种艾塞那肽缓释微球制剂,采用与实施例2相似的方法制备得到,由艾塞那肽和高分子聚合物组成,高分子聚合物由等重量份的聚乳酸羟基乙酸共聚物(PLGA)和聚乳酸(PLA)组成,其中艾塞那肽的重量百分比为7%,高分子聚合物的重量百分比为93%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例19一种艾塞那肽缓释微球制剂,采用与实施例3相似的方法制备得到,由艾塞那肽和高分子聚合物组成,高分子聚合物由重量比为2:1的聚乳酸羟基乙酸共聚物(PLGA)和聚羟基乙酸(PGA)组成,其中艾塞那肽的重量百分比为4%,高分子聚合物的重量百分比为96%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例20一种艾塞那肽缓释微球制剂,采用与实施例3相似的方法制备得到,由艾塞那肽和高分子聚合物组成,高分子聚合物由重量比为2:2:1的聚乳酸羟基乙酸共聚物(PLGA)、聚乳酸(PLA)、聚羟基乙酸(PGA)组成,其中艾塞那肽的重量百分比为5%,高分子聚合物的重量百分比为95%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例21一种艾塞那肽缓释微球制剂,采用与实施例1相似的方法制备得到,由艾塞那肽和高分子聚合物组成,高分子聚合物由重量比为3:2的聚乳酸(PLA)和聚羟基乙酸(PGA)组成,其中艾塞那肽的重量百分比为3.5%,高分子聚合物的重量百分比为96.5%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例22一种艾塞那肽缓释微球制剂,由艾塞那肽和聚乳酸羟基乙酸共聚物(PLGA)组成,其中艾塞那肽的重量百分比为9%,聚乳酸羟基乙酸共聚物(PLGA)的重量百分比为91%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内。实施例23一种艾塞那肽缓释微球制剂,由艾塞那肽和聚乳酸(PLA)组成,其中艾塞那肽的重量百分比为6%,聚乳酸(PLA)的重量百分比为94%,该缓释微球制剂在1小时内的体外初始释放率在重量百分比2%以内,该艾塞那肽缓释微球制剂的体外释放曲线为接近零级的释放曲线。以下通过上述实施例制备的微球制剂的质量评价实验证明本发明的有益效果。[方法]1、粒径分布测定:采用激光粒度仪(Malvern3000)测定微球的粒径分布。2、包封率测定:称量10mg微球,加入2ml二甲基亚砜,涡流振荡使完全溶解,加入纯化水定容至10ml。通过HPLC分析柱:TSK-GEL进行定量检测。计算包封率。包封率(%)=(投药量-游离药量)/投药量×100%3、体外释放测定:通过测定在释放缓冲液(pH9.4的tris-HCl溶液)中不同时间艾塞那肽的浓度,可测定体外释放(即体外累计释放)。室温下将100±2mg微球置于100ml缓冲液(pH9.4的tris-HCl溶液)中,振荡约30s以悬浮该溶液,然后置于37℃恒温水浴中。一定时间后振荡混合,静置30min,取上清液,立即通过HPLC分析柱:TSK-GEL进行定量检测。其中,测定1h的释放度为体外初始释放率。4、体内释放测定:夹层免疫定量血浆中艾塞那肽,用固相单克隆抗体EXE4:2-8.4来捕获分析物,通过放射性碘标记单克隆抗体GLP-1:3-3来检测。标准校正曲线来定量。对照制剂:美国礼来公司(EliLillyandCompany)、Amylin、Alkermes公司生产的艾塞那肽缓释制剂(Bydureon)。对照制剂制备方法来自于中国专利公开号CN101065116A包含多肽和糖的基于丙交酯/乙交酯共聚物的缓释微胶囊,具体制备步骤如下:采用W/O/O相凝聚原理来制备艾塞那肽微球,先将多肽与聚合物分别溶于水和有机溶剂,制备油包水型乳剂,其中水相中加入蔗糖作为保护剂,避免药物降解;随着硅油的加入,形成初期微粒;将其转移至猝灭溶剂中硬化;收集硬化微粒;干燥。实施例23实施例1-3的缓释制剂的参数评价采用上述方法测定实施例1-3的缓释制剂的平均粒径、包封率以及体外初始释放率,如表1所示。表1:实施例1-3的参数评价微球制剂实施例1实施例2实施例3平均粒径μm66.258.362.5包封率%93.892.091.3初始释放%0.961.051.11从表1可以看出,实施例1-3的艾塞那肽缓释制剂的包封率均达到了90%以上,初始释放率在2%重量百分比以内,平均粒径小,注射容易,患者注射的疼痛感小,进一步实验证实,其他实施例4-22也有具有与实施例1-3相似的效果。实施例24实施例1-3的缓释制剂与对照制剂的平台期比较测定实施例1-3的缓释制剂和对照制剂在第1、3、5、8、10、14、17天时的体外累计释放率,结果如表2所示。表2:实施例1-3的制剂与对照制剂的体外累计释放率从表2可知,对照制剂的平台期大于17天,而本发明实施例1-3的制剂没有平台期。对照制剂的平台期使得实际的给药过程存在叠加效应,加大体内突释效应,产生严重不良反应,进一步实验证实,其他实施例4-22也有具有与实施例1-3相似的效果。实施例25测定实施例3的缓释制剂和对照制剂的体外释放曲线测定实施例3的缓释制剂和对照制剂在一定时间内的体外累计释放率%,如表3所示,并以此数据得到图1的体外释放曲线。表3:实施例3的制剂与对照制剂的体外累计释放率从图1和表3可以看出,本发明的实施例3的释放曲线为接近零级释放曲线,进一步实验证实,本发明的其他实施例也有具有与实施例3相似的效果。实施例26测定实施例3的缓释制剂和对照制剂的体内释放曲线测定实施例3的缓释制剂和对照制剂在体内一定时间的体内血药浓度,结果如表4所示,并以此数据得到图2的体内释放曲线。表4:实施例3的制剂与对照制剂的体内血药浓度(ng/ml)其中,“-”表示未检出。从表3和图2可以看出,对照制剂体内释放波动大,而实施例3的体内释放稳定,释放可达60天以上,进一步实验证实,本发明其他实施例也有具有与实施例3相似的效果。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1