一种调控生物膜表面拓扑结构以促进细胞爬行的方法与流程
技术领域
本发明属于高分子生物医用材料技术领域,具体涉及一种调控生物膜表面拓扑结构以促进细胞爬行的方法。
背景技术:
生物膜材料的医学价值不仅体现在其原料本身良好的生物相容性,还与其表面拓扑结构关系密切。作为细胞生长支架的膜材料,为了更好地模拟细胞外基质,它们需要有合适的孔径、高的孔隙率。由于细胞与细胞外基质的作用处在纳米级别,人们对材料表面纳米级别的凸起及其对细胞黏附、爬行和分化的影响的研究也越来越多。由于组织的修复是新生细胞爬行替代坏死组织的过程,只有具备合适孔尺寸、空间隙和纳米突起的多孔支架才能为细胞的黏附、生长、增殖、分化以及新组织的生成提供良好的生长环境。孔隙过大不利于细胞爬行,孔隙过小则不利于细胞间的交通和细胞生长入支架材料之中。此外,当材料表面拥有很多纳米级凸起的时候不仅利于细胞黏附,也可促进细胞的爬行、增殖和分化。
据文献报道,可以通过调节溶液浓度、配比、静电纺丝的参数,包括电压强度、接收距离来调节纳米纤维的直径从而调节纤维的孔隙;通过调节溶液的浓度、冷冻干燥的温度来调节膜材料的孔隙率;通过更换溶解体系来调节膜材料的孔隙大小。亦有文献指出生物材料表面的粗糙度适当增加可以促进细胞的黏附,尤其材料表面纳米级别的凸起可以有效促进细胞的黏附、伸展和爬行。但是至今尚未发现有直接利用层层自组装技术调节生物医学材料表面孔尺寸、孔间隙和纳米凸起的研究和应用。专利号为“ZL 201310158591.0”的一项发明提到将聚电解质层层组装至纳米纤维膜后其孔径缩小;专利申请号为“201510586136.X”的一项发明利用层层自组装技术制备纳滤膜,其中提到将聚乙烯亚胺和氧化石墨烯交替组装至聚丙烯腈基膜的表面使得膜表面的亲水性和孔径大小得到有效的调控。遗憾的是,此两项专利均属于膜分离领域而非生物医用材料领域,且并未讨论材料的生物相容性、材料表面孔尺寸、孔间隙及表面纳米凸起对细胞生物行为的影响,因此将膜材料进行层层自组装的目的及聚电解质种类也与生物膜材料大相径庭。
近年来,层层自组装技术在生物医用材料领域受到广泛的应用。早在2010年,专利号为“ZL 201010022450.2”的一项专利就报道了静电自组装改性纳米纤维的生物医用材料的制备方法,其目标在于将具有其他生物性能的聚电解质组装在纳米纤维膜上以赋予其附加性能达到增加其生物相容性的目的,但此发明并未关注到静电自组装对纳米纤维膜表面孔隙大小及纳米凸起的变化,也未对这些改变对细胞行为所产生的影响进行研究。此外,专利号为“ZL 201310456538.9”的一项专利利用层层自组装技术将溶菌酶和丝素蛋白组装在纤维素纳米纤维膜表面,赋予了纳米纤维膜良好的抗菌性能和细胞粘着性,并制造大鼠背部创面模型进行体内实验,证明改性后的纤维素纳米纤维膜可以明显缩短创面愈合的时间;专利号为“ZL 201410423055.3”的一项发明介绍了一种用于促进心肌组织再生和干细胞监测的壳聚糖-丝素蛋白复合纳米纤维多功能补片的制备方法,该方法通过层层自组装技术将带正电的壳聚糖和带负电的丝素蛋白逐层交替组装到纳米纤维表面,而后将脂肪间充质干细胞和心脏祖细胞种子细胞接种于纳米纤维膜表面,拟以此作为心肌补片进行心肌修复。以上两项发明利用静电层层自装改性的主要目的依然只是利用纳米纤维膜的三维支架结构并将具有特定性能的聚电解质组装在纳米纤维膜的表面,以此获得相应的生物医学性能。它们同样没探讨生物膜材料表面孔尺寸、孔间隙及纳米凸起的变化对细胞爬行的影响,也并没有有意识地对纳米纤维膜的孔隙和表面纳米结构进行调控。
技术实现要素:
本发明的目的在于提供一种调控生物膜表面拓扑结构以促进细胞爬行的方法,本发明方法简单有效,并通过表面改性使生物膜材料获得附加的性能。
本发明目的通过以下技术方案实现:
一种调控生物膜表面拓扑结构以促进细胞爬行的方法,为采用聚电解质层层自组装目标生物膜,调控生物膜表面拓扑结构;所述的生物膜表面拓扑结构包括孔隙尺寸、孔间隙和表面纳米凸起。该方法具体包括如下步骤:选取两种带有相反电荷的聚电解质,然后根据目标生物膜表面电荷选择与其带有相反电荷聚电解质首先开始进行自组装,随后组装另一种带有相反电荷聚电解质,至此为组装一个双分子层,以此类推直至获得所需层数。层层自组装的方法可为溶液浸泡法、刮涂法、旋涂法、接枝共聚、静电喷涂、电沉积、流体固定。通过反复多次交替组装后即可获得表面拓扑结构改善的组织工程膜材料。拍摄场发射扫描电子显微镜观察改性后膜材料表面形貌及孔隙的变化。最后通过在这些生物膜材料及改性后膜材料的表面进行细胞接种并培养不同的时间后进行MTT试验或CCK-8试验和扫描电镜的拍摄来评估改性后的膜材料是否拥有更好的促进细胞粘附、生长、增殖的能力。若组装的聚电解质为抗菌活性物质、生长因子、抗肿瘤药物,则对此类性能进行评估。经过以上多种试验评估组装何种层数效果最为优异。
所述的聚电解质可为壳聚糖、丝素蛋白、胶原蛋白、溶菌酶、聚赖氨酸、聚丙烯氨基、聚乙烯亚胺、海藻酸钠、明胶、硫酸软骨素、硫酸肝素、硫酸葡聚糖、白蛋白、聚谷氨酸、透明质酸中的一种或者多种。
所述生物膜材料可通过流延法、静电纺丝、冷冻干燥、电沉积方法、旋涂法、刮涂法、真空法、浸没沉淀相转化法制作而成,其原料可为高分子材料中的一种或多种混合。
下面以利用层层自组装调节丝素蛋白膜为例介绍本发明方法,包括如下步骤:
(1)分别制备溶菌酶和I-型胶原蛋白水溶液,浓度均为1mg/mL,缓慢搅拌直到溶质完全溶解;按照体积比1:1的比例将上述两种溶液混合得到溶菌酶和胶原蛋白混合溶液,并调节其pH值为6.3。
(2)制备丝素蛋白水溶液,浓度为1mg/mL,调节其pH值为8.0。
(3)以丝素蛋白膜为底板膜,采用层层自组装将带有相反电荷的溶菌酶-胶原蛋白复合物和丝素蛋白交替组装至丝素蛋白底板膜的表面,得到不同双分子层数溶菌酶-胶原蛋白/丝素蛋白复合膜。
具体来说,步骤(3)中的所述的自组装过程为:将丝素蛋白膜于溶菌酶-丝素蛋白混合溶液中浸泡20分钟,再用超纯水洗涤三次,每次3分钟,至此为组装了0.5个双分子层;接着在丝素蛋白溶液中浸泡20分钟,同样用超纯水洗涤三次,至此为组装了1个双分子层;重复以上操作获得不同双分子层数的复合蛋白膜。
本发明提供了采用层层自组装调控生物膜表面拓扑结构在促进细胞在生物膜上爬行的应用。本发明结合层层自组装通过调节生物膜材料表面拓扑结构,包括孔尺寸、孔间隙以及其表面纳米凸起,来促进接种在其上的细胞黏附和爬行。通过层层自组装的方法对生物膜材料进行表面改性,不仅可以通过表面沉积调节膜表面孔隙的大小,还可以使其表面粗糙化,赋予膜表面更多的纳米凸起,使其能更加促进细胞黏附、增殖和分化。虽然在生物膜材料制备过程中有很多种方法可进行其表面孔隙调节,但是这些方法仍存在一些缺陷,材料一旦成型后,孔隙基本保持原状。层层自组装改性技术简单、条件温和、成本低廉,还可通过组装不同的聚电解质赋予膜表面更多的附加性能,利用此方法对材料表面进行调控是一种方便可行的途径。
本发明以生物膜材料为载体,通过层层自组装技术,较好地调节了膜材料表面孔隙的大小,使得较大的间隙缩小至细胞能很好迁移通过的尺寸,并使得膜表面的纳米级凸起大大增加。利用小鼠胚胎成骨前体细胞(MC3T3-E1)、人口腔黏膜上皮细胞(HIOEC)或人正常真皮成纤维细胞(NHDFs)进行体外试验,结果证明,表面改性后的膜材料能够更好的促进细胞的生长、增殖和分化。此外,这种表面改性还赋予了生物膜材料其他的生物性能,如抗菌能力(由溶菌酶的引入产生)等。与现有技术相比,本发明首次将层层自组装技术应用于调控生物膜材料表面的孔隙大小和纳米凸起,并赋予生物膜材料额外的性能,使其生物医学价值最大化,本发明具有原料成本低廉、操作工艺简单、条件温和等诸多优点,适用于大规模生产。
附图说明
图1是实施例1中丝素蛋白膜以及制备的溶菌酶-胶原蛋白/丝素蛋白复合膜的扫描电镜图。a-f依次是丝素蛋白膜、双分子层数为0.5、5、5.5、10和10.5的溶菌酶-胶原蛋白/丝素蛋白复合膜,放大倍数为1000×;a’-f’依次是丝素蛋白膜、双分子层数为0.5、5、5.5、10和10.5的溶菌酶-胶原蛋白/丝素蛋白复合膜,放大倍数为5000×。
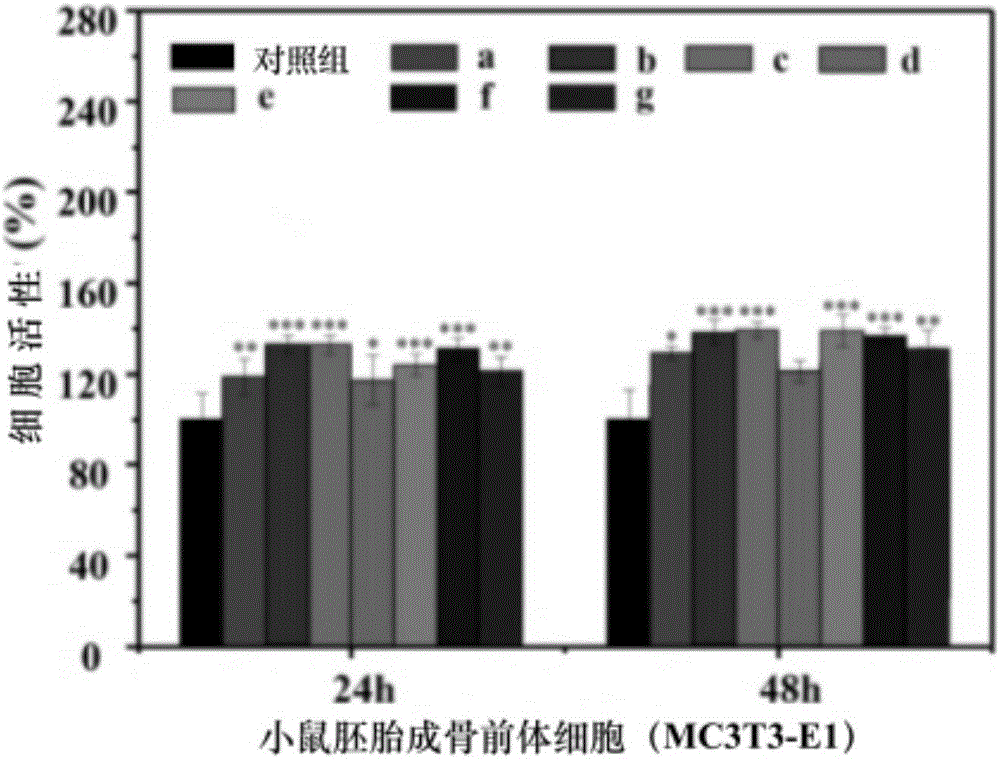
图2是实施例1中细胞增殖与毒性试验结果图,受试细胞为MC3T3-E1。a-g依次是丝素蛋白膜、双分子层数为0.5、1、5、5.5、10和10.5的溶菌酶-胶原蛋白/丝素蛋白复合膜。
图3是实施例1中MC3T3-E1细胞接种于丝素蛋白膜以及溶菌酶-胶原蛋白/丝素蛋白膜上以后的扫描电镜图。a-c依次是丝素蛋白膜、双分子层数为0.5和5.5的溶菌酶-胶原蛋白/丝素蛋白复合膜。
图4是实施例3中丝素蛋白/聚己内酯复合纳米纤维膜以及壳聚糖-胶原蛋白/丝素蛋白/聚己内酯复合纳米纤维膜的扫描电镜图。a-e依次是丝素蛋白/聚己内酯复合纳米纤维膜、双分子层数为5、5.5、10和10.5的壳聚糖-胶原蛋白/丝素蛋白/聚己内酯复合纳米纤维膜。
图5是实施例3中人正常真皮成纤维细胞(NHDFs)接种于丝素蛋白/聚己内酯复合纳米纤维膜以及壳聚糖-胶原蛋白/丝素蛋白/聚己内酯复合纳米纤维膜的扫描电镜图。a-d依次是丝素蛋白/聚己内酯复合纳米纤维膜、双分子层数为0.5、10和10.5的壳聚糖-胶原蛋白/丝素蛋白/聚己内酯复合纳米纤维膜。
具体实施方式
下面通过具体实施例对本发明的技术方案作进一步说明,其目的在于帮助更好地理解本发明的技术方案,但这些具体实施例不以任何方式限制本发明的保护范围。
实施例1
(1)分别制备溶菌酶和I-型胶原蛋白水溶液,浓度为1mg/mL,搅拌直到溶质完全溶解;按照体积比1:1的比例将上述两种溶液混合得到溶菌酶和胶原蛋白混合溶液,并使用冰醋酸和氨水将调节其pH值为6.3。
(2)制备丝素蛋白水溶液,浓度为1mg/mL,使用冰醋酸和氨水将调节其pH值为8.0。
(3)以湖北赛罗生物科技有限公司提供的丝素蛋白膜为底板膜。将丝素蛋白膜于溶菌酶-丝素蛋白混合溶液中浸泡20分钟,再用超纯水洗涤三次,每次3分钟,至此视为组装了0.5个双分子层;接着在丝素蛋白溶液中浸泡20分钟,同样用超纯水洗涤三次,至此视为组装了1个双分子层;重复以上操作获得双分子层数0.5-10.5的溶菌酶-胶原蛋白/丝素蛋白复合膜,室温下自然晾干进一步真空干燥。然后将各组样品拍摄扫描电镜,观察并比较表面改性前后生物膜表面形貌的变化。
(4)将改性后蛋白复合膜用打孔器制成直径为6mm的圆片,紫外线照射2h进行灭菌后,放置于96孔板中,并使其完全覆盖在孔底;并根据所组装的双分子层数的不同将其分成相应的组别,每组设置5个平行对照。
(5)将培养的在对数生长期的小鼠胚胎成骨前体细胞(MC3T3-E1)稀释至密度为5×103个/mL细胞悬液,分别取200μL的细胞悬液接种于步骤(4)中准备好的蛋白复合膜的样本中。放入细胞培养箱中培养(37℃,5% CO2),每2天更换一次细胞培养基。培养5-7天后收获细胞,固定、冲洗、脱水后喷金,然后拍摄扫描电镜观察细胞粘附情况及细胞生长形态。
(6)如步骤(4)所述制作样品并进行分组,设置不放蛋白复合膜的组别为空白对照组。每孔中接种3×103个MC3T3-E1细胞,分别于24h和48h后将细胞培养基移除,替换为新的含有cck-8试剂的培养基,根据说明书,避光置入培养箱内培养3h后取出,读取在450nm时的吸光度值。每组去掉最大值和最小值后取平均值,与对照组进行比较计算细胞增殖率。
所得溶菌酶-胶原蛋白/丝素蛋白复合膜的形貌见图1,可见丝素蛋白表面存在较多较大的孔隙,且表面相对光滑。而经过层层自组装改性以后,表面孔隙明显减小,且初见趋于平面化,表面也逐渐粗糙,拥有很多纳米凸起。
利用MC3T3-E1细胞进行体外细胞增殖与毒性试验,结果见图2、3。由图2可以看出层层自装改性以后的复合膜拥有更好的促进细胞增殖的能力。图3则直观的说明了丝素蛋白膜表面的较大间隙不利于细胞的迁移,而经过此方法表面改性后的复合膜则更好的促进了细胞的贴附与增殖。然而图2也说明了表面生物多孔性的重要,过多的组装使得材料表面趋于平面化将会使得其促进细胞生长增殖的能力有所降低,因此要根据目标效果对组装的双分子层数进行选择。
实施例2
(1)利用0.5% NaCO3溶液将家蚕丝脱胶、精练后用氯化钙/乙醇/水三元溶液溶解,透析、纯化、浓缩后得到2.5-3.5%的丝素蛋白溶液,经冷冻干燥后得到丝素蛋白膜。
(2)将所得丝素蛋白膜用75%乙醇交联1小时,室温晾干后进一步真空干燥。
(3)用2%乙酸配制壳聚糖溶液(1mg/mL),磁力搅拌至完全溶解后调节pH至5.0;配制I-型胶原蛋白水溶液(1mg/mL),磁力搅拌至完全溶解后用冰醋酸和氨水调节pH至5.0。
(4)首先将壳聚糖溶液利用旋涂法组装在步骤(2)所得丝素蛋白/聚己内酯复合纳米纤维膜表面,自然晾干。旋涂参数为:0.3mL,旋涂速度为1000rad,旋涂时间为3min,至此为视组装了0.5个双分子层;后以同样参数旋涂胶原蛋白水溶液,自然晾干,至此视为组装1个双分子层;重复以上操作获得双分子层数5-20的表面改性丝素蛋白膜,室温下自然晾干进一步真空干燥。然后将各组样品拍摄扫描电镜,观察并比较表面改性前后生物膜表面形貌的变化。
(5)将改性后丝素蛋白膜用打孔器制成直径为16mm的圆片,紫外线照射2h进行灭菌后,放置于24孔板中,并使其完全覆盖在孔底;并根据所组装的双分子层数的不同将其分成相应的组别,每组设置5个平行对照。
(6)将培养的在对数生长期的小鼠胚胎成骨前体细胞(MC3T3-E1)稀释至密度为5×104个/mL细胞悬液,分别取1mL的细胞悬液接种于步骤(4)中准备好的丝素蛋白膜及改性丝素蛋白膜的样本中。放入细胞培养箱中培养(37℃,5% CO2),每2天更换一次细胞培养基。培养5-7天后收获细胞,固定、冲洗、脱水后喷金,然后拍摄扫描电镜观察细胞粘附情况及细胞生长形态。
扫描电镜结果表明,将壳聚糖和胶原蛋白利用旋涂法组装在丝素蛋白膜的表面后,其表面孔隙有所减小,表面由光滑变得逐渐粗糙,表面纳米凸起增加,接种于其上的MC3T3-E1细胞伸展更加充分,可见更多的片状伪足和丝状伪足。
实施例3
(1)利用静电纺丝技术制备7wt%丝素蛋白/聚己内酯复合纳米纤维膜,其中丝素蛋白与聚己内酯的质量比为5:1。电纺参数包括:灌注速度为1.0mL/h,高压直流电源的电压为16kV,针头到接收板的距离为15cm;温度为27℃,湿度为50%。
(2)将所得丝素蛋白/聚己内酯复合纳米纤维膜用75%乙醇交联1小时,室温晾干后进一步真空干燥。
(3)用2%乙酸配制壳聚糖溶液(1mg/mL),磁力搅拌至完全溶解后用冰醋酸和氨水调节pH至5.0;配制I-型胶原蛋白水溶液(1mg/mL),磁力缓慢搅拌至完全溶解后用冰醋酸和氨水调节pH至5.0。
(4)将步骤(2)所得丝素蛋白膜首先置于壳聚糖溶液中浸泡20分钟,再用超纯水洗涤三次,每次3分钟,至此视为组装了0.5个双分子层;接着在胶原蛋白水溶液中浸泡20分钟,同样用超纯水洗涤三次,至此视为组装了1个双分子层;重复以上操作获得双分子层数0.5-10.5的表面改性丝素蛋白膜,室温下自然晾干进一步真空干燥。然后将各组样品拍摄扫描电镜,观察并比较表面改性前后生物膜表面形貌的变化。
(5)将改性后丝素蛋白膜用打孔器制成直径为6mm的圆片,紫外线照射2h进行灭菌后,放置于96孔板中,并使其完全覆盖在孔底;并根据所组装的双分子层数的不同将其分成相应的组别,每组设置5个平行对照。
(6)将培养的在对数生长期的人正常真皮成纤维细胞(NHDFs)稀释至密度为5×103个/mL细胞悬液,分别取200μL的细胞悬液接种于步骤(4)中准备好的丝素蛋白膜及改性丝素蛋白膜的样本中。放入细胞培养箱中培养(37℃,5% CO2),每2天更换一次细胞培养基。培养5-7天后收获细胞,固定、冲洗、脱水后喷金,然后拍摄扫描电镜观察细胞粘附情况及细胞生长形态。
本实施例所得壳聚糖-胶原蛋白/丝素蛋白/聚己内酯复合纳米纤维膜的形貌见图4,可见经过层层自组装改性以后,纳米纤维直径逐渐变大,表面逐渐粗糙,拥有很多纳米凸起。利用NHDFs进行细胞粘附试验,结果见图5。由图5可以看出层层自装改性以后的膜表面细胞体积较大,延展更加充分,表明其表面更利于细胞粘附,改性后的复合纳米纤维膜拥有更好的促进细胞增殖的能力。
实施例4
(1)配制浓度为10wt%聚己内酯溶液,溶剂为六氟异丙醇。磁力搅拌10h至聚己内酯完全溶解。
(2)取适量聚己内酯溶液在洁净玻璃板上刮膜,然后将膜及玻璃板置于通风橱中直到溶剂完全挥发。将膜取下后在蒸馏水中浸泡24h,随后在空气中晾干。
(3)配制溶菌酶水溶液(3mg/mL),完全溶解后调节pH至5.0;配制I-型胶原蛋白水溶液(2mg/mL),磁力搅拌至完全溶解后调节pH至5.0。
(4)首先取适量溶菌酶水溶液刮涂于步骤(1)即得的聚己内酯膜表面,自然晾干后,此为组装0.5个双分子层;随后取适量胶原蛋白水溶液刮涂,自然晾干,至此视为组装1个双分子层。重复以上操作获得双分子层数0.5-20的复合膜,室温下自然晾干进一步真空干燥。然后将各组样品拍摄扫描电镜,观察并比较表面改性前后生物膜表面形貌的变化。
(5)将改性后丝素蛋白膜用打孔器制成直径为16mm的圆片,紫外线照射2h进行灭菌后,放置于24孔板中,并使其完全覆盖在孔底;并根据所组装的双分子层数的不同将其分成相应的组别,每组设置5个平行对照。
(6)将培养的在对数生长期的人正常真皮成纤维细胞(NHDFs)稀释至密度为5×103个/mL细胞悬液,分别取200μL的细胞悬液接种于步骤(4)中准备好的丝素蛋白膜及改性丝素蛋白膜的样本中。放入细胞培养箱中培养(37℃,5% CO2),每2天更换一次细胞培养基。培养5-7天后收获细胞,固定、冲洗、脱水后喷金,然后拍摄扫描电镜观察细胞粘附情况及细胞生长形态。
扫描电镜结果表明,将溶菌酶和胶原蛋白利用刮涂法组装在聚己内酯膜的表面后,其表面孔隙减少,表面随着组装双分子层数的增加而逐渐粗糙,表面纳米凸起增加,接种于其上的NHDFs细胞伸展更加充分,可见更多的片状伪足和丝状伪足。
实施例5
(1)配制浓度为10wt%聚己内酯溶液,溶剂为六氟异丙醇。磁力搅拌10h至聚己内酯完全溶解。
(2)利用静电纺丝技术制备聚己内酯纳米纤维膜。电纺参数包括:灌注速度为1.0mL/h,高压直流电源的电压为16kV,针头到接收板的距离为15cm;温度为27℃,湿度为50%。
(3)配制2wt%壳聚糖溶液,溶剂2%冰醋酸,磁力缓慢搅拌至完全溶解;配制配制I-型胶原蛋白水溶液(2mg/mL),磁力缓慢搅拌至完全溶解。
(4)将壳聚糖溶液装入注射器中,开启高压电源,调至预定的电压。然后通过静电喷涂技术将壳聚糖固定于聚己内酯纳米纤维膜表面,喷涂时间为30s后待其自然晾干,至此为组装0.5个双分子层。电喷参数包括:灌注速度为1mL/h,高压直流电源的电压为20kV,针头到接收板的距离为9cm;环境温度为25℃,湿度为50%。
(5)以同样的方法及参数将胶原蛋白水溶液电喷固定于步骤(4)所得复合纳米纤维膜表面,至此视为组装1个双分子层。
(6)重复步骤(4)和步骤(5)即可获得双分子层0.5-20层的复合膜,室温自然晾干后进一步真空干燥。然后将各组样品拍摄扫描电镜,观察并比较表面改性前后生物膜表面形貌的变化。
(7)将改性后丝素蛋白膜用打孔器制成直径为6mm的圆片,紫外线照射2h进行灭菌后,放置于96孔板中,并使其完全覆盖在孔底;并根据所组装的双分子层数的不同将其分成相应的组别,每组设置5个平行对照。
(8)将培养的在对数生长期的人口腔黏膜上皮细胞(HIOEC)稀释至密度为5×103个/mL细胞悬液,分别取200μL的细胞悬液接种于步骤(4)中准备好的丝素蛋白膜及改性丝素蛋白膜的样本中。放入细胞培养箱中培养(37℃,5% CO2),每2天更换一次细胞培养基。培养5-7天后收获细胞,固定、冲洗、脱水后喷金,然后拍摄扫描电镜观察细胞粘附情况及细胞生长形态。
扫描电镜结果表明,经过层层自组装改性以后,聚己内酯膜纳米纤维直径逐渐变大,表面逐渐粗糙,拥有很多纳米凸起。接种在层层自装改性以后的生物膜表面HIOEC体积较大,延展更加充分,表明其表面更利于细胞粘附,改性后的复合膜拥有更好的促进细胞增殖的能力。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!