一种软骨修复支架及其制备方法与流程
本发明涉及软骨修复支架技术领域,特别涉及一种软骨修复支架及其制备方法。
背景技术:
随着运动水平及体育活动参与度的提高,关节软骨损伤越来越常见。关节软骨由于其特殊的解剖及组织学特点,损伤后自我修复能力差。此类损伤如果不能得到及时有效地治疗,可能会进展成骨性关节炎,给患者和社会带来沉重的负担。
目前常用的关节软骨损伤修复的方法主要有骨髓刺激技术(钻孔和微骨折)、骨软骨移植技术和软骨细胞移植技术等。
骨髓刺激技术(钻孔和微骨折)是利用释放的骨髓血形成的血凝块中含有的骨髓间充质干细胞分化形成新的软骨,修复缺损区域。该技术对软骨损伤具有一定效果,但是骨髓间充质干细胞分化产生的是纤维软骨,纤维软骨的生物学性能和力学性能均低于正常软骨,同时释放的血液无法在局部快速储存影响修复效果,尤其对于较大的缺损来说修复更加困难。
骨软骨移植技术包括自体软骨移植和同种异体软骨移植。这类技术能在一定程度上减轻患者疼痛、改善关节功能,然而有研究显示自体骨软骨移植有可能会导致供区细胞死亡,进而引起供区相应症状,同时还存在与正常软骨的契合性不理想、贮存期间细胞活性下降、供体移植物来源受限以及疾病传播的风险等问题,限制了其应用。
软骨细胞移植技术的缺点在于,该技术仍不可避免的面临着软骨细胞培养过程中的去分化,二次手术创伤及费用高昂等问题,而且与微骨折手术相比,该技术并不具有明显临床治疗优势。
因此,对软骨损伤修复的研究依然是临床研究中的难点和热点。
近年来,组织工程技术迅速发展,为关节软骨损伤修复带来了新的思路。组织工程技术主要通过支架、种子细胞和生物因子的相互作用和调控,产生新生组织,达到修复因创伤、疾病和老化引起的组织损伤和恢复生理功能的目的。组织工程技术使得关节软骨被认为是最有希望通过组织工程技术成功再生的组织和器官之一。
组织工程技术中软骨修复支架在设计上的要求是:1、生物降解不产生有毒物质;2、为新生组织提供良好的力学支持;3、降解速度与组织新生速度相匹配;4、能够具有孔隙性能,允许营养物质及代谢产物的弥散;5、匹配支架和正常软骨的抗压特性。
目前软骨组织工程常用的支架按制作材料分为:人工合成材料制成的支架和生物天然材料制成的支架。其中,人工材料制成的支架是通过人工构建制备出的具有特定理化性质、力学强度及材料构型的支架,在材料控制方面具有一定优势,但人工材料制成的支架生物相容性及降解性差。由天然材料制成的支架,尤其是通过生物方法制成的,能够促进正常细胞外基质的生成及重塑,并且天然材料制成的支架在生物相容性、生物降解及成软骨分化方面具有不可比拟的优势。
生物天然材料分为蛋白质类,如蚕丝蛋白、纤维蛋白、胶原蛋白和明胶等,和糖类,如琼脂糖、藻酸盐、透明质酸和壳聚糖等。其中,蚕丝蛋白由于具有来源丰富、生物相容性好、降解产物无毒副作用、力学性能良好以及价格低廉等优点,成为软骨修复的一种优良的支架材料;但是其降解速度过慢,一定程度影响软骨的再生修复。胶原是软骨基质的主要成分,它可以很好粘附和支持细胞的生长,但是动物来源的胶原往往有免疫源性。明胶作为胶原的替代材料,具有免疫源性低的特点,在组织工程领域取得良好的效果,然而明胶力学性能差,降解速度过快限制了其单独作为支架材料使用。
在研究中发现,除了支架材料本身的生物特性外,支架的空间结构,尤其是支架的三维结构和孔隙大小,也对软骨再生修复有重要意义。已有研究表明具有三维的立体结构的支架比单纯的平面结构更有利于软骨细胞分化和增殖。
微骨折技术利用种子细胞的多方向分化的潜能,结合生物天然材料制成的支架,再辅以细胞因子,修复软骨缺损,因其简单易行、费用低廉,在临床上具有广阔的前景。微骨折技术能使骨髓间充质干细胞(一种种子细胞)逸出,在支架中受到力学和生物因子刺激,向软骨细胞分化达到修复软骨缺损的目的。但是因微骨折后有效的骨髓间充质干细胞含量少、且易从软骨缺损区流出,不易保留在局部,致使新生软骨组织力学弱,不能经受关节的活动,影响了软骨修复的效果。
在实现本发明的过程中,发明人发现现有技术至少存在以下问题:传统的将生物天然材料直接冻干的方法无法实现精细化设计,制备出的支架为平面结构,不具有精细孔隙的三维立体结构,不但力学强度差,而且不利于骨髓间充质干细胞在支架上富集而保留在缺损区并分化成软骨细胞,形成新的软骨。
技术实现要素:
为解决上述技术问题,本发明提供一种软骨修复支架及其制备方法。技术方案如下:
第一方面,本发明提供了一种软骨修复支架的制备方法,包括:
利用3d打印技术打印软骨修复支架的模具;模具的底面具有多条相互平行的第一凸棱;与所述第一凸棱的上表面相连接的多条相互平行的第二凸棱;以及与所述第二凸棱的上表面相连接的多条相互平行的第三凸棱;所述第一凸棱的宽度为100-500μm;所述第二凸棱的宽度为100-500μm;所述第三凸棱的宽度为100-500μm;所述第一凸棱与所述第二凸棱交叉呈预设角度;所述第二凸棱与所述第三凸棱交叉呈预设角度;
配制蚕丝蛋白和明胶的混合溶液;
将所述混合溶液倒入模具中,使所述混合溶液的液面没过第三凸棱;
待所述混合溶液凝固成胶后,去除模具,得到软骨修复支架的材料主体;
对所述软骨修复支架的材料主体进行蛋白质变性处理;
对蛋白质变性处理后的软骨修复支架的材料主体进行化学交联处理,之后冷冻干燥,得到软骨修复支架。
优选地,所述第一凸棱与所述第二凸棱垂直;所述第二凸棱与所述第三凸棱垂直。
优选地,所述第一凸棱的宽度为300-500μm;所述第二凸棱的宽度为300-500μm;所述第三凸棱的宽度为300-500μm。
更优选地,所述第一凸棱、所述第二凸棱和所述第三凸棱的宽度均为400μm。
具体地,相邻两个第一凸棱之间的间隙为0.4-0.7mm;相邻两个第二凸棱之间的间隙为0.4-0.7mm;相邻两个第三凸棱之间的间隙为0.4-0.7mm。
具体地,所述混合溶液的液面高度比所述第一凸棱、所述第二凸棱和所述第三凸棱的高度之和高0.1-0.3mm。
优选地,所述蚕丝蛋白在所述混合溶液中的质量分数为2.3%-4.6%;所述明胶在所述混合溶液中的质量分数为2.3%-4.6%。
更优选地,所述蚕丝蛋白和所述明胶在所述混合溶液中的质量分数之和为6.9%。
具体地,所述蛋白质变性处理是将所述修复支架前体置于体积分数为95%的乙醇溶液中过夜。
具体地,所述对蛋白质变性处理后的软骨修复支架的材料主体进行化学交联处理为将所述蛋白质变性处理后的软骨修复支架的材料主体置于质量分数为0.3%-1%的京尼平溶液中室温过夜。
具体地,该制备方法还包括:对所述软骨修复支架进行消毒处理。
更优选地,该制备还包括:将骨髓间充质干细胞亲和多肽耦联到所述软骨修复支架的表面;所述骨髓间充质干细胞亲和多肽的氨基酸序列如seqidno:1所示。
具体地,将所述骨髓间充质干细胞亲和多肽耦联到所述软骨修复支架的表面的操作步骤为:
首先对所述软骨修复支架进行胺化处理;
再将胺化处理后的软骨修复支架在避光的条件下,浸泡于含有双异官能团交联剂的溶液中;
然后将含有双异官能团交联剂的软骨修复支架置于含有所述骨髓间充质干细胞亲和多肽的溶液中孵育;
最后对表面修饰有骨髓间充质干细胞亲和多肽的软骨修复支架进行冷冻干燥,制成耦联有骨髓间充质干细胞亲和多肽的软骨修复支架。
更具体地,所述对所述软骨修复支架进行胺化处理为将所述软骨修复支架浸泡于体积分数为5%-15%的乙二胺异丙醇溶液中,在温度为37℃的条件下,保持1小时以上。
更具体地,所述含有双异官能团交联剂的溶液为质量体积分数为5%-15%的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠的二甲基亚砜溶液;胺化处理后的软骨修复支架在所述双异官能团交联剂的溶液中的浸泡时间为1小时以上。
更具体地,所述含有骨髓间充质干细胞亲和多肽的溶液为骨髓间充质干细胞亲和多肽的浓度为0.05-0.15mg/ml的磷酸缓冲溶液;孵育的时间为1小时以上。
第二方面,本发明提供了一种利用上述任一种制备方法制备的软骨修复支架。
本发明实施例提供的技术方案的有益效果是:
1、本发明提供的一种软骨修复支架的制备方法,利用3d打印技术打印出具有三层精细凸棱结构的软骨修复支架的模具,从而制备出具有精细立体网状结构的软骨修复支架,具有更好的力学强度。
2、通过对模具的凸棱的宽度的设计,控制软骨修复支架的立体网状结构的孔隙的大小,并且混合溶液的液面没过第三凸棱,使软骨修复支架具有基座,形成致密的膜结构,有效地阻止骨髓释放的骨髓间充质干细胞流入关节腔,同时避免关节液对形成血凝块的冲刷,为骨髓间充质干细胞(bmsc)在支架上富集提供更多的附着位点和适合的生长微环境,使更多的骨髓间充质干细胞保留在缺损区而分化成软骨细胞,形成新的软骨,促进损伤软骨修复。
3、本发明的制备方法使用的软骨修复支架的材料为蚕丝蛋白和明胶的混合溶液,具有很好的生物相容性和可降解性,并且降解后不产生有毒物质。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明一示例性实施例示出的软骨修复支架的模具的立体图;
图2为本发明一示例性实施例示出的软骨修复支架的模具的剖视图;
图3为本发明一示例性实施例示出的软骨修复支架的模具的俯视图;
图4为本发明一示例性实施例示出的剪裁后的软骨修复支架的仰视图;
图5为图4的电镜图;
图6为本发明一示例性实施例示出的剪裁后的软骨修复支架的俯视图;
图7为图6的电镜图;
图8为本发明实施例3提供的软骨修复支架进行力学强度测定的结果图;
图9为本发明实施例3提供的软骨修复支架进行体外降解测定的结果图;
图10为本发明实施例3和实施例5提供的软骨修复支架进行cck-8测定的结果图;
图11为本发明实施例3和实施例5提供的软骨修复支架进行dna测定的结果图;
图12为本发明实施例3和实施例5提供的软骨修复支架进行粘多糖(gag)测定的结果图;
图13为本发明实施例7提供的激光共聚焦显微镜观测结果图;
图14为本发明实施例8提供的动物实验的软骨修复的结果图。
具体实施方式
为使本发明的技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
在第一方面,本发明提供了一种软骨修复支架的制备方法,包括:
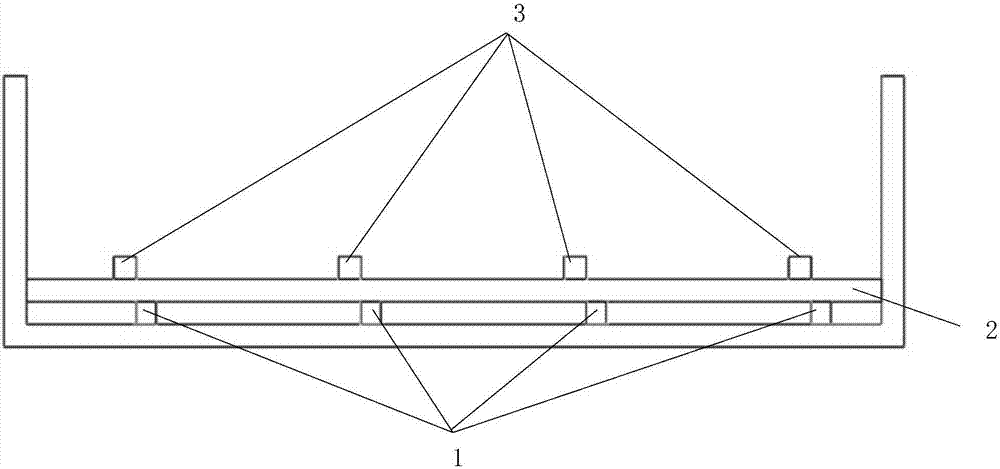
利用3d打印技术打印软骨修复支架的模具;如图1至3所示,模具为一个槽,槽的底面具有多条相互平行的第一凸棱1;与第一凸棱1的上表面相连接的多条相互平行的第二凸棱2;以及与第二凸棱2的上表面相连接的多条相互平行的第三凸棱3;第一凸棱1的宽度可以为100-500μm;第二凸棱2的宽度可以为100-500μm;第三凸棱3的宽度可以为100-500μm;第一凸棱1与第二凸棱2交叉呈预设角度;第二凸棱2与第三凸棱3交叉呈预设角度;
配制蚕丝蛋白和明胶的混合溶液;
将混合溶液倒入模具中,使混合溶液的液面没过第三凸棱;
待混合溶液凝固成胶后,去除模具,得到软骨修复支架的材料主体;
对软骨修复支架的材料主体进行蛋白质变性处理;
对蛋白质变性处理后的软骨修复支架的材料主体进行化学交联处理,之后冷冻干燥,得到软骨修复支架。
本发明提供的一种软骨修复支架的制备方法的有益效果:
1、本发明提供的一种软骨修复支架的制备方法,利用3d打印技术打印出具有三层精细凸棱结构的软骨修复支架的模具,从而制备出具有精细立体网状结构的软骨修复支架,具有更好的力学强度。
2、通过对模具的凸棱的宽度的设计,控制软骨修复支架的立体网状结构的孔隙的大小,并且混合溶液的液面没过第三凸棱,使软骨修复支架具有基座(致密的膜结构),有效地阻止骨髓释放的骨髓间充质干细胞流入关节腔,同时避免关节液对形成血凝块的冲刷,为骨髓间充质干细胞(bmsc)在支架上富集提供更多的附着位点和适合的生长微环境,使更多的骨髓间充质干细胞保留在缺损区而分化成软骨细胞,形成新的软骨,促进损伤软骨修复。
3、本发明的制备方法使用的软骨修复支架的材料为蚕丝蛋白和明胶的混合溶液,具有很好的生物相容性和可降解性,并且降解后不产生有毒物质。
本领域技术人员可以使用3d绘图技术绘制出软骨修复支架的模具的形状,再利用3d打印技术打印出软骨修复支架的模具。该模具可以为如图1所示的槽。该槽的底面具有多条平行的宽度为100-500μm的第一凸棱1,与第一凸棱1交叉的多条平行的宽度为100-500μm的第二凸棱2,与第二凸棱2交叉的多条平行的宽度为100-500μm的第三凸棱3。由于软骨修复支架的模具具有这样的立体交叉的网状结构,使得制备的软骨修复支架具有立体交叉的网状结构。将蚕丝蛋白和明胶的混合溶液倒入模具,并且混合溶液的液面没过第三凸棱,才能形成具有基座(致密的膜结构)和具有多个100-500μm×100-500μm的孔隙的立体网状结构。具有这样孔隙的三维立体网状结构的软骨修复支架不但力学强度高,而且可以有效地阻止骨髓释放的骨髓间充质干细胞流入关节腔,同时避免关节液对形成血凝块的冲刷,为骨髓间充质干细胞(bmsc)在支架上富集提供更多的附着位点和适合的生长微环境,使更多的骨髓间充质干细胞保留在缺损区而分化成软骨细胞,形成新的软骨,促进损伤软骨修复。
第一凸棱与第二凸棱交叉呈预设角度,0°<该预设角度≤90°,优选为45°~90°,更优选为60°~90°,进一步优选为75°~90°,为了加工方便等,最优选为90°。第二凸棱与第三凸棱交叉呈预设角度,0°<该预设角度≤90°,优选为45°~90°,更优选为60°~90°,进一步优选为75°~90°,为了加工方便等,最优选为90°。
如图1至图3所示,第一凸棱1与第二凸棱2可以为异面垂直,形成90°夹角;第二凸棱2与第三凸棱3可以为异面垂直,形成90°夹角;第一凸棱1与第三凸棱3平行;如图3所示,第三凸棱3不位于第一凸棱1的正上方,即二者的中心线所在的平面与水平面不垂直。当然,本领域技术人员也可以想到,第一凸棱与第二凸棱形成的夹角小于90°,第二凸棱与第三凸棱形成的夹角小于90°,并且形成的这两个夹角可以相同也可以不相同;第三凸棱可以位于第一凸棱的正上方,即二者的中心线所在的平面与水平面垂直,当然,第一凸棱与第三凸棱可以不平行。前述的第一凸棱、第二凸棱和第三凸棱的位置关系都可以形成本发明所需要的精细的立体交叉的网状结构,根据第一凸棱、第二凸棱和第三凸棱的宽度,使得根据该模具制备的软骨修复支架具有基座(致密的膜结构)和多个100-500μm×100-500μm的孔隙,促进损伤软骨修复。
需要说明的是,本发明的利用3d打印技术打印软骨修复支架的模具的步骤与配制蚕丝蛋白和明胶的混合溶液的步骤无明显先后逻辑顺序,本领域技术人员先操作这两个步骤中的哪个步骤都可以。
3d打印技术所使用的打印材料为本领域公知常识。为了获得完整无损的本发明的软骨修复支架,优选模具的材质为高强度的聚苯乙烯或聚苯丙烯等,并且聚苯乙烯和聚苯丙烯等可以溶解在d-柠檬烯中,从而将其去除掉,而且d-柠檬烯不破坏软骨修复支架的结构,并且不产生环境污染。本领域技术人员可以理解的是,在去除模具的过程,需要在低于明胶熔点的温度下进行,以防止明胶融化成液体,破坏软骨修复支架的结构,降低软骨修复支架的机械性能。
在实际情况下,将模具去除后,还可以使用体积分数95%的乙醇溶液对得到的软骨修复支架的材料主体进行反复清洗,通常清洗3至5次即可去除沾附于其上的d-柠檬烯。
本发明的软骨修复支架的孔隙对于骨髓间充质干细胞在软骨修复支架上富集和生长是非常重要的。为了得到更有利于骨髓间充质干细胞富集和生长的孔隙,本发明对软骨修复支架的模具的凸棱进行了一系列优化:
在软骨修复支架的模具的一种具体的实施方式中,如图1和图2所示,第一凸棱1与第二凸棱2异面垂直;第二凸棱2与第三凸棱3异面垂直。第三凸棱3位于第一凸棱1的正上方,即第一凸棱的中心线与第三凸棱的中心线位于同一平面上。
在软骨修复支架的模具的一种较佳的实施方式中,第一凸棱的宽度可以为300-500μm;第二凸棱的宽度可以为300-500μm;第三凸棱的宽度可以为300-500μm。本领域技术人员可以理解的是,第一凸棱、第二凸棱和第三凸棱的宽度可以相同也可以不同。
本发明所提及的长度、宽度和高度为人们通常意义上理解的长度、宽度和高度。以第一凸棱为例,如图2所示,第一凸棱1的长度是第一凸棱1的从前端到后端的距离,第一凸棱1的宽度是指第一凸棱从左边到右边的距离,第一凸棱1的高度是指第一凸棱1从上端到下端的距离。
对于软骨修复支架的模具的相邻两个第一凸棱之间的间隙可以为0.4-0.7mm;相邻两个第二凸棱之间的间隙可以为0.4-0.7mm;相邻两个第三凸棱之间的间隙可以为0.4-0.7mm,三者可以相同也可以不同。此处所提及的相邻两个第一凸棱之间的间隙是指,如图2所示,相邻两个第一凸棱1的位于左侧的第一凸棱1的最右边到位于右侧的第一凸棱1的最左边的距离。相邻两个第三凸棱之间的间隙的定义和相邻两个第二凸棱之间的间隙的定义与相邻两个第一凸棱之间的间隙的定义相同,请参见相邻两个第一凸棱之间的间隙的定义。
在软骨修复支架的模具的一种具体实施方式中,模具高度可以为0.5-1cm的槽,第一凸棱、第二凸棱和第三凸棱的宽度均可以为400μm;相邻两个第一凸棱之间的间隙可以为0.6mm;相邻两个第二凸棱之间的间隙可以为0.6mm;相邻两个第三凸棱之间的间隙可以为0.6mm;模具的侧壁的厚度可以为1mm,底面的厚度可以为1mm。
下面将对本发明公开的软骨修复支架的制备方法中涉及到的步骤进行详细说明。
配制蚕丝蛋白和明胶的混合溶液,为本领域常用的技术手段,即将蚕丝蛋白与明胶分别溶解于水中,形成各自的水溶液,在根据所需要的浓度进行配比。
由于在实际应用中,蚕丝蛋白的力学性能良好,但降解速率慢,而明胶虽然免疫原性很好,但力学性能稍差,并且降解速率快,为了使软骨修复支架具有很好的力学性能,并且其降解速率与软骨的再生速率相匹配,蚕丝蛋白在混合溶液中的质量分数为2.3%-4.6%,优选为2.3%;明胶在混合溶液中的质量分数为2.3%-4.6%,优选为4.6%,进一步地,蚕丝蛋白和明胶在混合溶液中的质量分数之和为6.9%。
本领域技术人员可以根据实际经验判断混合溶液何时凝固成胶。通常情况下混合溶液在模具中静止5分钟以上,即可实现混合溶液凝固成胶,也就是说形成软骨修复支架的材料主体。
由于蚕丝蛋白可以溶于水中,必须对其进行变性处理,又由于明胶在高温下融化,因此不易采用高温使蛋白质变性,并且还要考虑到毒性问题,因此,本发明选择将修复支架的材料主体置于体积分数为95%的乙醇溶液中过夜,过夜的时间通常可以为8-12小时,使蚕丝蛋白变性,经过蛋白质变性处理后,软骨修复支架的材料主体具有了一定的强度,并且在后续处理过程中蚕丝蛋白不会发生溶解现象。通过充分发挥蚕丝蛋白和明胶的各自优势,实现软骨修复支架力学和降解的性能优化。
在实际应用中,对软骨修复支架的材料主体进行化学交联处理之前,先用水清洗掉粘附于软骨修复支架的材料主体上的乙醇。无特殊说明,生物领域所使用的水通常为蒸馏水、双蒸水、去离子水或超纯水等。
对于蛋白质变性处理后的软骨修复支架的材料主体进行化学交联处理通常可以使用质量分数为0.01%-0.3%的碳化二亚胺溶液、质量分数为0.3%-1%的京尼平溶液或质量分数为0.1%-2%的戊二醛等,如可以将蛋白质变性处理后的软骨修复支架的材料主体置于质量分数为0.5%的京尼平溶液中室温过夜。过夜的时间通常可以理解为8-12小时。室温通常可以理解为18-25℃。
对化学交联处理后的软骨修复支架的材料主体进行冷冻干燥,具体可以使用冷冻干燥器机进行真空冻干处理,此为本领域常规的技术手段,本领域技术人员可以根据实际情况掌握,本发明在此不作赘述。
在使用本发明的软骨修复支架对损伤软骨进行修复之前,还要对该软骨修复支架进行消毒处理或在制备完成时对软骨修复支架进行消毒处理,并包装制成成品。
在本发明的一种优选实施方式中,该制备方法还包括:将骨髓间充质干细胞亲和多肽耦联到软骨修复支架的表面;骨髓间充质干细胞亲和多肽的氨基酸序列如seqidno:1所示,为eplqlkm,具有7个氨基酸,简称e7。该骨髓间充质干细胞亲和多肽可以有效地募集bmsc,且不具有种属特异性。该骨髓间充质干细胞亲和多肽性质稳定,可以从功能上更加有效地募集微骨折手术释放的骨髓间充质干细胞,并且使细胞保留在缺损区,为软骨缺损区提供更多的修复细胞。对于骨髓间充质干细胞亲和多肽的性质在公开号为cn102229646a专利文献中已有详细报道,本发明在此不作赘述。
本发明的骨髓间充质干细胞亲和多肽为人工合成的序列,由北京中科亚光生物科技有限公司合成。采用固相法在聚乙二醇(peg-ps)树脂上合成骨髓间充质干细胞亲和多肽,合成的大致步骤为:
a.在氮气环境下,用二环己基碳二亚胺活化3-马来酰亚胺基丙酸;
b.将活化的3-马来酰亚胺基丙酸与多肽分子连接在树脂上的氨基酸残基反应,使马来酰亚胺顺丁烯二酰亚胺耦联在多肽末端;用95%的三氟乙酸将马来酰亚胺顺丁烯二酰亚胺活化的多肽分子从peg-ps树脂上切下,冻干后分装。
将骨髓间充质干细胞亲和多肽耦联到软骨修复支架的表面的操作步骤为:
首先对软骨修复支架进行胺化处理;
再将胺化处理后的软骨修复支架在避光的条件下,浸泡于含有双异官能团交联剂的溶液中;
然后将含有双异官能团交联剂的软骨修复支架置于含有骨髓间充质干细胞亲和多肽的溶液中孵育;
最后对表面修饰有骨髓间充质干细胞亲和多肽的软骨修复支架进行冷冻干燥,制成耦联有骨髓间充质干细胞亲和多肽的软骨修复支架。
下面将对骨髓间充质干细胞亲和多肽耦联到软骨修复支架的表面的操作步骤进行详细说明。
对软骨修复支架进行胺化处理可以为将软骨修复支架浸泡于体积分数为5%-15%的乙二胺异丙醇溶液中,在温度为37℃的条件下,保持1小时以上。
含有双异官能团交联剂的溶液可以为质量体积分数为5%-15%的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠的二甲基亚砜溶液;胺化处理后的软骨修复支架在双异官能团交联剂的溶液中的浸泡时间为1小时以上。
含有骨髓间充质干细胞亲和多肽的溶液为骨髓间充质干细胞亲和多肽的浓度为0.05-0.15mg/ml的磷酸缓冲溶液(0.01m,ph值为7.2),优选为骨髓间充质干细胞亲和多肽的浓度为0.1mg/ml;孵育的时间为1小时以上。
在第二方面,本发明还提供了利用上述任一种制备方法制备的软骨修复支架。
从上述对软骨修复支架的模具的表述中可知,本发明通过限定软骨修复支架的模具的结构来确定所制备的软骨修复支架的结构。通过控制混合溶液的液面没过第三凸棱,即混合溶液的液面高于第一凸棱、第二凸棱和第三凸棱的高度之和,使得该软骨修复支架具有基座(致密的膜结构)。本发明的软骨修复支架的模具的结构与软骨修复支架的结构是相反的,即模具的凸棱对应软骨修复支架的凹槽。
在软骨修复支架的一种具体实施方式中软骨修复支架具有基座(如图4所示)以及形成在基座上的多个凹槽,凹槽之间交叉形成孔隙(如图6所示),基座是由混合溶液的液面没过第三凸棱所形成的致密的膜结构;该凹槽的形状与上述模具的凸棱形状相对应。如图6所示,软骨修复支架的上端面是将混合溶液倒入模具后,与模具的底面相贴合的面。具有此种结构的软骨修复支架可以有效地阻止骨髓释放的骨髓间充质干细胞流入关节腔,同时避免关节液冲刷形成的血凝块,为骨髓间充质干细胞(bmsc)在支架上富集提供更多的附着位点和适合的生长微环境,使更多的骨髓间充质干细胞保留在缺损区而分化成软骨细胞,形成新的软骨,促进损伤软骨修复。
软骨修复支架的电镜图如图5和图7所示,该软骨修复支架具有基座的三维立体网状的空间结构,三维立体网状结构经由3d打印设计形成,由棱和中间的孔隙结构组成,可以为关节软骨损伤修复中的骨髓间充质干细胞提供更加适宜的生存微环境;基座与三维立体网状结构连接,其结构为一层致密的蚕丝蛋白-明胶,在修复关节软骨损伤时可以有效的阻挡微骨折所释放的骨髓血液进入关节腔,将软骨修复所需要的骨髓间充质干细胞有效的保留在三维立体网状结构和顶面膜结构中,从而更加有效的促进损伤软骨的修复。
根据混合溶液的液面高度比第一凸棱、第二凸棱和第三凸棱的高度之和高0.1-0.3mm,可知本发明的软骨修复支架的基座的厚度约为0.1-0.3mm。
在实际应用中,可以根据所需要修复的软骨的厚度来设计本发明的软骨修复支架的高度。
该软骨修复支架由蚕丝蛋白和明胶的混合溶液制成,可简称为sfg支架。蚕丝蛋白和明胶都是天然生物材料具有良好的生物相容性、可降解性和无毒性。优选地,蚕丝蛋白在混合溶液中的质量分数为2.3%-4.6%;明胶在混合溶液中的质量分数为2.3%-4.6%。在此质量分量范围内获得软骨修复支架的降解速率与软骨再生的速率相匹配。更优选地,蚕丝蛋白和明胶在混合溶液中的质量分数之和为6.9%。
在软骨修复支架的一种优选实施方式中,软骨修复支架的表面耦联有骨髓间充质干细胞亲和多肽,该骨髓间充质干细胞亲和多肽的氨基酸序列如seqidno:1所示,为eplqlkm,简称为e7多肽。具有e7多肽的软骨修复支架可特异性地募集微骨折手术释放的骨髓间充质干细胞,并且使细胞保留在缺损区,为软骨缺损区提供更多的修复细胞。
实施例1提取蚕丝蛋白
在烧杯中装入2l的超纯水,煮沸,并称取4.24g的na2co3缓慢倒入其中;将5g的蚕茧(广东桑蚕基地)用剪刀剪碎后,倒入沸水中,浸泡30min并充分搅拌,使蚕茧中的丝胶蛋白全部溶解在水中,以去除蚕茧中的丝胶蛋白;
煮沸30min后,取出棉絮状的丝素蛋白,用超纯水冷却,挤出多余的水分,之后将其放入1l的烧杯中,加入超纯水搅拌30min,之后挤出水分,重复2-3遍;
之后取出纯净的丝素蛋白即为蚕丝蛋白,摊开在铝箔上,通风处过夜晾干;
按照蚕丝蛋白:libr(溴化锂)=1:4的重量比,称取相应质量的libr,并用水配成9.3m的libr水溶液。将libr水溶液倒入蚕丝蛋白上,使蚕丝蛋白被溶液完全覆盖;
将混合溶液加热到60℃,保持4h,使其完全溶解,呈透明琥珀色。随后用超纯水透析3天,并将透析后的溶液低温离心20min(4℃,9000rpm);
移取上清液并再次离心,随后将获得的蚕丝蛋白置于4℃中密封保存。
对于蚕丝蛋白的获取并不涉及本发明的发明点,本发明仅提供一种可以获得较高纯度的蚕丝蛋白的获取方法,本领域技术人员可以通过其他的常规手段获得或从市面上购买。
实施例23d模具的设计与制备
利用autocad软件绘制软骨修复支架的模具。其中,模具的高度为1cm;模具的侧壁和底面的厚度均为1mm。模具的底面具有28条相互平行的第一凸棱;与第一凸棱异面垂直,并与其上表面相连接的28条相互平行的第二凸棱;以及与第二凸棱异面垂直,并与其上表面相连接的28条相互平行的第三凸棱;共形成3层凸棱,第一凸棱、第二凸棱和第三凸棱的宽度和高度均为0.4mm,长度为3cm;
随后使用桌面式3d打印机(先临三维,中国)将软骨修复支架的模具打印出来,所选用的线材为hips(高强度聚苯乙烯,1.75mm)(闪铸科技,中国)。
实施例3软骨修复支架的制备
将蚕丝蛋白和明胶在混合溶液中各自的质量分数0%和6.9%(第一组)、2.3%和4.6%(第二组)、4.6%和2.3%(第三组)混合在一起,充分搅拌后,在明胶成胶前将其倒入模具中(混合溶液应没过第三凸棱,保证形成致密的顶面膜结构),置于60℃的真空干燥箱中10min,使得模具被复合溶液完全填充,随后取出;
待混合溶液在室温下凝固成胶后(5min),将模具放入d-柠檬烯(九橙实业,中国)中3天,将模具除去;
除去模具的过程中需保持温度低于明胶融化温度,且定时换液。待模具被除去后,冻干得到的多孔支架,并再次放入柠檬烯中除去残余的模具。
之后使用95%乙醇洗去d-柠檬烯,清洗干净后将支架放入95%乙醇中过夜,使蚕丝蛋白变性固化;
处理完成后,将支架放入质量分数为0.5wt%的京尼平(天丰生物科技,中国)水溶液中,室温过夜,使明胶和京尼平完成交联。取出经过交联后的支架,用超纯水清洗后,用环钻(φ4.00mm)将大块的交联后的支架钻成圆柱状的支架,进行冷冻干燥,得到圆柱状的软骨修复支架,在使用前对其进行钴60照射消毒。
由于软骨修复支架的材质为蚕丝蛋白和明胶,因此,本发明的软骨修复支架也可以称为蚕丝蛋白-明胶支架(sfg支架)。
实施例4对实施例3制备的蚕丝蛋白-明胶支架进行力学强度和体外降解测定
取实施例3制备的三种蚕丝蛋白-明胶支架,利用力学压缩仪器测量压缩形变与强度,计算三种蚕丝蛋白-明胶支架的力学强度;如图8所示,随着蚕丝蛋白浓度的增加蚕丝蛋白-明胶支架的力学强度增强。
分别对上述三种蚕丝蛋白-明胶支架称重,然后浸入pbs(0.01m,ph=7.2)中,在第7天、第14天和第21天取出sfg,冷冻干燥后并称量,计算体外降解率。如图9所示,单纯使用明胶制备的软骨修复支架迅速降解,而将蚕丝蛋白在混合溶液中的质量分数提高到4.6%时则降解速率明显减慢,为匹配软骨的再生速率,选择第二组作为最终的蚕丝蛋白-明胶支架浓度比,进行后续试验。
其中,第一组、第二组和第三组分别表示蚕丝蛋白和明胶在混合溶液中各自占的质量分数分别为0%和6.9%、2.3%和4.6%、4.6%和2.3%。
实施例5将e7多肽耦联到浓度比为第二组的蚕丝蛋白-明胶支架上
用异丙醇配制体积分数为10%乙二胺溶液,取浓度比为第二组的蚕丝蛋白和明胶支架浸泡在溶液内(37℃,1小时),进行胺化处理。
双蒸水冲洗3次;将10mg双异官能团交联剂(4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠,sulfo-smcc)溶解进100μl二甲基亚砜(dimethylsulfoxide,dmso)溶液内,现配现用。避光环境中浸泡胺化后的蚕丝蛋白-明胶支架1小时。
配制0.1m乙二胺四乙酸(edta)的磷酸缓冲溶液(pbs)(0.01m,ph=7.2),用该缓冲液冲洗蚕丝蛋白-明胶支架3次;骨髓间充质干细胞亲和多肽(e7多肽)溶解在pbs中(浓度为:0.1mg/ml),加入到支架中,室温孵育2小时,使e7多肽充分耦联到支架上,实现e7多肽对蚕丝蛋白-明胶支架的表面修饰,冷冻干燥24小时后备用。
在使用前,对耦联有e7多肽的蚕丝蛋白-明胶支架进行钴60照射消毒。
实施例6cck-8测定及dna和粘多糖(gag)测定
将1.5×105个/ml的骨髓间充质干细胞分别接种于蚕丝蛋白-明胶支架(sfg支架)和耦联有e7多肽的蚕丝蛋白-明胶支架(sfg-e7支架)之上,加入完全培养基培养,分别在第1、3、5、和7天时弃去培养基,pbs缓冲液冲洗2次后,加入含10微升cck-8工作液的新培养基200微升。37℃、5%co2条件下孵化2小时。取100微升上述溶液加入到96孔板中,测定od值,结果如图10所示,蚕丝蛋白-明胶支架(sfg支架)和耦联有e7多肽的蚕丝蛋白-明胶支架(sfg-e7支架)均可以良好的支持骨髓间充质干细胞的增殖,并且耦联有e7多肽的蚕丝蛋白-明胶支架优于蚕丝蛋白-明胶支架。
将1.5×105个/ml的骨髓间充质干细胞分别接种于sfg和sfg-e7之上,加入完全培养基培养,在第7、14和21天时弃去培养基,pbs冲洗2次后,加入200微升木瓜蛋白酶60℃条件下过夜,支架和细胞完全溶解;
取20微升上述溶解液滴入96孔板后,加入200微升的hoechst33258溶液或200微升的dmmb溶液,37℃孵化30分钟后测定od值。测定dna条件:激发光360nm,发射光460nm。测定gag条件:520nm处测定od值。根据dna和gag标准曲线校正实际值,结果分别如图11和图12所示,两种支架均可以良好的支持体外骨髓间充质干细胞的成软骨分化,且耦联有e7多肽的蚕丝蛋白-明胶支架对促进体外骨髓间充质干细胞的成软骨分化的效果更好。
实施例7激光共聚焦显微镜观察骨髓间充质干细胞在软骨修复支架上的生长与分布
将密度为1.5×105个/ml的骨髓间充质干细胞的培养基滴种于sfg和sfg-e7之上,37℃孵育1小时;
向6孔板里添加1mlmem-α培养基(不含核苷酸和脱氧核苷酸),37℃孵箱培养;
培养3天后,取出支架,pbs冲洗2次;
质量体积分数为4%的多聚甲醛固定,罗丹明-鬼笔环肽(160nm,2ml)避光染细胞骨架4小时;
pbs冲洗2次,hoechst33258(1:800,2ml)复染细胞核1小时;
pbs冲洗2次,激光共聚焦显微镜观测骨髓间充质干细胞分布情况。
图13为激光共聚焦显微镜观测结果图。图13显示了骨髓间充质干细胞在两种支架上的生长与分布情况。两种支架均可以良好地支持干细胞的粘附和生长,耦联有e7多肽的蚕丝蛋白-明胶支架可以粘附更多的骨髓间充质干细胞,说明耦联有e7多肽的蚕丝蛋白-明胶支架更利于骨髓间充质干细胞富集。
实施例8动物实验—兔子体内软骨缺损修复
取成年雄性新西兰大白兔,体重2.9±0.3kg。随机分为3组:mf组(单纯微骨折),sfg组(sfg支架+微骨折),sfg-e7组(耦联有e7多肽的sfg支架+微骨折)。
对3组新西兰大白兔通过耳缘静脉注射3﹪戊巴比妥进行麻醉,使用剂量为1ml/kg。兔成功麻醉后,取仰卧位,固定头部和四肢,暴露右后膝关节,将手术区备皮,碘伏常规消毒,酒精脱碘,铺无菌手术单;屈曲膝关节,由膝前正中入路切开皮肤,继续由内侧髌旁入路打开关节腔;伸膝—外翻髌骨—屈膝,暴露股骨滑车。以4mm直径角膜环由股骨滑车表面垂直钻入(深度为1mm),并取出钻下的圆柱形软骨栓,制成股骨滑车的全层软骨缺损区。手术操作须仔细,避免损伤滑膜、肌肉、半月板等组织。
mf组:软骨缺损区仅做微骨折处理(孔径0.5mm,孔间距1mm,深度以有血液和脂滴渗出为标准),不做任何支架的填充。
sfg组:首先在软骨缺损区行微骨折术,然后将sfg支架植入股骨滑车的软骨缺损处,填满缺损,逐层缝合关节腔。
sfg-e7组:首先在软骨缺损区行微骨折术,然后sfg-e7支架植入股骨滑车的软骨缺损处,填满缺损,逐层缝合关节腔。
手术后各组兔的膝关节不做任何外固定处理;肌肉注射青霉素80万u/只,连续3天;标准动物饲料喂养,室温保持15-20℃,洁净饮水,分笼饲养,自由活动。
微骨折术6月后对上述3组兔的软骨损伤的愈合情况进行检测。结果如图14所示:
微骨折组(mf):大体观察发现微骨折术后6个月仍未能填满软骨缺损区,缺损周边有骨质增生表现;核磁共振成像(mri)及苏木素-伊红(he)染色显示软骨缺损未填充,甲苯胺蓝染色显示软骨缺损区修复组织内蛋白多糖的含量较低,为纤维软骨修复,ⅱ型胶原免疫组化染色显示组织内ⅱ型胶原含量低。
蚕丝蛋白-明胶支架(sfg)组:大体上,缺损有填充,但不完全;mri可见软骨不连续,软骨下骨有囊表;he及甲苯胺蓝染色见缺损填充,gag和ⅱ型胶原含量略低。
耦联有e7多肽的蚕丝蛋白-明胶支架(sfg-e7)组:大体形态与正常软骨相似,缺损填充完全,软骨有光泽;mri结果可见软骨连续,软骨下骨无囊变等异常;he、甲苯胺蓝和免疫组化显示缺损填充良好,与周边组织结合紧密,gag和ⅱ型胶原含量接近正常软骨。
兔子体内软骨缺损修复实验说明,本发明提供的耦联有骨髓间充质干细胞亲和多肽的软骨修复支架和未耦联有骨髓间充质干细胞亲和多肽的软骨修复支架均能促进软骨修复,其中耦联有骨髓间充质干细胞亲和多肽的软骨修复支架促进软骨修复的效果更好。
以上仅是为了便于本领域的技术人员理解本发明的技术方案,并不用以限制本发明。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>北京大学第三医院
<120>一种软骨修复支架及其制备方法
<160>1
<170>patentinversion3.3
<210>1
<211>7
<212>prt
<213>artificial
<220>
<223>人工合成的氨基酸序列
<400>1
gluproleuglnleulysmet
15
- 还没有人留言评论。精彩留言会获得点赞!