DC‑CIK细胞和抗PD‑1抗体组合物及其用途的制作方法
本发明属于免疫学、肿瘤微环境和肿瘤免疫治疗学领域,涉及DC-CIK(树突状细胞活化的细胞因子诱导的杀伤细胞)细胞和抗PD-1(程序性死亡受体1)抗体组合物的用途,具体涉及DC-CIK细胞和抗PD-1抗体组合物用于制备免疫药物的用途。
背景技术:
随着工业化的发展,环境污染的加重,以及吸烟、不良生活和饮食习惯等外界因素的作用,肿瘤在全世界范围内的发病率逐年增高,已成为我国城市居民的首位死亡原因。
近年来,由于手术、化疗、放疗和免疫治疗等综合治疗手段的发展,肿瘤已渐渐成为一种可控性疾病。尤其是免疫治疗被认为是一种能彻底治愈肿瘤的终极方法。Science杂志于2013年将“肿瘤免疫治疗”评为当年十大科学突破,并在2014年继续将“肿瘤免疫治疗”列为2015年最值得关注的领域之一。而在肿瘤免疫治疗领域,免疫检查点阻断剂:抗PD-1抗体、抗PD-L1抗体和抗CTLA-4抗体在临床肿瘤免疫治疗中的应用最值得关注,它们显著延长了晚期恶性黑色素瘤、肺癌和结肠癌等患者的生存期。免疫检查点阻断剂主要是通过阻断肿瘤组织内T细胞抑制性信号通路,从而使T细胞持续性活化,达到杀伤肿瘤的目的。目前FDA已经批准了抗CTLA-4和抗PD-1抗体用于临床治疗晚期恶性黑色素瘤和肺癌等肿瘤。然而,在实际临床应用过程中,免疫检查点阻断剂也受到一些挑战:一是由于免疫检查点阻断剂是通过阻断机体内免疫应答的“刹车系统”,诱导机体免疫系统对肿瘤细胞的持续攻击,因而患者应用后常产生较强的自身免疫反应,从而引起较强的毒副作用;二是需要足量足疗程的应用,患者难以承受高额的治疗费用。
而作为一种高效低毒的过继性细胞免疫治疗方法,CIK细胞和DC-CIK细胞在多种血液系统肿瘤和实体肿瘤中均显示出强大的抗肿瘤作用。CIK细胞是一种由外周血单个核细胞在体外经多种细胞因子诱导扩增培养的多克隆T细胞,主要以CD3+CD56+、CD3+CD8+、和CD3-CD56+细胞亚群为主,其中CD3+CD56+细胞亚群是其主要活性细胞群,通过MHC非限制性的NK细胞样的作用杀伤肿瘤细胞。DC-CIK细胞是在CIK细胞培养到一定阶段,与自体或异体DC细胞混合培养后获得的一群异质性T细胞,因其含有更高水平的CD3+CD8+和CD3+CD56+细胞亚群,并具有更强的IFN-γ分泌能力,所以DC-CIK细胞的体内外杀伤肿瘤细胞的能力显著强于CIK细胞。近年来临床研究发现CIK细胞在肝癌、肺癌、结直肠癌、胃癌、宫颈癌、肾癌和白血病等多种肿瘤中有治疗作用,能改善患者的生存质量,提高患者的生存时间。与CIK细胞相比,DC-CIK细胞由于其制备过程较前者复杂,生产成本较高,因而目前有关DC-CIK细胞的临床研究相对较少。目前的研究证实,肿瘤患者常规治疗后,继续接受CIK细胞和DC-CIK过继性细胞免疫治疗,仅部分患者能从中获益,而且临床缓解力很低。因此,需要开展新的免疫治疗方法的临床研究以进一步提高肿瘤患者的治疗效果。
目前,已有部分研究报道将免疫检查点阻断剂与过继性细胞免疫治疗联合应用提高CIK细胞杀伤能力的方法。例如,Poh等人在体外用细胞杀伤实验证实,阻断KIR、LAG-3和PD-1等免疫检查点后,CIK细胞对急性髓性细胞白血病细胞的杀伤能力增强;但这种杀伤能力增强的作用在另外一个免疫检查点CTLA-4阻断后没有观察到(Poh SL,et al.Cancer ImmunolImmunother.2016;65(5):525-36)。同样,Dai等人也发现阻断PD-1后,CIK细胞对胃癌细胞的杀伤能力显著增强(Dai C,et al.Oncotarget.2016;7(9):10332-44)。由于与CIK细胞在细胞亚群分布和细胞因子分泌等诸多不同,目前尚无研究报道DC-CIK细胞与免疫检查点阻断剂联用的治疗作用,也无相关研究报道DC-CIK细胞和抗PD-1抗体组合物在人体应用的具体方法,治疗效果和毒副作用。
技术实现要素:
本发明的目的在于提供一种DC-CIK细胞和抗PD-1抗体组合物的用途。
本发明所述的用途是:DC-CIK细胞和抗PD-1抗体组合物用于制备治疗癌症或延缓癌症进展的免疫药物中的用途。
根据本发明所述的用途的进一步特征,所述免疫药物含有1-1.5×1010个DC-CIK细胞与10mg抗PD-1抗体。
根据本发明所述的用途的进一步特征,所述免疫药物在输入人体前在37℃恒温箱孵育30分钟。
优选地,所述的癌症包括:肝癌、肾癌、结直肠癌、肺癌、膀胱癌、乳腺癌、卵巢癌或鼻咽癌等。
优选地,所述的癌症是处于中晚期阶段。
本发明的另一个目的在于提供一种用于治疗癌症或延缓癌症进展的联合免疫组合物。
本发明所述的用于治疗癌症或延缓癌症进展的联合免疫组合物是由有效剂量的DC-CIK细胞和抗PD-1抗体组成。
根据权利要求1所述的组合物的进一步特征,所述组合物含有1-1.5×1010个DC-CIK细胞与10mg抗PD-1抗体。
根据权利要求1所述的组合物的进一步特征,所述DC-CIK细胞与抗PD-1抗体在组合后在37℃恒温箱孵育30分钟。
优选地,所述的癌症包括:肝癌、肾癌、结直肠癌、肺癌、膀胱癌、乳腺癌、卵巢癌或鼻咽癌等。
优选地,所述的癌症是处于中晚期阶段。
本发明的有益效果在于:DC-CIK细胞具有增强的活化、增殖和/或细胞裂解活性,虽然DC-CIK细胞具有杀伤肿瘤细胞的活性,但由于DC-CIK细胞可表达PD-1等抑制性分子,回输到机体内后,与肿瘤细胞表达的PD-L1分子作用,降低了DC-CIK细胞的杀伤活性,限制了它们治疗肿瘤的疗效。而在本发明所述的组合物中,DC-CIK细胞经抗PD-1抗体处理后再回输到体内,经体内外实验证实:显著增强了DC-CIK细胞杀伤肿瘤的活性,提供其治疗肿瘤的疗效。在一些实施方案中,肿瘤患者获得明显的疗效,出现肿瘤消失,部分反应或疾病稳定。
附图说明
图1是DC-CIK细胞和抗PD-1抗体组合物治疗方案。(A)根据入组标准和排除标准,37个晚期癌症患者符合入组条件,入组接受DC-CIK细胞和抗PD-1抗体组合物治疗,其中6人因失访脱落,最终有31人可以进行进一步的临床评价。(B)开始接受联合免疫治疗前1个月,患者停止使用所有其他肿瘤特异性治疗,开始治疗前14天抽血进行DC-CIK细胞制备,回输当天DC-CIK细胞与抗PD-1抗体在37℃恒温箱孵育30分钟后,静脉回输到患者体内,每个患者至少进行8个疗程的联合免疫治疗,前4个疗程为每周1次,后4个疗程为2周1次,部分患者在疗程结束后可以继续接受联合免疫组合物治疗,直至肿瘤进展。
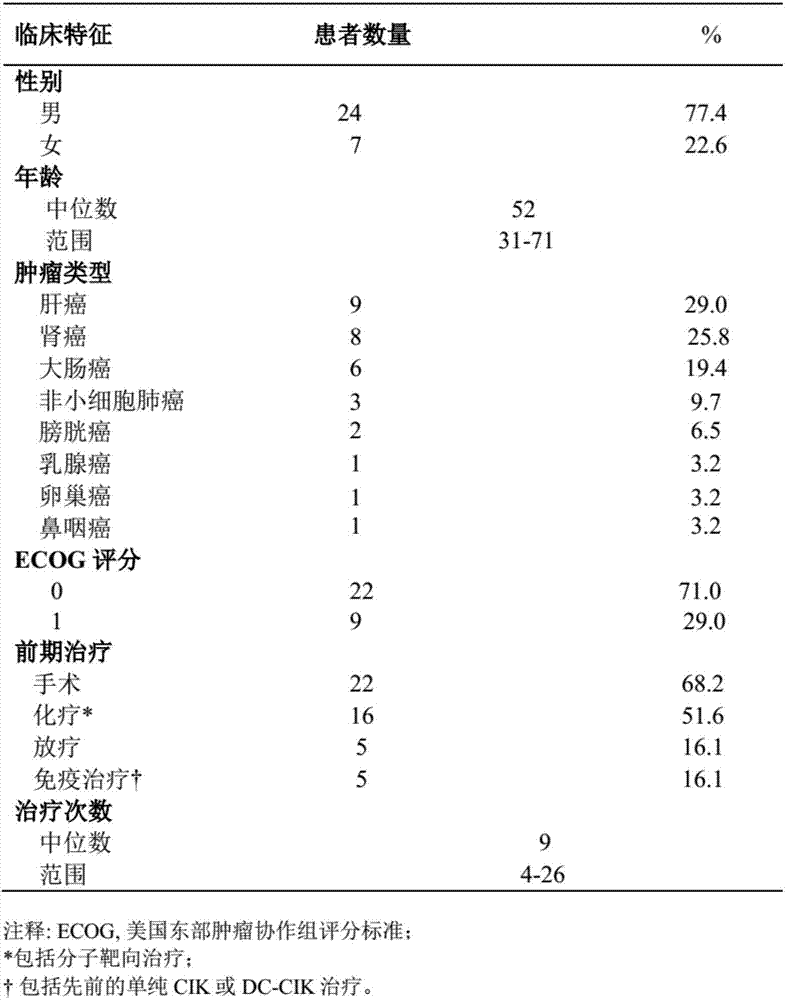
图2显示入组患者临床基本特征。可评价的31例癌症患者中,有24位是男性,7位女性,中位年龄是52岁(31-71岁)。治疗的癌症包括9例肝癌、8例肾癌、6例结直肠癌、3例肺癌、2例膀胱癌,乳腺癌、卵巢癌、鼻咽癌各1例。这些患者均在手术、化疗、放疗等综合治疗后失败,开始接受联合免疫治疗,接受联合免疫组合物治疗的次数至少8次,最多26次,中位的治疗次数为12次。
图3显示DC-CIK细胞和抗PD-1抗体组合物治疗晚期肿瘤患者的临床效果。(A)31例患者接受DC-CIK细胞和抗PD-1抗体组合物治疗后,按照RECIST评价标准,比较靶病灶较基线水平的变化。(B)患者的总生存和无疾病进展生存时间。(C)患者接受DC-CIK细胞和抗PD-1抗体组合物治疗后,1/31例获得完全缓解,7/31例患者获得部分缓解,疾病有效率达到22.5%;总共有20/31例患者疾病无进展,疾病控制率达到64.5%。
图4显示DC-CIK细胞和抗PD-1抗体组合物治疗前后病灶大小。病例1是一例肝癌患者接受联合免疫治疗,肝内病灶消失;病例2是一例肾癌患者肺转移病灶,接受联合免疫治疗后,肺内大部分病灶消失,剩余病灶明显缩小。
图5显示DC-CIK细胞和抗PD-1抗体组合物治疗晚期肿瘤患者的毒副作用。患者接受联合免疫治疗,仅2人出现了3或4级毒性反应,说明该方法安全性好。
图6显示体外实验分析DC-CIK细胞和抗PD-1抗体组合物的治疗作用机制。(A)制备的DC-CIK细胞表型检测。(B)DC-CIK细胞和抗PD-1抗体组合物对原代肿瘤细胞的杀伤作用。(C)原代肿瘤细胞杀伤前后PD-L1表达情况。(D)杀伤前后DC-CIK细胞分泌IFN-γ的水平。
具体实施方式
本发明所述的将DC-CIK细胞和抗PD-1抗体组合物用于制备治疗癌症或延缓癌症进展的免疫药物的实验步骤如下。
入组常规治疗失败经病理确诊的晚期癌症患者,并在开始接受联合免疫治疗前1个月停用所有其他特异性肿瘤治疗,从治疗前14天开始抽取患者外周血,用密度梯度离心法分离出单个核细胞(PBMC),采用Quanta-007无血清培养基悬浮分离的PBMC,以1×108/ml的数量铺于75cm2的培养瓶中,置于CO2培养箱中静置培养1小时。轻轻晃动培养瓶,吸出未贴壁的淋巴细胞,置于新的培养瓶中,加入1000U/ml IFN-γ培养24小时,第2天加入100ng/ml OKT、1ng/ml IL-1α和1000U/ml IL-2继续培养,隔天加入含IL-2的新鲜培养基。贴壁细胞加入含1000U/ml GM-CSF,400U/ml IL-4以及Cellgro无血清DC培养液进行培养。隔天全量补新鲜培养液一次,第5天收获未成熟DC细胞(iDC),加入OK-432(0.1KE/ml)和IFN-γ(1000U/ml)培养24小时后,即可获得成熟的DC细胞。第7天将成熟的DC细胞与上述CIK细胞按照1:20的比例混合培养7天,即可获得DC-CIK细胞。经离心、洗涤后DC-CIK细胞,用含10mg抗PD-1抗体的200ml的生理盐水重悬,孵育30分钟后,将DC-CIK细胞经静脉回输给患者。患者至少接受8个疗程的联合免疫组合物治疗,前4个疗程为每周1次,后4个疗程为2周1次,若患者肿瘤稳定可以继续接受该方案治疗,直至肿瘤进展。
本发明入组了37个晚期癌症患者,其中6人由于失访脱落,在接受联合免疫组合物治疗的31人中,按照RECIST评价标准,有1人获得完全缓解,6人获得部分缓解,13人获得疾病稳定,总的有效率达到22.5%,疾病控制率为64.5%,中位总生存时间为288天,中位无进展生存时间为162天。只有2人出现3或4级不良反应,分别是发热和白细胞减少。这些结果说明本发明所述的联合免疫组合物治疗方法,能显著提高疾病控制率,延长晚期癌症患者生成时间,与单独使用抗PD-1抗体(按美国上市的抗PD-1抗体的使用说明:肿瘤患者按2mg/kg体重使用,通常一次用量超过100mg)相比,具有用量少(每次10mg),副作用小,更好的安全性和有效性。
实施例1:临床试验的设计
本实施例开展的是I期单臂的前瞻性临床试验研究,有关病例选择了常规治疗(手术、放化疗、靶向治疗)后进展的晚期难治性恶性肿瘤患者,观察用DC-CIK细胞和抗PD-1抗体组合物治疗这些患者临床应用的安全性、可行性和有效性。
(一)研究对象的纳入:
1)入选标准:
①晚期难治性恶性肿瘤患者,包括原发性肝细胞癌、肾透明细胞癌、膀胱癌、结肠癌、非小细胞肺癌等;②年龄18-75岁;③预计生存期>3个月;④ECOG评分0或1分;⑤心肺肝肾功能正常;⑥充足的骨髓储备能力及凝血酶原正常;⑦育龄妇女在给药开始前尿妊娠试验阴性,并同意在试验期间直至最后一次随访采取有效的避孕措施者;⑧按照RECIST标准有可评价病灶;⑨自愿参加本实验并签署知情同意书。
2)排除标准:
①使用CTLA-4或PD-1/PD-L1阻断剂治疗过的患者;②年龄<18或>75岁;③妊娠期或哺乳期妇女,处于生育期而未采取有效避孕措施者;④有严重心、脑血管疾病,不能控制的高血压和糖尿病、肾功能不全或衰竭者;⑤HIV阳性或其它免疫缺陷疾病;⑥有自身免疫性疾病患者;⑦有器官移植史的患者在4周内使用过大剂量糖皮质激素或其它免疫抑制剂的患者;⑧有明确感染或者发热的患者;⑨T细胞淋巴瘤、骨髓瘤患者。
3)退出标准:
①医师根据患者情况认为终止治疗对患者有益;②患者主动要求退出或未按研究计划实施;③试验期间需要进行本方案以外的其它化疗、手术治疗或试验性药物治疗;④发生严重不良事件,并发症或特殊生理变化,不宜接受继续治疗。
(二)治疗方案:
用DC-CIK细胞和抗PD-1抗体组合物治疗前一个月,入组的患者停止所有肿瘤相关治疗,制备的DC-CIK细胞与抗PD-1抗体在37℃恒温箱内孵育30分钟后回输,每周一次,至少回输4次为前一阶段治疗;完成后进行一次评估,如果患者有效或稳定,可考虑进行第2个阶段的维持治疗,即2周一次的方案,共4次;完成第8个疗程后,经评估,如果病情稳定或有疗效,可继续考虑2周一次的维持治疗,并每3个月进行临床评估。
(三)结果分析:
1)患者纳入及基本临床资料分析:
参见图1A所示,患者纳入分析结果显示,临床试验的设计中共纳入了37例晚期难治性恶性肿瘤患者,进行DC-CIK细胞和抗PD-1抗体组合物治疗后有6例患者失访,最终剩余31例患者进行后续分析研究。如图2所示,31例患者中包括男性24例,女性7例。其中原发性肝细胞癌9例、肾透明细胞癌8例、大肠癌6例、非小细胞肺癌3例、膀胱癌2例,以及乳腺癌、卵巢癌、鼻咽癌各1例。
2)患者治疗方案设计结果:
参见图1B所示,研究纳入的患者按照设计的治疗方案进行DC-CIK细胞和抗P D-1抗体组合物治疗。图2的分析结果显示,31例患者的治疗至少都达到一个疗程(至少回输8次),前4个疗程为每周1次,后4个疗程为2周1次,回输次数范围是8-26次,中位回输次数为12次。
实施例2:DC-CIK细胞和抗PD-1抗体组合物治疗癌症的具体方法
确定研究对象后,本实施例将抽取患者外周血分离PBMC,进行DC-CIK细胞的培养,与抗PD-1抗体共孵育后回输到患者体内进行治疗。
(一)材料和方法:
1)DC-CIK细胞和抗PD-1抗体组合物的制备
认真核对抽血物品和患者相关信息后,抽取患者外周血50ml,800g×8min离心后,收集自体血浆,56℃水浴灭活30min,放置4℃15min后,800g×8min,取上清血浆(约20ml)待用。在超净工作台正常工作状态下,将离心收集后的外周血细胞用0.9%注射用生理盐水稀释至60ml,用2支一次性50ml灭菌离心管,贴上标签,标明患者姓名、性别、年龄和住院号等相关信息,分别加入20ml淋巴细胞分离液,用密度梯度离心法分离获得外周血单个核细胞(PBMC)。
采用Quanta-007无血清培养基悬浮分离的PBMC,以1×108/ml的数量铺于75cm2的培养瓶中,置于CO2培养箱中静置培养1小时。轻轻晃动培养瓶,吸出未贴壁的淋巴细胞,置于新的培养瓶中,加入1000U/ml IFN-γ培养24小时,第2天加入终浓度为100ng/ml OKT、1ng/ml IL-1α和1000U/ml IL-2继续培养,隔天加入含IL-2的新鲜培养基。上述贴壁细胞加入含1000U/ml GM-CSF,400U/ml IL-4以及Cellgro无血清DC培养液进行培养。隔天全量补新鲜培养液一次,第5天收获未成熟DC细胞(iDC),加入OK-432(0.1KE/ml)和IFN-γ(1000U/ml)培养24小时后,即可获得成熟的DC细胞。第7天将成熟的DC细胞与上述CIK细胞按照1:20的比例混合培养7天,即可获得DC-CIK细胞。
第14天或第15天,收集DC-CIK细胞于一次性无菌离心杯(250ml)中,2300rpm×8min离心收集,并用生理盐水洗涤2次,将细胞用含5ml 20%的人血白蛋白的0.9%注射用生理盐水中重悬。制备好的细胞悬液留样2ml于玻璃安瓿中,封安瓿口,贴上标签,注明病人姓名、性别、年龄、住院号和治疗项目,4℃存放三个月备查。将制备好的DC-CIK细胞与含有10mg抗PD-1抗体的200ml生理盐水于37℃、5%CO2培养箱内孵育30min后,送病区进行回输。
2)流式细胞仪分析DC-CIK细胞表型
收集一小部分上述制备好的DC-CIK细胞,流式细胞仪检测CD3+、CD3+CD4+、CD3+CD8+、CD3+CD56+及CD3-CD16+CD56+细胞的比例。其中CD3+CD8+细胞应不低于60%,CD3+CD56+细胞应不低于10%。
(二)结果分析:
1)DC-CIK细胞和抗PD-1抗体组合物的质量检测结果:
物理检查:外观为乳白色细胞悬浊液,装量约为200ml;
细胞数量:采用白细胞计数法,每例患者细胞数都不少于1×1010个细胞,范围约为1-1.5×1010个;
细胞存活率:用台盼蓝染色检测,细胞存活率都不低于95%;
无菌、无支原体和无内毒素检测:按现行版《中国药典》生物制品试验规程对回输细胞进行细菌、支原体及内毒素检测,结果均为阴性。
2)流式细胞仪分析结果:
采用流式细胞仪检测分析DC-CIK细胞后,CD3+、CD3+CD4+、CD3+CD8+、CD3+CD56+及CD3-CD16+CD56+细胞的比例。结果参见图6(A)所示,30例患者的DC-CIK细胞中,CD3+T淋巴细胞平均比例达到94.1%,而主要成分为CD3+CD8+T淋巴细胞,平均占的比例为66.1%;CD3+CD56+T淋巴细胞,平均占的比例为20.2%。
实施例3:DC-CIK细胞和抗PD-1抗体组合物治疗癌症的临床疗效和安全性评价
(一)疗效评估:
纳入本临床试验研究的患者都有可测量的目标病灶。病灶的评价是通过CT影像学在基线时(治疗前一个月)、治疗阶段(每3个月)以及治疗结束后的随访阶段(每6个月)进行。
1)疗效评估标准
采用实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)进行疗效评价。先确定所有可测量的目标病灶在基线时的长度总和,作为有效缓解记录的参考基线,然后根据治疗阶段或治疗结束后的随访阶段目标病灶相对基线水平的变化评价病情有效缓解情况。
2)有效缓解的标准
缓解的标准包括CR:所有目标病灶消失;PR:基线病灶长径总和缩小大于等于30%;SD:基线病灶长径总和有缩小但未达PR或有增加但未达PD;PD:基线病灶长径总和增加超过20%或出现新病灶。
3)随访
从治疗开始后,对每例患者进行随访记录,并每3个月复查一次以确定患者的进展情况,复查内容包括血常规、血生化、肿瘤标记物、肝肾功能、血电解质、甲状腺功能和影像学评估等。到肿瘤缓解稳定或进展后进入生存随访,每半年一次。根据患者的治疗时间与初次进展时间及死亡时间计算患者的无进展生存期(DFS)及总生存期(OS)。
(二)安全性评估:
本实验研究的安全性评估主要监测DC-CIK细胞和抗PD-1抗体组合物治疗相关的不良反应,即在治疗的过程中及治疗后的随访中,观察记录患者出现的治疗相关毒副作用,并根据美国国立癌症研究所不良事件通用术语标准(NCI-CTCAE)第4.0版进行分级。DC-CIK细胞和抗PD-1抗体组合物治疗相关的不良反应主要包括:发热、疲劳、贫血、肝肾功能异常、过敏反应、白细胞减少及甲状腺功能减退等。
(三)结果分析:
1)DC-CIK细胞和抗PD-1抗体组合物治疗的临床客观反应评估结果
通过CT影像学对患者目标病灶进行评价,确定患者治疗的有效缓解情况。参见图3A所示,31例晚期难治性恶性肿瘤患者中,20例获得有效缓解(64.5%),其中1例获得CR(3.2%),6例获得PR(19.4%),13例获得SD(41.9%)。其余11例出现进展(35.5%)。参见3C所示,在各类肿瘤患者中,肝癌与肾癌患者的治疗效果较好。其中一位64岁男性肝细胞性肝癌患者,经多次TACE和RFA治疗后,患者病灶较前仍有进展,经过8个疗程DC-CIK细胞和抗PD-1抗体组合物治疗后,患者肝内病灶消失。另一例33岁多发性肺、左锁骨上淋巴结及椎体转移的肾癌患者,经过8个疗程DC-CIK细胞和抗PD-1抗体组合物治疗后,患者多处转移病灶明显缩小或消失,特别是肺部的多发转移灶大部分消失,一些病灶明显缩小(图4)。这些结果表明DC-CIK细胞和抗PD-1抗体组合物治疗晚期难治性恶性肿瘤患者安全有效。
2)患者的总生存期与无进展生存期分析结果
根据对每例患者进行的随访记录,统计所有患者的总生存期与无进展生存期。参见图3B所示,截止目前的随访时间,31例患者的中位总生存时间为288天,中位无进展生存时间为162天,其中8例患者死亡,11例患者病情进展。
3)安全性评估结果:
参见图5所示,17例在治疗过程中出现治疗相关不良反应(54.8%),主要为发热、疲劳及白细胞减少等。其中,15例患者表现1或2级不良反应(88.2%),只有2例表现3或4级不良反应(11.8%),表明DC-CIK细胞和抗PD-1抗体组合物治疗晚期难治性恶性肿瘤患者是安全的。
实施例4:DC-CIK细胞和抗PD-1抗体组合物对肿瘤细胞的杀伤作用
为了验证DC-CIK细胞和抗PD-1抗体组合物治疗在临床应用中的有效性,本发明进一步在体外检测DC-CIK细胞和抗PD-1抗体组合物对患者自体肿瘤细胞的杀伤作用。
(一)材料和方法:
1)自体肿瘤细胞的分离和培养
收集肾癌患者新鲜肿瘤组织置于净化台内,在平皿中用无钙、镁PBS清洗2-3次。组织块剪碎后放入三角烧瓶中,加入比组织量多30-50倍的10%Ⅳ型胶原酶消化液,并置于37℃水浴锅轻微震荡1-2小时。待组织分散成细胞团或单个细胞后,终止消化。1500r/min离心5min,其弃上清后加入RPMI 1640培养基清洗,并通过100um的细胞滤网滤去尚未充分消化尚未组织块。1500r/min离心后弃上清,加入一定量的RPMI 1640培养基重悬离心下来的单个肿瘤细胞,并用含20%胎牛血清的RPMI 1640培养基置于37℃、5.0%CO2培养箱进行培养。
2)自体DC-CIK细胞体外杀伤实验
用0.25%胰蛋白酶消化液消化上述患者自体肿瘤细胞,1500r/min离心后重悬细胞,并用移液管将细胞吹打均匀。用计数板计数细胞悬液浓度后,配制成实验需要的细胞浓度10x 104细胞/ml。使用RTCA系统进行体外杀伤检测。首先在E-Plate 16的孔中加入50μl培养基后放到RTCA Station上检测基线水平。然后取出E-Plate 16检测板,在孔中加入100μl混合均匀的细胞悬液,使每孔中细胞数目为10x 103细胞/well。将E-Plate 16置于超净台中室温放置30min后放到培养箱中的RTCA Station上,进行细胞增殖的实时动态检测。第二天,将50ul DC-CIK细胞和抗PD-1抗体组合物或单纯DC-CIK细胞悬液按照3:1、10:1、30:1的效靶比加入E-Plate 16检测板内,另设一孔不加效应细胞的靶细胞孔作为对照组。将E-Plate16检测板置于RTCA检测台上实时监测,比较两组细胞对肿瘤细胞的杀伤作用。最后杀伤效果的计算公式为:杀伤率=(对照组CI值-实验组CI值)/对照组CI值。
3)DC-CIK细胞杀伤活性以及肿瘤细胞表达PD-L1水平变化的检测
利用Cytomics FC500流式细胞仪分析抗PD-1抗体对DC-CIK细胞分泌IFN-γ水平的影响,以判断细胞的杀伤活性。同时检测肿瘤细胞表达PD-L1的水平,分析肿瘤细胞对DC-CIK细胞杀伤活性的影响。对于DC-CIK细胞杀伤活性分析,细胞经50ng/mL PMA,500ng/mL ionomycin和10ng/mL brefeldin A刺激4h后,收集细胞于抗CD3/IFN-γ抗体中孵育30min后,上机检测。对于肿瘤细胞表达PD-L1水平分析,将细胞于抗PD-L1抗体中孵育30min后,上机检测。
(二)结果分析:
1)自体DC-CIK细胞体外杀伤自体肿瘤细胞实验结果
参见图6B所示,TC19代表治疗后达到PR的肾癌患者,TC17代表治疗后为SD的肾癌患者,TC13代表治疗后出现PD的肾癌患者。选取24小时时间点RTCA系统检测的杀伤结果进行统计分析,结果表明,治疗后获得有效缓解患者的自体DC-CIK细胞对自体肿瘤细胞具有明显的杀伤作用,而且加入抗PD-1抗体后能显著增强DC-CIK细胞杀伤肿瘤细胞的作用。对于未获得疾病缓解的患者,其自体DC-CIK细胞无论有加用抗PD-1抗体,都不具有明显杀肿瘤作用。
2)DC-CIK细胞杀伤活性以及肿瘤细胞表达PD-L1分析结果
进一步探讨获得有效缓解患者的自体DC-CIK细胞经抗PD-1抗体处理后表现更强抗肿瘤活性的机制发现,自体肿瘤细胞在受到DC-CIK细胞杀伤的同时,会上调PD-L1的表达,进而负反馈性通过PD-1/PD-L1通路抑制DC-CIK细胞的免疫活性。参见图6C所示,获得有效缓解的两例患者TC19与TC17,其肿瘤细胞在受到自体DC-CIK细胞杀伤后明显上调了PD-L1的表达水平,分别从21.9%和3.9%,增加到97%(98.1%)和34.2%(41%)。而未获得疾病缓解的患者TC13,未受到自体DC-CIK细胞的明显杀伤而没有明显上调PD-L1的表达,仅从2.7%,增加到4.4%(5.6%)。此外,参见图6D所示,对DC-CIK细胞杀伤活性的检测结果表明,TC19与TC17患者自体DC-CIK细胞在杀伤过程中受到肿瘤细胞上调的PD-L1负性免疫调节而减少了IFN-γ的分泌,分别从18.5%和11.8%,减少到10.7%和6.8%。而经抗PD-1抗体处理后,DC-CIK细胞不受PD-L1的影响,继续分泌更多的IFN-γ,分别从20.8%和12.5%,增加到39.6.7%和21.9%,从而发挥更强的杀伤肿瘤细胞的活性。TC13患者自体的DC-CIK细胞则不明显分泌IFN-γ的分泌。
- 还没有人留言评论。精彩留言会获得点赞!