核医学与磁共振双模态显像药物、药物前体、制备方法及应用与流程
本发明属于分子影像药物、放射性药物和核医学技术领域。具体地,涉及一种核医学与磁共振双模态显像药物前体。此外,本发明还涉及核医学与磁共振双模态显像药物前体的制备方法、核医学与磁共振双模态显像药物以及其在制备叶酸受体阳性肿瘤显像药物中的应用。
背景技术:
近期的研究报告指出,2012年全球新增1400万癌症病人并有820万病人死亡。其中,中国新增307万癌症病人并约有220万人死亡。癌症的早期诊断和有效治疗可以降低大约每年1/3至1/2(即240~370万)癌症病人的死亡。肿瘤早期诊断和靶向治疗药物的设计是利用各种肿瘤生物标志物(如特异性受体、单克隆抗体及其片段、多肽等)来实现的。
在许多肿瘤(如卵巢癌、宫颈癌、子宫内膜癌、肺癌、肾癌、乳腺癌、结肠癌和脑癌)中叶酸受体被过度表达。叶酸受体是与这些肿瘤密切相关的靶标。人们已开展了以叶酸受体为靶向的各种肿瘤放射性显像药物的研究。然而,无论是spect还是pet的单模态显像技术,尽管它们具有高灵敏度等优点,但其空间分辨率较低。而磁共振显像(mri)具有空间分辨率高、无辐射但灵敏度低的特点。目前,融合了两种显像模态的spect/ct、pet/ct和pet/mri已在临床中得到了应用。pet/mri或spect/mri双模态显像技术既具有高灵敏度和高软组织对比度,而且与pet/ct或spect/ct相比,还显著降低了辐射剂量,已成为具有广阔应用前景的双模态医学影像技术。全球约有70台pet/mri已投入了临床应用。
以叶酸受体为靶向的mri肿瘤造影剂已有一些研究,用于pet/mri或spect/mri的双模态显像药物也正在研发中,但到目前为止,在国内外还没有获得官方批准、可在临床中使用的pet/mri或spect/mri双模态显像药物。
技术实现要素:
基于上述技术问题,本发明首次提供了一种核医学与磁共振双模态显像药物前体,该前体经过放射性金属核素标记后得到pet/mri或spect/mri双模态显像药物,采用该药物作为显像药物的活性成分,可以清晰有效地检测出叶酸受体阳性肿瘤。
第一方面,提供一种核医学与磁共振双模态显像药物前体,该前体以超顺磁氧化铁纳米粒子为核心,在外层包覆生物相容性材料和双功能螯合剂,叶酸通过生物相容性材料与超顺磁氧化铁纳米粒子连接。
结合第一方面,在第一方面的一种可能的实现方式中,采用3-氨基丙基三乙氧基硅烷对超顺磁氧化铁纳米粒子表面进行修饰,生物相容性材料和双功能螯合剂均通过3-氨基丙基三乙氧基硅烷与超顺磁氧化铁纳米粒子连接。
结合第一方面或上述某些可能的实施方式,在第一方面的一种可能的实现方式中,上述生物相容性材料包括分子量为400-20000的聚乙二醇。
结合第一方面或上述某些可能的实施方式,在第一方面的一种可能的实现方式中,上述双功能螯合剂包括1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸。
结合第一方面或上述某些可能的实施方式,在第一方面的一种可能的实现方式中,该前体如下所示:
其中,n=9~454。
第二方面,提供一种核医学与磁共振双模态显像药物,由第一方面的任一种核医学与磁共振双模态显像药物前体经放射性金属核素标记得到。
结合第二方面,在第二方面的一种可能的实现方式中,上述放射性金属核素包括64cu、60cu、61cu、62cu、68ga、66ga、86y、44sc、89zr、45ti、55co、114min、94mtc、67ga、111in、177lu和99mtc中的任一种。
第三方面,提供第二方面任一种核医学与磁共振双模态显像药物在制备叶酸受体阳性肿瘤显像药物中的应用。
第四方面,提供第一方面的一种可能的实现方式中的核医学与磁共振双模态显像药物前体的制备方法,包括以下步骤:
(a)使用3-氨丙基三乙氧基硅烷对超顺磁氧化铁纳米粒子进行表面修饰,得到spions-aptes,
(b)叶酸与聚乙二醇偶联得到fa-peg,
其中,n=9~454;
(c)spions-aptes和fa-peg反应得到spions-peg-fa,再与1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸偶联,得到dota-spions-peg-fa,即核医学与磁共振双模态显像药物前体。
结合第四方面,在第四方面的一种可能的实现方式中,fa-peg通过以下步骤得到:叶酸与n-羟基琥珀酰亚胺偶联得到fa-nhs;fa-nhs与nh2-peg-cooh反应得到fa-peg,
上述的核医学与磁共振双模态显像药物前体,以超顺磁氧化铁纳米粒子为核心,在外层包覆生物相容性材料、叶酸和双功能螯合剂,在应用时,将此前体采用放射性金属核素,例如64cu、94mtc等进行标记,从而首次得到一种全新的双模态显像药物。该类药物体外稳定性好,应用于叶酸受体阳性肿瘤检测时,在肿瘤中有很高的初始摄取,很好的瘤/血比值,较长的滞留时间,并且,纳米粒子对肿瘤具有明显的主动靶向作用,能够有效适用于mri显像和pet或spect显像。
附图说明
图1是本发明实施例1中化合物fa-peg的1hnmr图。
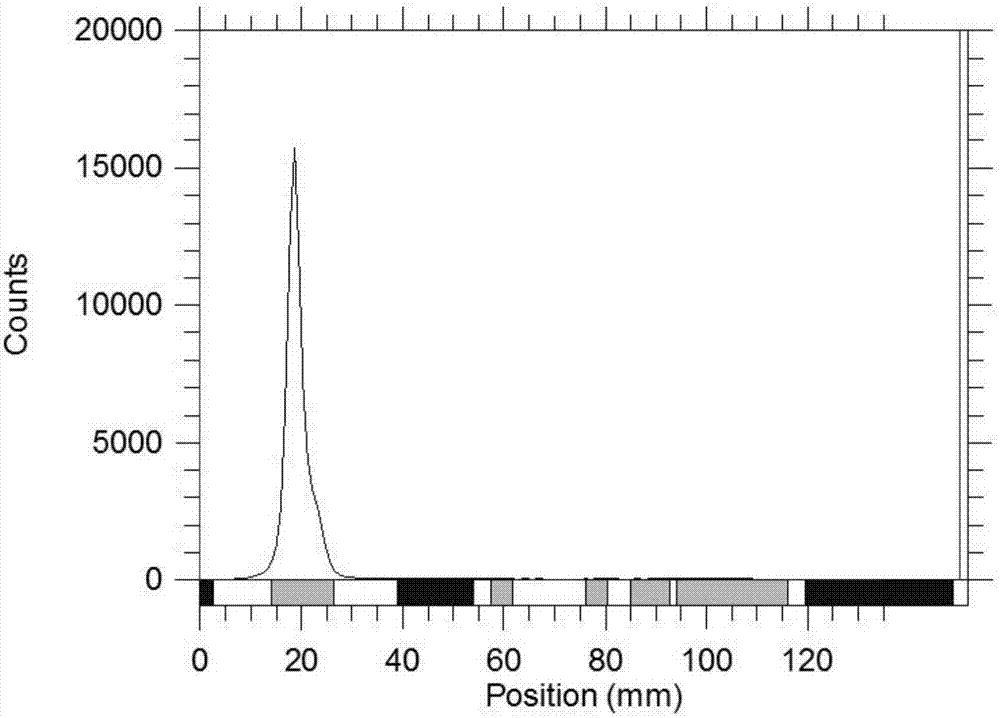
图2是本发明实施例1步骤8中纯化后标记物的放射性tlc图。
图3是本发明实施例4中(a)空白组,(b)阻断组,(c)dota-spions-peg-fa组各自的mri图。
图4是本发明实施例5中(a)64cu-dota-spions-peg-oh组,(b)阻断组,(c)64cu-dota-spions-peg-fa组各自的pet/ct图。
图5是本发明实施例1中化合物64cu-dota-spions-peg-fa的结构示意图。
具体实施方式
为更清楚的对本发明技术方案予以阐述,下面将结合具体实施方式对本发明的技术方案进行进一步阐述:
在一个具体的实施方式中,提供一种核医学与磁共振双模态显像药物前体,该前体以超顺磁氧化铁纳米粒子为核心,在外层包覆生物相容性材料和双功能螯合剂,叶酸通过生物相容性材料与超顺磁氧化铁纳米粒子连接。,
超顺磁氧化铁纳米粒子(spions)作为mri成像组分,将偶联了叶酸的生物相容性材料连接到spions上,以叶酸作为靶向基团,双功能螯合剂连接在spions上,用于连接作为pet或spect显像成分的放射性金属核素,在应用时,将此前体采用放射性金属核素进行标记,从而首次得到一类全新的双模态显像药物,包括pet/mri双模态显像药物和spect/mri双模态显像药物。该药物体外稳定性好,应用于叶酸受体阳性肿瘤检测时,在肿瘤中有很高的初始摄取,很好的瘤/血比值,较长的滞留时间,并且,纳米粒子对肿瘤具有明显的主动靶向作用,能够有效适用于mri显像和pet或spect显像。
生物相容性是指生命体组织对非活性材料或活性材料产生反应的一种性能,一般是指材料与宿主之间的相容性。生物相容性材料一般是指与宿主相容性较好的材料。
进一步地,采用3-氨基丙基三乙氧基硅烷(aptes)对超顺磁氧化铁纳米粒子表面进行修饰,生物相容性材料和双功能螯合剂均通过3-氨基丙基三乙氧基硅烷与超顺磁氧化铁纳米粒子连接。
进一步地,生物相容性材料包括分子量为400-20000的聚乙二醇,在实施例中采用的聚乙二醇分子量为2000。分子量为400-20000的聚乙二醇,其与叶酸及超顺磁氧化铁纳米粒子的连接原理和方式与分子量为2000的聚乙二醇的连接原理和方式相同,因此,本发明实施例中举例分子量为2000的聚乙二醇已足以支持权利要求书中对聚乙二醇分子量的限定范围。上述聚乙二醇也包括聚乙二醇衍生物,其中分子量的限定是对纯聚乙二醇的分子量的限定,不包括两端的其他基团。
进一步地,双功能螯合剂包括1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)。通过上述的双功能螯合剂,放射性金属核素可以牢固地被连接到超顺磁氧化铁纳米粒子上,从而得到完整的核医学与磁共振双模态显像药物rm-dota-spions-peg-fa,其中rm为放射性金属核素。双功能螯合剂还可以采用1,4,8,11-四氮杂环十四烷-1,4,8,11-四乙酸(teta)或1,4,7-三氮杂环壬烷-n,n',n”-三乙酸(nota)等;优选地采用dota,这是由于以上几种双功能螯合剂均属于多氮杂环类,dota是现今较常用的经典多氮杂环螯合剂。
在另一个具体实施方式中,提供一种核医学与磁共振双模态显像药物前体,该前体如下所示:
其中,n=9~454。
前述的任一种核医学与磁共振双模态显像药物前体经放射性金属核素标记得到双模态显像药物;放射性金属核素包括64cu、60cu、61cu、62cu、68ga、66ga、86y、44sc、89zr、45ti、55co、114min、94mtc、67ga、111in、177lu和99mtc中的任一种;rm不同,得到的双模态显像药物的作用不同,优选地采用64cu或99mtc进行标记,当dota-spions-peg-fa连接99mtc时,得到spect/mri双模态显像药物;当连接64cu时,则得到pet/mri双模态显像药物。
核医学与磁共振双模态显像药物可以用于制备叶酸受体阳性肿瘤显像药物,进而用于叶酸受体阳性肿瘤的诊断。叶酸受体阳性肿瘤显像药物中,还可以包括必要的医用辅料和/或医用溶剂。
在另一个具体实施方式中,提供一种核医学与磁共振双模态显像药物前体的制备方法,包括以下步骤:
(a)使用3-氨丙基三乙氧基硅烷对超顺磁氧化铁纳米粒子进行表面修饰,得到spions-aptes;
(b)叶酸与聚乙二醇偶联得到fa-peg;
(c)spions-aptes和fa-peg反应得到spions-peg-fa,再与1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸偶联,得到dota-spions-peg-fa,即核医学与磁共振双模态显像药物前体。
其中,fa-peg通过以下步骤得到:叶酸与n-羟基琥珀酰亚胺(nhs)偶联得到fa-nhs;fa-nhs与nh2-peg-cooh反应得到fa-peg。
通过上述合成方法,再经过放射性金属核素的标记,就可以得到粒径可控、磁学性质稳定、放化纯高的pet/mri双模态显像药物。
上述制备方法中步骤(a)、(b)、(c)的标号不用于限定制备方法中各个步骤的顺序,方法中的各个步骤,只要逻辑上合理,各步骤的顺序可以变化。例如,上述的步骤(a)或(b)同时独立进行;又例如,步骤(b)可以放在步骤(a)与之前进行。
采用化学共沉淀法制备超顺磁氧化铁纳米粒子,合成过程中,反应条件对最终纳米粒子形貌影响很大。本专利的具体实施方式中通过调整反应物投料比例、反应液ph值、滴加碱液及搅拌速率、改变反应温度,尽量降低纳米粒子的成核速度,从而对氧化铁纳米粒子的粒径分布进行有效的控制。
通过对氧化铁纳米粒子的表面修饰,使其表面带有活性基团,可同时与药物、抗体、基因、酶和细胞等多种物质结合,为其实现多功能化创造条件。本专利具体实施方式中采用有机小分子物质3-氨基丙基三乙氧基硅烷(aptes)和有机物高分子聚合物(peg)进行表面修饰,既为纳米粒子表面提供了可与有机物连接的活性基团,又减少了纳米粒子之间的聚集,使其具有良好的热稳定性和水溶性,生物相容性也大大增加。
此外,在合成上述双模态显像药物前体的基础上,还摸索和优化了64cu的标记和纯化条件,建立了相关的质控方法,开展了小动物体内生物学评价、pet和mri显像研究。
下面通过实施例进一步说明上述具体实施方式,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中其他未做特别说明的试剂、原料和仪器设备均可通过商业途径直接购得。
实施例1pet/mri双模态显像药物前体dota-spions-peg-fa以及pet/mri双模态显像药物64cu-dota-spions-peg-fa的制备
1.spions的制备
合成反应在n2保护下进行。将549mgfecl3·6h2o和282mgfeso4·7h2o溶于40ml除氧水中,搅拌溶解。滴加氨水将ph调至9。再将温度升高到50℃,继续反应1h。反应完毕后,用50ml除氧水洗涤,磁铁吸附倾倒,除去铵盐,重复3次。产物在60℃下真空干燥,得到黑色块状固体spions123mg,产率为53%,于4℃下保存。
产物ft-ir(cm-1)(日本shimadazu公司iraffinity-1型傅里叶变换红外光谱仪):3419.7,1623.0,576.7。磁性测定(美国quantumdesign公司bkt-4500z型振动样品磁强计):饱和磁化强度35.6emu/g,矫顽力9.3g,剩磁0.65emu/g。
2.spions-aptes的制备
移取0.5ml除氧水并和10ml无水乙醇混合,制备含水量为3%-5%(v/v)的水-乙醇混合溶液,并用冰醋酸调节ph(4.5-5.5)。然后,加入200μl3-氨基丙基三乙氧基硅烷(aptes),活化5min。再加入86mgspions,机械搅拌,反应过夜。反应结束后,以20ml95%乙醇洗涤,磁铁吸附倾倒,除去未反应的aptes,重复5次。产物在60℃下真空干燥,得到黑色粒状固体spions-aptes100mg,于4℃下保存。
产物ft-ir(cm-1):1525.6,1213.2,1149.5,580.5。水合动力学直径的测定(英国malvern公司nanozs型动态光散射纳米粒度分析仪):强度权重的动态光闪射(dls)图像显示为单峰,spions-aptes粒径主要分布于86±26nm。
3.fa-nhs的制备
本反应在室温、n2保护和避光下进行。将502mg叶酸(fa)加入到10ml无水dmso中,搅拌至溶解。再加入250mgdcc反应2h。将150mgnhs溶于1ml无水dmso中,然后滴加到上述反应液中,5min滴加完毕,在室温下反应过夜。将粗产物过滤除去沉淀,在40℃下将滤液减压浓缩30min,再向滤液中滴加无水乙醚:丙酮=7:3的混合液,至不再生成沉淀为止。过滤,所得固体以50ml无水乙醚:丙酮=7:3的混合液洗涤,重复3次,于30℃下真空干燥,获得黄色粒状固体fa-nhs322mg,产率为53%,装瓶封口后在-20℃下保存。
4.fa-peg的合成
在室温、n2保护下,将300mgnh2-peg-cooh(分子量为2000,购自北京希凯创新科技有限公司)加入到10mldmso中,再将162mgfa-nhs溶于2mldmso中,滴加到上述反应液中,5min滴加完毕,再加入150mgn,n-二异丙基乙基胺,于避光条件下反应24h。粗产物在去离子水中透析(mwco=1000)48h后冻干,得到黄色泡沫状固体fa-peg267mg,产率为76%,装瓶封口后-20℃下保存。
产物ft-ir(cm-1):3398.5,2883.3,1689.6,1608.6,1344.3,1109.0,842.8。1hnmr(dmso)如图1所示。δ=8.60(1h,n=ch-c,pteridine(a));7.68,6.62(4h,-c4h4-,ph(c,d));4.55(2h,-ch2-(b));4.31(1h,ch(e));3.31-3.50(182h,-ch2ch2o-,peg(h,i));2.19-2.38(6h,-ch2-(f,g,j));2.50(dmso)。
5.spions-peg-fa的制备
在n2保护下,将160mgfa-peg溶于20ml无水dmso中,加入84.8mgedc搅拌10min,再加入24.8mgnhs搅拌30min。然后,将50mgspions-aptes溶于5ml无水dmso中,加入上述反应液中,反应过夜。反应结束后,经透析(mwco=8000-14000)、冻干,得到黑色固体spions-peg-fa169mg,装瓶封口后在-20℃下保存。
产物ft-ir(cm-1):3431.3,2881.6,1631.7,1344.3,1109.0,958.6,840.9,582.5。dls图像显示为单峰,spions-peg-fa粒径主要分布于133±78nm。
6.dota-spions-peg-fa的制备
称取50mgdota溶于5ml水中,9.5mgedc溶于1ml水中,将两者混合。用0.1mol/lnaoh将ph值调至5,反应10min。将反应瓶移至冰浴中,加入9mgnhs,再用0.1mol/lnaoh将ph值调至5.5,继续反应30min。称取25mgspions-peg-fa溶于3ml水中,加入上述反应液中,再用0.1mol/lnaoh将反应液ph值调至8.5,反应过夜。反应结束后,经透析(mwco=8000~14000)、冻干,得到黑色固体dota-spions-peg-fa28mg,装瓶封口后在-20℃下保存。
产物ft-ir(cm-1):2877.7,1683.2,1601.7,1346.3,1111.0,842.8,686.3,578.6。磁性测定:饱和磁化强度7.9emu/g,剩磁0.2emu/g。
7.放射性金属核素的制备
放射性金属核素64cu、60cu、61cu、66ga、86y、89zr、45ti、55co、114min、94mtc、67ga、111in、44sc通过回旋加速器制备。68ga通过68ge/68ga发生器制备。62cu通过62zn/62cu发生器制备。99mtc通过99mo/99mtc发生器制备。44sc通过44ti/44sc发生器制备。177lu通过核反应堆制备。
以下以64cu为例,64cu的制备详述如下:
ni靶的制备。在铜靶托上均匀镀上金膜(11cm×2cm,12μm),金属ni靶层通过电沉积镀在金膜上。ni浓度~15mg/ml,电沉积温度为35-40℃,搅拌速度350转/分,电流250ma,正脉宽500ma,负脉宽40ma,周期1.0ms,电镀时间3h。最终称量得靶层(ni)质量为127mg。
将靶件固定于c-30质子回旋加速器固体靶系统中,用15.6mev、37~70μa束流强度的质子以6°的入射角度打靶2.5~10h。辐照结束后,在靶槽内加入12ml6mol/l盐酸和3mlh2o2,加热到95℃溶靶,待溶靶结束后,将溶靶液转移至烧杯中,加热蒸干,然后用5ml6mol/l盐酸溶解残渣。将溶靶液加载到预处理过的ag1-x8阴离子交换柱上,弃去流出液。先以20ml6mol/l盐酸淋洗交换柱,收集洗脱液,所得nicl2溶液可用于下一次的ni靶制备。再以20ml4mol/l盐酸淋洗交换柱,弃去流出液。最终,以20ml1mol/l盐酸淋洗交换柱,收集洗脱液,得到64cucl2溶液,备用。
64cu的特征能峰为1345.8kev,β+衰变能峰为511.0kev,γ谱仪测定结果显示,64cu的放射性核纯度大于99.0%。irisadvantage光谱仪测定64cu中的金属杂质(ni、co、fe和au)浓度均小于0.05mg/l。
8.64cu的标记和纯化
取5mg的dota-spions-peg-fa溶于500μl醋酸铵缓冲溶液(ph=6.5),加入到2mlep管中,再加入64cucl2(~296mbq),涡旋混匀,在60℃条件下孵育45min。
采用超滤浓缩离心管离心的方法进行纯化。将标记物移至超滤浓缩离心管上层,在5000转/分钟的条件下离心10min,弃去下层液体,上层残余物分别用500μl10mmdtpa和1mmdtpa溶液洗涤各一次,离心,至下层滤液基本无放射性活度检出,然后收集上层残余物。
采用快速薄层层析法(instantthinlayerchromatography,itlc)测定64cu-dota-spions-peg-fa的标记率和放化纯。取2μl反应液点样于whatman1号层析纸上,用10%醋酸铵/甲醇混合液(体积比为50:50)配制的15mmedta溶液为展开剂展开并用放射型薄层扫描仪(德国eckertziegler公司ar-2000型放射型薄层扫描仪)扫描,根据不同标记产物在纸层析展开体系中比移值(rf)的差异从而计算出标记率或放化纯。标记物集中在原点附近,rf=0-0.1,游离64cu的rf=0.6-0.7。
结果表明,在上述标记条件下,其标记率可达23%。经过超滤浓缩离心管纯化,放化纯在98%以上,比活度可达1.7μci/μg。
实施例2体外稳定性研究
将100μl64cu-dota-spions-peg-fa标记物(~0.37mbq),加入到200μl磷酸盐缓冲溶液pbs(ph=7.4)中,在37℃下温育,孵育0h、4h、12h后,取样并用快速薄层层析法测定放化纯。
结果表明,标记物在pbs中孵育4h时仍保持较好的放化纯稳定性,维持在93%以上。而一个半衰期(12h)后,放化纯降至85%。这表明该标记物在4h内基本稳定。
实施例3:荷瘤鼠体内的生物分布研究
动物选择荷kb细胞balb/c裸鼠(雌性,18-20g),购于中国医学科学院肿瘤研究所。取4-5周龄balb/c雌性裸鼠,右前肢腋下接种5×106个kb(人口腔表皮样癌)细胞,待肿瘤平均直径达到8-10mm时用于实验。
分别经尾静脉注射100μl64cu-dota-spions-peg-fa(30μg,~0.37mbq)和64cu-dota-spions-peg-oh(30μg,~0.37mbq)的生理盐水溶液,并在注射后1、3、6h时,对每组3只裸鼠进行摘眼球取血,继而断颈处死。取心、肝、脾、肺、肾、胃、小肠、肌肉、股骨、血、瘤称重,并用γ计数器(美国perkinelmer公司wallace1470-002型γ计数器)测定放射性计数。计算每克组织的百分注射剂量率(%id/g)和肿瘤/非肿瘤(肿瘤/血)比值。
标记物64cu-dota-spions-peg-fa和64cu-dota-spions-peg-oh在荷瘤鼠体内的生物分布结果分别如表2和表3所示:
表2.64cu-dota-spions-peg-fa在荷瘤鼠体内的生物分布(mean±sd,%id/g,n=3)
表3.64cu-dota-spions-peg-oh在荷瘤鼠体内的生物分布(mean±sd,%id/g,n=3)
由表2可知:靶向标记物64cu-dota-spions-peg-fa在肝脏中(21.04%id/g,6h)的摄取很大,在脾(15.04%id/g,6h)和肺(29.83%id/g,6h)中的摄取也较大。64cu-dota-spions-peg-fa在肝、脾和肺的高摄取主要与巨噬细胞的吞噬作用有关。体内的网状内皮系统(res,包括肝、脾、肺和骨髓等组织)具有丰富的吞噬细胞,可将一定大小的纳米颗粒作为异物而摄取,较大的颗粒由于不能滤过毛细血管,而被截留于某些部位。
与未连接叶酸的标记物64cu-dota-spions-peg-oh相比,64cu-dota-spions-peg-fa在肿瘤中的摄取明显增高。64cu-dota-spions-peg-fa和64cu-dota-spions-peg-oh在给药1h的摄取率分别为9.76±5.27%id/g和1.41±0.36%id/g;给药3h的摄取率分别为8.81±8.30%id/g和1.52±0.60%id/g;给药6h的摄取率分别为8.90±3.32%id/g和2.09±0.63%id/g。这表明连接叶酸后,纳米粒子对kb细胞瘤具有明显的主动靶向作用。
在给药1、3、6h时,64cu-dota-spions-peg-fa的肿瘤/血液比分别为6.82、6.67、6.74;而64cu-dota-spions-peg-oh的肿瘤/血液比分别为0.65、0.52、0.68。连有叶酸纳米粒子的肿瘤/血液比明显高于无叶酸连接的纳米粒子,并且在1-6h内t/b均大于6,这表明64cu-dota-spions-peg-fa在肿瘤中具有较长的滞留时间,靶与非靶组织反差明显,可在较宽的时间范围内对肿瘤进行显像。
实施例4:荷瘤鼠的mri显像研究
取荷kb细胞balb/c裸鼠3只,一只作为空白组;一只作为阻断组,先经尾静脉注射50μlfa-peg(200μg)进行叶酸受体阻断,30min后再注射100μldota-spions-peg-fa(20μg);一只作为实验组,经尾静脉注射100μldota-spions-peg-fa(20μg)。在给药后4h进行mri显像(显像仪器为美国varian公司7.0t小动物磁共振成像仪)。超顺磁性氧化铁纳米粒子在mri成像中作为t2造影剂,通过网状内皮系统中的吞噬细胞吞噬spions后使相应的区域信号减弱。
结果如图3所示。由图3(a)可知,空白组中肿瘤部位为最为明亮。当对叶酸受体进行阻断后(图3(b)),图像也稍变暗,这可能与实体瘤的高渗透和滞留效应有关,纳米粒子被肿瘤少量摄取。图3(c)显示,肿瘤部位最暗。这表明dota-spions-peg-fa在肿瘤部位有最大摄取,其摄取是与叶酸受体密切相关的,dota-spions-peg-fa可作为叶酸受体主动靶向的kb肿瘤mri造影剂。
实施例5:荷瘤鼠的pet/ct显像研究
取荷kb细胞裸鼠3只,一只作为非靶向组,经尾静脉注射100μl非叶酸受体靶向标记物64cu-dota-spions-peg-oh(~18.5mbq);一只作为阻断组,先经尾静脉注射50μlfa-peg(200μg)进行叶酸受体阻断,30min后再注射100μl64cu-dota-spions-peg-fa(~18.5mbq);一只作为实验组,经尾静脉注射100μl64cu-dota-spions-peg-fa(~18.5mbq)。在给药后4h进行pet/ct显像(显像仪器为德国siemens公司inveon小动物pet/ct成像仪)。
结果如图4所示。由图4可知,非靶向组(图4(a))以及阻断组(图4(b)),药物在肿瘤部位的摄取均较少,与肌肉相比没有显示出大的差异。而直接注射叶酸受体靶向标记物64cu-dota-spions-peg-fa后,药物在肿瘤部位的摄取明显增高(图4(c))。这说明64cu-dota-spions-peg-fa对kb细胞肿瘤有靶向性,这种靶向是通过与叶酸受体的作用而实现的,是主动靶向。
通过实施例2-5的检测数据说明,64cu-dota-spions-peg-fa可以作为pet/mri双模态显像药物,具有作为叶酸受体阳性肿瘤(如kb细胞肿瘤等)的显像药物的应用前景。
最后应说明的是:以上各实施例仅用以帮助理解本发明的技术方案及核心思想,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换,而这些修改或者替换也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!