一种调节肿瘤微环境和主动靶向的药物递送系统及其用途的制作方法
本发明属于药物制剂领域,涉及药物递送系统,具体涉及一种调节肿瘤微环境和主动靶向的药物递送系统及其用途。本发明的递送系统将半衰期短的疏水性天然药物单体包载于生物可降解的聚乳酸纳米粒中,同时在其表面通过化学键合修饰具有靶向功能的多肽,能达到特异性递送制剂到肿瘤微环境中。
背景技术:
据统计,胰腺癌是一类具有高度侵袭性的消化道恶性肿瘤,其5年生存率不足6%。手术治疗是治疗胰腺癌最有效的方法,但因胰腺癌起病隐匿,病程发展快,可手术切除的患者比例仅占10%左右;化疗是胰腺癌治疗的重要环节,但实践显示,临床接受以吉西他滨为基础的一线化疗方案患者其总体生存期仅6.8个月,folfirinox治疗方案(奥沙利铂+伊立替康+5-氟尿嘧啶)与吉西他滨相比有着更长的总体生存期,但存在有更大的毒性。总之,目前为止无论采用何种治疗方案对胰腺癌患者预后的改善都非常有限,因此有必要探寻一种新的思路以提高胰腺癌的化疗效果。
研究显示,胰腺癌的化疗效果有限与其独特而复杂的肿瘤微环境密切相关;在其肿瘤微环境中90%以上的细胞并非肿瘤细胞,而是间质细胞,包括肿瘤相关成纤维细胞(caf)、内皮细胞、周细胞、巨噬细胞等,其中caf含量最多,是肿瘤重要的支撑细胞,不仅成为化疗药物渗透进入肿瘤细胞的物理屏障,更对肿瘤的生长、耐药、转移起到重要的支持与促进作用;其中的成纤维细胞被激活后能够分泌大量细胞因子,这些因子能与肿瘤细胞相互作用,促进胰腺癌细胞的增殖和转移;同时caf还能分泌基质金属蛋白酶(mmps),其亦与肿瘤转移密切相关;caf能合成和分泌大量的细胞外基质,这些细胞外基质的大量生成以及不规则的沉积是造成胰腺癌部位间质高压的主要原因,限制了化疗药物的渗透能力,使其不能有效达到肿瘤细胞。传统的化疗手段在部分杀伤瘤细胞的同时也会非特异性地杀伤caf,但是caf的清除会造成肿瘤间质的耗竭从而引起自身免疫抑制;另外还能激活促进肿瘤细胞增殖、耐药、转移的wnt16b信号通路,导致预后效果较差。因此,对于胰腺癌这类富含异常激活caf的肿瘤而言,采用对其无毒性的天然产物单体,通过调节肿瘤微环境,抑制caf的异常激活,阻断激活的信号通路,减少肿瘤细胞外基质的沉积并联用靶向胰腺癌细胞的纳米药物从而提高其治疗效果有着较高的临床应用前景及转化价值。
纳米技术(nanotechnology)在药物递送上有许多优点,能够延长药物在血液循环中的稳定性和循环时间。天然产物单体在体内循环的半衰期短,采用乳化溶媒蒸发法将疏水性天然药物单体包载于生物可降解的聚乳酸纳米粒中,能够有效改善天然产物单体体内半衰期短,清除快,无法蓄积于肿瘤微环境的缺点,极大地延长天然产物单体在体内的循环时间,使其大量富集于肿瘤微环境。同时,通过在载体上修饰具有主动靶向功能的多肽creka之后能够特异性地将药物递送到病灶部位,增加药物在肿瘤实质的蓄积,有效改善肿瘤微环境。
基于现有技术的现状,本申请的发明人拟涉及提供新的药物递送系统,尤其是一种调节肿瘤微环境和主动靶向的药物递送系统。本发明的递送系统将半衰期短的疏水性天然药物单体包载于生物可降解的聚乳酸纳米粒中,同时在其表面通过化学键合修饰具有靶向功能的多肽,能达到特异性递送制剂到肿瘤微环境中。
技术实现要素:
本发明的目的是基于现有技术的现状,提供新的药物递送系统,尤其是一种调节肿瘤微环境和主动靶向的药物递送系统。本发明的递送系统将半衰期短的疏水性天然药物单体包载于生物可降解的聚乳酸纳米粒中,同时在其表面通过化学键合修饰具有靶向功能的多肽,能达到特异性递送制剂到肿瘤微环境中。
具体的,本发明以高性能的生物可降解的材料制备成的纳米粒作为载体,并物理性包载天然产物单体,通过化学键合的途径将靶向功能多肽修饰于纳米粒表面,利用其肿瘤微环境的靶向特性,达到调节肿瘤微环境,增加药物在肿瘤部位渗透和蓄积的目的。
更具体的,本发明中,以fda批准的药用高分子聚乳酸材料构建的生物相容性好、生物可降解的粒径均一的纳米粒子,将疏水性天然药物单体物理性包载于纳米粒子的疏水内核;同时通过共价结合的方法将功能性的多肽连接到纳米粒子表面,达到能够主动靶向肿瘤部位的能力。
本发明所采用的模型药物为天然药物单体为α-倒捻子素,通过物理包载的方式将其包载于生物可降解的聚乳酸材料中;能够有效抑制成纤维细胞的激活。
本发明中,,所述的高分子聚乳酸材料含有聚乙二醇-聚乳酸嵌段共聚物(peg-pla)。
本发明中,聚乙二醇-聚乳酸嵌段共聚物peg-pla的分子量为10000-50000da。
本发明中,所述的高分子聚乳酸材料含有马来酰亚胺-聚乙二醇-聚乳酸嵌段共聚物(mal-peg-pla),利用马来酰亚胺官能团与功能性多肽中的巯基反应,将多肽修饰于纳米颗粒的表面,达到主动靶向的作用。
本发明中,马来酰亚胺-聚乙二醇-聚乳酸嵌段共聚物mal-peg-pla的分子量为10000-50000da。
本发明中,具有主动靶向能力的功能分子能够与肿瘤微环境中大量的纤维蛋白-纤粘蛋白复合体结合,纤维蛋白-纤粘蛋白复合体在肿瘤微环境中细胞外基质高表达,同时也高表达于肿瘤相关的成纤维细胞表面;本发明的实施例中,具有主动靶向能力的功能分子多肽其完整氨基酸序列为creka;将creka多肽修饰于纳米递药系统的表面,能提高纳米粒子对于肿瘤部位的靶向效率。
本发明采用的小鼠成纤维细胞nih3t3和人源胰腺癌细胞bxpc-3均为本领域所公认且可市购获得。
本发明描述了该药物递释系统的制备方法,并且提供了药物递释系统体内外定性定量表达的结果以及药效学评价;本发明的实施例中,包载疏水性药物单体的方法是乳化溶媒蒸发法;采用乳化溶媒蒸发法将疏水性天然药物单体包载于生物可降解的聚乳酸纳米粒中,能够有效改善天然产物单体体内半衰期短,清除快,无法蓄积于肿瘤微环境的缺点,极大地延长天然产物单体在体内的循环时间,使其大量富集于肿瘤微环境。
本发明通过细胞特异性摄取实验,体内体外药效学实验证明,该药物递释系统能够特异性地靶向肿瘤微环境中的肿瘤相关成纤维细胞,抑制肿瘤相关的成纤维细胞的激活,增加药物在肿瘤部位的渗透和蓄积,且具有明显抗肿瘤效果。
附图说明
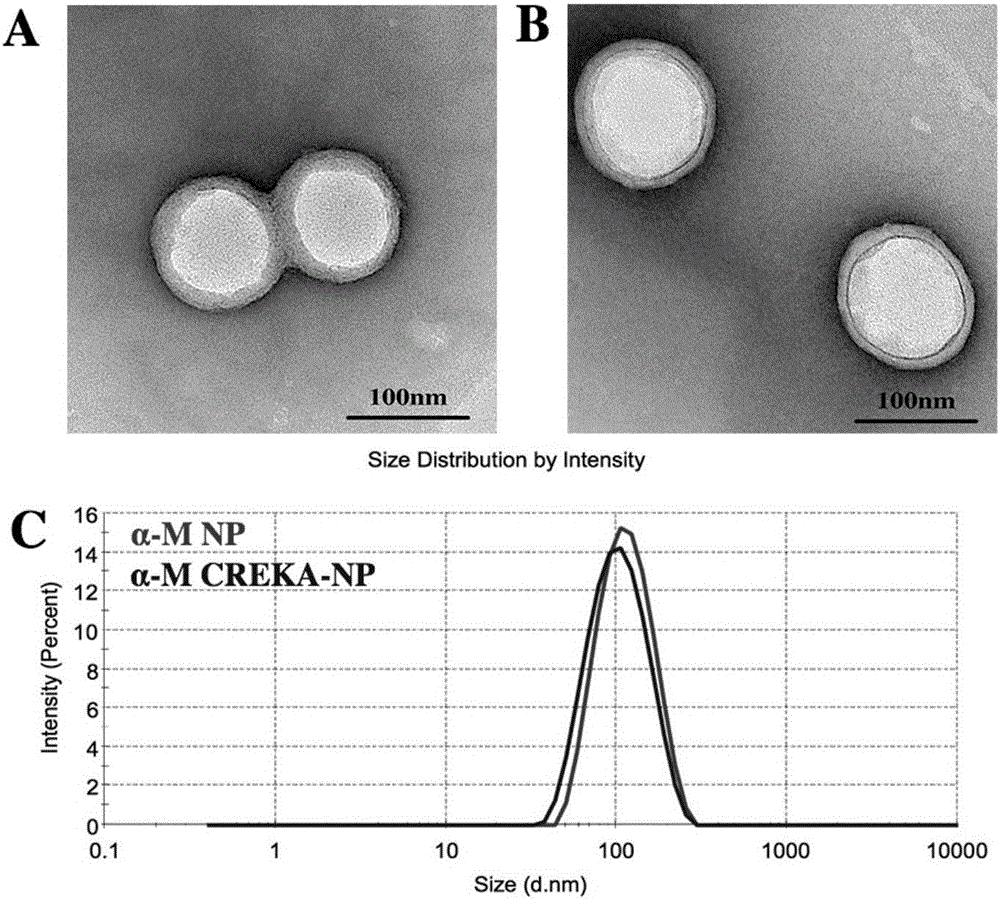
图1是纳米递药系统的表征,其中,
图a是α-mnp的场发射电镜图;
图b是α-mcreka-np的场发射电镜图;
图c是α-mnp和α-mcreka-np的粒径图。
图2是nih3t3细胞对于载香豆素的纳米递药系统的定性和定量结果,其中,
图a是未激活的nih3t3细胞对载香豆素的np和creka-np的摄取定性结果,
图b是激活的nih3t3细胞对载香豆素的np和creka-np的摄取定性结果,
图c是未激活和激活的nih3t3对载香豆素的np和creka-np的摄取定量结果。
图3是载药纳米递释系统对于激活的nih3t3细胞的抑制效果结果,其中,
图a是不同浓度的游离α-m对于激活的nih3t3细胞的fibronectin、α-sma和fap影响的pcr定量结果,
图b是不同浓度的游离α-m对于激活的nih3t3细胞的fibronectin、α-sma和fap影响的westernblotting结果。
图4是采用westernblotting和免疫组化荧光染色评价载药纳米递释系统对于皮下种植瘤模型动物的体内药效学,其中,
图a是肿瘤组织中fibronectin、α-sma和fap的的westernblotting结果,
图b是肿瘤组织的westernblotting的定量结果,
图c是肿瘤组织的冷冻免疫荧光切片表征fibronectin、α-sma和fap的结果,
图d是不同给药方案治疗后肿瘤的大小变化曲线。
图5是采用活体成像技术拍摄的载dir的纳米粒在荷原位瘤小鼠上的组织分布图,其中,
图a是纳米制剂在荷瘤小鼠体内的分布,
图b是纳米制剂在荷瘤小鼠的主要器官中的分布。
具体实施方式:
实施例1:纳米递释系统的制备和表征
采用乳化溶媒挥发法制备纳米递药系统。将22.5mg的mpeg-pla和2.5mg的mal-peg-pla溶于1ml的二氯甲烷中,加入适量的α-倒捻子素使其浓度为0.75mg/ml,再加入2ml的1%胆酸钠溶液,在冰浴的条件下于超声2.4min,超声条件为功率240w,间隔时间2s。随后用8ml的0.5%胆酸钠溶液分散10min,旋转蒸发除去残余的二氯甲烷,在4℃的条件下以15000rpm/min离心1h,吸除上清,即得到载药纳米粒(α-mnp)。具有靶向功能的纳米递药系统是在载药纳米粒的基础上,通过纳米粒表面的马来酰亚胺基和多肽的巯基反应,按照1:1的摩尔比加入多肽溶液,温和搅拌6h。将得到的纳米粒溶液过sepharosecl-4b柱,除去未包载的α-m和未连接上的多肽,得到具有靶向功能的载药纳米粒(α-mcreka-np),用malvern粒径/zeta电位测定仪测定纳米粒的粒径;
结果显示:α-mnp和α-mcreka-np的粒径分别为108.32±3.86nm和118.46±4.53nm,表明多肽链的引入并没有明显改变纳米粒的粒径,从场发射电镜图可以看出,两种纳米粒的外观圆整,大小均一,没有明显聚集现象。
实施例2:nih3t3细胞对递释系统的摄取考察
为了验证纳米递药系统是否对于肿瘤微环境中激活的肿瘤相关成纤维细胞具有靶向作用,考察了载有香豆素-6的np和creka-np在激活和未激活的成纤维细胞的摄取行为;首先制备载香豆素-6的纳米递释系统,纳米粒的制备方法同实施例1,将α-倒捻子素换为cou-6,使cou-6的浓度为2μg/ml。将nih3t3细胞以每孔3000个的密度接种于96孔板上(n=3),激活组的nih3t3预先于含tgf-β(10ng/ml)的dmem完全培养基孵育24h。用dmem完全培养基将载有香豆素的纳米粒(np和creka-np)稀释到100ng/ml,分别于96孔板的每孔加入100μl的纳米粒溶液,在37℃,5%的二氧化碳浓度的细胞培养箱中孵育1h和3h后取出,吸除每孔的培养基,用pbs(磷酸盐缓冲液,ph7.4)清洗3次,用4%的多聚甲醛溶液在37℃,5%的二氧化碳浓度的细胞培养箱中固定15min后,加入2μg/ml的dapi(4',6-diamidino-2-phenylindole)染色10min,于倒置荧光显微镜下面观察细胞摄取的定性结果,对于定量结果,在上述dapi染色后每孔加入100μl的pbs,通过高内涵筛选仪(thermoscientificusa)获得定量结果;
结果显示:激活的nih3t3细胞也就是肿瘤相关的成纤维细胞对于有无接靶的纳米粒摄取量都比未激活的nih3t3细胞高,并且靶向修饰后的纳米粒载体在激活的nih3t3细胞中的摄取量提高十分明显,结果表明,creka能够介导纳米粒进入细胞中。
实施例3:载药纳米递释系统对于激活的nih3t3细胞的抑制效果结果考察
为了验证α-倒捻子素是否对于激活的nih3t3细胞有抑制作用以及是否能够抑制fibronectin的分泌,用westernblotting和荧光定量pcr考察了fibronectin、α-sma、fap的表达情况;将nih3t3细胞以每孔20000个细胞的浓度均匀的接种于6孔板中,实验组的nih3t3细胞预先与含tgf-β(10ng/ml)的dmem完全培养基孵育24h,之后吸除培养基,再给予含10μm和20μm的np(α-m)的dmem完全培养基孵育24h,阴性对照组则不加入tgf-β进行激活。给药周期结束后吸除上清,用于westernblotting组的细胞用pbs洗3遍,将6孔板置于冰上,每孔加入200μl的ripa裂解液裂解30min,用细胞刮刀刮下细胞,将细胞碎片和裂解液加入1.5ml离心管,于4℃、12000rpm/min条件离心10min。将上清转移到新的预冷ep管中,弃去沉淀,用bca试剂盒定量后加入适量的5x的上样缓冲液,涡旋混匀后于95℃干式加热器上加热5min,上样,用于荧光定量pcr的细胞在给药周期结束后吸除上清,用pbs洗三遍,再用新鲜动物组织和细胞总rna抽提试剂盒进行rna的抽提,每孔加入350μl的trizol裂解液,用细胞刮刀刮下细胞,转入无rna酶的离心管中。再加入0.2ml三氯甲烷,剧烈摇动10s,室温放置1分钟。于4℃,12000g离心15min。将上清水相转移至另一新的无rna酶离心管中,并加入等体积的100%乙醇,吸取全部样品,加入带有2ml收集管的mini-spin离心柱。8000g,室温离心15s,弃尽流穿液。将剩余的样品转移至离心柱,重复上一步。往离心柱中加入700μlwb,轻盖盖子,8000g,室温离心15s,弃尽流穿液。重复上一步,用500μlwb洗涤离心柱两次,将离心柱转移至一新的无rna酶的1.5ml离心管中,往硅胶膜中央滴加50μldepc水,4℃,10000g离心3min洗脱rna。逆转录反应体系为2x逆转率缓冲液,逆转录引物(1μm),总rna,mmlv逆转录酶(200u/μl)和depc水总共20μl,逆转录程序设定为:42℃30min;85℃10min。实时荧光定量反应体系为2x定量pcrmastermix10μl,上游引物(20μm)和下游引物(20μm)各0.08μl,cdna模板2μl,taqdna聚合酶(2.5u/μl)0.4μl,三蒸水加至20μl。定量pcr反应程序为:94℃,3min变性;94℃,10s,60℃,40s,40次循环;
引物设计的序列:gapdh(fprimer:gagaaacctgccaagtatgatgac;rprimer:agagtgggagttgctgttgaag),α-sma(fprimer:gtcccagacatcagggagtaa;rprimer:tcggatacttcagcgtcagga),fibronectin(fprimer:atgtggacccctcctgatagt;rprimer:gcccagtgatttcagcaaagg),fap(fprimer:gtcacctgatcggcaatttgt;rprimer:ccccattctgaaggtcgtagat);
结果显示:当用tgf-β(10ng/ml)孵育nih3t3细胞24h后,成纤维细胞激活的蛋白α-sma、fap以及fibronectin的表达量大幅增加,提示成纤维细胞已经转变为激活的成纤维细胞,当给予α-mnp孵育24h后,与阳性对照组相比,α-mnp能够剂量依赖地降低α-sma、fap以及fibronectin的表达量,fibronectinmrna的表达水平降低2.02至4.35倍,α-smamrna的表达水平降低1.64至2.64倍,fapmrna的表达水平降低1.91到3.85倍,westernblotting实验结果说明,α-mnp能够降低α-sma、fap以及fibronectin蛋白水平的表达量;结果表明,α-m能够有效抑制成纤维细胞的激活以及抑制其分泌fibronectin。
实施例4:纳米递释系统对于皮下种植瘤模型动物的体内药效学评价
皮下种植瘤动物模型的建立:取对数生长期的胰腺癌细胞bxpc-3和成纤维细胞nih3t3,用胰酶消化后离心,用适量的pbs重悬使两种细胞的比例为1:1,总细胞浓度为2×107cells/ml。取4-6周、20g左右的雌性balb/c裸鼠,在后肢皮下注射100μl的的细胞悬液,15天后待肿瘤体积长至约200cm3,用于后续的实验;
将荷瘤裸鼠随机分为4组,每组6只,α-mnp高剂量组和低剂量组的给药剂量为10mg/kg和20mg/kg,α-m溶液剂组的给药剂量为20mg/kg,每两天通过尾静脉注射给药,总共给药4次,对照组给予相同体积的生理盐水,在接下来的30天内每隔一天用游标卡尺量取肿瘤的体积大小,肿瘤体积的计算公式为v=ab2/2(a为肿瘤的长边直径,b为肿瘤的短边直径),并绘制肿瘤体积生长曲线,为用于westernblotting实验的裸鼠在最后一次给药一天后处死裸鼠,剥离肿瘤组织,将组织剪碎后加入ripa(200μl/20mg)于冰上进行匀浆,充分裂解后于12000rpm/min离心10min离心取上清,后续实验步骤参照实施例3。用于免疫组化荧光染色实验的裸鼠在最后一次给药一天后处死裸鼠,剥离肿瘤组织,均匀脱水后用oct胶包埋后进行冷冻切片,用免疫荧光进行染色,于倒置荧光显微镜下观察fibronectin、α-sma、fap(绿色)的表达情况,细胞核用hoechst(蓝色)标记;
结果显示:与注射生理盐水组相比,α-mnp能够有效的降低肿瘤微环境中的成纤维细胞的激活,并且能够抑制fibronectin分泌到细胞外基质中,并且α-mnp改善肿瘤微环境的效果呈剂量依赖性,肿瘤体积生长曲线显示,与生理盐水组和α-m溶液组相比,α-mnp能够在一定程度上抑制肿瘤的生长,纳米制剂不管是高剂量组还是低剂量组其抑制肿瘤生长的效果显著,并且高剂量组的抑制肿瘤生长的效果最佳;由此说明α-mnp能够通过减少成纤维细胞的激活和抑制其增殖降减缓肿瘤的生长速度,其效果优于游离药物;从免疫组化荧光切片可以看出,注射生理盐水组的肿瘤微环境中的成纤维细胞以及纤维连接蛋白在肿瘤组织中呈弥散性分布,给药组的成纤维细胞的分布和纤维连接蛋白的分泌大量的减少;结果表明,α-mnp能够重塑肿瘤微环境,降低了化疗药物渗透进入肿瘤细胞的物理屏障。
实施例5:纳米递释系统的体内药效学评价
原位胰腺癌动物模型的建立:取对数生长期的bxpc-3细胞,用胰酶消化后离心,pbs清洗细胞两次后计数,将细胞的浓度调整为2×107cells/ml,置于冰盒备用。雄性裸鼠腹腔注射10%水合氯醛,待裸鼠麻醉后,碘伏消毒,用眼科剪于裸鼠的左下腹脾脏附近剪开2-3cm的切口,用镊子将脾脏轻轻钳出体外,找到裸鼠的胰腺,左手持镊子将胰尾轻轻提起,右手持注射器缓慢将100μl细胞悬液从胰尾向胰头方向注射,可观察到胰腺明显充盈呈半透明状,慢慢移出针头,用棉签将裸鼠的胰腺和脾脏轻轻推回体内,在伤口处滴适量的抗生素,并用医用可吸收线进行逐层缝合。所有操作均在超净手术台中进行。接种后每天观察动物状态和伤口愈合情况,在接种后10天进行实验;
将荷瘤裸鼠随机分为3组,每组6只,每两天通过尾静脉注射α-mnp(10mg/kg),总共给药4次,对照组给予相同体积的生理盐水,最后一次给药一天后,通过尾静脉注射载2mg/kgdir碘化物的纳米制剂np,裸鼠腹腔注射0.2ml5%水合氯醛麻醉,置于小动物活体成像仪内,于注射后2h,6h,12h,24h时间点进行荧光扫描(激发波长为780nm)。在24h时间点拍摄完成后,取出裸鼠的主要脏器(心、肝、脾、肺、肾和肿瘤)进行离体荧光扫描(激发波长为780nm),考察纳米制剂在各组织的分布情况;
结果显示:未给予α-mnp治疗的裸鼠原位胰腺肿瘤由于epr的效应有些许纳米粒蓄积在肿瘤组织中,但是给予α-mnp治疗的实验组裸鼠其纳米粒在肿瘤部位有更强的分布效果,对组织器官的分布情况考察结果显示,纳米制剂主要分布在肝脏、脾脏和肺部;结果表明,α-mnp能够有效的肿瘤微环境,降低了化疗药物渗透进入肿瘤细胞的物理屏障,增加纳米药物在肿瘤部位的渗透和蓄积,为后续的化疗药物的治疗提供了良好的环境。
- 还没有人留言评论。精彩留言会获得点赞!