胎盘样硫酸软骨素A靶向纳米投递系统及其制备方法和应用与流程
本发明属于药物载体技术领域,特别涉及一种胎盘样硫酸软骨素a靶向纳米投递系统及其制备方法和应用。
背景技术:
硫酸软骨素(cs)是共价连接在蛋白质上形成蛋白聚糖的一类糖胺聚糖。硫酸软骨素广泛分布于动物组织的细胞外基质和细胞表面,发挥着重要生理功能。虽然硫酸软骨素的多糖骨架简单,但就硫酸化程度、硫酸基和两种差异向异构糖醛酸在链内的分布来说,存在较大的差异。硫酸软骨素的精细结构决定着其功能的特异性,以及与多种蛋白质分子的相互作用。
胎盘样硫酸软骨素a(pl-csa)属于糖胺聚糖家族,其为附着至蛋白聚糖的、交替的氨基糖和己糖醛酸残基的直链聚合物,其糖基化模式与常规硫酸软骨素不同。早期研究指出pl-csa是造成胎盘中疟原虫感染的红细胞隔离的原因;2015年alisalanti等人在《targetinghumancancerbyaglycosaminoglycanbindingmalariaprotein》中指出,pl-csa在多种癌细胞中表达,为癌症的治疗指明了新的靶点。然而pl-csa的特异性受体是未知的,目前更没有文献报道能与胎盘样硫酸软骨素特异性结合的受体、投递系统等。
技术实现要素:
鉴于此,本发明提供了一种对胎盘样硫酸软骨素a(pl-csa)靶向的纳米投递系统及其制备方法和应用。所述靶向纳米投递系统的稳定性好、粒径较小且分布均一,对胎盘样硫酸软骨素的靶向识别能力好,该靶向纳米投递系统有望对胎盘样硫酸软骨素a的不恰当表达相关的某些癌症及其他疾病的诊断、治疗等提供重要研究价值。
第一方面,本发明提供了一种pl-csa纳米投递系统,所述靶向纳米投递系统包括疏水性多聚物层、黏性分子和外壳,其中,所述黏性分子粘附在所述疏水性多聚物层表面,所述外壳为靶向pl-csa的多肽所接枝的两亲性大分子化合物,所述两亲性大分子化合物的疏水端穿插于所述疏水性多聚物层中,所述两亲性大分子化合物的亲水端与所述多肽通过酰胺键连接,所述多肽暴露在所述疏水性多聚物层之外,其中,所述多肽的氨基酸序列选自seqidno:1-seqidno:3所示的氨基酸序列中的一种或多种。
本发明中,接枝到两亲性大分子化合物上的多肽可以是如seqidno:1、seqidno:2或如seqidno:3所示的一种序列,也可以如seqidno:1-seqidno:3所示序列的多种。
优选地,所述靶向纳米投递系统为球状结构,其直径为80~150nm。所述粒径是采用透射电子显微镜测得。纳米级的球状投递系统,一来,有利于减少肾脏的排泄清除、网状内皮系统吸收及吞噬细胞的识别;二来,可顺利通过毛细血管内皮细胞间隙到达靶组织。
其中,所述靶向纳米投递系统还包括目标投递物,所述目标投递物被所述疏水性多聚物层包裹,所述目标投递物构成所述靶向纳米投递系统的内核。这样可有效避免装载的目标投递物在到达靶组织之前发生聚集或泄露,保证负载的投递物的稳定性。
当所述目标投递物中含有气态成分时,所述pl-csa靶向纳米投递系统可称为“pl-csa靶向纳米泡”。
其中,所述目标投递物包括造影剂、荧光追踪剂、妊娠药物和抗肿瘤药物中的至少一种。
进一步优选地,所述疏水性聚合物与所述目标投递物的质量比为1:(0.1-0.5)。
可选地,所述目标投递物为造影剂和荧光追踪剂中的至少一种与抗肿瘤药物的混合物。此时,所述靶向纳米投递系统可用于诊断、治疗与胎盘样硫酸软骨素不恰当表达相关的某些癌症或肿瘤。
进一步,所述目标投递物中,所述抗肿瘤药物与除抗肿瘤药物外的其他目标投递物(即所述荧光追踪剂和/或造影剂)的质量比为1:(0.1-4),优选为1:(0.2-3)。
进一步优选地,所述目标投递物为(超声)造影剂和抗肿瘤药物时,所述抗肿瘤药物与造影剂的质量比为1:(0.2-1),更优选为1:1。
可选地,所述目标投递物为造影剂和荧光追踪剂中的至少一种与妊娠药物的混合物。此时,所述靶向纳米投递系统可用于诊断、治疗与胎盘样硫酸软骨素不恰当表达相关的妊娠疾病。
进一步,所述目标投递物中,所述妊娠药物与除妊娠药物外的其他目标投递物(即所述荧光追踪剂和/或造影剂)的质量比为1:(0.1-4),例如可以是1:0.2,1:0.4,1:0.6,1:0.8,1:1或1:2。
进一步优选地,当所述目标投递物为(超声)造影剂和妊娠药物时,所述妊娠药物与造影剂的质量比为1:(1-4),更优选为1:1。
上述抗肿瘤药物、妊娠药物包括各种化学药物、多肽类药物、蛋白、疫苗和基因药物中的一种或多种。所述“化学药物”包括但不限于有机化合物;所述“基因药物”包括但不限于包裹、结合或共混有核酸片段的阳离子聚合物、多肽、聚氨基酸或转染试剂。其中,“多肽类药物、蛋白、疫苗和基因药物”可概称为“生物药物”。
本文中的“妊娠药物”是针对妊娠疾病而言,妊娠疾病是指妊娠生理期间发生的与妊娠有关的疾病,如胎儿宫内发育受阻、妊娠糖尿病和早产等。其中,妊娠药物包括治疗妊娠糖尿病、治疗妊娠综合征、治疗胎儿宫内生长迟缓、早产、治疗先兆子痫(也称“子痫前期”)和防止胎膜早破的上述各类化学药物、生物药物。
具体地,所述妊娠药物选自硫酸高碘素、孕激素、米索前列醇、吲哚美辛、松弛肽、地高辛抗体、洋地黄抗体、生长激素样因子2、胰岛素生长因子2、elabela多肽中的一种或多种,但不限于此。其中,对于早产类的妊娠药物,可选自米索前列醇、米非司酮、前列甲酯、硫前列酮、三苯氧胺、来曲唑和甲氨蝶呤中的一种或多种。
其中,所述抗肿瘤的化学药物可列举阿霉素、表阿霉素、紫杉醇、去甲长春花碱、依托泊甙、顺铂、甲氨喋呤、姜黄素、5-氟尿嘧啶和灵菌红素中的一种或多种,但不限于此。
其中,所述抗肿瘤的多肽类药物可以选自曲普瑞林(triptorelin)、es-2多肽、蝎毒多肽、蜂毒肽、亮丙瑞林、布舍瑞林、大豆肽、豌豆肽、卵白肽、多粘菌素、乳酸杀菌素、乳酸链球菌肽、杆菌肽、放线菌素和争光霉素中的至少一种,但不限于此。
对于所述荧光追踪剂,可列举吲哚青绿、伊文思蓝、异硫蓝、专利蓝、亚甲蓝、香豆素6、ir780碘化物(11-氯-1,1'-二正丙基-3,3,3',3'-四甲基-10,12-三亚甲基吲哚三碳花青碘盐)和dir碘化物中的一种或多种,但不限于此。
其中,所述造影剂包括x射线造影剂、磁共振成像造影剂和超声造影剂的至少一种。优选采用超声造影剂,可提高造影成像的便捷度。
对于超声造影剂,其可包括生物惰性气体、液态氟碳类、热敏产气试剂中的至少一种。具体地,所述生物惰性气体选自氮气、六氟化硫、全氟丙烷(c3f8)、全氟丁烷等;所述液态氟碳类可选自全氟己烷(即十四氟己烷,c6f14)、全氟辛基溴化铵(pfob)、全氟己烷(pfp)、全氟萘烷(pfd)等;所述热敏产气试剂可选自碳酸钙(cahco3)、碳酸氢铵(nh4hco3)等,但不限于此。
对于x射线造影剂,可列举碘苯六醇、碘普罗胺、碘必乐、碘苯酯和硫酸钡中的一种或多种,但不限于此。对于磁共振成像造影剂,可列举锰的卟啉螯合物、gd-dtpa及其线型、环型多胺多酸类螯合物,叶酸修饰的钆螯合物、含钆富勒烯造影剂等。
本申请中,所述疏水性多聚物层是由疏水性多聚物构成。优选地,所述疏水性多聚物与所述两亲性大分子化合物的质量比为1:(0.1-0.4)。
在该质量比下,既可以使得所述两亲性大分子化合物以适当的密度均匀地穿插于所述疏水性多聚物层中,进而使所述靶向纳米投递系统可以接枝上适宜浓度的多肽,尽可能提供较多均匀的靶位点,也可避免原料的浪费。还可以不过多地影响所述疏水性多聚物层对目标投递物的包裹紧密程度。使得所述靶向纳米投递系统的结构较稳定、形貌较规则、分散性良好,所述靶向纳米投递系统不易被人体体液稀释、溶解而解体,有利于所述靶向纳米投递系统靶向到表达胎盘样硫酸软骨素a的靶组织(如癌细胞、胎盘滋养层细胞等)。
优选地,所述疏水性多聚物与所述黏性分子的质量比为1:(0.2-0.8)。其中,所述黏性分子选自聚乙烯醇(pva)、葡萄糖、透明质酸和明胶中的至少一种。
所述黏性分子具有一定的黏附性,主要用于提高所述疏水性多聚物层的致密性、封闭性,以及避免后期所述疏水性多聚物层包裹的目标投递物在冷冻干燥过程中泄露出来,对其起到一定保护作用。此外,在所述靶向纳米投递系统到达靶组织后,所述黏性分子又可被降解,使得疏水性多聚物层的致密性又降低,便于目标投递物释放出来。
优选地,所述单层脂类分子选自卵磷脂和脑磷脂(磷脂酰乙醇胺)中的至少一种,所述卵磷脂选自大豆卵磷脂、氢化大豆卵磷脂、蛋黄卵磷脂和磷脂酰胆碱中的一种或多种。进一步优选地,所述单层脂类分子具有面向所述疏水性内核的疏水部分和面向所述纳米泡外部的亲水部分。
优选地,所述两亲性大分子化合物与所述多肽的质量比为1:(1~5)。在该质量比下,多肽对两亲性大分子化合物的接枝率较高。
如本发明所述的,所述多肽接枝的两亲性大分子化合物层包括两亲性大分子化合物和多肽,所述两亲性大分子化合物具有疏水端和与所述脂端连接的亲水端。本发明中,所述两亲性大分子化合物的疏水端可帮助所述两亲性大分子化合物插入到所述疏水性聚合物层中,并且所述多肽与所述两亲性大分子化合物的疏水端相接枝并延伸在所述靶向纳米投递系统的外部。更具体地说,所述多肽暴露在所述疏水性多聚物层之外,以及黏性分子的外部。
优选地,所述两亲性大分子化合物为聚乙二醇衍生化磷脂,所述聚乙二醇衍生化磷脂由聚乙二醇及其衍生物通过共价键和磷脂类物质相连得到。此时,所述两亲性大分子化合物的疏水端为所述磷脂类物质,所述亲水端为羧基或氨基修饰的聚乙二醇、或者是带有其他活性官能团的聚乙二醇衍生物。其亲水端—聚二醇(peg)可有效阻碍免疫系统对所述纳米泡的识别,显著延长了所述纳米泡在体内的循环时间,进而借助增强渗透滞留效应(epr效应)富集到胎盘组织中,最终实现被动靶向。再基于上述多肽的主动靶向及peg引起的被动靶向,所述靶向纳米投递系统对胎盘组织细胞具有很强的亲和力。
其中,所述聚乙二醇的分子量优选为200~20000,具体地,聚乙二醇分子的分子量可以为200、500、1000、2000、5000、7000、10000、15000或20000。所述磷脂类物质可以为人工合成的或自然界存在的磷脂,所述磷脂类物质可以为但不限于二硬脂酰磷脂酰乙醇胺(dspe)、二硬脂酰磷脂酰甘油(dspg)或胆固醇。
进一步优选地,所述两亲性大分子化合物为二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧酸共聚(dspe-peg-cooh,又称为磷脂-peg-羧基)、二硬脂酰磷脂酰乙醇胺-聚乙二醇-氨基共聚(dspe-peg-nh2,又称为磷脂-peg-氨基)或二硬脂酰磷脂酰乙醇胺-聚乙二醇-马来酰胺。
优选地,所述疏水性多聚物选自聚乳酸-羟基乙酸共聚物(又称聚乙交酯丙交酯,简写为plga)、聚乳酸和聚己内酯的一种或多种,但不限于此。
进一步优选地,所述疏水性多聚物为聚乳酸-羟基乙酸共聚物(简写为plga),所述plga的分子量为7000-17000。其中,单体乳酸与羟基乙酸的共聚比为50:50。
本发明第一方面提供的硫酸软骨素靶向纳米投递系统中,疏水性聚合物可自组装成疏水性聚合物层,该疏水性聚合物层可用于包裹目标投递物,所述两亲性大分子化合物中的疏水端通过物理作用穿插于所述疏水性聚合物层中,所述多肽与所述两亲性大分子化合物的亲水端共价连接并延伸在所述靶向纳米投递系统的外部,所述多肽接枝的两亲性大分子化合物为所述靶向纳米投递系统提供了亲水性外壳及靶向胎盘样硫酸软骨素a的特异性受体,因此,所述靶向纳米投递系统可以对胎盘样硫酸软骨素a不恰当表达的组织有较好的靶向性。在所述靶向纳米投递系统携带有目标投递物时,可将它们特异性地供给到靶组织,提高诊断或治疗效果。
第二方面,本发明提供了一种pl-csa靶向纳米投递系统的制备方法,包括以下步骤:
(1)将疏水性多聚物溶于有机溶剂中,得到疏水性多聚物溶液;
将两亲性大分子化合物溶于第一溶剂,得到第一混合溶液;
(2)将所述疏水性多聚物溶液加入到所述第一混合溶液中,得到第二混合液,并将所述第二混合溶液进行震荡2~5min;
(3)将乳化剂水溶液加入到所述第二混合溶液中,进行超声处理1-3min,得到预乳液;
(4)对所述预乳液进行蒸发以去除非水溶剂,之后将蒸发后所剩溶液置于超滤离心管中,加水洗涤以去除乳化剂,进行超滤离心,收集上层清液;
(5)将黏性分子水溶液加入到所述上层清液中,经冷冻干燥,得到靶向纳米投递系统前驱体;
(6)将所述靶向纳米投递系统前驱体与靶向胎盘样硫酸软骨素a的多肽、催化剂、脱水剂在第二溶剂中进行酰胺反应,以使所述多肽所接枝到两亲性大分子化合物上,得到pl-csa靶向纳米投递系统;
所述靶向纳米投递系统包括疏水性多聚物层、黏性分子和外壳,其中,所述黏性分子粘附在所述疏水性多聚物层表面,所述外壳为靶向pl-csa的多肽所接枝的两亲性大分子化合物,所述两亲性大分子化合物的疏水端穿插于所述疏水性多聚物层中,所述两亲性大分子化合物的亲水端与所述多肽通过酰胺键连接,所述多肽暴露在所述疏水性多聚物层之外,其中,所述多肽的氨基酸序列选自seqidno:1-seqidno:3所示的氨基酸序列中的一种或多种。
优选地,所述靶向纳米投递系统中还含有目标投递物,所述目标投递物被所述疏水性多聚物层包裹,所述目标投递物包括造影剂、荧光追踪剂、妊娠药物和抗肿瘤药物中的至少一种。
进一步优选地,所述疏水性聚合物与所述目标投递物的质量比为1:(0.1-0.5)。
进一步地,当所述目标投递物含有疏水性成分时,所述疏水性多聚物溶液中含有疏水性的目标投递物。
进一步地,当所述目标投递物含有亲水性成分时,所述第一混合溶液中含有亲水性的目标投递物。
进一步地,当所述目标投递物中含有气态成分时,向所述第二混合溶液中通入气态成分的目标投递物,再进行振荡。需要说明的是,当所述目标投递物含有气态成分时,所述胎盘靶向递送系统可称为“胎盘靶向递送纳米泡”,此时,所述疏水性多聚物将所述目标投递物包裹起来。
上述这样的加入顺序,有利于提高所述疏水性多聚物对各种形态、亲/疏水性的目标投递物的负载率。其中,非气态成分可以包括液态和/固态形式的目标投递物原料。上述疏水性成分是指几乎不与水相溶的物质。这里的亲水性成分是指非疏水性(也包括两亲性)的液态和/或固态成分。
其中,当所述目标投递物中含有气态成分时,所述pl-csa靶向纳米投递系统可称为“pl-csa靶向纳米泡”。
优选地,步骤(1)中,所述有机溶剂包括乙腈、丙酮、乙醚、三氯甲烷、二氯甲烷和正己烷中的一种或多种。所述有机溶剂优选为能溶解疏水性多聚物的易挥发溶剂。
所述第一溶剂需使得两亲性大分子化合物和非疏水的目标投递物均能溶解。优选地,所述第一溶剂包括至少一种亲水溶剂,或者水与至少一种亲水溶剂形成的混合溶剂。其中,所述亲水溶剂选自乙醇、甲醇、1-辛醇、乙腈、丙酮、二甲基甲酰胺(dmf)和二甲基亚砜(dmso),但不限于此。
优选地,步骤(1)中,所述疏水性多聚物溶液的浓度为25-75mg/ml。
优选地,所述第一混合溶液中,所述两亲性大分子化合物浓度为30-600μg/ml。进一步优选为100-500μg/ml。
优选地,步骤(2)中,所述震荡是在恒温振荡器中进行,所述震荡时的温度为20-30℃。进一步优选为20-25℃。
其中,步骤(3)中,所述乳化剂水溶液中,乳化剂的质量分数为1-3%,所述乳化剂包括胆酸钠或聚醚f68(即,丙二醇嵌段聚醚)。
优选地,步骤(3)中,所述超声处理的功率为200-400w,工作电压为120v,频率为20-30khz。
优选地,步骤(4)中,所述蒸发是在恒温蒸发仪中进行,所述蒸发的时间为2-5h。蒸发的目的是去除预乳液中的挥发性有机溶剂,尤其是用于溶解疏水性多聚物的非亲水性溶剂。所述蒸发的温度可根据体系中含有的溶剂的沸点进行选择,可选地,所述蒸发的温度为20-80℃,优选为35-62℃。
优选地,步骤(4)中,所述超滤离心管的截留分子量为5-10kda;所述超滤离心的离心转速为3000-5000rpm下,每次离心3-6min。可选地,所述超滤离心的次数为3-5次。除最后一次超滤离心外,每次超滤离心后均采用水洗涤,以去除乳化剂。
其中,步骤(5)中,所述黏性分子水溶液中,黏性分子的质量分数为1%-3%,所述黏性分子包括pva、葡萄糖、果糖、蔗糖、麦芽糖、透明质酸和明胶中的至少一种。
需要说明的是,本申请中所述靶向纳米投递系统前驱体,是指无靶向性的纳米泡,相对于最终得到的靶向纳米投递系统而言,不同之处仅在于,其表面没有修饰有能特异性结合胎盘样硫酸软骨素a的多肽。
优选地,步骤(6)中,所述酰胺反应是在3-10℃下进行。
进一步优选地,当所述两亲性大分子化合物带有氨基时,则在进行所述酰胺反应时,将所述靶向纳米投递系统前驱体加入到第二溶剂中,加入催化剂、脱水剂进行活化0.5-3h,再加入所述靶向胎盘硫酸软骨素的多肽,于3-10℃下反应15-24h,得到反应液。
此外,当所述两亲性大分子化合物带有羧基时,则先将所述两亲性大分子化合物加入到第二溶剂中,加入催化剂、脱水剂进行活化;之后在加入所述靶向纳米投递系统前驱体进行反应,得到反应液。
进一步地,在得到酰胺反应的反应液之后,还包括:对所述反应液进行分离纯化,得到pl-csa靶向纳米投递系统。
其中,所述分离纯化为采用截留分子量为5-10kda的超滤离心管进行超滤离心,收集离心后所得上清液。优选地,所述超滤离心进行2-5次,除最后一次超滤离心外,每次离心后均采用水或pbs洗涤。
其中,所述超滤离心是在离心转速3000-5000rpm下,每次离心3-6min。
所述第二溶剂可以为水或其他亲水性溶剂。进一步地,所述第二溶剂包括水、ph值为5.5~6.7的2-(n-吗啡啉)乙磺酸缓冲液(简称为“mes缓冲溶液”)或ph值为7.0~7.9的磷酸盐缓冲液(pbs)等,但不限于此。
所述酰胺化反应的方法为本领域的技术人员所熟知。催化剂又可称为活化剂,常与缩合剂联用,用于酰胺化反应。其中,所述缩合剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(简称edc)。所述催化剂包括n-羟基琥珀酰亚胺(nhs)、n-羟基硫代琥珀酰亚胺钠盐(sufo-nhs)中的任意一种。
优选地,所述缩合剂、催化剂与所述两亲性大分子化合物的质量比为(0.2-0.4):(0.05-0.3):1。
更优选地,当所述两亲性大分子化合物为dspe-peg-cooh时,所述edc、nhs、dspe-peg-cooh的质量比为1:0.4:5。
在本发明的另外一种实施方式中,也可以先将所述多肽接枝到两亲性大分子化合物上,然后再将多肽接枝的两亲性大分子化合物、疏水性多聚物、单层脂类分子按照步骤(1)-(5)的操作,制成所述靶向纳米投递系统。
本发明第二提供的靶向纳米投递系统的制备方法简单易行,便于操作。制得的靶向纳米投递系统对不恰当表达pl-csa的组织的靶向性较强,其在靶组织的富集程度高;当其负载目标投递物时,可提高负载物的稳定性,延长体内循环时间,用于对与pl-csa不恰当表达相关的疾病的检测、治疗等。
第三方面,本发明提供了一种如本发明第二方面所述的胎盘样硫酸软骨素a靶向纳米投递系统在制备预防、治疗或诊断与pl-csa的不适当表达相关的疾病的药物中的应用。
所述与pl-csa的表达或不适当表达相关的疾病包括妊娠疾病、肿瘤疾病、关节炎、关节病、多发性硬化、由神经损伤导致的病理病症(例如神经损伤后的愈合)、软骨和疤痕组织的病症(如风湿病、软骨修复或伤口愈合)、银屑病等,但不限于此。
进一步地,所述妊娠疾病包括先兆子痫(也称“子痫前期”)、胎儿宫内生长迟缓、胎膜早破、早产、妊娠糖尿病、妊娠综合征等,但不限于此。
进一步地,所述肿瘤疾病包括胎盘绒毛癌、乳腺癌、胰腺癌、卵巢癌、子宫内膜癌、肝细胞癌、肺癌、结肠癌、前列腺癌、宫颈癌、睾丸癌、基底细胞皮肤癌、透明细胞肾细胞癌、头颈鳞状细胞癌、皮肤鳞状细胞癌、外阴角化鳞状细胞癌和外阴基底细胞癌、神经内分泌癌、肉瘤、造血系统癌和神经上皮组织的肿瘤中的一种或多种,但不限于此。需要说明的是,本申请中并没有对“癌”和“肿瘤”进行严格的区分。
其中,所述肉瘤包括但不限于纤维肉瘤、去分化软骨和脂肪肉瘤、平滑肌肉瘤、脂肪肉瘤、粘液性脂肪肉瘤、子宫体平滑肌肉瘤、骨肉瘤、尤因肉瘤和横纹肌肉瘤、滑膜肉瘤、孤立性纤维瘤;所述造血系统癌包括但不限于慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、急性髓细胞白血病(aml)、b细胞、t细胞和大颗粒状淋巴瘤;所述神经上皮组织的肿瘤,包括但不限于星形细胞瘤(多形性黄色星形细胞瘤、纤维型星形细胞瘤、间变型星形细胞瘤、多形性胶质母细胞瘤)、少突神经胶质瘤、室管膜瘤、脉络丛肿瘤、少星形细胞瘤、神经胶质肉瘤、神经节神经胶质瘤、视网膜母细胞瘤、神经细胞瘤、神经母细胞瘤(嗅神经母细胞瘤和神经节母细胞瘤)、髓母细胞瘤和非典型畸胎样横纹肌样肿瘤。
综上,本发明的有益效果包括以下几个方面:
1、本发明提供的硫酸软骨素靶向投递系统,表面上修饰的多肽是胎盘样硫酸软骨素a的特异性受体,可以有效提高所述靶向纳米投递系统对不恰当表达pl-csa的组织的靶向性和富集程度,延长其在体内的循环时间;
2、所述靶向纳米投递系统中,含有的疏水性多聚物、两亲性大分子化合物具有良好的生物相容性,可被生物降解并通过正常的生理途径排除;
疏水性多聚物层上粘附的黏性分子,可在靶向纳米投递系统到达靶组织之前提高其致密性、封闭性,在其到达靶组织后,黏性分子又可较疏水性多聚物更快地降解,及时降低疏水性多聚物层的致密性,便于目标投递物缓慢释放;
3、所述硫酸软骨素靶向投递系统的制备方法简单易行,便于操作;
4、所述靶向纳米投递系统的应用范围较广,可用于不恰当表达pl-csa的疾病的诊断、治疗,能够实现诊疗一体化。
附图说明
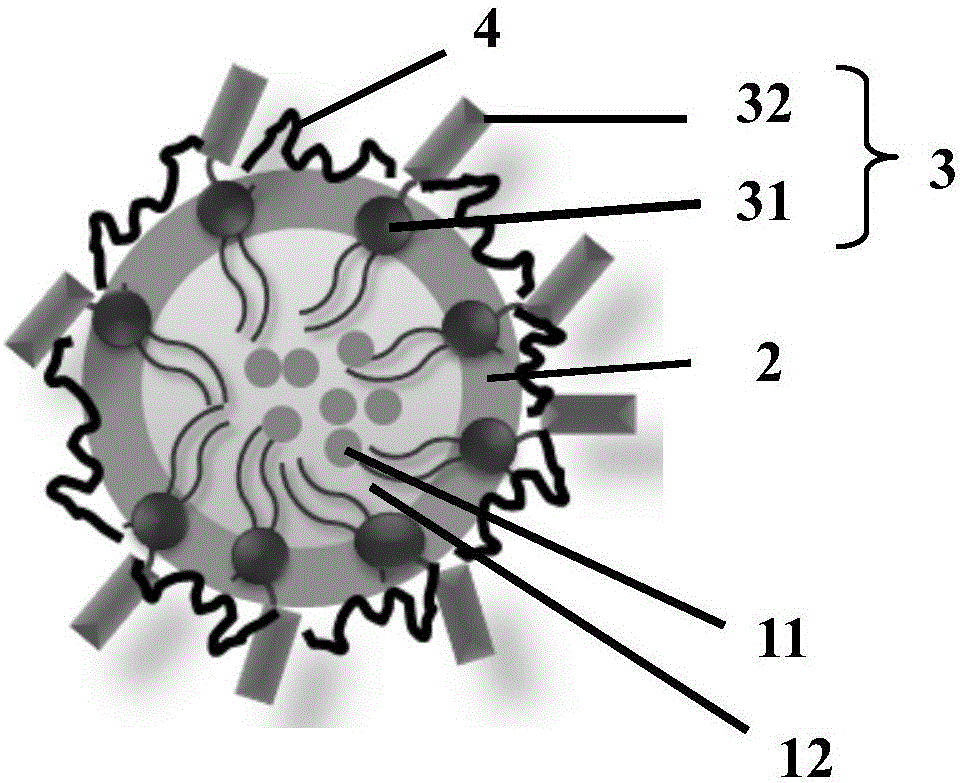
图1为实施例1制备的胎盘样硫酸软骨素a靶向纳米投递系统的结构示意图;
图2为实施例2中胎盘样硫酸软骨素a靶向纳米投递系统的粒径分布图;
图3为实施例3中胎盘样硫酸软骨素a靶向纳米投递系统的透射电镜图;
图4为实施例1中胎盘样硫酸软骨素a靶向纳米投递系统对小鼠卵巢癌组织的体外造影成像图,(a)为非靶向纳米投递系统组,(b)为靶向纳米投递系统组。
具体实施方式
以下所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
本发明中,用于靶向胎盘样硫酸软骨素a的多肽的序列如seqidno:1-seqidno:3所示。
具体地,lkpshekknddngkklckac如sequenceno.1所示。
edvkdinfdtkekflagclivsfhegkc如sequenceno.2所示。
gkktqelknirtnsellkewiiaafhegkc如sequenceno.3所示。
所述多肽是按照常规的多肽合成工艺进行,其中每个序列的最左端为n端,最右端为多肽的c端,c端或n端均可以与所述两亲性高分子化合物进行共价连接,这依据所用两亲性高分子化合物的性质而定。其中,当两亲性高分子化合物带有-cooh时,可利用其上的羧基与所述多肽的c端上的氨基(即,半胱氨酸c上的氨基)来进行酰胺反应。当两亲性高分子化合物带有氨基时,可利用其上的氨基与所述多肽的n端上的羧基来进行酰胺反应。
实施例1
一种胎盘样硫酸软骨素a靶向纳米投递系统的制备方法,包括以下步骤:
(1)将0.1g的聚乳酸-羟基乙酸共聚物(plga,分子量为15000,单体乳酸与羟基乙酸的共聚比为50:50)溶于4ml二氯甲烷中,并加入60μl(密度为5mg/ml)的全氟辛基溴化铵(pfob),得到plga溶液,其中,plga的浓度为25mg/ml,pfob的浓度为0.075mg/ml;
(2)将10mg的阿霉素和1mg的dspeg-peg-cooh溶解于1ml乙腈中,得到第一混合溶液;
(3)将上述4ml的plga溶液加入到上述1ml的第一混合溶液中,于恒温(20℃)振荡器中震荡2~5min,得到第二混合溶液;
(4)将20ml、1.5%的胆酸钠水溶液加入到上述第二混合溶液中,于120v、300w下超声处理1-3min,得到预乳液;
(5)将上述预乳液置于恒温蒸发仪中进行蒸发以去除有机溶剂二氯甲烷和乙腈,得到纳米投递系统前驱体;
(6)将纳米投递系统前驱体在截留分子量为10kda的超滤离心管中,加水洗涤,进行超滤离心,重复3次,其中离心转速36000rpm,每次离心4min,收集上清液;
(7)将30ml、1wt.%聚乙烯醇(pva)溶液加入到上述上清液中,于-20℃冷冻干燥24h,得到靶向纳米投递系统前驱体;
(8)将所述靶向超声纳米投递系统前驱体溶于水中,加入42μgedc和17μgnhs进行表面活化2h,之后加入2mg的序列为lkpshekknddngkklckac(如sequenceno.1所示)的多肽,在4℃下进行酰胺化反应16h,得到反应液;
将上述反应液用截留分子量为10kda超滤管进行超滤离心,并用pbs洗涤,重复3次,其中离心转速为3600rpm,每次离心3min,收集上清液,得到胎盘样硫酸软骨素a靶向纳米投递系统。
图1为本发明实施例1制得的胎盘样硫酸软骨素a靶向纳米投递系统的结构示意图。所述靶向纳米投递系统包括疏水性多聚物层2、黏性分子4和外壳3,其中,所述黏性分子4粘附在所述疏水性多聚物层2表面,所述外壳3为靶向胎盘样硫酸软骨素a的多肽32所接枝的两亲性大分子化合物31,所述两亲性大分子化合物31的疏水端穿插于所述疏水性多聚物层中,所述两亲性大分子化合物31的亲水端与所述多肽32通过酰胺键连接,所述多肽32暴露在所述疏水性多聚物层2之外,也暴露在靶向纳米投递系统的最外面。所述靶向纳米投递系统还包括被所述疏水性多聚物层2包裹的目标投递物,目标投递物构成该靶向纳米投递系统的内核。在本实施例中,所述目标投递包括液态超声造影剂pfob(图中标号是12),以及抗肿瘤药物阿霉素11。疏水性多聚物层2的成分为plga,黏性分子4为pva,两亲性大分子化合物31为dspe-peg-cooh。
实施例2
一种胎盘样硫酸软骨素a靶向纳米投递系统的制备方法,包括以下步骤:
(1)将0.2g的plga(分子量为15000,单体乳酸与羟基乙酸的共聚比为50:50)溶解于4ml丙酮中,并加入80μl(5mg/ml)的十四氟己烷搅拌均匀,得到plga溶液;
(2)将80mg紫杉醇和3mg的dspeg-nh2溶解于1ml乙腈中,得到第一混合溶液;
(3)将上述4ml的plga溶液加入到上述1ml第一混合溶液中,恒温(20℃)振荡器中震荡2~5min,得到第二混合溶液;
(4)将20ml、1.5%的胆酸钠水溶液加入到上述第二混合溶液中,于120v、400w超声处理2min,得到预乳液;
(5)将上述预乳液置于恒温蒸发仪中蒸发去除有机溶剂,得到纳米投递系统前驱体;
(6)将纳米泡前驱体在截留分子量为10kda的超滤离心管中,加水洗涤,进行超滤离心,重复3次,其中离心转速3000rpm,每次离心5min,收集上清液;
(7)将30ml、2wt%的pva水溶液加入到上述上清液中,于-20℃冷冻干燥48h,得到靶向载药纳米投递系统前驱体;
(8)将所述靶向载药超声纳米投递系统前驱体溶于mes缓冲液中(ph=5.5),加入100μg的edc和50μg的nhs进行表面活化1.5h,之后加入6mg的序列edvkdinfdtkekflagclivsfhegkc(如sequenceno.2所示)的多肽,在4℃下进行酰胺化反应20h,得到反应液;
将上述反应液用截留分子量为10kda超滤管进行超滤离心,并用水洗涤,重复3次,其中离心转速为4000rpm,每次离心2min,收集上清液,得到胎盘样硫酸软骨素a靶向纳米投递系统。
图2为本发明实施例2所得靶向纳米投递系统的透粒径分布图。从图2中可看出,该靶向纳米投递系统的平均粒径为106±4.2nm,其中200nm以下的纳米泡的分布强度达到82%;其pdi(聚合物分散性指数)为0.126±0.004,这进一步说明所制备的靶向纳米投递系统的粒径分布较均一。
实施例3
一种胎盘样硫酸软骨素a靶向纳米投递系统的制备方法,包括以下步骤:
(1)将0.2g的聚己内酯溶解于4ml氯仿,并加入50μl(6mg/ml)的pfob,得到聚己内酯溶液;
(2)将20mg甲氨蝶呤和4mg的dspeg-cooh溶解于1ml乙腈中,得到第一混合溶液;
(3)将上述4ml的聚己内酯溶液加入到上述1ml的第一混合溶液中,恒温(23℃)振荡器中震荡2~5min,得到第二混合溶液;
(4)将20ml、1.5%的胆酸钠水溶液加入到上述第二混合溶液中,于120v、350w超声处理1-3min,得到预乳液;
(5)将上述预乳液置于恒温蒸发仪中蒸发去除有机溶剂,得到纳米投递系统前驱体;
(6)将纳米泡前驱体在截留分子量为10kda的超滤离心管中,加水洗涤,进行超滤离心,重复4次,其中离心转速4000rpm,每次离心4min,收集上清液;
(7)将30ml、1.2wt%的pva水溶液保护剂加入到上述上清液中,于-20℃冷冻干燥36h,得到靶向载药纳米投递系统前驱体;
(8)将所述靶向载药超声纳米泡前驱体溶于mes缓冲液中(ph=5.5),加入120μg的edc和60μg的nhs进行表面活化2h,之后加入8mg的序列gkktqelknirtnsellkewiiaafhegkc(如sequenceno.3所示)的多肽,在4℃下进行酰胺化反应18h,得到反应液;
将上述反应液用截留分子量为10kda超滤管进行超滤离心,并用pbs洗涤,重复3次,其中离心转速为3800rpm,每次离心3min,收集上清液,得到胎盘样硫酸软骨素a靶向纳米投递系统。
图3为本发明实施例3所得靶向纳米投递系统的透射电镜照片。从图3中可看出,该靶向纳米投递系统的形貌较规则呈球形,大小较均一,粒径约为100-120nm。
应用实施例靶向纳米投递系统的体内超声成像能力研究
对本发明实施例1中制备的胎盘样硫酸软骨素a靶向纳米投递系统进行体内超声能力研究,以未连接多肽的纳米泡(即靶向载药纳米泡前驱体)为非靶向对照组,具体操作如下:
采用4-6周,体重为15-20g的雌性balb/c裸鼠作为试验动物,对裸鼠皮下注射1×106个卵巢癌(skov3)细胞,等肿瘤体积涨到0.5cm2注射不同的纳米泡,注射10min后,使用超声诊断仪,设置成浅表器官常规测试模式,收集储存图片。超声成像的结果如图4所示。其中,图4中(a)为非靶向纳米投递系统组,(b)为靶向纳米投递系统组,圆圈处代表肿瘤。
从图4可以看出,当注射胎盘样硫酸软骨素a靶向纳米投递系统10min后,肿瘤部位有很强的超声成像信号,而非靶向纳米投递系统,在肿瘤部位未能检测到超声信号(当存在超声信号,圈处呈色度较浅的白色)。这说明,制备的靶向纳米投递系统对卵巢癌有很强的特异性识别,并且能够快速地到达肿瘤部位,后期可以在靶向纳米投递系统内负载治疗性物质运输到肿瘤部位。该靶向纳米投递系统可以作为治疗和诊断卵巢癌的新型靶向制剂。此外,还可用作其他与pl-csa相关的疾病中。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
sequencelisting
<110>中国科学院深圳先进技术研究院
<120>胎盘样硫酸软骨素a靶向纳米投递系统及其制备方法和应用
<130>2017
<160>3
<170>patentinversion3.3
<210>1
<211>20
<212>prt
<213>人工序列
<400>1
leulysproserhisglulyslysasnaspaspasnglylyslysleu
151015
cyslysalacys
20
<210>2
<211>28
<212>prt
<213>人工序列
<400>2
gluaspvallysaspileasnpheaspthrlysglulyspheleuala
151015
glycysleuilevalserphehisgluglylyscys
2025
<210>3
<211>30
<212>prt
<213>人工序列
<400>3
glylyslysthrglngluleulysasnileargthrasnsergluleu
151015
leulysglutrpileilealaalaphehisgluglylyscys
202530
- 还没有人留言评论。精彩留言会获得点赞!
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法