无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
本发明涉及生物医药技术领域,特别涉及无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用。
背景技术:
癌症是严重威胁人类生命健康的疾病之一,肿瘤转移则是癌症患者死亡的最主要原因,资料表明,恶性肿瘤发生转移的比例达60%-62.5%,因此控制肿瘤转移是决定癌症患者预后的关键因素。某种程度上说,防止肿瘤转移即能控制肿瘤所致的死亡。肿瘤转移过程牵涉到细胞脱落、浸润、迁移运行、着床、新生血管生成等,理论上讲,只要能够阻止上述一个或多个过程,就能抑制肿瘤转移。因此,找出抗肿瘤转移的药物刻不容缓。
核酸适配体(aptamer)是一类寡核苷酸片段,包括核糖核酸(rna)和单链脱氧核糖核酸(ssdna),可与不同的靶标分子高亲和力特异性结合。它可作用于蛋白质、金属离子、小分子化合物、细胞膜表面受体等靶标。较之抗体、多肽等较常见的靶向性配体,核酸适配体具有体积相对较小、免疫原性较低且易于体外筛选、性质稳定、易合成、易标记、分子量较小和目标分子广泛等优势。随着研究不断深入,以适配体靶向纳米递送系统在肿瘤治疗中将会有广阔的应用前景。
近几年来,纳米药物载体在医学领域的应用极为广泛,尤其是在生物医学领域,得到越来越多研究者的关注,纳米药物载体已经成为生物医学领域的前沿和热点问题,在医药卫生领域有着广泛的应用和明尤其确的产业化前景。虽然纳米药物载体以其优异且独特的性质在疾病诊断、治疗和卫生保健方面发挥重要作用,但是能够应用临床的很少。当前的纳米药物载体虽在一定程度上提高了疏水性药物的生物利用度,但是载体本身的生物相容性和细胞毒性不容忽视。最新的研究发现大多数人工合成的纳米载体存在安全性问题,据报道一些纳米载体在临床试验中引起休克、呼吸困难、低血压等十分严重的不良症状,甚至有死亡的现象。纳米载体在体内的代谢机制不明确,对细胞产生毒副作用将成为阻碍纳米载药体系向前发展和进一步应用于临床的棘手问题。与传统的纳米载药体系相比,无载体纳米载药体系解决了纳米载体体系复杂、质控困难、作用机制不明确和代谢不清楚等问题。无载体纳米载药体系消除了引入载体对人体带来的安全问题,同时减轻对人体额外代谢的负担,更解决了载体纳米粒制备过程中批次质量不可控的问题。
熊果酸(ursolicacid,ua)又名乌索酸(乌苏酸),属五环三萜类化合物。它在自然界分布很广,如存在于杜鹃花科植物熊果的叶、果实中,玄参科植物毛泡桐的叶中,以及木樨科植物女贞的叶中。熊果酸具有广泛的生物活性,包括抗癌、对肝损伤的保护、抗菌消炎和抗病毒等作用。近年来体内试验证明发现:熊果酸的抗肿瘤作用广泛,熊果酸不仅对多种致癌、促癌物有抵抗作用,而且能抑制多种恶性肿瘤细胞的生长,此外熊果酸可以明显增强机体免疫功能,这说明熊果酸极有可能成为低毒有效的新型抗癌药物。
阿霉素(doxorubicin,dox)是一种蒽环糖苷类的广谱抗肿瘤药物,阿霉素结构上既有脂溶性蒽环配基和水溶性柔红糖胺,又有酸性酚羟基和碱性氨基,易通过细胞膜进入肿瘤细胞,具有很强的药理活性。临床上用于治疗急性淋巴细胞白血病、急性粒细胞性白血病、霍奇金和非霍奇金淋巴瘤、乳腺癌、肺癌、卵巢癌、软组织肉瘤、成骨肉瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、膀胱瘤、甲状腺瘤、绒毛膜上皮癌、前列腺癌、睾丸癌、胃癌、肝癌等。
技术实现要素:
本发明的目的在于提供一种无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用。本发明通过π-π堆积、疏水和静电力形成的具有靶向抗癌活性的共组装纳米药物,以解决现有技术中人工合成的载体纳米体系复杂、质控困难、作用机制不明确和代谢不清楚等问题,以达到协同治疗肿瘤的目的。
为实现上述目的,本发明采用的技术方案是:
无载体共组装肿瘤靶向抗癌纳米药物,其是由双抗癌纳米药物吸附具有肿瘤靶向功能的靶标而获得,所述双抗癌纳米药物为熊果酸与抗癌药物共组装而成。
所述靶标为核酸适配体、分子靶标、抗体或多肽。
所述核酸适配体为epcam、her2或muc1。
所述分子靶标为叶酸、乳糖酸或透明质酸。
与熊果酸共组装的抗癌药物包括但不限于盐酸阿霉素、盐酸厄洛替尼、甲苯磺酸索拉非尼、阿柔比星、阿柔比星b、伊达比星、吡柔比星、多西他赛、福美坦、埃博霉素、雷公藤内酯醇、米非司酮、喜树碱、10-羟基喜树碱、秋水仙碱、长春新碱、甲氨蝶呤、他莫西芬、替尼泊苷、顺铂和6-巯基嘌呤、盐酸柔红霉素、盐酸表阿霉素、盐酸佐柔比星或盐酸米托蒽醌和5-氟尿嘧啶。
本发明将熊果酸与抗癌药物共组装得到双抗癌纳米药物,双抗癌纳米药物通过电荷间相互作用吸附荧光标记核酸适配体或分子靶标或抗体、多肽等,形成无载体共组装肿瘤靶向抗癌纳米药物,该肿瘤靶向抗癌纳米药物同时兼具靶向性、成像和治疗的功能,可作为抑制肿瘤转移的药物而应用,能够达到很好的肿瘤治疗效果。
本发明所述无载体共组装肿瘤靶向抗癌纳米药物的制备方法,包括以下步骤:
1)将熊果酸溶于良性溶剂a中,得到溶液a,所述溶液a中的熊果酸浓度范围为1000μm‐20000μμ,所述良性溶剂a为二氯甲烷、氯仿、乙醚、乙酸乙酯、乙酸甲酯、丙酮、正丙醇、甲醇、吡啶、乙酸、二甲基亚砜中的一种或多种;
2)将待与熊果酸共组装的抗癌药物溶于良性溶剂b中,得到溶液b,所述溶液b中的抗癌药物浓度范围为1000μm‐20000μm,所述良性溶剂b为待组装抗癌药物的良性溶剂;
3)a.当所述良性溶剂b为水:
在搅拌状态下,将溶液a缓慢滴入溶液b中,搅拌一定的时间后得到溶液c1,溶液a与溶液b的体积为1:10‐1:100,溶液c1中熊果酸的浓度范围为100μm‐2000μm;
b.当所述良性溶剂b为非水良性溶剂:
将溶液a和溶液b混合得到混合液,混合液中熊果酸与抗癌药物的物质的量的浓度比为5:1-10:1,抗癌药物的物质的量的浓度范围为10μm-4000μm;然后在搅拌状态下,将混合液缓慢滴入熊果酸的不良溶剂中,搅拌一定的时间后得到溶液c2,混合液与不良溶剂的体积为1:10-1:100,溶液c2中的熊果酸浓度范围为100μm-2000μm;
所述不良溶剂为磷酸盐缓冲液、水、生理盐水、葡萄糖溶液中的一种或多种;
4)将上述得到的溶液c1或溶液c2搅拌0.5-2h后得到双抗癌纳米药物;
5)将上述双抗癌纳米药物中的有机溶剂吹干,之后滴加具有肿瘤靶向功能的靶标分子溶液,然后超声10-60min,得到肿瘤靶向抗癌纳米药物。
进一步,与熊果酸组装的抗癌药物为阿霉素,靶标分子为aptamer,得到的肿瘤靶向抗癌纳米药物为ap/ud纳米粒,所述ap/ud纳米粒的制备方法包括以下步骤:
1)将熊果酸溶于良性溶剂a中,得到溶液a,所述溶液a中的熊果酸浓度范围为1000μm‐20000μμ,所述良性溶剂a为二氯甲烷、氯仿、乙醚、乙酸乙酯、乙酸甲酯、丙酮、正丙醇、甲醇、吡啶、乙酸、二甲基亚砜中的一种或多种;
2)将盐酸阿霉素溶于良性溶剂b中,得到溶液b,所述溶液b中的盐酸阿霉素浓度范围为1000μm‐20000μm,所述良性溶剂b为水、甲醇、吡啶、乙酸、二甲基亚砜中的一种或多种;
3)a.当所述良性溶剂b为水:
在搅拌状态下,将溶液a缓慢滴入溶液b中,搅拌一定的时间后得到溶液c1,溶液a与溶液b的体积为1:10‐1:100,溶液c1中的熊果酸浓度范围为100μm‐2000μm;
b.当所述良性溶剂b为甲醇、吡啶、乙酸、二甲基亚砜中的一种或多种:
将溶液a和溶液b混合得到混合液,混合液中熊果酸与盐酸阿霉素的物质的量的浓度比为5:1-10:1,盐酸阿霉素的物质的量的浓度范围为10μm-4000μm;然后在搅拌状态下,将混合液缓慢滴入不良溶剂中,搅拌一定的时间后得到溶液c2,混合液与不良溶剂的体积为1:10-1:100,溶液c2中的熊果酸浓度范围为100μm-2000μm;
所述不良溶剂为磷酸盐缓冲液、水、生理盐水、葡萄糖溶液中的一种或多种;
4)将上述得到的溶液c1或溶液c2搅拌0.5-2h后得到双抗癌纳米药物ud;
5)将上述双抗癌纳米药物ud中的有机溶剂吹干,之后滴加aptamer溶液,然后超声10-60min,得到ap/ud纳米粒,即肿瘤靶向抗癌纳米药物。
本发明采用以上技术方案,用疏水性药物熊果酸和广谱抗肿瘤药物如阿霉素(或其它抗癌药物)共组装形成无载体纳米药物(ua-dox,简称ud),并通过电荷间相互作用在其表面吸附具有肿瘤靶向功能的荧光标记核酸适配体或分子靶标或抗体、多肽等,获得的肿瘤靶向抗癌纳米药物同时兼具靶向性、成像和治疗的功能,从而达到协同的抗肿瘤作用,实现诊疗一体化,尤其在抗肿瘤转移方面作用突出,更重要的是解决了传统纳米载体带来的体系复杂和体内代谢不明确等问题。
所述的熊果酸的结构式如式ⅰ所示,阿霉素的结构式如式ⅱ所示:
本发明的优点在于:
1、本发明所制备的双抗癌纳米药物中所用的熊果酸既具有良好的抗癌效果又具有抗转移效果;
2、本发明所制备的无载体双抗癌纳米药物中的熊果酸在水中可以通过溶剂交换法自组装成为纳米粒,并且可以和抗癌药物阿霉素等共组装形成新的纳米粒,有效地解决了抗癌药物熊果酸的水溶性和生物利用度的问题;
3、本发明的无载体双抗癌纳米药物具备ph响应性;
4、本发明双抗癌纳米药物表面电势是正,可以对本发明的无载体双抗癌纳米药物进行表面修饰,例如连上带有负电荷的叶酸或核酸适配体,使无载体双抗癌纳米药物具有靶向性和成像等功能,增加双抗癌纳米药物对肿瘤细胞的杀伤力,并可实现诊疗一体化;
5、本发明所制备的无载体双抗癌纳米药物制备过程简单,方便,可以解决传统纳米载体在体内代谢不明确,体系复杂等问题,消除了人工合成载体带来的临床安全性问题,并能为以后新药研发和制备提供新的思路。
附图说明
图1为实施例1中ua纳米胶束粒径图;
图2为实施例1中ua甲醇溶液与ua胶束溶液的对比成像图;
图3为实施例2中ud纳米粒的粒径图;
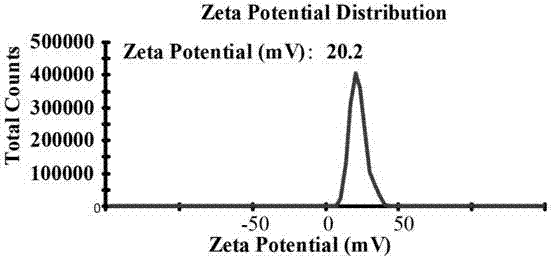
图4为实施例2中ud纳米粒的电势图;
图5为实施例2中ud溶液与实施例1中的ua纳米胶束以及ua甲醇溶液的对比成像图;
图6为实施例3中fud纳米粒的粒径图;
图7为实施例4中ap/ud纳米药物的粒径图;
图8为实施例5中ap/ud电泳图;
图9为实施例6中ap/ud对mcf-7肿瘤细胞的增殖抑制作用;
图10为实施例7中ap/ud对mcf-7肿瘤细胞的抗迁移作用;
图11为实施例8中ap/ud对mcf-7肿瘤细胞的抗侵袭作用;
图12为实施例9中ap/ud对mcf-7肿瘤细胞的抗粘附作用;
图13为实施例10中ud、ua纳米胶束的丁达尔效应;
图14为实施例11中ud的ph响应图。
具体实施方式
下面结合具体实施方式对本发明所述的技术方案作进一步的说明,但是本发明不仅限于此。
实施例1
熊果酸纳米胶束的制备方法
精确称取ua粉末0.00456g,溶于1ml甲醇中,超声溶解,配置成10mm的熊果酸甲醇溶液;取100μl上述溶液,在搅拌过程中逐滴滴加到含有2ml二次水中(注:滴加过程中高速搅拌,滴加时间为30s),此时ua在溶液中的浓度为500μm,然后搅拌8min,即得ua纳米胶束。
本实施例制备的ua纳米胶束平均粒径98.32纳米左右,粒径图如图1所示。
本实施例制备的ua纳米胶束溶液与ua甲醇溶液的对比成像图如图2所示。
实施例2
精确称取ua粉末0.00456g,溶于1ml甲醇中,超声溶解,配制成10mm的ua甲醇溶液;精确称取盐酸阿霉素粉末0.00579g,溶于1ml二次水中,超声溶解,配制成10mm的盐酸阿霉素水溶液;取200μlua甲醇溶液,逐滴滴加到含有2000μl含阿霉素水溶液的烧杯中(注:滴加过程中高速搅拌,滴加时间为30s,盐酸阿霉素水溶液浓度为0.2μm),ua在溶液中的浓度为1000μm,搅拌8min后,高速搅拌2h后,吹干甲醇溶液,即得无载体双抗癌纳米药物ud;
本实施例制备的无载体双抗癌纳米药物ud的平均粒径在207纳米左右,粒径图如图3所示。电势在15.1mv左右,电势如图4所示。
本实施例制备的ud溶液与实施例1中的ua纳米胶束以及ua甲醇溶液的对比成像图如图5所示。
实施例3
取实施例2制备的ud纳米溶液,滴加20μl叶酸溶液(水悬液,10mm),然后超声20min,混悬液消失,制备出具有叶酸靶向的fud纳米粒。
本实施例制备的无载体双抗癌纳米药物fud的平均粒径在164纳米左右,粒径图如图6所示。
实施例4
在实施例2备的ud纳米粒的基础上,取100μl于ep管中,滴加10μl(her2适配体,10μm),超声20min后,制备所得ap/ud纳米粒,使用dls检测粒径大小。
本实施例制备的ap/ud纳米药物的粒径118纳米左右,其粒径图如图7所示。
实施例5
实施例4制备所得ap/ud纳米粒,用聚丙烯酰胺凝胶电泳检测适配体是否成功吸附在ud纳米粒表面。
如图8所示,适配体成功地吸附在纳米粒表面(1为阿霉素,2为适配体,3为ap/ud纳米粒)。
实施例6
ud和ap/ud纳米药物的抗癌活性,通过细胞毒性来实现,采用标准mtt法测定ap/ud、ud、ua和dox及ua+dox对mcf-7细胞的增殖抑制活性,具体步骤为:
(1)取处于对数生长期状态良好的mcf-7细胞,经胰蛋白酶消化后,计数并调整细胞密度为0.8×105个/ml,配成细胞悬液。于每孔100μl接种到96孔板中,周围用nacl封板,置于37℃,5%co2培养箱中培养24h。
(2)去除旧的培养基,每孔加入100μl不同浓度梯度的含样品的培养基,另设空白对照组,每组设置5个复孔,于培养箱中继续孵育24h。
(3)移除培养基,于每孔中加入100μlmtt溶液(无血清、无酚红的rmpi1640培养基:mtt母液=9:1,v:v),继续孵育4h。
(4)取出96孔板终止培养,用移液枪轻轻吸去96孔板中的上清液,每孔加入dmso溶液100μl,振荡摇匀10min,使蓝紫色结晶全部溶解,用酶标仪于490nm波长处测定每孔的od值,使用graphpadprism5处理,实验结果如图9所示。
结果显示,药物的联合使用有一定的协同效果,纳米药物组的细胞毒性显著提高,在每组对应的浓度下都是ap/ud肿瘤靶向抗癌纳米药物组的抗肿瘤效果最好,和单药相比有显著性差异。
实施例7
ud和ap/ud纳米药物抗肿瘤细胞迁移活性,通过细胞划痕来测定ap/ud、ud、ua和dox及ua+dox对mcf-7细胞的迁移抑制作用,具体步骤为:
(1).取对数生长期状态良好的mcf-7细胞,经胰蛋白酶消化后,计数并调整细胞密度为8×105个/ml,配成细胞悬液。于每孔150μl接种到12孔板中,周围用nacl封板,置于37℃,5%co2培养箱中培养24h。
(2).第二天用枪头比着直尺,尽量垂至于孔板,枪头要垂直,每个孔划3天平行的直线。
(3).pbs洗细胞3次,去处划下的细胞,加入无血清培养基
(4).按照相应的药物浓度加入药物(ua:1.25μm;dox:0.25μm;ua+dox,udnps和ap/udnps相应的浓度)。
(5).放入37℃5%co2培养箱,培养。24h取样,拍照。
结果如图10所示,ua和dox在该浓度下和空白组对比有一定的抗肿瘤细胞迁移效果,混合物的抗肿瘤细胞迁移和单药没有显著性差异,纳米组有显著性提高了两药抗mcf-7细胞迁移效果,尤其是ap/udnps增加her2适配体靶向后,进一步提高了药物抗肿瘤细胞迁移效果。
实施例8
为了验证ap/ud纳米粒的抗侵袭能力,利用traswell实验验证ap/ud纳米粒对mcf-7的抗侵袭能力,具体步骤如下:
1、transwell法测定不同肿瘤细胞的侵袭能力,用1mg/ml的matrigel稀释液包被transwell小室底部膜的上室面,4℃风干。弃小室中残余液体,每孔加入50μl的1%bsa无血清培养液,于37℃放置1h。
2、取指数生长期的肿瘤细胞,消化离心,弃去上清液后用含0.1%bsa的无血清培养基重悬。调整细胞密度至1×106/ml,吸取200μl加入transwell上室,下室加入500μl含有20%fbs及含有纳米药物(ap/ud浓度含ua:1.25μm;dox:0.25μm)的培养基。
3、37℃培养24小时后,取出transwell小室用pbs洗2遍,用棉签擦去基质胶和上室内的细胞,用95%预冷的甲醇溶液中固定20min,后用0.1%的结晶紫染色15min,弃去染色液,用pbs清洗2遍。室温晾干后于正置显微镜进行观察和拍照。随机选取8个不同的视野细胞拍照并计数,实验重复3次。
结果如图11所示,ap/udnps增加her2适配体靶向后,对mcf-7细胞具有显著的抗侵袭能力。
实施例9
为了验证ap/ud纳米粒的抗粘附能力,利用细胞粘附实验验证ap/ud纳米粒对mcf-7的抗粘附能力,具体步骤如下:
细胞粘附实验:将处于对数期的huvec细胞消化后接种于24孔板,待上述24孔板的内皮细胞长满孔板时,用pbs清洗两三次,然后加入含有内皮刺激因子il-1β,浓度为1ng/l的培养基,在37℃,5%co2的条件下孵育4h,以此激活内皮细胞。4h后取出孔板,用pbs清洗两三次后,取对数生长期肿瘤细胞,荧光标记后制成4×105/ml-1单细胞悬液,并加入不同浓度药物(ap/ud浓度含ua:1.25μm;dox:0.25μm)的rpm-1640培养液,每孔500μl。37℃、5%co2孵育2h后,pbs轻洗3遍,控干后加入无血清培养液500μl。然后在荧光显微镜下进行拍照。
结果如图12所示,ap/udnps增加her2适配体靶向后,对mcf-7细胞具有显著的抗粘附能力。
实施例10
将实施例1制备的ua纳米胶束和实施例2制备的无载体共组装双抗癌纳米药物ud,分装白色瓶中,然后用激光笔照射,观察现象,结果如图13所示。观察到一束均一的光束,明显的丁达尔现象。
实施例11
将实施例2制备的ud各取500μl三份于比色皿中,然后分别加入ph为5.0、6.5和7.4的pbs溶液1500μl,观察现象。
如图14所示,ph5.0出现明显的浑浊,ph6.5出现少量析出,ph7.4的情况下纳米药物能够均一的存在。
以上所述仅为本发明的举例说明,对于本领域的技术人员而言,根据本发明的教导,在不脱离本发明的原理和精神的情况下凡依本发明申请专利范围所做的均等变化、修改、替换和变型,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!