pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与流程
本发明属于生物医药技术领域,更具体涉及一种pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法。
背景技术:
恶性肿瘤已经成为严重威胁人类健康的多发病和常见病,中国每年有220万人因癌症而死亡。国际癌症研究机构预计,至2030年中国每年癌症患者将达到500万人,占到全球新增的20%以上。因此,对癌症的预防和治疗具有十分重要的意义。目前,对癌症的治疗有多种手段,包括手术治疗、化学疗法、放射疗法、免疫疗法、基因疗法、中医中药疗法等。其中化疗是治疗肿瘤的主要手段之一,但是由于化疗药物缺乏选择性,在杀灭癌细胞的同时也会不可避免地损伤人体的正常组织细胞,产生较强的毒副作用。因此,提高抗肿瘤药物的靶向性,增大药物在肿瘤部位的富集,降低药物本身带来的毒副作用,对肿瘤的治疗有重要的现实意义和临床价值。
聚酰胺-胺树枝状大分子(Polyamidoamine dendrimer,PAMAM)是目前研究最广泛、最成熟的树状大分子之一,因其具有独一无二的结构特性而受到广泛的关注。PAMAM具有自己独特的结构特征:首先,其内部具有疏水性的空腔,可以包裹疏水性的药物分子,如阿霉素、紫杉醇等;其次,其末端有许多反应活性较强的氨基,通过修饰不仅可以连接多肽或抗体等生物活性物质,而且还可以通过酸敏感或还原敏感的化学键连接药物分子;此外,PAMAM还具有稳定、无免疫原性和良好的生物相容性等优点。
但是由于高代数的PAMAM会引起一定的细胞毒性和溶血毒性,所以通常在PAMAM表面对其进行PEG化的修饰,一方面可以减少其毒副作用,另一方面可进一步提高该载药系统的亲水性,从而延长药物在血液中的循环时间,有助于药物被动靶向于肿瘤组织,从而提高药物治疗效果。但是,经PEG修饰后的载体可能会在一定程度上降低药物的释放,且对PAMAM本身的酸敏感性及质子海绵效应造成一定的影响,这将降低药物的抗肿瘤效果。
因此,根据肿瘤胞内微环境的特点设计构建了一种pH氧化还原双敏感的靶向纳米给药载体是十分必要的。
技术实现要素:
本发明的目的是提供一种可根据肿瘤胞内微环境的特点,集主动靶向、长循环、pH氧化还原敏感、溶酶体逃逸等功能为一体的PAMAM靶向纳米给药载体及其制备方法。
根据本发明的一个方面,提供了一种高效pH氧化还原双敏感的PAMAM靶向纳米给药载体,通式为T-PEGn-SS-PAMAM-(His)m,
其中,T为肿瘤靶向配体,PAMAM为阳离子聚酰胺-胺树状大分子,PEG为聚乙二醇,-SS-为桥键二硫键,His为组氨酸,n为20-1000,m为1-4096。
在一些实施方式中,所述阳离子聚酰胺-胺树状大分子为以乙二胺为核的第1-10代聚酰胺-胺树状大分子。根据本发明的另一个方面,携载药物的高效pH氧化还原双敏感的PAMAM靶向纳米给药载体,通式为T-PEGn-SS-PAMAM-(His)m/X,
其中,T为肿瘤靶向配体,X为抗肿瘤药物,PAMAM为阳离子聚酰胺-胺树状大分子,PEG为聚乙二醇,-SS-为桥键二硫键,His为组氨酸,n为20-1000,m为1-4096。
在一些实施方式中,所述肿瘤靶向配体为转铁蛋白或叶酸或多肽。。
在一些实施方式中,所述抗肿瘤药物为阿霉素。
在一些实施方式中,所述阳离子聚酰胺-胺树状大分子为以乙二胺为核的第1-10代聚酰胺-胺树状大分子。
在一些实施方式中,阳离子聚酰胺-胺树状大分子为以乙二胺为核的第4代聚酰胺-胺树状大分子。
高效pH氧化还原双敏感的PAMAM靶向纳米给药载体的制备方法,包括如下步骤:
(1)以二甲基甲酰胺为溶剂,以1-羟基苯并三氮唑(HOBt)、苯并三氮唑-N,N,N,N-四甲基脲六氟磷酸酯(HBTU)和N,N-二异丙基乙胺(DIPEA)为催化剂,使PAMAM与N-芴甲氧羰基-N'-三苯甲基-组氨酸(Fmoc-His(trt)-OH)进行反应制得PAMAM-His,反应如下:
(2)以甲醇为溶剂,使PAMAM-His、3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯(SPDP)和一端巯基化的PEG(HS-PEG-OCH3)反应制得PEG-SS-PAMAM-His,反应如下:
其中,n为20-1000,
(3)将PEG-SS-PAMAM-His羧基化后与肿瘤靶向配体反应,超滤纯化,冷冻干燥得T-PEGm-SS-PAMAM-(His)n,反应如下:
其中,n为20-1000,m为1-4096。其有益效果为:①由于肿瘤细胞繁殖比正常的组织细胞要快很多,肿瘤血管产生大量的乳酸,导致肿瘤部位的pH值(6.5)比正常组织的pH值(7.4)低。此外,肿瘤细胞内各个细胞器之间的pH值也有差异,比如内涵体的pH值在5.0~6.5之间,而溶酶体的pH值在4.5~5.0之间。通过His的修饰,提高载体的pH敏感性,发挥质子海绵效应。谷胱甘肽(GSH)是细胞中含量最高的巯基化合物,同时也是生物化学反应中的一种重要还原剂,它可以对二硫键进行剪切,使二硫键发生断裂。细胞内的胞浆中含有大量高浓度的GSH,通常为2~10mM,而在血液中仅存在少量低浓度的GSH(2~10μM)。此外,肿瘤组织中的GSH浓度是正常细胞和组织的4倍。本发明利用这种GSH浓度的巨大差异,提出的氧化还原敏感的载药系统用于肿瘤部位的靶向药物释放。
②本发明的载体不仅能显著降低高代数PAMAM所引起的细胞毒性和溶血毒性,同时还能减少网状内皮系统的摄取,延长血液中的滞留时间,从而有效的将药物输送至肿瘤组织。表面His的修饰可以增加载体的酸敏感性,增强PAMAM的质子海绵效应,使药物快速从酸性的溶酶体中逃逸出来。载体在肿瘤细胞内低pH和高还原环境条件下,PAMAM内核打开,同时载体中的二硫键发生断裂,PEG脱落,使药物能够快速有效的释放,从而达到提高抗肿瘤药物的治疗效果和降低毒副作用的目的。
③通过二硫键将PEG连接在PAMAM的表面,一方面可以显著降低PAMAM的溶血毒性,延长聚合物在血液中的循环时间;另一方面在复合物进入肿瘤细胞内后,在高还原性的胞浆环境是二硫键断裂,促进其包载的药物迅速释放,从而实现还原和pH双重敏感释药的目的。二硫键与His的连接有助于药物的释放,肿瘤靶向配体的连接增强了其主动靶向性,从而发挥出明显的抗肿瘤作用。
④为了提高聚合物的靶向效率,增加肿瘤细胞对聚合物的摄取量,以含铁蛋白质(Tf)为肿瘤靶向配体为例进行说明:本发明对聚合物载药系统的表面进行了Tf修饰,TfR是与细胞增殖有关的一种跨膜糖蛋白,普遍存在于各类细胞中,由于癌细胞增殖较快,对铁的需求量增大,导致癌细胞表面的TfR远远多于正常细胞,肿瘤细胞表面的TfR是正常细胞的2~7倍,肿瘤细胞表面TfR与Tf亲和力是正常细胞的10倍~100倍。通过Tf与肿瘤细胞表面的TfR特异性的识别来促进细胞摄取,发挥其主动靶向作用,增加抗肿瘤效果。
附图说明
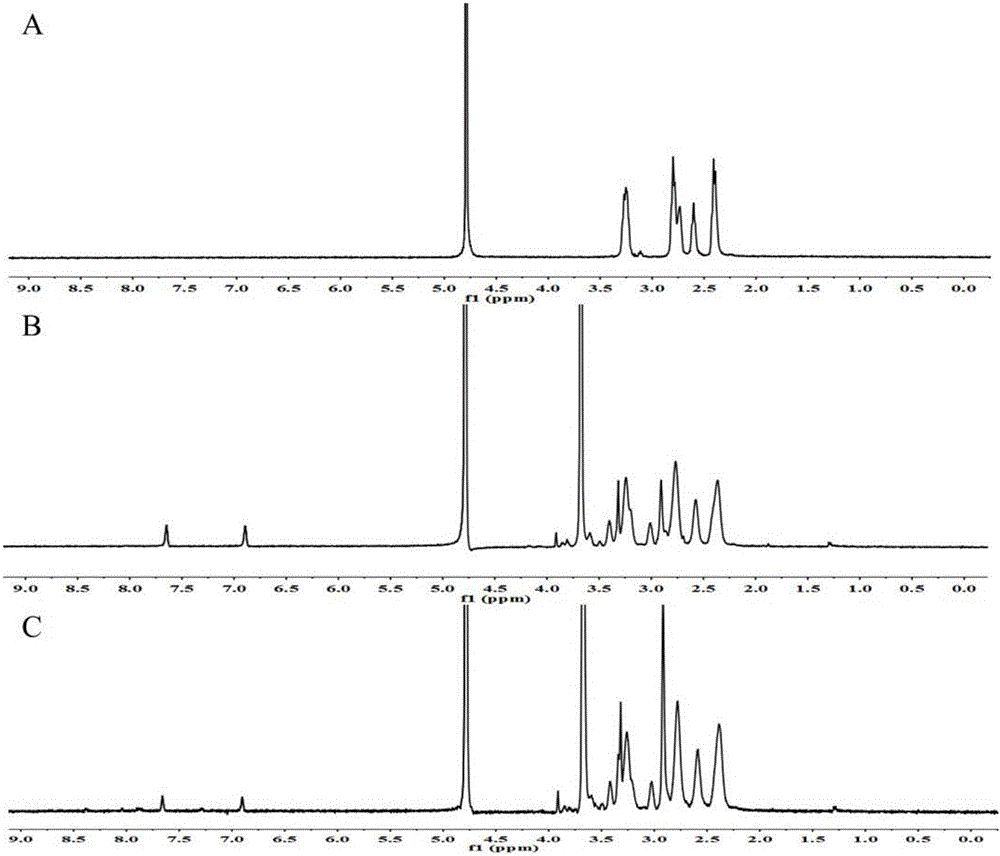
图1为PAMAM(A)、PAMAM-His(B)和PEG-SS-PAMAM-His(C)的1H-NMR图;
图2为Tf-PEG-SS-PAMAM-His/DOX、PSSPH/DOX和PPH/DOX的体外释放图;
图3为Tf-PEG-SS-PAMAM-His/DOX、PSSPH/DOX、PPH/DOX和DOX的体外抗MCF-7细胞实验的效果图;
图4为Tf-PEG-SS-PAMAM-His/DOX、PSSPH/DOX、PPH/DOX和DOX的体外抗HEPG2细胞实验的效果图;
具体实施方式
阳离子聚酰胺-胺树状大分子为以乙二胺为核的第4代聚酰胺-胺树状大分子,在下面的实施例中以第4代聚酰胺-胺树枝状聚合物(PAMAM,西格玛奥德里奇上海贸易有限公司)为例,转铁蛋白(Tf),盐酸阿霉素(DOX·HCl,纯度≥98%,北京华奉联博科技有限公司);功能化聚乙二醇(NHS-PEG2000-OCH3)(北京键凯科技有限公司),在T-PEGm-SS-PAMAM-(His)n通式中,m代表PEG的聚合度,n代表His的数量,在此处2000表示PEG的分子量,PEG的分子量为2000的聚合度仍落在20-1000之间。3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯(SPDP,圣克鲁斯生物技术上海有限公司);还原谷胱甘肽、甲醇、三乙胺等均购自国药集团化学试剂有限公司。采用超导核磁共振谱仪(Unity Inova 600M)对聚合物的结构进行确证,采用Nicomp TM 380 ZLS型激光纳米粒度/电位仪对聚合物粒径、电位进行表征。
实施例1
精密称取Fmoc-His(trt)-OH、1-羟基-苯并-三氮唑(HOBt)、苯并三氮唑-N,N,N,N-四甲基脲六氟磷酸酯(HBTU)、N,N-二异丙基乙胺(DIPEA)和PAMAM按64:64:64:64:1反应摩尔比溶于无水二甲基甲酰胺(DMF)中,氮气保护,室温避光反应12h;冷乙醚沉淀反应产物、洗涤、离心,然后重新溶于哌啶/DMF(v/v,30/70)溶液中,继续反应6h;冷乙醚再次沉淀产物,随后溶于三氟乙酸/三异丙基硅烷/H2O溶液中,反应12h;最后冷乙醚沉淀、DMF重新溶解、去离子水透析24h后冷冻干燥,即得终产物PAMAM-His。
将合成的产物PAMAM-His与SPDP以1:32摩尔比加入甲醇溶液中和,加入三乙胺,氮气保护,在30℃避光搅拌5h,然后加入一定量的HS-PEG-OCH3搅拌24h,旋蒸去除甲醇,透析冻干即得PEG-SS-PAMAM-His(PSSPH)。
将PEG-SS-PAMAM-His溶于MES缓冲溶液(0.1M,pH 6.0)中,加入5倍摩尔量的1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),活化羧基30min后,加入1M NaOH调pH至8.0,再加入三倍摩尔量的Tf,氮气保护,避光反应12h,反应结束后,将产物置于超滤管(Mw 100KDa)中,6000xg转速下,离心7-8次,冷冻干燥得淡红色固体即Tf-PEG-SS-PAMAM-His(Tf-PSSPH)。
PEG-PAMAM-His(PPH)的制备
精密称取实施例1制得的PAMAM-His和NHS-PEG2000-OCH3,按两者的反应摩尔比为1:16溶于磷酸缓冲液(0.1M,pH 8.2)中,避光搅拌24h。反应结束后将反应混合物转移至透析袋(MWCO=10KDa)中,蒸馏水透析3天,去除游离PEG,收集透析袋内液体,冷冻干燥得白色固体即为PEG-PAMAM-His(PPH)。
核磁分析
对PAMAM、实施例1中合成的产物的PAMAM-His和PEG-SS-PAMAM-His进行核磁分析,结果如图1所示,通过核磁氢谱对合成产物进行核磁分析,特征质子特征峰归属如下:其中PAMAM具有四个明显的的特征质子峰信号,分别为δ=2.45,2.61,2.81,3.28ppm;His特征质子峰信号分别为:δ=7.0,7.6ppm;同时HS-PEG2000-OCH3具有两个明显的特征质子峰信号,分别为:δ=3.35ppm(OCH3),δ=3.67ppm(CH2CH2O)。从产物PSSPH的核磁氢谱中可以发现同时具有PAMAM、His和HS-PEG2000-OCH3的特征质子峰,表明His和PEG已经成功共价结合到PAMAM表面。采用峰面积归一化法,HS-PEG2000-OCH3在δ3.67处H的个数为182个,而PAMAM在δ2.45处H的个数为248个,按照以下公式来计算PEG的连接个数:
Tf连接率测定
Tf的连接率采用BCA法测定样品在570nm下的吸光度,通过代入BCA标准曲线,计算转铁蛋白的浓度。将测定实施例4中复合物上转铁蛋白摩尔数除以所取复合物的摩尔数即得每个复合物的转铁蛋白数。结果平均每个PSSPH上连接1.53个Tf,链接率为51.00%。
聚合物粒径和Zeta电位的测定
取上述合成的聚合物PEG-PAMAM-His、PEG-SS-PAMAM-His和Tf-PEG-SS-PAMAM-His分别溶解在0.01MpH7.4PBS溶液中,终浓度为3mg/mL,0.45μm过滤器过滤,弃去初滤液,收集续滤液于测定池,用激光粒度分析仪测定粒径大小,每种样品平行测定3次。Zeta电位测定使用相同仪器,样品用0.01M PBS(pH=7.4)溶液进行溶解稀释至1mg/mL,每种样品平行操作3次。
测得实施例1合成的Tf-PEG-SS-PAMAM-His聚合物的粒径为20.81±0.48nm,Zate电位为-3.14±0.16mV。
实施例1合成的PEG-SS-PAMAM-His聚合物的粒径为13.80±0.65nm,Zate电位为+3.02±0.11mV。
PEG-PAMAM-His聚合物的粒径为12.65±0.10nm,Zate电位为2.93±0.28mV。
上述合成三种的聚合物PEG-PAMAM-His、PEG-SS-PAMAM-His和Tf-PEG-SS-PAMAM-His,较PAMAM(粒径5.07±0.17nm,Zate电位为+15.09±0.27mV),由于PEG链的引入粒径增大,Zeta电位显著降低,粒径较小且均匀,可用于传递药物并可显著提高稳定性,降低毒性。
制备载药复合物
精密称量一定量的DOX·HCl溶于甲醇溶液中,加入适量的三乙胺中和盐酸,使DOX游离出来。随后按照DOX和上述合成聚合物PEG-SS-PAMAM-His、PEG-PAMAM-His、Tf-PEG-SS-PAMAM-His的摩尔比30:1称取定量的Tf-PEG-SS-PAMAM-His聚合物加入甲醇/水(1:1,v/v)的溶液中,氮气保护,30℃避光搅拌12h,旋转蒸发除去甲醇溶液,加入适量的蒸馏水溶解复合物,5000rpm离心10min除去未包封的DOX,取上清液冷冻干燥即得上述合成聚合物的载药复合物Tf-PSSPH/DOX、PPH/DOX和Tf-PSSPH/DOX。载药复合物体外释放考察
采用透析袋法在不同释放条件下考察各个载药复合物的还原和pH敏感性,释放条件分别为:(1)非氧化还原条件下,即含有10μM GSH的PBS缓冲液(0.1M,pH 7.4),(2)还原条件下,即含有10mM GSH的PBS缓冲液(0.1M,pH 7.4),(3)酸性条件下,即含有10μM GSH的醋酸缓冲液(0.1M,pH 5.0)和(4)氧化及酸性双重条件下,即含有10mM GSH的醋酸缓冲液(0.1M,pH 5.0),其中pH7.4和GSH 10μM为正常组织非酸性pH及非氧化还原生理条件,pH5.0为肿瘤细胞内酸性pH条件,GSH 10mM为肿瘤细胞内高还原性条件。精密称取同摩尔量各复合物溶于2mL缓冲液置于透析袋中(MWCO=3500Da),两端扎紧,随即投入装有20mL不同释放介质的锥形瓶中,在37℃,100rpm恒温摇床中振摇,分别于0.5、1、2、4、6、8、12和24h取样4mL,同时补充同体积同温度相应的新鲜释放介质。采用紫外分光光度计测定各介质中DOX的浓度,并按以下公式计算累计释放百分数Er(%)=(Mt/M加)×100%。其中Er为累计释放百分数,Mt累计释放的DOX的量,M加为加入透析袋中DOX的总量。
从图2中可以看出DOX从PSSPH/DOX、PPH/DOX和Tf-PSSPH/DOX三种载药复合物中的释放均具有明显pH敏感性,在pH 5.0的条件下,DOX的释放速度及累计释放率明显高于在pH 7.4条件下的释放。这种pH释药行为主要是由于PAMAM本身具有pH敏感性,在低pH的条件下,其构象会从高pH值时的“致密中心”向“致密外壳”转变,外部的支链缩紧,内部的空腔打开,DOX迅速从复合物中释放出来。
DOX从Tf-PSSPH/DOX和PSSPH/DOX复合物中的释放均具有明显的还原敏感性。在pH 7.4,GSH=10μM的条件下,DOX从PSSPH/DOX复合物中的释放比较缓慢,在24h内的累计释放率仅为38.42%;而在pH 7.4,GSH=10mM的条件下,DOX从PSSPH/DOX复合物中的释放比较迅速,在24h内的累计释放率约达到48.77%。在从酸性的溶酶体中逃逸到高GSH的细胞质中,由于还原条件下二硫键断裂,所以促使-s-s-PEG-Tf链断裂,与PAMAM分离,解除了PEG层的位阻,让DOX更快的释放到载体外面。即在高浓度GSH的刺激下,连接在PAMAM与PEG之间的二硫键发生断裂,导致PEG从PAMAM的表面脱落,消除了DOX从PAMAM的内核向外面的介质中释放时的空间位阻。体外抗肿瘤实验
为了考察载药复合物Tf-PSSPH/DOX、PPH/DOX和Tf-PSSPH/DOX的体外抗肿瘤作用,取处于对数生长期的细胞MCF-7和HepG2,用0.25%胰酶消化后使其形成单个细胞悬液,以1×104cells/mL的细胞浓度接种于96孔板中,每孔100μL,设置阴性组和空白对照组。将96孔板置于培养箱中培养24h后,弃去旧的培养液,用PBS洗涤两次后,分别加入100μL含有系列浓度Tf-PSSPH/DOX、PPH/DOX和Tf-PSSPH/DOX的载药复合物溶液及游离DOX溶液,每组设四个复孔,放置CO2培养箱中培养48小时。弃去板中的培养液,用PBS清洗两次,每空加入100μL MTT溶液(0.5mg/mL)。置于培养箱中继续培养4h后,弃去MTT溶液,每孔加入100μL DMSO,涡旋1~5min直至结晶溶解。比色:用酶标仪测量每孔在492nm处吸光度值(OD),并计算细胞存活率(cell viability)。
实施例1、2、3、游离DOX对MCF-7和HEPG2细胞的IC50值如下表
由上表、图3和图4可以看出,各复合物对MCF-7和HEPG2细胞均具有一定的抗肿瘤作用。随着DOX浓度的增加,不同复合物对两种细胞的细胞毒性均呈依赖性上升。在相同的给药剂量下,Tf-PSSPH/DOX载药复合物显现出最强的细胞毒性,说明Tf连接后能显著增强复合物的细胞毒作用。对于MCF-7细胞,Tf-PSSPH/DOX载药复合物的IC50为0.297μg/mL,其细胞毒作用分别是PPH/DOX载药复合物(1.873μg/mL)、PSSPH/DOX载药复合物(1.114μg/mL)的6.31和3.75倍;对于HepG2细胞,Tf-PSSPH/DOX载药复合物的IC50为0.243μg/mL,其细胞毒作用分别是PSSPH/DOX载药复合物(0.743μg/mL)和PSSPH/DOX载药复合物(0.449μg/mL)的3.06和1.85倍。结果表明二硫键与His的连接有助于药物的释放,Tf的连接增强了其主动靶向性,从而发挥出明显的抗肿瘤作用。
以上所述的仅是本发明的一些实施方式。对于本领域普通技术人员来讲,子不脱离本发明创造构思的前提下,还可以做出若干变化,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺