一种海藻酸钙神经导管和神经支架的制备方法与流程
本发明属于生物医学领域,具体涉及一种神经导管和神经支架的制备方法。
背景技术:
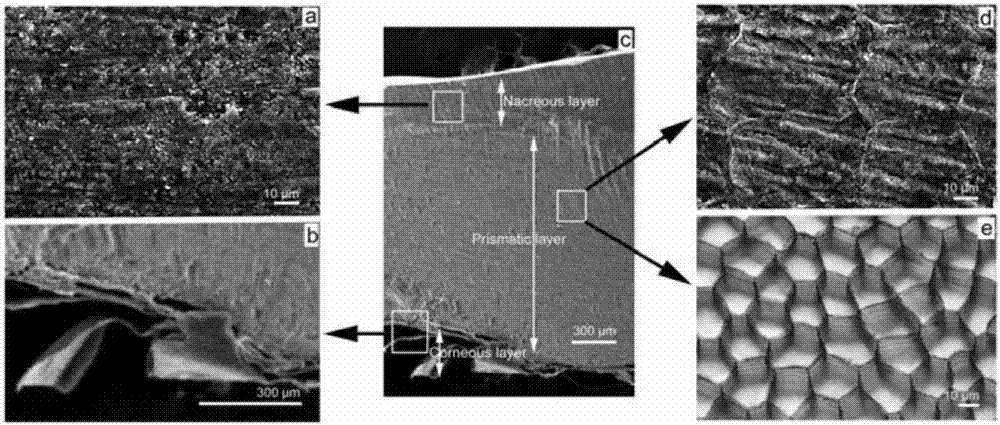
:周围神经损伤是临床工作中的常见疾病,对于不同的损伤部位和程度,可采用神经外膜,神经束膜端端吻合和神经移植等方法进行修复,而对于周围神经缺损则需要进行神经移植。自体神经移植是“金标准”,但是会导致供区的并发症,为此人们致力于人工神经(ang)的研究,以求用人工神经最终取代自体神经移植体。通常,人们习惯将中空的具有管状结构的人工神经称为神经导管(nc),将神经导管内部具填充物的称为神经支架(ns)。目前,研究报道的人工神经的种类比较多,但是归纳起来不外乎是两个方面的问题,其一是材料问题,另一个就是结构的问题。材料本身的理化性质和生物相容性直接决定了其对周围神经缺损修复的效果。对于同一种材料制备的人工神经而言,其内部结构的不同,应该也会导致不同的修复效果。人工神经结构的问题主要体现在孔隙问题和微通道问题。在人工神经的研究中,普遍认为,人工神经管壁孔隙的存在,有利于人工神经内外环境间的物质交换,从而有利于神经的再生,因此,在人工神经性质的评价中,通常将孔隙率作为一个重要指标。也有研究表明,人工神经管壁上孔隙的存在,会阻碍神经的再生。研究表明,人工神经的内部结构会直接影响修复效果,为此人们在神经支架内部设置微通道。在现有报道中,具有代表性的微通道数量有2、4、7、8、9、20、30、40、59、84和143个,这些具有不同数量和尺寸微通道的神经支架均表现出良好的促周围神经缺损修复效果。从结构的角度探讨孔隙和微通道对周围神经缺损修复效果的影响对于人工神经结构的设计是有重要意义的。发明cn101312756b提供了一种神经导管,为了获得一种允许轴突在再生过程中尽可能地自由生长的神经导管,提出一种具有成形体的神经导管,该成形体由交联的、可吸收的、基于明胶的材料形成,其中,该成形体是管状空心体,其具有包括外表面和内表面的壁,所述壁限定内腔,以及其中,所述神经导管包含围绕所述内腔地、半渗透性的层。该发明提供的神经导管的某层(其可以是成形体的一部分)是半渗透性的。神经导管的半渗透性层可以是例如有孔的,该孔平均小于约0.5μm。然而该发明没有对其孔径做进一步的描述。因此开发一种管壁具有孔隙的神经导管以及含有微通道的人工神经支架。本发明提供了上述神经导管和人工神经支架的制备方法,可制备管壁具有不同大小孔隙的神经导管以及含有不同尺寸、数目的微通道的人工神经支架,采用了贝壳粉末和海藻酸钠作为原料。上述的神经导管和含有微通道的神经支架可用来制备评价周围神经缺损修复效果的模型,从而为人工神经结构的设计提供参考依据,从而实现更好的促周围神经缺损修复效果。技术实现要素:有鉴于此,本发明的目的之一在于提供一种组合物,其可用于制备神经导管。为实现上述目的,本发明的技术方案为:用于制备神经导管的原料的组合物,由粒径为25~150μm的贝壳粉末和海藻酸钠组成。上述组合物中的海藻酸钠是一种具有良好生物相容性的材料,被广泛应用于生物医药领域,在神经损伤修复领域也有应用。未见将上述组合物中的贝壳粉末应用于人工神经制备的报道,贝壳粉末的不同粒径便于在神经导管壁上制备不同大小的孔隙。作为优选的方案,上述贝壳粉末和海藻酸的重量比为10~100:1。本发明的目的之二在于提供一种制备神经导管的方法,该方法采用的材料为目的一的组合物。为实现上述目的,本发明的技术方案为:所述方法包括以下步骤:1)将配方量的海藻酸钠溶解于水介质中,并加入配方量的贝壳粉末充分搅拌后制备成贝壳粉末/海藻酸钠乳浊液;2)在模具中加入步骤1)所得的贝壳粉末/海藻酸钠乳浊液,立即进行冰冻,脱模;3)用盐酸处理,直至无气泡产生,静置;4)漂洗后冷冻干燥。作为优选的方案,上述步骤3)可重复操作2~5次。作为优选的方案,所述贝壳粉末的制备包含以下步骤:①将背角无齿蚌贝壳用清水漂洗干净,烘干,分别打磨去角质层和珍珠层的浅层,剩余部分视为棱柱层,作为材料进行后续研究。②机械粉碎,筛分备用。选择标准筛,制备粒径介于25~150μm的贝壳粉末。神经导管管壁孔隙的大小由所用贝壳粉末的粒径决定。作为优选的方案,步骤2)所述冰冻的条件为-80℃冰箱中8h。作为优选的方案,所述盐酸为体积含量为3%的稀盐酸。作为优选的方案,所述漂洗为流水洗12h,纯化水漂洗3次,每次4h。作为优选的方案,制备完成后采用pla三氯甲烷溶液调节神经导管管壁孔隙大小。本发明的目的之三在于提供一种神经导管,所述神经导管管壁的孔径大小可不同。为实现上述目的,本发明的技术方案为:由目的二提供的方法制备得到神经导管,其直径由模具决定,管壁的孔径大小由贝壳粉末的粒径决定。本发明的目的之四在于提供一种上述的神经导管的应用,其可用于制备周围神经缺损修复效果的模型。为实现上述目的,本发明的技术方案为:在人工神经的研究中,普遍认为人工神经管壁孔隙的存在,有利于神经的再生,因此,在人工神经性质的评价中,通常将孔隙率作为一个重要指标。也有研究表明,人工神经管壁上孔隙的存在,会阻碍神经的再生。上述的神经导管可用来判断人工神经管壁孔隙的存在对周围神经缺损修复是否有利,以及如果孔隙的存在是必要的,孔隙的大小在何种范围。也就是说,该神经导管可用于制备周围神经缺损修复效果的模型。本发明的目的之五在于提供一种神经支架,其含有一定数量的微通道。为实现上述目的,本发明的技术方案为:该神经支架即上述的神经导管与管腔中的圆柱体组成,圆柱体内含有一定数量的微通道,所述微通道的直径为5~500μm。本发明的目的之六在于提供一种含有微通道的的神经支架的制备方法。为实现上述目的,本发明的技术方案为:所述的制备方法包括以下步骤:a布阵制备2个直径为0.5~2米等大的圆盘,在上面辐射状排列50~100条宽度为1~2mm的沟槽,每条沟槽上分布70~100个直径为0.8~1.5mm的圆孔;将此2圆盘正对固定,二者间相间0.5~1.5米,根据所需微通道数量,在圆盘上平行平均地排列2~10000条生物丝,在生物丝中段,相隔10~50mm用两个圆环限定丝束的外径;b倒模安装上一个内径与圆环限定的外径一致的管状模具,将配方量的海藻酸钠溶解于水介质中,并加入配方量的贝壳粉末充分搅拌后倒入管状模具中,在两个圆环外剪断生物丝;c抽丝加盐酸处理,抽出生物丝,得内部具微通道的圆柱体;d组装将权利要求5所述神经导管与制备得到的内部具微通道的圆柱体进行组装,得到具有微通道的神经支架。需要说明的是,在具体操作中,会根据实际情况进行一些调整,比如,可以在圆环上面直接钻孔而不设置沟槽,也可在两个圆环位置用石蜡固定生物丝后,再在两个圆环外剪断生物丝,然后再进行后续操作。作为优选的方案,步骤c的盐酸为体积含量为3%的稀盐酸。作为优选的方案,上述生物丝为蚕丝单丝。蚕丝是由2根单丝与丝胶蛋白包裹在一起形成。单丝的直径5~30μm,与轴突的直径范围相近(图1),而所形成微通道的直径由单丝的直径所决定,因此使用单丝形成的微通道的直径与轴突的直径范围相近。本发明的研究表明,经稀盐酸浸泡1~7天后,其力学性能无显著变化,因此蚕丝用于此处是可行的。本发明的目的之八在于提供一种上述含有微通道的的神经支架的应用,其可用于制备周围神经缺损修复效果的模型。为实现上述目的,本发明的技术方案为:本发明对大鼠坐骨神经横断面中的神经纤维数量进行了统计,结果显示,见图1,神经纤维的数量为6000根左右,神经纤维的直径为5~15μm。上述神经支架可用于判断神经支架的微通道数目、直径不同时周围神经缺损修复的效果,也就是说,上述的神经导管可用于制备周围神经缺损修复效果的模型。上述神经导管和上述含有微通道的神经支架评价周围神经缺损修复效果的方法包含以下过程:a移植建立大鼠坐骨神经10mm缺损模型,将所述神经导管和含有微通道的神经支架进行移植,以自体神经移植为对照。b移植后的形态学观察在移植后的第1、2、3、4、6、8、12、16、24周取材进行免疫荧光染色观察,区分胶原、成纤维细胞、雪旺氏细胞、炎症细胞和轴突。c移植后大鼠坐骨神经手术肢的功能恢复检测在移植后的第1、2、3、4、6、8、12、16、24周对大鼠坐骨神经手术肢的感觉和运动功能恢复程度进行检测。在移植后的第1、2、3、4、6、8、12、16、24周取材料进行离体神经电生理检测。d绝对定量pcr检测分析移植后的第1、2、3、4、5、6、7天和第2、4、6、8、12、16、24周取材料进行绝对定量pcr检测分析,测定netrin介导的信号途径中,轴突导向分子的表达量。本发明的有益效果在于:1)本发明采用了贝壳粉末和海藻酸钠作为原料,其原料成本较低。本发明中对海藻酸钠的使用方法有别于现有报道,也未见将贝壳应用于人工神经制备的报道。海藻酸钠是一种具有良好生物相容性的材料,贝壳粉末反应后留下的贝壳基质的成分主要为粘多糖,与胶原、明胶和丝素蛋白等异种蛋白材料相比,几乎无免疫原性。2)本发明提供的制备方法可制备管壁具有不同大小孔隙的神经导管以及含有不同直径、数目的微通道的人工神经支架。其中神经导管管壁孔隙的大小由所用贝壳粉末的粒径决定,人工神经支架的微通道数目、直径由生物丝数目、直径决定。其制备方法操作简单、快速。3)上述的神经导管和含有微通道的神经支架可用来制备评价周围神经缺损修复效果的模型,从而为人工神经结构的设计提供参考依据,实现更好的促周围神经缺损修复效果。附图说明图1为大鼠坐骨神经横断面。a.β-actin免疫荧光染色,b和c.h.e染色。图2为贝壳的结构。a.珍珠层,b.角质层,c.贝壳断面,d.棱柱层,e.贝壳基质。图3为蚕丝的结构。a.生丝,b.生丝去除丝胶后形成多根单丝,c.单丝。图4为微通道的制备方法示意图。a.带孔的圆盘,b.内径为18mm的圆环,c.生物丝,d.条状缝隙,e.圆孔。具体实施方式以下将(参照附图)对本发明的优选实施例进行详细描述。优选实施例中未注明具体条件的实验方法,通常按照常规条件,所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述
发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。实施例1神经导管(nc)壁孔隙对其促周围神经缺损修复效果的影响1)梯度粒径贝壳粉末的制备将背角无齿蚌贝壳用清水漂洗干净,烘干,其结构见图2。分别打磨去角质层和珍珠层的浅层,剩余部分视为棱柱层,作为材料进行后续研究。机械粉碎,筛分(n目)备用。按表1选择标准筛,制备粒径介于25~150μm的贝壳粉末。表1英制标准筛/粒径/预期孔隙对照表英制标准筛(目)100150200240300350400500粒径(μm)150105756353453725预期孔隙(μm)20015010075605040302)神经导管管壁梯度尺寸孔隙的制备按表1中的预期孔隙大小,每次选取1种粒径的贝壳粉末或碳酸钙颗粒,以制备1种孔隙大小的神经导管,其内径:18mm,壁厚:0.1mm。将一定量的海藻酸钠溶于三蒸水中,平均分为多份,置于烧杯中。分别称取一定量的贝壳棱柱层粉末或碳酸钙,置于海藻酸钠溶液中,充分搅拌,置于模具中,静置10min后,置于冰箱-80℃中,8h后取出,置于水中10min,去除模具,逐量加入体积含量比为3%的盐酸,至无大量二氧化碳泡沫生成为度,室温静置12h后,倾倒液体后再次加入盐酸静置12h,重复用盐酸处理3次。流水漂洗12h,三蒸水漂洗3次,每次4h。冷冻干燥,备用。3)神经导管管壁孔隙大小的观察和选取取nc进行扫描电镜观察,按以下方法计算孔隙的平均直径。统计单位面积内孔隙的面积和个数,计算每个孔隙的平均面积,再按圆的面积计算公式计算孔隙的平均直径。由于使用的颗粒的粒径不同,所制备的导管将具有不同大小的孔隙平均直径。如,导管a,b,c等壁上的孔隙平均直径可能分别为100μm、50μm,20μm等,选取其中6种左右具有梯度孔隙直径的导管进行后续试验。在本环节中,贝壳粉末的粒径可以通过选择不同的标准筛来进行控制,经盐酸处理后所产生的孔隙的大小与表1中的预期孔隙大小可能会存在偏差,但是会体现出一个正相关的趋势,即,贝壳粉末的粒径越大,所产生的孔隙就会越大。本实验的目标是探讨梯度尺寸的孔隙对周围神经缺损修复效果的影响,也就是说,只要制备出的神经导管壁上的孔隙尺寸呈现出一个梯度就能实现本实验研究目标,而不需要拘泥于孔隙尺寸一定要和表1中的预期孔隙大小的数值相等。4)神经导管管壁孔隙大小的调节和对照组的准备将上述nc用pla三氯甲烷溶液进行浸泡,不同的浓度、浸泡时间和次数对孔隙大小的降低程度不同,并以此方法制备一种表面孔隙小于0.01μm的nc作为对照组(视为表面无孔隙)。5)神经导管的移植建立大鼠坐骨神经10mm缺损模型,将上述具有不同孔隙大小的神经导管进行移植,以自体神经移植为对照。6)神经导管移植后的形态学观察在移植后的第1、2、3、4、6、8、12、16、24周取材进行免疫荧光染色观察,区分胶原、成纤维细胞、雪旺氏细胞、炎症细胞和轴突。7)神经导管移植后大鼠坐骨神经手术肢的功能恢复检测在移植后的第1、2、3、4、6、8、12、16、24周对大鼠坐骨神经手术肢的感觉和运动功能恢复程度进行检测。在移植后的第1、2、3、4、6、8、12、16、24周取材料进行离体神经电生理检测。8)绝对定量pcr检测分析移植后的第1、2、3、4、5、6、7天和第2、4、6、8、12、16、24周取材料进行绝对定量pcr检测分析,测定netrin介导的信号途径中,轴突导向分子的表达量。实施例2人工神经内部微通道对其促周围神经缺损修复效果的影响1)内部具微通道的圆柱体(as)的制备用图4的装置制备微通道。即,制备2个直径为1米等大的圆盘(图4a),在上面辐射状排列80条宽度为1.5mm的沟槽(图4d),每条沟槽上分布100个直径为1mm的圆孔(图4e)。将此2圆盘正对固定,二者间相间1m,根据表2中的微通道数量,在圆盘上平行平均地排列n条蚕丝(n=微通道数量)(图4c)。在纤维中段,相隔20mm用两个圆环(图4b)将之间的丝束的外径限定为18mm。安装上一个内径为18mm的管状模具,向其中加注海藻酸钠贝壳粉末胶体,自然干燥,在两个圆环(图4b)向外50mm位置剪断蚕丝,用稀盐酸处理,抽出蚕丝,即制备出内部具微通道的贝壳基质/海藻酸钙圆柱体。需要说明的是,在具体操作中,会根据实际情况进行一些调整,比如,圆盘的大小是根据操作者方便在上面固定生物丝而确定的,也可以在上面直接钻孔(图4e)而不设置沟槽(图4d),也可在两个圆环(图4b)位置用石蜡固定生物丝后,再在两个圆环(图4b)向外50mm位置剪断生物丝,然后再进行后续操作。表2贝壳基质/海藻酸钙棒状材料(直径:18mm)中微通道数量、直径和截面积理论值对照表2)内部具微通道的神经支架(ns)的组装将实施例1中制备的管壁具有梯度尺寸孔隙的神经导管,其内径为18mm,与内部具有不同数量和直径微通道的圆柱体,其外径为18mm,进行组装,即为神经支架(ns)。神经支架壁中孔隙的大小是由实施例1所制备的神经导管所决定的。神经支架内部微通道的数量和直径是由上述步骤所制备的贝壳基质/海藻酸钙圆柱体所决定的。3)其他研究内容神经支架的移植、移植后的形态学观察、移植后大鼠坐骨神经手术肢的功能恢复检测和绝对定量pcr检测分析的研究方法和内容与实施例1中的描述相同。最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1