用于治疗溃疡性结肠炎的方法与流程
本申请要求2016年8月3日提交的美国临时申请no.62/370,508和2016年11月23日提交的美国专利申请no.15/360,703的权益,其全部内容通过引用并入本文。
本公开涉及适合于在有需要的受试者中治疗溃疡性结肠炎的方法和给药方案。
背景技术:
哺乳动物在其胃肠道(gi)中含有多种微生物物种。这些微生物之间以及微生物与宿主之间的相互作用,例如宿主免疫系统、塑造微生物群。健康的微生物群为宿主提供多种益处,包括对广谱病原体的定殖抗性、必需的营养素生物合成和吸收、以及维持健康肠道上皮和适当控制的全身免疫力的免疫刺激。不平衡的微生物群(也称为“生态失调”或破坏的共生)可能失去其功能并导致对病原体的易感性增加,代谢特征改变或诱导可导致局部或全身性炎症或自身免疫的促炎信号。肠道微生物群在诸如肠道致病性感染的许多病症的发病机理中起重要作用。
溃疡性结肠炎是大肠的一种慢性疾病,也称为结肠,其中结肠内层发炎并形成微小的开放性溃疡或溃疡,产生脓液和粘液。溃疡性结肠炎最常发生在15至30岁的人群中,尽管这种疾病可能会折磨任何年龄的人。它平等地影响着男人和女人,并且似乎在某些家庭中流行。
溃疡性结肠炎是一种以大肠浅层炎症和微小溃疡为特征的疾病。炎症通常发生在直肠和结肠下部,但它可能影响整个大肠(全结肠炎)。溃疡性结肠炎很少影响其远端部分的小肠(backwashileitis)。
炎症伴随着腹泻,这可能是大量的和血腥的。在炎症破坏肠道细胞的地方形成微溃疡,这些区域出血并产生脓液和粘液。溃疡性结肠炎,特别是在轻度时,可能难以诊断,因为症状与其他肠道疾病类似,最明显的是其他类型的肠易激综合征(ibd),称为克罗恩病和肠易激综合征。克罗恩病与溃疡性结肠炎不同,因为它在整个肠壁厚度引起炎症并产生深部溃疡。克罗恩病通常发生在小肠中,但也可发生在大肠、肛门、食道、胃、阑尾和口腔中。克罗恩病导致瘘管,而溃疡性结肠炎则不会。克罗恩病和溃疡性结肠炎可能在同一患者中共存。炎症和溃疡的组合可引起腹部不适和频繁排空结肠。溃疡性结肠炎的现有治疗涉及强烈且冗长的组合药物治疗,具有显着的副作用或甚至需要手术以移除部分结肠。此外,相当大比例的溃疡性结肠炎患者对标准药物治疗有抵抗力。因此,需要更容易施用的溃疡性结肠炎的更有效的治疗方法。
将人结肠微生物群植入或施用到患病的肠中称为粪便微生物移植(fmt),通常也称为粪便细菌疗法。人们认为fmt通过多种微生物重新填充肠道,这些微生物通过创造一种不利于其增殖和存活的生态环境来控制关键病原体。它代表了一种治疗方案,可以快速重建正常的组成和功能性肠道微生物群落。
粪便微生物群移植(fmt),也称为“粪便细菌疗法”,代表了一种治疗方案,可以最快速地重建正常组合物和功能性肠道微生物群落。几十年来,fmt一直由世界各地的精选中心提供,通常作为复发性艰难梭菌感染(cdi)患者的最后选择。fmt也被建议用于治疗其他肠道感染因子,如大肠杆菌和耐万古霉素肠球菌(vre)。目前,fmt通过几种途径给药,包括通过结肠镜、灌肠或经鼻空肠管以均质化粪便,均质化粪便提取物或培养的粪便组分的形式输注人类微生物群。
发明概述
本公开提供了用于治疗或预防溃疡性结肠炎的方法和给药方案。
在一个方面中,本公开内容提供了治疗有需要的受试者的溃疡性结肠炎的方法,其中该方法包括用治疗方案治疗所述患者,所述治疗方案包括施用包含活的非致病性粪便细菌的药物组合物至少8周并且每周至少三次。
在方面中,本公开内容提供了治疗有需要的受试者的溃疡性结肠炎(uc)并且显示出3或更低的mayo内窥镜检查评分的方法,其中该方法包括向所述受试者施用包含活的非致病性粪便细菌的药物组合物。
在方面中,本公开内容提供了治疗有需要的受试者的溃疡性结肠炎的方法,其中该方法包括向受试者施用包含活的非致病性粪便细菌的药物组合物,其中所述受试者在该方法期间不使用伴随的皮质类固醇,并且在开始该方法之前不立即使用皮质类固醇。
在一个方面中,本公开提供了一种用于选择治疗有需要的受试者的溃疡性结肠炎(uc)的治疗计划的方法,其中该方法包括:确定所述受试者肠道中梭杆菌属、萨特氏菌属或两者的水平;和当所述梭杆菌属、萨特氏菌属或两者的水平高于预定水平时,推荐基于粪便细菌的疗法。
在方面中,本公开内容提供了用于选择治疗有需要的受试者的溃疡性结肠炎(uc)的治疗计划的方法,其中该方法包括:在所述受试者的肠道中测定选自由barnesiella、parabacteroides、梭菌属iv、瘤胃球菌属、布劳特氏菌属、dorea、瘤胃球菌属2和梭菌属xviii组成的组中的一种或多种细菌的水平;和当所述一种或多种细菌的水平选自高于预定水平时,推荐基于粪便细菌的疗法。
附图简述
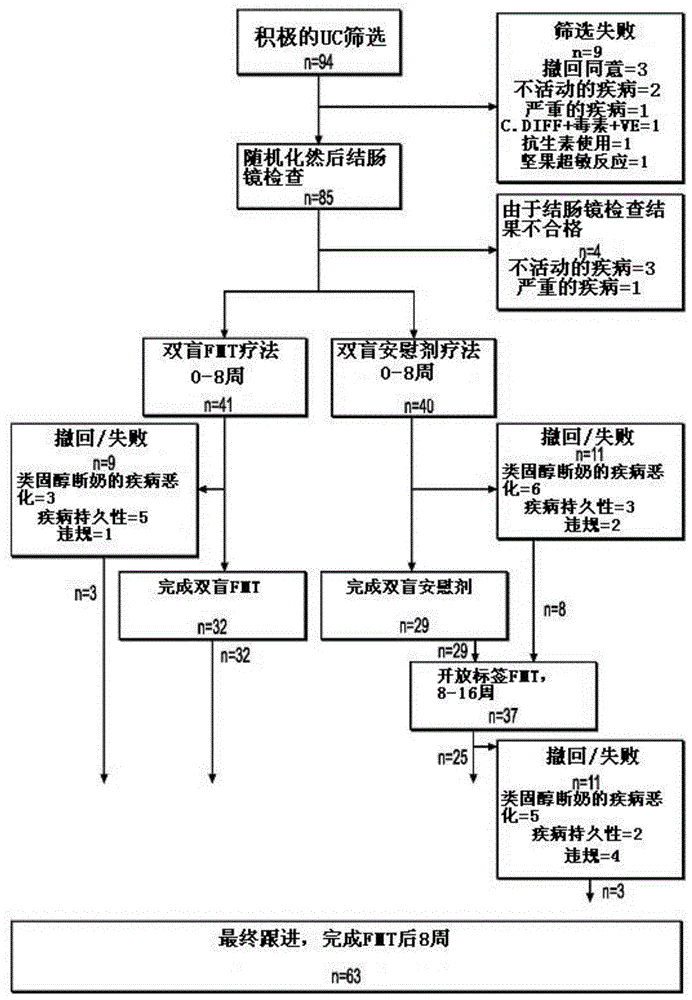
图1显示了根据本公开的实施例1的研究患者consort流程图;
图2显示了根据本发明实施例4的研究设计的图示;
图3a显示了在根据本发明的实施例5的治疗后第8周,fmt和安慰剂治疗组中达到无类固醇临床缓解和内窥镜缓解或响应的患者数量;
图3b显示了根据本发明的实施例在治疗后第8周的无类固醇临床缓解和临床响应的患者数量;
图3c显示了根据本发明的实施例的治疗后无类固醇内窥镜响应和完全粘膜愈合的患者数量。
图4a显示了根据本发明的实施例5的25cm直肠-乙状结肠活动性结肠炎的示例性基线内窥镜外观;
图4b示出了根据本公开的实施例5的第8周盲法fmt治疗的示例性内窥镜外观;
图4c显示了根据本公开的实施例5的肝硬化的广泛结肠炎的示例性基线内窥镜外观;
图4d示出了根据本公开的实施例5在8周开放标签fmt完成时的示例性内窥镜外观;
图5显示了根据本发明实施例5的治疗开始速度;
图6a显示了根据本发明的实施例6的每个粪便样品的操作分类单位(otu)的数量;
图6b显示了根据本发明实施例6的每个粪便样品中的系统发育多样性;
图6c显示了根据本发明实施例6的分类水平粪便样品的主成分分析;
图6d显示了根据本公开的实施例6的主要结果、个体供体和供体批次,在fmt治疗的盲法研究患者中的otu的数量。
图7a显示了治疗前直肠uc炎症(左1和2)的内窥镜检查图像;(右1)第20周时粪便附着在直肠粘膜上的炎症急剧减少;(左3和4)在治疗前在乙状结肠中标记uc炎症;和(右2和3)在第20周乙状结肠炎症明显减少。右2显示附着在乙状结肠发炎壁上的粪便。右3显示炎症的分散变化。
图7b显示了治疗后第8周的横向结肠中(左7、8、9和10)炎症和显着粘液的内窥镜检查图像;和(右6)在第20周时炎症的改善。在右6中,横结肠中的炎症得到改善但仍然可见。血管不可见。
发明详述
在描述本发明的组合物和方法之前,应理解本公开不限于所述的特定方法、组合物或方法,因为它们可以变化。还应理解,说明书中使用的术语仅用于描述特定版本或实施例的目的,并不意图限制本发明的范围,本发明的范围仅受所附权利要求的限制。例如,关于一个实施例示出的特征可以结合到其他实施例中,并且可以从该实施例中删除关于特定实施例示出的特征。因此,本公开预期在本公开的一些实施例中,可排除或省略本文中阐述的任何特征或特征组合。另外,根据本公开,本领域技术人员将清楚对本文提出的各种实施例的许多变化和添加,这些变化和添加不脱离本公开。在其他情况下,没有详细示出公知的结构、接口和过程,以免不必要地模糊本发明。意图是本说明书的任何部分都不应被解释为对本发明的全部范围的任何部分的否定。因此,以下描述旨在说明本公开的一些特定方面,而不是穷举地指定其所有排列、组合和变化。
除非本文另有定义,否则应根据相关领域普通技术人员的常规用法来理解术语。在本文的公开内容的描述中使用的术语仅出于描述特定实施例的目的,并不旨在限制本公开。
本文引用的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。
除非上下文另有说明,否则特别旨在可以以任何组合使用本文所述的本公开的各种特征。此外,本公开还预期在本公开的一些实施例中,可排除或省略本文中阐述的任何特征或特征组合。
本文公开的方法可以包括用于实现所描述的方法的一个或多个步骤或动作。在不脱离本发明的范围的情况下,方法步骤和/或动作可以彼此互换。换句话说,除非为了实施例的正确操作需要特定的步骤或动作顺序,否则可以修改特定步骤和/或动作的顺序和/或使用而不脱离本发明的范围。
如在本公开和所附权利要求的描述中所使用的,单数形式“一”、“一个”和“该”旨在也包括复数形式,除非上下文另有明确说明。
如本文所用,“和/或”是指并涵盖一个或多个相关所列项目的任何和所有可能组合,以及当在替代方案(“或”)中解释时缺乏组合。
当提及诸如百分比、密度、体积等可测量值时,本文所用的术语“约”和“近似”意味着包括指定量的20%、10%、5%、1%、0.5%或甚至0.1%的变化。
如本文所用,诸如“在x和y之间”和“在约x和y之间”的短语应该被解释为包括x和y。如本文所使用的,诸如“在约x和y之间”的短语意味着“在约x和约y之间”,短语诸如从约x到y“的短语意思是”从约x到约y”。
当提及物质在组合物中的存在时,本文所用的术语“基本上不含”是指包括该物质占体积或质量的全部物质的小于1%、小于0.5%、小于0.1%、或甚至小于0.01%。
如本文所用,术语“治疗”是指(i)完全或部分抑制疾病、病症或病症,例如,阻止其发展;(ii)完全或部分缓解疾病、病症或病症,例如引起疾病、病症和/或病症的消退;或者(iii)完全或部分地预防患者中可能易患疾病、病症和/或病症但尚未被诊断为患有疾病、病症或病症。类似地,“治疗”是指治疗性治疗和预防性或预防性措施。
如本文所用,“治疗有效量”或“药物活性剂量”是指有效治疗所述疾病、病症或病症的组合物的量。
如本文所用,“微生物群”和“菌群”是指可持续地和短暂地存在于受试者身体内或上的微生物群落,包括真核生物、古细菌、细菌和病毒(包括细菌病毒(即噬菌体)。非选择性粪便微生物群是指来自供体粪便样品的粪便微生物的群落或混合物,其没有选择,并且基本上类似于在这种粪便样品中发现的微生物成分和群体结构。
如本文所用,“缓解”、“治愈”或“解决率”是指响应于给定治疗而治愈或获得缓解或完全消退病症的患者的百分比。如本文所用,“临床缓解维持率”是指在完成治疗后达到缓解的所有患者中在指定的治疗后期间保留临床缓解的患者的百分比。定量地,当患者的ucdai评分低于或等于2时,在治疗8周后评估,实现缓解、治愈或消退。通过内窥镜和粘膜愈合可以进一步证实缓解、治愈或消退。
如本文所用,“无类固醇”是指完全缺乏或基本上缺乏类固醇使用。
如本文所用,“主要结果率”是指在接受该治疗或治疗方案的所有患者中在特定治疗或治疗方案之后达到主要结果的患者的百分比。
如本文所用,“应答率”是指对给定治疗呈阳性反应的患者百分比。定量地,当患者的ucdai评分从基线到第8周减少至少2时,患者对治疗有积极的反应。
如本文所用,“mayoclinic评分”或“mayo评分”是指用于评估溃疡性结肠炎病症的严重程度的指标系统。见表1和schoeder等人,nengljmed1987;317:1625-9。梅奥诊所的得分范围为0-12,子评分为0-3,其中得分越高表明疾病越严重。在一些方面,子评分可以被评定为粪便频率,直肠出血,内窥镜检查时的粘膜外观和医师的全面评估(pga)。
表1:用于评估溃疡性结肠炎活动的梅奥诊所评分系统(shoeder等人)
如本文所用,“溃疡性结肠炎内窥镜严重程度指数”或“uceis”是指用于评估内窥镜疾病活动的指数。该指数评估了三个标准,包括血管模式、出血、糜烂和溃疡(表2)。参见travis等人,开发一种评估溃疡性结肠炎的内窥镜严重程度的仪器:溃疡性结肠炎内窥镜严重程度指数(uceis)。分数越高反映疾病严重程度越高。
表2:溃疡性结肠炎评分系统内窥镜严重程度指数(见travis等人)
如本文所用,“溃疡性结肠炎疾病活动指数”或“ucdai”是指用于评估溃疡性结肠炎患者的症状严重性或反应的指标系统。该指数评估了四个变量,包括粪便频率、出血严重程度、结肠粘膜外观和医生对疾病活动的总体评估(表3)。参见sutherland等人,5-aminosalicylicacid灌肠治疗远端溃疡性结肠炎、直肠乙状结肠炎和直肠炎。消化内科。1987;92:1894-8。每个变量的评分为0-3,因此总指数评分范围为0-12;0-2:缓解;3-6:温和;7-10:温和;>10:严重溃疡性结肠炎。
表3:溃疡性结肠炎疾病活动指数的评分系统。(见tursi等人)
如本文所用,“真核”是指属于包含细胞核和膜结合细胞器的细胞。
如本文所用,“细菌”、“细菌”和“古细菌”是指缺乏膜结合细胞核且缺乏细胞器的单细胞原核生物。
如本文所用,“粪便细菌”是指可在粪便中发现的细菌。
如本文所用,“可行的”意味着具有繁殖的能力。
如本文所用,“分离的”或“纯化的”是指细菌或其他实体或物质,其已经(1)与最初产生时与其相关的至少一些组分分离(无论是在自然界还是在实验环境中)和/或(2)由人工制造、制备、纯化和/或制造。分离或纯化的细菌可以从至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或更多与其最初关联的其他组件的细菌中分离出来。
如本文所用,关于细菌或任何其他生物体或实体的术语“病原体”和“致病性”包括能够引起或影响含有该生物体或实体的宿主生物的疾病、病症或病症的任何此类生物体或实体。
如本文所用,“孢子”或“孢子”群包括通常可存活的细菌(或其他单细胞生物),比相同细菌的营养形式更耐受环境影响,例如热和杀菌剂,并且通常能够发芽和外生长。“孢子形成物”或“能够形成孢子”的细菌是含有基因的细菌和在合适的环境条件下产生孢子的其他必要能力。
如本文所用,两种或更多种细菌的“组合”包括两种细菌的物理共存,在相同的材料或产品中或在物理连接的产品中,以及两种细菌的暂时共同给药或共定位。
如本文所用,“受试者”是指任何动物受试者,包括人、实验室动物(例如,灵长类动物、大鼠、小鼠)、牲畜(例如,牛、绵羊、山羊、猪、火鸡、鸡)和家庭宠物(例如,狗、猫、啮齿动物等)。受试者或患者可能是健康的,或者可能由于胃肠道病原体而患有感染,或者可能有发展或向其他人传播由于胃肠道病原体引起的感染的风险。
如本文所用,“香农多样性指数”是指使用该公式解释在给定群落中存在的物种的丰度和均匀度的多样性指数。
其中h是香农多样性指数,r是群落中物种的总数,而pi是由第i种物种组成的r的比例。较高的值表示不同且均匀分布的社区,值为0表示在给定的社区中仅存在一个物种。有关进一步参考,请参阅shannonandweaver,(1949)themathematicaltheoryofcommunication.theuniversityofillinoispress,urbana.117pp。
如本文所用,“操作分类单元”或“otu”是指基于16s或18srrna标记基因确定的一组密切相关的微生物物种。
如本文所用,“抗生素”是指通过杀死细菌、抑制细菌生长或降低细菌活力来用于治疗和/或预防细菌感染的物质。
如本文所用,“间歇给药方案”是指给予治疗组合物一段时间,然后给药一段时间(治疗期),其中禁止用这种治疗组合物治疗(休息期)。间歇给药方案可表示为治疗期,以天或周/休息期,以天或周计。例如,4/1间歇给药方案是指间歇给药方案,其中治疗期为四周/天,休息期为一周/天。
如本文所用,“连续给药方案”是指给药方案,其中治疗组合物在治疗期间施用而没有休息期。在连续给药方案的整个治疗期间,治疗组合物可以例如每天,或每隔一天或每隔三天施用。在给予治疗组合物的那天,它可以在一天中以单剂量或多剂量给药。
如本文所用,“给药频率”是指在给定时间内给予治疗组合物剂量的频率。给药频率可以表示为每给定时间的剂量数,例如,每天一次,每周一次或两周一次。
如本文所用,“给药间隔”是指在给予受试者的多个剂量之间经过的时间量。
存在不同类型的溃疡性结肠炎。如本文所用,“溃疡性直肠炎”是指肠炎症限于直肠的疾病形式。由于其有限的范围(通常小于直肠的六英寸),溃疡性直肠炎往往是一种较轻的溃疡性结肠炎。它与较少的并发症相关,并提供比更广泛的疾病更好的前景。对于大约30%的患有溃疡性结肠炎的患者,该疾病始于溃疡性直肠炎。
如本文所用,“直肠乙状结肠炎”是指影响直肠和乙状结肠的结肠炎形式,结肠的下段位于直肠的正上方。症状包括血性腹泻、痉挛和持续感觉需要通过粪便,称为里急后重。腹部左下方的中度疼痛可能发生在活动性疾病中。
如本文所用,“左侧结肠炎”是指从直肠开始并延伸至脾脏附近的结肠弯曲的连续炎症,称为脾弯曲。症状包括食欲不振、体重减轻、腹泻、腹部左侧剧烈疼痛和出血。
如本文所用,“泛溃疡(总)结肠炎”影响整个结肠。症状包括腹泻、严重的腹痛、痉挛和广泛的体重减轻。潜在的严重并发症包括大量出血和结肠急性扩张(中毒性巨结肠),这可能导致肠壁开放。严重的并发症可能需要手术
已经提出了几种关于溃疡性结肠炎的原因的理论。有证据表明,身体的免疫系统会对遗传易感个体的环境、饮食或传染因子产生反应,导致肠壁炎症。最新推测的致病因子是由日本研究人员鉴定的fusobacteriumvarium的衬里感染。溃疡性结肠炎不是由某些食物或食品的情绪困扰或敏感引起的,但这些因素可能会引发某些人的症状。溃疡性结肠炎很可能不是异常反应,而是感染。
溃疡性结肠炎最常见的症状是血性腹泻和腹痛。患者还可能出现发烧、直肠出血、疲劳、贫血、食欲不振、体重减轻以及体液和营养素流失导致营养缺乏。这些症状在症状消失(缓解)期间发生间歇性发作。这些无病期可持续数月甚至数年。通常,攻击开始于排便的紧迫性,轻度的下腹部痉挛以及粪便中的血液和粘液。
溃疡性结肠炎可能引起长期问题,如关节炎、眼部炎症、肝脏疾病(脂肪肝、肝炎、肝硬化和原发性硬化性胆管炎)、骨质疏松症、皮疹、贫血和肾结石。当免疫系统引发身体其他部位的炎症时,可能会发生这些并发症。当有效治疗结肠炎时,这些问题可能消失。
溃疡性结肠炎的治疗取决于疾病的严重程度。大多数人都接受药物治疗。一些症状由某些食物引发的人能够通过避免使肠道不适的食物(如高度调味的食物或乳制品)来控制症状。每个人可能会以不同的方式经历溃疡性结肠炎,因此针对每个人调整治疗。
许多轻度或中度疾病患者首先接受5-asa药物治疗,包括5-氨基水杨酸和柳氮磺胺吡啶类药物的组合,有助于控制炎症。柳氮磺胺吡啶是这些药物中最常用的。柳氮磺胺吡啶可以根据需要使用,也可以与其他药物一起使用。对柳氮磺胺吡啶治疗效果不佳的患者可能会对较新的5-asa药物有所反应。5-asa制剂的可能副作用包括恶心、呕吐、胃灼热、腹泻和头痛。
患有严重疾病的人和对5-asa制剂无反应的人可以用添加的皮质类固醇治疗。泼尼松和布地奈德和氢化可的松是用于减轻炎症的皮质类固醇。根据炎症的位置,它们可以口服、静脉注射、灌肠或栓剂给药。皮质类固醇可引起副作用、如体重增加、痤疮、面部毛发、高血压、糖尿病、情绪波动和感染风险增加,因此医生会仔细监测服用这些药物的患者。
通常使用免疫抑制剂如硫唑嘌呤、6-巯基嘌呤(6-mp)和甲氨蝶呤,并且可以在低剂量下显着改善,副作用很少。可以给予其他药物以使患者放松或减轻疼痛、腹泻或感染。偶尔,症状严重到足以使患者住院治疗。例如,一个人可能有严重的出血或严重的腹泻,导致脱水。在这种情况下,医生会尝试阻止腹泻和血液、液体和矿物盐的流失。患者可能需要特殊饮食,通过静脉喂养、药物治疗或有时手术。
在严重的情况下,患者可能需要手术来移除患病的结肠。如果药物治疗失败或皮质类固醇或其他药物的副作用威胁患者的健康,医生有时会建议去除结肠。
在一个方面中,本发明提供了降低有此需要的受试者中钙卫蛋白水平的方法,其中该方法包括用治疗方案治疗所述患者,所述治疗方案包括给予包含活非致病性粪便细菌的药物组合物至少8周并且每周至少三次。在另一方面中,此处提供的任何方法或治疗方案也可用于降低有此需要的受试者中钙卫蛋白和炎症的水平。在方面中,本公开提供了一种方法,用于将有此需要的受试者中的钙卫蛋白水平与治疗前的钙卫蛋白水平相比降低至少10%。在另一方面中,钙卫蛋白水平降低至少20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%。在另一方面中,与治疗前的钙卫蛋白水平相比较,钙卫蛋白水平降低2%至10%、10至20%、20至30%、30至40%、40至50%、50至60%、60至70%、70至80%、80至85%、85至90%、90至95%和95至99%。在另外方面中,钙卫蛋白的水平降至100μg/g以下、90μg/g以下、80μg/g以下、70μg/g以下、60μg/g以下、65μg/g以下、55μg/g以下、50μg/g以下、45μg/g以下、40μg/g以下、或35μg/g以下。在另一方面中,在持续至少8周的治疗方案之后,在有此需要的受试者中钙卫蛋白的水平降低。在另一方面中,在治疗方案完成后8周,在有此需要的受试者中钙卫蛋白的水平降低。在另一个方面,钙卫蛋白的水平在有此需要的受试者中在治疗方案完成后1至12周之间降低、在2至12周之间降低、在3至12周之间降低、在4至12周之间降低、在5至12周之间降低、在6至12周之间降低、在7至12周之间降低、在8至12周之间降低、在9至12周之间降低、在10至12周之间降低、在1至2周之间降低、在2至3周之间降低、在3至4周之间降低、在4至5周之间降低、在5至6周之间降低、在6至7周之间降低、在7至8周之间降低、在8至9周之间降低、在9至10周之间降低、或在10至11周之间降低。在另外方面中,在有此需要的受试者中,钙卫蛋白的水平在治疗方案完成后12至30周之间降低、12至28周之间降低、12至20周之间降低、14至20周之间降低、14至26周之间降低、12至18周之间降低、12至16周之间降低、20至30周之间降低、25至30周之间降低、和21至27周之间降低。在另一方面中,在治疗方案完成1周或更长时间后、2周或更长时间后、3周或更长时间后、4周或更长时间后、5周或更长时间后、6周或更长时间后、7周或更长时间后、8周或更长时间后、9周或更长时间后、10周或更长时间后、11周或更长时间后、12周或更长时间后、13周或更长时间后、14周或更长时间后、15周或更长时间后、16周或更长时间后、18周或更长时间后、20周或更长时间后、22周或更长时间后、24周或更长时间后、26周或更长时间后、28周或更长时间后、30周或更长时间后、40周或更长时间后、50周或更长时间后,在有此需要的受试者中钙卫蛋白水平降低。
在一个方面中,本发明提供了一种治疗有需要的受试者的溃疡性结肠炎的方法,其中该方法包括用治疗方案治疗所述患者,所述治疗方案包括给予包含活非致病性粪便细菌的药物组合物至少8周并且每周至少三次。在另一方面中,此处提供的任何方法或治疗方案也可用于治疗选自胶原性结肠炎、淋巴细胞性结肠炎、克罗恩氏结肠炎、憩室炎和脓包炎的一种或多种适应症。
在方面中,本发明提供了一种治疗有需要的受试者的溃疡性结肠炎的方法,其显示出3或更低的mayo内窥镜检查评分,其中该方法包括给所述受试者施用包含活的非致病性粪便细菌的药物组合物。在一个方面中,该给药是在治疗方案之后持续至少8周。在方面中,该给药方案遵循至少8周且每周至少三次的治疗方案。在一个方面中,该给药方法是遵循至少8周且每周至少3次的治疗方案。
在方面中,本发明提供了一种治疗有需要的受试者的溃疡性结肠炎的方法,其中该方法包括给受试者施用包含活的非致病性粪便细菌的药物组合物,其中在该方法期间受试者没有伴随皮质类固醇使用并且在开始该方法之前没有立即使用皮质类固醇。在一个方面中,该给药方案遵循持续至少9周的方案。在方面中,该给药方案遵循至少8周和至少每周三次的方案。
在方面中,本公开的主题在治疗之前表现出至少4的mayo评分,例如mayo评分为4、5、6、7、8、9、10。在一个方面中,本发明在治疗前显示4-10的mayo评分,例如4至9、5至10、5至8或6至8。
在方面中,本公开的主题在治疗之前表现出至少4的uceis评分,例如uceis评分为4、5、6、7、8、9、10。在一个方面中,本公开内容在治疗前表现出4至10的uceis评分,例如4至9、5至10、5至8或6至8。
在一个方面中,本公开的主题能够在治疗方案结束时实现主要结果,其中主要结果在治疗方案结束时被定义为无类固醇临床缓解和内窥镜缓解或响应,其中类固醇免疫临床缓解定义为2或更低的总mayo评分,子评分为1或更低,并且其中内窥镜缓解或响应被定义为mayo内窥镜检查评分从基线减少至少1个点。在另一方面中,本公开的主题能够在治疗方案结束时实现主要结果,其中主要结果被定义为无类固醇临床缓解,其被定义为总的mayo评分为2或更低,子评分为1或更低。在另外方面中,本公开的主题能够在治疗方案结束时实现主要结果,其中主要结果被定义为无类固醇内窥镜缓解或响应,其被定义为mayo内窥镜检查评分从基线减少至少1个点。
在方面中,本公开的主题在开始本文提供的方法之前的至少一周内不使用类固醇。在另一方面中,本公开的主题在开始本文提供的方法之前的至少两周、三周、四周或五周内不使用类固醇。在另外方面中,在开始本文提供的方法之前的至少1、2、3、4、5、6、7、8、9、10、11、12、13或14天内不使用类固醇。在一个方面中,类固醇可以是泼尼松、布地奈德或氢化可的松。在方面中,本公开的主题在开始本文提供的方法之前的至少一周内没有使用皮质类固醇。在一个方面中,本公开的主题在开始本文提供的方法之前不使用皮质类固醇。
在一些方面,本公开的方法还包括确定受试者的基线肠道细菌多样性。在方面中,通过在治疗步骤之前分析香农对受试者粪便样品的多样性来评估受试者的基线肠道细菌多样性。在一个方面中,基于细菌种类水平,受试者的基线粪便香农多样性在0.5和2.2之间,例如0.5-2.0之间、1.0-2.2之间或1.0-1.5之间。在方面中,受试者的粪便香农多样性与治疗前相比增加至少50%、60%、70%、80%、90%、95%、98%、99%、99.5%、99.8%或99.9%。在一个方面中,与治疗前相比,受试者的粪便香农多样性增加至少1、2、3、4、5、6、7、8、9、10、11、15、20或30倍。在一个方面中,受试者的治疗后粪便香农多样性基于细菌种类水平在1.5和6.0之间,例如1.5-5.0之间、1.5-4.5之间、1.5-4.0之间、1.5-3.5之间、1.5-3.0之间、1.5-2.5之间、1.5-2.0之间、2.0-4.5之间、2.5-4.0之间、3.0-3.5之间、2.0-6.0之间、2.5-6.0之间、3.0-6.0之间、3.5-6.0之间、4.0-6.0之间、4.5-6.0之间、5.0-6.0之间、或5.5-6.0之间。
在某些方面,本公开的方法还包括确定受试者肠道中梭杆菌属、萨特氏菌属或两者的水平。在一些方面,本公开的方法还包括确定选自在受试者的肠道中由barnesiella、parabacteroides、梭菌属iv、瘤胃球菌属、布劳特氏菌属、dorea、瘤胃球菌属2、梭菌属xviii组成的组中的一种或多种细菌的水平。
在方面中,本发明提供能够实现相对于来自安慰剂的主要结果率至少高两倍的主要结果率的治疗方案,其中在治疗方案结束时主要结果被定义为无类固醇临床缓解和内窥镜缓解或响应,其中临床缓解被定义为总mayo评分为2或更低并且所有子评分为1或更低,并且其中内窥镜缓解或响应定义为mayo内窥镜检查评分从基线减少至少1个点。在一个方面中,本发明提供能够达到主要结果率高于安慰剂的主要结果率的治疗方案,其中在治疗方案结束时主要结果被定义为无类固醇临床缓解和内窥镜缓解或响应,其中临床缓解被定义为总mayo评分为2或更低并且所有子评分为1或更低,并且其中内窥镜缓解或响应定义为mayo内窥镜检查评分从基线减少至少1个点。
在一个方面中,根据本发明的治疗方案能够实现至少25%的主要结果率,例如至少20%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%或至少99.9%。在方面中,治疗方案能够实现20%-40%的主要结果率,例如20%-35%、25%-40%、25%-35%、25%-30%或30%-35%。
在一个方面中,根据本发明的治疗方案能够实现在治疗方案完成后8周临床缓解维持率至少为40%。在方面中,治疗方案能够实现至少为45%的临床缓解维持率,例如在治疗方案完成后8周至少为50%、至少为55%、至少为60%、至少为65%、至少为70%、至少为75%、至少为80%、至少为85%、至少为90%、至少为95%、至少为98%、至少为99%、至少为99.5%或至少为99.9%。在方面中,治疗方案能够实现35%-60%的临床缓解维持率,例如在治疗方案完成后8周为35%-55%、40%-60%、40%-55%、40%-50%、45%-55%或45%-50%。
在一个方面中,根据本发明的治疗方案相对于安慰剂的无类固醇临床缓解率能够实现至少高两倍的无类固醇临床缓解率,其中临床缓解被定义为直肠出血和大便次数的综合mayo评分为1或更低。在方面中,根据本发明的治疗方案能够实现高于来自安慰剂的无类固醇临床缓解率的无类固醇临床缓解率,其中临床缓解被定义为直肠出血和大便次数的综合mayo评分为1或更低。在方面中,治疗方案能够实现至少40%的无类固醇临床缓解率,例如至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%或至少99.9%。在一个方面中,治疗方案能够实现35%-55%的无类固醇临床缓解率,例如40%-55%、35%-50%、40%-50%、40%-45%或45%-50%。
在方面中,根据本发明的治疗方案相对于安慰剂的无类固醇临床响应率能够实现至少高两倍的无类固醇临床响应率,其中临床响应被定义为直肠出血和大便次数的综合评分中总的mayo评分减少3或更高或比基线减少50%。在一个方面中,根据本发明的治疗方案能够实现高于来自安慰剂的无类固醇临床响应率的无类固醇临床响应率,其中临床响应定义为直肠出血和大便次数的综合评分总mayo评分降低3或更高或比基线降低50%。在一个方面中,治疗方案能够实现至少50%的无类固醇临床响应率,例如至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%或至少99.9%。在方面中,根据本发明的治疗方案能够实现45%-65%的无类固醇临床响应率,例如45%-60%、50%-65%、50%-60%、50%-55%或55%-60%。
在一个方面中,根据本发明的治疗方案相对于安慰剂的内窥镜响应率能够实现至少高两倍的内窥镜响应率,其中内窥镜响应被定义为总uceis评分降低3或更高或从基线降低50%或更高。在一个方面中,根据本发明的治疗方案能够实现高于来自安慰剂的内窥镜响应率的内窥镜响应率,其中内窥镜响应被定义为总uceis评分降低3或更高或从基线降低50%或更高。在方面中,治疗方案能够达到至少30%的内镜率,例如至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%或至少99.9%。在一个方面中,治疗方案能够实现30%-45%的内窥镜响应率,例如30%-40%、35%-45%或35%-40%的内窥镜响应率。
在一个方面中,本公开内容提供了在有此需要的受试者中治疗溃疡性结肠炎的方法,其中该方法包括向受试者施用药物活性剂量的包含活的非致病性粪便细菌的治疗组合物。在另一方面中,本公开内容提供了包含活的非致病性粪便细菌的组合物在制备用于治疗溃疡性结肠炎的药物中的用途。
在一些方面,本公开的方法治疗一种形式的溃疡性结肠炎,其选自溃疡性直肠炎、直肠乙状结肠炎、左侧结肠炎和全溃疡性结肠炎。在方面中,根据本公开的药物组合物包括粪便微生物群制剂。在一个方面中,药物组合物包含分离的或纯化的活的非致病性粪便细菌群。在方面中,药物组合物包含非选择性粪便微生物群。在一个方面中,药物组合物包含未选择且基本上完整的粪便微生物群。在方面中,药物组合物包含全谱粪便微生物群。在一个方面中,一种方法还包括给予5-氨基水杨酸剂、皮质类固醇、免疫抑制剂或其组合。在另一方面中,还包括给予5-氨基水杨酸或其衍生物、柳氮磺吡啶或其衍生物、或其组合。
在一个方面中,本公开内容提供了一种用于选择治疗有需要的受试者中的溃疡性结肠炎的治疗计划的方法,其中该方法包括确定患者体内梭杆菌属、萨特氏菌属或两者的水平,并且当梭杆菌属、萨特氏菌属或两者的水平高于预定水平时,推荐基于粪便细菌的疗法。在方面中,梭杆菌属、萨特氏菌属或两者的水平比预定水平高约8%,例如比预定水平高约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%、约150%或约200%。在方面中,本公开内容提供了一种用于选择治疗有需要的受试者的溃疡性结肠炎的治疗计划的方法,其中该方法包括确定所述受试者肠道中梭杆菌属、萨特氏菌属或两者的水平,并且当所述梭杆菌属、萨特氏菌属或两者的水平在预定范围之间时,推荐基于粪便细菌的疗法。在一个方面中,预定范围比预定水平高约8%至约50%,例如比预定水平高约8%至约40%、约10%-50%、约15%至约40%、约20%至约35%或约25%至约30%。在方面中,预定范围比预定水平高约50%至约200%,例如比预定水平高约50%至约150%、约50%至约100%、约100%-150%、约80%至约120%、约90%至约110%或约98%至约100%。在一些方面,通过分析受试者的粪便来确定一种或多种细菌的水平。
在方面中,本公开内容提供了一种用于选择治疗有需要的受试者的溃疡性结肠炎的治疗计划的方法,其中该方法包括确定选自在所述受试者的肠道中由barnesiella、parabacteroides、梭菌属iv、瘤胃球菌属、布劳特氏菌属、dorea、瘤胃球菌属2、和梭菌属xviii组成的组中的一种或多种细菌的水平;当一种或多种所选细菌的水平高于预定水平时,推荐基于粪便细菌的疗法。在方面中,一种或多种所选细菌的水平比预定水平高约8%,例如比预定水平高约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%、约150%或约200%。在方面中,本公开内容提供了一种用于选择治疗有需要的受试者的溃疡性结肠炎的治疗计划的方法,其中该方法包括确定选自在所述受试者的肠道中由barnesiella、parabacteroides、梭菌属iv、瘤胃球菌属、布劳特氏菌属、dorea、瘤胃球菌属2和梭菌属xviii组成的组中的一种或多种细菌的水平;当一种或多种所选细菌的水平在预定范围之间时,推荐基于粪便细菌的疗法。在一个方面中,预定范围比预定水平高约8%至约50%,例如比预定水平高约8%至约40%、约10%至50%、约15%至约40%、约20%至约35%或约25%至约30%。在方面中,预定范围比预定水平高约50%至约200%,例如比预定水平高约50%至约150%、约50%至约100%、约100%至150%、约80%至约120%、约90%至约110%或约98%至约100%。在一些方面,通过分析受试者的粪便来确定一种或多种细菌的水平。
在一个方面中,通过健康受试者中一种或多种所选细菌的相应水平建立预定水平。在方面中,通过与受试者相同的人口统计学类别中的健康受试者中的一种或多种所选细菌的相应水平建立预定水平。在一个方面中,通过同一受试者中的总梭菌属或拟杆菌种群的丰度来建立预定水平。
在一个方面中,本发明提供了一种消除或减少一种或多种溃疡性结肠炎症状的方法,所述症状选自腹泻、痉挛、里急后重、体重减轻、出血、食欲不振、腹痛、发热、疲劳、贫血、炎症和微溃疡。
在一个方面中,本公开内容提供了在有此需要的受试者中治疗溃疡性结肠炎的方法,其中该方法包括向受试者施用药物活性剂量的包含活的非致病细菌的治疗组合物。在一个方面中,本发明提供了一种治疗有需要的受试者的溃疡性结肠炎的方法,其中该方法包括每天向受试者施用药物活性剂量的包含活的非致病性粪便细菌的治疗组合物。在一个方面中,将治疗组合物给予有此需要的溃疡性结肠炎患者至少每天一次至少连续两天。在一个方面中,治疗组合物每天至少给药一次,连续至少3、4、5、6、7、8、9、10、11、12、13、14或15天。在另一方面中,治疗组合物每天至少施用一次,持续至少1、2、3、4、5、6、7、8、9、10、11或12周。在一个方面中,治疗组合物每天至少给药一次,持续最多4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或数周。在另一方面中,治疗组合物每天至少给药一次,持续至多1、2、3、4、5、6、7、8、9、10、11或12周或月。在另外方面中,治疗组合物至少给予一次,持续至少1、2、3、4、5、6、7、8、9、10、11或12个月或数年,长期用于受试者整个寿命,或无限期的时间。
在一个方面中,将治疗组合物给予有此需要的溃疡性结肠炎患者至少每天两次,持续至少连续两天。在一个方面中,治疗组合物每天至少给药两次,持续至少3、4、5、6、7、8、9、10、11、12、13、14或15天。在另一方面中,治疗组合物每天至少给药两次,连续至少1、2、3、4、5、6、7、8、9、10、11或12周。在一个方面中,治疗组合物每天至少给药两次,连续最多4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或周。在另一方面中,治疗组合物每天至少施用两次,持续至多1、2、3、4、5、6、7、8、9、10、11或12周或月。在另外方面中,治疗组合物至少连续两次给药,持续至少1、2、3、4、5、6、7、8、9、10、11或12个月或年,长期用于受试者整个寿命,或无限期的时间。
在一个方面中,将治疗组合物给予有此需要的溃疡性结肠炎患者,每日至少三次,连续至少两天。在一个方面中,治疗组合物每天至少给药三次,持续至少3、4、5、6、7、8、9、10、11、12、13、14或15天。在另一方面中,治疗组合物每天至少施用三次,持续至少1、2、3、4、5、6、7、8、9、10、11或12周。在一个方面中,治疗组合物每日至少给药三次,持续最多4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或周。在另一方面中,治疗组合物每天施用至少三次,持续至多1、2、3、4、5、6、7、8、9、10、11或12个周或月。在另外方面中,治疗组合物至少施用3次,持续至少1、2、3、4、5、6、7、8、9、10、11或12个月或年,在受试者的整个寿命长期使用,或无限期的时间。
在一个方面中,本发明提供了一种治疗有需要的受试者的溃疡性结肠炎的方法,其中该方法包括口服给予受试者药物活性剂量的治疗组合物,其包含活的、非致病的、合成的细菌混合物或活的、非致病的、纯化的或提取的粪便微生物群,其中剂量以每天至少一次或两次的给药方案施用至少连续三天或几周。在另一方面中,每日至少给药一次、两次或三次,持续1至12周、2至12周、3至12周、4至12周、5至12周、6至12周、7至12周、8至12周、9至12周、10至12周、1至2周、2至3周、3至4周、4至5周、5至6周、6至7周、7至8周、8至9周、9至10周或10至11周。
在一个方面中,本公开内容提供了在有此需要的受试者中治疗溃疡性结肠炎的方法,其中该方法包括第一给药方案,然后是第二给药方案。在一个方面中,第一个给药方案包括治疗或诱导剂量。在一个方面中,第一个给药方案包括连续给药方案。在另一方面中,第二给药方案包括低于或等于第一给药方案的药学活性剂量的维持剂量。在另一方面中,第二次给药方案持续至少约2、4、6、8、10、12、18、24、36、48、72或96个月。在一个方面中,第二个给药方案永久持续,用于受治疗的受试者的整个寿命,或无限期的时间。在一个方面中,第二个给药方案是连续给药方案。在另一方面中,第二个给药方案是间歇给药方案。在另外方面中,第二个给药方案是间歇给药方案,其包括至少1、2、3、4、5、6、7、8、9、10、11、12、13或14天的治疗期,然后是至少1、2、3、4、5、6、7、8、9、10、11、12、13或14天的休息期。在另一方面中,第二给药方案包括每隔一天、每两天或每隔3、4、5、6、7、8天给予第二剂量(例如维持剂量)。在另一方面中,维持剂量长时间施用,有或没有滴定(或以其他方式改变剂量或给药方案)。在一个方面中,第一和第二给药方案之间的间隔是至少约1、2、3、4、5、6、7、8、9、10、11或12周。在另一方面中,第二给药方案(例如,维持剂量)包含比第一给药方案中使用的剂量低约2、5、10、50、100、200、400、800、1000、5000或更多倍的剂量(例如,初始治疗剂量)。在另一方面中,第二给药方案(例如,维持给药方案)具有与第一给药方案相同或更低的给药频率(例如,初始治疗给药方案)。在另一方面中,第二给药方案(例如,维持给药方案)具有比第一给药方案更高的给药间隔(例如,初始治疗给药方案)。
在一个方面中,方法中使用的第一或第二给药方案可以是每周一次,每周两次或每周三次。术语“每周一次”是指剂量在一周内施用一次,优选在每周的同一天施用。“每周两次”是指剂量在一周内给药两次,优选在每周一次的相同两天给药。“每周三次”是指剂量在一周内给药三次,优选在每周一次的相同三天给药。
在一个方面中,被治疗的受试者是已经患有溃疡性结肠炎的受试者。将公开的治疗组合物给予临床上,无遗传倾向或易患溃疡性结肠炎的无症状人类受试者也可用于预防溃疡性结肠炎的临床症状的发作。遗传易感或易患溃疡性结肠炎的人类受试者可以是具有亲密家庭成员或亲属表现或遭受溃疡性结肠炎的人类受试者。在另一方面中,被治疗的受试者是要预防溃疡性结肠炎的受试者。在另一方面中,所治疗的受试者易患或易患溃疡性结肠炎。在另一方面中,被治疗的受试者是被诊断为患有溃疡性结肠炎的受试者。在一个方面中,受治疗的受试者是有需要的患者。
在一个方面中,被治疗的对象是人类患者。在一个方面中,患者是男性患者。在一个方面中,患者是女性患者。在一个方面中,患者是一个早产儿。在一个方面中,患者是新生儿。在一个方面中,患者是新生儿。在一个方面中,患者是婴儿。在一个方面中,病人是一个小孩。在一个方面中,病人是个小孩。在一个方面中,病人是个孩子。在一个方面中,患者是青少年。在一个方面中,患者是一名儿科患者。在一个方面中,患者是老年患者。在一个方面中,人类患者是低于约18、15、12、10、8、6、4、3、2或1岁的儿童患者。在另一方面中,人类患者是成年患者。在另一方面中,人类患者是一位老年患者。在另外方面中,人类患者是大约30、35、40、45、50、55、60、65、70、75、80、85、90或95岁以上的患者。在另一方面中,患者年龄大约在1到5之间、2到10之间、3到18之间、21到50之间、21到40之间、21到30之间、50到90之间、60到90之间、70到90之间、60到80之间、或65至75之间。在一个方面中,患者是年轻的患者(65-74岁)。在一个方面中,患者是中年患者(75-84岁)。在一个方面中,患者是老年患者(>85岁)。
在一个方面中,一种方法包括口服、通过灌肠或通过直肠栓剂给予治疗组合物。在一个方面中,本文给出的治疗组合物被配制成肠溶包衣(和/或耐酸)胶囊或微胶囊、或配制成食品、食品添加剂、乳制品、大豆基产品或其衍生物、果冻或酸奶的一部分或与其一起施用。在另一方面中,将本文施用的治疗组合物配制成耐酸的肠溶包衣胶囊。治疗组合物可以作为与食品或饮料组合出售的粉末提供。食品或饮料可以是基于乳制品的产品或基于大豆的产品。在另一方面中,食品或食品补充剂包含含有治疗组合物的肠溶衣和/或耐酸微胶囊。
在方面中,治疗组合物包括液体培养物。在另一方面中,将治疗组合物冻干、粉碎并粉化。然后可以将其注入,溶解在诸如盐水中,作为灌肠剂。或者,可将粉末包封为肠溶包衣和/或耐酸胶囊,用于口服给药。这些胶囊可以采用肠溶包衣和/或耐酸微胶囊的形式。粉末可优选以可口的形式提供,用于重构饮用或作为食品添加剂重构。在另外方面中,食物是酸奶。在一个方面中,粉末可以通过鼻-十二指肠输注重建以输注。
在另一方面中,本文给予的治疗组合物是液体、冷冻、冷冻干燥、喷雾干燥、冻干或粉末形式。在另外方面中,本文给药的治疗组合物被配制成延迟或逐渐的肠溶释放形式。在另一方面中,本文给予的治疗组合物包含赋形剂、盐水、缓冲剂、缓冲剂或流体-葡萄糖-纤维二糖琼脂(rgca)培养基。在另一方面中,本文给予的治疗组合物包含冷冻保护剂。在一个方面中,一种冷冻保护剂包括聚乙二醇、脱脂乳、赤藓糖醇、阿拉伯糖醇、山梨糖醇、葡萄糖、果糖、丙氨酸、甘氨酸、脯氨酸、蔗糖、乳糖、核糖、海藻糖、二甲基亚砜(dmso)、甘油或其组合。
在一个方面中,本文给予的治疗组合物还包含酸抑制剂、抗酸剂、h2拮抗剂、质子泵抑制剂或其组合。在一个方面中,一种基本上不含非生物物质的治疗组合物。在另一方面中,本文给予的治疗组合物基本上不含选自残余纤维、dna、病毒包衣材料和非活菌材料的无细胞材料。
在一个方面中,治疗组合物还包含或补充有选自多元醇、低聚果糖(fos)、低聚果糖、菊粉、低聚半乳糖(gos)、低聚木糖(xos)、聚葡萄糖、单糖、塔格糖和/或甘露寡糖的益生元营养素。
在一个方面中,一种方法还包括在施用治疗性细菌或微生物群组合物之前用抗生素组合物预处理受试者。在一个方面中,本文给出的抗生素组合物包含抗生素、其选自由利福布汀、克拉霉素、氯法齐明、万古霉素、利福平、硝基咪唑、氯霉素及其组合组成的组。在另一方面中,本文施用的抗生素组合物包含抗生素,其选自由利福昔明、利福霉素衍生物、利福平、利福布汀、利福喷汀、利福拉齐、比卡霉素、氨基糖苷、庆大霉素、新霉素、链霉素、巴龙霉素、verdamicin、mutamicin、西索米星、奈替米星、retymicin、卡那霉素、氨曲南、大黄素、大环内酯、克拉霉素、地红霉素、罗红霉素、泰利霉素、阿奇霉素、次水杨酸铋、万古霉素、链霉素、非达霉素、阿米卡星、阿贝卡星、新霉素、奈替米星、巴龙霉素、红霉素、妥布霉素、安普霉素及其组合组成的组。在另外方面中,一种方法还包括在施用治疗性细菌或微生物群组合物之前用抗炎药预处理受试者。
在一个方面中,一种方法可达到至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%的溃疡性结肠炎的缓解、治愈、反应或消退率。在一个方面中,一种治疗方法,治疗8周后,溃疡性结肠炎活动指数(ucdai)降低2、3、4、5、6、7、8、9、10或11以上。在另一方面中,一种治疗方法在治疗8周后使溃疡性结肠炎疾病活动指数(ucdai)在至少10%、20%、30%、50%、60%、70%、80%或90%患者人群中降低2、3、4、5、6、7、8、9、10或11以上。在一个方面中,与基线(例如,在治疗之前)相比,治疗8周后治疗方法使溃疡性结肠炎疾病活动指数(ucdai)降低至少10%、20%、30%、50%、60%、70%、80%或90%。在一个方面中,与基线相比(例如,在治疗之前),治疗8周后,治疗方法在至少10%、20%、30%、50%、60%、70%、80%或90%的患者中实现至少10%、20%、30%、50%、60%、70%、80%或90%的溃疡性结肠炎活动指数(ucdai)降低。
在另外方面中,使用疾病活动指数(dai)或mayo评分系统评估患者,如在schroeder等人,coatedoral5-aminosalcylicacidtherapyformildlytomoderatelyactiveulcerativecolitis.nengjmed.1987;317:1625–1629.中所述。在一个方面中,与基线相比(例如,在治疗之前),治疗8周后治疗方法实现mayo评分减少至少10%、20%、30%、50%、60%、70%、80%或90%。在一个方面中,与基线相比(例如,在治疗之前),治疗8周后治疗方法在至少10%、20%、30%、50%、60%、70%、80%或90%的患者中实现至少10%、20%、30%、50%、60%、70%、80%或90%的mayo评分减少。
在一个方面中,药学活性或治疗有效剂量包含至少约105,106,107,108,109、1010、1011、1012或1013cfu。在另一方面中,药学活性治疗有效剂量包括至多约105、106、107、108、109、1010、1011、1012或1013cfu。在另外方面中,药理活性治疗有效剂量选自由下组组成的组:108cfu-1014cfu、109cfu-1013cfu、1010cfu-1012cfu、109cfu-1014cfu、109cfu-1012cfu、109cfu-1011cfu、109cfu-1010cfu、1010cfu-1014cfu、1010cfu-1013cfu、1011cfu-1014cfu、1011cfu-1013cfu、1012cfu-1014cfu和1013cfu-1014cfu。
在一个方面中,药学活性或治疗有效剂量包含至少105、106、107、108、109、1010、1011、1012或1013个细胞或孢子。在另一方面中,药学活性或治疗有效剂量包含至多约105、106、107、108、109、1010、1011、1012或1013个总细胞或孢子。在另外方面中,药理活性或治疗有效剂量选自由下组组成的组:108-1014、109-1013、1010-1012、109-1014、109-1012、109-1011、109-1010、1010-1014、1010-1013、1011-1014、1011-1013、1012-1014和1013-1014个细胞或孢子。在方面中,药物活性或治疗有效剂量细胞计数针对活细胞。
在一个方面中,本文给予的治疗组合物包括粪便细菌。在一个方面中,本文给出的治疗组合物包含一种或多种、两种或更多种、三种或更多种、四种或更多种、或五种或更多种分离的、纯化的或培养的微生物,其选自梭菌属、bacillus、collinsella、bacteroides、eubacterium、梭杆菌属、propionibacterium、lactobacillus、瘤胃球菌属、escherichiacoli、gemmiger、desulfomonas、peptostreptococcus、bifidobacterium、coprococcus、dorea和monilia。
在一个方面中,本文给予的治疗组合物包含至少一种、至少两种、至少三种、至少四种、至少五种、至少六种、或至少七种粪便微生物,其选自:bacteroidesfragilisssp.vulgatus、collinsellaaerofaciens、bacteroidesfragilisssp.thetaiotaomicron、peptostreptococcusproductusii、parabacteroidesdistasonis、fusobacteriumprausnitzii、coprococcuseutactus、collinsellaaerofaciensiii、peptostreptococcusproductusi、ruminococcusbromii、bifidobacteriumadolescentis、gemmigerformicilis、bifidobacteriumlongum、eubacteriumsiraeum、ruminococcustorques、eubacteriumrectale、eubacteriumeligens、bacteroideseggerthii、clostridiumleptum、bacteroidesfragilisssp.a、eubacteriumbiforme、bifidobacteriuminfantis、eubacteriumrectaleiii-f、coprococcuscomes、pseudoflavonifractorcapillosus、ruminococcusalbus、doreaformicigenerans、eubacteriumhallii、eubacteriumventriosumi、fusobacteriumrussi、ruminococcusobeum、eubacteriumrectale、clostridiumramosum、lactobacillusleichmannii、ruminococcuscallidus、butyrivibriocrossotus、acidaminococcusfermentans、eubacteriumventriosum、bacteroidesfragilisssp.fragilis、bacteroidesar、coprococcuscatus、aerostipeshadrus、eubacteriumcylindroides、eubacteriumruminantium、eubacteriumch-1、staphylococcusepidermidis、peptostreptococcusbl、eubacteriumlimosum、tissirellapraeacuta、bacteroidesl、fusobacteriummortiferumi、fusobacteriumnaviforme、clostridiuminnocuum、clostridiumramosum、propionibacteriumacnes、ruminococcusflavefaciens、ruminococcusat、peptococcusau-1、bacteroidesfragilisssp.ovatus、-ssp.d、-ssp.f;bacteroidesl-1,l-5;fusobacteriumnucleatum、fusobacteriummortiferum、escherichiacoli、gemellamorbillorum、finegoldiamagnus、peptococcusg,-au-2;streptococcusintermedius、ruminococcuslactaris、ruminococcuscogemmigerx、coprococcusbh、-cc;eubacteriumtenue、eubacteriumramulus、bacteroidesclostridiiformisssp.clostridliformis、bacteroidescoagulans、prevotellaoralis、prevotellaruminicola、odoribactersplanchnicus、desuifomonaspigra、lactobacillusg、succinivibrioa及其组合。
在一个方面中,本文给予的治疗组合物不包含活的拟杆菌,梭杆菌属,propionibacterium,lactobacillus,ruminococcus,escherichiacoli,gemmiger,desulfomonas,peptostreptococcus,bifidobacterium,monilia或其任意组合。在另一方面中,本文施用的治疗组合物不包含活的bacteroidesfragilisssp.vulgatus、collinsellaaerofaciens、bacteroidesfragilisssp.thetaiotaomicron、peptostreptococcusproductusii、parabacteroidesdistasonis、fusobacteriumprausnitzii、coprococcuseutactus、collinsellaaerofaciensiii、peptostreptococcusproductusi、ruminococcusbromii、bifidobacteriumadolescentis、gemmigerformicilis、bifidobacteriumlongum、eubacteriumsiraeum、ruminococcustorques、eubacteriumrectale、eubacteriumeligens、bacteroideseggerthii、clostridiumleptum、bacteroidesfragilisssp.a、eubacteriumbiforme、bifidobacteriuminfantis、eubacteriumrectaleiii-f、coprococcuscomes、pseudoflavonifractorcapillosus、ruminococcusalbus、doreaformicigenerans、eubacteriumhallii、eubacteriumventriosumi、fusobacteriumrussi、ruminococcusobeum、eubacteriumrectale、clostridiumramosum、lactobacillusleichmannii、ruminococcuscallidus、butyrivibriocrossotus、acidaminococcusfermentans、eubacteriumventriosum、bacteroidesfragilisssp.fragilis、bacteroidesar、coprococcuscatus、aerostipeshadrus、eubacteriumcylindroides、eubacteriumruminantium、eubacteriumch-1、staphylococcusepidermidis、peptostreptococcusbl、eubacteriumlimosum、tissirellapraeacuta、bacteroidesl、fusobacteriummortiferumi、fusobacteriumnaviforme、clostridiuminnocuum、clostridiumramosum、propionibacteriumacnes、ruminococcusflavefaciens、ruminococcusat、peptococcusau-1、bacteroidesfragilisssp.ovatus、-ssp.d、-ssp.f;bacteroidesl-1、l-5;fusobacteriumnucleatum、fusobacteriummortiferum、escherichiacoli、gemellamorbillorum、finegoldiamagnus、peptococcusg、-au-2;streptococcusintermedius、ruminococcuslactaris、ruminococcuscogemmigerx、coprococcusbh、-cc;eubacteriumtenue、eubacteriumramulus、bacteroidesclostridiiformisssp.clostridliformis、bacteroidescoagulans、prevotellaoralis、prevotellaruminicola、odoribactersplanchnicus、desuifomonaspigra、lactobacillusg、succinivibrioa或其组合。
在一个方面中,本文给出的治疗组合物包含粪便微生物群。在另一方面中,本文使用的粪便微生物群的制备涉及选自乙醇处理、去污剂处理、热处理、辐射和超声处理的处理。在另一方面中,本文使用的粪便微生物群的制备不涉及选自乙醇处理、去污剂处理、热处理、辐射和超声处理的处理。在一个方面中,本文使用的粪便微生物群的制备涉及选自密度梯度、过滤(例如筛、尼龙网)和色谱法的分离步骤。在另一方面中,本文所用的粪便微生物群的制备不涉及选自密度梯度、过滤(例如筛、尼龙网)和色谱法的分离步骤。在另一方面中,本文使用的粪便微生物群包含供体的整个粪便微生物群。在另一方面中,本文给予的治疗组合物包含基本上不含来自粪便微生物群供体的真核细胞的粪便微生物群。
在另一方面中,本文给予的治疗组合物包含进一步用粪便微生物补充、掺入或增强的粪便微生物群。在一个方面中,粪便微生物群补充有梭菌、collinsella、dorea、瘤胃球菌属、coprococcus、prevotella、veillonella、bacteroides、baccillus或其组合的非致病性(或具有减毒致病性)细菌。在另一方面中,本文给予的治疗组合物包含进一步补充、掺入或增强的一种粪便微生物群,其中有一种veillonellaceae、firmicutes、gammaproteobacteria、bacteroidetes或其组合。在另一方面中,本文给予的治疗组合物包含进一步补充有粪便细菌孢子的粪便微生物群。在一个方面中,粪便细菌孢子是梭菌孢子、芽孢杆菌孢子或两者。
在方面中,在治疗组合物包括来自受试者的粪便微生物群,所述粪便微生物群选自人、牛、乳牛、反刍动物、绵羊、山羊或鹿。在另一方面中,治疗组合物可以施用于选自人、牛、乳牛犊、反刍动物、绵羊、山羊或鹿的受试者。在方面中,治疗组合物基本上或几乎无气味。
在方面中,本文提供或施用的治疗组合物包含粪便微生物群,其包含大于或等于0.3、大于或等于0.4、大于或等于0.5、大于或等于0.6、大于或等于0.7、大于或等于0.8、大于或等于0.9、大于或等于1.0、大于或等于1.1、大于或等于1.2、大于或等于1.3、大于或等于1.4、大于或等于1.5、大于或等于1.6、大于或等于1.7、大于或等于1.8、大于或等于1.9、大于或等于2.0、大于或等于2.1、大于或等于2.2、大于或等于2.3、大于或等于2.4、大于或等于2.5、大于或等于3.0、大于或等于3.1、大于或等于3.2、大于或等于3.3、大于或等于3.4、大于或等于3.5、大于或等于3.6、大于或等于3.7、大于或等于3.8、大于或等于3.9、大于或等于4.0、大于或等于4.1、大于或等于4.2、大于或等于4.3、大于或等于4.4、大于或等于4.5或大于或等于5.0的香农多样性指数。在另一方面中,治疗组合物包括粪便微生物群,其包含0.1-3.0、0.1-2.5、0.1-2.4、0.1-2.3、0.1-2.2、0.1-2.1、0.1-2.0、0.4-2.5、0.4-3.0、0.5-5.0、0.7-5.0、0.9-5.0、1.1-5.0、1.3-5.0、1.5-5.0、1.7-5.0、1.9-5.0、2.1-5.0、2.3-5.0、2.5-5.0、2.7-5.0、2.9-5.0、3.1-5.0、3.3-5.0、3.5-5.0、3.7-5.0、31.9-5.0或4.1-5.0的香农多样性指数。在一个方面中,香农多样性指数在门水平计算。在另一方面中,香农多样性指数在家庭层面计算。在一个方面中,香农多样性指数在属级别计算。在另一方面中,香农多样性指数在物种水平上计算。在另外方面中,治疗组合物包含比例含量的植物制剂,其类似于正常健康的人类粪便菌群。
在另外方面中,治疗组合物包括来自至少1、2、3、4、5、6、7、8、9或10个不同家族的粪便细菌。在另外方面中,治疗组合物包括来自多个供体的粪便细菌。在方面中,本文提供或施用的治疗组合物包含粪便微生物群,其包含不大于0.05%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%或10%重量的非生命材料/重量生物材料。在另一方面中,本文提供或施用的治疗组合物包含粪便微生物群,其包含不大于20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%重量的非生物材料/重量生物材料。在另一方面中,本文提供或施用的治疗组合物包括、由或由基本上由粪便样品的非生物材料颗粒和/或生物材料颗粒组成,所述粪便样品通过筛、柱、或类似的过滤装置,其具有2.0mm、1.0mm、0.5mm、0.25mm、0.212mm、0.180mm、0.150mm、0.125mm、0.106mm、0.090mm、0.075mm、0.063mm、0.053mm、0.045mm、0.038mm、0.032mm、0.025mm、0.020mm、0.01mm或0.2mm的筛子、排除物或颗粒过滤器尺寸。“非活体材料”不包括赋形剂,例如添加到加工过的粪便材料中的药学惰性物质,例如冷冻保护剂。“生物材料”是指粪便中的活体物质,包括包括原核细胞在内的微生物,如细菌和古细菌(如活的原核细胞和能够形成孢子的孢子成为活的原核细胞)、真核细胞如原生动物和真菌以及病毒。在一个实施例中,“生物材料”是指存在于正常健康人的结肠中的活体材料,例如微生物、真核细胞和病毒。在方面中,本文提供或施用的治疗组合物包含人粪便提取物,其中所述组合物基本上无气味。在方面中,本文提供或施用的治疗组合物包括冻干、粗制、半纯化或纯化制剂中的粪便物质或粪便花制剂。
在方面中,治疗组合物中的粪便微生物群包含高度精制或纯化的粪便菌群,例如基本上不含非花粪便物质。在方面中,可以进一步处理粪便微生物群,例如在筛分之前、之后或之前和之后进行微滤。在另一方面中,高度纯化的粪便微生物群产品被超滤以除去大分子但保留治疗性微生物群,例如细菌。
在另一方面中,本文使用的治疗组合物中的粪便微生物群包含或基本上由基本上分离的或纯化的粪便菌群或整个(或基本上完整的)微生物群组成,所述微生物群是(或包含)至少约90%91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.6%、99.7%、99.8%或99.9%分离或纯的粪便菌群的分离物,或具有不超过约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%或1.0%或更多的非粪菌群材料;或者,基本上分离的、纯化的或基本上整个的微生物群,如sadowsky等人,wo2012/122478a1,或如borody等人,wo2012/016287a2中所述。
在方面中,治疗组合物中的粪便微生物群包含供体的基本上完整或非选择性的粪便微生物群、重构的粪便物质或合成的粪便物质。在另一方面中,治疗组合物中的粪便微生物群不包含抗生素抗性群体。在另一方面中,治疗组合物包含粪便微生物群并且基本上不含外来物质(例如,非生物物质,包括无细胞物质、例如残留纤维、dna、rna、病毒包衣材料、非活力物质;和例如来自粪便物质供体的真核细胞等生物物质)。
在方面中,本文使用的治疗组合物中的粪便微生物群来自疾病筛选的新鲜同源粪便或等同的冷冻干燥和重建的粪便。在方面中,新鲜的同源粪便不包括抗生素抗性群体。在另一方面中,治疗组合物中的粪便微生物群来源于合成粪便组合物。在方面中,合成粪便组合物包含活菌群的制剂,其优选成比例含量,类似于不包括抗生素抗性群体的正常健康人粪便菌群。合适的微生物可选自:bacteroides,eubacterium,梭杆菌属,propionibacterium,lactobacillus,瘤胃球菌属,escherichiacoli,gemmiger,clostridium,desulfomonas,peptostreptococcus,bifidobacterium,collinsella,coprococcus,dorea和瘤胃球菌属。
在方面中,治疗组合物与其他佐剂例如抗酸剂组合以抑制胃中的细菌灭活(例如,mylanta、mucaine、gastrogel)。在另一方面中,使用h2-拮抗剂或质子泵抑制剂也可以在药理学上抑制胃中的酸分泌。示例性的h2拮抗剂是雷尼替丁。质子泵抑制剂的实例是奥美拉唑。在一个方面中,在给予治疗组合物或与治疗组合物共同给药之前给予酸抑制剂。
在方面中,治疗组合物的形式为:灌肠组合物,可用适当的稀释剂重建;肠溶胶囊;肠溶微胶囊;耐酸片;耐酸胶囊;耐酸微胶囊;用适当稀释剂重建的粉末,用于鼻肠输注或结肠镜输注;用适当的稀释剂、调味剂和胃酸抑制剂重建用于口服摄入的粉末;用食物或饮料复原的粉末;或包含组合物、粉末、果冻或液体的肠溶包衣和/或耐酸微胶囊的食品或食品补充剂。
在方面中,一种治疗方法可以治愈、症状减轻或溃疡性结肠症状减轻百分比。植物群的变化优选尽可能“接近完全”,并且植物群被活的生物体取代,这些生物体会挤出任何剩余的原始植物群。通常,肠道菌群的变化包括将一系列预定菌群引入胃肠系统,因此在优选形式中,治疗方法包括在需要这种治疗的患者中基本上或完全置换致病性肠道菌群。
在另一方面中,治疗组合物可与药学上可接受的载体一起提供。如本文所用,“药学上可接受的载体”是指无毒溶剂、分散剂、赋形剂、佐剂或与活细菌混合的其他材料,以允许形成药物组合物,例如能够给患者服用的形式的剂量。药学上可接受的载体可以是液体(例如盐水)、凝胶或固体形式的稀释剂、佐剂、赋形剂或耐酸的胶囊化成分。合适的稀释剂和赋形剂包括药物级的生理盐水、右旋糖、甘油、甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等、以及它们的组合。在另一方面中,治疗组合物可含有辅助物质,例如润湿剂或乳化剂、稳定剂或ph缓冲剂。在方面中,治疗组合物包含约1%-5%、5%-10%、10%-15%、15-20%、20%-25%、25-30%、30-35%、40-45%、50%-55%、1%-95%、2%-95%、5%-95%、10%-95%、15%-95%、20%-95%、25%-95%、30%-95%、35%-95%、40%-95%、45%-95%、50%-95%、55%-95%、60%-95%、65%-95%、70%-95%、45%-95%、80%-95%或85%-95%的有效成分。在方面中,治疗组合物包含约2%-70%、5%-60%、10%-50%、15%-40%、20%-30%、25%-60%、30%-60%或35%-60%的有效成分。
在方面中,治疗组合物可以掺入片剂、浸剂、大丸剂、胶囊或预混料中。将这些活性成分配制成这样的剂型可以通过药物制剂领域熟知的方法完成。参见,例如,美国专利no.4,394,377。用任何所需形式的活性成分填充明胶胶囊容易产生胶囊。如果需要,这些材料可以用惰性粉末稀释剂稀释,例如糖、淀粉、奶粉、纯化的结晶纤维素等,以增加体积以便于填充胶囊。
在方面中,常规制剂方法可用于制备含有治疗组合物的片剂。除活性成分外,片剂还可含有碱、崩解剂、吸收剂、粘合剂和润滑剂。典型的碱包括乳糖、糖、氯化钠、淀粉和甘露醇。淀粉也是一种良好的崩解剂,因为藻酸。有时也使用表面活性剂如十二烷基硫酸钠和二辛基磺基琥珀酸钠。常用的吸收剂包括淀粉和乳糖。碳酸镁也适用于油性物质。作为粘合剂,可以使用例如明胶、树胶、淀粉、糊精、聚乙烯吡咯烷酮和各种纤维素衍生物。在常用的润滑剂中有硬脂酸镁、滑石、石蜡、各种金属皂和聚乙二醇。
在方面中,为了制备诸如片剂的固体组合物,将活性成分与药物载体混合,例如常规的压片成分,例如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或牙龈、或其他药物稀释剂,例如水,以形成含有本发明组合物的均匀混合物的固体预配制组合物。当将这些预制剂组合物称为均匀时,意指活性成分均匀地分散在整个组合物中,使得组合物可以容易地细分成等效的单位剂型,例如片剂、丸剂和胶囊剂。然后将该固体预配制组合物细分为上述类型的单位剂型,其含有所需量的活性成分(例如,至少约105、106、107、108、109、1010、1011、1012或1013cfu)。本文使用的治疗组合物可以是调味的。
在方面中,治疗组合物可以是片剂或丸剂。在一个方面中,可以将片剂或丸剂包衣或以其它方式混合以提供具有延长作用优点的剂型。例如,片剂或丸剂可包含内剂量和外剂量组分,后者在前者上形成包膜。这两种组分可以通过肠溶层分开,肠溶层用于抵抗胃中的崩解并允许内部组分完整地进入十二指肠或延迟释放。多种材料可用于此类肠溶层或涂层,这些材料包括许多聚合酸和聚合酸与诸如虫胶、鲸蜡醇和乙酸纤维素等物质的混合物。
在方面中,治疗组合物可以是一个浸水。在一个方面中,通过选择盐水悬浮形式的治疗组合物来制备浸液。一种成分的水溶性形式可以与另一种成分的水不溶性形式结合使用,通过用另一种成分的水溶液制备一种成分的悬浮液。水不溶性形式的任一种活性成分可以制备成悬浮液或在一些生理学上可接受的溶剂如聚乙二醇中制备。水不溶性形式的任一种活性成分的悬浮液可以在油如花生、玉米、芝麻油等中制备;在二醇如丙二醇或聚乙二醇中;或取决于特定活性成分的溶解度在水中。为了保持活性成分悬浮,可能需要合适的生理学上可接受的佐剂。佐剂可包括增稠剂,例如羧甲基纤维素、聚乙烯吡咯烷酮、明胶和藻酸盐。表面活性剂通常用于悬浮活性成分,特别是脂溶性丙酸盐增强化合物。最有用于在液体非溶剂中制备悬浮液的是烷基酚聚环氧乙烷加合物、萘磺酸盐、烷基苯磺酸盐和聚氧乙烯脱水山梨糖醇酯。此外,影响液体的亲水性、密度和表面张力的许多物质可有助于在个别情况下制备悬浮液。例如,硅氧烷消泡剂、二醇、山梨糖醇和糖可以是有用的悬浮剂。
在方面中,治疗组合物包含一种或多种,两种或更多种,三种或更多种,或四种或更多种梭菌属的非致病性孢子,其选自:clostridiumabsonum、clostridiumargentinense、clostridiumbaratii、clostridiumbotulinum、clostridiumcadaveris、clostridiumcarnis、clostridiumcelatum、clostridiumchauvoei、clostridiumclostridioforme、clostridiumcochlearium、clostridiumfallax、clostridiumfelsineum、clostridiumghonii、clostridiumglycolicum、clostridiumhaemolyticum、clostridiumhastiforme、clostridiumhistolyticum、clostridiumindolis、clostridiumirregulare、clostridiumlimosum、clostridiummalenominatum、clostridiumnovyi、clostridiumoroticum、clostridiumparaputrificum、clostridiumperfringens、clostridiumpiliforme、clostridiumputrefaciens、clostridiumputrificum、clostridiumsardiniense、clostridiumsartagoforme、clostridiumscindens、clostridiumsepticum、clostridiumsordellii、clostridiumsphenoides、clostridiumspiroforme、clostridiumsporogenes、clostridiumsubterminale、clostridiumsymbiosum、clostridiumtertium、clostridiumtetani、clostridiumwelchii和clostridiumvillosum。
在方面中,治疗组合物包括纯化的、分离的或培养的活的非致病性梭菌属和多种纯化的、分离的或培养的来自选自下组的一个或多个属的非病原微生物:collinsella、coprococcus、dorea、eubacterium和瘤胃球菌属。在另一方面中,治疗组合物包含多种纯化的、分离的或培养的来自选自下组的一个或多个属的非致病性微生物:梭菌属、collinsella、coprococcus、dorea、eubacterium和瘤胃球菌属。
在方面中,治疗组合物包含两个或更多个属,其选自:collinsella、coprococcus、dorea、eubacterium和瘤胃球菌属。在另一方面中,治疗组合物包含两个或更多个属,其选自:coprococcus、dorea、eubacterium和瘤胃球菌属。在另外方面中,治疗组合物包含一个或多个、两个或更多个、三个或更多个、四个或更多个、或五个或更多个种,其选自:coprococcuscatus、coprococcuscomes、dorealongicatena、eubacteriumeligens、eubacteriumhadrum、eubacteriumhallii、eubacteriumrectale和ruminococcustorques。
在一个方面中,治疗组合物包括至少约105、106、107、108、109、1010、1011、1012或1013cfu。在另一方面中,治疗组合物包括最多约105、106、107、108、109、1010、1011、1012、1013或1014cfu。
在另一方面中,治疗组合物包括至少约105、106、107、108、109、1010、1011、1012或1013个细胞。在另一方面中,治疗组合物包括最多约105、106、107、108、109、1010、1011、1012、1013或1014个细胞。
从上述内容可以理解,本发明可以以各种方式实施,包括但不限于以下实施例:
1.一种治疗有需要的受试者的溃疡性结肠炎(uc)的方法,包括用治疗方案治疗受试者,所述治疗方案包括给予包含活的非致病性粪便细菌的药物组合物至少8周并且每周至少3次。
2.一种治疗有此需要的受试者的病症的方法,包括用治疗方案治疗受试者,所述治疗方案包括给予包含活的非致病性粪便细菌的药物组合物至少8周并且每周至少三次,其中病症选自胶原性结肠炎、淋巴细胞性结肠炎、克罗恩氏结肠炎、憩室炎和脓包炎。
3.实施例1或2的方法,其中治疗方案能够实现至少高于相对于来自安慰剂的主要结果率两倍的主要结果率,其中在治疗方案结束时主要结果被定义为无类固醇临床缓解和内窥镜缓解或响应,其中临床缓解被定义为总mayo评分为2或更低并且所有子评分为1或更低,其中内窥镜缓解或响应定义为mayo内窥镜检查评分从基线减少至少1个点。
4.实施例3的方法,其中治疗方案能够实现至少25%的主要结果率。
5.实施例3的方法,其中治疗方案能够实现20%-40%的主要结果率。
6.实施例3的方法,其中在治疗方案完成后8周治疗方案能够实现至少40%的临床缓解维持率。
7.实施例3的方法,其中在治疗方案完成后8周治疗方案能够实现35%-60%的临床缓解维持率。
8.实施例1或2的方法,其中治疗方案相对于安慰剂的无类固醇临床缓解率能够实现至少高两倍的无类固醇临床缓解率,其中临床缓解被定义为直肠出血和大便次数的综合mayo评分为1或更低。
9.实施例8的方法,其中治疗方案能够实现至少40%的无类固醇临床缓解率。
10.实施例8的方法,其中治疗方案能够实现35%-55%的无类固醇临床缓解率。
11.实施例1或2的方法,其中治疗方案相对于安慰剂的无类固醇临床响应率能够实现至少高两倍的无类固醇临床响应率,其中临床响应被定义为在直肠出血和大便次数的综合评分中总mayo评分减少3或更高或从基线减少50%或更高。
12.实施例11的方法,其中治疗方案能够实现至少50%的无类固醇临床响应率。
13.实施例11的方法,其中治疗方案能够实现45%-65%的无类固醇临床响应率。
14.实施例1或2的方法,其中治疗方案相对于安慰剂的内窥镜响应率能够实现至少高两倍的内窥镜响应率,其中内窥镜响应被定义为总uceis评分降低3或更高或从基线降低50%或更高。
15.实施例14的方法,其中治疗方案能够实现至少30%的内窥镜响应率.
16.实施例14的方法,其中治疗方案能够实现30%-45%的内窥镜响应率。
17.如实施例1或2所述的方法,其中所述方法还包括确定所述受试者的基线肠道细菌多样性。
18.实施例17的方法,其中通过在治疗步骤之前分析受试者粪便样品的香农多样性来评估受试者的基线肠道细菌多样性。
19.实施例18的方法,其中受试者的粪便香农多样性基于细菌物种水平在0.5和2.2之间。
20.实施例1或2的方法,其中该方法还包括确定受试者肠道中梭杆菌属、萨特氏菌属或两者的水平。
21.实施例1或2的方法,其中该方法还包括测定选自受试者肠道中barnesiella、parabacteroides、梭菌属iv、瘤胃球菌属、布劳特氏菌属、dorea、瘤胃球菌属2和梭菌属xviii的一种或多种细菌的水平。
22.实施例1或2的方法,其中药物组合物包含粪便微生物群制剂。
23.实施例1或2的方法,其中受试者在治疗步骤之前表现出至少4的mayo评分。
24.实施例1或2的方法,其中受试者在治疗步骤之前表现出4-10的mayo评分。
25.一种治疗有需要的受试者的溃疡性结肠炎(uc)并显示3或更低的mayo内窥镜检查评分的方法,该方法包括向受试者施用包含活的非致病性粪便细菌的药物组合物。
26.实施例25的方法,其中所述施用遵循持续至少8周的治疗方案。
27.实施例25的方法,其中所述给药遵循至少8周且每周至少3次的治疗方案。
28.如实施例27所述的方法,其中所述受试者能够在所述治疗方案结束时实现主要结果,其中在治疗方案结束时主要结果被定义为无类固醇临床缓解和内窥镜缓解或响应,其中无类固醇临床缓解被定义为总mayo评分为2或更低并且所有子评分为1或更低,其中内窥镜缓解或响应被定义为mayo内窥镜检查评分从基线减少至少1个点。
29.实施例25的方法,其中所述施用步骤在每日治疗方案之后持续至少8周。
30.一种治疗有需要的受试者的溃疡性结肠炎(uc)的方法,该方法包括向受试者施用包含活的非致病性粪便细菌的药物组合物,其中在所述方法期间受试者没有伴随使用皮质类固醇并且在开始该方法之前不立即使用皮质类固醇。
31.实施例30的方法,其中所述受试者在开始所述方法之前至少一周内不使用类固醇。
32.实施例30的方法,其中所述受试者在开始所述方法之前至少一周内不使用皮质类固醇。
33.实施例30的方法,其中所述受试者在开始所述方法之前不使用皮质类固醇。
34.实施例30的方法,其中所述施用遵循持续至少8周的方案。
35.实施例30的方法,其中所述给药遵循至少8周并且至少每周三次的方案。
36.如实施例35所述的方法,其中所述受试者能够在所述方案结束时实现主要结果,其中在治疗方案结束时主要结果被定义为无类固醇临床缓解和内窥镜缓解或响应,其中无类固醇临床缓解被定义为总mayo评分为2或更低并且所有子评分为1或更低,其中内窥镜缓解或响应被定义为mayo内窥镜检查评分从基线减少至少1个点。
37.一种选择用于治疗有需要的受试者的溃疡性结肠炎(uc)的治疗计划的方法,该方法包括确定受试者肠道中梭杆菌属、萨特氏菌属或两者的水平;并且当梭杆菌属、萨特氏菌属或两者的水平低于预定水平时,推荐基于粪便细菌的疗法。
38.一种选择治疗有需要的受试者的溃疡性结肠炎(uc)的治疗计划的方法,该方法包括确定选自受试者肠道中barnesiella、parabacteroides、梭菌属iv、瘤胃球菌属、布劳特氏菌属、dorea、瘤胃球菌属2和梭菌属xviii的一种或多种细菌的水平;并且当选自上述一种或多种细菌的水平高于预定水平时,推荐基于粪便细菌的疗法。。
39.实施例37或38的方法,其中通过分析所述受试者的粪便确定一种或多种细菌的水平。
实施例
实施例1.患者选择标准.
患者,包括18至75岁的男性和女性,具有临床和内镜活动性溃疡性结肠炎,总mayo评分为4-10,其中包括大便频率、直肠出血、内窥镜检查时的粘膜外观以及医生的全球评估(pga)包括在内。内窥镜检查评分必须≥1且pga评分≤2。此外,这种溃疡性结肠炎的持续时间必须超过三个月。除了<5cm的孤立性直肠炎外,治疗任何程度的溃疡性结肠炎。所有入选标准见表4。
表4:研究参与者入选标准
接受口服5-氨基水杨酸盐,硫嘌呤和甲氨蝶呤治疗的患者必须服用稳定的剂量。患者允许使用口服泼尼松龙,前提是剂量为isisolone,允许注册。接受强制性口服泼尼松龙治疗的患者每周可逐渐减少2.5毫克,并且在第8周需要无类固醇。
在过去2周内接受直肠治疗,过去4周内接受抗生素或益生菌治疗,并在过去12周内接受生物治疗的患者将被排除在外。表现出中毒性巨结肠的证据或病史的患者,以及任何其他显着的胃肠道疾病,包括但不限于肠易激综合征、憩室炎和肿瘤,也被排除在外。被排除在诊断为克罗恩病或不确定结肠炎的患者之外。肛周疾病如瘘管和预先存在的裂隙的患者被排除在外。患有严重贫血、白血球或粒细胞减少症的患者被排除在外。在治疗前不到3个月进行阑尾切除术的患者也被排除在外。排除具有显着食物超敏反应的患者。所有排除标准见表5。
表5:研究参与者排除标准
基于上述标准,本研究招募了85名患者。选择的患者随机接受81次开始治疗(图1)。除疾病严重程度外,两组匹配良好;患有最轻微(mayo1)内窥镜疾病的患者被随机分配到安慰剂。表6总结了招募患者的基线特征。
表6:基线患者特征.
示例2.大便捐赠者选择.
包括18至65岁的男性和女性的粪便供体,其没有胃肠疾病的历史或当前症状,包括但不限于炎性肠病和肠易激综合征。捐助者不应该有任何重要的积极医疗合作动员。捐赠者应该使用最少的常规药物,没有可能干扰粪便活力的药物,包括在捐赠前的前三个月没有抗生素、益生菌和质子泵抑制剂。所有供体纳入标准见表7。
表7:健康粪便供体入选标准
为排除不健康的供体,使用以下一项或多项测试评估潜在供体的粪便:clostridiumdifficile毒素pcr、粪便显微镜检查/培养/对肠道病原体常规细菌培养的敏感性、粪便贾第虫抗原、粪便孢子虫抗原、粪便卵/囊肿/寄生虫(包括人芽囊原虫和dientamoebafragilis)和诺如病毒eia。还测试潜在供体的血液中的一种或多种:全血细胞计数(cbc);电解质、尿素和肌酐(euc);肝功能检查(lft);红细胞沉降率(esr);c反应蛋白(crp);人类免疫缺陷病毒(hiv)1型和2型;甲型肝炎病毒igm;乙型肝炎病毒表面抗原、乙型肝炎病毒核心抗体(igm+igg)、乙型肝炎病毒表面抗体;丙型肝炎病毒抗体;快速血浆恢复和/或荧光密螺旋体抗体吸收;和人t细胞淋巴细胞病毒(htlv)1和2。
表8:健康粪便供体排除标准
根据上述标准和测试,选择了14名捐助者。
实施例3.fmt和安慰剂的制备和储存.
fmt输注由3至7个供体的混合粪便构成,以增加微生物的异质性。每位患者从同一供体批次接受所有fmt输注,以确保输注的粪便微生物群的一致性和可重复性。
安慰剂输注包括等渗盐水。将有色、棕色食用色素4,4'-2,4-二羟基-5-羟甲基-1,3-亚苯基-双偶氮-1-萘磺酸二钠(分别复制粪便气味和颜色)和甘油冷冻保护剂(浓度10%)加入150ml安慰剂和fmt输注液中,然后储存在-80℃。
在研究中,三到七个选定的捐助者参与了21个fmt批次中的每一个。对所有输注使用多个供体是本研究的特征之一。
例4.研究设计.
在三个临床中心,患者随机1:1双盲对fmt:安慰剂使用4个排列的块,分层用于研究部位和伴随的皮质类固醇使用。
在完全肠道准备后,对回肠末端进行结肠镜检查并进行初始输注。然后患者每周自我灌肠5次,持续8周。8周后,用乙状结肠镜检查评估粘膜炎症。
在最初的8周研究期后,安慰剂治疗的患者每周5次提供8周的开放式fmt灌肠,没有初始结肠镜输注。在开放标记的fmt后重复进行乙状结肠镜检查。
图2显示了该研究设计的图形表示。
示例5.研究评估和终点.
在盲法和开放标签研究期间每两周对患者进行一次评估,并在fmt后8周进行最终评估。在研究治疗期间每4周进行一次血液和粪便调查。血液检查包括cbc、euc、lft、esr和crp。粪便测试包括粪便钙卫蛋白。
使用mayo内窥镜检查子评分和uceis评分评估每次内窥镜检查中最严重的炎症部位,对5名ibd专家胃肠病学家进行盲法评估和所有内窥镜照片图像的中心共识评分。
主要复合结果是无类固醇临床缓解以及第8周的内窥镜缓解或响应,定义为≤2的总mayo评分,内窥镜检查评分中所有子评分≤1且≥1点减少。
41名(27%)fmt治疗患者中的11名和40名(8%)安慰剂治疗患者中的3名达到主要结果(p=0.02,or4.5(95%ci1.2-17.7))(图3a、图4a-d)。
图3a显示了在第8周达到无类固醇临床缓解和内窥镜缓解或响应的主要结果的fmt和安慰剂治疗组的患者人数(在内窥镜检查子评分中,所有子评分≤1且与基线相比≥1点减少的总mayo评分≤2)。总的mayo评分范围为0到12,子评分范围为0到3,分数越高表明疾病越严重。
图4a和图4b显示了fmt疗法对37岁女性患者的影响,该患者具有4年左侧溃疡性结肠炎和急性结肠炎(腹泻每天6次出血),尽管最大口服和局部用药5-asa疗法。图4a示出了具有内窥镜mayo子评分2和总mayo评分8的25cm直肠-乙状结肠活动性结肠炎的示例性基线内窥镜外观。图4b示出了在第8周盲法fmt治疗结束时同一患者中的内窥镜mayo子评分0和总mayo评分0的示例性内窥镜外观。该患者在完成盲法fmt疗法后8周的最终研究随访中保持临床缓解。
图4c和图4d显示了fmt疗法对具有7年广泛性溃疡性结肠炎病史的28岁女性患者的影响。该患者使用美沙拉嗪、益生菌和阿达木单抗治疗失败。因此,患者维持在硫唑嘌呤和别嘌呤醇上,并且对于口服布地奈德9mg/天是类固醇依赖性的。在研究开始时,该患者每天腹泻8次,并伴随出血和腹痛。图4c示出了具有内窥镜mayo亚评分3和总mayo评分10的肝硬化的广泛性结肠炎的示例性基线内窥镜外观。该患者在初步研究期间接受安慰剂治疗,但是不能使皮质类固醇逐渐减少,因此主要结果治疗失败。图4d显示在完成8周开放标记的fmt时同一患者的内窥镜外观,内窥镜mayo子评分0和总mayo评分0。在开放标记的fmt8周后,该患者完全断奶皮质激素,临床和内镜缓解。
次要结果包括无类固醇临床缓解(直肠出血综合评分≤1加大便频率mayo子评分)、临床响应(直肠综合征减少≥3和/或≥50%、加上大便频率mayo子评分)、内窥镜响应(mayo内镜检查子评分≤1、从基线开始减少≥1)、完全粘膜愈合(mayo内镜检查子评分0)、使用ibdq10的生活质量和安全性。
使用mayo和uceis评分进行所有内窥镜图像的盲中心读数。使用uceis评分中基线减少≥3点和/或≥50%评估无类固醇内镜检查结果,第8周时fmt和安慰剂组之间的差异为37%比10%,p<0.01,or5.2,95%ci1.5-17.5。当使用uceis≤1的标准时,在第8周时,fmt和安慰剂治疗的患者之间的差异为17%比8%,p=0.19,or2.5,95%ci0.6-10.6。
在总体mayo评分中观察到显着差异,并且在第8周,在fmt和安慰剂治疗组之间观察到总mayo评分的减少(表9)。ibdqfmt数据仅来自31名患者。所有缺失的数据在整个队列中被指定为最差值。所有连续变量均报告为中位数和四分位数范围。
表9:第8周的功效结果.
图3b显示了第8周无类固醇临床缓解(直肠出血加大便次数mayo分数的综合评分≤1)和临床响应(在直肠出血加粪便频率mayo分数的综合评分中,从基线减少≥3分和/或≥50%)的患者数。第8周的无类固醇临床缓解(44%对比20%,p=0.02,or3.1,95%ci1.2-8.4)和无类固醇临床响应(54%对比23%,p<0.01,or4.0,95%ci1.5-10.4)在fmt中显着高于安慰剂治疗的患者。
图3c显示具有无类固醇内窥镜响应(mayo内窥镜检查子评分≤1,从基线降低≥1)和完全粘膜愈合(mayo内窥镜检查子评分0)的患者数。在第8周,在fmt治疗的患者中,无类固醇内窥镜响应(32%对比10%,p=0.02,or4.2,95%ci1.2-14.2)显着更高。完全粘膜愈合(mayo0:12%对比8%,p=0.48,or1.795%ci0.4-7.7)在fmt中比安慰剂组更大,但这种差异不显着。结果与uceis得分相似(图5)。图5显示了治疗开始的速度。在第4周结束时,临床响应在fmt[41个中的17个(41%)]中显着高于安慰剂(40个中的5个(13%))治疗的患者(p<0.01,or5.0,95%ci1.6-15.3)。临床缓解在治疗组之间没有显着差异[分别是41例中的12例(29%)与40例中的5例(13%),(p=0.06,or2.9,95%ci0.91-9.2)]。
ibdq评分和炎症标志物在各组之间没有显着差异(表9)。
最初安慰剂治疗患者中有37名患者进行了开放式fmt标记。开放标签fmt后,10例(27%)符合主要终点,17例(46%)处于临床缓解,8例(22%)完全粘膜愈合。
结果与解剖学疾病程度之间没有关系(p=0.23)。内镜炎症的严重程度与治疗结果相关(p=0.01),没有患者在研究开始时获得主要结果的mayo内窥镜检查评分3。皮质类固醇的使用也与治疗结果相关(p=0.02),没有患者进入皮质类固醇研究,在盲法治疗结束时达到主要终点;一名开放标签fmt患者皮质类固醇激素患者在完成时符合主要终点。
完成双盲或开放式fmt后8周,63名患者参加了最终研究随访,其中28名患者处于临床缓解期,20名需要uc治疗升级。
在第8周之前,9名盲法fmt患者和11名安慰剂患者(p=0.56)退出或有协议失败。盲法治疗时退缩或方案失败的原因包括类固醇断奶的疾病恶化(3fmt,6安慰剂),在没有类固醇断奶(5fmt,3安慰剂)和不依从性(1fmt,2安慰剂)的情况下疾病持续或恶化。
开始接触开放标签fmt的11名患者退出或有方案失败:5名患者在类固醇断奶时病情恶化,2名患者在没有类固醇断奶时有疾病持续或恶化,4名患者不顺从。
在盲法治疗期间,32名(78%)fmt和33名(83%)安慰剂治疗的患者经历至少一种不良事件,不良事件的数量或类型没有显着差异(表10)。最常见的不良事件是自限性胃肠道不适(腹痛、腹胀和胃肠胀气)。在研究治疗期间发生六种严重不良事件(sae):2盲法fmt,1安慰剂,3开放标记fmt。由于临床和内镜(mayo2至3,uceis5至7)恶化,一名患有盲法fmt的难治性结肠炎的患者在第2周退出,并进行了结肠切除术。一名患有中度至重度结肠炎的患者在盲法积极治疗的第3周仍然不适,退出并因静脉内皮质类固醇治疗住院。一名患有中度至重度结肠炎的患者在安慰剂治疗的第3周撤回并需要住院治疗。三名初始安慰剂治疗的患者未能通过开放标签fmt改善,并因治疗升级住院。
表10:不良事件
在研究治疗期间观察到六个严重不良事件:2个不知情的fmt,1个安慰剂,3个开放标记的fmt。一名因盲法fmt而患有难治性uc的患者因临床和内镜恶化而退出,并接受了结肠切除术。三名初始安慰剂治疗的患者无法通过开放标签fmt改善,需要住院静脉注射皮质类固醇或抗tnf治疗。
uc中的多供体,强化剂量fmt在短期内似乎是安全的。最严重的不良事件涉及无法耐受类固醇断奶的皮质类固醇依赖性或难治性患者,或患有中度至重度结肠炎的患者。在fmt期间接受结肠切除术的患者表明,一小部分uc患者可能对该疗法的疾病恶化敏感。
没有单独的供体或供体批次与主要结果显着相关,尽管该特定研究无法对此进行评估。其中一名捐赠者倾向于与福利相关,37%的患者和18%没有该捐赠者达到主要结果(p=0.054)。供体批次与主要终点或严重不良事件无关。
根据现有数据和轶事经验,预测的fmt缓解率为60%,安慰剂率为15%,辍学率为30%。在意向治疗分析中,每组40名患者需要80%的概率证明双侧α为0.05的差异。
所有分析均为治疗意向(itt),包括至少接受一次研究剂量的所有患者。需要增加治疗,违反研究方案,在第8周未能停用皮质类固醇或因任何原因终止研究的患者被视为治疗失败。在队列中为缺失和不完整的数据分配最差值以进行统计分析。
为所有变量计算描述性统计。正态分布的连续数据表示为平均值和标准偏差,并使用非配对t检验进行分析。非正态分布的数据表示为中位数和四分位数范围,并使用wilcoxon秩和检验进行分析。分类数据通过卡方检验和fisher精确检验进行评估。结果表示为具有95%置信区间的优势比。p值<0.05被认为是显着的。
使用spss23.0版软件(chicago,il)进行统计学分析。
实施例6.胃肠道微生物群分析.
对患者,个体供体和fmt批次粪便样品进行微生物分析。将样品储存在-80℃。提取粪便细菌dna。使用f27和519r引物扩增16srrna基因片段,然后在illuminamiseq平台(2×300bp化学)上进行高通量测序以确定微生物群的多样性和丰度。使用mothur分析原始序列(schloss等人,appl.environ.microbiol.2009;75:7537-41)。对计数和相对丰度进行统计测试。
多样性(α-和系统发育)分析和统计分析,包括主成分分析(pca),cluster和simprof测试,置换manova(permanova),并且使用mothur和primer-e对读数进行permdisp(clarke.j.ofecology1993;18(1):117-43)。线性判别分析效果大小(lefse)分析(segata等人,genomebiol.2011;12:r60)使用galaxyweb应用程序(goecks等人,genomebiol.2010;11:r86)执行。
从70名患者收集粪便样品。分析了314个患者和113个供体粪便样品(55个个体供体和58个批次样品)。每个样品获得的清洁序列数为26976±540稀释曲线表明取样已达到饱和。
供体批次中的操作分类单位(otu)和系统发育多样性的数量显着高于个体供体(图6a和图6b)。供体样品(批次和个体)的otu数量和系统发育多样性显着高于基线患者样品(图6a和图6b)。图6a和图6b中的***表示p<0.0001。
在4周和8周时,所有fmt治疗的患者的otu数和系统发育多样性相对于基线显着增加(p<0.0001),并且在fmt后8周持续(p<0.0001)(图6a和图6b)。对物种丰富度和香农的多样性观察到类似的模式。
在fmt后,从otu到类别分类水平观察到微生物谱和降低的分散水平的显着差异。pca证实了接受fmt的患者的微生物特征的变化(图6c)。患者概况从拟杆菌(bacteroides)的优势转变为普氏菌(prevotella)(图6c)。在otu水平上,接受fmt的患者的微生物特征向供体的转变最为显着。
将患者基线样品与第4周,第8周和fmt后8周进行比较,以鉴定通过fmt改变的分类群,并与供体样品一起鉴定与供体批次相关的otu和与患者相关的otu。所有分类水平的255个微生物类群被移植到fmt中,其中78个显示出强烈的关联(lda得分>3)。患者拟杆菌(例如otu8、15、69)的减少和供体普氏菌(例如otu2)和供体拟杆菌(例如otu12、26、56)与fmt的显着增加,与临床结果无关。当以更高分辨率拾取otu时,这种模式更加明显。
获得主要结果的盲法fmt治疗患者倾向于比不进行主要结果的患者具有更高的基线α多样性(p=0.1,图6d)。盲法fmt治疗与所有患者的多样性显着增加有关;然而,实现主要结果的患者在fmt期间和fmt后8周具有更大的多样性,达到高于个体供体的水平,尽管低于供体批次(图6d)。增加的α多样性是fmt特有的;符合安慰剂主要结果的3名患者的多样性没有变化。
为了鉴定与fmt上的主要结果相关的微生物类群,用盲法fmt进行lefse分析,并对开放标记的fmt患者进行分层。87个分类群与盲法患者的主要结果和开放标签fmt患者的46个分类群显着相关。一系列微生物类群与盲法fmt(例如barnesiella、parabacteroides、梭菌属iv和瘤胃球菌属)和开放标签fmt患者(例如布劳特氏菌属、dorea、瘤胃球菌属2和梭菌属xviii)的缓解相关。梭杆菌属和萨特氏菌属均与盲法和开放标记的fmt患者均无明显缓解相关;对于梭杆菌属,这涉及未达到缓解的患者根除不足、无缓解的患者移植、或达到缓解的患者根除。
实施例7.治疗-naive溃疡性结肠炎患者用口服粪便微生物组疗法治疗
一名44岁的未接受过治疗的男性患者(患者dm)患有腹泻、粪便中的血液和粘液、痉挛/腹痛和体重减轻的一年病史。患者在排便时会出现剧烈疼痛、开车时大小便失禁、食欲不振、恶心、无法食用辛辣食物和鱼类、脑雾、体重减轻16磅。患者每天也经历10-12次排便,一致性为7(布里斯托尔),严重腹胀,严重的腹部不适和严重的尿急。该患者被诊断患有严重的全结肠炎。使用包含抗酸/延迟释放双重包封的口服胶囊的治疗方案,所述口服胶囊含有冻干的供体衍生的未选择的粪便微生物群。简言之,收集供体粪便并用冷冻保护剂匀浆,将得到的浆液冻干并包封在含有~1.6×1011个活细胞/胶囊的
患者的uc症状显示出改善(见表11)。到治疗后第8周,粪便中几乎看不到血液和粘液,到第10周时,它是零。患者的尿失禁停止,肠运动减少至2-3/天,稠度为4(布里斯托尔)。通过持续治疗,钙卫蛋白水平从第22周时的600μg/g降至第26周时的344μg/g。这证实了持续的炎症减少,这也通过图7中的内窥镜检查显示。患者未报告任何副作用与治疗的耐受性有关。患者没有报告与治疗耐受性有关的任何副作用。该病例代表用口服粪便微生物组疗法成功治疗溃疡性结肠炎(uc)。除了由于患者的uc症状改善而导致的生活质量(qol)改善之外,还存在能量水平的显着增加,其允许每日锻炼并且由于减少尿失禁而重新开始工作的信心。患者继续每天4粒胶囊的维持治疗。口服粪便微生物组治疗在治疗患有全结肠炎的未经治疗的uc患者时是有效的,从而导致总体改善的qol。
表11:治疗前后的症状
实施例8.溃疡性结肠炎患者用口服粪便微生物组疗法治疗.
一名31岁的患者(患者td)接受粪便微生物组治疗。治疗方案包括含有冻干供体衍生的未选择的粪便微生物群的耐酸/延迟释放双包封口服胶囊。患者的症状包括每天4次排便,一致性为2,中度腹胀,中度腹部不适,轻度紧迫,腿部和针头疲劳感。在诱导期间,患者接受6周治疗方案,其中每周一次粪便微生物组治疗液体结肠镜输注和1-2次直肠灌肠。在维持期间,患者每天服用4粒胶囊,持续4周。患者腹胀症状减轻,腹部不适和紧急症状消失。患者每天进行一次排便,一致性为3。患者也会出现轻度胃肠胀气和全身不适。胶囊治疗后两周,患者的钙卫蛋白读数为243μg/g。从第一次钙卫蛋白测试开始三周,从最初的胶囊摄入开始4周,患者的钙卫蛋白水平降低至88μg/g。
由于可以在不脱离本公开的范围的情况下对本文描述和说明的构造和方法进行各种修改,所以包含在前面的描述中的所有内容应当被解释为说明性的而不是限制性的。本公开的广度和范围不应受任何上述示例性实施例的限制,而应仅根据所附权利要求及其等同物来限定。本说明书中引用的所有专利和非专利文献均通过引用整体并入本文。
- 还没有人留言评论。精彩留言会获得点赞!