一种人恶性胶质瘤细胞SCID鼠大脑移植瘤模型的构建方法与流程
本发明属于动物模型的构建技术领域,具体地说,涉及一种人恶性胶质瘤细胞SCID鼠大脑移植瘤模型的构建方法。
背景技术:
已有研究发现,HCMV的基因表达产物在恶性胶质瘤中表达显著增高,且与肿瘤恶性程度呈正相关。恶性胶质瘤对手术、放疗、化疗均不敏感,亟需寻求靶向的治疗方法。HCMV感染细胞通过NF-КB、TBK1-IRF3I型干扰素通路参与抗病毒及抗肿瘤作用,多种泛素特异性蛋白酶作用于该通路的不同靶点进行负向调控。在前期研究中,我们发现HCMV感染星形胶质细胞6小时,基因表达水平变化大于10倍的分子全部是干扰素刺激基因,其中负性调节基因只有泛素特异性蛋白酶USP18。通过临床标本检测发现,HCMV即刻早期、早期和晚期基因表达产物及USP18在恶性胶质瘤呈高表达。
由于CMV感染具有严格的细胞嗜性和种属特异性,缺乏合适的动物模型进行体内实验,至今为止,HCMV感染与恶性胶质瘤发生和发展的关系机制不明。有报道利用鼠CMV感染的胶质瘤细胞建立体内感染模型1,但是鼠CMV与HCMV的基因组和感染模式均有差别,因此实验结果仅具参考价值。
技术实现要素:
有鉴于此,本发明针对目前缺乏与天然感染模式相近的HCMV感染人胶质瘤动物模型的问题,提供了一种人恶性胶质瘤细胞SCID鼠大脑移植瘤模型的构建方法。
为了解决上述技术问题,本发明公开了一种人恶性胶质瘤细胞SCID鼠大脑移植瘤模型的构建方法,包括以下步骤:
步骤1、复苏液氮罐冻存的恶性胶质瘤细胞,在培养箱中培养过夜,然后加入Hoechst33342标记原代恶性胶质瘤细胞,继续培养48h后收集细胞,制备得到原代恶性胶质瘤细胞;
步骤2、选取雄性SCID鼠,体重210-110g,分为5组:①脑内接种原代恶性胶质瘤细胞;②脑内接种原代恶性胶质瘤细胞胞并感染HCMV;③脑内接种原代恶性胶质瘤细胞感染HCMV并用USP18高表达腺病毒载体处理组;④脑内接种原代恶性胶质瘤细胞感染HCMV并用干扰腺病毒载体USP18小干扰腺病毒载体USP18处理组;⑤正常对照组,每组10只;
步骤3、参考Batker法确定靶点,在SCID鼠双眼连线后3mm,冠状缝前1mm,中线旁开1mm颅骨处用圆头牙科钻钻一小孔,孔径1.2mm,深达硬脑膜表面而不伤及脑组织,无菌接种1*108/mL10μL单细胞悬液,速率为0.2μL/min;终止实验时,断头取脑;
步骤4、用HE染色观察病理形态学,鉴定人恶性胶质瘤细胞SCID鼠大脑移植瘤模型是否构建成功。
进一步地,所述培养箱的条件为:温度为37℃,5%CO2氛围,用10%高糖DMEM/F12(Hyclone)进行培养恶性胶质瘤细胞U87。
进一步地,步骤4中用HE染色观察病理形态学,鉴定人恶性胶质瘤细胞SCID鼠大脑移植瘤模型是否构建成功具体为:如果①②③④组结果显示细胞生长活跃,密集成群,排列紊乱,异型性明显,病理性核分裂相多见,证明大量HCMV感染的恶性胶质瘤细胞的生长,⑤组细胞分布均匀,无胶质瘤细胞的异常生长;TUNEL染色检测细胞凋亡,如果①②③④组的细胞凋亡异常,为恶性肿瘤细胞,⑤组细胞为正常凋亡的细胞;鉴定动物模型建立成功。
与现有技术相比,本发明可以获得包括以下技术效果:
1)相对于鼠恶性胶质瘤细胞SCID鼠大脑移植瘤模型,本发明的人恶性胶质瘤细胞SCID鼠大脑移植瘤模型更能体现HCMV感染人胶质瘤的实际感染状态。
2)相对于裸鼠模型,本发明的人恶性胶质瘤细胞SCID鼠大脑移植瘤模型更能耐受人胶质瘤的生长和浸润,裸鼠接种胶质瘤细胞30天,肿瘤达(1032±97)mm3,而SCID鼠接种胶质瘤7天,肿瘤达(1001±103)mm3。
3)相对于建立表皮胶质瘤感染的模型,本发明采用大脑原位移植更能体现肿瘤生长的实际位置和实际的生长过程。表皮接种胶质瘤细胞,肿瘤呈浸润性生长,底部多侵入肌肉和骨骼组织;而SCID鼠接种胶质瘤,肿瘤生长快速,呈浸润性生长,与正常脑组织无明显界限,周围脑水肿显著。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
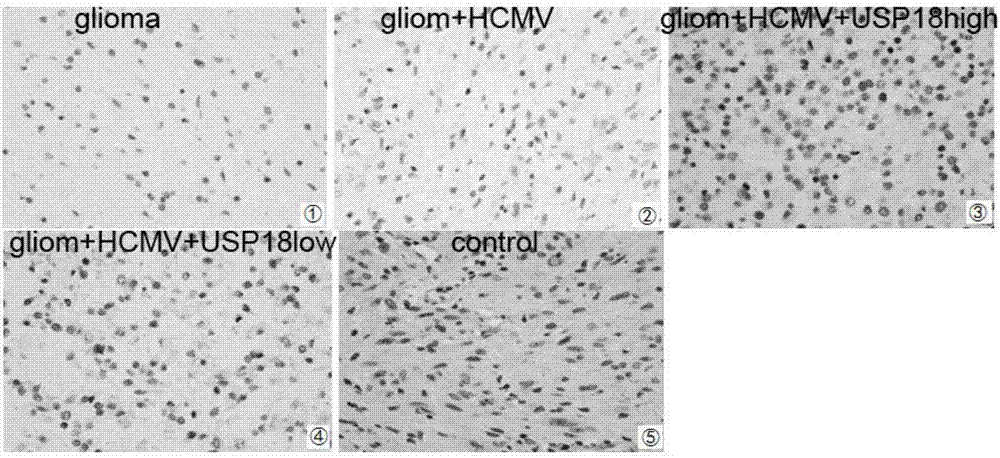
图1是本发明免疫组化检测USP18的表达;
图2是本发明免疫组化检测IFN-β的表达;
图3是本发明移植瘤qRT-PCR技术检测I型干扰素TBK1-IRF3信号通路分子的表达变化。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例1人恶性胶质瘤细胞SCID鼠大脑移植瘤模型的建立
包括以下步骤:
步骤1、复苏液氮罐冻存的恶性胶质瘤细胞U871×107个细胞/100μl,100μl/只,在37℃5%CO2培养箱中用10%高糖DMEM/F12(Hyclone)培养过夜,加入5μL Hoechst33342标记原代恶性胶质瘤细胞,继续培养48h后收集细胞,制备得到原代恶性胶质瘤细胞;
步骤2、选取雄性SCID鼠,体重210-110g,分为5组:①脑内接种原代恶性胶质瘤细胞;②脑内接种原代恶性胶质瘤细胞胞并感染HCMV;③脑内接种HCMV感染的原代培养来源的原代恶性胶质瘤细胞并用USP18高表达腺病毒载体处理组;④脑内接种原代培养来源的原代恶性胶质瘤细胞感染HCMV并用USP18干扰腺病毒载体处理组;⑤正常对照组,每组10只;
步骤3、参考Batker法(余永强,陈俊,钱银锋,等.立体定向建立大鼠C6脑胶质瘤模型[J]中国药理学通报,2003(2):222-225.)确定靶点,在SCID鼠双眼连线后约3mm,冠状缝前1mm,中线旁开约1mm颅骨处用圆头牙科钻钻一小孔,孔径约1.2mm,深达硬脑膜表面而不伤及脑组织,无菌接种1*108/mL 10μL单细胞悬液,速率为0.2μL/min;观察各组实验鼠体重变化情况,皮肤整洁度、饮水觅食情况、活动度兴奋度偏瘫情况以及生存时间;
步骤4、终止实验时,断头取脑,观察移植瘤的组织的结构特点,测量肿瘤的大小,计算活体移植瘤的体积。
步骤5、用HE染色观察病理形态学,如果①②③④组结果显示细胞生长活跃,密集成群,排列紊乱,异型性明显,病理性核分裂相多见,证明大量HCMV感染的恶性胶质瘤细胞的生长,⑤组细胞分布均匀,无胶质瘤细胞的异常生长;TUNEL染色检测细胞凋亡,如果①②③④组的细胞凋亡异常,为恶性肿瘤细胞,⑤组细胞为正常凋亡的细胞;鉴定动物模型建立成功。
免疫组织化学法检测USP18、IFNβ的表达情况,如图1和图2可知,①组USP18、IFNβ表达量低,②组USP18、IFNβ表达量高,③组USP18表达量大幅升高,④组USP18表达量明显变低。免疫荧光检测细胞迁移情况,结果发现,比较①②④⑤组,③组的迁移率最高,结果证实了USP18的促瘤作用。
移植瘤qRT-PCR技术检测I型干扰素TBK1-IRF3信号通路分子的表达变化。结果显示见图3,对比①②④⑤组,③组的I型干扰素TBK1-IRF3信号通路分子的表达明显降低,结果证明了高表达USP18对I型干扰素TBK1-IRF3信号通路分子的抑制作用。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!